Actividades-1bpendiente-quimica
Anuncio
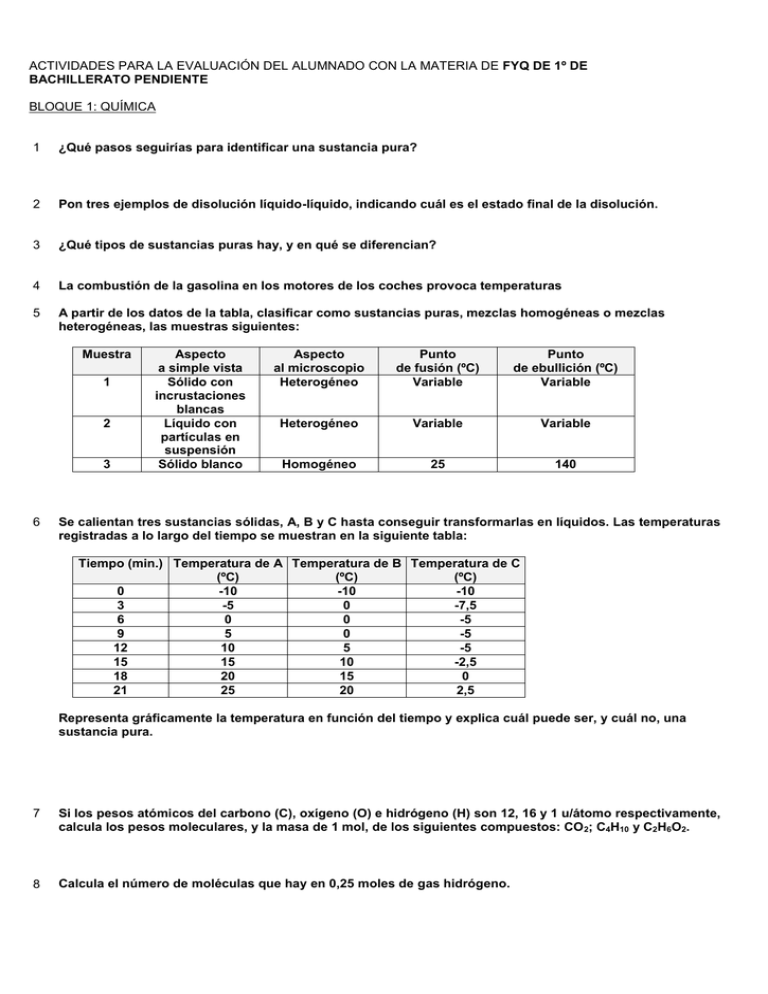
ACTIVIDADES PARA LA EVALUACIÓN DEL ALUMNADO CON LA MATERIA DE FYQ DE 1º DE BACHILLERATO PENDIENTE BLOQUE 1: QUÍMICA 1 ¿Qué pasos seguirías para identificar una sustancia pura? 2 Pon tres ejemplos de disolución líquido-líquido, indicando cuál es el estado final de la disolución. 3 ¿Qué tipos de sustancias puras hay, y en qué se diferencian? 4 La combustión de la gasolina en los motores de los coches provoca temperaturas 5 A partir de los datos de la tabla, clasificar como sustancias puras, mezclas homogéneas o mezclas heterogéneas, las muestras siguientes: Muestra 1 2 3 6 Aspecto a simple vista Sólido con incrustaciones blancas Líquido con partículas en suspensión Sólido blanco Aspecto al microscopio Heterogéneo Punto de fusión (ºC) Variable Punto de ebullición (ºC) Variable Heterogéneo Variable Variable Homogéneo 25 140 Se calientan tres sustancias sólidas, A, B y C hasta conseguir transformarlas en líquidos. Las temperaturas registradas a lo largo del tiempo se muestran en la siguiente tabla: Tiempo (min.) Temperatura de A Temperatura de B Temperatura de C (ºC) (ºC) (ºC) 0 -10 -10 -10 3 -5 0 -7,5 6 0 0 -5 9 5 0 -5 12 10 5 -5 15 15 10 -2,5 18 20 15 0 21 25 20 2,5 Representa gráficamente la temperatura en función del tiempo y explica cuál puede ser, y cuál no, una sustancia pura. 7 Si los pesos atómicos del carbono (C), oxígeno (O) e hidrógeno (H) son 12, 16 y 1 u/átomo respectivamente, calcula los pesos moleculares, y la masa de 1 mol, de los siguientes compuestos: CO 2; C4H10 y C2H6O2. 8 Calcula el número de moléculas que hay en 0,25 moles de gas hidrógeno. 9 Calcula la masa de 3 moles de agua. 10 Calcula los moles de gas metano que habrá en 30 litros del mismo, medidos en condiciones normales. 11 A partir de los datos de la tabla, clasificar como sustancias puras, mezclas homogéneas o mezclas heterogéneas, las muestras siguientes: Muestra 1 2 3 Aspecto a simple vista Líquido verde Líquido azul Sólido blanco Aspecto al microscopio Homogéneo Heterogéneo Homogéneo Punto de fusión (ºC) De 0 a 10 De -12 a -3 200 Punto de ebullición (ºC) De 80 a 95 De 110 a 118 650 12 Sabiendo que la masa atómica del oro es 196,97 g/mol, calcula cuántos átomos de oro hay en un lingote de 1 kg de masa. 13 ¿Qué sucede con la presión de una masa de gas si, manteniendo la temperatura constante, se introduce en un recipiente que tenga el doble de capacidad? 14 Una masa de gas a 320 K ocupa un volumen de 10 litros. ¿Qué volumen ocupará si, manteniendo la presión constante, se aumenta la temperatura hasta 350 K? 15 0,7 g de litio se combinan con 1,9 g de flúor para formar fluoruro de litio. Razona cuál de las siguientes afirmaciones es correcta. a) Se obtienen 2,6 moles de fluoruro de litio. b) Se obtienen 2,6 gramos de fluoruro de litio. c) Se obtienen 2,6 litros de fluoruro de litio. 16 En la combustión de 5,8 g de gas butano se necesitan 20,8 g de oxígeno gaseoso, para obtener 17,6 g de dióxido de carbono y agua. ¿Qué cantidad de agua se ha obtenido en la reacción? 17 ¿Cuáles de las siguientes fórmulas moleculares son, a su vez, las fórmulas empíricas? a) C4H10 b) Li2O2 c) C2H6O d) HNO3 e) C6H2 f) H2O 18 Determinar la fórmula empírica de un compuesto de carbono e hidrógeno, sabiendo que una muestra del mismo contiene 0,135 moles de C y 0,2025 moles de H. 19 Explica la diferencia entre un espectro de absorción y uno de emisión. Pon ejemplos de ellos. 20 Una onda electromagnética tiene una frecuencia de 4·10 13 Hz. Calcula su longitud de onda y la energía, en eV, asociada a dicha frecuencia. 21 ¿Cuál es el máximo número de electrones que pueden encontrarse en el nivel de energía n = 1? 22 ¿En qué se diferencian y en que se parecen los orbitales 2s, 3s, y 4s? 23 Escribe, por orden de energía de los orbitales, las configuraciones electrónicas de los siguientes átomos: Cl (Z = 17); Ba (Z = 56); Ca (Z = 20); I (Z = 53). 24 ¿Cómo están colocados los elementos en el sistema periódico? 25 Explica cuáles de estas afirmaciones son correctas y cuáles son falsas: a) Un átomo se transforma en su ion negativo cuando pierde protones en el núcleo. b) Un átomo se transforma en su ion positivo cuando pierde electrones en su corteza. c) Un átomo se transforma en su ion negativo cuando pierde electrones en la corteza. d) Un átomo se transforma en su ion positivo cuando gana protones en el núcleo. e) Un átomo se transforma en su ion negativo cuando gana electrones en la corteza. 26 ¿Qué similitudes existen entre átomos del mismo grupo? ¿Y entre los del mismo período? 27 La configuración electrónica de un elemento es: 1s 22s22p63s23p5. Indica si se trata de un metal o de un no metal, a qué grupo del sistema periódico pertenece, su símbolo, un elemento con mayor energía de ionización y otro con menor que él. 28 Justifica a qué tipo de sustancias da lugar el enlace iónico. 29 ¿Puede formarse un enlace iónico entre átomos de un mismo elemento químico? ¿Por qué? 30 ¿Cuándo se dice que un enlace covalente es polar? 31 ¿A qué se denomina nube electrónica en un metal? 32 Formula los siguientes compuestos: a) Óxido de hierro (II). b) Óxido de dipotasio. c) Óxido de bario. d) Óxido de níquel (II). e) Trióxido de dialuminio. 33 Formula los siguientes compuestos: f) Trisulfuro de dialuminio. g) Bromuro de potasio. h) Fluoruro de calcio. i) Sulfuro de disodio. j) Ioduro de plomo (II). 34 Nombra los siguientes compuestos: a) Cl2O3 b) AsI3 c) CCl4 d) SO2 35 Nombra los siguientes compuestos: a) TiO2 b) As4O6 c) Na2O d) CaO 36 Formula los siguientes compuestos: k) Seleniuro de dihidrógeno. l) Fluoruro de hidrógeno. m) Bromuro de hidrógeno. n) Ioduro de hidrógeno. o) Telururo de dihidrógeno. 37 Revisa las siguientes ecuaciones químicas, señalando aquellas que no aparezcan correctamente formuladas y corrígelas. a) MgCO3 → CO + MgO b) C6H6 + O → CO2 + H2O c) Al + HCl → AlCl + H2 d) ZnS + O2 → ZnO2 + SO2 38 La magnesita es un mineral constituido en su mayor parte por carbonato de magnesio. Por calefacción se descompone en óxido de magnesio y dióxido de carbono. ¿Cuántos gramos de óxido de magnesio se obtienen al calcinar 20 g de magnesita? 39 ¿Qué masa de hierro tendrá que reaccionar con 300 cm 3 de una disolución de sulfato de cobre (II) al 45 % en masa, para obtener sulfato de hierro (II) y cobre metal, sabiendo que la densidad de la disolución empleada es 1,05 g/cm3? 40 Indica cuales de los siguientes procesos son exotérmicos: a) La combustión del gas natural. b) La deflagración de la pólvora. c) La fotosíntesis de las plantas. 41 Las reacciones exotérmicas van acompañadas de un desprendimiento de energía mediante calor. Sabiendo que en la combustión del metano se desprenden 890,1 kJ por cada mol de metano que ha reaccionado, escribe la ecuación termoquímica correspondiente.






