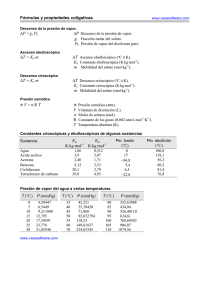
Cuando se quema 1g de un compuesto orgnico, constituido por C
Anuncio

Química en la Ingeniería Examen 25-10-2010 APELLIDOS: .................................................................. NOMBRE: .............................. Datos: Masas atómicas: H = 1; C = 12; N = 14; O = 16; Ca = 40; Cl = 35,5 R = 0,082 atm·L·K-1·mol-1 = 1,98 cal·K-1·mol-1 = 8,314 J·K-1·mol-1 1.- ¿Cuánto calor se necesita para convertir 10,0 g de hielo a -15 ºC en vapor de agua a 110 ºC? Los calores específicos del hielo, agua y vapor de agua son, respectivamente, 2,03, 4,18 y 2,01 J·(ºC)-1·g-1. La entalpía estándar de fusión del agua es 6,0 kJ·mol-1 y la entalpía estándar de vaporización es 40,32 kJ·mol-1. a. b. c. d. e. 30,42 kJ 27,10 kJ 8,00 kJ 5,23 kJ 4,69 kJ 2.- En un calorímetro a volumen constante tiene lugar una reacción que se sabe libera 21,70 kJ de calor elevándose la temperatura 3,50 ºC. A continuación, y en este mismo calorímetro, se produce la reacción de combustión de 15 g de ácido esteárico (C18H36O2) produciéndose una elevación de temperatura de 6,55 ºC. ¿Cuál es la variación de entalpía, en kJ/mol, de este proceso? C18H36O2(s) + O2(g) → CO2(g) + H2O(l) a. b. c. d. e. ∆H = -768,88 kJ/mol ∆H = -430,67 kJ/mol ∆H = -749,06 kJ/mol ∆H = -788,70 kJ/mol ∆H = -391,03 kJ/mol 3.- Calcular la variación de entalpía estándar de la reacción siguiente: 2 CH4(g) + O2(g) → 2 CH3OH(l) A partir de los datos de las tres ecuaciones siguientes: CH4(g) + H2O(g) → CO(g) + 3 H2(g) 2 H2(g) + CO(g) → CH3OH(l) 2 H2O(g) → 2 H2(g) + O2(g) a. b. c. d. e. ∆H = -414,44 kJ/mol ∆H = +680,86 kJ/mol ∆H = -286,11 kJ/mol ∆H = -11,08 kJ/mol ∆H = -88,58 kJ/mol ∆Hº = +325,86 kJ ∆Hº = –128,33 kJ ∆Hº = +483,64 kJ 4.- Calcular la energía reticular del cloruro de sodio a partir de los siguientes datos: ∆Hf(NaCl) = –411 kJ·mol-1; ∆Hs(Na)= 108 kJ·mol-1; ∆HD(Cl2)= 244 kJ·mol-1; P.I. (Na) = 496 kJ·mol-1; A.E. (Cl) = –349 kJ·mol-1. a. b. c. d. e. 1608 kJ·mol-1 1486 kJ·mol-1 910 kJ·mol-1 788 kJ·mol-1 546 kJ·mol-1 5.- Se recogió una muestra de nitrógeno sobre agua a 35 ºC y a una presión atmosférica de 760 mm Hg. El volumen de la muestra es de 612 mL. ¿Cuántos gramos de N2 hay en la muestra? (Presión de vapor del agua a 35 ºC es de 140,6 mm Hg). a. b. c. d. e. 237,27 g 0,55 g 333,89 g 0,70 g 312,20 g 6.- Rellena el siguiente diagrama de OM para la molécula-ión N2–2 (Número atómico del nitrógeno 7) ¿Cuál es su orden de enlace? a. 1 b. 1,5 c. 2 d. 2,5 e. 3 7.- La presión de vapor de la acetona, C3H6O, a 7 ºC es 99,76 mm Hg y su entalpía de vaporización es de 48,6 kJ·mol-1. Estimar el punto de ebullición normal de la acetona. a. b. c. d. e. 20,11 ºC 62,30 ºC 46,23 ºC 37,30 ºC 2,91 ºC 8.- A 85 °C la presión de vapor del agua es 83 mm Hg y la del etanol, C2H6O, 400 mm Hg. En una disolución donde ambos se encuentran al 50 % en peso, calcular la fracción molar del etanol en el vapor. a. b. c. d. e. 0,70 0,40 0,30 0,50 0,65 9.- Se prepara 0,1 L de una disolución disolviendo 3,0 g de cloruro de calcio en agua. Calcular la presión osmótica de esta disolución a 27 ºC, suponiendo que la sal se disocia totalmente en sus iones componentes. a. b. c. d. e. 6,60 atm 13,30 atm 18,20 atm 19,95 atm 8,80 atm 10.- 15,0 mL de ácido nítrico (d = 1,05 g/mL), se disuelven en suficiente agua para preparar 500,0 mL de disolución. ¿Cuál es la molaridad del ácido nítrico en la disolución? a. b. c. d. e. 0,50 M 0,48 M 0,46 M 0,44 M 0,42 M