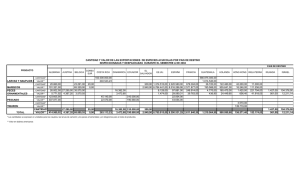
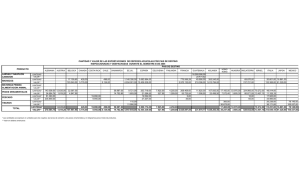
desarrollo morfológico de las estructuras - CICIMAR-IPN
Anuncio

INSTITUTO POLITÉCNICO NACIONAL CENTRO INTERDISCIPLINARIO DE CIENCIAS MARINAS “DESARROLLO MORFOLÓGICO DE LAS ESTRUCTURAS INVOLUCRADAS EN LA PRIMERA ALIMENTACIÓN EXÓGENA Y EVALUACIÓN DE LA EFICIENCIA ALIMENTICIA DE LAS LARVAS DEL HUACHINANGO DEL PACÍFICO LUTJANUS PERU (NICHOLS & MURPHY, 1922).” TESIS QUE PARA OBTENER EL GRADO DE DOCTORADO EN CIENCIAS MARINAS PRESENTA OSCAR IRAM ZAVALA LEAL LA PAZ, B.C.S., JUNIO DE 2011. SIP-1" BIS INSTITUTO POLITÉCNICO NACIONAL SECRETARIA DE INVESTIGACiÓN Y POSGRADO ACTA DE REVISIÓN DE TESIS En la Ciudad de Mayo del La Paz, 8.C.S., siendo las 12:00 horas del dia 20 del mes de 2011 se reunieron los miembros de la Comisión Revisora de Tesis designada por el Colegio de Profesores de Estudios de Posgrado e Investigación de _ CCI :;:I.:;"M '"A"R' -_ _ __ para examinar la tesis titulada: "DESARROLLO MORFOLOGICO DELAS ESTRUCTURAS INVOLUCRADAS EN LA PRIMERA ALIMENTACiÓN EXOGENA y EVALUACiÓN DE LA EFICIENCIA ALIMENTICIA DE LAS LARVAS DEL HUACHINANGO DEL PAciFICO Luljanus peru (Nichol. & Morphy, 19221" Presentada por el alumno: Aspirante de: DOCTORADO EN CIENCIAS MARINAS Después de interca mbiar opiniones los miembros de la Comisión manifestaron APROBAR LA DEFENSA DE LA TESIS , en virtud de que satisface lOS requisitos señalados por las disposiciones reglamentarias vigentes. LA COMISION REVISORA Directores de Tesis AS DR. RENA~ Di rector a de Tesis OIrect r de Tesis DR. DAVID ALfARO SlQUEIROS aELTRONES DRA. LAURA SÁNCHEZ VElASCO VER LÓPEZ VlllEGAS 0."" ~c.UTlVo <o> PRESIDENTE DEL COLEGIO DE PRO 0= .. DR. RAFAEL CERVAN G- _ • • ~ tI'" ~ UARTE IPN CICIMAR DIRECCION INSTITUTO POLITÉCNICO NACIONAL SECRETARíA DE INVESTIGACiÓN Y POS GRADO CARTA CESiÓN DE DERECHOS el dla 01 En la Ciudad de La Paz, e.c.s., el (la) que suscribe Programa de del mes Junio del año 2011 aJumno(a) del M e. OSCAR 'RAM ZAVALA LEAL -- DOCTORADO EN CIE NCIAS MAR INAS con número de registro -­ 6071224 adscrito al CENTRO INTERDISCIPttNARIO DE CIENCIAS MARIN AS manifiesta que es autor (a) intelectual del presente trabajo de tesis, bajo la dirección de: OR A. Sl l VIE DUMAS V DR. REN ATO PE ~A M A RTfNe""Z~_ _ y cede los derechos del trabajo titulado: "DESARROllO MORFOLÓGICO DE LAS ESTRUCTURAS INV OLU CRADAS EN LA PRIMERA ALIMENTACiÓN - ---"'= EXóGENA y EVALUACIÓN DE LA eFICIENCIA ALIMENTI CIA DE LAS LARVAS DEL HUACHINANGO DEl PAc iFI CO Lutjonus peru (Nichols & MO!]lhy, 1922)" al Instituto Po litécnico Naciona l, para su difusión con fines académicos y de investigacIón Los usuarios de la informac ión no deben reprod ucIr el contenido textual, grsficas o datos del trabaío sin el permiso expreso del autor y/o director del trabajo . sigu iente di rección : t:ste, puede ser obtenido escri biendo a la zir am28@hot mai l.com - silvieduma [email protected] Si el permiso se otorga , el usuario mismo _ deber¡~ - blackla rvae@ hotmail.co dar el agradecimiento correspo ndIente y citar la fuente del ~'"''' t.VALALEAL RECONOCIMIENTO El presente trabajo fue desarrollado gracias al apoyo otorgado al proyecto SEPCONACYT: “Cultivo del huachinango Lutjanus peru: inducción al desove y condiciones ambientales en la primera alimentación de las larvas”. DEDICATORIA El presente trabajo lo dedico de manera general a toda mi familia, que de una manera u otra siempre me han apoyado y alentado para seguir luchando y haciendo lo que he querido en mi vida. A la memoria de dos seres muy queridos que me brindaron siempre una amistad incondicional y jamás me mostraron una cara triste, por lo contrario siempre tratando de animar a los demás sin importar su estado de ánimo, a mis tíos: Emilio y Armando Zavala López A mis padres, hermanos y sobrinos que desde siempre han estado conmigo, que tantos consejos me dan y me alientan; siendo parte fundamental de mi forma de ser y pensar, por quienes puedo hacer lo que hago y hago todo lo que puedo. “ASNF” AGRADECIMIENTOS - Al instituto Politécnico Nacional y al Centro Interdisciplinario de Ciencias Marinas por su invaluable formación tanto profesional como personal. - Al Consejo Nacional de Ciencia y Tecnología (CONACYT) y al Programa de Formación de Investigadores (PIFI) del Instituto Politécnico Nacional, por las becas otorgadas para el apoyo de mis estudios de postgrado. - Al comité revisor de mi tesis: Dra. Silvie Dumas; Dr. Renato Peña; Dra. Laura Sánchez; Dr. David Siqueiros; Dr. Oliver López, por sus acertados comentarios y revisiones. - Al personal que labora o laboró a mi paso por la Unidad Piloto de Maricultivos del CICIMAR, formando un excelente grupo de trabajo: Dra. Silvie Dumas, M. en C. Dora Esther Hernández, M. en C. Mauricio Contreras, Dr. Renato Peña, Biol. Laura Flores, Dr. Juan Pablo Alcántar, M. en C. Elín Pérez, M. en C. Ivette Moguel por su apoyo durante el desarrollo de este trabajo, pero sobre todo por su invaluable y entrañable amistad. - Al personal de apoyo técnico del CICIMAR: Martín Cuevas (El Conejo), Ciro Arista (El Carebu), Manuel Zamarrón (El Borrego) y Efraín Flores (El Ministro) quienes son parte fundamental para el trabajo en campo, siendo nuestras manos derechas. - A todos mis amigos y amigas que de alguna manera contribuyeron en el desarrollo de este trabajo, los cuales no los enlisto por que me llevaría mucho tiempo. - Finalmente quiero agradecer a mis compañeros del fútbol, cuya actividad fue parte primordial para eliminar el estrés, durante el curso del programa. ¡¡¡De antemano mil gracias a todos!!! ÍNDICE GENERAL RESUMEN --------------------------------------------------------------------------------------- iv ABSTRACT ------------------------------------------------------------------------------------- v RELACIÓN DE FIGURAS -------------------------------------------------------------------- vii RELACIÓN DE TABLAS --------------------------------------------------------------------- ix GLOSARIO -------------------------------------------------------------------------------------- x I. INTRODUCCIÓN ------------------------------------------------------------------------------ 1 II. ANTECEDENTES ---------------------------------------------------------------------------- 3 2.1 Desarrollo de los sistemas involucrados en la alimentación exógena ---------- 3 2.1.1 Órganos sensoriales --------------------------------------------------------------------- 4 2.1.2 Aparato bucal ------------------------------------------------------------------------------ 5 2.1.3 Sistema digestivo y órganos accesorios -------------------------------------------- 6 2.2 Factores que afectan la alimentación en larvas ------------------------------------- 7 2.3 Estudios sobre el huachinango del Pacifico ------------------------------------------ 11 III. JUSTIFICACIÓN ---------------------------------------------------------------------------- 12 IV. OBJETIVOS ---------------------------------------------------------------------------------- 12 V. HIPÓTESIS ----------------------------------------------------------------------------------- 13 VI. MATERIALES Y MÉTODOS ------------------------------------------------------------ 14 6.1 Inducción al desove ----------------------------------------------------------------------- 14 6.2 Desarrollo de órganos y sistemas involucrados en la alimentación ------------ 14 6.2.1 Órganos sensoriales y sistema digestivo ------------------------------------------ 14 6.2.2 Aparato bucal ----------------------------------------------------------------------------- 16 6.3 Eficiencia en la alimentación exógena ------------------------------------------------ 17 i 6.3.1 Temperatura de incubación ----------------------------------------------------------- 18 6.3.2 Efecto de la intensidad de luz, tipo de presa y color del tanque -------------- 19 6.3.3 Talla de la presa y densidad ---------------------------------------------------------- 19 6.3.4 Temperatura del agua y salinidad --------------------------------------------------- 19 6.4.5 Concentración de microalga y densidad de presa -------------------------------- 19 VII. RESULTADOS ---------------------------------------------------------------------------- 21 7.1 Aspectos generales ----------------------------------------------------------------------- 21 7.2 Desarrollo de órganos y sistemas involucrados en la alimentación ------------- 25 7.2.1 Desarrollo de órganos sensoriales -------------------------------------------------- 25 7.2.1.1 Retina ------------------------------------------------------------------------------------ 25 7.2.1.2 Neuromastos --------------------------------------------------------------------------- 32 7.2.1.3 Oído interno ----------------------------------------------------------------------------- 34 7.2.1.4 Órgano olfativo ------------------------------------------------------------------------- 36 7.2.2 Desarrollo del aparato bucal ---------------------------------------------------------- 37 7.2.3 Sistema digestivo ------------------------------------------------------------------------ 40 7.3 Eficiencia en la alimentación exógena ------------------------------------------------- 51 7.3.1 Temperatura de incubación ------------------------------------------------------------ 51 7.3.2 Efecto de la intensidad de luz, tipo de presa y color del tanque -------------- 52 7.3.3 Talla de la presa y densidad ---------------------------------------------------------- 53 7.3.4 Temperatura del agua y salinidad --------------------------------------------------- 54 7.3.5 Concentración de microalga y densidad de presa ------------------------------- 55 VIII. DISCUSIÓN --------------------------------------------------------------------------------- 56 8.1 Aspectos generales del desarrollo ----------------------------------------------------- 56 ii 8.2 Desarrollo estructural --------------------------------------------------------------------- 57 8.2.1 Eclosión ------------------------------------------------------------------------------------ 58 8.2.2 Periodo de alimentación endógena ------------------------------------------------- 60 8.2.3 Primera alimentación exógena ------------------------------------------------------- 63 8.3 Eficiencia en la alimentación exógena ------------------------------------------------ 66 IX. SUMARIO Y CONCLUSIONES --------------------------------------------------------- 69 9.1 Eclosión --------------------------------------------------------------------------------------- 69 9.2 Periodo de alimentación endógena ---------------------------------------------------- 69 9.3 Primera alimentación exógena ---------------------------------------------------------- 70 X. RECOMENDACIONES -------------------------------------------------------------------- 72 XI. LITERATURA CITADA ------------------------------------------------------------------- 73 XII. ANEXO I ------------------------------------------------------------------------------------- 89 iii RESUMEN El huachinango del Pacífico Lutjanus peru es considerado de gran importancia comercial, y durante los últimos años se ha intentado someter a cultivo. Pese a su importancia es una especie de la cual se conoce poco sobre su desarrollo. Este trabajo tiene como objetivo describir el desarrollo morfológico de las estructuras necesarias para iniciar la alimentación exógena de las larvas del huachinango del Pacífico Lutjanus peru durante el desarrollo inicial, así como evaluar la eficiencia alimenticia durante los primeros días de la alimentación exógena bajo condiciones de cultivo. Las larvas fueron obtenidas tras la inducción al desove de reproductores silvestres. Los huevos fueron incubados en tolvas cónicas de 100L de capacidad a 25-26.5ºC. En la primera parte de este trabajo se describe el desarrollo de los órganos sensoriales, aparato bucal y sistema digestivo. Para ello se tomaron muestras de las larvas al momento de la eclosión y a las 6, 12, 18, 24, 36, 48, 70 (primera alimentación) y 93 horas después de la eclosión (hde). Se muestrearon alrededor de 50 larvas para realizar histología convencional (hematoxilinaeosina), 50 para microscopia electrónica de barrido (MEB) y 50 para microscopia electrónica de transmisión (MET). Para la descripción del aparato bucal se utilizó el método propuesto por Potthoff (1984) modificado para larvas. Se observó que las larvas eclosionan con una talla de 2.45 mm (Longitud Total) y un grado de desarrollo incipiente, la boca aún está cerrada. No hay pigmento en los ojos, las estructuras sensoriales que presentan son neuromastos libres y el oído medio. Seis horas después de la eclosión se observan las lamelas de las placas olfativas. Al momento de la primera alimentación presentan una talla de 3.72±0.19 mm y un ancho de boca de 0.22±0.02 mm. Están presentes estructuras como el cartílago de Meckels, cuadrado, hioideo, hiomandibular e interhial. El ojo está diferenciado y funcional. Presenta conos sencillos como únicas células fotorreceptoras. El tubo digestivo presenta una regionalización: cavidad buco-faríngea, esófago e intestinos anterior y posterior. Ambos intestinos presentan un epitelio columnar, pliegues en la mucosa y microvellosidades en la zona apical. Los enterocitos presentan características ultraestructurales de células diferenciadas. Las glándulas accesorias ya se han diferenciado. El páncreas esta conectado al intestino anterior mediante el conducto de Wirsung. Estan diferenciados los islotes de Langerhans y se encuentran rodeados por células pancreáticas exocrinas que sintetizan gránulos de zimógeno denotando funcionalidad. En el hígado se observan algunos sinusoides y canículos biliares. Los hepatocitos presentan en posición supranuclear, inclusiones aparentemente de reserva como glucógeno y lipoproteínas. En la segunda parte se desarrollaron 5 experimentos en los cuales se evaluaron la incidencia alimenticia (porcentaje de larvas con alimento en el tracto digestivo) e intensidad alimenticia (número de presas por larva) al momento de la primera alimentación. Estos experimentos se realizaron en acuarios cuadrados de 10-L de capacidad. Se probaron, Exp. 1) la temperatura de incubación (26, 28 y 30ºC), Exp. 2) la intensidad de luz (2000, 2500 y 3000 lux), tipo de presa (nauplios de copépodos y mezcla entre nauplios de copépodos y neonatos de rotíferos 1:1) y color del tanque (blanco y negro), Exp. 3) talla de la presa (46±8μm; estadio I-III y 72±12μm; estadio IV-VI) y densidad (5, 10 y 15 nauplios ml-1), Exp. 4) temperatura del agua (25 y 28ºC) y salinidad (25, 30 y 35 ups), Exp. 5) la concentración de microalgas (0, 3x105 y iv 1x106 células ml-1) y densidad de presa (10 y 15 nauplios ml-1). De manera general, en todos los experimentos realizados no se observaron diferencias significativas en la intensidad alimenticia para ningún factor (p>0.05). No se encontraron diferencias significativas para la incidencia alimenticia (p>0.05), en los Exp. 1 y 5. En el Exp. 2 se presentaron diferencias significativas (p<0.05) para el tipo de presa y la intensidad de luz. Se presentó también una interacción significativa (p<0.05). A 3000 lux no hubo diferencias significativas entre el tipo de presa mientras que, a 2000 y 2500 lux, fue significativamente mayor (p<0.05) con los nauplios de copépodos. Sin embargo, es importante mencionar que con 3000 lux no hubo consumo de rotíferos en el tratamiento de dieta mixta. En el Exp. 3, la incidencia alimenticia fue mayor con nauplios en estadio I-III a densidades de 10 y 15 nauplios ml-1. En el Exp. 4, la temperatura del agua fue el único factor que mostró diferencias significativas (p<0.05) alcanzando una mayor incidencia alimenticia las larvas alimentadas a 25 ºC. Finalmente se concluye que las larvas de Lutjanus peru pueden recibir alimentación viva desde las 70 hde (día 3), cuando la boca está abierta y articulada. El tubo digestivo diferenciado en esófago, intestino anterior y posterior. Y el ojo pigmentado. Dado que la mayor incidencia alimenticia se presentó con nauplios de copépodos en estadio I-III, con 3000 lux a 25º C, se recomienda el uso de estas condiciones en el cultivo larval del huachinango. ABSTRACT Pacific red snapper Lutjanus peru is considered a species of great commercial importance, which in recent years has been tried to bring into cultivation. Despite its importance is a species which at present little is known about its development. This work to describe the morphological development of the necessary structures to initiate exogenous feeding larvae of the Pacific red snapper during the initial development and to evaluate feed efficiency during the first days of exogenous feeding under culture conditions. The larvae were obtained after the induction of spawning of wild broodstock. The eggs were incubated in a conical tank with 100L capacity at 25-26.5 ° C. In the first part of this work we describe the development of the sense organs, mouthparts and digestive system. To describe the development of these structures was collected larvae at hatching and at 6, 12, 18, 24, 36, 48, 70 (first feeding) and 93 hours after hatching (hah). We sampled about 50 larvae for conventional histology (hematoxylin-eosin), 50 for electron microscopy (SEM) and 50 for transmission electron microscopy (TEM). To describe the mouthparts development we employed, the method proposed by Potthoff (1984) modified for larvae. The larvae hatch with a size of 2.45 mm (total length) and few structural developments, it mouth still closed. There is no pigment in the eyes, showing sensory structures are free neuromasts and inner ear. A few hours after hatching were observed lamellae of the olfactory plates. At the time of first feeding they have a size of 3.72 ± 0.19 mm and a width of mouth 0.22 ± 0.02 mm. Structures such as Meckels cartilage, square, hyoid, interhial and hyomandibular are present. The eye is differentiated and functional. It features v simple and unique cone photoreceptor cells. The gastrointestinal tract presents a regionalization: oro-pharyngeal cavity, esophagus, foregut and hindgut. Both intestines have a columnar epithelium and folds in the mucosa with apical microvilli. The ultrastructural characteristics of enterocytes were similar at differentiated cells. The accessory glands have been differentiated. The pancreas is connected to the foregut through the pancreatic duct. Islets of Langerhans are differentiated and surrounded by exocrine pancreatic cells that synthesize zymogen granules denoting functionality. In the liver sinusoids and there are some bile canaliculli. The hepatocytes presented in supranuclear position, inclusions appear as glycogen reserve and lipoproteins. In the second part of this work, we realized 5 experiments in which we evaluated the feeding incidence (percentage of larvae with food in the digestive tract) and feeding intensity (number of prey per larva) at first feeding. These experiments were conducted in aquaria (10-L capacity). Were tested, Exp 1) the incubation temperature (26, 28 and 30 º C), Exp 2) light intensity (2000, 2500 and 3000 lux), type of prey (nauplii of copepods and a mix of copepod nauplii and rotifer neonates 1:1) and tank color (white and black), Exp 3) size of prey (46 ± 8μm, stage I-III and 72 ± 12μm, stage IV-VI) and density (5, 10 and 15 nauplii ml-1), Exp 4) water temperature (25 and 28 º C) and salinity (25, 30 and 35 gL-1), Exp 5) the microalgae concentration (0, 3x105 and 1x106 cells ml-1) and prey density (10 and 15 nauplii ml-1). Generally in all the experiments, no significant differences were observed in the feeding intensity for any factor (p> 0.05). No significant differences were found for feeding incidence (p> 0.05), in Exp 1 and 5. In Exp 2 significant differences were observed (p <0.05) for prey type and light intensity. Also showed a significant interaction (p <0.05). At 3000 lux, there was no significant difference between the type of prey while 2000 and 2500 lux, was significantly higher (p <0.05) with copepod nauplii. However, it is important to mention that with 3000 lux, there was no consumption of rotifers in the treatment of mixed diet. In Exp 3, the feeding incidence was higher with nauplii stage I-III at densities of 10 and 15 nauplii ml-1. In Exp 4, the water temperature was the only factor that showed significant differences (p <0.05) reaching a higher incidence feed the larvae fed at 25 °C. Finally we conclude that the larvae of Lutjanus peru can receive live feed from the 70 hde (day 3), when the mouth is open and articulate. The digestive tract is differentiated in the esophagus, foregut and hindgut. The eye is pigmented. Since higher feeding incidence was presented with copepod nauplii stage I-III, at light intensity of 3000 lux and water temperature of 25 ºC, we recommend using these conditions in the larval rearing of the Pacific red snapper. vi RELACION DE FIGURAS Figura 1.- Larvas de huachinango del Pacífico Lutjanus peru al momento de la eclosión -------------------------------------------------------------------------------------------22 Figura 2.- Morfología externa de larvas de huachinango del Pacífico Lutjanus peru ------------------------------------------------------------------------------------------------24 Figura 3.- Musculatura de lavas del huachinango del Pacífico Lutjanus peru a las 70 hde ----------------------------------------------------------------------------------------24 Figura 4.- Ojo al momento de la eclosión en larvas del huachinango del Pacífico Lutjanus peru ------------------------------------------------------------------------------------25 Figura 5.- Retina en larvas del huachinango del Pacífico Lutjanus peru entre las 18 y 36 horas después de la eclosión --------------------------------------------------------------27 Figura 6.- Retina en larvas del huachinango del Pacífico Lutjanus peru entre las 48 y 70 horas después de la eclosión ----------------------------------------------------29 Figura 7.- Retina de larvas del huachinango del Pacífico Lutjanus peru a las 93 horas después de la eclosión ---------------------------------------------------------------30 Figura 8.- Ultraestructura de los conos en la retina del huachinango del Pacífico Lutjanus peru a las 93 horas después de la eclosión --------------------------------31 Figura 9.- Neuromastos libres en larvas del huachinango del Pacífico Lutjanus peru al momento de la eclosión ------------------------------------------------------------32 Figura 10.- Neuromastos libres en larvas del huachinango del Pacífico Lutjanus peru a las 18 horas después de la eclosión ---------------------------------------------33 Figura 11.- Oído interno en larvas del huachinango del Pacífico Lutjanus peru al momento de la eclosión ----------------------------------------------------------------------34 Figura 12.- Oído interno en larvas del huachinango del Pacífico Lutjanus peru a las 24 horas después de la eclosión ------------------------------------------------------35 Figura 13.- Órgano olfativo en larvas del huachinango del Pacífico Lutjanus peru hasta el momento de la primera alimentación ----------------------------------36 Figura 14.- Ilustración del desarrollo de estructuras que componen el aparato bucal en larvas del huachinango del Pacífico Lutjanus peru ----------------------38 Figura 15.- Estructura del cartílago en larvas del huachinango del Pacífico Lutjanus peru al momento de la primera alimentación -------------------------------39 Figura 16.- Larvas del huachinango del Pacifico Lutjanus peru al momento de la eclosión ---------------------------------------------------------------------------------------41 vii Figura 17.- Ultraestructura de la región media del tracto digestivo de larvas del huachinango del Pacífico Lutjanus peru al momento de la eclosión -------------41 Figura 18.- Estructura del hígado en larvas del huachinango del Pacífico Lutjanus peru a las 18 horas después de la eclosión -------------------------------42 Figura 19.- Morfología de larvas del huachinango del Pacífico Lutjanus peru a las 48 horas después de la eclosión ------------------------------------------------------44 Figura 20.- Ultraestructura del intestino en larvas del huachinango del Pacífico Lutjanus peru a 48 horas después de la eclosión -------------------------------------46 Figura 21.- Estructura del páncreas e hígado en larvas del huachinango del Pacífico Lutjanus peru a las 48 horas después de la eclosión --------------------47 Figura 22.- Tubo digestivo en larvas del huachinango del Pacífico Lutjanus peru después de la primera alimentación ------------------------------------------------------49 Figura 23.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru incubadas a diferentes temperaturas ----------------------------------51 Figura 24.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas bajo diferentes condiciones de luz y tipo de presa ---------------------------------------------------------------------------------------------------------52 Figura 25.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas con nauplios de copépodos de diferentes estadios y densidad ------------------------------------------------------------------------------------------53 Figura 26.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas a diferentes temperaturas y salinidades -------------54 Figura 27.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas a diferentes concentraciones de microalga y densidades de presa --------------------------------------------------------------------------55 viii RELACIÓN DE TABLAS Tabla 1. Técnica de transparentación y tinción para larvas de peces marinos-16 Tabla 2. Longitud total de las larvas del huachinango del Pacífico Lutjanus peru a cada tiempo de muestreo -----------------------------------------------------------------21 ix GLOSARIO Bastones: Células fotorreceptoras. Son las responsables de la percepción de la intensidad de la luz (Leeson et al., 1990). Conos: Células fotoreceptoras, codifican para diferentes longitudes de onda, son las responsables de la percepción del color (Leeson et al., 1990). Eclosión: Proceso en el cual se rompe el corion que cubre el huevo y emerge el eleuteroembrión o larva vitelina (Balon, 1975). Enterocitos: Término que reciben las células epiteliales de la mucosa que reviste a ambos intestinos del tubo digestivo debido a su función de absorción de nutrientes (Stroband & Dabrowski, 1979). Eficiencia alimenticia: Término que se emplea para evaluar la alimentación, implica la determinación de la incidencia e intensidad alimenticia (Yin & Blaxter, 1987). Glóbulo de aceite: Lisosomas modificados que adquieren forma esférica y que se forman al fusionarse las vesículas de vitelo, muchas especies presenta uno o más glóbulo en o cerca de la masa vitelina. Sirve inicialmente como una estructura de flotación o equilibrio y que al consumirse es utilizado como recurso potencial de energía (Carrillo & Zanuy, 1993). Hepatocitos: Células que componen al hígado (Leeson et al., 1990). Incidencia alimenticia: Proporción de larvas que presentan alimento en el tubo digestivo (Yin & Blaxter, 1987). Intensidad alimenticia: Cantidad de presas presentes en el tubo digestivo de las larvas (Yin & Blaxter, 1987). Nauplio: La forma larval más simple de los crustáceos, se presenta en algunos miembros de todas las clases incluidos copépodos y artemias (Tucker, 1998). Neonato: Estadio de un organismo recién nacido (en este caso para rotíferos) Ontogenia: comprende una serie de cambios morfofisiológicos que se dan durante el ciclo de vida de los animales (Balon, 1984). Reservas vitelinas: Reservas nutritivas del huevo, involucra tanto al saco de vitelo como al glóbulo de aceite (Heming & Buddington, 1988). x Sincitio: Masa citoplasmática poseedora de muchos núcleos y rodeada de una membrana, p. ej. periblasto en los teleósteos (Heming & Buddington, 1988). Vitelo: Sustancia nutritiva del embrión al iniciarse el desarrollo, que se encuentra acumulado en la célula sexual femenina; sus componentes principales son: proteínas, fosfolípidos y en menor grado grasas neutras (Balinsky, 1978). xi I. INTRODUCCIÓN El huachinango del Pacífico Lutjanus peru (Nichols & Muyphy, 1922) es una especie de gran interés comercial, considerada con gran potencial de cultivo (Avilés-Quevedo et al., 1996). Sin embargo, pese a su importancia, es una especie de la cual se conoce poco. En la última década se han realizado trabajos dirigidos al cultivo de esta especie. Se ha logrado alcanzar la maduración gonádica mediante un régimen foto-térmico (Dumas et al., 2004) y la maduración final y posterior desove mediante el uso de hormonas (Dumas et al., 2004; Pelcastre-Campos, 2006). En cuanto a la crianza larvaria, se ha logrado producir juveniles pero en cantidades muy bajas (Duncan et al., 2002; Dumas, COM. PERS.). Estos autores reportan altas mortalidades en los primeros días de cultivo que han asociado principalmente a la alimentación. De manera general, se han observado grandes variaciones en la eficiencia alimenticia y por ende en la supervivencia durante los primeros días de cultivo (Zavala-Leal, 2007; Dumas, COM. PERS). Las variaciones en la eficiencia alimenticia pueden ser atribuidas al estado nutricional de las larvas al inicio de la alimentación exógena, al desarrollo morfo-fisiológico que presentan las larvas al momento de iniciar la alimentación exógena (Yúfera & Darias, 2007) y a otros factores tanto bióticos como abióticos (Zavala-Leal, 2007). Dentro de los bióticos, se ha observado que diferentes características de las presas juegan un papel importante, como lo son, la densidad de presa y su distribución (Guldbransend, 1991), el tamaño (Ware, 1973; Seiffert et al., 2001), la movilidad y el color (Utne-Palm, 1999). Otros factores bióticos que intervienen en la detección y consumo de presas son el tamaño del depredador (Bermudes & Ritar, 1999), así como el tamaño de su boca (Blaxter & Straines, 1970). Dentro de los factores abióticos, los que más se han reportado son la intensidad de luz (Hunter, 1981; Gutherie, 1986), el color del tanque (Nass et al., 1996; Peña et al., 2005), turbidez ocasionada por la adición de microalgas (Shaw et al., 2006), la salinidad y temperatura (Wintzer & Motta, 2004; Fielder et al., 2005). Las larvas de peces marinos son de los vertebrados más pequeños de vida libre con alimentación activa (Wieser, 1995). Numerosas especies de 1 peces marinos con huevos pelágicos presentan una ontogenia indirecta que se caracteriza por presentar cinco periodos: 1) embrionario, 2) larvario, 3) juvenil, 4) adulto, y 5) senectud (Balon, 1975). Al momento de la eclosión, están pobremente diferenciados. Suelen ser pequeños con una escasa pigmentación, un sistema visual no funcional, al igual que su sistema digestivo, el cual solo está compuesto por un tubo digestivo poco desarrollado sin apertura oral y anal. El hecho de no presentar sistemas funcionales al momento de la eclosión implica que durante un periodo de tiempo relativamente corto se lleven a cabo procesos complejos y altamente dinámicos de diferenciación de órganos, morfogénesis y crecimiento (Sala et al., 2005). Durante el primer periodo de su ontogenia, los embriones son dependientes del suministro de nutrientes y energía de origen maternal y almacenado en las reservas vitelinas (alimentación endógena) (Balon, 1975; Kamler, 1992; 2002). Durante este periodo los procesos dominantes son el crecimiento, la diferenciación de tejidos y cambios anatómicos y funcionales de las estructuras (Kamler, 2002). La utilización del vitelo en el periodo embrionario permite el desarrollo de los primeros órganos y/o sistemas que los peces necesitan para sobrevivir en el siguiente periodo de desarrollo, el periodo larval. El desarrollo en la ontogenia inicial presenta diferentes patrones de crecimiento entre especies o poblaciones; además, depende de factores bióticos y abióticos. La temperatura es uno de los factores ambientales más importantes; se considera que existen temperaturas óptimas de desarrollo, sin embargo, es más factible considerar que existe un intervalo de temperatura óptimo en el cual el desarrollo se efectúa de manera normal y con un nivel similar de eficiencia en la utilización del vitelo (Kamler et al., 1998). De manera general, la tasa de desarrollo ontogénico es lenta a temperaturas bajas y se incrementa con el aumento de temperatura (Kamler, 2002). Por otra parte, dentro de los factores bióticos, uno de los más relevantes es la talla del huevo (Kamler, 2002), el cual depende de la nutrición de los reproductores, su edad y nivel de estrés (Jobling, 1998; Morehead et al., 2001), así como el número de desoves en la temporada reproductiva en desovadores parciales. No obstante, estos factores no se presentan por separado y es necesario analizar su interacción. 2 Con base en lo anterior, es evidente la necesidad de hacer investigación básica sobre el desarrollo larval, no con la finalidad de resolver de manera inmediata la situación del cultivo, sino de poder generar conocimientos que posteriormente puedan ser aplicados. En el presente trabajo se abordarán dos aspectos principales: 1) el desarrollo inicial, en donde se describirá la morfología de los principales sistemas involucrados en la alimentación exógena de las larvas; y 2) la primera alimentación, en donde se evaluará el efecto de diferentes factores ambientales como el tipo de presa, densidad de presa, intensidad de luz, color del tanque, concentración de microalga, temperatura y salinidad sobre la eficiencia alimenticia bajo condiciones de cultivo experimental. II. ANTECEDENTES 2.1 Desarrollo de los sistemas involucrados en la alimentación en larvas El inicio de la alimentación exógena es un momento crucial en el desarrollo de las larvas de peces marinos (Yúfera & Darias, 2007). Este momento es asociado con altas mortalidades tanto en cultivo como en el ambiente natural. Las mortalidades tempranas en larvas son atribuidas principalmente a la falta de alimento o a un bajo consumo, y por otro lado a la pobre calidad nutricional del mismo (Yúfera & Darias, 2007). Antes de la primera alimentación exógena, el embrión se alimenta de las reservas vitelinas las cuales son aprovechadas en mayor o menor magnitud dependiendo de la especie o las condiciones en donde se desarrolle. Aunque el consumo de vitelo depende de diversos factores dentro de los más importantes resaltan la cantidad y calidad de vitelo y la temperatura (Heming y Buddington, 1988; Polo et al., 1991; Hardy & Litvak, 2004). Para iniciar la alimentación exógena, las larvas deben presentar órganos sensoriales que les permitiera llevar a cabo con éxito la localización de la presa o del alimento que se les proporcione; la boca, la aleta caudal y los músculos deben presentar un desarrollo suficiente para permitir la captura y ingestión de presas; y finalmente, el sistema digestivo debe presentar un cierto grado de 3 desarrollo anatómico y fisiológico para que se dé la digestión y absorción del alimento. 2.1.1 Órganos sensoriales Los órganos sensoriales son órganos provistos de células especializadas que reciben estímulos del exterior y transmiten un impulso a través de vías nerviosas hacia el sistema nervioso central para ser procesado, traducido y generar una respuesta, que permite una comunicación entre ambiente e individuo. De manera general, los órganos sensoriales están compuestos por células receptoras y células de soporte. Las células receptoras son células nerviosas modificadas caracterizadas por poseer una sensibilidad diferencial. Las células receptoras se clasifican de acuerdo al tipo de estímulo que perciben. Existen las foto-receptoras, mecano-receptoras, quimioreceptoras, audio-receptoras, termo-receptoras (Eckert et al., 1990), aunque en algunas especies es posible encontrar electro-receptoras (Bennett, 1971). En los peces, los principales órganos sensoriales son los ojos, las papilas gustativas, el oído interno, la línea lateral y las placas olfativas. En especies con ontogenia indirecta, se ha observado que al momento de la eclosión los únicos receptores sensoriales presentes son mecano-receptores (neuromastos libres), quimio-receptores (placas olfativas) y audio-receptores (oído interno) (Matsuoka, 2001). En diferentes especies, los neuromastos libres se observan a lo largo de todo el cuerpo (Matsuoka, 2001; Mukai, 2006) y permiten a las larvas responder a los estímulos mecánicos como el movimiento del agua. En la sardina Sardinops melanostictus, las placas olfativas son localizadas en el extremo anterior de la boca y se reubican en la parte dorsal de la boca al momento de su apertura permaneciendo sin cambios aparentes desde la primera alimentación hasta alcanzar tallas de 18-20 mm de longitud estándar (Matsuoka, 2001). El oído medio presenta una vesícula auditiva de forma oval que contiene dos otolitos, el Lapilus y Sagitta. El epitelio sensorial llamado macula se sitúa en posición ventral de la vesícula auditiva bajo de los otolitos. Sin embargo, y pese a su aparición temprana en el desarrollo, aún se 4 desconoce su funcionalidad en los primeros días de vida de las larvas (Blaxter, 1986; Matsuoka, 2001). En cuanto al desarrollo del ojo se ha observado que al momento de la eclosión esta indiferenciado (Kawamura et al., 2003; Peña, 2005; Peña & Dumas 2007). Peña (2005) reporta que en la cabrilla arenera Paralabrax maculatofasciatus al momento de la eclosión, la retina está formada por células indiferenciadas con un arreglo concéntrico sin estratificación. Al día 1 después de la eclosión, la retina ya presenta cierta estratificación observándose cinco capas desde el exterior hacia el interior (capa nuclear externa, capa plexiforme externa, capa nuclear interna, capa plexiforme interna y capa ganglionar). La capa nuclear externa está formada por segmentos nucleares de los conos aun en desarrollo. Para el día 2, se observa la capa epitelial pigmentada rodeando la capa nuclear externa de la retina y los conos sencillos ya bien formados. Al momento de la apertura de la boca, los ojos están pigmentados y la retina consta de conos simples mientras que los bastones aparecen después en el transcurso del desarrollo (Peña & Dumas, 2007; Yúfera & Darias, 2007). 2.1.2 Aparato bucal En los pocos estudios que existen sobre el desarrollo de las estructuras bucales en la etapa larval, se ha observado que la diferenciación de nuevas estructuras coincide con cambios bien definidos en las proporciones cefálicas (Hunt von Herbing, 2001). Cambios a nivel estructural y funcional como el movimiento en la mandíbula son los primeros fenómenos que ocurren, facilitando la transición de una alimentación endógena a una exógena. Las estructuras implicadas en la alimentación exógena durante este periodo incluyen el cartílago de Meckel, hiomandibular-symplecticum, cartílago hioideo, cuadrado e interhial, las cuales a este momento son cartilaginosas (Hunt von Herbing, 2001). En Gadus morhua y Pseudopleuronectes americanus al momento de la eclosión, las estructuras del aparato bucal son simples, pocas en número y no articuladas, y aunque la boca está formada, no está abierta. Se ha reportado que una vez que la boca es abierta y articulada, su movimiento es controlado por un simple mecanismo referido al acoplamiento hioideo, el cual 5 resulta de la contracción de los músculos mandibulares (geniohideos y esternohioideos) para abrir la boca (Otten, 1982; Liem, 1991; Hunt von Herbing et al., 1996). Posteriormente, con el crecimiento de la región cefálica se presenta el segundo mecanismo que corresponde a un acoplamiento opercular, el cual se da por la contracción de músculos en el opérculo los cuales transmiten una fuerza a lo largo de un ligamento a la mandíbula inferior (Hunt von Herbing, 1996; Liem, 1997). 2.1.3 Sistema digestivo y órganos accesorios La ontogenia del sistema digestivo presenta un patrón similar en diferentes especies (Yúfera & Darias, 2007) pero con ciertas variaciones, principalmente en la secuencia de la aparición de las diferentes estructuras. En la mayoría de las larvas de peces marinos, al momento de la eclosión, el tracto digestivo es un tubo recto simple localizado sobre el saco de vitelo, con un epitelio formado por una capa simple de células columnares (Govoni et al., 1986; Gisbert et al., 2004; Santamaría et al., 2004; Falk-Petersen, 2005; Ostaszewska, 2005: Peña 2005; Yúfera & Darias, 2007). Al momento de la apertura de la boca, la parte posterior de este tubo esta flexionado para abrirse en la zona caudal. Además, se distingue la cavidad bucal (sin dientes), el esófago con un epitelio escamoso estratificado y el intestino con un epitelio columnar simple (Yúfera & Darias, 2007). Pocos días después de la apertura bucal pueden identificarse las regiones anterior, media y posterior del intestino, con la aparición de un esfínter pilórico y una constricción correspondiente a lo que será la válvula íleo-rectal. En algunas especies como la dorada Sparus aurata (Sarasquete et al., 1995; Calzada et al., 1997), eglefino Melanogrammus aeglefinus (Hamlin et al., 2000), jurel aleta amarilla Seriola lalandi (Chen et al., 2006) y lenguado de California Paralichthys californicus (Gisbert et al., 2004), las células caliciformes están ausentes o son escasas al momento de la apertura de la boca y aparecen algunos días después. Aunque en otras especies como el lenguado senegalés Solea senegalensis (Ribeiro et al., 1999), lenguado común Solea solea (Boulhic & Gabaudan, 1992), platija de verano Paralichthys dentatus (Bisbal & Bengtson, 1995), lenguado cola amarilla 6 Pleuronectes ferruginea (Baglole et al., 1997) y percuda o pez payaso Amphiprion percula (Gordon & Hecht, 2002), dichas células se presentan desde la primera alimentación, cuya principal función es secretar mucina para mantener húmedo el epitelio de recubrimiento del sistema digestivo. Al momento de la eclosión, los órganos complementarios en la función digestiva como el hígado y páncreas están ausentes e inician su diferenciación a partir de dos grupos de células esféricas de núcleo basofílico y citoplasma ligeramente eosinofílico, entre el primer y segundo día (Gisbert et al., 2004). En Paralichthys californicus, el hígado está en posición ventral al tubo digestivo en desarrollo y puede ser identificado como una masa de tejido blanquecina no lobulada. Histológicamente, se observa como un tejido compacto de hepatocitos poliédricos basofílicos con núcleos localizados en el centro y un citoplasma reducido. Conforme la larva crece, el hígado sigue su diferenciación y al día 5 después de la eclosión, los hepatocitos se presentan en un arreglo alrededor de los sinusoides hepáticos y aparece el conducto biliar con un epitelio cuboidal simple (Gisbert et al., 2004). Entre el día 1 y 2 después de la eclosión, el páncreas es extrahepático y las regiones exógenas y endógenas son visibles. Se detectan diversos grupos de células pancreáticas basofílicas (páncreas exócrino) que contienen gránulos de zimógeno acidófilos. Al día tres después de la eclosión, las células pancreáticas exógenas son arregladas en un hacino y los conductos pancreáticos son claramente distinguibles. El páncreas endocrino está diferenciado y las células endocrinas dispuestas alrededor de muchos tubos capilares son agrupadas en islotes de Langerhans (Gisbert et al., 2004; Abol-Munafi et al., 2006). 2.2 Factores que afectan la alimentación en larvas La presencia de las estructuras anatómica y fisiológicamente necesarias para iniciar la alimentación exógena no asegura el éxito ya que este es fuertemente influenciado por factores bióticos y abióticos. Dentro de los factores bióticos se ha mencionado que los más importantes son la talla y densidad de la presa, la turbidez generada en condiciones de cultivo por la adición de microalgas (técnica de agua verde) y la talla del depredador. La talla 7 o tamaño de la presa ha sido considerada como uno de los principales factores limitantes para el éxito en la primera alimentación en larvas de peces marinos en cultivo (Hunter, 1981; Pascual & Yúfera, 1987; Planas & Cunha, 1999). En la larvicultura se emplean con mayor frecuencia para la alimentación temprana, dos grupos del zooplancton, uno que es el braquiópodo Artemia sp. y el otro los rotíferos como Brachionus plicatilis y B. rotundiformis (Gulbrandsen, 1991; Polo et al., 1992; Fernández-Díaz et al., 1994; Planas & Cunha, 1999; Khemis et al., 2003; Alves et al., 2006). Sin embargo, en algunas especies no han resultado satisfactorios como primer alimento debido a su tamaño (Treece & Davis, 2000). Recientemente, se reporta en la literatura el uso de copépodos que para varias especies, son en su estadio naupliar más pequeños que las presas anteriormente mencionadas. Treece & Davis (2000) observaron que al ofrecer como alimento una mezcla de plancton, los nauplios de copépodos son preferentemente consumidos sobre los rotíferos. En Sparus aurata, se ha reportado la preferencia de presas pequeñas al inicio de la alimentación exógena (Helps, 1982) tanto en experimentos a pequeña escala como en cultivo extensivo (Kentouri et al., 1984). La densidad de las presas es otro de los principales factores que influyen sobre la eficiencia (Hunter, 1976; Houde & Schekter, 1978; Ina et al., 1979; Hunter, 1980; Gulbrandsen, 1991; Duray et al., 1996; Laurel et al., 2001). Por otro lado, se ha reportado que una alta densidad de presa reduce el tiempo de búsqueda de esta, lo cual incrementa la tasa de encuentro entre depredador-presa (Hart, 1997). Peña et al. (2005) estudiaron el efecto de la densidad de presa en la primera alimentación en larvas de Paralabrax maculatofasciatus y encontraron que a mayor densidad de presa, mayor fue el número de larvas que ingieren el alimento. Sin embargo, en Theragra chalcogramma no se observaron diferencia en el número de larvas que comieron cuando la densidad de presa fue proporcionada en un amplio rango (8 y 50 presas/ml) (Paul, 1983). El tamaño del depredador y de su boca (Blaxter & Straines, 1970; Bermudes & Ritar, 1999) así como el uso de microalgas en el cultivo (Skifstevik et al., 2003) son otros factores bióticos que intervienen en la eficiencia alimenticia. En diferentes especies se ha observado que la temperatura del agua afecta la talla que alcanzan las larvas a la eclosión y al final de la alimentación endógena (Pittman, et al., 1989; Blaxter, 1992; Bermudes & Ritar, 1999; Morehead & Hart, 2003). Blaxter (1969) sugirió que 8 una temperatura de incubación óptima producirá larvas más grandes, las cuales serán más fuertes y mejores nadadoras lo que podría incrementar su supervivencia en periodos críticos como la primera alimentación (Bermudes & Ritar, 1999). En cuanto al uso de agua verde, se ha observado en algunos casos un incremento en la supervivencia (Naas et al., 1992). Se ha reportado que las larvas de Rhombosolea tapirina criadas en agua verde, consumen un mayor número de presas que en agua clara (Shaw et al., 2006). Sin embargo, en otros casos, la eficiencia alimenticia, el crecimiento y supervivencia de las larvas no es afectada o bien disminuye con el incremento en la concentración de microalgas (Breitburg, 1988; Gulbrandsen et al., 1996; Cobcroft et al., 2001; van der Meeren et al., 2007). Miner & Stein (1993) observaron que una alta intensidad luminosa en la superficie del agua junto con el uso de agua verde, aumenta la visibilidad de la presa mientras que a bajas intensidades de luz, el uso de agua verde puede afectar la visibilidad y consecuentemente disminuir la eficiencia en la alimentación. En cuanto a los factores abióticos, la intensidad de luz, color del tanque, temperatura y salinidad muestran un mayor efecto sobre la alimentación exógena durante los primeros días. Las larvas de peces son consideradas depredadoras visuales (Hunter, 1981; Gutherie, 1986). Diversos trabajos se han encaminado a estudiar el efecto de la intensidad de la luz sobre la eficiencia alimenticia, crecimiento y supervivencia, demostrando que esta influye de manera directa en la detección de las presas (Vinyard & O`Brien, 1976; Paul, 1983; Utne-Palm, 1997; Downing & Litvak, 1999; Cook & Rust, 2002; Peña et al., 2004). Huse (1994) evaluó la intensidad de luz sobre la incidencia alimenticia en la primera alimentación de diferentes especies y encontró valores muy diferentes entre especies: bacalao, Gadus morhua (1 lux), lenguado, Pleuronectes platessa (87 lux) y rodaballo (Scophthalmus maximus) (860 lux). Además, estos valores se relacionan con una distribución vertical diferente entre especies. Recientemente, Peña et al. (2004) estudiaron el efecto de la intensidad de luz (100, 400 y 700 lux) en la primera alimentación de larvas de cabrilla arenera (Paralabrax maculatofasciatus). Concluyeron que el número de larvas con alimento en el tracto digestivo aumenta conforme a la intensidad de luz. No obstante la intensidad de luz no es el único factor que 9 afecta la detección de presas. Factores como el color de las paredes del tanque de cultivo, la turbidez, entre otros afectan también su eficiencia de alimentación (Tamazouzt, et al., 2000; Peña et al., 2004; 2005; Shaw et al 2006). El color del tanque afecta la iluminación debido a que modifica el contraste con la presa (Nass et al., 1996). Los colores mayormente probados son el blanco, gris y negro y se ha reportado que afectan la eficiencia alimenticia, el crecimiento y supervivencia (Downing & Litvak, 1999; Peña et al., 2005). Nass et al (1996) recomiendan el uso de tanques con paredes color negro debido a que la iluminación es mayor y las larvas no tienden a acumularse a lo largo de las paredes, resultando en un menor daño por abrasión. En algunas especies como Scophthalmus maximus (Howell, 1979) y Coryphaena hippurus (Ostrowski, 1989), este color de tanque resulta en un mayor crecimiento y supervivencia mientras que en Melanogrammus aeglefinus la supervivencia es mayor en tanques con paredes blancas (Downing & Litvak, 1999). En otras especies como Paralabrax maculatofasciatus se observó que el color del tanque no tiene un efecto significativo sobre la eficiencia alimenticia al momento de la primera alimentación (Peña et al., 2004). Otros factores abióticos que pueden afectar la eficiencia de las larvas para alimentarse son la temperatura y la salinidad. Ambos factores afectan en mayor o menor medida la fisiología de las larvas y la física del agua en la cual nadan (Hunt von Herbing, 2002; Fielder et al., 2005). En Melanogrammus aeglefinus y Amphiprion melanopus se ha observado que a mayor temperatura, las larvas presentan una mayor velocidad de nado (Hunt von Herbing & Keating, 2003; Green & Fisher, 2004) lo cual podría ser una ventaja para la larva al momento de atacar a su presa. Sin embargo, Hochachka & Somero (2001) mencionan que un decremento o incremento de la temperatura fuera del rango óptimo puede resultar en una reducción en la tasa metabólica, lo que puede afectar el desempeño de la larva al momento de alimentarse. Por otro lado, los cambios en la viscosidad del agua tienen un impacto significativo en el nado sobre todo en larvas pequeñas, afectando la velocidad absoluta de nado, distancia recorrida y duración de nado (Fuiman & Batty, 1997; Hunt von Herbing & Keating, 2003) disminuyendo así su capacidad de alimentación. 10 2.3 Estudios sobre el huachinango del Pacífico Como se ha mencionado con anterioridad, se han realizado trabajos dirigidos al cultivo de esta especie. Se ha logrado alcanzar la maduración gonádica en organismos mantenidos en cautiverio mediante la aplicación de un régimen foto-térmico (Dumas et al., 2004) y la maduración final y posterior desove mediante la aplicación de hormonas (Dumas et al., 2004; PelcastreCampos, 2006). En cuanto a la crianza larvaria, se ha logrado producir juveniles, sin embargo, en cantidades muy bajas (Duncan et al., 2002; Dumas COM. PERS). Estos autores reportan altas mortalidades en los primeros días de cultivo y las han asociado al poco éxito en la primera alimentación exógena en la cual proporcionaron como primera presa neonatos de rotíferos Brachionus plicatilis y B. rotundiformis. Debido a esos resultados y con la finalidad de conocer más sobre el efecto de factores ambientales sobre la primera alimentación exógena, Zavala-Leal (2007) evaluó el efecto de la intensidad de luz, tipo y densidad de presa sobre la eficiencia alimenticia y encontró que al momento de la primera alimentación (alrededor de 72 horas después de la eclosión) las larvas no consumen los neonatos de B. rotundiformis. Mientras que con los nauplios de copépodos Euterpina acutifrons la incidencia alimenticia se incrementa con el aumento en la intensidad de luz. 11 III. JUSTIFICACIÓN El huachinango del Pacífico Lutjanus peru es una especia de importancia comercial, que recientemente ha generado grandes expectativas para su cultivo tanto en el sector público como privado. Pese a su importancia, es una especie de la cual aún se tiene poco conocimiento sobre su desarrollo. Es por ello que el presente trabajo plantea realizar investigación básica mediante la descripción del desarrollo de los sistemas y estructuras involucrados en la captura, ingestión y digestión al inicio de la alimentación exógena de esta especie, que pueda servir como base para posteriores estudios, en los que se realicen descripciones ya sean morfológicas o de comportamiento como en la taxonomía, ecología y/o acuacultura. IV. OBJETIVOS 4.1 Objetivo General: El presente trabajo tiene como objetivo describir la organogénesis de las principales estructuras desarrolladas desde la eclosión hasta el inicio de la alimentación exógena de las larvas de Lutjanus peru (Nichols & Murphy, 1922), así como evaluar la eficiencia alimenticia bajo condiciones de cultivo experimental. 4.2 Objetivos Específicos: Describir a nivel morfológico, histológico y ultraestructural, el desarrollo de los órganos sensoriales, aparato bucal y el sistema digestivo en el desarrollo inicial de Lutjanus peru. Evaluar el efecto de la intensidad de luz, color del tanque, tipo, tamaño y densidad de presa, salinidad y temperatura sobre la eficiencia alimenticia al momento de la primera alimentación exógena bajo condiciones de cultivo experimental. 12 V. HIPÓTESIS Partiendo de la premisa que al igual que en otras especies de ontogenia indirecta, el desarrollo de las larvas de huachinango al momento de la eclosión y primera alimentación será limitado en cuanto a estructuras y funcionamiento, se espera encontrar pocos órganos sensoriales y quizá rudimentarios. Debido a que al término de la alimentación endógena deben ingerir el alimento, al igual que en otras especies el aparato bucal se desarrollará y estará constituido de estructuras cartilaginosas. El sistema digestivo será poco diferenciado, sin embargo, presentará cierta regionalización que le permita digerir el alimento y absorber los nutrientes. De la misma forma, como se ha observado en otras especies el bajo grado de desarrollo al inicio de la alimentación exógena (locomoción, agudeza y sensibilidad visual, etc.), limitará el desempeño en la alimentación. Por lo que se espera que la eficiencia alimenticia sea afectada de manera significativa por factores como el color del tanque, la salinidad, la turbidez ocasionada por la adición de microalgas y la temperatura. De manera más específica, en cuanto a la intensidad de luz, tipo y densidad de presa; cuyos factores ya han sido evaluados sin alcanzar el pico máximo en la eficiencia alimenticia (Zavala-Leal, 2007) es factible suponer que la mayor eficiencia alimenticia se logrará en tratamientos donde se empleen altas intensidades de luz, presas de tamaño pequeño y altas densidades de las mismas. 13 VI. MATERIALES Y MÉTODOS 6.1 Inducción al desove Se recolectaron reproductores silvestres de la región de la Ribera, municipio de Los Cabos, BCS, México. A su llegada al laboratorio, los organismos que presentaron oocitos de un diámetro ≥ 400µm, característico del estadio de vitelogénesis avanzada, se indujeron a la maduración final y el desove mediante la aplicación del factor de liberación de la hormona luteinizante (LHRH-a) (Pelcastre-Campos, 2006). La fecundación de los huevos se realizó en seco en un recipiente de plástico. Después de 10 minutos, se enjuagaron los huevos con agua de mar filtrada (0.1 μm) y se depositaron en tolvas cónicas de 100L de capacidad con circulación continua de agua filtrada (filtro mecánico de 1 μm e luz ultravioleta) a temperatura de 25-26.5 °C y bajo un fotoperiodo de 13:11 horas (luz: oscuridad). Diariamente se retiraron los huevos muertos mediante sifonado con un tubo de vidrio y manguera de polietileno de 2mm de diámetro. 6.2. Desarrollo de órganos y sistemas involucrados en la alimentación. 6.2.1 Órganos sensoriales y sistema digestivo Para describir el desarrollo de estas estructuras se tomaron muestras de las larvas al momento de la eclosión y a las 6, 12, 18, 24, 36, 48, 70 y 93 horas después de la eclosión (hde). Se recolectaron larvas para su estudio histológico: 50 larvas para la microscopia óptica (MO), 50 para microscopia electrónica de barrido (MEB) y 50 para microscopia electrónica de transmisión (MET). Las larvas se anestesiaron con 2-fenoxietanol 400 ppm y se enjuagaron con agua destilada. Las larvas que se emplearon para la MO, se fijaron con formol al 4% saturado con borato de sodio. Alrededor de 4 semanas después se cambiaron de formol a alcohol al 70%. Posteriormente se deshidrataron en alcohol en un orden creciente (70% hasta el 100%). Después de la deshidratación se incluyeron en parafina y se realizaron cortes sagitales finos de 1 a 0.5 µm de 14 espesor con un micrótomo de rotación. Los cortes fueron teñidos mediante la técnica de hematoxilina-eosina (H-E). Se analizaron las muestras con un microscopio óptico a diferentes aumentos. Las muestras para la microscopia electrónica se fijaron con glutaraldehído 2.5% en PBS de Sörensen. Para la técnica de MEB, se deshidrataron las muestras con etanol en gradiente y se secaron en un desecador a punto crítico (Samdri-PVT-3B, Tousimis Research Corporation, Rockville, MD). Posteriormente, las larvas se montaron en placas metálicas y fueron disectadas. Se recubrieron las muestras con paladio (Desk II, Denton Vaccum, NY) y se observaron al microscopio electrónico de barrido (Hitachi S3000N, High Tecnologies American, Inc. CA). Para la MET, dos horas después de la fijación, se enjuagaron las muestras tres veces con una solución de cacodilato de sodio y se refrigeran a 4 ºC en esta misma solución. Alrededor de 4 semanas después, se cambio la solución de cacodilato de sodio para evitar la formación de cristales de sal. Después de 9 semanas de la colecta de las muestras, se retiró la solución de cacodilato de sodio y se les agregó tetraoxido de osmio al 2% por una hora. Posteriormente, se lavaron tres veces (5 minutos c/u) con una solución amortiguadora de cacodilato-HCl para eliminar el exceso de osmio. Una vez lavadas, se procedió a la deshidratación mediante la inmersión en etanol en orden creciente de 40, 50, 60, 70, 80, 90 y 100% (10 minutos de duración en cada concentración). Después de la deshidratación, se les añadió óxido propileno. Este paso se hizo 2 veces; 20 minutos entre uno y otro, para asegurar la eliminación del etanol para prepararlas para la incorporación de la resina dentro del tejido. Para la inclusión en resina, se agregó una solución 1:3 de resina y óxido propileno, una hora después, se cambió por una solución en proporción 1:1 y a continuación se cambió a una proporción 3:1 por 15 horas. Finalmente se incluyó en resina (EMBed-812, Electron Microscopy Sciences, PA) al 100% (se repitió el proceso 2 veces, una hora entre una y otra) y se etiquetó cada muestra antes de meterse a polimerizar en una estufa a 60 ºC por 24 h. Se realizaron cortes finos de 60 nanómetros en un ultramicrotomo (Leica módelo Ultracut UCT, Electron Microscopy Sciences, PA) y fueron depositados en rejillas de cobre de 60 mallas. Las muestras fueron 15 contrastadas con acetato de uranilo y citrato de plomo. Finalmente, los cortes fueron observados bajo el microscopio electrónico de transmisión (JEOL JEM1010 Electron Microscope, MA) a diferentes aumentos. 6.2.2 Aparato bucal Se recolectaron 50 larvas al momento de la eclosión y después de 6, 12, 18, 24, 36, 48, 70 y 93 hde. Se anestesiaron con 2-fenoxietanol 400 ppm y se tomaron imágenes digitales para realizar mediciones de la longitud total y del ancho de la boca. Posteriormente, se fijaron en formol 10% saturado con borato de sodio. Después de 5 días, se colocaron en alcohol etílico 70% para su conservación hasta proceder a la deshidratación. Las larvas fueron transparentadas y teñidas mediante el método descrito por Potthoff (1984) pero con modificaciones (Tabla 1) (Ver anexo 1 para más detalles). Tabla 1.- Técnica de transparentación y tinción para larvas de peces marinos (modificado de Potthoff, 1984). Pasos Sustancias o Reactivos Tiempos (h) Fijación Formol 10% saturado con borato de sodio 48 Deshidratación Alcohol 50%, 70% y 100% 24 Tinción de cartílago Solución azul alcian 18 Neutralización Solución de borato de sodio saturada 6 Digestión tripsina Solución de tripsina (1%) 4 Tinción de hueso Solución rojo alizarin 3 Decoloración Solución tripsina (1%) <1* * El tiempo en tripsina no pudo ser estimado con exactitud debido a que las muestras se degradaban por lo que se mantuvieron bajo observación y se lavaron cuando eran decoloradas. 16 Finalmente, se realizaron los esquemas del desarrollo a partir de fotografías de las larvas teñidas. La estimación de la apertura máxima potencial de la boca (AB) se realizó utilizando la ecuación de Shirota (1970): AB = √2 * LMS Donde: AB = Ancho de la boca LMS = Longitud de la mandíbula superior 6.3 Eficiencia en la alimentación exógena. En esta parte del trabajo se realizaron cinco experimentos. Con la finalidad de complementar un estudio realizado previamente en el cual se observó que las larvas incubadas a 24 ºC presentan una longitud mayor que las incubadas a 28 y 30 ºC (Zavala-Leal, 2007), se evaluó en el primer experimento el efecto de la temperatura de incubación sobre la eficiencia alimenticia al momento de la primera alimentación. En el resto de los experimentos se evaluó el efecto de diferentes factores sobre la eficiencia alimenticia como, la intensidad de luz, color del tanque y tipo de presa (exp. 2), talla de la presa y densidad de presa (exp. 3), temperatura del agua y salinidad (exp. 4) y concentración de microalga y densidad de presa (exp. 5). Los experimentos se realizaron en acuarios rectangulares de 30x20x20 cm con capacidad de 10 litros pintados con pintura epóxica no tóxica de color negro (Fulmex-E-26-B, Prometal, México), excepto en el experimento 2. Se llenaron con agua tratada mediante filtro de arena, luz ultravioleta, clorada (16ppm) y tiosulfatada (10ppm). Se les suministró una aireación constante. Las larvas fueron transferidas a los acuarios alrededor de 60 horas después de la eclosión a densidad de 50 larvas/litro. La temperatura del agua fue de 25-26 ºC, la salinidad de 35 ups (excepto en el experimento 4), y la intensidad de luz de 3000 lux (excepto en el experimento 2). Se empleó una concentración de 3x105 células de Nannochloropsis oculata como agua verde (excepto en el experimento 5). Los tratamientos se hicieron por triplicado. Se ofreció el alimento (presas vivas) cuando las larvas presentaron el ojo bien pigmentado, 17 la boca abierta y articulada y el ano abierto. El momento óptimo para muestrear las larvas fue determinado en los 3 primeros experimentos. Para este fin, se colocaron 2 acuarios extras para identificar el momento del inicio de la alimentación. Se muestreó cada hora después de proporcionar el alimento y se determinó que el tiempo necesario para que las larvas inicien la alimentación es de seis horas. Seis horas después de proporcionar el alimento se recolectaron de manera aleatoria 30 ± 5 larvas de cada acuario. Se anestesiaron con 2-fenoxyetanol (400ppm) y se observaron bajo una lupa estereoscópica para evaluar la eficiencia alimenticia contando el número de larvas con alimento en el tracto digestivo (Incidencia alimenticia) y el número de presas por larva (Intensidad alimenticia). Cuando fue necesario se realizó una disección del tracto digestivo de la larva para contar las presas. El alimento vivo que se probó fue nauplios del copépodo Euterpina acutifrons y rotíferos Brachionus rotundiformis. Ambas especies fueron cultivadas en la Unidad Piloto de Maricultivos a temperatura de 26 y 25 ºC, respectivamente. Se alimentaron con Nannochloropsis oculata, Chaetoceros calcitrans y Dunaliella sp. La cosecha de los nauplios se realizó con tamices de luz de malla de 90 y 50 μm para separar los estadios IV-VI y de 50 y 25 μm para estadios I-III. Los rotíferos fueron cosechados en tamices de 70 y 100 μm, y se alimentó con la fracción más pequeña. 6.3.1 Exp. 1 Temperatura de incubación Las diferentes temperaturas probadas fueron 26, 28 y 30 ºC. Los embriones fueron incubados en tanques cónicos de 180 litros de capacidad, con paredes negras y fondo blanco. La temperatura fue mantenida utilizando calentadores para acuario. A cada uno de los tanques se les recambió diariamente el 50% del volumen total del agua cuidando mantener constante la temperatura del agua. Una vez que las larvas eran morfológicamente aptas para iniciar la alimentación, como se describió en el párrafo anterior, se transfirieron a los acuarios para ofrecerles el alimento. El alimento que se les proporcionó fue nauplios (estadio I-III) de copépodos Euterpina acutifrons (45 ± 6 μm de ancho) a razón de 10 ml-1. La temperatura de los acuarios para la alimentación fue de 25 ± 0.5 ºC. Se registró la longitud total promedio (n = 30) de las larvas para cada una de las temperaturas. 18 6.3.2 Exp. 2 Efecto de la intensidad de luz, tipo de presa y color del tanque Se realizó un experimento multifactorial. Se probaron diferentes intensidades de luz (2000, 2500 y 3000 lux), colores de tanque (negro y gris) y tipos de presa (nauplios de copépodos Euterpina acutifrons (estadio I-VI) y nauplios de copépodos (estadio I-VI) con rotíferos Brachionus rotundiformis en proporción 1:1) a una densidad de 10 presas ml-1. La talla de los nauplios de copépodos fue de 80 ± 15 μm (altura) y 65 ± 7 μm (ancho) y de los rotíferos de 143 ± 28 μm (altura) y 95 ± 10 μm (ancho). La fuente de luz fueron lámparas de luz blanca de 100 W (Philips, Somerset, NJ). La intensidad de luz fue medida en la superficie del agua con un fotómetro (L246373, Extech Instruments, Long Branch, NJ). La intensidad luminosa fue ajustada colocando una malla sobre la superficie del acuario para alcanzar las intensidades de luz más bajas (2 000 y 2 500 lux). Los acuarios fueron pintados de color negro y gris con pintura epóxica no toxica (Fulmex-E-26-B, Prometal, México). 6.3.3 Exp. 3 Talla de la presa y densidad Se ofrecieron nauplios de copépodos en estadios I-III (altura: 63 ± 17; ancho: 46 ± 8 μm) y estadios IV-VI (altura: 91 ± 12 μm; ancho: 75 ± 12 μm). Se proporcionaron a unas densidades de 5, 10 y 15 nauplios ml-1. 6.3.4 Exp. 4 Temperatura del agua y salinidad Las temperaturas probadas fueron de 25 y 28 ºC en combinación con 25, 30 y 35 ups. La temperatura fue mantenida utilizando calentadores para acuarios. La salinidad fue ajustada utilizando agua de mar y agua dulce filtrada. El alimento proporcionado fue nauplios de copépodos Estadios I-III (ancho: 46 ± 8μm) a razón de 10 nauplios ml-1. 6.4.5 Exp. 5 Concentración de microalga y densidad de presa Las concentraciones de microalgas empleadas fueron 0, 3x105 y 1x106 células de Nannochloropsis oculata ml-1. Se proporcionó nauplios de copépodos estadios I-III (ancho: 45 ± 13 μm de ancho) a razón de 10 y 15 nauplios de copépodos por mililitro. 19 Después de verificar la normalidad y homogeneidad de varianzas (Shapiro-Wilks y Cochran C test, respectivamente), los resultados se analizaron estadísticamente con un análisis de varianza multifactorial, excepto por el primer experimento, el cual fue de una sola vía (Statistics 6.0). En el caso de la incidencia alimenticia se transformaron los datos mediante la raíz cuadrada de arcoseno. Para las pruebas a posteriori se utilizó la prueba de Tukey. Las gráficas se realizaron en el software Sigma-Plot 9. 20 VII. RESULTADOS 7.1 Aspectos generales del desarrollo Durante el periodo de muestreo se registró la longitud total de un promedio de 40 larvas para cada tiempo de muestreo (tabla 1). Tabla 2.- Longitud total (Lt); promedio y desviación estándar (DE) de las larvas de huachinango del Pacífico Lutjanus peru a cada tiempo de muestreo. Estadio de desarollo Larva vitelina Larva preflexión Edad (hde) Lt (mm) DE 0* 6 12 18 24 36 48 70 93 2.45 2.77 3.02 3.04 3.09 3.22 3.31 3.44 3.73 0.08 0.10 0.08 0.06 0.07 0.12 0.12 0.22 0.19 * La edad 0 corresponde a la eclosión Las larvas eclosionaron (50% de eclosión) alrededor de las 26 horas después de la fertilización a 25-26.5 ºC, provistas de un saco de vitelo de forma piriforme localizado en la región antero-ventral que ocupó casi la mitad de la longitud de la larva, y también de un glóbulo de aceite esférico en posición anterior en el saco de vitelo (Fig. 1A). El periblasto o sincitio vitelino que separa al embrión de las estructuras de reserva presentó múltiples núcleos de forma irregular, una cantidad considerable de mitocondrias y abundantes parches de retículo endoplásmico y complejos de Golgi, así como también algunos cuerpos vesiculares con estructuras membranosas y material electrodenso (Fig. 1B, C). A las 24 hde, se observó una disminución considerable del saco vitelino, mientras que el glóbulo de aceite también fue consumido pero en menor proporción (Fig. 2A). Dada la transparencia de las larvas se pudo observar que el tubo digestivo incrementó en diámetro y longitud. En la región posterior presentó una ligera curvatura separándose de la 21 musculatura del tronco, sin embargo, aun no presentaron aperturas hacia el exterior (boca y ano). En las larvas anestesiadas, era posible percibir los latidos del corazón en la región anterior de la cavidad ventral en posición dorsal del saco vitelino A las 48 hde, el saco vitelino era casi reabsorbido por completo mientras que el glóbulo de aceite permanecía (Fig. 2B). Se observó un mayor ensanchamiento en la región media del tubo digestivo (conforme avance en el desarrollo dará origen al intestino anterior), formando una especie de bolsa alargada, mientras que la región posterior del tracto digestivo (posteriormente originará al intestino posterior y el recto) no apareció tan ensanchado. La curvatura del tubo digestivo se observó más marcada con un ángulo de 90º con respecto a la musculatura troncal. Así mismo, se pudo observar la formación de la válvula intestinal (Fig. 2B). Figura 1.- Larvas de huachinango del Pacífico Lutjanus peru al momento de la eclosión. A) Larva completa, barra = 20μm. B) saco de vitelo mostrando el periblasto (per), técnica MET, barra = 2μm C) ultraestructura del periblasto mostrando sus organelos y algunos cuerpos vesiculares (flechas), técnica MET, barra = 500nm. G, aparato de Golgi; ga, glóbulo de aceite; m, mitocondrias; mt, musculatura troncal; N, núcleo; oj, ojo; pl, pliegue de la aleta; sv, saco vitelino; re, retículo endoplásmico. 22 El saco vitelino y glóbulo de aceite fueron reabsorbidos entre las 55 y 60 hde a temperatura de 26.5-27.5 ºC. La primera alimentación ocurrió entre las 70 y 80 hde. Al momento de la primera alimentación las larvas presentaron una musculatura troncal robusta (Fig. 3A), así como un pliegue o membrana que rodeó toda la superficie del cuerpo (Fig. 1A). La musculatura del tronco mostró tanto músculo estriado como fibras musculares de tipo liso y una gran cantidad de mitocondrias (Fig. 3A). El pliegue esta constituido por una membrana delgada que presentó fibras musculares de tipo estriado como esqueleto interno, mientras que por la periferia se observaron cordones delgados de musculo liso, algunas mitocondrias y retículo endoplásmico (Fig. 3B). 23 Figura 2.- Morfología externa de larvas de huachinango del Pacífico Lutjanus peru. A) 24 horas después de la eclosión (hde). B) 48 horas después de la eclosión, barras = 20μm; ga, glóbulo de aceite; ia, intestino anterior; ip, intestino posterior; mt, musculatura troncal; oj, ojo; sv, saco vitelino; td, tubo digestivo; vi, válvula intestinal. Figura 3.- Musculatura de lavas del huachinango del Pacífico Lutjanus peru a las 70 hde, técnica MET. A) Musculatura troncal, y B) pliegue de la aleta, barras = 500nm; fm, fibras musculares; m, mitocondrias; me, músculo estriado; ml, músculo liso; re, retículo endoplásmico. 24 7.2 Desarrollo de órganos y sistemas involucrados en la alimentación. 7.2.1 Desarrollo de órganos sensoriales 7.2.1.1 Retina Al momento de la eclosión (Lt = 2.45 ± 0.08 mm), los ojos eran indiferenciados. Era difícil de distinguirlos como tal, se localizaron en posición dorsal-posterior al glóbulo de aceite (Fig. 4A). Histológicamente, se apreció el cristalino rodeado por la retina, la cual era rodeada por la esclera formada de tejido conectivo en arreglo centrífugo sin estratificación (Fig. 4B). A nivel ultraestructural, la retina presentó un cierto grado de estratificación aunque las diferentes capas eran todas constituidas por células similares las cuales eran alargadas o planas con un gran núcleo de forma irregular que ocupó relativamente todo el volumen celular (Fig. 4C, D). Mientras que en el escaso citoplasma se pudieron apreciar algunas mitocondrias y retículo endoplásmico (Fig. 4D). A lo largo de toda la retina se pudieron observar algunos cordones nerviosos compuestos de múltiples fibras delgadas los cuales se encontraron localizados entre los espacios intercelulares (recuadro en Fig. 4C). Figura 4.- Ojo al momento de la eclosión en larvas del huachinango del Pacífico Lutjanus peru. A) morfología externa, barra = 20μm. B) región anterior de la larva mostrando la retina (r), técnica H-E, barra = 10μm. C) retina mostrando cordones nerviosos (flechas), barra = 2μm, recuadro: detalle de un cordón nervioso, técnica MET, barra = 100nm. D) células de la retina; las flechas indican la membrana celular, técnica MET, barra = 500nm. cr, cristalino; es, esclera; ga, glóbulo de aceite; m, mitocondria; mt, musculatura troncal; N, núcleo; oj, ojo; re, retículo endoplásmico; sv, saco de vitelo. 25 A las 18 hde (3.04 ± 0.06 mm) se observó el inicio de la estratificación de la retina con la formación de la primera capa llamada capa nuclear externa (CNE) (Fig. 5A), con células alargadas con un núcleo eucromatíco grande y de forma alargado e irregular. El núcleo ocupó casi todo el volumen de la célula y el citoplasma presentó retículo endoplásmico y algunas mitocondrias de gran tamaño (Fig. 5B). En algunos espacios intercelulares se apreciaron los cordones nerviosos (Fig. 5B). De igual manera, a nivel ultraestructural se observó la diferenciación de la capa plexiforme externa. Se encontró una zona delgada de transición entre la capa nuclear externa y el resto del mosaico de celular sin diferenciación aparente. Esta capa era constituida por los axones de las neuronas modificadas que conforman la CNE (Fig. 5C). En el interior de los axones, en el axoplasma, se podían observar microtúbulos y microfilamentos (Fig. 5C). A las 36 hde (3.09 ± 0.07) se observó la diferenciación de tres capas más en la retina. En orden desde el exterior hacia el interior se observaron la capa nuclear externa (CNE), capa plexiforme externa (CPE), capa nuclear interna (CNI), capa plexiforme interna (CPI) y capa ganglionar (CG) (Fig. 2D). 26 Figura 5.- Retina en larvas del huachinango del Pacífico Lutjanus peru entre las 18 y 36 hde. A) retina a las 18 hde, se oberva la capa nuclear externa (cne) en formación. técnica H-E, barra = 20μm. B) capa nuclear externa 18 hde, técnica MET, barra = 2μm. C) capa plexiforme externa 24 hde, nótese en el recuadro superior los microtúbulos y microfilamentos dentro de los axones, técnica MET, barras, 500nm y 100nm en el recuadro. D) capas de la retina diferenciada a las 36 hde, técnica H-E, barra = 5μm. cg, capa ganglionar; cne, capa nuclear externa; cni, capa nuclear interna; cpi, capa plexiforme interna; cr, cristalino; m, mitocondria; N, núcleo; re, retículo endoplásmico; flechas, cordones nerviosos. 27 A los 48 hde (3.31 mm ± 0.12), la morfología externa de las larvas se encontró muy diferente de lo que se observó a la eclosión (Fig. 6A). Los ojos eran pigmentados aunque la boca y el ano permanecían cerrados. En el ojo, una delgada capa de pigmento epitelial se observó en la zona de la CNE, sin embargo todavía un tanto difuso y aun escaso (Fig. 6B, comparece con la Fig. 6C). Se observaron también escasas células redondeadas en desarrollo. Eran células fotorreptoras llamadas conos (Fig. 6B). El resto de las capas de la retina eran fácilmente distinguible, sin embargo poco diferenciadas a nivel celular (Fig. 6B). Al momento de la primera alimentación (70 hde, Lt: 3.44 ± 0.22mm) la retina era más diferenciada (Fig.6C). Se observaron ocho capas principales: capa de pigmento epitelial (PE), capa de células fotorreceptoras o conos (CO), capa nuclear externa (CNE), capa plexiforme externa (CPE), capa nuclear interna (CNI), capa plexiforme interna (CPI), capa ganglionar (CCG) y capa de fibras nerviosas (CFN) (Fig. 6C). La capa del pigmento epitelial presentó mayor grado de arreglo y una mayor densidad de pigmento. En la capa de células fotorreceptoras se observaron células mayormente diferenciadas y un mayor número de conos. La CNE era compuesta por una sola hilera de células con núcleos alargados, eucromatícos y de forma más o menos irregular. La CPE presentó un aspecto granuloso. Era constituida por axones y/o dendritas de las células adyacentes (Fig. 6C, D). Dentro de la CNI se encontraron desde el exterior hacia el interior, tres tipos diferentes de células: las células horizontales orientadas de manera paralela a la superficie de la retina (Fig. 6C, D), las células bipolares y finalmente, en el borde inferior, las células amacrinas (Fig. 3C). La CPI tenía un aspecto muy similar a la CPE pero era más ancha. La CCG era constituida por células ganglionares conectadas al tallo óptico mediante una serie de fibras nerviosas que constituyen la última capa de la retina (CFN) (Fig. 6C). 28 29 Figura 6.- Retina en larvas del huachinango del Pacífico Lutjanus peru entre las 48 y 70 hde. A) Morfología externa de la larva a las 48 hde con ojo (oj) pigmentado, barra = 20μm. B) estratificación de la retina a las 48 hde, técnica MET, barra = 2μm. C) retina diferenciada a las 70 hde mostrando las células bipolares (asteriscos) y células amacrinas (flechas blancas) en la capa nuclear interna (cni), técnica MET, barra = 10μm. D) capa plexiforme externa (cpe) y capa nuclear interna (cni) mostrando las células horizontales (ch), técnica TEM, barra = 2μm. b, boca; ccg, capa ganglionar; cfn, capa de fibras nerviosas; cg, célula ganglionar; ch, células horizontales; cne, capa nuclear externa; cni, capa nuclear interna; cpe, capa plexiforme externa; cpi, capa plexiforme interna; co, capa de células fotorreceptoras (conos); cr, cristalino; pe, capa de pigmento epitelial; td, tubo digestivo. Pocas horas después de la primera alimentación se observó un incremento en el número de conos y una mayor cantidad de pigmento en la PE (Fig. 7A). El pigmento epitelial era dispuesto alrededor de las células fotorreceptoras (conos) en un arreglo ordenado (Fig. 7B) e incluso unidos entre sí (Fig 7C). Figura 7.- Retina de larvas del huachinango del Pacífico Lutjanus peru a las 93 hde. A) parte superior de la retina mostrando un denso pigmento epitelial (pe) y abundantes conos (co), técnica H-E, barra = 5μm. B) corte transversal de la retina mostrando el arreglo del pigmento epitelial (pe) y las células fotorreceptoras (co), técnica MET, barra = 2μm. C) corte transversal de los conos mostrando en su interior los discos (di) y la fusión con el pigmento epitelial (pe), técnica MET, barra= 500nm. se, segmento externo de los conos. 30 Dentro de los conos y del exterior al interior de la retina, se encontró el segmento externo (SE), constituido por una serie homogénea de placas o laminas planas también llamadas discos (Fig. 7C), seguido del segmento interno, compuesto por el elipsoide (EL) y el mioide. El EL era unido al SE mediante un cilio. En el mioide, se observaron algunos organelos como el retículo endoplásmico (Fig. 8). En el segmento interno, se observaron algunas mitocondrias. En la zona periférica donde convergen el SE y EL, se observó una estructura conocida como proceso apical. Figura 8.- Ultraestructura de los conos en la retina del huachinango del Pacífico Lutjanus peru a las 93 hde, técnica MET, barra = 500nm. ap, proceso apical; ci, cilio; el, elipsoide; m, mitocondria; mio, mioide; se, segmento externo. 31 7.2.1.2 Neuromastos Morfológicamente, los neuromastos libres se observaron como estructuras convexas que sobresalían de la superficie corporal de la larva. Desde la eclosión, las larvas presentaron un par de neuromastos libres en la región frontal, ligeramente por encima del hocico (el cual permaneció cerrado hasta las 70 hde aproximadamente) (Fig. 9A). Se observaron de dos a tres pares alrededor de los ojos (Fig. 9B) y de 4 a 5 pares en el tronco (Fig. 9C). Figura 9.- Neuromastos libres en larvas del huachinango del Pacífico Lutjanus peru al momento de la eclosión, técnica MEB. A) dos neuromastos frontales (flechas), barra = 50 μm. B) tres neuromastos en la región del ojo (flechas), barra = 200μm. C) cuatro neuromastos en la región del tronco (flechas), barra = 200μm; oj, ojo. 32 Los neuromastos eran constituidos por células sensoriales alargadas o piriformes con un gran núcleo basal, grandes y alargadas mitocondrias, retículo endoplásmico y complejo de Golgi. Eran rodeados por células de soporte (Fig. 10A.) En la región apical, de las células sensoriales, dos tipos de cilios se observaron. El primer tipo se presentó como un conjunto de cilios relativamente cortos llamados estereocilios y el segundo tipo más largo, como un solo cilio llamado kinocilio (Fig. 10A, C). El kinocilio presentó una estructura típica fibrosa con un arreglo 9+2 de sus microtúbulos (Fig. 10D). Al momento de la primera alimentación (70 hde; Lt: 3.44 ± 0.22 mm) el único cambio aparente fue un desplazamiento ascendente del par de neuromastos de la región frontal (Fig. 13C). Figura 10.- Neuromastos libres en larvas del huachinango del Pacífico Lutjanus peru a las 18 hde, técnica MET. A) ultraestructura de un neuromasto, barra = 2μm. B) células sensoriales de un neuromasto libre, barra = 500nm. C) región apical de un neuromasto, las flechas señalan los estenocilios, barra = 500nm. D) estructura de un kinocilio mostrando el arreglo 9+2 de sus microtúbulos, barras = 500nm y 100nm en el recuadro. cs, células sensoriales; cso, células de soporte; G, aparato de Golgi; ki, kinocilio; m, mitocondria; N, núcleo; re, retículo endoplásmico. 33 7.2.1.3 Oído interno Los oídos internos de las larvas se presentaron como estructuras pareadas localizadas en el cráneo, cerca del cerebro medio. Al momento de la eclosión, el oído interno se apreció como una vesícula ovalada que contenía dos pares de otolitos de tejido cartilaginosos: el Lapillus y el Sagitta (Fig. 11A y B). Figura 11.- Oído interno en larvas del huachinango del Pacífico Lutjanus peru al momento de la eclosión. A) región anterior dorsal, en el acercamiento (imagen derecha) se muestra la cámara ótica (co) conteniendo un otolito (ot), técnica MEB, Barra de la sección izquierda = 200μm, barra de sección derecha = 20 μm. B) vesícula ótica mostrando los otolitos, técnica H-E, barra = 5μm. Lp: otolito Lapillus; oj, ojo; Sg: otolito Sagitta; co: vesícula ótica. A las 24 hde, la cavidad ótica era relativamente más grande y compuesta por un epitelio simple en la región dorsal y por un epitelio estratificado en la región ventral, el cual era constituido por células de soporte y células sensoriales formando la mácula (Fig. 12A y B). Ultraestructuralmente, estas células sensoriales presentaron un gran núcleo centro-basal, mitocondrias supranucleares, grandes complejos de Golgi, así como grandes cisternas de retículo endoplásmico con ribosomas unidos. Presentaron en la región apical cilios o kinocilios (Fig. 12C). Se observó también una comunicación entre los canales semicirculares (Fig. 12D). 34 Figura 12.- Oído interno en larvas del huachinango del Pacífico Lutjanus peru a las 24 hde A) borde de la cámara ótica mostrando un epitelio simple (eps) y epitelio estratificado (epe), técnica MET, barra = 10μm. B) epitelio sensorial de la cámara ótica, técnica MET, barra = 2μm. C) ultraestructura de las células sensoriales, con la presencia de kinocilios (ki) técnica MET, barra = 500nm. D) cámara ótica mostrando los canales semicirculares con sus otolitos, técnica H-E, barra = 5μm. cs, célula sensorial; csa, cámara sacular; cso, celula de soporte; cu, cámara utricular; G, aparato de Golgi; lu, lumen; m, mitocondria; N, núcleo; re, retículo endoplásmico. 35 7.2.1.4 Órgano olfativo El órgano olfativo al momento de la eclosión era rudimentario. Sin embargo, aunque los nostrilos aun permanecían cerrados, seis horas después de la eclosión se observaron las lamelas de las placas olfativas (Fig. 13A). La apertura de los nostrilos se observó a las 48 hdde (Fig. 13B), mientras que el epitelio olfativo era presente en las larvas a las 70 hdde (primera alimentación) (Fig. 13C). A esa edad, se observó que el epitelio olfativo era conectado al bulbo olfatorio. Figura 13.- Órgano olfativo en larvas del huachinango del Pacífico Lutjanus peru hasta el momento de la primera alimentación. A) ubicación de las placas olfativas (po) a las 6 hde, técnica MEB, barra = 5μm. B) parte frontal de una larva de 48 hde mostrando los nostrilios (no), técnica MEB, barra = 30μm. C) región anterior de una larva de 70 hde mostrando el epitelio olfativo (eo), técnica H-E, barra = 20μm. n, neuromasto libre; oj, ojo. 36 7.2.2 Desarrollo del aparato bucal Al momento de la eclosión, las larvas presentaron una boca cerrada, en posición subventral que carecía de estructuras bucales. Las primeras estructuras en desarrollarse fueron, el cartílago de Meckel, cuadrado, hioideo y hiomandibular, las cuales se observaron en larvas de 3.31 ± 0.12 mm de Lt (48 hde). Sin embargo, presentaron un desarrollo limitado y la boca se encontraba todavía cerrada (Fig. 14A). El interhial se observó a los 3.45±0.21 mm de Lt y un ancho de boca de 0.208 ± 0.01 (70 hde). A esta talla, las larvas ya presentaron la boca abierta (Fig. 14B). Al momento de iniciar la alimentación exógena, las larvas presentaron una longitud total promedio de 3.72 ± 0.19 mm y un ancho de la boca de 0.22 ± 0.02 mm (93 hde). Las estructuras presentes incrementaron en diámetro (Fig. 14C) y se observó la presencia de cuatro pares de arcos branquiales (Fig. 15A). Además de presentar la boca abierta, se observaron movimientos permitidos por dos articulaciones entre el cartílago de Meckels y el cuadrado, y entre el hiomandibular y el cráneo. Todas las estructuras que componen el aparato bucal hasta esta edad eran constituidas por cartílago hialino, el cual era formado por una abundante matriz extracelular ubicando a los condrocitos en espacios vacíos llamados lagunas (Fig. 15B). La matriz extracelular de los condrocitos era compuesta de fibras de colágeno y acido hialurónico (Fig. 15C, D). Cada placa de tejido cartilaginoso, estuvo rodeada por el pericondrio compuesto de tejido conjuntivo denso en el cual se distinguía una capa externa fibrosa y una capa interna celular. Es esta capa, se observan algunas células que pueden dar origen a condroblastos que son los precursores de los condrocitos (células maduras) (Fig. 15D). Dentro de una misma placa de tejido cartilaginoso los condrocitos estaban separados por la matriz interterritorial, que principalmente de colágeno tipo II y glicoproteinas (Fig. 15B). 37 esta formada Figura 14.- Ilustración del desarrollo de estructuras que componen el aparato bucal en larvas del huachinango del Pacífico Lutjanus peru. c, cuadrado; cM, cartílago de Meckel; hi, hiodeo; hm, hiomandibular; ih, interhial. Las abreviaturas: hde, horas después de la eclosión; Lt, longitud total. 38 Figura 15.- Estructura del cartílago en larvas del huachinango del Pacífico Lutjanus peru al momento de la primera alimentación. A) corte longitudinal de la región anterior mostrando cuatro pares de arcos branquiales (a), técnica H-E, barra = 10μm. B) cartílago de Meckel mostrando los condrocitos (c), técnica MET, barra = 10μm. C) placa de tejido cartilaginoso mostrando la capa interna celular (cic) y la capa externa fibrosa (cef) del pericondrio (pc), técnica MET, barra = 10μm. D) ultraestructura de un condrocito, técnica MET, barra = 2μm. al, aleta; c, condrocitos; cM, cartílago de Meckel; fc, fibras de colágeno; mt, matriz territorial; mit, matriz interterritorial; N, núcleo; re, retículo endoplásmico; v, vesícula de secreción. 39 7.2.3 Sistema digestivo El tracto digestivo de las larvas de huachinango, al momento de la eclosión, se observó como un simple tubo recto e indiferenciado localizado sobre el saco de vitelo (Fig. 16A). No se distinguían la boca ni el ano (Fig. 16A y B). Se observó un epitelio simple cuboidal recubriendo el tracto digestivo el cual presentó un lumen muy estrecho (Fig. 16B). En la región media del tracto digestivo, se pudo observar las células del epitelio, sentadas sobre una delgada capa o lámina basal que a su vez descansó sobre una capa de tejido subepitelial. Las células epiteliales presentaron un gran núcleo de forma irregular, así como numerosas mitocondrias, retículo endoplásmico rugoso, ribosomas dispersos y aparatos de Golgi (Fig. 17A). En posición supranuclear se observaron cuerpos vesiculares con estructuras membranosas y material electrodenso rodeado por un halo irregular. El borde apical del epitelio presentó pequeñas microvellosidades (menores de 100 nm) en aparente desarrollo y ligadas al citoplasma mediante complejos de unión (Fig. 17A y B). Tanto el hígado como el páncreas se observaron como un pequeño conjunto de células indiferenciadas (Fig. 16C). Alrededor de las 18 hde se observó el inicio del ensanchamiento del tubo digestivo en su región anterior y un incremento de tamaño tanto en páncreas como en hígado (Fig. 18A). El hígado se encontró rodeado por tejido conjuntivo (Fig. 18B). Los hepatocitos presentaron un gran núcleo ocupando alrededor de dos terceras partes de la célula, mientras que en el citoplasma se observó una gran cantidad de mitocondrias y retículo endoplásmico (Fig. 18C). 40 Figura 16.- Larvas de huachinango del Pacifico Lutjanus peru al momento de la eclosión. A) estructura general, técnica H-E, barra = 10μm. B) tubo digestivo (td) con el lumen estrecho (*), técnica H-E, barra = 10μm. C) región anterior de una larva mostrando el desarrollo incipiente del hígado (h) y el páncreas (p), técnica H-E, barra = 25μm. c, corazón; enc, encéfalo; ga, glóbulo de aceite; mt, musculatura troncal; oj, ojo; td, tubo digestivo; v, saco de vitelo. 41 Figura 17.- Ultraestructura de la región media del tracto digestivo de larvas del huachinango del Pacífico Lutjanus peru al momento de la eclosión, técnica MET. A) futuro intestino anterior compuesto por el tejido subepitelial (tse), la lamina basal (lb) y los enterocitos. B) zona apical del futuro intestino anterior mostrando pequeñas microvellosidades en desarrollo (flechas). Barras = 500nm; cu, complejo de unión; G, aparato de Golgi; lu, lumen; m, mitocondrias; me, material electrodenso; N, núcleo; cv, cuerpos vesiculares. Figura 18.- Estructura del hígado en larvas del huachinango del Pacífico Lutjanus peru a las 18 hde. A) región ventral de la larva, técnica H-E, barra = 10μm. B) corte transversal del hígado mostrando los hepatocitos (hp), técnica MET, barra = 2μm. C) ultraestructura de un hepatocito mostrando un prominente núcleo (N), técnica MET, barra = 500nm. ga, glóbulo de aceite; h, hígado; m, mitocondrias; mt, musculatura troncal; oj, ojo; p, páncreas, re, retículo endoplásmico; tc, tejido conectivo; td, tubo digestivo; v, saco de vitelo. 42 A las 48 hde se observó de manera externa cierta diferenciación e incremento de tamaño del tubo digestivo, así como un incremento en el tamaño del hígado y páncreas (Fig. 19A). El intestino anterior se apreció como una especie de saco alargado y más dilatado en su porción rostral, seguido de la válvula intestinal en formación (Fig. 19A). Finalmente, la región posterior también presentó un mayor ensanchamiento y una curvatura en un ángulo de 90º, sin embargo el ano aun no era abierto. A nivel histológico se pudo observar una regionalización del tracto digestivo: cavidad bucofaríngea, esófago e intestino anterior y posterior (Fig. 19B). La cavidad bucofaríngea era comunicada con el intestino anterior a través del esófago que apareció como una región corta y de lumen estrecho, recubierto por un epitelio escamoso simple (Fig. 19B). Tanto el intestino anterior y posterior eran recubiertos por un epitelio columnar simple con microvellosidades desarrolladas. Ultraestructuralmente, sus células presentaron un núcleo eucromatíco con un espacio perinuclear dilatado, un gran número de ribosomas libres dispersos por toda la célula (Fig. 20A) y mitocondrias rodeadas por estructuras lamelares (Fig. 20B). Se presentaron también mitocondrias ramificadas y mitocondrias en aparente degradación, con un menor número de crestas en su interior y una matriz electrolúcida (Fig. 20B). En el borde plumoso de los enterocitos se observaron las microvellosidades con un casquete apical electrodenso (Fig. 20A). 43 Figura 19.- Morfología de larvas del huachinango del Pacífico Lutjanus peru a las 48 hde. A) morfología externa, barra = 20μm. B) regionalización del tracto digestivo, técnica H-E, barra = 50μm. b, boca; cbf, cavidad bucofaríngea; e, esófago; h, hígado; ia, intestino anterior; ip, intestino posterior; mt, musculatura troncal; p, páncreas. 44 A esta misma edad, se observó una diferenciación de las glándulas accesorias como el hígado y páncreas (Fig. 19B). El páncreas era fácilmente detectable en posición dorsal del intestino anterior, aunque se pudo observar también rodeando al intestino, y conectándose a este por medio del conducto pancreático o canal de Wirsung, compuesto de células cúbicas (Fig. 21A). Dentro del tejido pancreático se observó el primer islote de Langerhans constituido por células endocrinas unidas entre sí en el seno del tejido pancreático exocrino. Las células endocrinas presentaron un núcleo de contorno irregular y alargado y en su citoplasma exhibieron algunas mitocondrias, retículo endoplásmico y escasos gránulos endocrinos de contenido relativamente electrodenso, y en ocasiones, rodeados por un delgado halo claro (Fig. 21B). El páncreas exocrino, el cual se encontró rodeando al islote de Langerhans, era compuesto de grandes células redondas con un gran núcleo relativamente céntrico. El citoplasma de estas células era ocupado por mitocondrias y retículo endoplásmico. Igualmente se apreciaron vesículas y vacuolas de diferentes tamaños y de contenido electrodenso de variable intensidad que diferencia a los diferentes estadios de la formación de gránulos de zimógeno (Fig. 21B). El hígado localizado en posición ventral del esófago (Fig. 19b) presentó hepatocitos con un núcleo grande y más o menos central, grandes y abundantes mitocondrias, así como complejos de Golgi y abundantes ribosomas libres (Fig. 21C). Se observaron también los sinusoides con un gran espacio de Disse (espacio perisinusoidal) y algunos canalículos biliares con aparentes microvellosidades (Fig. 21C). En posición supranuclear, se observaron algunas inclusiones de material electrodenso las cuales al parecer son material de reserva como el glucógeno. Se observaron también otras inclusiones transparentes las cuales corresponden a lipoproteínas (Fig. 21C). 45 Figura 20.- Ultraestructura del intestino en larvas del huachinango del Pacífico Lutjanus peru a las 48 hde, técnica MET. A) región apical del intestino mostrando la presencia de las microvellosidades (mic). B) región sub-nuclear mostrando estructuras lamelares (el) unidas a las mitocondrias (m), la flecha indica el espacio intercelular Barras = 500nm. lu, lumen; m, mitocondrias; me, material electrodenso; mr, mitocondrias ramificadas; N, núcleo; asterisco, mitocondrias en aparente degeneración. 46 Figura 21.- Estructura del páncreas e hígado en larvas del huachinango del Pacífico Lutjanus peru a las 48 horas después de la eclosión. A) corte transversal del tracto digestivo mostrando el páncreas (p) y el conducto pancreático (cp), técnica H-E, barra = 1μm. B) ultraestructura del páncreas endocrino mostrando un islote de Langerhans (IL) con pequeños gránulos endocrinos (flechas) y el páncreas exocrino (Ex) mostrando gránulos de zimógeno (z), técnica MET, barra = 2μm. C) ultraestructura del hígado mostrando gránulos de glucógeno (gl) y lipoproteínas (lp), técnica MET, barra = 2μm. cb, canales biliares; cp, conducto pancreático, eD, espacio de Disse; ia, intestino anterior; m, mitocondria; N, núcleo; re, retículo endoplásmico; s, sinusoide. 47 Al inicio de la primera alimentación (70 hde), la cavidad bucofaríngea presentó cuatro pares de arcos branquiales (Fig. 15A). El esófago era cubierto de un epitelio con células caliciformes con un gran núcleo en posición central, escasas mitocondrias y una gran cantidad de retículo endoplásmico (Fig. 22A). En la región apical del epitelio se observó una gran cantidad de vesículas de secreción expulsadas mediante la evaginación de la membrana celular (Fig. 22A). Seguido del esófago se observó el estómago en desarrollo, que consistió en un tubo recto y corto de lumen más amplio y sin repliegues agudos como es el caso del intestino. Era tapizado por una simple capa de células de tipo columnar (Fig. 22B). Las células epiteliales del estómago presentaron un núcleo eucromático de forma irregular ocupando gran parte del volumen celular y rodeado por un espacio perinuclear ligeramente dilatado. Por encima del núcleo, se observaron generalmente los complejos de Golgi (Fig. 22C). En la zona apical del citoplasma se apreciaron escasas vesículas. En la membrana plasmática, se observaron escasas microvellosidades apicales, cortas, irregulares y sin casquete apical electrodenso como en el caso del intestino. En el lumen estomacal, se presentaron estructuras membranosas cerradas, que probablemente representaban secciones de estructuras globulares con contenido electrolúcido similar al del lumen (Fig. 22C). La lámina basal, formada por una capa delgada con aspecto claro era continua. El tejido subepitelial era constituido por una capa de una a dos células indiferenciadas de forma más o menos alargadas, de contorno irregular y de tipo mesenquimatoso que mostrarón un núcleo alargado y eucromatíco y en su citoplasma, ribosomas dispersos y escasos complejos de Golgi. El (Fig. 22D). Finalmente, a las 93 hde, en el intestino se observaron repliegues en la mucosa más pronunciados y en posición supranuclear, una mayor cantidad de mitocondrias ramificadas (Fig. 22E). Una mayor cantidad de microvellosidades de mayor tamaño y con algunas ramificaciones se observaron en el bordo plumoso (Fig. 22E). Una válvula compuesta de epitelio columnar simple y fibras musculares se observó entre el intestino anterior y posterior (Fig. 22F). 48 49 Figura 22.- Tubo digestivo en larvas del huachinango del Pacífico Lutjanus peru después de la primera alimentación. a-d, 72 hde y e-f, 93 hde. A) corte transversal del esófago con algunas vesículas de secreción (vs), técnica MET, barra = 2μm. B) corte transversal del tracto digestivo mostrando el desarrollo del futuro estomago (es), técnica H-E, barra = 5μm. C) estómago mostrando algunas vesículas de pinocitosis (vp) y en la región apical escasas microvellosidades (mic), técnica MET, barras = 2μm. D) estómago envuelto en una capa de tejido subepitelial (tse) y lamina basal (lb), técnica MET, barra = 1μm. E) intestino bien desarrollado con abundantes y alargadas microvellosidades (mic), técnica MET, barra = 500nm. F) válvula intestinal (vi) separando ambos intestinos, técnica H-E, barra = 5μm. cu, complejo de unión; el, estructura lamelar; em, estructura membranosa; G, aparato de Golgi; h, hígado: ia, intestino anterior; ip, intestino posterior; lu, lumen; m, mitocondria; mr, mitocondria ramificada; N, núcleo; p, páncreas; re, retículo endoplásmico. 50 7.3 Eficiencia en la alimentación exógena En todos los experimentos, se observó que las larvas presentaron alimento en el tracto digestivo a las 6 horas después de habérselos proporcionado. El rango de talla de las larvas al momento de la primera alimentación (74-80 hde) fue de 3.22 a 3.76 y con un ancho de boca de 2.07 a 2.26. 7.3.1 Temperatura de incubación En este experimento no se presentaron diferencias significativas en la eficiencia alimenticia (p>0.05) entre las temperaturas de incubación (Fig. 23A y B). La incidencia alimenticia fue de 29.6 ± 4.4 a 26 ºC, 26.9 ± 5.4 a 28 ºC y 31.1 ± 3.8 a 30 ºC. La intensidad alimenticia fue de 1.1 ± 0.1 a 26 ºC, 1.1 ± 0.2 a 28 ºC y de 1.1 ± 0.1 a 30 ºC. 40 A 1,4 B a a Número de presas por larva a Larvas con alimento (%) a a a 1,2 30 20 10 1,0 0,8 0,6 0,4 0,2 0 0,0 26 28 30 26 Temperatura de incubación (ºC) 28 30 Temperatura de incubación (%) Figura 23.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru incubadas a diferentes temperaturas. A) incidencia alimenticia, y B) intensidad alimenticia. Letras diferentes indican diferencias significativas (p<0.05). 51 7.3.2 Efecto de la intensidad de luz, tipo de presa y color del tanque En cuanto al color del tanque, no se presentaron diferencias significativas sobre la incidencia alimenticia (p=0.493), ni en la intensidad alimenticia (p=0.195). De manera general, la incidencia alimenticia fue menor al 25% en todos los tratamientos (Fig. 24A). Se observaron diferencias significativas para el tipo de presa e intensidad de luz. De la misma manera se observó una interacción significativa entre estos dos factores. A 3000 lux no hubo diferencias significativas entre el tipo de presa, a 2500 y 2000 lux la incidencia alimenticia fue significativamente mayor con nauplios de copépodos. Sin embargo, es importante mencionar que con 3000 lux, no hubo consumo de neonatos de rotíferos en el tratamiento de dieta mixta. En cuanto a la intensidad alimenticia, no se observó diferencias significativas (p>0.05) para ningún factor. El número promedio de presas por larva fue de 1.1 ± 0.1 nauplios (Fig. 24B). 1,6 25 N M A a B 1,4 a Número de presas por larva Larvas con alimento (%) 20 b b 15 c c 10 5 1,2 N M a a a a a a 1,0 0,8 0,6 0,4 0,2 0,0 0 3000 2500 3000 2000 2500 2000 Intensidad de luz (Lux) Intensidad de luz (Lux) Figura 24.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas bajo diferentes condiciones de luz y tipo de presa, durante la primera alimentación exógena. A) incidencia alimenticia, y B) intensidad alimenticia. N=nauplios de copépodos E. acutifrons; M= mezcla de nauplios de E. acutifrons y neonatos de rotíferos B. rotundiformis en una proporción 1:1. Letras diferentes indican diferencias significativas (p<0.05). 52 7.3.3 Talla de presa y densidad La incidencia alimenticia mostró diferencias significativas, con respecto a la talla del nauplio. Se observó que la mayor (p=0.00001) incidencia alimenticia fue con nauplios I-III (Fig. 25A). En cuanto a la densidad de presa, la menor incidencia (p=0.001) se observó a 5 nauplios ml-1, mientras que no hubo diferencias (p=0.38) entre 10 y 15 nauplios ml-1. Se observó una interacción (p=0.002) entre los factores talla del nauplio y la densidad. La incidencia alimenticia fue mayor (p=0.01) en el tratamiento con 5 nauplios ml -1 de talla 46 ± 8μm (estadio I-III) que en los tratamientos de 5, 10 y 15 nauplios ml -1 a una talla de 72 ± 12μm (estadio IV-VI) (Fig. 25A). La intensidad alimenticia no mostró diferencias significativas (p>0.05), el número promedio de presas consumidas fue de 1.1 ± 0.2 nauplios larva-1(Fig. 25B). b 15 nauplios/ml 30 a 20 c 10 c 5 nauplios/ml 10 nauplios/ml B 5 nauplios/ml 10 nauplios/ml 15 nauplios/ml Número de presas por larva A Larvas con alimento (%) 2,5 b 40 a 2,0 a 1,5 a a a a 1,0 0,5 c 0,0 0 I-III I-III IV-VI IV-VI Estadio naupliar Estadio naupliar Figura 25.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas con nauplios de copépodos de diferentes estadios (I-III y IV-VI) y densidad. A) incidencia alimenticia, y B) intensidad alimenticia. Letras diferentes indican diferencias significativas (p<0.05) 53 7.3.4 Temperatura del agua y salinidad La incidencia alimenticia fue afectada solo por la temperatura del agua. La mayor (p=0.0003) incidencia se presentó a temperatura de 25 ºC (Fig. 26A). En cuanto a la salinidad, no hubo diferencias significativas (p=0.149). La interacción entre los factores no fue significativa (p=0.549). La intensidad alimenticia no mostro diferencias significativas (p>0.05) para ningún factor, el número promedio de nauplios consumidos fue de 1.3 ± 0.1 presas larva-1 (Fig. 26B). 1,8 70 25 ups 30 ups 35 ups a 60 Larvas con alimento (%) a a 50 40 b b 30 b 20 1,6 Número de presas por larva A 10 a B 25 ups 30 ups 35 ups a a a 1,4 a a 1,2 1,0 0,8 0,6 0,4 0,2 0,0 0 25 25 28 28 Temperatura de alimentación (ºC) Temperatura de alimentación (ºC) Figura 26.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas a diferentes temperaturas y salinidades. A) incidencia alimenticia, y B) intensidad alimenticia. Letras diferentes indican diferencias significativas (p<0.05). 54 7.3.5 Concentración de microalga y densidad de presa No se observaron diferencias significativas (p>0.05) para la concentración de microalga y tampoco para la densidad de presa (Fig. 27A y B). El valor promedio de la incidencia alimenticia fue de 21.7 ± 2.2, mientras que la intensidad alimenticia fue 1.2 ± 0.1. 40 15 nauplii/ml 1,6 a Número de presas por larva Larvas con alimento (%) a 30 B 15 nauplios/ml a 10 nauplii/ml 1,8 10 nauplios/ml A a a a 20 10 1,4 a a a a a a 1,2 1,0 0,8 0,6 0,4 0,2 0,0 0 0 300 0 1000 300 1000 Concentración de microalgas (miles de celulas/ml) Concentración de microalgas (miles de células/ml) Figura 27.- Eficiencia alimenticia en larvas del huachinango del Pacífico Lutjanus peru alimentadas a diferentes concentraciones de microalga Nannochloropsis oculata y diferentes densidades de presa. a) Incidencia alimenticia, b) Intensidad alimenticia. 55 VIII. DISCUSIÓN 8.1 Aspectos generales del desarrollo En Lutjanus peru, el diámetro promedio del huevo fue de 0.82 mm, la larva eclosionó en 2.45 mm de LT y al momento de la primera alimentación midió alrededor de 3.45 mm de LT. Estos datos son similares a lo registrado para otras especies de la Familia Lutjanidae (Leu et al., 2003). En el huachinango, la completa reabsorción del vitelo se observó entre las 55-60 hde. La absorción de las reservas vitelinas se da mediante el periblasto o sincitio el cual era compuesto de una membrana multi-nucleada con gran cantidad de mitocondrias, parches de retículo endoplásmico y complejos de Golgi, al igual que en otras especies como Stizostedion lucioperca (Mani-Ponset et al., 1994), Perca fluviatilis (Krieger & Fleig, 1999). Heming & Buddington (1988) mencionan que se pueden distinguir dos regiones a nivel ultraestructural. La primera, caracterizada por la presencia de retículo endoplásmico liso, numerosos mitocondrias y gránulos de glucógeno, e involucrada con el metabolismo de carbohidratos y lípidos; y la segunda, caracterizada por la presencia de retículo endoplásmico rugoso y complejos de Golgi, involucrada en la síntesis y transporte de sustancias proteicas. Al inicio de la alimentación exógena (3 días después de la eclosión) las larvas presentan la boca y ano abiertos. El tiempo de inicio de la alimentación varía según la especie y la temperatura; por ejemplo, en Sigannus guttatus, Lates calcarifer (Avila & Juario, 1987) y Scophthalmus rhombus (Hachero-Cruzado et al., 2009) se da al día 1 después de la eclosión (DE); en Paralabrax maculatofasciatus se da al día 2 DE (Peña et al., 2003); en Sparus aurata (Calzada, 1996), Paralichthys californicus (Gisbert et al., 2004) y Lutjanus peru (Zavala-Leal, 2007) al día 3 DE; mientras que en Stizostedion lucioperca se da entre 5-6 días DE (Mani-Ponset et al., 1996). En este estudio se observó que la apertura de la boca y ano, coincidieron con la diferenciación o regionalización del tracto digestivo como se ha mencionado para otras especies (HacheroCruzado et al., 2009; Gisbert et al., 2004). Además, coincidió con la presencia de pigmento en el ojo lo que le confiere funcionalidad (Porter & Theilacker; 1999; Roo et al., 1999) y con la presencia de una musculatura troncal bien 56 desarrollada que rodea la notocorda, una aleta media o pliegue que rodea todo el cuerpo y un par de aletas pectorales, lo cual permite tener un nado activo y ataque sobre su presa (Osse & Akser, 1996) para poder capturarla e ingerirla. 8.2 Desarrollo estructural La mayoría de los estudios realizados sobre el desarrollo del ojo y el tubo digestivo en peces se han realizado mediante técnicas histológicas convencionales (Sarasquete et al., 1995; Porter & Theilacker, 1999; Roo et al., 1999; Peña et al., 2003; Peña & Dumas, 2007). Y los que se realizan a nivel ultraestructural solo describen el periodo exotrófico (Avila & Juario, 1987; Deplano et al., 1991; Segner et al., 1994; Calzada et al., 1998; Elbal et al., 2004). El presente trabajo describe de una manera más detallada el desarrollo ontogénico de los órganos sensoriales, sistema digestivo y aparato bucal de Lutjanus peru desde el momento de la eclosión hasta el inicio de la primera alimentación, periodo en el cual se presentan los mayores cambios ontogénicos (Calzada, 1996; Hunt von Herbing et al., 1996; Matsuoka, 2001; Rodríguez & Gisbert, 2001; Peña & Dumas, 2007), haciendo más completo el estudio de la organogénesis. Los resultados de la presente tesis describen el desarrollo de cada uno de los órganos o estructuras antes mencionadas, sin embargo, con la finalidad de presentar una mejor perspectiva sobre el desarrollo de las larvas de huachinango del Pacífico me he permitido realizar una discusión basada en las diferentes etapas del desarrollo de los organismos como lo son la eclosión, periodo de alimentación endógena y la primera alimentación exógena. 57 8.2.1 Eclosión (0 hde) Los peces de ontogenia indirecta, como es el caso del huachinango, eclosionan con un bajo grado de desarrollo (Kendall et al., 1984). Al igual como se ha observado en otras especies (Porter & Theilacker, 1999), los sistemas visual y digestivo presentaron escaso desarrollo, ambos compuestos de células indiferenciadas. La retina se observó, sin estratificación y con un arreglo concéntrico como sucede en otras especies (Kawamura & Ishida, 1985; Kawamura et al., 2003; Peña & Dumas, 2007). El tracto digestivo apareció como un tubo recto e indiferenciado, situado en la parte dorsal del saco de vitelo. La boca y ano permanecían cerrados. El epitelio digestivo no era diferenciado y constó de una sola capa de células cuboidales, con núcleos basales y con algunas microvellosidades cortas en la región apical tal y como se ha descrito también en Scophthalmus rhombus (Hachero-Cruzado et al., 2009). En Sparus aurata se observó que, al igual como sucede en el huachinango las células epiteliales del tracto digestivo poseen características embrionarias, como son: la presencia de cilios, núcleos voluminosos, eucromatícos y de forma irregular, escases de organelos y numerosas mitocondrias alargadas. Sin embargo, como lo ha descrito Calzada (1996), es posible detectar algunas señales de diferenciación y una regionalización del tracto digestivo en 5 regiones. La presencia de algunas estructuras membranosas en la luz del tubo digestivo aún no es muy clara, sin embargo, Calzada (1996) quien reporta su presencia en Sparus aurata, menciona que podrían ser restos celulares procedentes del recambio celular y que mientras no se abre el ano permanecen en la luz del tubo digestivo, evacuándose con la apertura de este. Las glándulas accesorias como el hígado y el páncreas, se observan como un conjunto de células indiferenciadas como en muchas otras especies (Morrison, 1993; Hamlin et al., 2000; Peña et al., 2003) en forma de parches compactos. Las estructuras que presentaron mayor grado de desarrollo al momento de la eclosión fueron órganos sensoriales como neuromastos libres, el oído interno y el órgano olfativo. En L. peru, se observaron de 2-3 pares de neuromastos en la región cefálica y de 4-5 en el tronco. El número de neuromastos presentes, varía de acuerdo a la especie y la edad (Matsuoka, 2001; Diaz et al., 2003; 58 Kawamura et al., 2003). Presentaron células sensoriales con estenocilios y kinocilios. Su presencia denota funcionalidad como es reportado para Thunnus orientalis (Kawamura et al., 2003) lo cual le permite detectar o evadir depredadores. Se conoce poco sobre el desarrollo temprano del oido interno (Matsuoka, 2001) y su funcionalidad en los primeros días de vida (Baxter, 1986). En el huachinango, al igual que en otras especies como Sardinops melanostictus (Matsuoka, 2001), Paralichthys olivaceus (Kawamura & Ischida, 1985), Oxyeleotris marmoratus (Senoo et al., 1994), el oído interno, al momento de la eclosión, se presentó como una vesícula ovalada con dos otolitos. La mácula fue detectada alrededor de las 24 hde mientras que en S. melanostictus se presenta una mácula bien desarrollada desde la eclosión. Kawamura & Ishida (1985) mencionan que la presencia de la mácula otorga a la larva la capacidad de orientarse horizontalmente lo que se acompaña de un mejor nado. En L. peru se ha observado que a las 24 hde cuando ya esta presente la macula, las larvas presentan una mayor capacidad de nado, es decir, nadan de una manera dirigida y no errática como al momento de la eclosión. Otra estructura sensorial presente al momento de la eclosión es el órgano olfatorio (Ishida & Kawamura, 1985; Kawamura & Ishida, 1985). En Sardinops melanostictus las placas olfativas se observan desde 4 hde (Matsuoka, 2001) mientras que en el huachinango se observó la presencia de las placas olfativas en el segundo muestreo o sea 6 hde. Existe la posibilidad que hayan estado presentes antes pero no se ha observado entre la eclosión y 6 hde. Por otra parte, en otras especies aparecen días después de la eclosión (Appelbaum et al., 1983; Kawamura & Washiyama, 1989). En especies como Engraulis mordax (O`connell, 1981), Sardinops melanostictus (Matsuoka, 2001) y Thunnus orientalis (Kawamura et al., 2003), se observó que con la formación de las placas olfativas se encuentran dos tipos de células receptoras, ciliadas y con microvellosidades. Sin embargo, en las muestras revisadas no se encontraron estos tipos de células. Kawamura (1991) sugiere que el órgano olfativo es funcional antes de la pigmentación de los ojos y la apertura de la boca, debido a la conexión que existe entre el bulbo olfativo y el cerebro, y la apertura de los nostrilos. 59 8.2.2 Periodo de alimentación endógena (6 - 48 hde) En larvas de huachinango se presentaron notorios cambios en la morfología de la retina, el aparato bucal y el tracto digestivo entre 24-48 hde. De manera general se ha reportado que los cambios más agudos se presentan en órganos asociados a la localización de presas (retina), captura (boca), ingestión y digestión (sistema digestivo) (Yúfera & Darias, 2007). Lo que puede ser atribuido al hecho que el cambio de alimentación endógena a exógena implica que, en un tiempo relativamente corto, procesos complejos y altamente dinámicos de diferenciación de órganos, morfogénesis y crecimiento se lleven a cabo (Sala et al., 2005). La retina mostró una estratificación iniciando con la formación de la capa nuclear externa (CNE), conformada por células precursoras de los conos, seguida de la capa plexiforme interna (CPE). Posteriormente inicia el desarrollo de otras capas, siendo la aparición de la capa ganglionar (CG) la que sugiere una posible conexión entre la retina y el tallo óptico antes de la aparición del segmento externo de los conos como ha sido observado en previos estudios sobre el desarrollo simultáneo de la retina y el cerebro (Powers & Raymond, 1990). No obstante, Kawamura et al. (1984) mencionan que el ojo es funcional solamente cuando se desarrolla completamente la capa de pigmento epitelial. En especies como Paralichthys olivaceus (Kawamura & Ishida, 1985), Theregra chalcogramma (Porter & Theilacker, 1999), Pagrus pagrus (Roo et al., 1999), Paralabrax maculatofasciatus (Peña & Dumas, 2007) se ha observado el mismo grado de desarrollo en este periodo, lo cual nos puede indicar la falta de funcionalidad. Las estructuras bucales inician su desarrollo antes de la apertura de la boca (Kohno, 1998), e incluso en algunas especies desde el momento de la eclosión (Hunt von Herbing et al., 1996). En el presente estudio, se describen únicamente las estructuras esqueléticas de la cavidad bucal, sin incluir las estructuras viscero-craniales y la musculatura. En el huachinango, el aparato bucal fue formado por cuatro estructuras cartilaginosas en desarrollo (cuadrado, cartílago de Meckel, hioideo e hiomandibular) como sucede en Gadus morhua y Pseudopleuronectes americanus (Hunt von Herbing, 2001), 60 las cuales son las encargadas de dar soporte y movimiento a las mandíbulas una vez desarrolladas. Conforme se estaban desarrollando la retina y el aparato bucal, se observó una regionalización del tracto digestivo, confirmando lo que varios autores han mencionado, es decir, una sincronía en el desarrollo de los principales órganos asociados a la localización de presas, captura, ingestión y digestión como en otras especies de peces (Roo et al., 1999; Yúfera & Darias, 2007). Las regiones parcialmente diferenciadas en este periodo fueron la cavidad bucofaríngea, esófago, intestino anterior e intestino posterior. Calzada (1996) en larvas de Sparus aurata describió 5 regiones del tracto digestivo (esófago, estómago, intestino medio, posterior y recto) mediante la técnica de microscopia electrónica de transmisión, mientras que Sarasquete y colaboradores (1995) en la misma especie describen solamente tres regiones (esófago, estomago rudimentario e intestinos), mediante técnicas de histología convencional. Calzada, (1996) menciona que estas diferencias pueden estar más relacionadas con las técnicas de análisis debido a que las principales diferencias se dan a nivel epitelial o celular y que son detectadas más fácilmente con la microscopia electrónica. En el huachinango, el tracto digestivo estaba recubierto por un epitelio simple (en algunos casos llamado monoestratificado) y de tipo escamoso en la cavidad bucofaríngea y el esófago, como sucede en Paralabrax maculatofasciatus (Peña et al., 2003), Dentex dentex (Gisbert et al., 2004) y Sparus aurata (Calzada, 1996). Sin embargo, en esta última especie se observaron dos tipos de epitelios, uno escamoso y otro cuboidal, atribuido al inicio del desarrollo del futuro estómago (Calzada 1996) lo cual no se observó en L. peru. El intestino anterior y posterior no presentó grandes diferencias morfológicas. La principal diferencia es el mayor ensanchamiento del intestino anterior. Estas regiones son separadas por una válvula en desarrollo, la cual se forma por plegamiento de la mucosa (Calzada, 1996). Ambas regiones son similares a nivel de epitelial. El epitelio es de tipo columnar, aunque en otras especies también se han reportado de tipo cilíndricas (Calzada et al., 1998) o piramidal (Elbal et al., 2004). Las células epiteliales presentan núcleos prominentes eucromatínicos característicos de la división celular (mitosis) 61 (Stroband & Debets, 1978), la cual es mayor en el intestino anterior reflejándose en la gran cantidad de pliegues formados (Stroband & Debets, 1978; Rombout et al., 1984). Además, una gran cantidad de mitocondrias de forma alargada y en algunos casos se observan rodeadas de estructuras lamelares las cuales parecen ser típicas de los intestinos de peces teleósteos (Calzada et al., 1998) y cuya función aun sigue siendo objeto de controversia. Se les ha atribuido un rol en el transporte de partículas lipo-proteicas desde los enterocitos hacia los espacios extracelulares (Deplano et al., 1991; OstosGarrido et al., 1993), pero también se ha señalado su función en el transporte de agua e iones (Yamamoto, 1966; Stroband, 1977; Calzada, 1996). La presencia de las estructuras lamelares asociadas a las mitocondrias quizá sea debido a la demanda de energía necesaria para los procesos de osmoregulación (Calzada et al., 1998). El borde apical del epitelio intestinal está constituido por microvellosidades responsables de la absorción de moléculas (Storch, 1996). Las glándulas accesorias también presentaron un cierto grado de diferenciación. Dentro del tejido pancreático se localizó un islote de Langerhans (páncreas endocrino), el cual está rodeado por células del páncreas exócrino como se ha observado en Scophthalmus rhombus (Hachero-Cruzado et al., 2009). Las células endocrinas muestran un núcleo irregular alargado y en el citoplasma algunos gránulos endocrinos. Las células del islote de Langerhans son de mayor tamaño y un gran núcleo redondeado y contienen a esta edad gránulos de zimógeno en diferentes estadios, como lo observado por Calzada (1996) en Sparus aurata. La presencia de gránulos de zimógeno y del conducto pancreático o canal de Wirsung observado en este estudio, según Beccaria et al., (1991) denotan la funcionalidad del páncreas. En Dicentrarchus labrax con estas características se ha detectado actividad tripsina (Zambonino-Infante & Cahu, 1994). El hígado presenta el desarrollo de sinusoides y canalículos biliares. Los hepatocitos muestran inclusiones de material de reserva como el glucógeno y presuntas lipo-proteínas como ha sido observado para otras especies (Mani-Ponset et al., 1994; Calzada, 1996). En Sparus aurata las partículas de glucógeno son observadas horas después de la eclosión, y momentos antes de la primera alimentación se ha observado una funcionalidad 62 del hígado en el metabolismo de los nutrientes (Guyot et al., 1995). Por lo anterior, es posible que en L. peru también a esta edad, las glándulas accesorias ya sean funcionales. 8.2.3 Primera alimentación exógena (70 – 93 hde) El inicio de la primera alimentación es un momento crucial en el desarrollo de las larvas. En el huachinango, el ojo se observó completamente pigmentado, la boca y ano estaban abiertos y se observó un par de aletas pectorales. Este conjunto indica funcionalidad en la localización, captura, ingestión y digestión de presas (Kvenseth et al., 1996; Porter & Theilacker, 1999: Roo et al., 1999; Yúfera & Daria, 2007). De hecho, Yufera & Darias (2007) se refieren a este momento como el momento cumbre en la sincronía entre el desarrollo morfológico y fisiológico. En la retina, se pudo observar la presencia de tres capas más: capa de fibras nerviosas, capa de células fotorreceptoras o conos y la capa de pigmento epitelial. La conexión existente entre la capa de fibras nerviosas con el tallo óptico y el desarrollo de los segmentos externos de los conos indican la funcionalidad de la retina, permitiendo la transmisión de impulsos nerviosos al sistema nervioso central (Kvenseth et al., 1996; Peña & Dumas, 2007). El pigmento epitelial (PE) se apreció en contacto de manera centrífuga al segmento externo de los conos en la región más externa de la retina. Un día después de la primera alimentación, el arreglo y fusión entre el PE y los conos se extendió a regiones más internas dentro de la retina, sugiriendo por una parte una mayor cantidad de pigmento en la retina y por otra, la capacidad de migrar del pigmento. Kvenseth y colaboradores (1996) reportan la migración del pigmento al momento de la primera alimentación. Neave (1984) reporta la migración del pigmento un poco después de la primera alimentación en Pleuronectes platessa y Scophthalmus maximus, mientras que Blaxter & Staines (1970) no encontraron evidencia de migración del pigmento antes de la metamorfosis en diversas especies de larvas. De acuerdo a Neave (1984), este tipo de discrepancias puede ser debido a la diferencia entre los niveles de intensidad y exposición a la luz, sugiriendo la posibilidad de que las larvas 63 jóvenes necesiten altas intensidades de luz para estimular la reacción retinomotora (Kvenseth et al., 1996). En la capa nuclear interna, se observó una sola capa de células horizontales en el periodo de estudio. Sin embargo, en Thunnus orientalis se observa que, dos días después de que el ojo llega a ser funcional, las células horizontales forman tres capas indicando una agudeza visual en dirección dorso-nasal de la larva (Kawamura et al., 2003). En esta etapa de desarrollo, la retina del huachinango está compuesta únicamente de células fotorreceptoras simples tal como sucede en otras especies de larvas pelágicas (Porter & Theilacker, 1999; Roo et al., 1999; Moorman, 2001; Kawamura et al., 2003; Peña & Dumas, 2007). La boca es funcional. La presencia de los cinco siguientes elementos (cuadrado, cartílago de Meckels, hiodeo, hiomandibular e interhial) aún constituidos de cartílago permiten inferir según Hunt von Herbing et al. (1996) que la boca era funcional. En Siganus guttatus, el aparato bucal también es cartilaginoso al momento de la apertura de la boca, sin embargo, 6 horas después se desarrolla la maxila superior y está osificada (Kohno, 1998). Hunt von Herbing (2001) encontró que la osificación de las estructuras bucales está relacionada con el tipo de simetría del organismo. Por ejemplo, en Gadus morhua; que presenta simetría en su periodo larval y juvenil como L. peru, la osificación se observa al final del estadio larval, mientras que en Pseudopleuronectes americanus la osificación se presenta hasta después de completar la metamorfosis y adquirir una forma asimétrica (Hunt von Herbing, 2001). El desarrollo de las estructuras que conforman el aparato bucal (número, tamaño y grado) determina el tipo de alimentación de las larvas. El movimiento mandibular está dado por dos articulaciones principales. La primera es entre el cartílago de Meckels y el cuadrado (unión mandibular) y la segunda entre el hiomandibular y el cráneo; estas dos articulaciones permiten el movimiento mandibular simple en dirección dorso-ventral (Hunt von Herbing, 2001) característico de la alimentación por succión. Ya presentes el cartílago de Meckel y el cuadrado se puede inferir que las larvas de huachinango se alimentan por succión (sucking), de manera similar a Lutjanus argentimaculatus, el cual cambia al tipo de alimentación por “grasping” (asimiento) a las 150 horas después de la apertura de la boca (Kohno, 1998), sin embargo como nuestro estudio no llegó mas allá de las 13 64 horas de la apertura de la boca, desconocemos el momento en que se da el cambio en el tipo de alimentación. El tracto digestivo era diferenciado como en Sparus aurata, permitiendo la digestión, absorción y asimilación del alimento (Calzada, 1996). La cavidad bucofaríngea está más expandida debido a la completa formación de los arcos branquiales, lo cual le permite una mayor capacidad de succión al momento de alimentarse (Hunt von Herbing et al., 1996). Está recubierta por un epitelio escamoso simple rodeado por tejido conectivo y una capa muscular circular como en diferentes especies (Peña et al., 2003; Santamaría et al., 2004; Hachero-Cruzado et al., 2009). A diferencia de otras especies como Dentex dentex (Santamaría et al., 2004) y Scophthalmus rhombus (Hachero-Cruzado et al., 2009), en Lutjanus peru no se observaron células caliciformes en la cavidad bucal pero si se observaron en el esófago al igual que lo reportado para otras especies (Ribeiro et al., 1999; Boulhic & Gabaudan, 1992; Bisbal & Bengtson, 1995; Baglole et al., 1997; Gordon & Hecht, 2002; Hachero-Cruzado et al., 2009). Peña et al., 2003 señalan que estas células secretan mucina que permite mantener húmedo el epitelio de recubrimiento del sistema digestivo. En Scophthalmus rhombus se ha reportado que estas células contienen principalmente mucosustancias neutras y glicoproteínas (Hachero-Cruzado et al., 2009). La aparición de un estómago rudimentario separado del intestino anterior mediante un esfínter pilórico primordial tal como se ha observado en L. peru al momento de la primera alimentación, ha sido reportado en otras especies cómo Sparus aurata (Calzada, 1996), Paralabrax maculatofasciatus (Peña et al., 2003), Dentex dentex (Santamaría et al., 2004), Scophthalmus rhombus (Hachero-Cruzado et al., 2009). Sin embargo, el estómago no es funcional hasta la aparición de las glándulas gástricas (Elbal et al., 2004). El intestino en esta etapa mostró mayor cantidad de pliegues en su mucosa incrementando la superficie de absorción. La ultraestructura de las células de la mucosa intestinal de Lutjanus peru al inicio de la primera alimentación exógena fue muy similar a las de otras especies de teleósteos (Avila & Juario, 1987; Deplano et al., 1991; Calzada et al., 1998; Elbal et al., 2004). Algunos autores han observado que poco antes de recibir la primera alimentación los enterocitos son células 65 diferenciadas, e incluso son similares a los enterocitos de los adultos, excepto por la presencia de un mayor número de estructuras lamelares asociadas las mitocondrias (Calzada, 1996; Elbal et al., 2004). 8.3 Eficiencia en la alimentación exógena Gran parte del éxito en la larvicultura se basa en proporcionar las condiciones de cultivo adecuadas que mejoren la eficiencia en la alimentación y el crecimiento de las larvas desde que inician con la alimentación exógena, reduciendo el riesgo de inanición, lo cual puede impactar en el posterior crecimiento y supervivencia (Peña & Dumas, 2005, Zhang et al., 2009; Wang et al., 2010). En comparación con los resultados obtenidos en otras especies en la primera alimentación, la incidencia alimenticia (menos del 40%) e intensidad alimenticia (aprox. 1.1 presas por las larvas) observados en L. peru fueron bajas. Una alta eficiencia alimenticia durante la primera alimentación aumenta las posibilidades de supervivencia y la tasa de crecimiento, y reduce el riesgo de inanición (Ashton & Rust, 2003). Estos mismos autores reportaron que una incidencia alimenticia superior al 50% puede ser considerado como un indicador apropiado de una buena tasa de supervivencia en etapas posteriores. Algunos factores tuvieron un impacto más significativo que otros en el éxito de alimentación de L. peru. Los rotíferos y copépodos se han utilizado como un alimento exitoso al momento de la primera alimentación en la larvicultura de peces marinos (Wilcox et al., 2006). En nuestro estudio, los rotíferos no fueron consumidos bajo ninguna de las condiciones experimentales. Algunos estudios han demostrado la relevancia de proporcionar un tipo de presa con el tamaño adecuado en la transición de la alimentación endógena a la alimentación exógena (Hunter, 1981). Este mismo autor sugiere que el tamaño de la presa ingerida durante los primeros días de desarrollo está determinado principalmente por el ancho de la boca de las larvas; aunque también diferencias en los movimientos de natación entre los nauplios de copépodos y rotíferos afectan la respuesta de la alimentación de las larvas (Buskey et al., 1993). Sin embargo, la diferencia en el tamaño de las presas utilizadas en este estudio (B. rotundiformis y nauplios de E. acutifrons) pudo haber sido el factor 66 más importante en la eficiencia alimenticia. Por otra parte el hecho de que los nauplios de copépodos I-III hayan sido ingeridos más intensamente que los nauplios IV-VI demostró que las larvas de L. peru prefieren presa más pequeña. La intensidad de la luz también tuvo un efecto sobre el número de larvas que se alimentaron. Un número significativamente mayor de larvas alimentadas se registró en tratamientos de 3000 lux respecto a 2500 y 2000 lux. Puvanendran & Brown (1998) sugieren que el aumento en la iluminación permite un mayor contraste entre las paredes del tanque y la presa. Los fotoreceptores de la retina en las larvas al momento de la primera alimentación son conos sencillos, lo que les proporciona una limitada agudeza visual y menor sensibilidad a diversas longitudes de onda, reduciendo el contraste con la presa (Evans & Browman, 2004). La densidad de presa también influyó en la incidencia alimenticia. Laurel et al (2001) mencionan que la densidad determina la disponibilidad y la distribución de la presa, que a su vez afecta la eficiencia alimenticia en las larvas. En este estudio se encontró una mayor incidencia alimenticia en altas densidades de presa. Una alta densidad de presa reduce el tiempo de búsqueda de la presa y la distancia de reacción para las larvas, lo que aumenta la tasa de encuentro depredador-presa y disminuye el tiempo de manejo de presas (Hart, 1997). Sin embargo, cuando la intensidad de luz se incrementó a 3000 lux, la incidencia fue igual entre el tratamiento con 10 nauplios y el tratamiento con 5 nauplios: 5 rotíferos, sugiriendo que con altas intensidades de luz se puede utilizar una menor densidad de nauplios. No obstante, no se puede descartar un posible efecto de la presencia de rotíferos en el acuario. La eficiencia alimenticia no se vio afectada por los otros factores evaluados en este estudio. Por ejemplo, el color del tanque, la salinidad, y la adición de microalgas no tuvieron efectos significativos. Rocha et al. (2008) no encontraron ninguna diferencia en la incidencia alimenticia en la primera alimentación de Sparus aurata y Solea senegalensis, empleando agua verde. De igual manera, se ha reportado que en Gadus morhua no hay cambio en el comportamiento de alimentación de las larvas entre el agua clara y agua verde 67 en la primera alimentación (Skiftesvik et al., 2003). Numerosos reportes han demostrado que el uso de microalgas mejora la respuesta visual de las larvas al momento de la alimentación, el tiempo de inicio de la primera alimentación, la proporción de larvas que ingieren alimento y la cantidad de alimento que ingieren (Naas et al., 1992; Lazo et al., 2000; Shaw et al., 2006). Sin embargo, como han observado Shaw et al (2006), el agua verde mejora el número de presas consumidas cuando la densidad de la presa es baja, lo que tal vez explica que el uso de altas densidad de presas en este estudio no permitió esa observación. El número de larvas con presas en el tracto digestivo se vio más afectada por las condiciones de cultivo que el número de presas ingeridas por las larvas, lo que sugiere que la intensidad alimenticia no es afectada por los factores bióticos y abióticos probados. Se ha reportado que la cantidad de presas ingeridas por larva está regulado por varios factores como la temperatura (Blaxter, 1986), la densidad y el tamaño de presa (Hunter, 1981), el desarrollo de la conducta alimentaria (Coughlin, 1991), la saciedad (Yúfera & Darias, 2007) y mecanismos hormonales (Ronnestad et al., 2007). En el presente estudio, se evaluó la eficiencia de la alimentación en cuando se pudo detectar la presencia de alimento en el tracto digestivo, o sea, seis horas después de la adición de la presa. En el inicio de la alimentación exógena, el proceso de aprendizaje del comportamiento alimenticio puede tardar varias horas o días para lograr una captura de presas más eficiente (Yúfera & Darias, 2007). De haber esperado más tiempo hubiera permitido observar una incidencia e intensidad mayores. Sin embargo, existe el riesgo de que el alimento sea digerido y difícilmente evaluado. 68 IX. SUMARIO Y CONCLUSIONES 9.1 Eclosión Al momento que las larvas de Lutjanus peru eclosionan presentan un gran saco vitelino y glóbulo de aceite que constituyen las reservas nutritivas. La presencia de una musculatura troncal y de una aleta media (pliegue) permite que realicen movimientos de cierta amplitud, aunque no como para evadir depredadores. En este momento, todavía hay órganos y/o estructuras que no han comenzado su morfogénesis, como el ojo, hígado, páncreas, aparato bucal. El tubo digestivo es un tubo recto simple e indiferenciado, recubierto por un epitelio cuboidal simple y con pequeñas microvellosidades en el borde apical, considerándose no funcional. Las vías sensoriales desarrolladas y funcionales son la mecánica, constituida de neuromastos libres dispersos en la cabeza y tronco, y la auditiva que está compuesta por los otolitos Lapillus y Sagitta, lo que les permite percibir algunas vibraciones en el ambiente. 9.2 Periodo de alimentación endógena Durante este periodo se constituyen la mayor parte de los sistemas orgánicos de Lutjanus peru. La retina se diferencia en cinco capas. Presenta células fotorreceptoras de tipo cono en desarrollo, e inicia la diferenciación de la capa de pigmento epitelial. Aunque a esta edad aparentemente no es funcional. Inicia el desarrollo de las estructuras bucales esqueléticas de soporte (Cartílago de Meckels, Cuadrado, Hioideo, Hiomandibular). El tubo digestivo presenta una regionalización compuesta por la cavidad buco-faríngea, esófago e intestinos anterior y posterior. Ambos intestinos presentan un epitelio columnar, pliegues en la mucosa y microvellosidades en la zona apical. Al final de este periodo, los enterocitos presentan características ultraestructurales de células diferenciadas. Las glándulas accesorias ya se han diferenciado. El páncreas esta conectado al intestino anterior mediante el conducto de Wirsung. Se diferencia el islote de Langerhans que se encuentra rodeado por células pancreáticas exocrinas que sintetizan gránulos de zimógeno denotando funcionalidad. En el hígado se observan algunos sinusoides y canículos 69 biliares. Los hepatocitos presentan en posición supranuclear inclusiones aparentemente de reserva como glucógeno y lipoproteínas. Todas estas características son indicadoras de que las larvas son aptas; en términos de digestión, para iniciar la alimentación exógena. 9.3 Primera alimentación La primera alimentación exógena es un momento clave en el periodo larval de los peces por la sincronía que se puede observar entre los órganos y/o estructuras involucradas en la localización, captura, ingestión y digestión de las presas. La retina está formada por completo y funcional. Lo mismo que el aparato bucal y tracto digestivo. Los órganos sensoriales están presentes, excepto las papilas gustativas. No obstante, se ha demostrado en este y anteriores trabajos que la visión es la principal vía sensorial para la localización de presas debido a que las larvas de Lutjanus peru no se alimentan en ausencia de luz y son poco eficientes al momento de alimentarse a bajas intensidades de luz. El ojo está diferenciado y es funcional. Presenta conos sencillos como únicas células fotorreceptoras. Por tanto, se ha observado que su agudeza visual y sensibilidad a las longitudes de onda es limitada por lo que necesita iniciar su alimentación en ambientes bien iluminados. El aparato bucal está constituido por 5 elementos cartilaginosos: cartílago de Meckels, cuadrado, hioideo, hiomandibular e interhial. La funcionalidad es adquirida por las articulaciones entre el cartílago de Meckels y el hioideo, y el hiomandibular y el cráneo. La apertura bucal es de 0.22 ± 0.02 mm y como se ha comprobado en este trabajo, son capaces de capturar presas de tallas iguales o menores a 45-50% de su ancho de boca. En relación al desarrollo del tubo digestivo, se observa que el esófago presenta células caliciformes con vesículas de secreción. Así también, se observa la formación de un estómago rudimentario. El intestino es mayormente plegado con una gran cantidad de microvellosidades en el borde apical de su epitelio. Se ha formado la válvula intestinal, por lo que ya se puede regular el flujo del alimento para una mejor digestión. Finalmente, el número de larvas que consumen alimento es afectado por la intensidad de luz, tipo de presa, la talla y concentración de presa, y la 70 temperatura. Parece también que a intensidad alta como 3000 lux, menos nauplios de copépodos pueden ser usados. 71 X. RECOMENDACIONES Debido a la experiencia generada a través de la realización de este trabajo se dan las siguientes recomendaciones técnicas: 1) Cuando se vaya a realizar microscopia electrónica de transmisión para observar el tubo digestivo, se recomienda seccionar a las larvas bajo una lupa estereoscópica previo a la fijación para seleccionar solamente la porción que incluye la estructura a observar, de tal manera que al momento de realizar los cortes semifinos sea más fácil reconocer la región observada. 2) Dado que la mayor incidencia alimenticia se presentó con nauplios de copépodos en estadio I-III, una intensidad de luz de 3000 lux y temperatura del agua de 25º C, se recomienda el uso de estas condiciones en el cultivo larval del huachinango. Así también, se presentan algunas recomendaciones y propuestas de investigación: 3) De manera general, la eficiencia alimenticia ha sido bajas. Además de lo que ya se ha comentado al respecto, probablemente se deba a que los experimentos se hayan realizado en acuarios. En ese sentido, se recomienda evaluar los factores ambientales que hayan resultado más favorables en este estudio en tanques de mayor capacidad, y probar presas de tamaño más pequeño como pueden ser las larvas trocóforas y el rotífero Proales similis. 4) Evaluar el crecimiento y supervivencia empleando las condiciones ambientales que han resultado más favorables en estos experimentos en una escala mayor. 5) Describir la organogénesis de las estructuras aquí abordadas durante todo el periodo larval. 72 XI. LITERATURA CITADA Abol-Munafi, A.B., P.T. Liem, M.V. Van & M.A. Ambak. 2006. Histological ontogeny of the digestive system of marble goby (Oxyeleotris marmoratus) larvae. J. Sustain. Sci Mngt., 1 (2): 79-86 Appelbaum, S. J.W. Adron, S.G. George, A.M. Mackie & B.J.S. Pirie. 1983. On the development of the olfactory and gustatory organs of the Dover sole, Solea solea, during metamorphosis. J.Mar. Biol. Ass. U. K., 63: 97-108. Alves Jr. T.T., R.V. Cerqueira, & J.A. Brown. 2006. Early weaning of fat snook (Centropomus parallelus Poey 1864) larvae. Aquaculture., 253: 334-342. Ashton, N. & M.B. Rust. 2003. Effect of light intensity on feeding incidence and survival of preflexion larval black rockfish (Sebastes melanops). 27th Larval Fish Conference, August 20–23, Santa Cruz, California (book of abstracts). Ávila, E.M. & J.V. Juario. 1987. Yolk and oil globule utilization and developmental morphology of the digestive tract epithelium in larval rabbitfish, Siganus guttatus (Bloch). Aquaculture, 65: 319-331. Avilés-Quevedo, A., L. Reyes, O. Hirales, R. Rodríguez, & U. McGregor. 1996. Resultados preliminares en el cultivo de huachinango del Pacífico Lutjanus peru (Nichols and Murphy, 1922) en jaulas flotantes en bahía Falsa, BCS, México. 248-250, En: A. Silva & G. Merino (Eds.). Acuicultura en Latinoamerica. IX Congreso latinoamericano de acuicultura. 2° Simposio avances y perspectivas de la acuicultura en Chile. Coquimbo, Chile. Baglole, C.J., H.M. Murray, C.P. Goff & G.M. Write. 1997. Ontogeny of the digestive tract during larval development of yellowtail flounder: a light microscopic and mucous histochemical study. J. Fish Biol., 51: 120–134. Balon, E.K. 1975. Terminology of intervals in fish development. J. Fish. Res. Bd. Can., 32: 1663-1670. Balon, E.K. 1984. Reflections on some decisive events in the early life of fishes. Trans. Am. Fish. Soc., 113: 178-185. 73 Balinsky, B. I. 1978. Introducción a la embriología. Omega. Barcelona, España. 644p. Beccaria, C., J.P. Díaz, R. Connes & B. Chatain. 1991. Organogenesis of the exocrine pancreas in the sea bass, Dicentrarchus labrax L., reared extensively and intensively. Aquaculture, 99: 339-354. Bennett, M.V.L. 1971. Electric organs. 347-491p. En: Hoar, W.S. & D. J. Randall. (Eds). Fish Physiology. Academic Press, London. Bermudes, M. & A.J. Ritar. 1999. Effects of temperature on the embryonic development on the striped trumpeter (Latris lineata Bloch y Schneider, 1801). Aquaculture, 176: 245-225. Blaxter, J.H.S. 1969. Development: eggs and larvae. 177-252p. En: Hoar, W.S & D.J.Randall (Eds). Fish Physiology Vol. 3. Academy Press, New York. Blaxter, J.H.S. & M. Straines. 1970. Pure-cono retine and retinomotor response in larval teleost. J. Mar. Biol. Assoc. U. K., 50: 449-460. Blaxter J.H.S. 1986. Development of sense organs and behaviour of teleost larvae with special reference to feeding and predator avoidance. Trans. Amer. Fish. Soc., 115: 98-114. Blaxter, J.H.S. 1992. The effects of temperature on larval fishes. Neth. J. Zool., 42 (2-3): 336-357. Bisbal, G.A. & D.A. Bengtson. 1995. Development of digestive tract in larval summer flounder. J. Fish Biol., 47: 277–291. Boulhic, M. & J. Gabaudan. 1992. Histological study of the organogenesis of the digestive system and swim bladder of the Dover sole, Solea solea (Linnaeus 1758). Aquaculture, 102: 373–396. Breitburg, D.L. 1988. Effects of turbidity on prey consumption by striped bass larvae. Trans. Am. Fish. Soc., 117: 72–77. Buskey, E.J., C. Coulter & S. Strom. 1993. Locomotory patterns of microzooplankton: potential effects on food selectivity of larval fish. Bull. 74 Mar. Sci., 53: 29-43. Calzada, B.A. 1996. Desarrollo postembrionario del intestino y órganos asociados de la dorada, Sparus aurata L., en cultivo. Estudio histológico y ultraestructural. Tesis doctoral. Universidad de Cadiz. 258 p. Calzada, A., A. Medina & M.L. González de Canales. 1997. Fine structure of the intestine development in cultured sea bream larvae. J. Fish Biol., 53: 340–365. Chen, B.N., J.G. Qin, M.S. Kumar, W.G. Hutchinson & S.M. Clarke. 2006. Ontogenetic development of the digestive system in yellowtail kingfish Seriola lalandi larvae. Aquaculture, 256: 489–501. Cobcroft, J.M., P.M. Pankhurst, P.R. Hart & S.C. Battaglene. 2001. The effects of light intensity and algae induced turbidity on feeding behaviour of larval striped trumpeter. J. Fish Biol., 59: 1181-1197. Cook M.A. & M.B. Rust. 2002. The effect of light intensity on development and hatching success of lingcod, Ophiodon elongates (Girard) eggs. Aquacult. Res., 33: 217-222. Coughlin, D.J.1991. Ontogeny of feeding behavior of first-feeding Atlantic salmon (Salmo Salar). Can. J. Fish. Aqua. Sci., 48: 1896-1904. Deplano M., J.P. Diaz, R. Connes, M. Kentouri-Divanach & F. Cavalier. 1991. Appearance of lipid-absorption capacities in larvae of the sea bass Dicentrarchus labrax during transition to the exotrophic phase. Mar. Biol., 108: 361-371. Diaz, J.P., M. Prie-Granie, M. Kentouri, S. Varsamos & R. Connnes. 2003. Development of the lateral line system in the sea bass. J. Fish Biol., 62: 24-40. Downing, G. & M.K. Litvak. 1999. The influence of light intensity on growth of larval haddock. North. Am. J. Aquacult., 61: 135-140. Dumas, S., M.O. Rosales-Velásquez, M. Contreras-Olguín, D.E. HernándezCeballos & N. Silverberg. 2004. Gonadal maturation in captivity and 75 hormone-induced spawning of the Pacific red snapper Lutjanus peru. Aquaculture, 234: 614-623. Duncan, N., Z. Ibarra-Zatarain, I. Adbo-de la Parra, G. Velasco, A. GarcíaOrtega, R. Peña, P. Pintos, H. Skyol, M. Rosales, D. Hernández, & S. Dumas. 2002. Larval culture of the Pacific red snapper (Lutjanus peru) a preliminary study. VI Simposium Internacional De Nutrición Acuícola, 3-6 septiembre. Cancún, México. Duray, M.N., C.B. Estudillo, & L.G. Alpasan. 1996. The effect of background color and rotifer density on rotifer intake. Growth and survival of the grouper (Epinephelus suillus) larvae. Aquaculture, 146: 217-224 Eckert, R., D. Randall & G. Augustine. 1990. Fisiología Animal. Mecanismos y Adaptaciones. Interamericana-McGraw-Hill. Madrid. 683 pp. Elbal, M.T., M.P. García-Hernández, M.T. Lozano & B. Agulleiro. 2004. Development of the digestive tract of gilthead sea bream (Sparus aurata L.). Light and electron microscopic studies. Aquaculture, 234: 215-238. Evans, B.I. & Browman, I. H. 2004. Variation in the development of the fish retina. 145-166, En: Govoni, J. (Ed.). American Fisheries Society Simposio. Vol. 40. Bethesda, Maryland. Falk-Petersen, I.B. 2005. Comparative organ differentiation during early life stages of marine fish. Fish Shell. Immunol., 19: 397-412. Fernández-Díaz, C., E. Pascual, & M. Yúfera. 1994. Feeding behaviour and prey size selection of gilthead seabream, Sparus aurata, larvae fed on inert and live food. Mar. Biol., 118: 323-328. Fielder, D.S., W.J. Bardsley, D.L. Allan & P.M. Pankhurst. 2005. The effects of salinity and temperature on growth and survival of Australian snapper, Pagrus auratus larvae. Aquaculture, 250: 201–214. Fuiman, L.A. & R.S Batty. 1997. What a drag it is getting cold: partitioning the physical and physiological effects of temperature on fish swimming. J. Exp. Biol., 200: 1745–1755. 76 Gisbert, E., R.H. Piedrahita & D.E. Conklin. 2004. Ontogenetic development of digestive system in California halibut (Paralichthys californicus) with notes on feeding practices. Aquaculture, 232: 455-470. Gordon, A.K. & T. Hecht. 2002. Histological studies on the development of the digestive system of the clownfish Amphiprion percula and the time of weaning. J. Appl. Ichthyol., 18: 113-117. Govoni J. J., G. W. Boehlert & Y. Watanabe. 1986. The physiology of digestion in fish larvae. Environ. Biol. Fishes, 16: 59-77. Green B.S. & R. Fisher. 2004. Temperature influences swimming speed, growth and larval duration in coral reef fish larvae. J. Exp. Mar. Biol. Ecol., 299: 115-132. Gulbrandsen, J. 1991. Functional response of Atlantic Halibut larvae related to prey density and distribution. Aquaculture, 94: 89-98. Gulbrandsen, J., I. Lein & I. Holmefjord. 1996. Effects of light administration and algae on first feeding of Atlantic halibut larvae, Hippoglossus hippoglossus (L.). Aquacult. Res., 27: 101–106. Gutherie, D.M. 1986. Role of vision in fish behaviour. 75-113p. En: Pitcher, T. J. (Ed.), Behaviour of Teleost Fishes, 2nd edition. Croom Helm, London. Guyot, E., J.P.Diaz & R. Connes. 1995. Organogenesis of the livier in sea bream. J. Fish Biol., 47: 427-437. Hachero-Cruzado, I., J.B. Ortiz-Delgado, B. Borrega, M. Herrera, J.I. Navas & C. Sarasquete. 2009. Larval organogenesis of flatfish brill Scophthalmus rhombus L: Histological and histochemical aspects. Aquaculture, 286: 138-149. Hamlin, H.J., I. Hunt von Herbing & L.J. Kling. 2000. Histological and morphological evaluations of the digestive tract and associated organs of haddock throughout post-hatching ontogeny. J. Fish Biol., 57: 716–732. Hardy, R.S. & M.K. Litvak. 2004. Effects of temperature on the early development, growth and survival of shortnose sturgeon, Acipenser 77 brevirostrum, and Atlantic sturgeon, Acipenser oxyrhynchus, yolk-sac larvae. Environ. Biol. Fish., 70: 145–154. Hart, P.J. 1997. Foraging tactics. 104-133, En: Godin, J.G. (Ed.), Behavioural ecology of teleost fishes. Oxford University Press, Oxford. Helps, S.K. 1982. An examination of prey size selection and its subsequent effect on survival and growth of larval gilthead sea bream (Sparus aurata). Master Thesis. Plymouth Polytechnic. UK. 50p. Heming, T.A., & R.K. Buddington. 1988. Yolk absorption in embryonic and larval fishes. 407-446, En: Hoar, W.S. & D.J. Randall (Eds.). Fish Physiology, vol. XI A. Academic Press Inc., London. Hochachka, P.W. & G.N. Somero. 2001. Biochemical Adaptation. Oxford: Oxford University Press. Hunt Von Herbing, I. 2001. Development of feeding structures in larval fish with different life histories: winter flounder and Atlantic cod. J. Fish Biol., 59: 767-782. Hunt von Herbing, I., 2002. Effects of temperature on larval fish swimming performance: the importance of physics to physiology. J. Fish Biol., 61: 865– 876. Hunt von Herbing, I. & K. Keating. 2003. Temperature-induced changes in viscosity and its effects on swimming speed in larval haddock. 23-34, En: Browman, H.I. & A.B. Skiftesvik (Eds.). The big fish bang. Institute of Marine Research, Bergen, Norway. Hunt von Herbing, I., T. Miyake, B.K. Hall & R.G. Boutilier. 1996. Ontogeny of feeding and respiration in larval Atlantic cod Gadus morhua (Teleostei, Gadiformes): II. Function. J. Morph., 227: 37–50. Houde, E.D. & R.C. Schekter. 1981. Growth rates, ratios and cohort consumption of marine fish larvae in relation of prey concentration. Rapp. P.v. Reun. Cons. Int. Explor. Mer., 178: 441-453. 78 Howell, B.R. 1979. Experiments on the rearing of larval turbot, Scophthalmus maximus L. Aquaculture, 18: 215–225. Hunter, J. R. 1976. Culture and growth of northern anchovy, Engraulis mordax, larvae. Fish. Bull. Fish Wildl. Serv. U.S., 74:81-88. Hunter, J.R. 1980. The feeding behaviour and ecology of marine fish larvae. En: Bardach, J.E., J.J. Magnuson, R.C. May, & J.M. Reinhart (Eds.). Fish behaviour and its use in the capture and culture of fishes. ICLARM Conference Proceedings 5, International Center for Living Aquatic Resources Management. Manila, Philippines. 512p. Hunter, J.R. 1981. Feeding ecology and predation of marine fish larvae. 34-77, En: Lasker, R. (Ed.). Marine Fish Larvae. Morphology, ecology and relation to fisheries. University of Washington Press, Seattle. Huse, I. 1994. Feeding at different illumination levels in larvae of three marine teleostos species: cod Gadus morhua L., plaice Pleuronectes platessa L., and turbot Scophthalmus maximus L. Aquacult. Fish. Manag., 25: 687-695. Ina, K., Y. Ryogi, & K. Higashi. 1979. Color sensitivity of red sea bream, Pagrus major. Bull. Jpn. Soc. Sci. Fish., 45 (1): 1-5. Ishida, K. & G. Kawamura. 1985. Development of sense organs. Aquabiology, 36: 8–14. Jobling, M. 1998. Feeding and nutrition in intensive fish farming. 77-113, En: Black, K. D. & A. D. Pickering (Eds). Biology of farmed fish. Sheffield: Sheffield Academic Press. Kamler, E. 1992. Early life history of fish: An energetics approach. Chapman & Hall, London, 267 pp. Kamler, E. 2002. Ontogeny of yolk-feeding fish: an ecological perspective. Rev. Fish Biol. Fish., 12: 79-103. Kamler, E., H. Keckeis & E. Bauer-Nemeschkal. 1998. Temperature-induced changes of survival, development and yolk partitioning in Chondrostoma nasus. J. Fish Biol., 53: 658-682. 79 Kawamura, G. 1991. Sensory organs. 9-20, En: Tanaka, M. (Ed.). Early Development in Fishes. Koseisha Koseikaku, Tokyo. Kawamura, G. & K. Ishida. 1985. Changes in sense organ morphology and behaviour with growth in the flounder Paralichthys olivaceus. Bull. Japan. Soc. Sci. Fish., 51(2): 155-165. Kawamura, G. & N. Washiyama. 1989. Ontogenetic changes in behavior and sense organ morphogenesis in largemouth bass and Tilapia nilotica. Trans. Amer. Fish. Soc., 118: 203–213. Kawamura G., Y. Mukai & H. Ohta. 1984. Change in the visual threshold with development of rods in ayu Plecoglossus altivelis. Nippon Suisan Gakkaishi, 50: 2133. Kawamura, G., S. Masuma, N. Tezuka, M. Koiso, T. Jimbo & K. Namba. 2003. Morphogenesis of sense organs in the bluefin tuna Thunnus orientalis. 123-135, En: Browman, H. I. & A. B. Skiftesvik. (Eds.). The Big Fish Bang. Institute of Marine Research, Bergen, Norway. Kendall, A.W., E.H. Ahlstrom & H.G. Moser. 1984. Early life history stripes of fishes and their characters. 11-24, En: Moser, H.D., W.J. Richards, D.M. Cohen, M.P. Fahay, A.W. Kendall Jr. & S.L. Richardson (Eds.). Ontogeny and systematics of fish. Am. Soc. Ichthyol. Herpetol. Special. Pub., Vol. 1. Kentouri, M., P. Divanach, & J. Paris. 1984. Approche du comportement trophique des larves du sar (Diplodus sargus), de la daurade (Sparus auratus), du charax (Puntazzo puntazzo) et du marbré (Lithognathus mormyrus). 139-159. En: Bernabé, G. & R. Billard. (Eds.). L’Aquaculture du Bar et des Sparidés. INRA, Paris. Khemis, I. B., C. Audet, R. Fournier, & J. De la Noue. 2003. Early weaning of winter flouder (Pseudopleuronectes americanus Walbaum) larvae on a commercial microencapsulated diet. Aquacult. Res., 34: 445-452. 80 Kohno, H. 1998. Early life history features influencing larval survival of cultivated tropical finfish. 74-109, En: De Silva, S. (Ed.). Tropical Mariculture. Academic Press Inc. London. Krieger, J. & R. Fleig. 1999. Yolk mobilization in perch, Perca fluviatilis L., embryos. Fish Physiol. Biochem., 21: 157-165. Kvenseth, A. M., K. Pittman & J.V. Helvik. 1996. Eye development in the Atlantic halibut (Hippoglossus hippoglossus): differentiation and development of the retina from early yolk-sac stages through metamorphosis. Can. J. Fish. Aqua. Sci., 53: 2524-2532. Laurel, B.J., J.A. Brown & R. Anderson. 2001. Behaviour, growth and survival of redfish larvae in relation to prey availability. J. Fish Biol., 59: 884-901. Lazo, J.P., M.T. Dinis, G.J. Holt, C. Faulk & C.R. Arnold. 2000. Co-feeding microparticulate diets with algae: towards eliminating the need of zooplankton at first feeding in larval red drum (Sciaenops ocellatus). Aquaculture, 188: 339-351. Leeson, T. S., C. R. Leeson & A. A. Paparo. 1990. Texo-Atlas de histología. Interamericana-McGraw Hill. México. 741 pp. Leu, M.J., I.H. Chen & L.S. Fang. 2003. Natural spawning and rearing of mangrove red snapper, Lutjanus argentimaculatus, larvae in captivity. Israeli J. Aquacult. – Bamidgeh, 55(1): 22-30. Liem, K. F. 1991. A functional approach to the development of the head of teleosts: Implications on the constructional morphology and constraints. 231-249, En: Schmidt-Kittler, N. & K. Vogel (Eds.). Constructional Morphology and Evolution. Springer-Verlag. Berlin. Liem, K. F. 1997. Developmental analysis of a functional complex that defines Amia and the Teleostei. S. Afr. J. Sci., 93: 523–528. Mani-Ponset L., J.P. Diaz, O. Schlumberger & R. Connes. 1994. Development of yolk complexe, livier and anterior intestine in pike-perch larvae, 81 Stizostedion lucioperca (Percidae), according to the first diet during rearing. Aquat. Living Resour., 7: 191-200. Mani-Ponset L., E.Guyot, J.P. Diaz & R. Connes. 1996. Utilization of yolk reserves during post-embryonic development in three teleostean species: the sea bream Sparus aurata, the sea bass Dicentrarchus labrax, and the pike-perch Stizostedion lucioperca. Mar. Biol., 126: 539547. Matsuoka, M. 2001. Development of sense organs in the Japanese sardine Sardinops melanostictus. Fish. Sci., 67: 1036-1045. Miner, J.G. & R.A. Stein. 1993. Interactive influence of turbidity and light on larval bluegill (Lepomis macrochirus) foraging. Can. J. Fish. Aquatic Sci., 50: 781–788. Moorman, S. J. 2001. Development of sensory systems in zebrafish (Danio rerio). ILAR Journal, 42(4): 292-298. Morrison, M. 1993. Histology of the Atlantic cod, Gadus morhua: an atlas. Part 4. Eleutheroembryo and larva. Canadian Special Publication of Fisheries and Aquatic Sciences No. 119, 496pp. Morehead, D.T., P.R. Hart, G.A. Dunstan, M. Brown & N.Y. Pankhurst. 2001. Differences in egg quality between wild striped trumpeter (Latris lineata) and captive striped trumpeter that were fed different diets. Aquaculture, 192: 39-52. Morehead, D.T., & P. Hart. 2003. Effect of temperature on hatching success and size of striped trumpeter (Latris lineata) larvae. Aquaculture, 220: 595-606. Mukai, Y. 2006. Role of free neuromastos in larval feeding of willow shiner Gnathopogon elongatus caerulescens Teleosti, Cyprinidae. Fish. Sci., 72: 705-709. Naas, K.E., T. Næss & T. Harboe. 1992. Enhanced first feeding of halibut larvae (Hippoglossus hippoglossus L.) in green water. Aquaculture, 105: 14382 156. Naas, K., I. Huse, & J. Iglesias. 1996 Illumination in first feeding tanks for marine fish larvae. Aquacult. Eng., 15: 291-300. Neave, D.A. 1984. The development of visual acuity in larval plaice (Pleuronectes platessa L.) and turbot (Scophthalmus maximus L.). J. Exp. Mar. Biol. Ecol., 78: 167–175. O`Connell, C.P. 1981. Development of organ systems in the northern anchovy Engraulis mordax, and other Teleosts. Amer. Zool., 21: 429-446. Osse, J.W. & Akster. 1996. Growth related changes in feeding, respiration and muscle differentiation of fish larvae. En: Verreth, J. (Ed.). Sixth international course of fish larvae nutrition (ERASMUS). Ostaszewska, T. 2005. Developmental changes of digestive system structures in pike-perch (Sander lucioperca L). Electronic. J. Ichthyol., 2: 65-78. Ostos-Garrido, M.V., M.V. Núñez-Torres & M.A. Abaurrea-Equisoain. 1993. Lipid absorption by enterocytes on the rainbow trout Oncorhynchus mykiss: diet-induced changes in the endomembranous system. Aquaculture, 110:161-171. Ostrowski, A.C. 1989. Effect of rearing tank background colour on early survival of dolphin larvae. The Progressive Fish-Culturist, 51: 161–163. Otten, E. 1982. The development of the mouth-opening mechanism in a generalized Haplochromis species: H. elegans Trewavas, 1933 (Pisces, Cichlidae). Neth. J. Zool., 32: 31–48. Paul, A. J. 1983. Light, temperature, nauplii concentrations, and prey capture by first feeding pollock larvae Theragra chalcogramma. Mar. Ecol. Prog. Ser., 13: 175-179. Pascual, E. & M. Yúfera. 1987. Alimentación durante el cultivo larvario de peces marinos. 251-293. En: Espinosa de los Monteros, J. & U. Labarta (Eds). Alimentación en acuicultura. CAICYT, Madrid. 83 Pelcastre-Campos, V. 2006. Inducción a la ovulación y espermiogénesis en el huachinango del Pacífico Lutjanus peru (Nichols and Murphy 1922) y almacenamiento de su semen. Tesis de maestría. CICIMAR-IPN. México. 96p. Peña, R., S. Dumas, M. Villalejo-Fuerte & J.L. Ortiz-Galindo. 2003. Ontogenetic development of the digestive tract in reared spotted sand bass Paralabrax maculatofasciatus larvae. Aquaculture, 219: 633-644. Peña R., S. Dumas, R. Saldivar-Lucio, G. García, A. Trasviña, & D.E. Hernández-Ceballos. 2004. The effects of light intensity on first feeding of the spotted sand bass Paralabrax maculatofasciatus Steindachner larvae. Aquacult. Res., 35: 345-349. Peña, R. 2005. Estudios de la función digestiva en la cabrilla arenera Paralabrax maculatofasciatus: Aspectos alimenticios y sus aplicaciones. Tesis de doctorado. CICIMAR-IPN. 141p. Peña, R., S. Dumas, A. Trasviña, G. García, H. Pliego-Cortéz. 2005. The effects of rearing tank color and prey density on first feeding of the spotted sand bass Paralabrax maculatofasciatus. Aquacult. Res., 36, 1239-1242. Peña, R. & S. Dumas. 2007. Desarrollo de la retina en larvas de la cabrilla arenera Paralabrax maculatofasciatus (Percoidei: Serranidae) bajo condiciones de cultivo. Ciencias Marinas, 33: 293-300. Pittman, K., A. Berit, & T. Harboe. 1989. Effect of temperature on growth rates and organogenesis in the larvae of halibut (Hippoglossus hippoglossus L.). Rapp. P.v. Réun. Cons. Int. Explor. Mer., 191: 421-430. Planas, M. & I. Cunha. 1999. Larvae culture of marine fish: problems and perspectives. Aquaculture, 177: 171-190. Polo, A., M. Yúfera, & E. Pascual. 1991. Effects of temperature on eggs and larval development of Sparus aurata L. Aquaculture, 92: 367-375. 84 Polo, A., M. Yúfera, & E. Pascual. 1992. Feeding and growth of gilthead seabream (Sparus aurata L) larvae in relation to size of the rotifer strain used as food. Aquaculture, 79: 157-161. Porter, S.M. & G.H. Theilacker. 1999. The development of the digestive tract and eye in larval walleye Pollock, Theragra chalcogramma. Fish. Bull., 97: 722-729. Potthoff, T. 1984. Clearing and staining techniques. 35-37, En: Moser, H.D., W.J. Richards, D.M. Cohen, M.E. Fahay, A.W. Kendall Jr. & S.L. Richardson (Eds.). Ontogeny and systematics of fishes. Am. Soc. Ichthyol. Herpetol. Special. Pub., Vol. 1. Powers, M.K. & P.A. Raymond. 1990. Development of the visual system. 419442, En: Douglas, R. & M. Djamgoz (Eds.). The visual system of fish. Chapman and Hall, London. Puvanendran, V. & J.A. Brown. 1998. Effect of light intensity on the foraging and growth of Atlantic cod larvae, interpopulation difference? Mar. Ecol. Prog. Ser., 167: 207-214. Ribeiro, L., J.L. Zambonino-Infante, C. Cahu & M.T. Dinis. 1999. Development of digestive enzymes in larvae of Solea senegalensis, Kaup 1858. Aquaculture, 179: 465-473. Rocha, R.J., L. Ribeiro, R. Costa & M.T. Dinis. 2008. Does the presence of microalgae influence fish larvae prey capture? Aquacult. Res., 39: 362369. Rodríguez, A. & E. Gisbert. 2001. Morphogenesis of the eye of Siberian sturgeon. J. Fish Biol., 59: 1427-1429. Rombout, J.H.W., H.W.J. Stroband & J.J. Taverne-Thiele. 1984. Proliferation and differentiation of intestinal epithelial cells during development of Barbus conchonius (Teleostei, Cyprinidae). Cell Tissue Res., 236: 207-216. Ronnestad, I., Y. Kamisaka, L.E. Conceicao, S. Morais & S.K. Tonheim. 2007. Digestive physiology of marine fish larvae: hormonal control and processing capacity for proteins, peptides and amino acids. Aquaculture, 85 268: 82-97. Roo, F. J., J. Socorro, M.S. Izquierdo, M.J. Caballero, C.M. Hernández-Cruz, A. Fernández & H. Fernández-Palacios. 1999. Development of red porgy Pagrus pagrus visual system in relation to changes in the digestive tract and larval feeding habits. Aquaculture, 179: 499-512. Sala, R., C.A. Santamaría & S. Crespo. 2005. Growth of organ systems of Dentex dentex (L) and Psetta maxima (L) during larval development. J. Fish Biol., 66: 315-326. Santamaría, C.A., M. Marín de Mateo, R. Traveset, R. Sala, A. Grau, E. Pastor, C. Sarasquete & S. Crespo. 2004. Larval organogenesis in common dentex Dentex dentex L. (Sparidae): histological and histochemical aspects. Aquaculture, 237: 207-228. Sarasquete M.C., A. Polo & M. Yúfera. 1995. Histology and histochemistry of the development of the digestive system of larval gilthead seabream, Sparus aurata L. Aquaculture, 130: 79-92. Segner, H., V. Storch, M. Reinecke, W. Kloas & W. Hanke. 1994. The development of functional digestive and metabolic organs in turbot, Scophthalmus maximus. Mar. Biol., 119: 471-486. Seiffert, B., 2001. Effect of dietary (n-3) highly unsaturated fatty acids on growth and survival of fat snook (Centropomus parallelus, Pisces, Centropomidae) larvae during first feeding. Braz. J. Med. Biol. Res., 34: 645-651. Senoo, S., K.J. Ang & G. Kawamura. 1994. Development of sense organs and mouth and feeding of reared marble goby Oxyeleotris marmoratus larvae. Fisheries Sci., 60: 361–368. Shaw, G.W., P.M. Pankhurst & S.C. Battaglene. 2006. Effect of turbidity, prey density and culture history on prey consumption by greenback flounder Rhombosolea tapirina larvae. Aquaculture, 253: 447-460. Shirota, A. 1970. Studies on the mouth size of fish larvae. Bull. Jap. Soc. Scient. Fish., 36(4): 353-368. 86 Skiftesvik, A.B., H.I. Browman & J.F. St-Pierre. 2003. Life in green water: the effect of microalgae on the behaviour of Atlantic cod (Gadus morhua) larvae. 97-103, En: Browman, H.I. & A.B. Skiftesvik (Eds.). The big fish bang. Institute of Marine Research, Bergen, Norway. Storch, V. 1996. Ultrastructue of intestine. En: Verreth, J. (Ed.). Sixth international course on fish larvae nutrition (ERASMUS). Stroband, H.W.J. 1977. Growth and diet dependant structural adaptations of the digestive tract in juveniles grass carp (Ctenopharyngodon idella, Val.). J. Fish Biol., 11: 167-174. Stroband, H.W.J. & K.R. Dabrowski. 1979. Morphological and physiological aspects of the digestive system and feeding in fresh-water fish larvae. 355376, En: Fontaine, M (Ed). La nutrition des poissons. CNERNA. Paris. Stroband, H.W.J. & F.M.H. Debets. 1978. The ultrastructure and renewal of the intestinal epithelium of the juvenile grasscarp, Ctenopharyngodon idella (Val.). Cell. Tissue Res., 187: 181-200. Tamazouzt, L., B. Chatain & P. Fontaine. 2000. Tank wall colour and light level affect growth and survival in Eurasian perch larvae (Perca fluviatilis L.) Aquaculture, 182: 85-90. Treece, G. D., & D. A. Davis. 2000. Culture of small zooplankters for the feeding of larval fish. SRAC, 701: 1-7. Tucker, J.W. 1998. Marine Fish Culture. Kluwer Academic Publishers, Norwell, Massachusetts, U.S.A. 750 pp. Utne-Palm, A.C.W. 1997. The effect of turbidity and illumination on the reaction distance and research time of the marine planktivore Gobiusculus flavescens to its planktonic prey. J. Fish Biol., 50: 926-938. Utne-Palm, A.C.W. 1999. The effect of prey mobility, prey contrast, turbidity and spectral composition on the reaction distance of Gobiusculus flavescens to its planktonic prey. J. Fish Biol., 54: 1244-1258. 87 van der Meeren, A. Mangor-Jensen & J. Pickova. 2007. The effect of green water and light intensity on survival, growth and lipid composition in Atlantic cod (Gadus morhua) during intensive larval rearing. Aquaculture, 265: 206-217. Vinyard, G.L., & W.J. O’ Brien. 1976. Effect of light and turbidity on the reaction distance of bluegill (Lepomus macrochirus). J. Fish. Res. Board Can., 33: 2845-2849. Wang, Y., M. Hu, W. Wang, S.G. Cheung, P.K. Shin & L. Cao. 2010. Effects of the timing of initial feeding on growth and survival of loach (Misgurnus anguillicaudatus) larvae. Aquacult. Int., 18: 135-148. Ware, D.M. 1973. Risk of epibenthic prey to predation by rainbow trout (Salmo gairdneri). J. Fish Res. Board Can., 30: 787-797. Wieser, W. 1995. Energetics of fish larvae, the smallest vertebrates. Acta Physiol. Scand., 154: 279-290. Wilcox, J.A., P.L Tracy & N.H. Marcus. 2006. Improving live feeds: Effect of a mixed diet of copepod nauplii (Acartia tonsa) and rotifers on the survival and growth of first-feeding larvae of the southern flounder, Paralichthys lethostigma. J. World Aquacult. Soc., 37: 113-120. Wintzer, A.P. & P.J. Motta. 2004. The effects of temperature on prey-capture kinematics of the bluegill (Lepomis macrochirus): implication for feeding studies. Can. J. Zool., 82: 794-799. Yamamoto, T. 1966. An electron microscope study of the columnar epithelial cell in the intestine of fresh water teleost: goldfish (Carassius auratus) and rainbow trout (Salmo irideus). Z. Zellforsch, 72: 66-87. Yin, M.C. & J.H.S. Blaxter. 1987. Feeding ability and survival during starvation of marine fish larvae reared in the laboratory. J. Exp. Mar. Biol. Ecol., 105: 73-83. Yúfera, M. & M.J. Darias. 2007. The onset of exogenous feeding in marine fish larvae. Aquaculture, 268: 53-63. 88 Zambonino Infante, J.L. & C.L. Cahu. 1994. Development and response to a diet change of some digestive enzymes in sea bass (Dicentrarchus labrax) larvae. Fish Physiol. Biochem., 12: 399-408. Zavala-Leal, I. 2007. Efecto de la temperatura, intensidad de luz, tipo y densidad de presa en la eficiencia alimenticia durante la ontogenia inicial del huachinango del Pacífico (Lutjanus peru). Tesis de maestría. CICIMAR-IPN. 52p. Zhang, L., Y.J. Wang, M.H. Hu, Q.X. Fan, S.G. Cheung, P.K. Shin, H. Li & L. Cao. 2009. Effects of the timing of initial feeding on growth and survival of spotted mandarin fish Siniperca scherzeri larvae. J. Fish Biol., 75: 1158-1172. 89 ANEXO I. Técnica de transparentación y tinción descrito por Potthoff (1984) 90