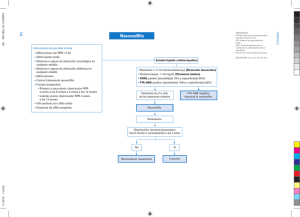
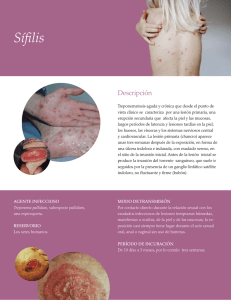
LINEAMIENTOS PARA LA VIGILANCIA POR LABORATORIO DE
Anuncio

LINEAMIENTOS PARA LA VIGILANCIA POR LABORATORIO DE ITS InDRE – RNLSP 2012 SECRETARIA DE SALUD SALOMÓN CHERTORIVSKI WOLDENBERG SECRETARIO DE SALUD DR. PABLO KURI MORALES SUBSECRETARIO DE PREVENCIÓN Y PROMOCIÓN DE LA SALUD DR. JESÚS FELIPE GONZÁLEZ ROLDÁN DIRECTOR GENERAL DE EPIDEMIOLOGÍA INSTITUTO DE DIAGNÓSTICO Y REFERENCIA EPIDEMIOLÓGICOS DR. JOSÉ ALBERTO DÍAZ QUIÑONEZ DIRECTOR GENERAL ADJUNTO DRA. MA. DEL CARMEN GUZMÁN BRACHO DIRECTORA DE DIAGNÓSTICO Y REFERENCIA QFB. LUCÍA HERNÁNDEZ RIVAS DIRECTORA DE SERVICIOS Y APOYO TÉCNICO LIC. JESÚS OMAR CASTILLO HERNÁNDEZ SUBDIRECTOR DE OPERACIÓN QBP. IRMA HERNÁNDEZ MONROY JEFA DEL DEPARTAMENTO DE BACTERIOLOGÍA M EN C IRMA LÓPEZ MARTÍNEZ JEFA DEL DEPARTAMENTO DE VIROLOGÍA QFB. ROBERTO VÁZQUEZ CAMPUZANO JEFE DEL DEPARTAMENTO DE ENFERMEDADES EMERGENTES Y URGENCIA QC. ISRAEL PARRA ORTEGA JEFE DEL DEPARTAMENTO DE PARASITOLOGÍA DRA. CLARA GORODEZKY LAUFERMAN JEFA DEL DEPARTAMENTO DE INMUNOLOGÍA M EN C JUDITH ESTÉVEZ RAMÍREZ JEFA DEL DEPARTAMENTO DE CONTROL DE MUESTRAS Y SERVICIOS DR. ERNESTO RAMÍREZ GONZÁLEZ JEFE DEL DEPARTAMENTO DE BIOLOGÍA MOLECULAR Y VALIDACIÓN DE PRUEBAS QFB. ALICIA LUNA VÁZQUEZ (INDRE) QFB. MARICELA GORDILLO MARÍN (UIFL) JEFES DE LABORATORIO DE ITS Y UIFL ANTECEDENTES DE LA RNLSP PARA DIAGNOSTICO DE VIH/ITS La RNLSP exclusivamente para Infecciones de transmisión sexual no existe por lo que siempre ha formado parte de la Red de VIH-ITS la cual inicia sus actividades desde mediados de la década de los ochentas, como consecuencia del descubrimiento del virus de la inmunodeficiencia humana (VIH). Inicialmente esta Red se dedica al diagnóstico de la infección por VIH en personas que acuden a solicitar la detección de anticuerpos. Posteriormente con los avances sobre la epidemiología de la enfermedad, en 1989 se divide en tres redes diferentes: Red de donadores, en la cual participan los Centros Estatales de la Transfusión Sanguínea; Red de Vigilancia Epidemiológica, conformada por los Laboratorios Estatales de salud Pública (LESP) y el Programa de VIH y la Red de Población Abierta, en la cual se logra la participación de centros de salud y algunos hospitales ubicados en todo el país. Todas estas redes fueron coordinadas por el InDRE hasta 1994 cuando el control de la Red de Donadores es transferido al Centro Nacional de la Transfusión Sanguínea, al dejar de ser la disposición de componentes sanguíneos del ámbito de competencia del InDRE. La Red de Población Abierta estaba financiada en su totalidad por el InDRE, quién era responsable del envío de reactivos para el diagnóstico de VIH a los LESP, que tenían como función, la coordinación estatal con los organizamos responsables de la utilización del reactivo. Esta Red funciono de manera regular hasta el año 2000 en el cual por situación presupuestal, se decide suspender el funcionamiento de la misma. ORGANIZACIÓN DE LA RED NACIONAL DE LABORATORIOS DE VIH/ITS La Red para la Vigilancia Epidemiológica continua funcionando con 31 LESP y el InDRE como institución coordinadora, normativa y rectora. Está Red realiza trabajo en conjunto para el diagnóstico de la infección en algunos laboratorios con base en las atribuciones de cada LESP, la correcta identificación de casos difíciles o cuando se requiere de pruebas suplementarias (referencia) y en el control de calidad de muestras, reactivos y analistas involucrados en este trabajo. El único estado que no participa es el Distrito Federal por no contar con laboratorio. SITUACION ACTUAL DE LA RED Se realizo un análisis de la capacidad diagnóstica y de la infraestructura de los miembros de la Red, mediante el envío de una encuesta, lo que permitió identificar la capacidad instalada en cada LESP. El 100% de los laboratorios tienen la capacidad de realizar diagnostico presuntivo y confirmatorio para VIH y el 77% realiza el diagnostico de ITS. La capacidad para la realización de pruebas de seguimiento en personas que viven con VIH ha aumentado notablemente en los últimos años. Actualmente la tercera parte de los laboratorios de la red tienen la capacidad instalada para la realización de pruebas de seguimiento. Las metodologías utilizadas en los Laboratorios de la Red son heterogéneas, sin embargo el 93.5% de ellos utilizan reactivos evaluados por el InDRE, lo que nos permite conocer el desempeño y el funcionamiento de los mismos y la trazabilidad de los resultados. El trabajo desarrollado por la red nos ha permitido identificar las siguientes fortalezas y debilidades: Fortalezas: Capacidad diagnostica para VIH en el 100% de los laboratorios de la red. Control de calidad mediante el envío de paneles para la evaluación del desempeño. Concordancias superiores al 90% en 26 de los 31 laboratorios que conforman la red. Existencia de normas y guías nacionales e internacionales que favorecen la homogeneidad en la aplicación de los métodos. Capacidad diagnostica para pruebas de seguimiento en el 32% de los laboratorios de la RED. Muy buena calidad de la mayoría de los reactivos existentes en el mercado, utilizados por la red para el diagnostico y seguimiento de la infección por el VIH. Capacitación y actualización continua del personal que realiza el diagnostico de VIH/ITS. Curso de actualización en VIH/ITS avalado por la Facultad de Medicina, evaluado con calificación de 9.5 por la UNAM. Visitas de auditoría y supervisión a todos los miembros de la red de laboratorios. Participación del InDRE y otros miembros de la Red en programas internacionales para la evaluación del desempeño. Debilidades: Trabajo desvinculado de la Red y el Programa para la Prevención y Control de la Infección por el VIH (CENSIDA). Falta de coordinación con las áreas de vigilancia epidemiológica estatales y federales. Desvinculación entre la Red y las demás instituciones del Sector Salud. Procesos de adquisición de materiales y reactivos prolongados y complicados. Necesidad de inclusión de reactivos en el catalogo de auxiliares de diagnostico del cuadro básico. Realización de algunas pruebas de seguimiento en laboratorios particulares con métodos y procedimientos de desempeño desconocido. Duplicación de funciones entre las instituciones que realizan diagnostico y seguimiento de pacientes. Falta de lineamientos nacionales referentes al uso de reactivos para diagnostico y seguimiento de pacientes. Falta de vinculación entre los bancos de sangre, la red y los sistemas de vigilancia epidemiológica. Falta de oportunidad en los resultados. Falta de control de calidad externo para las pruebas de seguimiento. FUNCIONES Y RESPONSABILIDADES DE LA RED Las funciones de la red de laboratorios de diagnóstico deben responder a los propósitos de la vigilancia epidemiológica de las enfermedades infecciosas y otras de interés en salud pública, según se disponga en el Consejo Nacional de Vigilancia Epidemiológica, pero en términos generales se considerarán los siguientes: Implantar y mantener un sistema de intercambio de información. Promover acuerdos bilaterales o multilaterales entre las instituciones participantes para hacer efectiva la prestación de los servicios y la ejecución de programas y proyectos de interés común. Identificar, coordinar y desarrollar actividades conducentes a la armonización de métodos de diagnóstico. Formular y ejecutar un programa para la preparación, mantenimiento e intercambio de cepas, reactivos y materiales de referencia. Organizar y dictar cursos, seminarios y talleres sobre temas de interés común y de trascendencia regional. Llevar a cabo trabajos de investigación colaborativos, especialmente de tipo aplicado sobre temas de interés de la red. Participar en el programa de acreditación de laboratorios y evaluación periódica del desempeño con el fin de orientar a los participantes en la realización de sus actividades. Facilitar el intercambio de expertos para apoyar proyectos de interés nacional o para proveer cooperación técnica a otros países. Diseñar, organizar y participar en un programa de control externo de calidad de laboratorios tendientes a asegurar la confiabilidad del producto de la actividad diagnóstica. FUNCIONES DEL LABORATORIO DE REFERENCIA NACIONAL (InDRE) Funciones generales El InDRE desde sus inicios ha promovido el trabajo en red y entre sus funciones se encuentran: Establecer la normatividad, tendiente a la estandarización de las técnicas de diagnóstico en uso ya la comparación de los resultados. Proporcionar supervisión y asesoría a los niveles intermedios o locales, según el grado de desarrollo del sistema. Llevar a cabo la referencia nacional para el diagnóstico de casos especiales o de confirmación. Acreditar, evaluar y supervisar a los laboratorios de la red. Capacitar personal. Desarrollar investigación aplicada. Evaluar nuevas tecnologías con miras a mejorar la calidad del diagnóstico Producir patrones, reactivos y productos biológicos de referencia según las necesidades de salud del país. Controlar la calidad de medios y reactivos para el diagnóstico. Publicar y actualizar un directorio de las instituciones participantes. Coordinar sus actividades con las de otros laboratorios de referencia nacionales o del extranjero. Funciones específicas para el diagnóstico de Sífilis. 1. Coordinación de la Red Nacional de Laboratorios para la vigilancia epidemiológica de Sífilis. 2. Realizar el diagnóstico de Sífilis por la técnica de USR y FTA-ABS laboratorios que no cuenten con infraestructura, reactivos y/o insumos. 3. Realizar estos métodos como referencia a las muestras que envíen con resultados previos que deseen sean confirmados. 4. Procesar todas las muestras enviadas al InDRE para Control de Calidad por el método de USR para Sífilis. 5. Capacitar a los LESP e Instituciones del Sector Salud que lo requieran, en las diferentes técnicas utilizadas en el diagnóstico de Sífilis de acuerdo a su nivel dentro de la Red. 6. Capacitar a todo el personal que solicite entrenamiento teórico- práctico en los métodos empleados para el diagnóstico de Sífilis. 7. Realizar la captura y emisión de resultados del laboratorio. 8. Realizar evaluación del desempeño para Sífilis a través del envío de paneles cuatrimestralmente. 9. Participar en el curso teórico práctico anual del Departamento de Enfermedades Emergentes y Urgencias. 10. Participar en Pruebas de Proficiencia para sífilis con el CDC. 11. Coordinación de la Red Nacional de Laboratorios para la vigilancia epidemiológica de Sífilis. 12. Realizar el diagnóstico de Sífilis por la técnica de USR y FTA-ABS laboratorios que no cuenten con infraestructura, reactivos y/o insumos. 13. Realizar estos métodos como referencia a las muestras que envíen con resultados previos que deseen sean confirmados. 14. Procesar todas las muestras enviadas al InDRE para Control de Calidad por el método de USR para Sífilis. 15. Capacitar a los LESP e Instituciones del Sector Salud que lo requieran, en las diferentes técnicas utilizadas en el diagnóstico de Sífilis de acuerdo a su nivel dentro de la Red. 16. Capacitar a todo el personal que solicite entrenamiento teórico- práctico en los métodos empleados para el diagnóstico de Sífilis. 17. Realizar la captura y emisión de resultados del laboratorio. 18. Realizar evaluación del desempeño para Sífilis a través del envío de paneles cuatrimestralmente. 19. Participar en el curso teórico práctico anual del Departamento de Enfermedades Emergentes y Urgencias. 20. Participar en Pruebas de Proficiencia para sífilis con el CDC. Funciones específicas para la producción, evaluación y suministros de reactivos y equipos diagnósticos. Suministrar a la RNLSP de reactivos y equipos diagnósticos altamente especializados, sean elaborados por el InDRE o adquiridos de otras fuentes, previa evaluación de su eficacia. Mantener actualizadas las técnicas de diagnóstico de las enfermedades infecciosas y unificar criterios y conceptos de análisis e interpretación diagnósticos. Mantener en la Red Nacional de Laboratorios de Salud Pública un programa permanente de actualización en el manejo, control e interpretación de metodología de laboratorio. ANTECEDENTES HISTÓRICOS DEL DEPARTAMENTO DE ENFERMEDADES EMERGENTES Y URGENCIAS/ LABORATORIO DE ITS El Laboratorio de Enfermedades de Transmisión Sexual (ETS) se crea en 1985 dentro del entonces Instituto de Salubridad y Enfermedades Tropicales (ISET) como respuesta del instituto y la Secretaria de Salud, a la necesidad de contar con un laboratorio dedicado exclusivamente al diagnóstico y control de las enfermedades sexualmente transmitidas. Inicialmente el laboratorio solo realizaba el diagnóstico para algunas de las llamadas ETS clásicas como son sífilis y gonorrea. En 1987 debido a la epidemia cada vez más importante causada por la infección del virus de la inmunodeficiencia humana (VIH), se incluyen los métodos de diagnóstico presuntivo y confirmatorio para este virus. Posteriormente en 1997, el laboratorio de ETS del Instituto Nacional de Diagnóstico y Referencia Epidemiológicos se convierte en el Departamento de VIH y Otras ITS, conformado por 4 laboratorios (VIH, ITS bacterianas, ITS virales y Hepatitis virales ) establecidos como laboratorios nacionales de referencia que realizan la confirmación de los diagnósticos realizados por los laboratorios estatales de salud publica, laboratorios estatales pertenecientes a hospitales o clínicas, servicios coordinados de salud, centros estatales de la transfusión sanguínea, centros de salud en el D.F. y otras dependencias (IMSS, ISSSTE, Ejército, Marina, PEMEX, etc.). Para principios de 1999 se anexan los laboratorios de Carga viral para VIH, Protozoosis y un laboratorio de nivel de bioseguridad 3 al Departamento. En el 2004 con base a las necesidades epidemiológicas del país, el área cambia de nombre y se convierte en el Departamento de Enfermedades Emergentes, con la incorporación del laboratorio de virus hemorrágicos, el laboratorio de apoyo a urgencias y desastres y la coordinación de los laboratorios de nivel 3 de bioseguridad en apoyo a la liberación intencional de agentes biológicos. DIAGNOSTICO DE SIFILIS Treponema pallidum es el agente etiológico de la sífilis, enfermedad de transmisión sexual descrita desde la antigüedad y cuya importancia ha sido reconsiderada a raíz de la descripción de la asociación con la infección por el VIH. Esta bacteria pertenece al orden de las Spirochaetales y a la familia Spirochaetaceae. Presenta una movilidad característica de tirabuzón, con desplazamiento muy rápido sobre el campo microscópico de observación. Varias propiedades de las espiroquetas hacen difícil su detección y recuperación en el laboratorio, por ejemplo capta los colorantes pobremente dificultándose su observación por éstos procedimientos, por lo que su observación debe hacerse siempre en microscopía de campo oscuro o por tinción fluorescente, procedimientos con los cuales se visualiza el microorganismo con todas sus características. Además el microorganismo no se ha podido cultivar en ninguno de los procedimientos ensayados. El tioglicolato puede conservarle en forma viable hasta por un máximo de 22 días, pero aquí no se multiplica, simplemente se conserva. Existen varias cepas de Treponema que han sido aisladas y cultivadas en anaerobiosis, sin embargo ninguna es patógena ni corresponden a T. pallidum (cepas Nichols, Noguchi, Kazan y cepa Reiter). Con respecto a su diagnóstico, conviene ante todo insistir en que no hay prueba de laboratorio que sustituya a la historia clínica y al examen físico, por tanto el estudio de todo paciente sospechoso de sífilis debe de iniciarse con una buena historia y un examen físico completo. La fase primaria y secundaria de la enfermedad, así como las lesiones de la sífilis congénita recientes son ricas en T. pallidum y por tanto su investigación directa es un auxiliar importante para confirmar el diagnóstico. Esto se realiza por la técnica de campo obscuro que es de utilidad, sobre todo en aquellos casos en que los niveles de anticuerpos no son detectables (principalmente sífilis primaria). A pesar de lo específico de este diagnóstico, las pruebas más utilizadas en la actualidad son los exámenes indirectos (pruebas serológicas), las cuales detectan anticuerpos en un tiempo promedio de 4 semanas después de ocurrida la infección. Las pruebas serológicas útiles en el diagnóstico de la sífilis se pueden dividir en dos grandes grupos: 1. Las que investigan los anticuerpos heterólogos y que utilizan antígeno de origen no treponémico Ejem: USR,VDRL, RPR. 2. Las que investigan anticuerpos específicos y que utilizan antígenos de orígen treponémico. Ejem: FTA-Abs, TPHA ALGORITMOS ALGORITMO MAESTRO (DIAGNÓSTICO)PARA LA DETERMINACION DE ANTICUERPOS CONTRA Treponema pallidum EN SÍFILIS ADQUIRIDA Muestra* Suero o Plasma Pruebas no treponemicas VDRL, RPR, USR Estándar de calidad en servicio: 3 días Estándar de calidad en servicio: 5 días Reactivo No reactivo Prueba treponémica FTA-ABS IgG Reportar Negativo Si se solicita Prueba treponémica FTA-ABS IgG Positivo Negativo Positivo Negativo Reportar Positivo IgG Reportar Negativo IgG Reportar Positivo IgG Reportar Negativo IgG * Las muestras recibidas por el área son de 32 Estados de la RNLSP y otras instituciones pertenecientes a la Secretaria de Salud así como también del IMSS, ISSSTE, DDF, particulares, etc. Ref: Informe anual de pruebas del InDRE Bitácora de recepción de muestras del laboratorio. ALGORITMO MAESTRO(DIAGNÓSTICO)PARA LA DETERMINACION DE ANTICUERPOS CONTRA Treponema pallidum EN SÍFILIS CONGÉNITA Muestra* Suero o Plasma Pruebas no treponemicas VDRL, RPR, USR Reactivo No reactivo Prueba treponémica FTA-ABS IgG Estándar de calidad en servicio: 5 días Prueba treponémica FTA-ABS IgM Positivo Negativo Positivo Negativo Reportar Positivo IgG Reportar Negativo IgG Reportar Positivo IgM Reportar Negativo IgM * Las muestras recibidas por el área son de 32 Estados de la RNLSP y otras instituciones pertenecientes a la Secretaria de Salud así como también del IMSS, ISSSTE, DDF, particulares, etc. Ref: Informe anual de pruebas del InDRE Bitácora de recepción de muestras del laboratorio. ALGORITMO MAESTRO( REFERENCIA) PARA LA DETERMINACION DE ANTICUERPOS CONTRA Treponema pallidum EN SÍFILIS ADQUIRIDA Muestra* de suero o plasma y referencia documentada del resultado obtenido previamente Pruebas no treponemicas VDRL, RPR, USR Estándar de calidad en servicio: 3 días Estándar de calidad en servicio: 5 días Reactivo No reactivo Prueba treponémica FTA-ABS IgG Prueba treponémica FTA-ABS IgG Positivo Negativo Positivo Reportar Positivo IgG Reportar Negativo IgG Reportar Positivo IgG Negativo Reportar Negativo IgG * Las muestras recibidas por el área son de 32 Estados de la RNLSP y otras instituciones pertenecientes a la Secretaria de Salud así como también del IMSS, ISSSTE, DDF, particulares, etc. Ref: Informe anual de pruebas del InDRE Bitácora de recepción de muestras del laboratorio. ALGORITMO MAESTRO (REFERENCIA) PARA LA DETERMINACIÓN DE ANTICUERPOS CONTRA Treponema pallidum EN SÍFILIS CONGÉNITA Muestra* de suero o plasma de recién nacido y referencia documentada del resultado obtenido previamente Pruebas no treponemicas VDRL, RPR, USR Reactivo No reactivo Prueba treponémica FTA-ABS IgG Estándar de calidad en servicio: 5 días Prueba treponémica FTA-ABS IgM Positivo Negativo Positivo Negativo Reportar Positivo IgG Reportar Negativo IgG Reportar Positivo IgM Reportar Negativo IgM * Las muestras recibidas por el área son de 32 Estados de la RNLSP y otras instituciones pertenecientes a la Secretaria de Salud así como también del IMSS, ISSSTE, DDF, particulares, etc. Ref: Informe anual de pruebas del InDRE Bitácora de recepción de muestras del laboratorio. ALGORITMO MAESTRO (CONTROL DE CALIDAD)PARA LA DETERMINACION DE ANTICUERPOS CONTRA Treponema pallidum A LA RNLSP Muestras* de la RNLSP (sueros) Pruebas no treponemicas VDRL, RPR, USR Estándar de calidad en servicio: 3 días Reactivo No reactivo Reportar Positivo Reportar Negativo * Las muestras recibidas por el área son de 32 Estados de la RNLSP Ref: Informe anual de pruebas del InDRE Bitácora de recepción de muestras del laboratorio. ALGORITMO MAESTRO PARA EVALUACIÓN DE DESEMPEÑO DE Treponema pallidum DEL InDRE A LA RNLSP Muestras del Banco de Sueros para diagnóstico de Treponema pallidum Selección de muestras positivas a pruebas no treponémicas y treponémicas. Selección de muestras negativas a pruebas no treponémicas y treponémicas. Elaboración de alícuotas Preparación y envío a la RNLSP Análisis de concordancia Estándar de calidad en servicio: 2 envíos ALGORITMO MAESTRO PARA EL PANEL DE PROFICIENCIA DE Treponema pallidum DEL CDC AL InDRE Panel de proficiencia para Treponema pallidum enviado por el CDC Pruebas no treponemicas VDRL, RPR, USR Reactivo No reactivo Reportar positivo Reportar negativo Prueba treponémica FTA-ABS IgG Estándar de calidad en servicio: 5 días Positivo Negativo Reportar Positivo IgG Reportar Negativo IgG TOMA Y MANEJO DE MUESTRAS La muestra de suero o plasma a utilizar se obtendrá de acuerdo a las indicaciones del Manual de Toma, Manejo y Envío de Muestras del InDRE. Para la obtención de suero puede emplearse el tubo de tapón rojo con gel y para la obtención de plasma el tubo de tapón morado con anticoagulante (EDTA); sin embargo estas muestras se pueden recibir debidamente separadas en tubos de plástico, criotubos, viales, etc. correctamente etiquetadas. METODO DE DETECCION DE ANTICUERPOS REAGINICOS CONTRA TREPONEMA PALLIDUM (USR) 1. Equipos Agitador orbital Marca H Gemmy Industrial, Modelo VRN-210 (No. de Serie 221440) con velocidad ajustable, fijado a 180 r.p.m. Micropipeta automática Marca Finnpipette vol. variable 20-200 ml Micropipeta automática Marca Finnpipette vol. variable 5-40 ml Microscopio Optico Marca Olympus, Modelo BX41TF (No. de Serie 1L0039) Balanza semianalítica digital, Marca Denver Instrument Company, Modelo TR-203 (No. de serie T0115271) Mezclador Vortex Refrigerador vertical para almacenamiento de muestras biológicas y reactivos (2-8°C) Ultracongelador (-70°C) para conservación del banco de muestras. 2. Materiales Placas de vidrio,fondo plano con arillo de cerámica de 18 mm. de diámetro. Espátula. Matraz volumétrico de 100 ml. Matraz Erlenmeyer de 250 ml. Probeta de 100 ml. Puntas amarillas para micropipetas. Bata. Guantes de látex. Cubrebocas. Lentes de seguridad. Bote para desechos punzocortantes. 3. Reactivos y Materiales biológicos Solución salina isotónica: 0.9 NaCl%. Pesar 0.9 g. de NaCl y disolverlo perfectamente en 100 ml. de Agua destilada. Immutrep USR PLUS Antigen, Marca Omega Diagnostics, frasco con 10 ml. Ref.OD111A; incluye Suero Control Positivo el cual contiene anticuerpos contra Treponema pallidum, frasco con 0.5 ml. Suero Control Interno Negativo. Suero Control Positivo de un solo analito: Accurrun Anti-Treponema (syphilis).Marca BBI Diagnostics, No. de catálogo A-155-5010. 4. Pasos del Método 4.1 Método Cualitativo sin Diluciones 4.1.1 Las muestras y los reactivos deben de estar a temperatura ambiente (25-30°C) antes de iniciar la prueba. 4.1.2 Elaborar mapa de colocación de muestras considerando también los pozos para los controles(Fig.1) 4.1.3 Dispensar una gota (50L.) de suero y controles homogeneizados en los pozos correspondientes de la placa de acuerdo al mapa. 4.1.4 Añadir 1 gota (22 L.) de antígeno previamente homogeneizado (no es preciso mezclar los dos componentes). 4.1.5 Rotar la placa a 180 r.p.m. durante 4 minutos. 4.1.6 Inmediatamente después observar el resultado en el microscopio (aumento 100x). 4.1.7 Registrar los resultados como: -No reactivo (ausencia de floculación) -Reactivo (agregados finos, medianos o grandes) 4.1.8 Realizar el método cualitativo con diluciones a las muestras reactivas. SS F M 1 CN CP M 2 M3 Fig.1 4.2 Método Cualitativo con Diluciones 4.2.1 Colocar 50L de solución salina 0.9% en 5 pozos de la placa. CP AC SSF: Solución Salina Fisiológica CP: Control Positivo CN: Control Negativo CP AC: Control Positivo ACCURRUN M: Muestra M4 4.2.2 4.2.3 4.2.4 4.2.5 4.2.6 4.2.7 Adicionar 50L de la muestra a evaluar en el primer pozo, mezclar con la solución salina y retirar 50L de esta dilución con la pipeta para mezclarla con la solución salina del siguiente pozo; repetir hasta el último pozo con solución salina. De esta forma las diluciones de la muestra son 1:2, 1:4, 1:8, 1:16, 1:32.(Fig.2) Añadir 22l de antígeno previamente homogenizado a la muestra. (no es necesario mezclar los dos componentes). Agite la placa por 4 minutos a 180 r.p.m. Inmediatamente después observar el resultado en el microscopio (aumento 100x). Si en la última dilución existe floculación, se repetirá el ensayo realizando más diluciones hasta obtener la dilución donde se observe la ausencia de floculación. Se reportará la última dilución en la que se observó floculación. 50l SUERO POSITIVO 50l Dilución 1:2 50l Dilución 1:4 50l Dilución 1:8 50 l 50 l 50 l 50 l SSF SSF SSF SSF 50 l 50 l 50 l 50 l SSF SSF SSF SSF 50l Dilución 1:16 Fig.2 INTERPRETACIÓN POR EL LABORATORIO Método Cualitativo sin Diluciones Agregados finos, medianos o grandes Reactivo No se observan agregados No Reactivo Método Cualitativo con Diluciones El título que se reporta es la máxima dilución que produce floculación (Fig.3) 1:2 POS 1:25 6 NEG 1:12 8 NEG 1:16 POS 1:8 POS 1:4 POS 1:64 NEG 1:32 POS Fig.3 Prueba cualitativa de una muestra título 1:32 METODO DE DETECCION DE ANTICUERPOS ANTI-TREPONEMA PALLIDUM POR INMUNOFLUORESCENCIA (FTA-ABS) Reactivos: - - Antígeno. Treponema pallidum cepa Nichols. Suspensión liofilizada de T. pallidum cultivado in vivo en testículos de conejo. Sorbente. Extracto liofilizado de treponema reiter inactivado por autoclave. Conjugado anti-inmunoglobulina M humana - fluoresceína. Suero testigo positivo. Suero extraído de pacientes con diagnóstico confirmado de sífilis. (No contiene anticuerpos tipo IgM). Suero testigo negativo. Suero proveniente de pacientes sanos. Suero testigo inespecífico. Suero humano liofilizado que muestra una reacción positiva no específica en la prueba de FTA-Abs. Solución amortiguadora de fosfatos (PBS) pH = 7.2 a 7.4. Medio de absorción para factor reumatoide (RF). Preparación liofilizada de anti-anticuerpos humanos para la detección de IgM. Solución de montaje PBS-glicerol Material y Equipo: - Microscopio de epifluorescencia Portaobjetos para inmunofluorescencia cubiertos con teflón de 8 pozos. Cubreobjetos Pipetas automáticas de 20 y 50 µl Trabajos preliminares: 1.- 2.- 3.- 4.- Reconstitución del antígeno. a) Reconstituir la suspensión liofilizada del antígeno con 1 ml de agua destilada. b) Dejar reposar a temperatura ambiente durante 10 minutos. c) Homogeneizar la suspensión por pipeteo 10 veces. d) Colocar 10 µl de la suspensión en cada pozo y secar en una estufa a 37°C durante 3 horas. e) Fijar la preparación con acetona durante 10 minutos. f) Almacenar a -70°C hasta su uso. Lavar los portaobjetos con el antígeno fijado, en una cámara de Koplik con una solución de PBS por 10 minutos, cambiar el PBS y lavar nuevamente por 5 minutos. Finalmente enjuagar con agua destilada. Descomplementar los sueros, incubando a 56°C durante 30 minutos, o calentar a 56°C por 10 minutos cuando han pasado más de 4 horas de haberse descomplementado. Permitir que los sueros alcancen la temperatura ambiente para ser procesados. Procedimiento: 1.2.3.- Diluír lo sueros 1 : 5 con el sorbente (10 µl de suero + 40 µl de sorbente) y mezclar. Diluír simultáneamente y de la misma manera los controles positivo, negativo e inespecífico. Pasar 50 µl de la mezcla anterior a un criotubo con 50 µl de medio de absorción para factor reumatoide RF. Incubar a 37°C para eliminar los anticuerpos de grupo no específicos contra Treponema y absorber el factor reumatoide. 4.- Colocar 10 µl del suero problema diluído a un pozo del portaobjetos con el antígeno fijado, lavado y secado previamente. Hacer lo mismo para cada uno de los sueros control. 5.Incubar a 37°C durante 30 minutos en cámara húmeda. 6.- Realizar dos lavados, con PBS durante 10 y 5 minutos respectivamente. Se enjuagan en un baño con agua destilada y se le permite que secar al aire. 7.Adicionar 10 µl del conjugado anti-IgM previamente titulado(diluído 1 50) a cada pozo. (Ejemplo: 10 µl de conjugado + 490 µl de PBS). 8.Incubar a 37°C durante 30 minutos en cámara húmeda. 9.Lavar como se describe en el punto 6. 10.- Agregar 2 gotas de la solución de montaje y colocar un cubreobjetos. 11.- Realizar la lectura con objetivo de inmersión 100X. Resultados: 1.- 2.3.- Verificar la ausencia de fluorescencia en los testigos negativo e inespecífico. Es posible observar únicamente las siluetas de los treponemas. Reacción negativa. No se observa fluorescencia o existe un ligero tono verde en los treponemas observables. Un resultado positivo se presenta cuando se observan los treponemas fijados en el portaobjetos con la fluorescencia característica (brillo verde manzana). La intensidad de la fluorescencia observada se reporta de 1 a 4 cruces. Departamento de Enfermedades Emergentes y Urgencias LINEAMIENTOS PARA EL DIAGNÓSTICO DE Neisseria gonorrhoeae 2012 Introducción El género Neisseria pertenece a la familia Neisseriaceae, en donde existen dos especies de importancia, Neisseria gonorrhoeae y Neisseria meningitidis. N. meningitidis (meningococo) figura entre los 3 principales agentes causales de meningitis infantil. Esta afección es muy grave debido a su alta tasa de mortalidad entre los niños, y a la elevada frecuencia con que los pacientes que salvan la vida llegan a presentar consecuencias neurológicas muy serias. Neisseria gonorrhoeae es el agente causante de blenorragia o gonorrea, enfermedad muy antigua descrita. Fue observada en 1879 por Albert Neisser en exudados purulentos de uretra de un paciente que presentaba uretritis gonocócica y cultivada por primera vez en 1882 por Leistikow. La gonorrea es, generalmente, una infección de transmisión sexual (ITS). En varones, el cuadro clínico es sintomático en 75,0% a 85,0%, lo contrario sucede en mujeres, donde la infección en la mayoría de casos es asintomática. Las infecciones más frecuentes causadas por el gonococo son: uretritis, cervicitis, proctitis, salpingitis, faringitis, vulvovaginitis en niñas, y oftalmía del recién nacido y adultos, entre otras. Es poco frecuente la infección sistémica y la artritis gonocócica. El éxito del aislamiento primario del gonococo depende de una adecuada obtención de la muestra, contar con personal debidamente capacitado y de la calidad de los medios de cultivo; además, que la identificación confirmatoria del mismo garantiza el diagnóstico clínico y orienta el tratamiento del paciente infectado. Existen diversas pruebas de laboratorio para confirmar el diagnóstico bacteriológico del gonococo: pruebas bioquímicas, serológicas con anticuerpo monoconal, hibridación del ácido desoxiribonucleico (ADN), amplificación del ADN, siendo el más común el método bioquímico de utilización de carbohidratación en base CTA, conocido como el método “convencional” o método del crecimiento. Objetivo Establecer los procedimientos técnicos para realizar el diagnóstico bacteriológico de la infección causada por N. gonorrhoeae en la población. Medidas de Bioseguridad Agente Sensible a los desinfectantes como hipoclorito de sodio al 1%, etanol al 70%, glutaraldehído, yodo y formaldehído. Sensible al calor húmedo a presión (121°C por 15 minutos) y al calor seco (160°C170°C por una hora). Se ha reportado que puede sobrevivir hasta 48 horas en vidrio, papel hasta 3 días, plástico por 24 horas y asientos de baño por varias horas. Debido a la producción de betalactamasas de origen plasmídico y/o cromosomal, se ha incrementado el número de cepas resistentes a penicilina. Riesgos en el laboratorio Infecciones adquiridas en el laboratorio: Se han reportado 4 casos en Estados Unidos. Muestras en las que puede estar presente: exudados de conjuntiva, uretra o cervix uterino, líquido sinovial, orina, heces y líquido cefaloraquídeo. Riesgos primarios: inoculación parenteral accidental, contacto directo o indirecto de las membranas mucosas con material clínico infeccioso, etc. Precauciones Contención: Nivel 2 de bioseguridad para toda actividad que envuelva material clínico y cultivos. Ropa de protección: Usar bata de laboratorio y guantes cuando exista posibilidad de contacto de la piel con el material infeccioso. Obtención de la muestra Las muestras deberán obtenerse antes que el paciente inicie el tratamiento con antimicrobianos. Para cada zona de muestreo (uretra, cervix, nasofaringe, ocultar, etc.) se aplicará un procedimiento específico, debiendo recolectarse la muestra, preferentemente con hisopos de baja toxicidad como dacrón o alginato de calcio. No se deben utilizar hisopos de algodón, ya que son tóxicos para la bacteria. Transporte de la muestra Las muestras (hisopados clínicos, biopsias, etc.) deben llegar al laboratorio en buenas condiciones, de tal manera que el gonococo se mantenga viable y pueda ser aislado. Si se trata de un aislamiento sospechoso de ser gonococo y es enviado al Laboratorio Referencial para el respectivo diagnóstico confirmatorio, el remitente debe asegurarse que el cultivo esté viable y libre de contaminantes, porque la presencia de éstos en el medio de transporte puede ocasionar la no viabilidad de la bacteria. Las muestras o cultivos sospechosos deben ser transportados en medios adecuados, dependiendo del tiempo que demorará para llegar a su destino. Estos se clasifican en: 1) Medios no Nutritivos, como el Amies con carbón, el cual es adecuado cuando la muestra va a llegar al laboratorio dentro de las seis horas de su obtención. El tiempo es muy importante para las muestras procedentes de portadores asintomáticos o de pacientes tratados con antimicrobianos, las que podrían presentar escasos gonococos viables. a. Procedimiento: - Depositar la muestra junto con el hisopo (utilizar hisopo sintético). - Introducir el hisopo al tubo, previamente rotulado, que contiene el medio de transporte. - Romper el mango sobrante y cerrar bien la tapa del tubo del hisopo. 2) Medios Nutritivos o de Crecimiento, tal como el Transgrow o Placas JEMBEC o en medio de crioconservación, cuando las muestras no van a ser sembradas dentro de las seis horas. El tiempo óptimo de transporte en éstos medios es de 24 a 28 horas. a. Procedimiento - Sembrar la muestra sobre la superficie del medio de cultivo haciendo estrías. - Hacer una incubación previa antes del transporte, a 35°C-37°C durante 18-24 horas. PROCEDIMIENTOS PARA EL DIAGNÓSTICO BACTERIOLÓGICO Fundamento El agente etiológico de la gonorrea es Neisseria gonorrhoeae, bacteria Gram negativa, que tiene forma de coco a la observación microscópica, se agrupan generalmente en pares, dando la apariencia de riñones o granos de café, no forma esporas, ni presenta flagelos. Presenta pili y microcápsulas, metabolismo oxidativo e utiliza la glucosa sin producción de gas. Es una bacteria muy exigente, que desarrolla en medios de cultivos artificiales, con vitaminas, hierro y ciertos aminoácidos. Asimismo, requiere de humedad 50-70%, anhídrido carbónico 7-10% y temperatura 35°C37ºC. Para el diagnóstico de gonorrea se considera al cultivo como el estándar de oro en la demostración del agente etiológico, pero es importante tomar en cuenta que en las infecciones agudas, el diagnóstico presuntivo basado en la presencia de diplococos gramnegativos intracelulares en frotis de exudados genitales, identifica el 95% de las infecciones en el hombre, pero solo del 50 al 65% de las infecciones en mujeres; motivo por el cual, es indispensable el aislamiento de la bacteria, aunado también a la presencia, cada vez más frecuente, de cepas productoras de beta lactamasa; aunque también existen técnicas basadas en el hallazgo de antígenos gonocócicos, que pretenden sustituir al cultivo (coaglutinación y ELISA). Método para el cultivo e identificación de Neisseria gonorrhoeae Material y Equipo Cajas petri 15 x 100 mm Tubos de ensayo de vidrio clase A (borosillicato) 10 x 75 mm Asas de siembra (nicrón, aluminio) Guantes Hisopos de algodón Portaobjetos Papel Kraft Pinzas de acero inoxidable Piseta de plástico Papel seda Canastillas para tinción Mechero Fisher Jarra de anaerobiosis Incubadora 35°C – 37°C Microscopio compuesto, binocular, con lentes objetivo de 10X, 40X y 100X Vela de parafina pura (sin olor y color) Autoclave Balanza Jarra de cierre hermético tipo GasPak System Refrigerador doméstico 4°C-8°C Potenciómetro Reactivos Solución de cristal violeta Solución de lugol Solución de safranina Solución de alcohol-acetona 1:1 Agua estéril Aceite de inmersión N,N-Dimethyl-1,4 phenylenediamonium HCl o N,N,N.N-tetramethyl-pphenylenediamine-HCl solución 1 % . Medios diferencial CTA-carbohidrato (Glu, lac, fru, mal y sac) Peróxido de hidrógeno 30 % Agar Thayer-Martin modificado (ATMM) Agar chocolate enriquecido (ACH) Material Biológico Muestra de exudado cervical o uretral extendidas en un portaobjetos. (Ver Manual de Toma manejo y Envío de Muestras del InDRE) Colonias bacterianas en cajas Petri con agar Thayer-Martin de 24 – 48 Hrs de incubación. Colonias bacterianas características de N. gonorrhoeae en cajas Petri con agar Gelosa chocolate especial de 24-48 Hrs de incubación. (Fig 1) Examen directo de la muestra Procedimiento para el frotis de la muestra De las muestras obtenidas con asa bacteriológica o hisopo, preparar dos frotes tan finos como sean posibles y que abarquen una buena extensión en el portaobjeto (limpio, desengrasado, no rayado). Para evitar alteraciones de la morfología celular, no debe frotarse vigorosamente. Cuando la muestra se obtiene por hisopado, ésta se debe rotar suavemente sobre la superficie del portaobjetos. Deje secar la muestra a temperatura ambiente o a calor suave, para luego realizar la coloración de Gram. Coloración de Gram (modificado por Hucker). Cubrir el frotis con cristal violeta durante un minuto. Lavar con agua corriente. Aplique la solución de lugol para Gram durante dos minutos. Lavar con agua corriente. Decolore con alcohol-acetona (1:1). Lavar con agua corriente. Cubra el frotis con safranina durante 20 a 30 segundos. Lavar con agua corriente. Deje secar la lámina al aire o suavemente con papel absorbente. Observar la lámina al microscopio con lente objetivo de inmersión. Interpretación del resultado del examen directo Positivo : Si se observa la presencia de diplococos intracelulares Gram negativos típicos (ovales, de formas arriñonadas agrupados en pares). Sospechoso : Si sólo se observan diplococos Gram negativos extracelulares Negativo : Si no se observan diplococos Gram negativos En términos generales, el informe del examen directo (coloración de Gram), debe indicar además la presencia y cantidad de leucocitos polimorfonucleares. Este dato es muy importante para el clínico, ya que puede indicar estar frente a un caso de infección no gonocócica. La coloración de Gram es de gran valor para el diagnóstico de gonorrea aguda en varones (tiene una sensibilidad y especificidad de 99,0%), mientras que en la mujer es considerablemente menor (especificidad de 45,0% a 55,0%) debido a la presencia de flora bacteriana nativa, siendo necesaria la realización del cultivo. Cultivo Procedimiento 1) La muestra se siembra de inmediato en medio selectivo de Thayer – Martin. 2) Distribuír el inóculo por estriado masivo en toda la caja, en condiciones asépticas. 3) Incubar entre 35 – 37°C en atmósfera húmeda (70% de humedad), con 3 al 5% de bióxido de carbono (CO2). Nota. Para el proceso de incubación se puede usar una de las siguientes opciones: Frasco de boca ancha con algodón humedecido, que contenga del 3 al 10% de bióxido de carbono (el CO2 se genera utilizando una vela de parafina que se enciende y apaga dentro del recipiente). Jarra de anaerobiosis, con sobres generadores de CO2 (gas-pack). Incubadora de CO2 con depósito de agua. 4) Al cabo de 24 a 48 Hrs se buscan colonias pequeñas, no pigmentadas (blancas o grisáceas), convexas, mucoides y no hemolíticas, de un diámetro de 0.5 a 1 mm, 5) A las colonias características de Neisseria, se les hace tinción de Gram, prueba de oxidasa y prueba de catalasa. 6) Realizar una re-siembra de las colonias sospechosas, distribuyendo la muestra por cuadrantes para aislar en el medio gelosa chocolate especial. 7) Repetir los puntos 3, 4 y 5. Fig 1. Inoculación de muestras en Agar Thayer Martin Fig. 2. Inoculación en Jarra de Anaerobiosis (gas pack) Fig 3. N. gonorrhoeae en Agar Thayer Martin Identificación confirmatoria semi-automatizada La identificación de N. gonorrhoeae, de forma automatizada, utiliza pruebas estandarizadas y miniaturizadas, así como una base de datos específica, que para este efecto se encuentra incluida en el software del equipo utilizado. Fundamento Cada galería de identificación está formada por 10 microtubos que contienen substratos de forma deshidratada para la realización de 12 pruebas de identificación bioquímica (reacciones enzimáticas y/o para la fermentación de azucares), así como la investigación de una penicilinasa. Las reacciones producidas durante la incubación, se traducen en cambios de color espontáneos o revelados por la adición de reactivos. Después de dos horas de incubación a 3537°C, se realiza visualmente la lectura de las reacciones y la identificación se obtiene ingresando los datos al programa del instrumento. Material y Equipo Puntas estériles para pipeta automática de 200 µl Asas bacteriológicas Guantes de nitrilo Cubrebocas Papel secante Mechero Fisher Incubadora Micropipeta automática de 50 a 250 µl Densitómetro o patrón de referencia No 4 de MacFarland Equipo para identificación Reactivos Aceite de inmersión Galería de identificación bioquímica y enzimática Api NH Reactivo revelador James Reactivo revelador ZYM B Ampolletas de cloruro de sodio al 0.85% Material Biológico Colonias bacterianas características de N. gonorroheae en cajas Petri con agar Gelosa Chocolate especial de 24 Hrs de incubación. Procedimiento 1) Tomar una cámara de incubación (fondo y tapa) y anotar en la lengüeta lateral la clave de la muestra. Sacar una galería de su bolsa hermética y colocarla en la cámara (húmeda) de incubación. 2) A partir de un cultivo reciente (24 horas) puro, tomar con un asa estéril unas colonias para realizar una suspensión en la ampolleta de cloruro de sodio 0.85%. 3) Ajustar la suspensión a una turbidez igual al patrón 4 de MacFarland (utilizar un densitómetro). Inoculación de la Galería 1) Colocar en los pozos correspondientes a los sustratos PEN, GLU, FRU, MAL, SAC, ODC y URE 55 µl en cada uno y 150 µl en los tres últimos correspondientes a LIP/ProA, PAL/GGT, bGAL/IND, procurando no formar un menisco convexo. 2) Adicionar en los siete primeros pozos una gota de aceite de parafina y cerrar la cámara de incubación. 3) Incubar dos horas a 35 – 37 °C en atmósfera aeróbica. Lectura de la Galería 1) Leer las reacciones con la ayuda de la tabla de lectura de la ficha técnica Nota: Añadir una gota del reactivo ZYM B en los pozos LIP/ProA y PAL/GGT y una gota del reactivo de James en el pozo bGAL/IND. 2) Esperar tres minutos y leer las reacciones con la tabla de la ficha técnica. 3) Si después de dos horas de incubación varias reacciones son dudosas, reincubar la galería dos horas más y leer de nuevo (excepto las pruebas enzimáticas) Interpretación Codificar las reacciones en un perfil numérico de acuerdo al valor asignado en la hoja de resultados para cada prueba (1, 2 o 4). Sumar los valores de las pruebas positivas para cada grupo y obtener un código de cuatro cifras. Nota: No codificar la primera prueba (Penicilinasa) Identificación Visual: Buscar el perfil numérico en la lista de perfiles de la ficha técnica Automatizada: Seguir el procedimiento para la operación del equipo. Patrón de Identificación Tabla de la muestra patrón de identificación PAL βGal ProA GGT - - - + - - - + - - - - - - - - - - + - - - - - - + + - - PEN GLU FRU MAL SAC ODC URE N. gonorrhoeae + + - - - - - B. catarrhalis - + - - - - N. cinerea - - - - - N. lactamica - + - + - Microorganismo Donde: LIP PEN: Penicilinasa PAL: Fosfatasa Alcalina GLU: Glucosa βGAL: Beta galactosidasda FRU: Fructosa ProA: Prolina arilaminidasa MAL: Maltosa GGT: Gamma glutamiltransferasa SAC: Sacarosa IND: Indol ODC: Ornitin descarboxilasa URE: Ureasa LIP: Lipsas IND Prueba de utilización de carbohidratos en base CTA Prueba convencional ampliamente utilizada por los países en desarrollo, no es muy costosa pero requiere de un buen inóculo y de mayor tiempo de incubación (de 18 a 72 horas), en comparación con las pruebas rápidas que sólo requieren de 2 a 4 horas, dependiendo del kit empleado. Condiciones Específicas Esta prueba debe realizarse con cultivo joven de 18-24 horas, procedente de sub cultivo en agar chocolate con suplemento enriquecedor. Procedimiento a. Inocular la bacteria en estudio en tubos de 13x100 mm que contienen el medio diferencial CTA-Carbohidrato. Depositar un buen inóculo. b. Inocular por picadura en el tercio superior del citado medio diferencial y luego diseminar por estriación sobre la superficie inclinada (pico de flauta). c. Incubar a 37°C sin CO2 durante 18-72 horas. Frecuentemente, resulta suficiente 18-24 horas. d. Examinar e interpretar: Es positiva, cuando el medio ha cambiado del color rojo inicial hacia el amarillo claro o pálido en el área del inóculo. Si el color amarillo se extiende por todo el medio diferencial, podría tratarse de bacterias contaminantes. En estos casos se debe hacer una coloración de Gram y repetir la prueba, previa descontaminación, en medio selectivo Agar Thayer Martin Modificado (ATMM). Fundamento de la prueba a. La prueba consiste en determinar la capacidad de la bacteria sospechosa de ser gonococo de utilizar oxidativamente, uno o más carbohidratos (glucosa, lactosa, maltosa, y sacarosa), mientras se va desarrollando. b. El carbohidrato presente en el medio diferencial se encuentra en un agar base cisteína-tripticasa, el cual tiene como indicador rojo de fenol, siendo el pH del medio de cultivo 7,1±0,1. c. N. gonorrhoae sólo utiliza glucosa, produciendo acidificación del medio, sin producción de gas, lo cual se evidencia por el viraje de color rojo a amarillo. d. Kellog y Orwing determinaron que esta prueba tiene una sensibilidad de 97,6% y una especificidad de 100,0%. Pruebas de Sensibilidad a los Antimicrobianos para N. gonorrhoeae Introducción Las pruebas de susceptibilidad antimicrobiana están indicadas para cualquier microorganismo que contribuye a un proceso infeccioso en el que se justifique el uso de terapia antimicrobiana y cuando se sabe que el microorganismo pertenece a especies capaces de presentar resistencia a los agentes antimicrobianos comúnmente usados en el tratamiento. Las pruebas de susceptibilidad son también importantes en estudios epidemiológicos sobre la resistencia y cuando se estudian nuevas terapias. Las pruebas de susceptibilidad generalmente son útiles como una guía para la selección de antimicrobianos, en cada caso, o bien para la modificación de un tratamiento. En la actualidad, las técnicas para determinar la susceptibilidad de un microorganismo a un antimicrobiano pueden realizarse por los siguientes métodos: a) Método de dilución: Consiste en incorporar diluciones de un antimicrobiano a un medio de cultivo (caldo o agar), después se inocula el microorganismo a estudiar. La concentración más baja que inhibe completamente el crecimiento visible después de la incubación, se denomina Concentración Mínima Inhibitoria (CMI). b) Método de difusión con discos: En un medio de agar, sembrado uniformemente con el microorganismo en prueba, se colocan discos impregnados con antimicrobianos a concentraciones predeterminadas y después de un periodo de incubación se observa la susceptibilidad o resistencia de acuerdo a los patrones establecidos. c) Método de dilución y difusión con tiras: En un medio con agar, sembrado masiva y uniformemente con el microorganismo, se colocan tiras plásticas impregnadas con gradientes exponenciales y predefinidos del antimicrobiano, las cuales liberan de manera inmediata y efectiva el antibiótico sobre el agra, creando un gradiente contínuo de concentración debajo de la tira. Después de la incubación se puede distinguir una elipse de inhibición del crecimiento. El valor CMI es determinado en la escala de la tira donde la elipse intercepta. d) Métodos automatizados: En el comercio se encuentran diferentes aparatos que además de las pruebas de susceptibilidad, el sistema permite identificar a la bacteria, como por ejemplo, mini API, AutoBac o el MS-2 y los aparatos semiautomatizados (replicador de Steer). Cada método utilizado tiene sus ventajas y sus limitaciones y su utilidad dependerá de las necesidades y recursos de cada laboratorio. Las pruebas de sensibilidad deberán efectuarse en los siguientes casos: Para practicar encuestas epidemiológicas en laboratorios de referencia con objeto de obtener información básica sobre la sensibilidad y vigilar las tendencias de resistencia a medicamentos. En los laboratorios de ITS que practican gran número de pruebas, como complemento de los procedimientos utilizados para vigilar la eficacia clínica de las recomendaciones y orientar el tratamiento. Para el estudio de nuevos agentes antimicrobianos. Para facilitar la información a los clínicos, en caso de fracaso del tratamiento. Pueden utilizarse dos procedimientos diferentes: la difusión en disco y la determinación de la CIM por una técnica de dilución en agar. Solo se recomienda esta última para vigilar las tendencias de la resistencia medicamntosda y para el estudio de nuevos fármacos. Un método útil para laspruebas de sensibilidad a los antimicrobianos es el método de difusión en agar (Kirby Bauer) que pro su sencillez, rapidez, economía y reproducibilidad. DETECCIÓN DE CEPAS PRODUCTORAS DE BETA-LACTAMASA Desde el año 1976 se reporta la presencia de cepas productoras de betalactamasa (penicilinasa), así como de cepas resistentes a otros antibióticos utilizados en el tratamiento de la gonorrea. La prueba de susceptibilidad antibiótica para el gonococo comúnmente se realiza mediante el método de concentración inhibitoria mínima (CIM), con el objetivo de realizar vigilancia de resistencia antibiótica y evaluar los esquemas del tratamiento. OBJETIVO Establecer los procedimientos para realizar la detección de la enzima betalactamasa en cepas de gonococo. CONDICIONES GENERALES Haber realizado el aislamiento e identificación de N. gonorrhoeae. La cepa no debe estar contaminada y debe ser un cultivo joven, de preferencia, de subcultivo en agar chocolate enriquecido. Las técnicas que comúnmente utilizamos en el Laboratorio de Referencia Nacional son: Método de la cefalosporina cromógena, Cefinase (prueba directa). Método yodométrico rápido (prueba indirecta). MÉTODO DE LA CEFALOSPORINA CROMÓGENA, CEFINASE Fundamento Consiste en un disco de papel impregnado con cefalosporina cromógena (NITROCEFIN) que cambia de amarillo a rojo cuando el anillo beta-lactámico es hidrolizado por la enzima beta-lactamasa. Esta prueba tiene un amplio espectro de susceptibilidad , es fácil de realizar y no requiere de mucho tiempo. Procedimiento Con la ayuda de una pinza estéril, coger un disco por prueba a realizar y colocarlo dentro de una placa petri vacía. Humeder el disco con 1 gota de agua destilada estéril. Impregnar varias colonias de N. gonorrhoeae en la superficie del disco humedecido con un asa estéril o un mondadientes. Observa la reacción durante 1 a 5 minutos. Interpretación del método Si la cepa en estudio produce beta-lactamasa, el disco cambiará de amarillo a rojo Algoritmos Departamento de Enfermedades Emergentes y Urgencias LINEAMIENTOS PARA EL DIAGNÓSTICO DE ITS en Primer Nivel 2012 Infecciones de Transmisión Sexual Introducción Las infecciones de transmisión sexual (ITS) son un grupo de padecimientos de distribución mundial y en la actualidad constituyen el grupo más frecuente de enfermedades infecciosas en personas entre 15 y 50 años. Las cinco ITS clásicas son: gonorrea, sífilis, chancroide, linfogranuloma venéreo y el granuloma inguinal. Las ITS son un problema importante en salud pública, que se ha reconsiderado recientemente a partir de la descripción de su asociación con la infección por VIH, sobre todo de las ITS úlcerogenitales. Actualmente las enfermedades producidas por virus junto con Clamydia y Gardnerela, tienden a sustituir en importancia y frecuencia a las enfermedades bacterianas clásicas, por lo que estos agentes se consideran como la segunda generación de las ITS, ya que son más difíciles de identificar y tratar, además de que pueden desencadenar graves complicaciones que conducen a enfermedades crónicas, discapacidad e incluso la muerte. Aunque las tasas de infección para hombres y mujeres son muy similares, son estas últimas junto con los lactantes, las que sufren la mayoría de las complicaciones y secuelas graves. Las ITS en embarazadas pueden producir infecciones en el recién nacido (oftalmia neonatal, blenorragia, ceguera, etc.), partos prematuros o la muerte del producto antes de nacer y frecuentemente, la enfermedad pélvica inflamatoria es causa de infertilidad y embarazos ectópicos. Entre los microorganismos causantes de este tipo de enfermedades se encuentran diversos grupos de agentes, dentro de los cuales tenemos: Virus, bacterias, hongos, protozoarios y ectoparásitos. Durante las últimas dos décadas, el espectro de las ITS se ha expandido grandemente y actualmente incluye por lo menos 50 síndromes clínicos distintos, causados por más de 25 organismos patógenos conocidos, de esta manera, el mismo microorganismo puede causar diferentes síndromes y el mismo síndrome puede deberse a diferentes microorganismos. La identificación de estos agentes se realiza utilizando diversas metodologías según el tipo de microorganismo que está involucrado y los métodos utilizados son tan diversos como las observaciones en fresco, la identificación de los antígenos del agente en la muestra clínica, el aislamiento por cultivo, la evidencia del contacto con el agente mediante técnicas serológicas, etc. Obtención y manejo de la muestra La toma y manejo de muestras requieren condiciones especiales en cada caso y se recomienda que la muestra: 1) Se debe tomar cuando existe la sintomatología y en algunos casos en los contactos asintomáticos del caso 2) El paciente NO debe estar bajo tratamiento antimicrobiano 3) Para su toma se tienen que usar materiales adecuados, como los hisopos de alginato de calcio o de dacrón 4) Cuando se indique, la siembra para el aislamiento debe hacerse de inmediato y si no es posible, hay que emplear buenos medios de transporte, protegiendo la muestra de las condiciones ambientales principalmente de la desecación El tipo de muestra apropiada para el diagnóstico de infecciones de las vías genitales depende del sitio de la infección y del organismo responsable. Las infecciones de los genitales inferiores pueden ser clínicamente indistinguibles y ser causadas por diferentes agentes y cada uno requiere de técnicas de colección y aislamiento específicas. Por ello se recomienda una buena comunicación con el médico, para conocer la naturaleza de los agentes que sospecha como causales Existen casos en mujeres y en hombres donde es necesario muestrear otros sitios anatómicos, sobre todo en los pacientes que refieren contacto oro-genital, anogenital u oro-anal. Muestras de canal endocervical 1) Se utiliza un espejo para revisar el cérvix. Antes de tomar la muestra el exocervix se limpia con un hisopo de algodón para eliminar moco y exudado 2) .El hisopo debe introducirse dentro del canal endocervical de 2 a 4 cm, se rota presionando contra la pared y se saca, evitando el contacto con las superficies vaginales 3) Los hisopos recomendados son los de alginato de calcio o de dacrón, con mango de aluminio o plástico. No se recomienda el uso de hisopos de algodón. Si no se puede evitar el uso de este tipo de material, se recomienda agitar vigorosamente el hisopo en el medio de transporte, y luego presionarlo contra la pared del tubo para quitar el exceso de líquido. El hisopo se elimina de inmediato para prevenir la introducción de factores inhibitorios 4) El cepillo citológico se usa para agentes intracelulares y para toma de muestras para tinción de papanicolau y solo debe utilizarse después del uso del hisopo Muestras de canal vaginal Se coloca el espejo y se obtiene una muestra de la pared posterior vaginal, introduciendo el hisopo y dejando pocos segundos para la absorción de material. Si el himen está intacto, el espejo no debe ser utilizado, solo se introduce el hisopo en el orificio vaginal. Muestras de canal anal 1. Se coloca al paciente en posición supina (boca abajo) y se inserta un hisopo aproximadamente 3 cm dentro del canal anal 2. Con cuidado se rota el hisopo sobre las criptas del anillo anal y se esperan unos 30 seg para que se absorba la muestra Observación en fresco Las observaciones en fresco son de gran utilidad sobre todo en mujeres en las cuales existe exudado vaginal y en el caso de tricomoniosis, vaqinosis bacteriana y candidiasis. 1. La recolección se debe realizar del exudado vaginal del fórnix posterior utilizando un hisopo de algodón. 2. La muestra recolectada se coloca inmediatamente en un portaobjetos con una gota de solución salina fisiológica, se pone por encima el cubreobjetos y se observa inmediatamente al microscopio, con objetivo de 40X y poca iluminación. En el caso de exudado abundante, el hisopo se coloca en un tubo con 1 ml de solución salina y se observa inmediatamente. Gardnerella vaginalís es un bacilo pequeño con extremos redondeados, pleomórficos, Gram-negativos a Gram variables, no capsulados, no poseen flagelos, ni forman esporas. Existe discusión de si esta bacteria pertenece o no la flora normal, pues se ha aislado en mujeres que no tienen signos y síntomas, sin embargo la mayoría de los autores concuerdan que existe una fuerte correlación entre vaginosis bacteriana y el aislamiento de G. vaginalis. En 1983, Amsel, determinó que las muestras de exudado vaginal deberían de cumplir 3 de los 4 siguientes criterios para establecer un diagnóstico de vaginosis bacteriana: 1) Que el exudado sea homogéneo 2) Que el pH del exudado sea mayor de 4.5 (medición que se puede realizar con tiras reactivas de papel pH) 3) Que la prueba de KOH resulte positiva (al exudado que queda sobre el espejo vaginal se le añaden unas gotas de solución de KOH al 10% y se reporta como positiva si se desprende un olor característico a “pescado" el cual se debe a aminas volátiles). 4) Que se demuestre la presencia de células clave o células guía (que son células del epitelio vaginal con un aspecto granuloso, con límites poco precisos, llenas de bacilos que se observan en fresco o por la tinción de Gram). Estos criterios son muy útiles cuando no se cuenta con los medios adecuados para el aislamiento. Preparación de frotis 1) Mediante un hisopo o asa para cultivos se deposita una pequeña cantidad de muestra sobre un portaobjetos 2) La muestra se extiende sobre la superficie para obtener un frotis delgado. El frotis debe prepararse por rotación y no tallado para conservar así la integridad de las células presentes en la muestra (por ejemplo, polimorfonucleares) 3) Una vez obtenido el frotis, se deja secar completamente y se fija a la llama cuidando de no sobrecalentar 4) Se hace una tinción por el método de Gram y cuando es aconsejable, una de Giemsa o de Wright, ante la sospecha de Chlamydia De uno y de otro grupo hay múltiples pruebas, pero de ellas sólo muy pocas han quedado como verdaderamente útiles. La realización de estas pruebas es rápida y en general sencilla, sin embargo es conveniente que todo el personal que las realice esté perfectamente adiestrado en ellas y se lleven a cabo programas de control de calidad que aseguren la uniformidad en el diagnóstico serológico de la sífilis Con respecto a las pruebas serológicas, se sabe que existen situaciones en las que las técnicas, principalmente las que utilizan antígeno no treponémico pueden ser reactivas sin haber infección y contrariamente en formas tardías de sífilis pueden ser negativas. Agoritmos BIBLIOGRAFÍA 1. Dickinson B. Microbiology system. Manual of BBL products and laboratory procedures. Sixth edition; 1992. 2. Dickinson B. BBL paper discs for the determination of B-lactamase enzymes. 88-0080-1; 1992. 3. Dickinson B. GonoGen Ii. 88-102025; 1994. 4. Dillon JR, Li H. A laboratory course manual: identification and antimicrobial susceptibility testing of Neisseria gonorrhoeae. Third Edition. Ottawa-Canada: WHO/PAHO GASP Coordinating Center; 1994. 5. Ehret JM, Judson FN, Biddle JW. Gonorrhea. In: Wentworth BB, Judson FN. Laboratory methods for the diagnosis of sexually transmitted diseases. USA: American Public Health Association; 1984. p. 43-79. 6. Kellogg J, Orwig LK. Comparison of gono gen, gono gen II and micro trak direct fluorescent antibody test with carbohidrate fermentation for confirmation of culture isolates of Neisseria gonorrhoeae. J Clin Microbiol 1995; 33(2): 474-6. 7. Krieg NR. Bergey’s manual of systematic bacteriology. Vol. 1. Williams and Wilkins. Baltimore-London; 1984. 8. Morello JA, Janda W, Bohnhoff M. Neisseria and Branhamella. In: Lennette HE (Ed.). Manual of clinical microbiology. American Society for Microbiology. Fourth edition. USA; 1985. p. 176-92. 9. Organización Mundial de La Salud. Neisseria gonorrhoeae e infecciones gonocócicas. Ginebra: OMS; 1978. Serie de Técnicos 616. p. 156. 10. Organización Panamericana de la Salud. Guía técnica para el estudio de evaluación del riesgo microbiológico en la vía pública en ciudades de América Latina. OPS; 1994. 11. Sonnenwirth A, Jarett L. Métodos y diagnóstico del laboratorio clínico. 8°edición. Ed. Panamericana. Buenos Aires-Argentina; 1984. 12. Sonnenwirth A, Gradwohl JL. Métodos y diagnóstico del laboratorio clínico. 8° edición. Ed. Médico Panamericana. Buenos Aires; 1969.