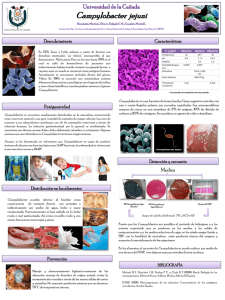
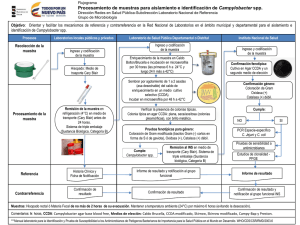
estudio para la implementacion del analisis de campylobacter spp
Anuncio

ESTUDIO PARA LA IMPLEMENTACION DEL ANALISIS DE CAMPYLOBACTER SPP SEGÚN LA METODOLOGIA USDA/FSIS MLG CAPITULO 6 1998 EN EL LABORATORIO LABSER DE RANCAGUA CHILE Vivian Arturo Canal Fabiola Silva Páez PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA INDUSTRIAL Rancagua (Chile) Septiembre 14 2007 ESTUDIO PARA LA IMPLEMENTACION DEL ANALISIS DE CAMPYLOBACTER SPP SEGÚN LA METODOLOGIA USDA/FSIS MLG CAPITULO 6 1998 EN EL LABORATORIO LABSER DE RANCAGUA CHILE Vivian Arturo Canal Fabiola Silva Páez TRABAJO DE GRADO Presentado como requisito parcial Para optar al título de Microbióloga industrial Directora: Astrid Maldonado Illesca PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA INDUSTRIAL Rancagua (Chile) Septiembre 14 2007 NOTA DE ADVERTENCIA Artículo 23 de la Resolución N° 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. ESTUDIO PARA LA IMPLEMENTACION DEL ANALISIS DE CAMPYLOBACTER SPP SEGÚN LA METODOLOGIA USDA/FSIS MLG CAPITULO 6 1998 EN EL LABORATORIO LABSER DE RANCAGUA CHILE Vivian Arturo Canal Fabiola Silva Páez APROBADO ________________________ Astrid Maldonado, Tec. Alimentos Director ________________________ Fernando Fuentes, Ing. Civil Bioquímico Jurado ________________________ Paulina Rojas, Mic. Industrial Asesor ________________________ Julio Gomez, Químico lab. Jurado ESTUDIO PARA LA IMPLEMENTACION DEL ANALISIS DE CAMPYLOBACTER SPP SEGÚN LA METODOLOGIA USDA/FSIS MLG CAPITULO 6 1998 EN EL LABORATORIO LABSER DE RANCAGUA CHILE Vivian Arturo Canal Fabiola Silva Páez APROBADO ________________________ Angela Umaña Muñoz, M.Phil Decano, Académico ________________________ David Gomes Méndez, M. Sc Director de carrera TABLA DE CONTENIDOS Pág. LISTA DE TABLAS vii RESUMEN viii ABSTRACT ix 1. INTRODUCCION 1 2. MARCO TEORICO 3 2.1 Historia 3 2.2 Características microbiológicas Campylobacter spp 3 2.2.1 Taxonomia 4 2.2.2 Morfología y características fisiológicas 4 2.2.3 Especies importantes 6 2.2.3.1 Especies termofilas 6 2.3 Vías de transmisión y alimentos implicados 2.4 Enfermedades en humanos 7 10 2.4.1 Epidemiología 10 2.4.2 Patogenia 10 2.4.3 Presentación clínica 11 2.4.4 Diagnostico de laboratorio 14 2.5 Enfermedades en animales 14 2.5.1 Campilobacteriosis 14 2.5.1.1 Campilobacteriosis genital bovina 15 2.5.1.1.1 Manifestaciones clínicas 15 2.5.1.1.2 Diagnostico 16 2.5.1.1.3 Control 16 2.6 Medios de cultivo y pruebas bioquímicas 17 2.7 Laboratorio LABSER 18 3. FORMULACION DEL PROBLEMA Y JUSTIFICACION 3.1Formulación del problema 20 20 -v- 3.2 Preguntas de investigación 20 3.3 Justificación de la investigación 20 4. OBJETIVOS 21 4.1 Objetivo general 21 4.2Objetivos específicos 21 5. MATERIALES Y METODOS 22 5.1 Materiales 22 5.1.1 Materiales para el aislamiento, identificación, y cuantificación de Campylobacter jejuni/coli en productos de carne y aves. 22 5.1.1.1 Equipos 22 5.1.1.2Reactivos 23 5.1.1.3 Medios de cultivo 23 5.1.2 Métodos 24 5.1.2.1 Preparación de medios de cultivo 24 5.1.2.2 Aislamiento y cuantificación 28 5.1.2.3 Identificación de Campylobacter 30 5.1.2.3.1Pruebas bioquímicas 5.2 Métodos 31 33 6. RESULTADOS Y DISCUSIÓN 34 6.1 Cotizaciones 34 6.1.1 Equipos 34 6.1.2 Reactivos 37 6.1.3 Medios de cultivo 37 6.2 Costo por análisis 38 7. CONCLUCIONES 48 8. RECOMENDACIONES 49 9. REFERENCIAS 50 - vi - LISTA DE TABLAS Pág. Tabla 1.Cotización Equipos 35 Tabla 2.Cotización Reactivos 35 Tabla 3.Cotización Medios de cultivo 36 Tabla 4.NMP Campylobacter spp en muestras de carne de vacuno o esponja 39 Tabla 5. NMP Campylobacter spp en muestras de carne de carcasa o carne de ave 41 Tabla 6. Aislamiento e identificación de Campylobacter spp en muestras de vacuno o esponja 43 Tabla 7. Aislamiento e identificación de Campylobacter spp en muestras de carcasa o carne de ave 45 - vii - RESUMEN En los laboratorios de alimentos es muy importante realizar un detallado análisis de Campylobacter spp ya que este microorganismo es la principal causa de infección entérica zoonótica en la mayor parte de países desarrollados, al igual que en los países en vía de desarrollo. En el presente trabajo se realizó un estudio económico – financiero en el laboratorio LABSER de Rancagua (Chile), con el objetivo principal de evaluar la implementación del análisis de Campylobacter spp según la metodología USDA/FSIS MLG- Capitulo 6, 1998. A través de este trabajo de campo se logró determinar cuales eran los equipos, reactivos y medios de cultivo necesarios para este análisis. Se realizaron diferentes cotizaciones, escogiendo los precios más bajos y por último se estableció cuál es el costo total del análisis que se ofrecerá a los clientes, basado en los insumos, hora-hombre, gestión de calidad y costos indirectos. Con este estudio se comprobó que la metodología USDA/FSIS MLG Capitulo 6 1998 es muy costosa, y no es conveniente su implementación debido a la alta inversión en los equipos y al reducido número de muestras que llegan al laboratorio. - viii - ABSTRACT In the food laboratories is very important to make the analysis of Campylobacter spp since this microorganism is the main cause of zoonótica enteric infection in most of the developed countries like in those in way of development. In the present work, an economic and financier study was made in laboratory LABSER of Rancagua - Chile to see if the implementation of the analysis of Campylobacter spp is possible according to methodology USDA/FSIS MLG Chapter 6 1998 used The equipment, reagents and crops were identified for this analysis. Different quotations were made, choosing the low prices to establish the cost of the analysis that will be offered to the clients, based on inputs, hours per men, indirect management of quality and costs. With this study, it was verified that the methodology USDA/FSIS MLG Chapter 6 1998 is too expensive, and is not advisable his implementation due to the high investment in the equipment and because the number of samples that arrived at the laboratory are reduced. - ix - 1. INTRODUCCION Campylobacter spp es la principal causa de infección entérica zoonótica en la mayor parte de los países desarrollados como en los de desarrollo y su incidencia reportada se ha incrementado marcadamente en los últimos 20 años. El reservorio natural de Campylobacter spp es el tracto intestinal de animales de sangre caliente. El diagnóstico de Campylobacter indica que alrededor del 95% de las infecciones por Campylobacter son causadas por Campylobacter jejuni o Campylobacter coli; estas dos son responsables de la mayoría de enfermedades en humanos. Las enteritis relacionadas a Campylobacter spp han emergido como una de las formas de enfermedades diarreicas de mayor incremento en países desarrollados. Con la aplicación técnicas mejoradas para su aislamiento se ha podido comprobar que la incidencia de Campylobacter en estos países es superior a Salmonella. Actualmente son considerados como la bacteria que más comúnmente causa enteritis en el mundo siendo su incidencia mayor en niños y jóvenes, decreciendo con la edad. El mecanismo de transmisión más frecuente es la ingestión de agua y alimentos contaminados. Por la importancia epidemiológica de este patógeno bacteriano, su aislamiento y caracterización es muy importante en muestras de alimentos, principalmente en productos carnicos. El laboratorio LABSER cuenta con diversos análisis de gran importancia en el área de microbiología, pero hace falta el análisis de Campylobacter spp que es un microorganismo muy común en alimentos. Por esta razón se quiere implementar este análisis en el laboratorio. Para llevar acabo esta implementación es importante hacer un análisis de costos de lo que esta implica y así determinar si es posible hacerla o no. El estudio económico que se realizo en el presente trabajo esta basado en hacer una comparación de precios de insumos que las diferentes casas comerciales de productos microbiológicos proponen, además determinar cuales son los equipos que se utilizan en este análisis con los que el laboratorio no cuenta y cual debe ser -1- su inversión para obtenerlos y por ultimo establecer el costo del análisis para los clientes; basándose en insumos, horas/hombres, gestión de calidad, costos indirectos etc. -2- 2. MARCO TEORICO 2.1 Historia Las primeras observaciones de bacterias semejantes a Campylobacter fueron realizadas por Escherich en 1886 a partir de materia fecal de niños y de gatos con diarrea. Aunque no pudo realizar los aislamientos, Escherich denominó Vibrio felinus a las bacterias observadas sólo microscópicamente. Los primeros aislamientos de especies del género Campylobacter fueron realizados en el área de microbiología veterinaria, en 1909 y 1913. Mac Fadyean y Stockmann y posteriormente Smith en 1918 establecieron la participación de una bacteria microaerófila en el aborto del ganado bovino y ovino, de morfología similar a las especies del género Vibrio, por lo que se la denominó Vibrio fetus. En 1931, Jones y Little aislaron a partir de bovinos con disturbios intestinales un “vibrión” microaerófilo, al que denominaron Vibrio jejuni. En 1944, Doyle describió un “vibrión” aislado del intestino de cerdos con diarrea y lo denominó Vibrio coli. La primera asociación entre estas bacterias curvas y diarrea en el hombre fue sugerida por Levy en 1946, el que realizó un estudio en un brote de gastroenteritis sobre 357 pacientes en dos establecimientos penales en Illinois, observando en exámenes directos la presencia de formas bacterianas semejantes a Vibrio en el 20% de las muestras. En 1957, E. King, estudiando las características de estos “vibrios” aislados de diferentes fuentes, estableció que no todos correspondían a Vibrio fetus, determinando dos grupos con características serológicas y bioquímicas diferentes. Mientras algunos eran capaces de crecer a 25 y 37°C, otros lo hacían a 42°C. A estos últimos se los consideró como “Vibrios relacionados” (related Vibrios) sugiriendo que eran agentes de diarrea aguda. En 1963, Sébald y Veron proponen la creación del género Campylobacter para incluir estas bacterias. En la década del 70, Butzler y Skirrow, Bolton y Robertson, Blaser y Col, desarrollaron medios selectivos que permitieron aislar estos microorganismos con relativa facilidad y establecer su participación en diferentes cuadros infecciosos en el hombre. -3- En 1972 Dekeyser y Butzler aislaron los microorganismos de las heces de pacientes con enteritis aguda usando una técnica de filtración que permitía el pasaje de pequeños bastones curvos a través de una membrana, pero retenía microorganismos fecales más grandes. Esta técnica se utiliza actualmente para el aislamiento de otras especies del género, diferentes de C. jejuni o C. coli como son, por ejemplo, C. upsaliensis, C. hyointestinalis y C. jejuni subsp. doylei. (Fernández, 2003) 2.2 Características microbiológicas Campylobacter spp 2.2.1 Taxonomía: Las primeras especies de este género fueron identificadas hace más de 90 años en animales, pero no fue sino hasta 1970 cuando se reconoció como patógeno humano. Inicialmente incluidos dentro del género Vibrio, Sin embargo, mas tarde, debido a que presentan diferencias fundamentales con relación a la constitución del DNA y por su incapacidad de fermentar los hidratos de carbono, fueron agrupados en un nuevo género bacteriano denominado Campylobacter (campylo = curvo) (bacter = bacteria). Actualmente se han incorporado nuevas especies y se ha creado la familia Campylobacteriaceae, la cual está compuesta por dos géneros: Campylobacter y Arcobacter; y un género de afiliación incierta Helicobacter. Las diferencias fundamentales entre los géneros de Campylobacter y Arcobacter son que Campylobacter no puede crecer a 15°C, es móvil por un solo flagelo polar en uno o sus dos extremos y en cultivos viejos degeneran a formas cocoides; Arcobacter tiene un solo flagelo, crece bien a bajas temperaturas (17°C) pero mal a 37°C y 42°C, a 30°C pueden crecer aeróbicamente. (Ministerio de Salud, 2001) (http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi? CMD =&DB=taxonomy) 2.2.2 Morfología y características fisiológicas: El género Campylobacter pertenece a la familia Campylobacteriaceae. Estas bacterias son patógenas o comensalistas agrupan bacilos Gram negativos -4- pequeños (0.3-0.6 µm de diámetro, 0.5-5 µm de ancho), no formadores de esporas curvos, espirilados o en forma de S que presenta un flagelo polar único en uno o ambos extremos que les confiere motilidad. Son microaerofílicos capaces de crecer en una atmósfera de 5% de oxígeno, 10% de dióxido de carbono y 85% de nitrógeno. En cultivos de varios días (mas de tres) degeneran en formas esféricas u ovoides que han perdido su viabilidad. La mayoría de estas bacterias crecen a una temperatura de 37 °C, a excepción de Campylobacter jejuni que crece a 42, por lo que es práctica habitual en el laboratorio la incubación a esta temperatura con el fin de facilitar el aislamiento selectivo. Su velocidad de desarrollo es más lenta que la de las bacterias de la flora normal entérica, por lo que para su aislamiento a partir de materias fecales se requieren medios de cultivo selectivos que inhiban esta flora. Los Campylobacter son organismos de lento crecimiento. Las especies de Campylobacter (C. coli, C. concisus, C. curvus, C. fetus, C. gracilis C. helveticus, C. hyointestinalis, C. jejuni, C. lari, C. mucosalis, C. rectus, C. showae, C. sputorum y C. upsaliensis) han sido asociadas con múltiples enfermedades en animales y humanos. Las dos bacterias de mayor importancia clínica como agentes causales de la campilobacteriosis humana son C. jejuni y C. coli. Por lo general se multiplican en forma lenta, en medios enriquecidos como el de Skirrow, Butzler y Campy-Bap; los dos últimos contienen el antibiótico cefalotina que inhibe el crecimiento de Campylobacter fetus. Para su caracterización bioquímica se realizan las pruebas de catalasa, oxidasa y la hidrólisis del hipurato. También puede ser diagnosticada con muestras frescas de materia fecal observadas al microscopio con tinción de Gram. Campylobacter puede ser diagnosticado utilizando Kits comerciales para una detección directa de antígenos presentes en las heces, utilizando la técnica aglutinación en látex. La técnica de PCR (reacción en cadena de la polimerasa) también se utiliza para detectar diferentes campylobacterias, es rápida y se tienen los resultados el mismo día, la desventaja que existe es que es costosa. (García, 2007) (http://www.bvsops.org.uy/pdf/campylobacter.pdf ) (Malavez, 2005) (Ministerio de Salud, 2001) -5- 2.2.3 Especies importantes C. fetus ss. venerealis, C. fetus ss. fetus, C. jejuni, C. sputorum ss. sutorum, bubulus y mucosalis, C. coli, C. concisus, C. hyointestinalis. Los diferentes serotipos se definen con base en los antigénos somáticos y flagelares. (Velasco, 2002) 2.2.3.1 Especies termofilas Son aquellas capaces de crecer a 42-43°C pero no a 25°C, comprende C. jejuni (subespecies jejuni y doylei), C. coli, C. laridi (biovar ureasa + y -), y C. upsaliensis. De este grupo, Campylobacter jejuni (subespecie jejuni) es agente causal de diarreas, siendo considerado el más virulento por su mayor resistencia a la fagocitosis; luego le sigue Campylobacter coli, pero se considera que la diarrea que produce es más benigna. Ambos se encuentran como comensales en el tracto gastrointestinal de un amplio grupo de animales a los cuales se ha adaptado perfectamente, es por ello que su temperatura óptima de desarrollo es a 42-43°C. Infecciones extraintestinales pueden ocurrir raramente en huéspedes normales; en pacientes HIV positivos e inmunocomprometidos pueden producir bacteriemias, bursitis, artritis, infecciones del tracto urinario, endocarditis, peritonitis, aborto y sepsis neonatal. Campylobacter lari ha sido aislado de intestino de gaviotas, de otros animales y también del hombre. Su rol patógeno para este último aún no está definido. La diferencia con los otros dos enteropatógenos está en que es negativo para la prueba de indoxyl acetato. Campylobacter upsaliensis raramente es aislado de diarreas, produce bacteriemias en huéspedes inmunocomprometidos. Son más resistentes al poder bactericida del suero que las otras especies termófilas, por lo que puede sobrevivir en sangre. Si bien su fuente de infección no está bien definida, se ha relacionado con animales, especialmente perros, alimentos como leche no pasteurizada y sus derivados. Campylobacter fetus (subsp. fetus y veneralis) son microorganismos de gran importancia veterinaria producen aborto esporádico en el ganado bovino y ovino. Para el humano C. fetus subsp. fetus es considerado un patógenos oportunista, provocando infecciones sistémicas en pacientes debilitados o inmunosuprimidos, se aísla de intestino de ovejas, vacas y cerdos. C. fetus subsp. veneralis se -6- encuentra frecuentemente en el aparato genital de vacas causando infertilidad. La diferencia entre ambas subespecies es la capacidad de crecer en 1% de glicina de C. fetus subsp. fetus. Campylobacter hyointestinalis se ha recuperado de hisopados réctales de hombres homosexuales con proctitis. Anteriormente solo era hallado en animales, sobre todo como causa de ileitis en cerdos. Presenta reacciones bioquímicas similares a C. fetus subsp fetus, pero a diferencia de este también puede crecer a 42°C y produce H2S en TSI. Campylobacter consisus y Campylobacter rectus se aíslan de pacientes con enfermedad periodontal, infecciones intestinales y bacteriemia. Campylobacter sputorum biovar sputorum forma parte de la flora normal de la boca e intestino humano, ha sido aislado de forúnculos perianales y abscesos pulmonares. Campylobacter sputorum biovar bubulus es un comensal de ovejas y vacas, se ha aislado de forúnculos y abscesos en hígado, escroto, ingle y axilas humanas en personas que trabajan en el campo. Campylobacter showae es una especie recientemente descrita, aislada de enfermedad periodontal, presenta la particularidad de tener múltiples flagelos. (Ministerio de salud, 2001) 2.3 Vías de transmisión y alimentos implicados Varias especies de Campylobacter se encuentran como comensales en el tracto gastrointestinal de animales salvajes y domésticos. Los principales reservorios los constituyen el ganado bovino, ovino y suino, roedores, perros y gatos. Otro reservorio principal son las aves, donde está presente como saprofito y también como patógeno entérico ocasional. El espectro de reservorios varía con la especie: C.jejuni tiene un reservorio amplio, mientras que C.coli es más frecuentemente aislado en suinos. La adquisición primaria del germen por los animales ocurre generalmente temprano en la vida y puede ser causa de morbimortalidad en estos animales, pero la mayoría de las veces la colonización conduce a un estado de portador de por vida. (http://www.bvsops.org.uy/pdf/campylobacter.pdf) (Canals, A). -7- La mayoría de las infecciones se originan por consumo de alimentos de origen animal, sobretodo la carne de pollo y derivados de aves. Otros alimentos implicados son las carnes rojas, despojos, moluscos, leche y quesos no pasteurizados y aguas no cloradas. La transmisión de la enfermedad se produce principalmente por contaminaciones cruzadas entre los alimentos, donde los manipuladores de alimentos, con sus prácticas higiénicas, tienen una importancia fundamental. La transmisión por los manipuladores (portadores), es poco frecuente ya que en el hombre, el Campylobacter spp., es un huésped transitorio, y por tanto, una fuente poco importante de infección. El microorganismo se elimina por el tratamiento térmico (cocción). No sobrevive en las cocinas domésticas ni los tratamientos culinarios tradicionales. La dosis infectiva del Campylobacter spp. es baja si la comparamos con la de Salmonella spp. Se ha demostrado experimentalmente, que entre 500-800 células microbianas son suficientes para instaurar la enfermedad; y que por debajo de 100 células la enfermedad no se desarrolla. Estas diferencias se deben a variaciones del pH del jugo gástrico del huésped y del tipo de alimento consumido. La leche y alimentos grasos, permiten salvar la barrera ácida del estómago y producir la infección de forma más fácil. Está demostrado que la carne de pollo es sin duda la fuente de infección más importante. Diferentes estudios epidemiológicos han establecido que entre el 5070 % de las infecciones esporádicas de origen alimentario por Campylobacter spp. se deben al consumo o manipulación de la carne de pollo poco hecha (por contaminación de estas carnes con otros alimentos, por contaminación con las superficies de contacto o las superficies de corte utilizadas). Lo que no está del todo claro es la fuente de infección principal. Se sabe que la mayoría de las explotaciones avícolas de engorde están infectadas con C. jejuni. Las camas y agua no clorada, han estado vinculadas como vehículos de introducción y transmisión de la infección. Las jaulas, ropa, manos y calzado del personal de las explotaciones avícolas, también pueden ser vías de entrada del microorganismo. Otras fuentes podrían ser los animales domésticos o salvajes alrededor de la explotación. -8- Una vez ha entrado en la explotación, el Campylobacter spp. se disemina y coloniza el intestino de los pollos de engorde (entre 14 y 49 días de edad). Estos pollos irán la mayoría al matadero para su sacrificio, y en este transporte de la granja al matadero, por tener un contacto directo entre ellos, hace que se aumente hasta 1000 veces el grado de contaminación superficial de estos animales, sobretodo por las heces de los animales. En el matadero, en el proceso del faenado, se contaminan la mayoría de los equipos y de las herramientas, así como superficies de contacto, y maquinarias. Unos estudios, aparecidos en junio del 2001, por el Departamento de Agricultura de los Estados Unidos, Servicio de Investigación Agraria, han desvelado que la superficie del huevo fértil en el momento de la eclosión sería uno de los vehículos principales de transmisión del Campylobacter spp., en las explotaciones avícolas. (Canals, A) El agua contaminada puede ser la fuente de brotes de Campylobacteriosis, sobre todo por el consumo de la misma y en vinculación con actividades recreacionales. También, bajo condiciones que favorecen la replicación del germen, la contaminación fecal del suelo puede ser origen de infección humana, principalmente por el consumo de vegetales cosechados en ellas. En los países industrializados el microorganismo se transmite principalmente a través de alimentos de origen animal, mientras que en los países menos desarrollados predominan la transmisión por alimentos y aguas contaminadas con excretas así como el contacto directo con personas o animales enfermos. La transmisión de C.jejuni se ve minimizada a temperatura ambiente o menor; además los alimentos no constituyen un sustrato favorable para su desarrollo. Estos dos hechos sugieren que la ocurrencia de ETA por este agente refleja condiciones muy inadecuadas en el manejo de los alimentos (mala refrigeración, malas condiciones de higiene, etc.). Por otra parte, en todas partes del mundo el número de casos aumenta en verano y principios del otoño, coincidiendo con el aumento de la temperatura ambiental. (http://www.bvsops.org.uy/pdf/campylobacter.pdf) -9- 2.4 Enfermedades en humanos 2.4.1 Epidemiología La campylobacteriosis es una zoonosis de distribución mundial. Las especies diarreogénicas de Campylobacter spp se encuentran habitualmente como comensales del tracto gastrointestinal de una gran variedad de mamíferos y de aves, tanto domésticos como de vida libre. Muchos de los casos de enteritis humana han sido asociados al contacto con animales, agua o alimentos de origen animal especialmente de aves contaminados con estas bacterias. En países industrializados, Campylobacter es el primer agente de diarrea. La enfermedad es más frecuente en los meses de verano. Se considera que un alto porcentaje de infecciones es provocado por consumo de carne de ave mal cocida o por contaminación cruzada al momento de preparar alimentos. En países en vías de desarrollo Campylobacter es el segundo o tercer agente de diarrea, según sea el lugar geográfico. La enfermedad afecta a todas las edades pero parece ser más frecuente en niños de corta edad, menores de 4 años y adultos jóvenes de 15 a 44 años de edad. Los individuos con HIV (SIDA) tienen un alto riesgo de adquirir la infección por Campylobacter, además de que ésta puede ser invasiva. C. jejuni y C. coli son causas importantes de diarreas agudas en viajeros que visitan zonas en vías de desarrollo. No soportan durante mucho tiempo situaciones de desecación o congelamiento, características que limitan su transmisión. Sobreviven en la leche, otros alimentos o el agua a 4°C durante una semana. De la misma forma que con otros patógenos entéricos, es importante tener presente, para efectos de prevención, la transmisión fecal-oral de persona a persona sobre todo en lactantes, que no controlan esfínteres. (Fernández, 2003) ( Kapperud, 1994) 2.4.2 Patogenia El daño al huésped y las manifestaciones clínicas dependen principalmente de dos factores: el inóculo ingerido y el estado inmunológico del huésped. - 10 - El principal mecanismo de patogenicidad es la invasión de la mucosa intestinal, en forma similar a como lo hace Shigella. La invasión de la lámina propia se observa tanto a nivel del intestino delgado como del colon, y el resultado es generalmente una enterocolitis inespecífica, que puede incluir los siguientes hallazgos: degeneración y atrofia glandular, pérdida de la producción de mucus, abscesos de las criptas, y ulceración de la mucosa epitelial. En otros casos, las características patológicas son similares a las observadas en infecciones por Salmonella o Shigella. Parece evidente que el lipopolisacárido de la pared bacteriana, con actividad endotóxica típica, desempeña un rol central en el daño inflamatorio. Aunque se han reconocido una toxina termo-lábil similar a la de Vibrio cholerae y varias citotóxinas, la producción in vivo e in vitro de éstas parece de bajo nivel por lo que se duda que tenga alguna significación en la patogenia. Se cree que Campylobacter puede jugar un papel en el Síndrome de GuillainBarré (SGB) por un mecanismo que involucraría la similitud entre el ácido siálico de algunos antígenos O y los gangliósidos humanos. (Blazer, 2000) Las campilobacterias producen proteínas citotóxicas que pueden intervenir en el desarrollo clínico de la enfermedad, además poseen toxinas extracelulares con actividad citopática y enterotoxinas clásicas, parecidas a las de Escherichia coli. (http://www.bvsops.org.uy/pdf/campylobacter.pdf) (Noordzij, 2002).Además se ha demostrado la producción de citotóxinas sobre células CHO, HeLa y Vero, entre las que destaca la cytolethal distending toxin que tiene la capacidad de producir distensión y posterior muerte celular. 2.4.3 Presentación clínica La gastroenteritis aguda causada por Campylobacter se caracteriza por una rápida elevación de la temperatura, acompañada de malestar general, dolor abdominal, calambres y retortijones. La infección gastrointestinal por lo general es autolimitada. El periodo de incubación es de 2 a 5 días, pero puede extenderse hasta los 10 días. Se ha observado que el 50% de los pacientes con diarrea es precedida por un periodo febril, malestar generalizado, mialgia, dolor abdominal y fiebre que puede llegar a los 40 °C. Es habitual que se presente un periodo - 11 - prodrómico con fiebre, cefalea, mialgia y malestar general entre 12 y 24 h, antes del inicio de los síntomas. Al inicio de la infección la materia fecal es acuosa, pero a medida que progresa la enfermedad ésta se torna sanguinolenta con tenesmo, el cual es un síntoma común. Las deposiciones, disgregadas o acuosas, pueden ser mucosanguinolentas, son oscuras, con mayor olor, ligeramente verdosas. En el análisis de las heces al microscopio se observa un exudado inflamatorio con infiltrado de leucocitos, así como un gran número de campylobacterias, las cuales pueden reconocerse por sus características morfológicas. Con frecuencia se ven células de inflamación y un predominio de microorganismos de formas curvas y espirilares. La presentación puede ser variable, desde una forma leve de corta duración a un cuadro más severo y prolongado con características similares a Shigellosis o Salmonelosis. Los casos mas leves no requieren de tratamiento antimicrobiano, la presentación más grave o recidivante se trata; la droga de elección es la eritromicina. En los neonatos puede presentarse con una o más deposiciones sanguinolentas y ningún otro síntoma. También se puede desarrollar solo una fiebre tan severa y persistente que es necesario diferenciar de fiebre tifoidea. En pacientes inmunosuprimidos puede presentarse colecistitis aguda, pancreatitis, cistitis, artritis reactiva y otras complicaciones como síndrome urémico hemolítico, nefritis intersticial, hepatitis y síndrome de Guillén-Barré. Debido a la progresión de la enfermedad en adultos jóvenes, la infección por Campylobacter jejuni, presenta un cuadro que se le puede confundir con colitis ulcerosa o enfermedad de Crohn. En la materia fecal puede observarse sangre fresca al tercer día. La diarrea puede oscilar en severidad desde materia fecal blanda hasta líquida o sanguinolenta. Puede haber más de 10 evacuaciones en el peor día de la enfermedad. El dolor abdominal puede ser de tipo cólico que disminuye durante la defecación. Es raro que se presente vómito. La diarrea puede continuar por 2 ó 3 días, así como también pueden persistir el dolor abdominal y malestar aun cuando no haya diarrea. - 12 - En una proporción significativa de pacientes infectados por Campylobacter jejuni las heces pueden contener sangre fresca, pus o moco, sugiriendo una inflamación colorrectal, lo cual no es raro. La sigmoidoscopia revela anormalidades de la mucosa que van desde un edema o una congestión con o sin hemorragia petequial, hasta una mucosa dañada severamente parecida a tejido carcinogénico. El dolor abdominal severo puede llegar a confundirse con una peritonitis aguda. Ocasionalmente estos pacientes, principalmente adolescentes y adultos jóvenes, pueden desarrollar una peritonitis de una apendicitis aguda, pero en la mayoría de éstos se observa una inflamación del íleon y el yeyuno con adenitis mesentérica. Puede haber complicaciones locales como la colecistitis, pancreatitis y peritonitis. La infección también puede manifestarse como una colitis aguda con síntomas de fiebre, cólicos abdominales y diarrea sanguinolenta, que persiste durante una semana o más. Se ha documentado que personas deficientes en inmunoglobulinas (Igs), las infecciones por campylobacterias pueden ser prolongadas, severas y recurrentes, con frecuencia desarrollando bacteriemia y otras manifestaciones extraintestinales, tales como lesiones cutáneas erisipeloides, osteomielitis. Además, varias semanas después de la infección, puede aparecer artritis reactiva en personas que portan los antígenos de histocompatibilidad HLA-B2. Las infecciones extraintestinales por Campylobacter como meningitis, osteomielitis y sepsis neonatal son raras, pero se han llegado a observar; se ha reconocido Campylobacter jejuni asociada con pacientes que padecen síndrome de Guillain-Barré. El síndrome de Guillain-Barré es una afección autoinmune del sistema nervioso periférico que produce parálisis fláccida aguda. El síndrome se ha llegado a correlacionar a una infección previa por Campilobacter jejuni hasta en un 40% de los casos, demostrándose que este síndrome se produce como consecuencia del ataque inmune debido al mimetismo molecular que existe entre algunas moléculas del lipopolisacárido (LPS) de cepas de C. jejuni y los gangliósidos del tejido nervioso humano, siendo los más severos y que requieren de hospitalización rápida. Algunos serotipos de C. jejuni también están asociados al SGB. (Ministerio de Salud, 2001) (García, 2007). - 13 - 2.4.4 Diagnóstico de laboratorio. El examen directo de las heces es una herramienta de utilidad en la investigación inicial del paciente con enteritis. La microscopía de campo oscuro o de contraste de fases, sobre todo en la fase aguda de la enfermedad, puede revelar la movilidad característica de Campylobacter que aporta un diagnóstico presuntivo en forma rápida. También pueden observarse frotis teñidos por técnica de Gram modificado para observar bacilos-gramnegativos sugestivos del germen, pero la sensibilidad de este método es de 50-75%. La microscopía directa también sirve para demostrar hematíes y polimorfonucleares que están presentes en las heces de la mayoría de los pacientes con enteritis por Campylobacter. El diagnóstico se confirma mediante el aislamiento del germen en medios especiales, según ya se describió. Se debe señalar que el cultivo cobra especial importancia en el diagnóstico de enfermedad sistémica ya que es la única forma de demostrar bacteriemia. 2.5 Enfermedades en animales: C. fetus ss. fetus: aborto en ovinos. C. fetus ss. venerealis: infertilidad, reabsorciones embrionarias y en algunas ocasiones aborto. C. sputorum ss. mucosalis y C. hyointestinalis: asociados a enteritis proliferativa en cerdos. 2.5.1 Campilobacteriosis Antiguamente conocida como vibriosis, esta enfermedad de ovejas y cabras es causada por Campilobacter fetus var.fetus, que no es el agente causal de la vibriosis bovina. La campilobacteriosis causa abortos tardíos en ovejas, pero raramente afecta a cabras. Las ovejas se enferman por ingestión de forrajes o agua contaminadas por descargas vaginales o fecales de otras ovejas que hayan abortado. Esta es una enfermedad que puede causar tormentas de abortos cuando ingresa por primera - 14 - vez a una majada no inmunizada, y Campilobacter generalmente es traído por ovejas compradas o ingresadas por cualquier motivo. La enfermedad deja una inmunidad sólida luego de provocar abortos o un aumento en la mortalidad perinatal. Los abortos son tardíos, y las ovejas no se ven enfermas, aunque alguna puede morir de peritonitis. Los fetos abortados aparecen frecuentemente "ventrudos" por el agrandamiento del hígado, en el que se encuentran focos necróticos blanquecinos del tamaño de una nuez y forma redondeada. Además hay colectas líquidas en cavidad abdominal. El diagnóstico se confirma por aislamiento o por microscopía de campo oscuro, que permite identificar el agente causal en una muestra de contenido estomacal del feto o de los fluidos vaginales de la oveja o de la placenta. Se deben eliminar los restos orgánicos y fetos abortados para evitar la difusión de la enfermedad, y toda la manada debería tratarse inmediatamente con tetraciclina por vía oral, comenzando con 400 mg/oveja/día durante 3 días para luego disminuir a la mitad hasta terminar los partos. También pueden tratarse por inyección de tetraciclinas de larga acción. (http://www.acampo.com.ar/espanol/ot_gan/ot_gan2.htm) 2.5.1.1 Campylobacteriosis genital bovina La Campylobacteriosis Genital Bovina (CGB) es una enfermedad asociada a infertilidad, repetición de celos y ocasionales abortos. Es de transmisión venérea y afecta al ganado lechero y de carne. El agente etiológico es el Campylobacter fetus (C.fetus) con 2 subespecies: venerealis y fetus. La subespecie venerealis, a su vez, tiene 2 biotipos: intermedius y Dedié. La subespecie fetus incluye los tipos 1 (cepas intermediarias) y 2. Esta diferenciación se realiza por biotipificación. 2.5.1.1.1Manifestaciones clínicas El toro es el portador asintomático de la enfermedad, no afectándose su capacidad reproductiva. Campylobacter fetus habita en las criptas prepuciales del toro. En los toros adultos estas criptas son mayores en número y en medida por lo que - 15 - contendrían un número importante de bacterias en su interior. El toro juega un rol importante en la transmisión de la enfermedad asociado al factor etáreo. En la hembra se manifiesta por ciclos estrales largos, repeticiones de celo, disminución del porcentaje de preñez, debida a mortalidad embrionaria y abortos que no suelen superar el 10 %. Campylobacter fetus habita en la hembra en las mucosas del útero, cérvix y vagina. La infertilidad en la hembra está relacionada con la restricción de O2 que provoca el ingreso de C. fetus en el útero, la acción de la mucinasa que despolimeriza el mucus vaginal y por la endometritis mucopurulenta subaguda. 2.5.1.1.2Diagnostico El diagnóstico se realiza en los machos, en las hembras y en los fetos. En el toro se efectúan 3 raspajes prepuciales con intervalo de 7 a 10 días para evitar falsos negativos. También se puede analizar el semen ya sea fresco o congelado. En las hembras el material de elección es el mucus vaginal o descargas uterinas de animales abortados, utilizándose para su extracción la pipeta de inseminación. En el caso de fetos, el líquido abomasal y el pulmón son los materiales de elección para aislar Campylobacter fetus. El aislamiento del microorganismo permite obtener la certeza del diagnóstico y la biotipificación diferencia las subespecies venerealis y fetus y el biotipo intermedius. Actualmente también se puede clasificar subespecies de C. fetus por técnicas de biología molecular como el PCR. También se utiliza para diagnóstico la técnica de Inmunofluorescencia Directa como método de “screening”, tanto para machos como para hembras y fetos. Es una técnica sensible y específica pero tiene el inconveniente de no diferenciar subespecies de C. fetus. 2.5.1.1.3Control El control de la enfermedad es posible siempre y cuando se adopten medidas de manejo, tratamientos con antibióticos en machos y vacunaciones sistemáticas de todos los bovinos que entren a servicio. La mayoría de los establecimientos de cría no han adoptado tecnologías para lograr un buen control reproductivo. Medidas simples como son el - 16 - estacionamiento del servicio, el uso de toros jóvenes y con certificado sanitario que los acredite como libres de Campylobacter fetus, no rotar los toros durante el servicio, el realizar por lo menos 3 muestreos a partir de los 30 días de retirados los toros del servicio con intervalos de 7 a 10 días, son instrumentadas en muy pocos establecimientos. (http://www.produccionbovina.com/sanidad_intoxicaciones_metabolicos/enferme dades_reproduccion/08-enfermedades_afectan_reproduccion.htm.). 2.6 Medios de cultivo y pruebas bioquímicas En este análisis se utilizan varios medios de cultivo y pruebas bioquímicas, entre ellos están: Caldo y agar Brucella: Contiene los componentes mínimos requeridos para el crecimiento de Campylobacter, como peptona, extracto de levadura, dextrosa, bisulfito de sodio, etc. Agar Brucella BBL: Este medio de cultivo contiene sangre de caballo por la cual el microorganismo presenta reacciones hemolíticas. Suplemento FBP: Este suplemento favorece el crecimiento y la aerotolerancia de Campylobacter. (DIFCO) Agar MCCDA: El uso de este medio es específico por el ministerio de agricultura, pesqueras y productos alimenticios, el suplemento CCDA inhibe el crecimiento de levaduras, hongos y enterobacterias. (MERCK) Oxidasa: La presencia de citocromo C oxidasa en la cadena de trasporte de epuede detectarse utilizando un aceptor de e- artificial p-fenilendiamina. Es una prueba que detecta la presencia del enzima citocromooxidasa. La enzima - 17 - citocromooxidasa, en presencia de oxígeno atmosférico, oxida el reactivo fenilendiamina oxidasa para formar un compuesto coloreado: indofenol. Catalasa: La catalasa es una enzima que protege a las células frente al peróxido de hidrógeno producido en el metabolismo del oxígeno. Se basa en la capacidad del enzima catalasa de descomponer el peróxido de hidrógeno añadido, formándose agua y O2, el cual se libera en forma de burbujas. Excluyendo los estreptococos, la mayoría de las bacterias aerobias y anaerobias facultativas poseen actividad catalasa. (http://chopo.cnice.mecd.es/~gdiaz3/apuntes/UT162.pdf) Fermentación de la glucosa: Mediante esta prueba se puede determinar la capacidad que tiene el microorganismo de fermentar un azúcar como la glucosa. Para esto se utiliza el indicador de pH rojo de fenol, el cual cambia de color en cuanto el pH del medio cambia, observándose acido (amarillo) cuando el azúcar fue fermentada y alcalino (rojo) cuando no. Sensibilidad a antibióticos: Muchos microorganismos presentan sensibilidad o no a cierto tipo de antibióticos. Mediante estas pruebas se puede determinar que tan sensibles son frente a cualquier antibiótico. Esto se define observando el halo de inhibición que el microorganismo presenta en presencia de antibióticos. (Velasco 2002) 2.7 Laboratorio LABSER La globalización es una realidad que Chile debe asumir para asegurar su desarrollo económico y bienestar social. LABSER es un laboratorio dotado de infraestructura tecnológica y profesional que permite ofrecer servicio y asesoría permanente a las actividades de importación y/o exportación, principalmente de alimentos y materias primas de manera de garantizar la calidad e inocuidad de tales bienes de consumo. Hoy en día la calidad e inocuidad de los alimentos vale decir ausencia de contaminantes químicos, microbiológicos o físicos- es una condición exigida - 18 - prioritariamente por distribuidores y consumidores para aceptar o rechazar un determinado producto alimenticio. El laboratorio en el área de microbiología cuenta con diversos análisis tales como: • Recuento de Aerobios Mesófilos (BAM FDA / Petrifilm AOAC) • Recuento de Microorganismos cultivables. • Determinación de Salmonellas (BAM – FDA / USDA – FSIS / SAG / Assurance EIA) • Recuento de Hongos y Levaduras. • Recuento de Enterobacterias. • Determinación Coliformes (tubos múltiples / Petrifilm) • Determinación Listeria • Análisis Ambiental de superficie • Recuento S. aureus • Recuento Clostridium perfringens • Recuento Sulfito Reductores • Metodología PCR (http://www.labser.cl/HOME.htm) - 19 - 3. FORMULACION DEL PROBLEMA Y JUSTIFICACION 3.1 Formulación del problema. El propósito de este trabajo es hacer un estudio financiero (costos) para determinar si se puede implementar el análisis de Campylobacter spp según la metodología descrita por USDA/FSIS MLG Capitulo 6 1998 en el laboratorio LABSER de Rancagua Chile. 3.2 Preguntas de investigación. La presente propuesta plantea los siguientes interrogantes: ¿Al realizar el estudio financiero (costos) será posible implementar el análisis de Campylobacter spp USDA/FSIS Capitulo 6 1998 en el laboratorio LABSER? ¿Será que la implementación de esta técnica es muy costosa? 3.3 Justificación de la investigación. El laboratorio LABSER ubicado en la ciudad de Rancagua Chile es un laboratorio encargado de realizar diferentes análisis tanto químicos como microbiológicos. Este laboratorio no cuenta con todo el procedimiento para análisis de Campylobacter spp por eso este trabajo se realizo con el fin de evaluar los costos para determinar si se puede implementar el método de análisis de Campylobacter spp según la USDA/FSIS Capitulo 6 1998. Campylobacter es el microorganismo causante de muchas enfermedades en el hombre como en los animales. La mayoría de las infecciones se originan por consumo de alimentos de origen animal, sobretodo la carne de pollo y derivados de aves. Otros alimentos implicados son las carnes rojas, despojos, moluscos, leche y quesos no pasteurizados y aguas no cloradas. Por eso su identificación es muy importante hacerla en muestras de alimentos. - 20 - 4. OBJETIVOS 4.1 Objetivo general Realizar un estudio para la implementación del análisis de Campylobacter spp basado en la metodología USDA/FSIS MLG Capitulo 6 1998 en el laboratorio LABSER de Rancagua Chile, haciendo una investigación económica- financiera y según esta determinar si es posible la implementación de este método en el laboratorio. 4.2 Objetivos específicos Comparar entre las diferentes casas comerciales de productos microbiológicos cual es la más económica y conveniente para el análisis de Campylobacter spp. Determinar cuales son los equipos que se utilizan en este análisis con los que el laboratorio no cuenta y cual debe ser su inversión para obtenerlos. Establecer el costo del análisis para los clientes, basándose en insumos, horas/hombres, gestión de calidad, costos indirectos etc. Comparar el costo final del análisis en esta investigación con el costo establecido por el laboratorio de la Universidad de Chile a la cual LABSER subcontrata para el análisis. - 21 - 5. MATERIALES Y METODOS 5.1 Materiales Los materiales y métodos descritos a continuación, son los propuestos por la metodología USDA/FSIS MLG Capitulo 6 1998 5.1.1 Materiales para el aislamiento, identificación y cuantificación de Campylobacter jejuni/coli en productos de carne y aves de corral. 5.1.1.1 Equipos • Microscopio. Objetivo de 100X • Incubadoras con agitación/baño termostatado a 37 ± 1.0°C y 42 ± 1.0ºC • Incubadora estática 42 ± 1.0 ºC • Balanza, sensibilidad de 0.1 g • Bolsas de Qwik Seal® (metales Co. de Reynolds, Richmond, VA; # RS78) tamaño 1/4 • Jarras anaerobiosis (expresadas o no ventiladas) • CampyPak PlusÔ (BBL 71045) o kits para Campylobacter que generan gas (Oxoid BR56 para tarros de 3.0-3.5 litros, o BR60 para tarros de 2.5-3.0 litros) • Bomba al vacío con tubería y conectores para la evacuación de gas en jarras anaerobiosis • Cilindro de gas que contiene una mezcla de O2 al 5%, CO2 al 10%, y N2 al 85% con tubería y conectores apropiados para traspasarse a jarras de anaerobiosis y bolsas de Qwik Seal® • Regulador para el cilindro de gas compatible con la conexión en el cilindro • Papel de filtro (para humectar con glicerol y para la prueba de oxidasa) • Placas de Petri (100 x 15 milímetros) • Asas estériles • Filtros de membrana estériles de 0.2 µm • Laminas, laminillas y aceite de inmersión - 22 - • Tubos de tapa rosca de 16 x 150 milímetros y de 16 x 125 milímetros • Frascos de 250 ml • Esponjas estériles • Pinzas y tijeras estériles • Pipetas estériles • Bolsas plásticas grandes estériles • Stomacher 400, y bolsas Stamacher 400 • Centrifuga, rotor, para botellas de 250 ml estériles • Embudos estériles 5.1.1.2 Reactivos • Glicerol • Solución de peróxido de hidrógeno al 3% • Discos de sensibilidad a antibióticos (Cefalotina 30 µg) • Discos de sensibilidad a antibióticos (Acido Nalidixico 30 µg) • Reactivo para prueba de Oxidasa (Solución tetrametil-p-fenilendiamina dihidrocloridrico al 1%) 5.1.1.3 Medios de cultivo • Caldo de enriquecimiento Hunt (HEB) • Agua peptonada al 0.1% • Agar diferencial modificado para Campylobacter (MCCDA) • Caldo Brucella-FBP (BFBP) • Medio semisólido glucosa Brucella • Agar Brucella-FBP (BFBP) - 23 - 5.1.2 Métodos 5.1.2.1 Preparación de medios de cultivo • Caldo de enriquecimiento Hunt (HEB) Caldo básico Caldo nutritivo 25.0g Extracto de levadura 6.0g Agua destilada 950.0ml Disolver el caldo nutritivo y el extracto de levadura en agua destilada. Autoclavar 121ºC por 15 minutos. pH final 7.5 ± 0.2 a 25ºC Los suplementos (FBP, antibióticos, y sangre del caballo esterilizados con filtro por filtración) se agregan momentos antes del uso y se mezclan. Suplemento FBP Sulfato ferroso 0.25g Metabisulfito de sodio 0.25g Piruvato de sodio 0.25g Ver preparación abajo. Antibióticos Clorohidrato vancomicina 10.0 mg Solución stock de Vancomicina En un frasco volumétrico, disolver 0.25g vancomicina en 100ml de agua destilada, mezclar y esterilizar con filtración por membrana. Almacenar a 4oC. Utilizar 4ml para cada litro de caldo del enriquecimiento. Trimetoprim Lactato 12.5 mg - 24 - Solución stock de lactato del Trimetoprim En un frasco volumétrico, disolver 0.3125g de lactato de trimetoprim en 100ml de agua destilada, mezclarte y esterilizarlos con filtro. Almacenar en 4oC. Utilizar 4ml para cada litro de caldo del enriquecimiento. Cefoperazona de Sodio 15.0 mg Solución stock de Cefoperazona En un frasco volumétrico, disolver 0.375g de cefoperazona en 100ml de agua destilada, mezclar, y esterilizarlos con filtración por membrana. Almacenar a 70oC en alícuotas de 4ml. Inicialmente, utilizar 4ml para cada litro de caldo de enriquecimiento (para las primeras cuatro horas, la incubación está a 37oC). Después de cuatro horas, agregar 4ml/l adicional, para traer la concentración final a 30mg/l, y aumentar la temperatura de incubación a 42oC. Cicloheximida 100.0 mg Solución stock de Cicloheximida Preparar una solución al 10% en etanol al 50%. En un frasco volumétrico de 50 ml, disolver 5g de cicloheximida en 50 ml de etanol al 50%, mezclar y esterilizar con filtración por membrana y almacenar en 4oC. Utilizar 1ml para cada L de caldo. Sangre lisada de caballo estéril 50.0 ml Lise la sangre del caballo sujetándola a dos ciclos de heladas/deshielo. Almacenar en congelación. • Agua peptonada al 0.1% Agregar 0.1g de peptona en 100ml de agua destilada según el análisis lo requiera. • Agar diferencial modificado para Campylobacter (MCCDA) Caldo nutritivo 25.0 g - 25 - Carbón activado 4.0 g Caseína hidrolizada 3.0 g Desoxicolato de sodio1.0 g Sulfato ferroso 0.25 g Piruvato sodico0.25 g Agar 12.0 g Cefoperazona de sodio 0.032 g Agua destilada 1.0 L Preparación del medio: Suspender 45.5g del agar base selectiva sin sangre de Campylobacter Oxoid (CM739) en 1L de agua destilada y llevarlo a ebullición para disolver. Esterilizar en autoclave a 121°C por 15 minutos. Enfriar a 50°C. Agregar en condiciones asépticas 1 vial del suplemento selectivo SR0155 de CCDA. Mezclar bien y verter en las placas de Petri estériles. • Caldo Brucella-FBP (BFBP) Bacto triptona 10.0 g Bacto Peptona 10.0 g Bacto dextrosa 1.0 g Bacto extracto de levadura 2.0 g Cloruro de sodio 5.0 g Bisulfito de sodio 0.10 g Agua destilada 1.0 L Suplemento FBP Sulfato ferroso 0.25g Metabisulfito de sodio 0.25g Piruvato de sodio 0.25g Ver preparación abajo - 26 - Disolver 28g de caldo Brucella en 1L de agua destilada y autoclavar a 121oC por 15 minutos. Enfriar el medio a temperatura ambiente y agregar la solución FBP. En condiciones asépticas dispensar en tubos tapa rosca. pH final 7.2 ± 0.2 a 25ºC • Medio semisólido glucosa Brucella Pancreatic digest of casein 15.0 g Peptic digest of animal tissue 5.0 g Extracto de levadura 2.0 g Cloruro de sodio 5.0 g Bisulfito de sodio 0.1 g Agar 1.6 g Dextrosa 11.0 g Rojo de fenol 0.02 g Agua destilada 1.0 L Suspender 28g del caldo Brucella (Albimi; deshidratado; BBL) excepto rojo de fenol y el agar en 1L de agua destilada, y ajustar el pH a 7.4 con NaOH al 8 N. Agregar el agar. Calentar la mezcla hasta que se observe que está bien disuelta. Enfriar a 55°C y agregar 2.5ml de la solución rojo de fenol (0.08 g/10 ml de 0.1 N NaOH ). Reajustar el pH a 7.4 en caso de necesidad, dispensarlo y esterilizarlo en 121oC por 10 minutos. pH final 7.0 + 0.2 a 25oC. • Agar Brucella-FBP (BFBP) Bacto peptona 20.0 g Bacto dextrosa 1.0 g Bacto extracto de levadura 2.0 g Cloruro de sodio 5.0 g Bisulfito de sodio 0.1 g - 27 - Bacto Agar 15.0 g Agua destilada 1.0 L Suplemento FBP Sulfato ferroso 0.25g Metabisulfito de sodio 0.25g Piruvato de sodio 0.25g Ver preparación abajo. Suspender 43g de agar Brucella (Deshidratado; Difco) en 1L de agua destilada. Calentar la mezcla hasta observar que está bien disuelta. Autoclavar a 121oC por 15 minutos. Enfriar a 50oC y agregar la solución ferrosa esterilizada con filtro por filtración 4 ml de la solución FBP. Mezclarte y servir. • solución stock FBP Sulfato ferroso 6.25g Metabisulfito de sodio 6.25g Piruvato de sodio 6.25g Disolver los ingredientes en 100ml de agua destilada en un frasco volumétrico. Conservar a -20oC. Utilizar 4ml por cada litro de caldo del enriquecimiento. 5.1.2.2 Aislamiento y cuantificación 1. 25g para muestras de carne o esponja en 100 ml de HEB en bolsas de Qwik Seal® tamaño 1/4. Colocar las bolsas en el Stomacher a 400 RPM durante 2 minutos. Quitar todo el aire posible sin derramar el contenido, después sellar las bolsas, dejando una abertura de 1/2 pulgada en un extremo. En condiciones asépticas insertar una pipeta estéril de 10 ml. Conectar la boca de la pipeta con la mezcla del gas de Campy microaerofilo (O2 al 5%, CO2 al 10%, y N2 al 85%) con un tubo de goma estéril y un filtro estéril, inflar lentamente la bolsa - 28 - con el Campy para proveer gas a la mezcla y continuar llenando hasta que exceso del gas salga de la bolsa. Continuar con el párrafo 4. 2. Colocar la carcasa o la carne de pollo cruda (hasta 1360 g) en una bolsa plástica grande estéril y agregar 200 ml de agua peptonada al 0.1%. Sellar las bolsas y mezclar el contenido por 2 minutos. Inclinar la bolsa permitiendo fluir el líquido a una esquina. Esterilizar la esquina de la bolsa con una solución de hipoclorito 1000 PPM o etanol al 70%, después enjuagar con agua destilada estéril. En condiciones asépticas cortar la esquina de la bolsa y verter el líquido en una botella estéril de 250 ml para centrifugar. Centrifugar a 16.000 RPM x g durante 15 minutos. Desechar el sobrenadante y resuspender el pellet en 10 ml de agua peptonada al 0.1%. Para la detección, inocular 1 ml del lavado concentrado en 100 ml HEB en una bolsa de Qwik Seal®. Seguir con los pasos descritos en la tercera línea del párrafo 1. 3. Si desea cuantificar, debe realizar NMP con HEB utilizando series de tres tubos. Se deben elegir las diluciones y los volúmenes de caldo HEB según el nivel de contaminación que las muestras tengan. Por ejemplo, para productos de aves de corral se agregan 10ml de la muestra en tres bolsas o botellas con 90ml de caldo HEB. Realizar diluciones seriadas de la muestra con agua peptonada al 0.1%. Preparar el NMP en tubos subsecuentes y agregar 1ml en tubos de 9ml de HEB por triplicado para la dilución decimal. Colocar todos los tubos en jarras de anaerobiosis, como se indica en el párrafo 7. Seguir los pasos de la incubación del párrafo 4. Según los tubos positivos obtenidos después de la incubación calcular el resultado según la tabla MPN de Campylobacter. 4. Incubar las bolsas de Qwik Seal® o las jarras de anaerobiosis que contienen los tubos de NMP a 37 ± 1 ºC, agitando a 100 RPM durante 4 H. 5. Después de la incubación, en condiciones asépticas agregar una solución adicional de cefoperazona estéril 4 ml/l para tener una concentración final en - 29 - cada recipiente de enriquecimiento de 30 mg/l. Restablecer la atmósfera microaerófila y aumentar temperatura 42 al ± 1 ºC. Continuar la incubación durante 20 h a 100 RPM. 6. Enriquecimiento directo de la esponja en dilución 1:100 sobre las placas de MCCDA (para productos cocinados, dilución 1:50) la dilución se hace dependiendo del tipo de matriz que se vaya a analizar, puede ser directa o consecutiva. Sembrar 0.1ml del caldo de enriquecimiento o de las diluciones y con un rastrillo expandir la muestra. 7. Incubar las placas de MCCDA a 42 ± 1 ºC durante 24 h en las jarras de anaerobiosis bajo condiciones microaerófilas. Agregar cerca de 4 gotas de glicerol a un papel de filtro y colocarlo en la jarra, para disminuir el confluente. Si no hay crecimiento después de 24 h, reincubar las placas durante 24 a 48 h adicionales para procurar la recuperación. Las condiciones microaerófilas se pueden alcanzar en la jarra con cualquiera de los siguientes métodos: • Evacuar el aire en una jarra de anaerobiosis expresado al vacío con 20 pulgadas de mercurio y llenar la jarra con una mezcla del gas del O2 al 5%, CO2 al 10%, y N2 al 85%. Repetir el procedimiento del evacuación reemplazo tres veces para asegurar las condiciones atmosféricas apropiadas. • CampyPak PlusÔ (BBL) o kit para Campylobacter que genera gas (Oxoid). Seguir las instrucciones de uso del fabricante y la disposición de los materiales del kit. 5.1.2.3 Identificación de Campylobacter Las colonias de Campylobacter en MCCDA son lisas, brillantes, con borde plano o definido, transparente o translúcido, y con superficie de borde irregular; descolorido como crema grisácea y ligera; y generalmente 1 a 2 milímetros de diámetro pero dentro pueden tener una punta de varios milímetros. Las placas con - 30 - las colonias de Campylobacter se pueden almacenar hasta 48 h refrigeradas bajo condiciones microaerófilas. Utilizar un asa para escoger tres colonias sospechosas de Campylobacter de las placas de MCCDA y transferirlas cada una a 10 ml de caldo del Brucella-FBP (BFBP). Puesto que Campylobacter puede tener varios cambios en cuanto a su morfología colonial, es recomendable cultivar paralelamente por lo menos uno o todos los tipos de colonias presentes en las placas, para asegurar no pasar por alto ninguna. Alternativamente, las colonias se pueden investigar con microscopia antes de sembrarlas en BFBP. Para cultivar colonias aisladas, se deben incubar los tubos de BFBP con las tapas flojas durante 24 a 48 h a 42 ± 1 ºC en una atmósfera del O2 al 5%, CO2 al 10%, y N2 al 85%. Los tubos no deben ser mezclados ya que esto introducirá oxígeno en los medios. Realizar las siguientes pruebas para la identificación de las colonias crecidas en caldo BFBP: • Examinar superficie mojada en el caldo BFBP y observar las colonias en el microscopio con un objetivo de 100X usando aceite de inmersión. Las células jóvenes de Campylobacter aparecen como barras curvadas estrechas (0.2 a 0.8µm de ancho por 1.5 a 5µm de largo). Estos microorganismos demuestran el movimiento rápido. Los pares de células pueden asemejarse a la silueta de la letra S. Cuando las cadenas son mas largas pueden parecer helicoidales, curvadas, y multiespirales, las formas filamentosas alargadas pueden existir. Células crecidas durante más de 72 h pueden convertirse en no cultivables y cocoides. Campylobacter se caracteriza por ser Gram – pero las características más significativas de estos organismos son la morfología y la motilidad. 5.1.2.3.1 Pruebas bioquímicas • Inocular las colonias del caldo BFBP a una profundidad de 10 milímetros en los tubos de medio semisólido glucosa para Brucella. Incubar los tubos con las tapas flojas dentro de una jarra de anaerobiosis bajo condiciones microaerófilas a 42 ± 1.0oC durante 1 a 3 días. - 31 - 1. Prueba de la fermentación de la glucosa: Campylobacter no es un fermentador de la glucosa, así que el color del medio seguirá siendo rojo-anaranjado. Una reacción positiva demuestra un color amarillo (ácido con el indicador del rojo de fenol) en el medio semisólido glucosa para Brucella. 2. Prueba de la Catalasa: Después de leer los resultados de la prueba de la fermentación de la glucosa, agregar 1 ml de peroxido de hidrógeno al 3% a la colonia en el medio semisólido glucosa para Bruella, después de dos a tres minutos, invertir suavemente el tubo para distribuir el reactivo. Examinar después de 1 a 10 minutos la formación de burbujas, indicando una reacción positiva. C, Jejuni y C. coli son catalasa positivo. • Agregar cerca de seis gotas de la colonia del caldo de BFBP a una placa de agar BFBP, y sembrar por agotamiento el inoculo sobre la superficie con una torula o con un rastrillo. En condiciones asépticas colocar un disco de ácido nalidixico (30µg) y un disco de cefalotina (30µg) en cada placa. Presionar cada disco con pinzas estériles para adherirlo a la superficie del agar. Incubar las placas en una jarra de anaerobiosis a 42 ± 1 ºC durante 1 a 3 días en una atmósfera microaerófila. 1. Susceptibilidad al ácido nalidixico y a la cefalotina: Observar el crecimiento alrededor de los discos impregnados con el antibiótico C. Jejuni y C. coli son sensibles al ácido nalidixico, existirá alrededor del disco una zona clara debido a la inhibición. Una zona de cualquier tamaño que indica la sensibilidad. Este organismo es resistente a la cefalotina, así que el crecimiento será presente hasta el disco. El crecimiento de Campylobacter puede ser muy ligero y difícil de ver, así que es adecuado inclinar la placa en ángulo bajo luz para verlo. 2. Prueba de Oxidasa: Poner un pedazo de papel de filtro cuadrado de 2 centímetros en una placa vacía y agregar de 1 a 2 gotas del reactivo de oxidasa al papel. Impregnar el papel con reactivo sobre un punto con células de 3 a 5 milímetros diámetro usando un asa en loop de platino o plástico. La prueba es positiva si el papel cambia a color púrpura oscuro en un plazo de 30 segundos. - 32 - Alternativamente, la prueba de oxidasa de Disco DrySlideÔ puede ser utilizada. Campylobacter es oxidasa positivo. (USDA/FSIS MLG 1998. Capitulo 6) 5.2 Métodos Según la metodología USDA/FSIS descrita en el numeral 5.1 se determino cuales eran los equipos, reactivos y medios de cultivo necesarios para implementar Campylobacter spp en el laboratorio LABSER. Estos fueron organizados en una lista, y en el caso de los equipos se verifico con cuales contaba el laboratorio y en cuales tenia que hacer la inversión. Posteriormente se hicieron las diferentes cotizaciones para los medios de cultivo, reactivos y equipos. Estas cotizaciones se realizaron en diferentes casas comerciales de productos microbiológicos, de las cuales LABSER provee todos sus materiales. Se hizo una comparación entre estas casas comerciales para determinar cual era la más conveniente en el laboratorio. Después de haber realizado este estudio financiero se estableció cual es el costo total del análisis que se ofrecerá a los clientes, basado en insumos, horas hombres, gestión de calidad y costos indirectos etc. Los costos horas hombres, gestión de calidad y costos indirectos se obtuvieron según los valores establecidos por LABSER en previos análisis. Las horas hombres se adquieren haciendo un análisis directo del tiempo de trabajo que requiere el método, los costos indirectos incluyen inversión, servicios de agua, luz y gas, además de la utilización de equipos, materiales de trabajo, los insumos necesarios para el área de lavado y preparación de material; y en gestión de calidad se evalúa el trabajo diario del personal realizando control de calidad a equipos , medio ambiente, materiales, cepas, y medios de cultivo a los cuales se les hace pruebas de estabilidad, selectividad, productividad y control de pH. - 33 - 6. RESULTADOS Y DISCUSIÓN 6.1 Cotizaciones 6.1.1 Equipos Según el listado de equipos necesarios para el análisis de Campylobacter spp LABSER tiene los siguientes: microscopio, incubadora estática, balanza, bomba al vacío con tubería y conectores para la evacuación de gas en jarras anaerobiosis, cilindro de gas que contiene una mezcla de O2 al 5%, CO2 al 10%, y N2 al 85% con tubería y conectores apropiados para traspasarse a jarras de anaerobiosis y bolsas de Qwik Seal, regulador para el cilindro de gas compatible con la conexión en el cilindro, stomacher. Algunos de estos se encuentran disponibles en el área de química. En la tabla 1 se indican los equipos con los que este laboratorio no cuenta y sus respectivas cotizaciones. Dentro de los equipos está la incubadora con agitación, que es muy importante ya que esta tiene establecidas las temperaturas a las cuales Campylobacter spp debe ser sometido para su crecimiento, además de proporcionar un permanente movimiento al medio facilitando un mejor desarrollo del microorganismo. Debido a que Cambylobacter spp es un microorganismo microaerofilico es importante someterlo a una atmósfera mínima de oxigeno, para esto se utilizan las jarras de anaerobiosis las cuales protegen a los cultivos del oxigeno libre. La centrifuga es un aparato mecánico que utiliza la fuerza centrípeta para separar sustancias de diferentes densidades, pueden usarse para la separación rápida de sustancias que en condiciones normales se separarían lentamente bajo la influencia de la gravedad. El principio de la centrifuga es separar partículas en un medio líquido por sedimentación. (http://www.aguamarket.com/diccionario/terminos.asp?Temas=453&termino=&I d=453) En este caso la centrifuga se utilizara para separar el microorganismo del medio de cultivo, esto con el fin de obtener mas concentración para los posteriores análisis. - 34 - Tabla 1. Cotización de equipos Equipos Recipiente de anaerobios 2.5 L Centrifuga botellas Baño termoregulado con agitación Total Costo Merck $ 87.313 $ 4.438.000 Costo Arquimed Costo Andes Import $ 95.700 Costo Establecido $ 87.313 $ 4.438.000 $ 1.779.500 $ 6.304.813 Costo/l-uni Andes import $ 21.720 /1L Costo/l-uni Establecido $ 21.720 /1L $ 5.900 / 250 Discos $ 5.900 / 250 Discos $ 17.550 / 50 Tiras $ 4.968.900 $ 1.779.500 Tabla 2. Cotización reactivos Reactivos Peróxido de hidrógeno al 3% Discos (Cefalotina 30 µg) Discos (Acido Nalidixico 30 µg) Oxidasa Costo/l-uni Merck Costo/l-uni PV Equip S.A $ 7.200 / 250 Discos $ 7.200 / 250 Discos $ 5.900 / 250 Discos $ 5.900 / 250 Discos $ 17.550 / 50 Tiras * Sin IVA * Valores en pesos chilenos - 35 - Tabla 3. Cotización medios de cultivo Componentes y/o Medios Caldo nutritivo Extracto de levadura Peptona Suplemento FBP Agar (MCCDA) Caldo Brucella FBP (BFBP) Caldo Brucella Albimi BBL Agar Brucella FBP (BFBP) Clorohidrato Vancomicina Trimetoprim Lactato Cefoperazona de Sodio Cicloheximida NaOH Rojo de fenol Sangre lisada de caballo Costo/g-ml Merck Costo/g-ml PV Equip S.A $ 46.100 / 500g $ 27.900 / 500g $ 77.000 / 500g $ 31.770/ 3.75g $57.960/ 500g $ 65.300 /250mg $ 71.100 /50mg $ 56.500 /1g $ 198.102 / 5g $ 15.600/ 5g $ 9,500/ 500ml $ 17.800/ 5g Costo/g-ml Andes Import $ 41.630 / 500g $ 19.398 / 454g $ 33.095 / 500g $ 58.536 /500g $ 50.560 / 500g $ 52.682 /500g $ 61.990 / 250mg $ 65.750 / 50mg $ 55.700 / 1g $ 60.600 / 1g $ 11,200/ 500ml $ 63.000 /500ml * Sin IVA * Valores en pesos chilenos - 36 - Costo/g-ml Establecido $ 46.100 / 500g $ 19.398 / 454g $ 33.095 / 500g $ 31.770/ 3.75g $57.960/ 500g $ 58.536 /500g $ 50.560 / 500g $ 52.682 /500g $ 61.990 / 250mg $ 65.750 / 50mg $ 55.700 / 1g $ 198.102 / 5g $ 9,500/ 500ml $ 15.600/ 5g $ 63.000 /500ml Según la tabla 1 el laboratorio tendría que hacer una inversión de $ 6.304.813 para adquirir estos equipos, el costo es alto y se requiere de tener una alta demanda con el análisis de Campylobacter spp para recuperar la inversión. Se debe tener en cuenta que al laboratorio no entran muchos análisis para este microorganismo con relación a los otros. Para operar estos equipos es importante que el personal este capacitado, además requieren mantenimiento cada cierto periodo de tiempo y son equipos que únicamente se utilizarían en el laboratorio para este análisis. 6.1.2 Reactivos LASER trabaja con la mayoría de estos reactivos debido a los diferentes análisis que este laboratorio realiza. Estos reactivos son importantes para la identificación bioquímica de Campylobacter spp. Las cotizaciones de estos se muestran en la tabla 2. 6.1.3 Medios de cultivo En el caso de los medios de cultivo se hicieron varias averiguaciones en las diferentes casas comerciales que LABSER maneja, estas no contaban con el caldo HEB descrito en la técnica, por esta razón se realizo la cotización de los componentes por separado, los otros medios junto con el suplemento FPB fueron cotizados sin ningún problema. La tabla 3 muestra cada medio necesario para implementar este análisis. Para el estudio de reactivos y medios de cultivo se hicieron cotizaciones a tres proveedores con los cuales LABSER trabaja hace mucho tiempo, el parámetro de elección para estos insumos fue escoger precio más económico para el laboratorio. Estos medios de cultivo proveen al microorganismo de interés todos los nutrientes necesarios para su crecimiento y desarrollo. Algunos de estos tienen sustancias inhibidoras de flora acompañante que puede ser competencia de nutrientes para y además intervenir en el aislamiento e identificación de Campylobacter spp. - 37 - Campylobacter spp es un microorganismo patógeno causante de enfermedades en animales y humanos por eso su aislamiento y caracterización es muy importante en muestras de alimentos, principalmente productos carnicos de aves de corral y ganado vacuno. Está demostrado que la carne de pollo es sin duda la fuente de infección más importante. Diferentes estudios epidemiológicos han establecido que entre el 50-70 % de las infecciones esporádicas de origen alimentario por Campylobacter spp. se deben al consumo o manipulación de la carne de pollo. (Canals, A) Para prevenir infecciones por esta bacteria es importante la higiene escrupulosa en la Industria Alimentaría, detección de los portadores sanos, detección precoz de la enfermedad, correctos tratamiento térmicos y de manipulación posterior así como de almacenamiento, para impedir recontaminaciones cruzadas. Los laboratorios de análisis de alimentos son los responsables de aislar e identificar diferentes microorganismos causantes de enfermedades por esta razón es importante someter los alimentos que se comercializan, a un análisis microbiológico. 6.2 Costo por análisis La metodología descrita por la USDA/FSIS MLG Capitulo 6 1998 va dirigida a cuatro matrices para el análisis de Campylobacter spp en alimentos. Las matrices son: Carne de ave, carne de vacuno, esponja y carcasa. Estas se pueden cuantificar mediante la técnica de número más probable (NMP) o identificar por medio de aislamiento y pruebas bioquímicas. En las tablas 4 y 5 se muestra el análisis de costos para la prueba de NMP correspondiente a las cuatro matrices y en las tablas 6 y 7 el costo para el aislamiento e identificación del microorganismo en las diferentes matrices. - 38 - Tabla No.4 NMP Campylobacter spp en muestras de carne de vacuno o esponja. Series 3 tubos. Dil 3 Insumo Hra. Hombre Aseg. Calidad Costos indirectos Bolsa estéril Agua peptonada 0,1% HEB Extracto de Levadura Caldo nutritivo Suplemento FBP Clorohidrato vancomicina Trimetoprim lactato Cefaperazona de sodio Cicloheximida Sangre lisada de caballo HEB Extracto de Levadura Caldo nutritivo Suplemento FBP Clorohidrato vancomicina Trimetoprim lactato Cefaperazona de sodio Cicloheximida Sangre lisada de caballo Presentación Cantidad Presentación en Análisis a Usar Volumen ml/Mta $/Producto por Producto HR UN UN UN 1 $ 114 Tubo 3 9 27 $ 33.095 500 $/g-ml Receta gEnvase(g/Lt) ml/Mta 66,2 1 0,027 $/Mta $ 817 $ 160 $ 12.456 $ 114 $2 Botella Botella Botella Botella Botella Botella Botella Botella 1 1 1 1 1 1 1 1 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 $ 19.398 $ 41.630 $ 31.770 $ 61.990 $ 65.750 $ 55.700 $ 198.102 $ 63.000 454 500 3,75 0,25 0,05 1 5 500 42,7 83,3 8472,0 247960,0 1315000,0 55700,0 39620,4 126,0 6 25 0,75 0,01 0,0125 0,015 0,1 50 0,600 2,500 0,075 0,001 0,001 0,002 0,010 5,000 $ 26 $ 208 $ 635 $ 248 $ 1.644 $ 84 $ 396 $ 630 Tubo Tubo Tubo Tubo Tubo Tubo Tubo Tubo 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 81 81 81 81 81 81 81 81 $ 19.398 $ 41.630 $ 31.770 $ 61.990 $ 65.750 $ 55.700 $ 198.102 $ 63.000 454 500 3,75 0,25 0,05 1 5 500 42,7 83,3 8472,0 247960,0 1315000,0 55700,0 39620,4 126,0 6 25 0,75 0,01 0,0125 0,015 0,1 50 0,486 2,025 0,061 0,001 0,001 0,001 0,008 4,050 $ 21 $ 169 $ 515 $ 201 $ 1.331 $ 68 $ 321 $ 510 - 39 - Glicerol Campi Pack Plus Papel filtro Total Gota Bolsa UN 4 1 1 * Sin IVA * Valores en pesos chilenos - 40 - 0,05 0,5 0,5 0,2 0,5 0,5 $ 4.900 $ 44.660 $ 5.363 1000 25 100 4,9 1786,4 53,6 1 1 1 0,200 0,500 0,500 $1 $ 893 $ 27 $ 21.476 Tabla No.5 NMP Campylobacter spp en muestras de carcasa o carne de ave. Series 3 tubos. Dil 3 Insumo Hra. Hombre Aseg. Calidad Costos indirectos Bolsa estéril Agua peptonada 0,1% Agua peptonada 0,1% HEB Extracto de Levadura Caldo nutritivo Suplemento FBP Clorohidrato vancomicina Trimetoprim lactato Cefaperazona de sodio Cicloheximida Sangre lisada de caballo HEB Extracto de Levadura Caldo nutritivo Suplemento FBP Clorohidrato vancomicina Trimetoprim lactato Cefaperazona de sodio Cicloheximida Sangre lisada de caballo Presentación Cantidad Presentación en Análisis a Usar Volumen ml/Mta $/Producto por Producto HR UN UN UN 1 $ 114 Botella 1 200 200 $ 33.095 500 Tubo 3 9 27 $ 33.095 500 $/g-ml Receta gEnvase(g/Lt) ml/Mta 66,2 66,2 1 1 0,200 0,027 $/Mta $ 817 $ 160 $ 10.780 $ 114 $ 13 $2 Botella Botella Botella Botella Botella Botella Botella Botella 3 3 3 3 3 3 3 3 90 90 90 90 90 90 90 90 270 270 270 270 270 270 270 270 $ 19.398 $ 41.630 $ 31.770 $ 61.990 $ 65.750 $ 55.700 $ 198.102 $ 63.000 454 500 3,75 0,25 0,05 1 5 500 42,7 83,3 8472,0 247960,0 1315000,0 55700,0 39620,4 126,0 6 25 0,75 0,01 0,0125 0,015 0,1 50 1,620 6,750 0,203 0,003 0,003 0,004 0,027 13,500 $ 69 $ 562 $ 1.716 $ 669 $ 4.438 $ 226 $ 1.070 $ 1.701 Tubo Tubo Tubo Tubo Tubo Tubo Tubo Tubo 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 81 81 81 81 81 81 81 81 $ 19.398 $ 41.630 $ 31.770 $ 61.990 $ 65.750 $ 55.700 $ 198.102 $ 63.000 454 500 3,75 0,25 0,05 1 5 500 42,7 83,3 8472,0 247960,0 1315000,0 55700,0 39620,4 126,0 6 25 0,75 0,01 0,0125 0,015 0,1 50 0,486 2,025 0,061 0,001 0,001 0,001 0,008 4,050 $ 21 $ 169 $ 515 $ 201 $ 1.331 $ 68 $ 321 $ 510 - 41 - Glicerol Campi Pack Plus Papel filtro Total Gota Bolsa UN 4 1 1 * Sin IVA * Valores en pesos chilenos - 42 - 0,05 0,5 0,5 0,2 0,5 0,5 $ 4.900 $ 44.660 $ 5.363 1000 25 100 4,9 1786,4 53,6 1 1 1 0,200 0,500 0,500 $1 $ 893 $ 27 $ 26.393 Tabla No.6 Aislamiento e identificación Campylobacter spp en muestras de carne de vacuno o esponja. Dil 3 Insumo Hra. Hombre Aseg. Calidad Costos indirectos Bolsa Qwik Seal Agua peptonada 0,1% HEB Extracto de Levadura Caldo nutritivo Suplemento FBP Clorohidrato vancomicina Trimetoprim lactato Cefaperazona de sodio Cicloheximida Sangre lisada de caballo MCCDA Glicerol Campi Pack Plus Papel filtro Caldo Brucella Suplemento FBP M. semisólido glucosa Rojo de fenol NaOH Presentación Cantidad Presentación en Análisis a Usar Volumen ml/Mta $/Producto por Producto HR UN UN UN 1 $ 304 Tubo 3 9 27 $ 33.095 500 $/g-ml Receta gEnvase(g/Lt) ml/Mta 66,2 1 0,027 $/Mta $ 957 $ 160 $ 7.647 $ 304 $2 Botella Botella Botella Botella Botella Botella Botella Botella 1 1 1 1 1 1 1 1 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 $ 19.398 $ 41.630 $ 31.770 $ 61.990 $ 65.750 $ 55.700 $ 198.102 $ 63.000 454 500 3,75 0,25 0,05 1 5 500 42,7 83,3 8472,0 247960,0 1315000,0 55700,0 39620,4 126,0 6 25 0,75 0,01 0,0125 0,015 0,1 50 0,600 2,500 0,075 0,001 0,001 0,002 0,010 5,000 $ 26 $ 208 $ 635 $ 248 $ 1.644 $ 84 $ 396 $ 630 Placa Gota Bolsa UN Tubo Tubo Tubo Tubo Tubo 1 16 4 4 3 3 3 1 1 80 0,05 0,5 0,5 10 10 10 2,5 10 80 0,8 2 2 30 30 30 2,5 10 $ 57.960 $ 4.900 $ 44.660 $ 5.363 $ 58.536 $ 31.770 $ 50.560 $ 15.600 $ 9.500 500 1000 25 100 500 3,75 500 5 500 115,9 4,9 1786,4 53,6 117,1 8472,0 101,1 3120,0 19,0 45,5 1 1 1 28 0,75 28 0,08 100 3,640 0,800 2,000 2,000 0,840 0,023 0,840 0,000 1,000 $ 422 $4 $ 3.573 $ 107 $ 98 $ 191 $ 85 $1 $ 19 - 43 - Peroxido de hidrogeno Agar BFBP Suplemento FBP Disco Cefalotina Disco Acido nalidixico Bactident Oxidasa Placa Petri Desechable TOTAL Gota Placa Placa UN UN UN Placa 3 3 3 3 3 3 7 * Sin IVA * Valores en pesos chilenos - 44 - 1 20 20 1 1 1 3 60 60 3 3 3 $ 21.720 $ 52.682 $ 31.770 $ 5.900 $ 5.900 $ 17.500 $ 45 1000 500 3,75 250 250 50 21,7 105,3 8472,0 23,6 23,6 350,0 1 43 0,75 1 1 1 3,000 2,580 0,045 3,000 3,000 3,000 $ 65 $ 272 $ 381 $ 71 $ 71 $ 1.050 $ 315 $ 19.665 Tabla No.7 Aislamiento e identificación Campylobacter spp en muestras de carcasa o carne de ave. Dil 3 Insumo Hra. Hombre Aseg. Calidad Costos indirectos Bolsa estéril Bolsa Qwik Seal Agua peptonada 0,1% Agua peptonada 0,1% Agua peptonada 0,1% HEB Extracto de Levadura Caldo nutritivo Suplemento FBP Clorohidrato vancomicina Trimetoprim lactato Cefaperazona de sodio Cicloheximida Sangre lisada de caballo MCCDA Glicerol Campi Pack Plus Papel filtro Caldo Brucella Suplemento FBP Presentación Cantidad Presentación en Análisis a Usar Volumen ml/Mta $/Producto por Producto HR UN UN UN 1 $ 114 UN 1 $ 304 Botella 1 200 200 $ 33.095 500 Tubo 3 9 27 $ 33.095 500 Tubo 1 10 10 $ 28.000 500 $/g-ml Receta gEnvase(g/Lt) ml/Mta 66,2 66,2 56,0 1 1 39,5 0,200 0,027 0,395 $/Mta $ 957 $ 160 $ 7.742 $ 114 $ 304 $ 13 $2 $ 22 Botella Botella Botella Botella Botella Botella Botella Botella 1 1 1 1 1 1 1 1 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 $ 19.398 $ 41.630 $ 31.770 $ 61.990 $ 65.750 $ 55.700 $ 198.102 $ 63.000 454 500 3,75 0,25 0,05 1 5 500 42,7 83,3 8472,0 247960,0 1315000,0 55700,0 39620,4 126,0 6 25 0,75 0,01 0,0125 0,015 0,1 50 0,600 2,500 0,075 0,001 0,001 0,002 0,010 5,000 $ 26 $ 208 $ 635 $ 248 $ 1.644 $ 84 $ 396 $ 630 Placa Gota Bolsa UN Tubo Tubo 1 16 4 4 3 3 80 0,05 0,5 0,5 10 10 80 0,8 2 2 30 30 $ 57.960 $ 4.900 $ 44.660 $ 5.363 $ 58.536 $ 31.770 500 1000 25 100 500 3,75 115,9 4,9 1786,4 53,6 117,1 8472,0 45,5 1 1 1 28 0,75 3,640 0,800 2,000 2,000 0,840 0,023 $ 422 $4 $ 3.573 $ 107 $ 98 $ 191 - 45 - M. semisólido glucosa Rojo de fenol NaOH Peroxido de hidrogeno Agar BFBP Suplemento FBP Disco Cefalotina Disco Acido nalidixico Bactident Oxidasa Placa Petri Desechable TOTAL Tubo Tubo Tubo Gota Placa Placa UN UN UN Placa 3 1 1 3 3 3 3 3 3 7 * Sin IVA * Valores en pesos chilenos - 46 - 10 2,5 10 1 20 20 1 1 1 30 2,5 10 3 60 60 3 3 3 $ 50.560 $ 15.600 $ 9.500 $ 21.720 $ 52.682 $ 31.770 $ 5.900 $ 5.900 $ 17.500 $ 45 500 5 500 1000 500 3,75 250 250 50 101,1 3120,0 19,0 21,7 105,3 8472,0 23,6 23,6 350,0 28 0,08 100 1 43 0,75 1 1 1 0,840 0,000 1,000 3,000 2,580 0,045 3,000 3,000 3,000 $ 85 $1 $ 19 $ 65 $ 272 $ 381 $ 71 $ 71 $ 1.050 $ 315 $ 19.909 Según las anteriores tablas podemos determinar que el análisis de Campylobacter spp es costoso tanto para el laboratorio como para el cliente; ya que esta técnica requiere de equipos y medios de cultivos específicos que tienen un alto valor en el mercado. Se debe tener en cuenta que estos precios no incluyen IVA ni tampoco el porcentaje de ganancia que el laboratorio establece. Cuando estos valores se sumen al costo del análisis, el valor final de la prueba será mayor y este no favorece a los clientes. No todas las empresas chilenas le dan importancia a este análisis, son pocas las que tienen en cuenta hacerlo. Desde enero hasta agosto del 2007 solo entraron 14 muestras para el análisis de Campylobacter spp al laboratorio, numero que no es bueno para una prueba tan costosa. La inversión que el laboratorio tendría que hacer en equipos es alta y pasaría mucho tiempo en recuperarse si tenemos en cuenta los pocos análisis que llegan al laboratorio, un promedio de 2 análisis por mes. La proyección de ingresos es baja. Actualmente el laboratorio subcontrata a la Universidad de Chile para realizar este análisis, ellos se basan en la metodología de la 4º ED. Compendium of Methods for the Microbiological Examination of Foods, APHA donde hacen únicamente la cuantificación del microorganismo por un valor de $ 20.640 por análisis. - 47 - 8. CONCLUCIONES No es posible implementar el análisis de Campylobacter spp basado en la metodología USDA/FSIS MLG Capitulo 6 1998 debido a que es muy costoso. Al comparar el costo del análisis determinado por la investigación y el costo del análisis subcontratado es conveniente seguir con el laboratorio subcontratado. Según este estudio los equipos necesarios para el análisis de Campylobacter spp basado en la USDA/ FSIS son muy costosos y solo se utilizarían para esta prueba. La proyección de ingresos no es prospera para el laboratorio ya que no muestra la recuperación de la inversión a corto o mediano plazo. La metodología USDA/FSIS MLG capitulo 6 1998 para el aislamiento y cuantificación de Campylobacter spp descrita en este estudio es de fácil manejo. Para los clientes no es favorable realizar un análisis tan costoso teniendo en cuenta la competencia que hay en el mercado. - 48 - 9. RECOMENDACIONES Para implementar el análisis de Campylobacter spp en el laboratorio LABSER es importante hacer una evaluación de otros métodos para el aislamiento e identificación y cuantificación de este microorganismo. Se podría desarrollar una segunda evaluación de costos directos e indirectos para tener el margen de precios que existen en el mercado actualmente. Realizar diferentes cotizaciones de los insumos con otras casas comerciales ya que en este estudio solo se tuvieron en cuenta algunos proveedores a los cuales LABSER siempre compra sus productos. Hacer un análisis mercados y exigencias futuras que estos tienen para exportaciones de productos alimentarios; que países exigen este análisis a los que Chile exporta, y si realmente es importante implementar Campylobacter spp. Desarrollar un programa con el proveedor con el fin de disminuir el costo del análisis. - 49 - 10. REFERENCIAS Aguamarket. Productos y servicios para la industria del agua Latinoamericana. (http://www.aguamarket.com/diccionario/terminos.asp?Temas=453&termino =&Id=453) (Consulta 2 Septiembre 2007) Blaser, M. 2000. Campylobacter jejuni and related species. In: Mandell, Bennett, Dolin, eds. Principles and Practice of Infectious Diseases. 5th Ed. New York: Churchill Livingstone. Campylobacter: http://www.bvsops.org.uy/pdf/campylobacter.pdf (Consulta: 21 de Agosto 2007). Canals A. Campylobacteriosis en aves de corral. Departament de Sanitat i Seguretat Social. Generalitat de Catalunya. Veterinario Oficial Matadero de Aves Moré, S.A. (Argentina). http://www.colvet.es/ infovet/ ene02/ciencias_v/ articulo 1.htm (Consulta: 20 de Agosto 2007). DIFCO laboratories. Difco Manual: Dehydrated culture media and reagents for microbiology.Detroit Michigan. Fernández, H. 2003. Manual de procedimientos diagnostico de Campylobacter en muestras clínicas y de alimentos. Instituto de Microbiología Clínica. Facultad de Medicina. Universidad Austral de Chile. Argentina. Pág.: 1- 22. García, E. Cravio, A. 2007. Campylobacter y enfermedades asociadas. Epidemiología Molecular y Genómica Bacteriana. Facultad de Medicina, UNAM. Vol.50 No.1 Enero-Febrero. Pág.: 31– 35. Kapperud ,G. 1994. Campylobacter infection. Epidemiology, risk factors and preventive measures. Tidskr Nor Laegeform. Vol 114: 795-799. - 50 - LABSER. Laboratorio de servicios avanzados. http://www.labser.cl/HOME.htm (Consulta: 20 Agosto 2007) Malavez, Y. 2005 . Detección de Campylobacter jejuni en las incubadoras de una planta procesadora de pollos barrilleros de Puerto Rico. Maestro en Ciencias y tecnología de alimentos. Universidad de Puerto Rico. Recinto Universitario de Msayagüez. Puerto Rico. Pág.: 1- 52. MERCK. Microbiology Manual. 12 th edition, Darmstadt, Germany. Ministerio de Salud. 2001. Manual de procedimientos de Campylobacter. Subsecretaria de Investigación y Tecnología. Instituto Nacional de Enfermedades Infecciosas. Departamento de Bacteriología. Bacteriología sanitaria. Buenos Aires, Argentina. Pág.: 1-29. National Center for Biotechnology Information. Taxonomy browser: Campylobacter group. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi? CMD =&DB=taxonomy (Consulta: 15 Agosto 2007). Noordzij, P. 2002. Ganglioside mimicry of Campylobacter jejuni lipopolysaccharide determines antiganglioside specificity in rabbits. Infect Immun. Vol 70: 5081-5085. Otros ganados: aborto caprino y ovino. http://www.a- campo.com.ar/espanol/ot_gan/ot_gan2.htm. (Consulta: 24 Agosto 2007) Protocolos de las pruebas de identificación http://chopo.cnice.mecd.es/~gdiaz3/apuntes/UT162.pdf. Septiembre 2007) - 51 - bacteriana. (Consulta: 3 Repiso, M. Campylobacteriosis genital bovina. http://www.produccionbovina.com/sanidad_intoxicaciones_metabolicos/enfer medades_reproduccion/08-enfermedades_afectan_reproduccion.htm. (Consulta: 25 Agosto 2007) USDA/FSIS Microbiology Laboratory Guidebook 3rd edition/1998. Chapter 6. Isolation, identification, and enumeration of Campylobacter jejuni/coli from meat and poultry products. Gerri m. Ransom and Bonnie E. Rose Velasco, E. Yamasaki, A. 2002. Bacterias de interés veterinario. Medicina veterinaria vol. 19 (1): 1-11. - 52 -