ganvirel
Anuncio

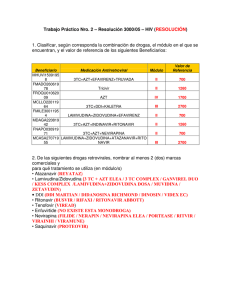
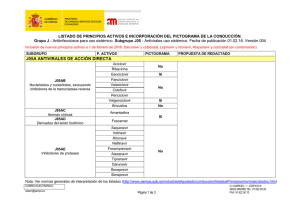
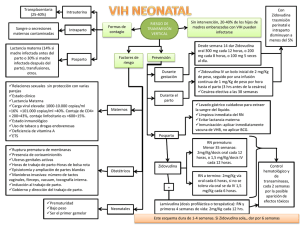
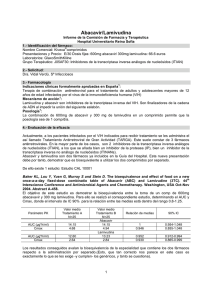
GANVIREL ® LAMIVUDINA Comprimidos recubiertos Industria Argentina Venta bajo receta archivada FORMULA: Cada comprimido recubierto contiene: Lamivudina 150 mg Excipientes: lactosa, dióxido de silicio coloidal, celulosa microcristalina, almidón glicolato sódico, povidona K30, estearato de magnesio, hidroxipropilmetilcelulosa, etilcelulosa N20, dióxido de titanio, talco, propilenglicol, tween 80 c.s. ACCION TERAPEUTICA: Análogo nucleósido inhibidor de la transcriptasa reversa. ( Código ATC: J05AF05). PROPIEDADES FARMACOLOGICAS: Propiedades farmacodinámicas: Virología: Lamivudina es un potente inhibidor selectivo de la autorreproducción in vitro del HIV-1 y HIV-2. También es activa contra aislados clínicos, resistentes a zidovudina del HIV. Continúa investigándose la relación entre susceptibilidad in vitro del HIV a Lamivudina y la respuesta clínica a la terapéutica. Las pruebas de la sensibilidad in vitro no se han estandarizado y los resultados pueden variar según los factores metodológicos. Se ha comunicado una sensibilidad in vitro reducida a Lamivudina en el caso de aislados del HIV de pacientes tratados con Lamivudina. Se ha demostrado que Lamivudina actúa en forma aditiva o sinérgica con otros agentes anti-HIV, concretamente la zidovudina, inhibiendo la autorreproducción del HIV en cultivos celulares. Los estudios in vitro indican que aislados de virus resistente a la zidovudina pueden convertirse en sensibles a ella cuando adquieren simultáneamente resistencia a Lamivudina. Además, in vivo, se ha demostrado que Lamivudina más zidovudina demora la aparición de aislados resistentes a la zidovudina en personas que no habían recibido tratamiento antirretrovírico anteriormente. In vitro Lamivudina demuestra poseer una baja citotoxicidad para los linfocitos de la sangre periférica, para las líneas celulares establecidas de linfocitos y monocitos-macrógafos y para una variedad de células progenitoras de la médula ósea. Por lo tanto Lamivudina tiene, in vitro, un elevado índice terapéutico. Lamivudina se metaboliza intracelularmente en el 5’-trifosfato que tiene una vida media intracelular de 10,5 a 15,5 horas. El 5’-trifosfato de Lamivudina es un débil inhibidor de las actividades dependientes del ARN y ADN de la transcriptasa inversa del HIV; su principal modo de acción es la terminación de la cadena de la transcriptasa inversa del HIV. Lamivudina no interfiere el metabolismo de los desoxinucleótidos, y ejerce poco efecto sobre las células del mamífero y el contenido de ADN mitocondrial. Propiedades farmacocinéticas: Lamivudina se absorbe bien en intestino, y la biodisponibilidad de Lamivudina por vía oral en el adulto es normalmente entre un 80% y un 85%. Tras su administración por vía oral, el tiempo (tmáx) promedio hasta alcanzar las concentraciones séricas máximas (Cmáx) es de alrededor de una hora. A las dosis terapéuticas, es decir, 4 mg/kg/día (en forma de dos dosis, una cada 12 horas), la Cmáx es del orden de 1 a 1,5 mcg/ml. A juzgar por los estudios realizados por vía intravenosa, el volumen medio de la distribución es de 1,5 l/kg y la vida media terminal de eliminación es de 5 a 7 horas. La depuración general media de Lamivudina es de aproximadamente 0,32 l/kg/h, con una depuración predominantemente renal (> 79%) a través de la secreción tubular activa, pero con poco metabolismo hepático (< 10%). En los niños, los niveles plasmáticos de Lamivudina disminuyen con relación a la dosis del adulto. Esto es a consecuencia de una absorción menor (biodisponibilidad), aproximadamente 65% y de una depuración mayor (0,52 l/kg/h). No obstante, se recomienda una dosis mayor para los pacientes pediátricos (8 mg/kg/día) que proporcione una exposición comparable a la de la dosis recomendada para el adulto (150 mg 2 veces al día). No es necesario ajustar la dosis cuando se coadministre con comida, dado que la biodisponibilidad de Lamivudina no se altera aunque se han observado una demora de tmáx, y una reducción de la Cmáx, Lamivudina presenta una farmacocinética lineal en la escala de dosis terapéuticas y se enlaza limitadamente con la principal proteína plasmática, la albúmina. La eliminación de Lamivudina será afectada por el compromiso renal, ya esté relacionado con una enfermedad o con la edad. En la sección sobre la posología, figuran las dosis recomendadas para pacientes con una depuración de la creatinina por debajo de 50 ml/min. La coadministración de zidovudina produce un aumento del 13% de la exposición a ésta y un aumento del 28% de los niveles plasmáticos máximos. Esto no se considera importante para la seguridad del paciente y por lo tanto no es necesario ajustar la dosis. La asociación de Lamivudina, zidovudina y didanosina (ddl) se ha investigado en pacientes pediátricos. No hubo diferencias importantes en el ABC para ninguno de estos tres fármacos cuando se administraron por sí solos o en asociaciones de dos o de tres. La probabilidad de interacciones medicamentosas con Lamivudina es escasa debido a lo limitado del metabolismo y del enlace con las proteínas plasmáticas y a su casi completa depuración renal. La interacción con la trimetoprima, un constituyente del cotrimoxazol, causa un aumento del 40% de la exposición de Lamivudina a las dosis terapéuticas. Esto no exige ajustar la dosis a menos que el paciente también padezca de compromiso renal (véanse los ajustes de las dosis en la sección sobre el compromiso renal). Deberá evaluarse cuidadosamente la administración de cotrimoxazol con la asociación de Lamivudina/zidovudina en pacientes con compromiso renal. Datos limitados demuestran que Lamivudina penetra en el Sistema Nervioso Central y alcanza el líquido cefalorraquídeo (LCR). La relación media de la concentración en el LCR/sérica de Lamivudina, 2 a 4 horas después de su administración por vía oral, fue aproximadamente 0,12. Se desconoce el verdadero grado de penetración o la relación con la eficacia clínica. Datos preclínicos sobre seguridad y/o toxicidad: la administración de Lamivudina en los estudios de toxicidad en animales, a dosis muy elevadas, no fue acompañada de toxicidad en ninguno de los principales órganos. Los efectos clínicamente pertinentes advertidos fueron una reducción de la cuenta de glóbulos rojos y neutropenia. Lamivudina no fue mutagénica en las pruebas bacterianas pero, como en el caso de muchos otros análogos del nucleósido, mostró actividad en un análisis citogenético in vitro y en el análisis del linfoma murino. Lamivudina no fue genotóxica in vivo, a dosis que dieron concentraciones plasmáticas de 30 a 40 veces mayores que los niveles plasmáticos clínicos previstos. No hay datos todavía sobre el peligro tumorigénico en los animales, y por lo tanto cualquier peligro potencial para el ser humano tendrá que sopesarse frente a los beneficios esperados del tratamiento. INDICACIONES: Lamivudina, en asociación con zidovudina, está indicada para el tratamiento de: - Adultos infectados con HIV, con inmunodeficiencia progresiva (recuento de células CD4 = 500 células/mm3), que no han recibido tratamiento antirretrovírico anteriormente. - Adultos infectados con HIV, con inmunodeficiencia progresiva, que han sido tratados anteriormente con zidovudina. - Niños infectados con HIV, con inmunodeficiencia progresiva, que no han sido tratados anteriormente o que han sido tratados anteriormente con zidovudina. POSOLOGIA: Adultos y adolescentes (12 a 16 años): la dosis recomendada es 150 mg de Lamivudina, 2 veces al día, en asociación con zidovudina. Para adultos con bajo peso corporal (menos de 50 kg) la dosis oral recomendada de Lamivudina es de 2 mg/kg, 2 veces por día administrados en combinación con zidovudina. No hay datos disponibles respecto a recomendación de dosis para adolescentes con bajo peso corporal (menos de 50 kg). Pacientes pediátricos: la dosis recomendada para pacientes pediátricos (hasta 12 años de edad) es de 4 mg/kg de Lamivudina, 2 veces al día, hasta un máximo de 300 mg diarios, en asociación con zidovudina. No se tiene experiencia en niños de menos de 3 meses de edad. Compromiso renal y hepático: los niveles plasmáticos de Lamivudina (ABC) ascienden en pacientes con un compromiso renal de moderado a severo, debido a la depuración disminuida. Por lo tanto, deberá ajustarse la dosis en estos casos (véase el cuadro). Ajuste de dosis de Lamivudina según clearance de creatinina: adultos (> 16 años) Clearance de creatinina ≥ 50 Dosis recomendada de Lamivudina (ml/min) 150 mg, 2 veces por día 30 - 49 150 mg, 1 vez por día 15 - 29 150 mg la primera dosis, luego 100 mg 1 vez por día 5 - 14 150 mg la primera dosis, luego 50 mg 1 vez por día <5 50 mg la primera dosis, luego 25 mg 1 vez por día No se dispone de datos suficientes para recomendación de dosis en pacientes dializados. Como Lamivudina se excreta casi exclusivamente por vía renal, no es necesario ajustar la dosis para los pacientes con compromiso hepático. CONTRAINDICACIONES: El uso de Lamivudina está contraindicado en los pacientes con hipersensibilidad conocida a Lamivudina o a cualquier componente del preparado. En la asociación con zidovudina, deberán tenerse en cuenta las precauciones, contraindicaciones y advertencias para su uso de esta última droga. ADVERTENCIAS: Se ha observado pancreatitis en algunos pacientes que reciben Lamivudina. No obstante, no está claro si se debe a la farmacoterapia o a la infección subyacente con HIV. Deberá sospecharse pancreatitis cuando el paciente desarrolle dolor abdominal, náusea, vómito o elevación de los marcadores bioquímicos. Se cesará el tratamiento con Lamivudina hasta excluirse el diagnóstico de pancreatitis. En la población pediátrica con una historia de pancreatitis u otros factores de riesgo significativos para el desarrollo de pancreatitis, la combinación de Lamivudina y zidovudina deberá ser utilizada con extrema precaución y sólo si no hay tratamientos alternativos satisfactorios. PRECAUCIONES ESPECIALES: Debido a que los efectos adversos experimentados pueden ser atribuibles al componente zidovudina de la terapéutica combinada, deberán consultarse los datos completos sobre la prescripción de zidovudina antes de iniciar la politerapia. Los pacientes que reciben Lamivudina o cualquier otro tratamiento antirretrovírico, pueden continuar contrayendo infecciones oportunistas y otras complicaciones de la infección por HIV. El tratamiento con Lamivudina no ha demostrado que disminuya la frecuencia de dichas enfermedades. Debe avisarse a los pacientes que no se ha demostrado que la terapéutica antirretrovírica actual, incluyendo Lamivudina, impida el peligro de transmitir el HIV a otras personas a través del contacto sexual o por la contaminación de la sangre. Deberán continuarse adoptando las precauciones debidas. En los pacientes con un compromiso renal moderado a serio, la vida media terminal plasmática de Lamivudina aumenta debido a la disminución de la depuración. Deberá ajustarse la dosis (véase POSOLOGIA - Compromiso renal y hepático). Lamivudina deberá usarse con cautela en pacientes con hepatopatía cirrótica debida a infección crónica por Hepatitis B, dado que existe cierto peligro de hepatitis de rebote después del tratamiento. EMBARAZO Y LACTANCIA: No se ha determinado la inocuidad de Lamivudina durante el embarazo humano. Los estudios de reproducción en animales no han demostrado teratogenicidad, ni efecto alguno sobre la fertilidad del macho o de la hembra. Hubo cierta evidencia de una embrioletalidad precoz cuando se administró a conejas gestantes a niveles de exposición comparables a los alcanzados en el ser humano. Lamivudina cruza la placenta animal, pero no hay datos sobre la transferencia placentaria humana. Aunque los estudios de la reproducción en animales no siempre predicen la respuesta humana, solamente deberá considerarse la administración del fármaco durante el embarazo si el beneficio esperado sobrepasa cualquier posible riesgo. Un estudio en ratas lactantes demostró que, tras su administración por vía oral, Lamivudina fue excretada por la leche. No se sabe si Lamivudina es excretada por la leche humana. Se recomienda que las madres que tomen Lamivudina no amamanten a sus hijos. EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y PARA MANEJAR MAQUINARIAS: No se ha realizado ningún estudio para investigar el efecto de Lamivudina sobre la capacidad para conducir vehículos o manipular maquinarias. Además, no puede predecirse un efecto perjudicial sobre tales actividades a partir de la farmacología del medicamento. No obstante, deberá tenerse presente el estado clínico del paciente y el perfil de eventos adversos tanto de Lamivudina como de zidovudina al considerar la capacidad del paciente para conducir o manejar maquinaria. CARCINOGENESIS, MUTAGENESIS Y RETRASO DE LA FERTILIDAD: Estudios a largo plazo sobre carcinogenicidad de Lamivudina en animales no han sido completados. No hay evidencia de genotoxicidad in vivo en la rata a dosis orales de hasta 2.000 mg/kg. No se ha observado deterioro de la fertilidad, administrado a ratas a dosis de hasta 130 veces la dosis usual del adulto. INTERACCIONES CON OTROS MEDICAMENTOS Y DE OTROS TIPOS: La probabilidad de interacción es escasa gracias a lo limitado del metabolismo y de la combinación con proteínas plasmáticas y a una depuración renal casi completa. Los niveles plasmáticos de zidovudina no cambian mucho cuando se coadministra con Lamivudina. La zidovudina no ejerce ningún efecto sobre la farmacocinética de Lamivudina (véase la sección Propiedades farmacocinéticas). La administración de trimetroprima, un constituyente del cotrimoxazol, causa un aumento de los niveles plasmáticos de Lamivudina. No obstante, a menos que el paciente padezca de compromiso renal, no es necesario ajustar la dosis de Lamivudina (véase la sección Compromiso renal y hepático). Esta última no ejerce ningún efecto sobre la farmacocinética de cotrimoxazol. Deberá pensarse la posibilidad de interacciones con otros fármacos administrados concurrentemente, en especial cuando su principal vía de eliminación sea la renal. Para más datos sobre las interacciones de la zidovudina, consultar los datos correspondientes a esta última droga. EFECTOS ADVERSOS: Lamivudina es habitualmente bien tolerada y la mayoría de los eventos adversos serios evaluados no están relacionados con el tratamiento de base con Lamivudina. Se han comunicado los siguientes eventos adversos (≥ 5%) durante el tratamiento contra la infección por HIV, con Lamivudina como monoterapia y en asociación con zidovudina. En el caso de muchos de ellos, no está claro si están relacionados con el fármaco o si son consecuencia del proceso patológico subyacente: Generales: cefalea, malestar general y fatiga, fiebre. Digestivos: náuseas, diarrea, náuseas y vómitos, anorexia y/o apetito disminuido, dolor abdominal, dispepsia. Sistema Nervioso: neuropatía, insomnio y otros trastornos del sueño, vértigos y/o mareos, trastorno depresivo. Respiratorios: signos y síntomas nasales, tos. Cutáneos: rash. Musculoesqueléticos: dolor musculoesquelético, mialgia, artralgia. Han habido comunicaciones de pancreatitis (< 0,5%), si bien su relación causal con el tratamiento a menudo no estuvo clara. Los cambios en los parámetros de laboratorio incluyen: neutropenia (7,2%), trombocitopenia (0,4%), anemia (2,9%), ascensos transitorios de las enzimas hepáticas séricas (1,7% y 3,7%; para AST y ALT, respectivamente) y ascensos de la amilasa sérica (4,2%) y de la bilirrubina (0,8%). Debido a que los efectos adversos pueden ser atribuibles al componente zidovudina de la terapéutica combinada, deberán consultarse los datos completos sobre la prescripción de zidovudina antes de iniciar la politerapia. Pacientes pediátricos: información limitada sobre la incidencia de eventos adversos en niños que reciben monoterapia con Lamivudina, es disponible a partir de un ensayo clínico abierto, no controlado. El 14% de los niños que recibieron monoterapia con Lamivudina, desarrollaron pancreatitis. En otro estudio comparando Lamivudina/didanosina, Lamivudina/zidovudina y Lamivudina/zidovudina/didanosina, el 15% de los niños desarrolló pancreatitis. Parestesias y neuropatía periférica se reportó en el 13% de los pacientes. Las anormalidades sobre parámetros de laboratorio, halladas durante la terapia con Lamivudina en niños, fueron: neutropenia, anemia, trombocitopenia, elevaciones de la ALT y AST y de la amilasa. Los siguientes eventos adversos han sido observados luego de la aprobación de la droga, durante su etapa de comercialización: alopecía, anafilaxia, hiperglucemia, acidosis láctica y esteatosis hepática, neuropatía periférica, prurito, rash, urticaria y debilidad. INCOMPATIBILIDADES: No se ha comunicado ninguna. SOBREDOSIFICACION: La administración de Lamivudina a dosis muy elevadas en estudios a corto plazo en animales no produjo toxicidad en ningún órgano. Hay datos limitados sobre las consecuencias de la ingesta de sobredosis agudas por el ser humano. No hubo muertes y los pacientes se recuperaron. No se identificaron signos o síntomas específicos tras esas sobredosis. De ingerirse una sobredosis, el paciente deberá ser vigilado y se aplicará el tratamiento de apoyo estándar según sea necesario. Ante la eventualidad de una sobredosificación, concurrir al Hospital más cercano o comunicarse con los Centros de Toxicología: Hospital de Pediatría "DR. RICARDO GUTIERREZ" Tel.: (011) 4962-6666 / 2247 Hospital "DR. A. POSADAS" Tel.: (011) 4654-6648 / 4658-7777 PRESENTACION: GANVIREL®: envases con 60 comprimidos recubiertos. Especialidad Medicinal autorizada por el Ministerio de Salud. Certificado No 48.179 IVAX Argentina S.A. - Suipacha 1111, piso 18 (C1008AAW) Ciudad Autónoma de Buenos Aires Directora Técnica: Rosana B. Colombo (Farmacéutica) Conservar en su envase original a temperatura ambiente entre 15ºC y 30ºC MANTENGA LOS MEDICAMENTOS FUERA DEL ALCANCE DE LOS NIÑOS Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica Fecha de última revisión: 10/1999 424062 1211