ESTRUCTURA Y FUNCIÓN DE AMINOÁCIDOS Y PROTEÍNAS
Anuncio

ESTRUCTURA Y FUNCIÓN DE AMINOÁCIDOS Y PROTEÍNAS
3.1. AMINOÁCIDOS COMO
CONSTITUYENTES DE LAS
PROTEÍNAS
Las células vivas producen gran variedad de
macromoléculas como son las proteínas,
ácidos nucleicos y polisacáridos, entre
otros. Estas macromoléculas son biopolímeros constituidos por unidades monoméricas
o estructurales. Para los ácidos nucleicos,
las unidades estructurales son los nucleótidos; para los polisacáridos son los monosacáridos.
En virtud de que las proteínas desempeñan
una amplia variedad de funciones esenciales
en los organismos, las cuales describiremos
más adelante, es evidente que para conocer
tanto el funcionamiento normal como patológico de un organismo se requiere un
conocimiento claro de la estructura y propiedades de las proteínas.
Aunque muchas proteínas contienen otras
sustancias, además de los aminoácidos, la
estructura y muchas de sus propiedades biológicas están determinadas por las clases de
aminoácidos presentes y el orden en el que
están dispuestos en la cadena polipeptídica.
Es asombroso que en una célula existan
millares de proteínas con estructura y fun-
ción diferentes, pero resulta aún más sorprendente que todas ellas estén integradas
por sólo 20 aminoácidos comunes. Los aminoácidos comunes son aquéllos para los que
existe un codón específico en el código genético del DNA (ver el capítulo Ácidos nucleicos). Los aminoácidos derivados son
generados después de su incorporación a la
molécula proteínica.
Además de ser las unidades estructurales
de las proteínas, los aminoácidos tienen
otras funciones importantes como la transmisión de impulsos en el sistema nervioso,
como material energético, y otros.
3.1.1.
Estructura general
Desde el descubrimiento del primer aminoácido, asparagina, en 1806, habrían de pasar
más de 130 años para que le llegara el turno
a la treonina, con la que se cerró la lista de
los 20 aminoácidos.
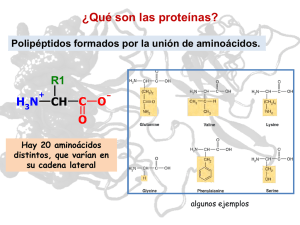
Un aminoácido es un compuesto que contiene dos grupos funcionales: un grupo amino
y uno carboxüo. Ambos grupos están unidos
al mismo átomo de carbono, designado carbono a. Al carbono a de cada aminoácido
también está unido un átomo de hidrógeno y
Tabla 3.2.
del espárrago, alanina de alantoides) o de alguna propiedad característica (glicina por su
sabor dulce). De la denominación trivial ha
surgido una abreviatura de tres letras que, dadas las técnicas modernas de secuenciación,
han obligado la anotación de los aminoácidos por una sola letra mayúscula (tabla 3.1.).
Los aminoácidos presentes en las proteínas pueden clasificarse en dos grandes grupos dependiendo de la polaridad relativa de
sus grupos R (tabla 3.2).
3.1.4.1. Aminoácidos con grupo R no polar
Los aminoácidos más hidrofóbicos (no polares) son la fenilalanina, leucina, isoleucina,
valina, alanina, metionina y triptofano.
Clasificación de los L-a-aminoácidos presentes
en las proteínas con base a las polaridades relativas de sus grupos R. Un grupo no polar es aquel
que tiene poca o ninguna diferencia de carga de una región a otra, en tanto que un grupo
polar tiene una diferencia de carga relativamente grande en diferentes regiones.
La mayoría de las cadenas laterales de los ca, lejos del agua de solvatación de la superaminoácidos más hidrofóbicos están orien- ficie.
tadas hacia el interior de la molécula protei-
En la prolina el grupo R es único ya que incorpora el grupo amino en la cadena lateral. Realmente la prolina es un iminoácido que tiene
consecuencias estructurales importantes para
las proteínas como veremos más adelante.
La glicina, el más pequeño de los aminoácidos, puede encajar en regiones de la estructura tridimensional de las proteínas
inaccesibles para otros aminoácidos.
3.1.4.2. Aminoácidos con grupo R polar
sin carga
A este grupo pertenecen aminoácidos cuya
cadena lateral tiene naturaleza polar (hidrofi'licá) como son la serina, treonina, cisteína,
asparagina, glutamina y tirosina.
3.1.43. Aminoácidos con grupo R polar
con carga negativa
En esta categoría se encuentran los ácidos
aspártico y glutámico.
3.1.4.4. Aminoácidos con grupo R polar
con carga positiva
Los aminoácidos que pertenecen a este grupo son la lisina, arginina e histidina.
Las cadenas laterales de los aminoácidos
polares sin carga se encuentran en proporciones significativas tanto en el interior como en la interfase de la proteína con el
disolvente. Por el contrario, los aminoácidos
polares glutamina y asparagina y los que tie-
nen grupos cargados a pH 7.0 como Usina,
arginina, histidina, glutamato y aspartato se
hallan predominantemente en la superficie
de las proteínas globulares donde la carga se
encuentra estabilizada por el disolvente
acuoso. La colocación poco usual de una cadena lateral cargada en el interior de una
proteína globular se correlaciona con un papel estructural o funcional esencial.
Los grupos R con carga de los aminoácidos básicos y acídicos, tienen un papel clave
en la estabilización de la conformación proteínica a través de enlaces salinos. Además,
funcionan en sistemas enzimáticos que requieren de transmisión de cargas. Ya se ha
mencionado el lugar importante de la histidina en la catálisis enzimática en virtud de la
carga de su grupo imidazol que le permite
funcionar, a pH 7.0, como base o como ácido catalítico.
3.1.5.
3.1.5.1. Ejemplos de importancia
La omitiría funciona como intermediario en
el metabolismo de la treonina, aspartato y
metionina; junto con la citrulina, es un intermediario en la biosíntesis de la urea.
Aminoácidos no proteínicos
Existen aminoácidos que no forman parte de
las proteínas pero que realizan importantes
funciones en el metabolismo intermediario,
o bien, como hormonas, neurotransmisores
y otras.
La DOPA (dihidroxifenilalanina) es un
aminoácido neurotransmisor, precursor de
la melanina y se encuentra en la vía metabólica biosintética de las aminas neurotransmisoras: d o p a m i n a , a d r e n a l i n a y
noradrenalina.
molécula de agua y formando un tipo de enlace amida conocido como enlace peptídico
(fig-3.8)
3.2.2. Formación
El enlace peptídico posee una serie de interesantes características estructurales. Dada
la resonancia del grupo carbonilo (-C-), el
II
o
El ácido gama-aminobutírico (GABA) es
un neurotransmisor derivado del glutamato.
enlace peptídico tiene naturaleza de doble
enlace parcial.
H2N-CH2-CH2-CH2-COOH
GABA
3.2. ENLACE PEPTÍDICO
La reacción más importante de los aminoácidos es el enlace peptídico. Este enlace determina la fuerza de unión primaria de una
proteína; su estructuración corresponde a
una polimerización de aminoácidos, es decir, una proteína es un polipéptido complejo.
3.2.1. Definición
El grupo a -carboxilo de un aminoácido (RO
puede unirse covalentemente al grupo a amino de otro aminoácido (R2) eliminando una
3.2.3. Estructura del etano
Si recordamos la estructura del etano (un
enlace C-C) y del etileno (doble enlace
C=C) veremos que en el primer caso, los
átomos de carbono del etano giran libremente teniendo como eje el enlace sencillo; en
cambio, el doble enlace del etileno representa una estructura rígida que impide la libre rotación.
3.2.4 Estructura coplanar
El enlace peptídico con la característica de
ser un doble enlace parcial, determina una
estructura rígida entre carbono y nitrógeno y
por lo tanto es un enlace coplanar. En un polipéptido, los carbonos a de aminoácidos
cercanos están en situación trans respecto al
enlace peptídico.
33. PÉPTIDOS
3.3.1. Definición
3.2.5. Rotación del enlace
Así como en el enlace peptídico no puede
haber rotación, sí puede haberla en torno a
los enlaces C-N y C-C determinando ángulos de conformación (y y <fr) que, en las
proteínas naturales, presentan poca variabilidad en sus valores. Esto trae como consecuencia que, en un péptido, los enlaces
peptídicos presentan una alternancia que determina una secuencia en zig-zag (fig. 3.10).
Cuando los grupos amino y carboxilo de los
aminoácidos se combinan para formar un
polipéptido. Los aminoácidos constituyentes se denominan residuos de aminoácidos.
Un péptido consta de dos o más residuos de
aminoácidos unidos por enlaces peptídicos.
En la figura 3.10 se muestra un tripéptido en
el que hay que hacer notar que es aquel formado con tres residuos, no con tres enlaces
peptídicos.
3.3.2. Clasificación
Por convención, las estructuras peptídicas se
describen a partir del residuo amino terminal (grupo-NH2 libre), que se coloca a la izquierda, y termina con el residuo carboxilo
terminal (grupo -COOH libre) que se coloca
a la derecha. La repetición de este proceso
secuencial genera un polipéptido con una
secuencia de aminoácidos específica ( R r
R2-R3-R4... Rp).
Aunque existen discrepancias en la literatura, el término oligopéptido se reserva para
moléculas con 2 a 20 residuos, polipéptido
de 20 a 50 residuos y proteína a las que superan esta cifra.
3.3.3.
Representación de estructuras
Las estructuras polipeptídicas pueden representarse colocando el aminoácido inicial (el
del extremo amino terminal) y a partir de éste colocar en zig-zag los residuos en el orden
secuencial correspondiente (fig. 3.11).
Como los polipétidos pueden contener un
número de residuos muy elevado, es poco
práctico usar las fórmulas estructurales convencionales. En cambio, puede utilizarse la
abreviatura de tres letras (o incluso de una
sola) para designar el péptido. En nuestro
ejemplo (fig. 3.11) se podría escribir: Ala Ser - Gli - Tre, o bien, A-S-G-T-.
3.3.4.
Péptidos de importancia biológica
En todos los seres vivos se han aislado péptidos de interés biológico. Uno de los más
sencillos es el tripéptido glutatión (y-glutamil-cisteinil-glicina), en el cual el glutamo
inicial está unido a la cisteína por medio del
carboxilo gama (y) en lugar del alfa ( a ), como ocurre con la gran mayoría de los péptidos.
Este tripéptido lleva a cabo funciones oxidorreductoras por su grupo sulfhídrilo (-SH),
se requiere para la actividad de varias enzimas
y participa en el transporte de aminoácidos.
Un grupo importante es el de los péptidos
cerebrales con actividad de neurotransmisores, como la sustancia P (decapéptido) o los
analgésicos opiáceos como las endorfinas y
encefalinas. Tir-Gli-Gli-Fen-Met Encefalina (Metionina) Arg-Pro-Lis-Pro-Gln-FenFen-Gli-Leu-Met Sustancia P.
La oxitocina y vasopresina son polipétidos cíclicos. Los antibióticos polipeptídicos
a menudo contienen D y L-aminoácidos y
otros no presentes en proteínas, por ejemplo,
la tirocidina y gramicidina S, que contienen
D-fenilalanina y ornitina. Estos polipétidos
no son sintetizados en los ribosomas.
Otros polipéptidos importantes son las
hormonas colecistocinina y gastrina, la insulina y glucagón, la hormona liberadora de tirotropina y otras.
3.4. PROTEÍNAS
3.4.1. Definición
Las proteínas constituyen sin duda uno de
los grupos de moléculas de gran trascendencia en los seres vivos. Todas las proteínas
son polipéptidos de peso molecular elevado.
Arbitrariamente, como se ha señalado antes,
se ha establecido como línea divisoria entre
polipétidos y proteínas un peso molecular de
8,000 y 10,000. Una proteína simple es aquélla que contiene sólo aminoácidos; una proteína compleja contiene, además, otras moléculas
diferentes como el hemo (de la hemoglobina), vitaminas, lípidos, carbohidratos o elementos minerales (metaloenzimas).
3.4.2.
Importancia biomédica
Las proteínas desempeñan una amplia variedad de funciones que pueden agruparse en
dos clases: dinámicas y estructurales. De las
funciones dinámicas, la más importante es la
función catalítica. De hecho, la mayor parte
de las reacciones químicas celulares son
catalizadas por enzimas, casi todas ellas de
naturaleza proteica. En realidad, estas moléculas son tan importantes que merecen un
capítulo especial dentro de la bioquímica.
Otra función dinámica de las proteínas es
el transporte, ejemplos de este grupo son la
hemoglobina y mioglobina. Otras proteínas
actúan como hormonas. Las proteínas también pueden funcionar con un papel protector
como las inmunoglobulinas y el interferón.
Algunas participan en los mecanismos contráctiles como la miosina y actina. Otras tienen una función de reconocimiento, como es
el caso de los receptores hormonales situados en la membrana celular o en el citosol.
Dentro de las proteínas estructurales se
encuentran el colágeno, la elastina y la queratina.
Así pues, las proteínas son quizá las macromoléculas más versátiles, que se responsabilizan en gran parte de las funciones metabólicas
y de la morfología de los seres vivos. No en
vano el término proteína deriva del griego
proteos que significa "primero", "primoridaT.
3.4.3.
Clasificación
En la actualidad no existe un sistema de clasificación de las proteínas universalmente
aceptado. Durante mucho tiempo se dividieron en simples y conjugadas. Sin embargo,
en todas las proteínas, aun las más simples,
casi siempre están asociadas otras moléculas
llamadas grupo prostético. En esto se basa
la clasificación propuesta en la tabla 3.3.
3.4.3.1. Basada en su solubilidad
Un sistema de clasificación basado en la solubilidad todavía está en uso, en particular
en bioquímica clínica (tabla 3.4.).
Sin embargo en esta clasificación, no se
puede hacer una distinción entre albúminas
y globulinas únicamente en base a sus solubilidades en agua o en soluciones salinas.
Así, se subdividieron en seudoglobulinas
(solubles al agua) y euglobulinas (insolubles
en agua exenta de sales).
3.4.3.2. Basada en la forma
Otra clasificación se basa en la forma (relación entre longitud y amplitud) y en ésta se
consideran Xas proteínas globulares, de forma esférica, solubles en agua, dentro de las
cuales se encuentran la insulina, albúmina y
Albúminas
Globulinas
Solubles en agua y en soluciones salinas. Sin aminoácidos distintivos
Escasamente solubles en agua pero solubles en soluciones salinas.
Sin aminoácidos distintivos
Protaminas
Solubles en etanol a 70-80% pero insolubles en agua y en alcohol etilíco
absoluto. Ricas en arginina
Histonas
Solubles en soluciones salinas
Escleroproteínas Insolubles en agua o en soluciones salinas. Ricas en glicina, alanina y prolina
globulinas plasmáticas y numerosas enzimas.
Las proteínas fibrosas, son de forma alargada, baja solubilidad en agua, resistentes a la
tracción, dentro de las cuales tenemos la
queratina, miosina, colágeno y fibrina.
3.43.3. Basada en sus funciones
Las proteínas se pueden clasificar de acuerdo a sus funciones en proteínas estructurales,
catalíticas ( e n z i m a s ) , reguladoras,
protectoras (inmunoglobulinas), de transporte, etc. (tabla 3.5).
3.4.4. Importancia biológica de las
proteínas, Genes y proteínas. Diversidad
Hemos mencionado el papel tan relevante y
versátil de las proteínas con sus múltiples
funciones. La diversidad de formas y funciones proteicas que existen en una sola célula, formadas a partir de 20 aminoácidos,
nos indica que tal variabilidad depende de la
combinación casi infinita de aminoácidos en
cada una de las proteínas existentes en un
ser vivo. ¿Qué determina tal variabilidad?
En los siguientes subcapítulos hablaremos de los niveles de organización de la es-
una cadena lateral, designada R que es diferente para cada uno de los 20 aminoácidos
comunes excepto para la glicina (fig. 3.1).
3.1.2. Propiedades generales
3.1.2.1. Asimetría. Estereoisomería
Con excepción de la glicina, para la cual
R-H, los cuatro grupos unidos al carbono a
de los aminoácidos son diferentes. Esta
orientación tetraédrica con cuatro grupos diferentes alrededor del carbono a confiere
actividad óptica (capacidad de rotar el plano
de luz polarizada) a los aminoácidos. En la
configuración absoluta, utilizando la proyección de Fisher, el COOH está dirigido
hacia arriba y atrás del plano de la página, el
grupo R de la cadena lateral se dirige hacia
abajo y atrás del mismo plano, el grupo H y el
grupo -NH2» en el carbono a están dirigidos
hacia el lector, si por convención el grupo examino está proyectado hacia la izquierda, el
aminoácido tiene la configuración absoluta. Su
enantiómero óptico, con el grupo a-amino
hacia la derecha tiene la configuración absoluta denominada D, como en el D-gliceraldehído (fig. 3.2). En las proteínas de mamífero
sólo se encuentran L-a-aminoácidos.
La dificultad surgida de intentar denominar
familias de isómeros ópticos con dos o más
centros asimétricos ha dado lugar al establecimiento de un método más general de desig¿
nación estereoquímica, el sistema RS, donde
los grupos unidos a un orden basado en el número atómico: SH>OH>NH2>CDOH>CH3>H.
En todos los casos el grupo H se encuentra
debajo del plano. Si los otros tres grupos se
ordenan de mayor a menor prioridad en el
sentido de las manecillas del reloj, el centro
asimétrico es R (RECTUS en latín) y S (sinisterenel opuesto) (ver fig. 3.3.).
Dado que los aminoácidos de las proteínas son asimétricos, las proteínas también
tienen propiedades asimétricas.
3.1.22. Formas iónicas de los aminoácidos
Los grupos amino y carboxilo de un aminoácido pueden ionizarse. El pK del grupo
amino es 9.8 y el del grupo carboxilo es 2.1.
Por tanto, dentro de los límites fisiológicos del
pH, ambos grupos están cargados (fig. 3.4),
constituyendo un ion dipolar o switterion
(en alemán, ion híbrido).
Cabe aclarar que la estructura sin carga de
un aminoácido indicada en la fig. 3.1 no
puede existir a ningún pH, pero es posible
usarlo por conveniencia, al describir la química de los aminoácidos.
Los aminoácidos tienen carácter anfótero,
por comportarse como ácidos o bases debido a sus grupos ionizables. En los aminoácidos neutros, que existen como ion dipolar,
es decir, aquella forma en la que la carga positiva es igual a la carga negativa (carga neta
tructura proteica. El primer nivel, o estructura primaria, se refiere al orden de los aminoácidos en la cadena polipeptídica. Es
decir, cada proteína posee un ordenamiento o
secuencia de aminoácidos bien definido per o . . . ¿qué determina ese ordenamiento?
Aquí debemos detenernos y, quizá adelantando un poco, hablar de ese factor particular
en cada célula u organismo que determina
ese ordenamiento y, por ende, la gran diversidad de estructuras y funciones proteicas.
Ese elemento dictador de la secuencia polipeptídica es la unidad transmisora de los
caracteres hereditarios, el gene o gen; bioquímicamente, el DNA. La información genética contenida en cada célula o individuo
se expresa a través de una proteína, muy frecuentemente de una enzima. En este sentido,
las proteínas vienen a ser las ejecutoras de
las ordenes dictadas por los genes. Sobre esto se tratará más ampliamente en el capítulo
de ácidos nucleicos.
dos automáticos en el análisis de aminoácidos introducidos por Moore y Stein en 1964.
El analizador automático de aminoácidos
(secuenciador) está cediendo lugar actualmente a sistemas basados en métodos cromatográficos de alta eficacia, que utilizan la
técnica de degradación de Edman, y los métodos secuenciales del gen que codifica a la
proteína en estudio.
La importancia de la estructura primaria
es tal que una variación en un solo aminoácido de una cadena polipeptídica puede determinar una falta letal en la proteína
completa. El ejemplo clásico es el de la hemoglobina S (HbS) que tiene la sexta posición de la cadena P ocupada por valina en
lugar de glutámico como la hemoglobina
normal (HbAí). Los individuos que tienen
este defecto padecen anemia de células falciformes, con una elevada hemolisis y obstrucción de capilares por los eritrocitos
anormales.
3.4.5. Niveles estructurales de una
proteína*
3.4.5.2. Estructura secundaria
3.4.5.1. E s t r u c t u r a primaria
La estructura primaria, ya familiar desdé la
descripción de los péptidos, se refiere al orden de los aminoácidos en la cadena polipeptídica. La fuerza estabilizadora de esta
estructura es el enlace covalente (peptídico).
En esta estructura se incluye, además de la
secuencia de aminoácidos, la localización
de los puentes disulfuro (cistina).
La determinación de la estructura primaria de una proteína es actualmente una técnica
accesible a la mayor parte de los laboratorios de bioquímica. Esto ha sido posible gracias a los esfuerzos de Sanger, quien en 1953
fue el primero en estudiar y determinar la
estructura primaria de una proteína, la insulina. Ahora se conoce la secuencia completa
de más de 2,000 proteínas, gracias a los méto-
Si una proteína estuviera constituida por sólo una disposición polipeptídica lineal, su
única conformación posible, fuera la fibrosa.
Sin embargo, en virtud de la estructura coplanar del enlace peptídico y los ángulos de
rotación § y vy que regularmente toman valores de 132 y 123° respectivamente, surge
una estructura particularmente estable que
es la a-hélice. En este tipo de estructura secundaria, la cadena polipeptídica se pliega
adoptando una forma helicoidal con giro a la
derecha que contiene 3.6 residuos de aminoácidos por vuelta. Esta estructura fue propuesta inicialmente por Pauling y Corey. La
máxima estabilidad de la hélice está determinada por puentes de hidrógeno que se establecen entre el grupo carbonilo (C-0) de
un enlace peptídico y el amino (N-H) presente cuatro residuos más adelante en la cadena (fig. 3.12).
Figura 3.12. Representación de un polipéptido en conformación de a-hélice
En la conformación de a-hélice las cadenas
laterales R se proyectan en forma perpendicular al eje de la hélice y hacia el exterior de
la estructura en espiral generada por la cadena peptídica. Si estos grupos R están próximos y tienen carga del mismo signo o están
ramificados (valina, isoleucina), sus interacciones desestabilizan la estructura helicoidal. Otro factor que rompe la conformación
a-helicoidal es la presencia de prolina, ya
que el anillo pirrolidina de su cadena lateral
interacciona estéricamente con la cadena lateral del aminoácido precedente y, además,
porque no puede ocurrir rotación del enlace
N-C. La presencia de prolina entre dos cadenas en a-hélice produce una acodadura de
la dirección general de la molécula, lo cual
es de gran importancia en la configuración
general de una proteína. Otro aminoácido
que tiende a desestabilizar la a-hélice es la
glicina, por tener un grupo R muy pequeño.
Pauling y Corey también propusieron otra
estructura secundaria que es la estructura P
(P porque fue una segunda estructura, siendo la a-hélice la primera). La conformación p
está formada por dos o más cadenas polipep-
tídicas que pueden ser paralelas (en el mismo
sentido) o antiparalelas (en direcciones opuestas) y se estabilizan también por puentes de
hidrógeno (fig. 3.13). En tanto que la hélice
es una cadena polipeptídica enrollada, la tira
plegada p está extendida y se dispone a la
manera de un acordeón con los grupos R proyectados por encima y por debajo de los planos
generados por las cadenas polipeptídicas. La
estabilidad es mayor en la conformación antiparalela, la más frecuente en las proteínas
naturales, incluso más que la a-hélice.
En general, estas estructuras laminares se
dan en las proteínas fibrosas como la queratina del pelo y la piel, la fibroma de la seda;
la sustancia amiloide que se deposita en
condiciones patológicas, es un depósito de
proteína en forma de tira plegada.
Es común que en numerosas proteínas
ocurran simultáneamente ambas estructuras,
la a-hélice y la hoja plegada p, como se
ilustra en la fig. 3.14.
Finalmente, dentro de la estructura secundaria, pueden existir algunas regiones de las
proteínas que no son a-hélice ni tira plegada, sino que son conformaciones enrolladas
al azar. En términos de su función biológica, las regiones de enrollamiento aleatorio
son de igual importancia que las de a-hélice
o tira plegada.
tática de tipo salino entre un grupo carboxilato (-COO - ) y un grupo amino (-NH3+) de
residuos glutamato o aspartato con Usina o
arginina; b) puentes de hidrógeno, entre grupos carboxilato, oxhidrilo (-OH) o los propios grupos carbonilo (-C=0) de las
uniones peptídicas; c) interacción de cadenas polares, como los grupos aromáticos de
la fenilalanina o los no aromáticos de alanina e isoleucina, etc; d) fuerzas de Van der
Waals, cuando los residuos son idénticos
como dos metilos de la alanina, hidroximetilos de la serina, etc; e) puentes disulfuro,
que se establecen entre los grupos sulfhidrilo (-SH) de la cisteína para dar el enlace covalente disulfuro (-S-S-) entre cadenas
vecinas (fig. 3.15).
El resultado de las distintas uniones descritas es una estructura terciaria de gran estabilidad. El estudio de la estructura terciaria
ha sido posible gracias a la cristalografía de
rayos X desarrollada por la escuela de Bragg
en Cambridge y a la labor pionera de Kendrew sobre la mioglobina y de Perutz sobre
la hemoglobina.
Las estructuras terciarias de las proteínas
permiten agruparlas en familias y subfamilias; por ejemplo, proteínas fibrosas de forma alargada y proteínas globulares de forma
esferoidal.
3.4.5.3. Estructura terciaria
3.4.5.4. Estructura cuaternaria
Existen razones sobradas para pensar que
gran parte de las proteínas tienden a adoptar
forma esférica, globular. Esto sólo puede
ocurrir si suponemos que, además del plegamiento secundario, existe un superplegamiento de la proteína que da lugar a una
estructura compacta. Es la que se conoce como estructura terciaria de las proteínas. Se
trata de un arreglo tridimensional que forma
diversos repliegues específicos.
Los tipos de enlaces que estabilizan la estructura terciaria son: a) atracción electros-
Cuando una proteína se compone de más de
una cadena polipeptídica, se dice que posee
estructura cuaternaria. Las proteínas que poseen este grado de organización estructurai se
denominan oligoméricas y las cadenas polipeptídicas individuales que la integran se denominan monómeros, protómeros o subunidades.
Cuando una proteína oligomérica contiene dos
o cuatro monómeros o subunidades se denomina dímero o tetrámero, respectivamente. El
mejor ejemplo estudiado es la hemoglobina
que es una proteína tetramérica (fig. 3.16).
Figura 3.13. Conformación p de una proteína con disposición paralela (a) antiparalela (b).
Figura 3.14. Representación esquemática del plegamiento de la cadena principal de la ribonucleasa bovina.
La región de a-hélice está encerrada en un óvalo y la región p está sombreada. Otras porciones constituyen
un enrollamiento al azar.
Figura 3.15. Tipo de uniones que estabilizan el plegamiento de las proteínas. 1. interacción electrostática; 2
puentes de hidrógeno, entre treonina y serina; 3 interacción dipolo-dipolo entre dos serinas; 4 unión de disulfuro, convalente, entre dos cisternas, y 5. interacción hidrofóbica entre leucina e isoleucina.
Figura 3.16. Estructura cuaternaria de ias proteínas. Esquema de la disposición de cuatro subunidades de una
molécula de hemoglobina, formada por dos cadenas a en la parte inferior de la figura y dos cadenas p en la
parte superior.
Los enlaces que mantienen la estructura
cuaternaria son del mismo tipo que los que
mantienen la estructura terciaria, excepto
enlaces covalentes. Por ejemplo, la ot-quimotripsina contiene tres cadenas polipeptídicas unidas por enlaces disulfuro y no se
considera estructura cuaternaria. La mioglobina está compuesta por una sola cadena
polipeptídica y no posee estructura cuaternaria. Sin embargo, la hemoglobina contiene 4 subunidades unidas no covalentemente
y, por tanto, tiene estructura cuaternaria. La
enzima aspartato transcarbamilasa tiene una
estructura cuaternaria formada por 12 subunidades. Otros ejemplos incluyen la sintetasa
de ácidos grasos, la piruvato deshidrogenasa, a las cuales se les conoce como complejos
multier>zimáticos o estructuras supramoleculares.
La estructura cuaternaria está íntimamente ligada a las propiedades reguladoras de
las proteínas, particularmente en los sistemas llamados alostéricos. En estos sistemas, la respuesta puede estar afectada por la
presencia de efectores (inhibidores o activadores) que modulan la acción primaria de la
proteína (ver capítulo de Enzimas).
Las estructuras secundaria y terciaria de
una proteína están determinadas por la estructura primaria. Por lo tanto, no es necesario
postular un control genético independiente
para los niveles de estructuración superiores
al nivel primario, puesto que la estructura
primaria determina la secundaria, terciaria y
(cuando está presente) la cuaternaria.
3.5. RELACIÓN ENTRE
ESTRUCTURA Y FUNCIÓN
La actividad biológica de una proteína depende del ordenamiento tridimensional
apropiado de sus grupos funcionales. De este modo, las proteínas sólo funcionan cuando están plegadas en su estructura original o
conformación nativa. Debido a que las con-
formaciones nativas de la mayor parte de las
proteínas están estabilizadas sólo por enlaces no covalentes, el plegamiento puede ser
alterado por condiciones como alta temperatura, pH extremo o presencia de solventes
orgánicos que debilitan las interacciones no
covalentes.
3.5. L
Desnaturalización
La alteración de una proteína que modifique
su conformación nativa se denomina desnaturalización; este cambio provoca la consiguiente alteración o desaparición de sus
funciones. En una proteína se produce la
desnaturalización al perder su estructura secundaria, terciaria y cuaternaria, conservándose la primaria (covalente). En el estado
desnaturalizado los niveles de estructuración superior de la conformación nativa se
encuentran al azar, es decir la proteína altamente ordenada queda reducida a un polimero estadístico formado por una cadena de
aminoácidos (fig. 3.17). La existencia de enlaces disulfuro en una proteína aumenta su
resistencia a la desnaturalización.
3.5.1.1. Agentes desnaturalizantes
Todos aquellos agentes capaces de romper o
alterar los enlaces que mantienen las estructuras de orden superior de una proteína pueden desnaturalizarla.
Un agente desnaturalizante muy común es
el calor, esto tiene aplicación cotidiana en el
laboratorio de bioquímica. Otros agentes físicos (radiaciones, tensoactividad, altas
presiones) o químicos (ácidos, álcalis, urea,
detergentes) capaces de alterar las interacciones débiles pueden llegar a desnaturalizar
las proteínas. En proteínas cuya estructura
tridimensional está determinada por enlaces
disulfuro, pueden ser desnaturalizadas por
agentes reductores como el mercaptoetanol
o el ditiotreitol. En ocasiones esta alteración
es reversible cuando se elimina el agente
agresivo. En otros casos la desnaturalización es irreversible.
Una consecuencia de la desnaturalización
es la pérdida drástica de solubilidad. Otras
alteraciones incluyen disminución de la viscosidad, velocidad de difusión y facilidad
con que cristalizan.
Siendo la conformación de la molécula
proteínica la base principal de su función, al
desnaturalizarse la proteína, se altera su actividad fisiológica. Por ejemplo, las globulinas plasmáticas desnaturalizadas pierden
sus funciones de anticuerpos.
3.5.2. Complementarte dad y capacidad
de reconocimiento
Existen proteínas capaces de reconocer determinado tipo de moléculas que serán objeto
de su actividad. Ese sitio de reconocimiento
se debe a la presencia en la proteína de una
estructura complementaria a la de la molécula (llámese sustrato, hormona, antígeno,
efector, grupo prostético), que permite a la
proteína (sea enzima, anticuerpo, receptor
membranal) reconocer a la molécula en
cuestión y asociarse con ella en forma específica. Para explicar el fenómeno de la especificidad, Emil Fisher propuso en 1894 una
analogía similar a la que existe entre llave y
cerradura.
En las proteínas donde más se ha ejemplificado el fenómeno de la especificidad de
reconocimiento molecular es entre las enzimas y su sustrato; de ellas nos ocuparemos
más adelante. Otro ejemplo es el de la globina que se une específicamente a su grupo
prostético, el grupo hemo, debido a que la
proteína tiene un hueco molecular con la
forma precisa para el hemo y dado que las
cadenas laterales de los aminoácidos en contacto con el anillo son no polares.
Clásico ejemplo de reconocimiento es la
unión de sustancias llamadas antígenos con
su anticuerpo específico. El anticuerpo es
una molécula proteínica especial perteneciente al grupo de las inmunoglobulinas.
Los receptores membranales de reconocimiento de las hormonas, que representan el
primer sitio de acción hormonal, son también proteínas de reconocimiento.
Como regla general, un sitio fijador (de
reconocimiento) en una proteína se ajusta al
compuesto que se va a unir en forma, tamaño y polaridad.
3.5.3.
Alosterismo
En algunas enzimas y en la hemoglobina se
encuentra, además del sitio activo (para el
sustrato), otro sitio de reconocimiento para
moléculas llamadas efectores alostéricos; la
ocupación de este otro sitio determina una
inhibición o una activación de la reacción,
mecanismo conocido como alostérico. Un
mecanismo alostérico es un proceso común
en moléculas proteicas en el que la asociación del sustrato está influenciada por la fijación de otras moléculas que no son
sustratos directos de la proteína. En un proceso alostérico debe haber en la proteína
centros separados de fijación para el sustrato
(por ejemplo, O2 en el caso de la hemoglobina) y el efector (inhibidor o activador) que
ejerce el control alostérico.
3.6. MÉTODOS DE SEPARACIÓN Y
ANÁLISIS
3.6.1.
Cromatografía
Las experiencias en cromatografía se remontan a 1850, cuando Runge describió un
método para el análisis de mezclas de colorantes, aplicando gotas de colorantes en papel y notando la separación en diferentes
colores. Sin embargo, el crédito del descubrimiento de'la cromatografía se le dá al botánico Tswett, quien en 1906 efectuó la
separación de mezclas de pigmentos vegetales en un tubo conteniendo material adsorb e n t e s ó l i d o f i n a m e n t e d i v i d i d o . La
separación cromatográfica se basa en el coeficiente de partición líquido-líquido de los
compuestos.
La cromatografía en papel, como todas
las técnicas simples, ha revolucionado la se-
paración y detección de productos de reacción y la determinación e identificación de
compuestos. Desarrollada en 1944 por Martin en Inglaterra, consiste en colocar en tiras
de papel como soporte de una fase estacionaria acuosa mientras una fase móvil orgánica se desplaza en la tira, gotas de la
sustancia a separar cerca del punto donde
partirá el desplazamiento de la fase orgánica
(fig. 3.18).
La relación de la distancia recorrida por el
compuesto entre la distancia que recorre el
frente del solvente desde el sitio de aplicación se conoce como valor Rf (relación de
frentes) del compuesto. Bajo condiciones
estrictamente controladas el Rf es una constante importante para propósitos de identificación.
El método descrito es cromatografía unidimensional. La cromatografía bidimensional es una variante de considerable poder de
separación, ya que se emplean dos diferentes solventes aplicados secuencialmente para desplazar un solo compuesto (fig. 3.19).
La gota del compuesto (generalmente un
aminoácido o un péptido) se "revela" como
una mancha en el papel. El material usado
como revelador es usualmente la ninhidrina
mencionada antes.
La cromatografía en capa fina utiliza el
mismo principio de la cromatografía en papel (cromatografía de adsorción); el soporte
utilizado es sílica gel o celulosa colocadas
en una hoja de vidrio o plástico en forma de
capas muy finas. En este proceso, la separación cromatográfica es muy rápida (fig.
3.20).
Las dos primeras técnicas descritas se utilizan generalmente para separar e identificar
aminoácidos o péptidos pequeños. A continuación se describirán técnicas para la separación e identificación de proteínas.
También utilizando una separación en columna, pero aprovechando las cargas residuales de las proteínas como carácter
diferencial, se describe la cromatografía de
Figura 3.18 Cromatografía en papel.
intercambio iónico. Las resinas de intercambio iónico para preparar la columna cromatográfica, se preparan a partir de materiales
insolubles (agarosa, poliacrilamina, celulosa,
etc.) que contienen ligandos cargados negativamente (R-CH3-COO--SO5) o ligandos
cargados positivamente (dietilamino) unidos a la resina insoluole.
Las resinas cargadas negativamente fijan
cationes conociéndose como resinas de intercambio catiónico. Igualmente, las resinas
cargadas positivamente fijan aniones y se
denominan resinas de intercambio aniónico.
El grado de retención o retardo de una proteína (o aminoácido) por una resina dependerá del número de cargas (positivas o
negativas) de la proteína al pH del experimento (revisar pl de una proteína). Aquellas
moléculas proteicas con la misma carga que
la resina se eliminarán primero, seguidas por
proteínas de carga opuesta, que por atracción de cargas, se retendrán más tiempo en
la columna. Cuando es difícil eliminar una
molécula fuertemente atraída por la resina,
se utilizan cambios de pH o fuerza iónica
para debilitar la interacción.
Los derivados de celulosa como carboximetil celulosa (CMC) y dietilaminoetil celu-
cero), no se desplazan ni hacia el cátodo ni
hacia el ánodo en un campo eléctrico. El
punto isoeléctrico (pl) de un aminoácido se
define como el pH en el cual no tiene carga
eléctrica neta; en el caso de los aminoácidos
con sólo un grupo amino y uno carboxilo corresponde a la siguiente ecuación:
pl = | ( P K 1+ pK2)
Si consideramos la curva de titulación de
un aminoácido sencillo como la glicina, su
equilibrio de ionización corresponde a:
A pH de 1 la forma iónica predominante
tiene una carga de +1 (forma catiónica) y se
desplazará hacia el cátodo en un campo
eléctrico. La adición de base hasta alcanzar
la forma de zwitterión, corresponde al punto
isoeléctrico (pl=5.97).
La adición de base a la forma dipolar de la
glicina, completa la titulación del grupo NH 3, el pH de la solución es superior a 11.5
y la especie predominante tiene una carga
formal de -1 (forma aniónica).
Como puede verse en la fíg. 3.5, la glicina
y otros aminoácidos con cadena lateral no
ionizable y valores de pKi próximos a 2.5 y
de pK2 próximos a 9.5, pueden actuar como
amortiguadores en dos zonas de pH, donde
ninguna les permite actuar como amortiguadores al pH fisiológico del plasma.
Precisamente, el pH de 7.4 es un valor
cercano al pl de dichos aminoácidos, y éste
es el punto de menor solubilidad de aminoácidos y proteínas.
Un caso más complejo lo constituyen los
aminoácidos con un grupo ionizable en su
cadena lateral. Tal es el caso del ácido glutámico y del aspártico que poseen un grupo
losa (DEAE) se han utilizado con éxito en la
purificación de proteínas.
En la cromatografía líquida de alta resolución, la mezcla de proteínas a separar e
identificar se pasa a través de una columna
empaquetada con pequeñas esferas de resina
insoluble. Como en esta técnica la resina está tan densamente empaquetada se requiere
de bombeo a elevada presión para forzar el
paso de la proteína. En esta técnica la columna es metálica y no de vidrio como la
cromatografía a presión normal. Las esferas
de resina pueden cubrirse con grupos cargados, como en la cromatografía de intercambio iónico, o con residuos hidrofóbicos con
lo que las moléculas no polares se retrasarán
al paso por la resina. Las esferas pueden ser
porosas y actuar con el mismo principio de
la cromatografía de exclusión molecular, separando moléculas grandes de las pequeñas.
La cromatografía de afinidad se basa en
la alta afinidad que tienen las proteínas por
sus sustratos, grupos prostéticos, receptores
de membrana, inhibidores no covalentes específicos y anticuerpos específicos. Estos
compuestos de alta afinidad se pueden unir
en forma covalente a una resina insoluble y
utilizarse para purificar una proteína mediante cromatografía en columna.
3.6.2. Filtración en gel
La separación de proteínas de diferente tamaño haciéndolas pasar a través de una columna empaquetada con un gel poroso en
forma de pequeñas esferas insoluoles se denomina filtración en gel o cromatografía de
exclusión molecular. El polisacárido dextrana es tratado químicamente para que se formen enlaces cruzados que den un retículo o
malla por la cual pueden pasar moléculas
pequeñas. Esta sustancia queda como pequeñas esferas hidrofílicas, pero insolubles,
que al colocarlas en agua se hinchan para
formar un gel insoluble. El nombre comercial de este gel es sephadex.
Las proteínas pequeñas pueden penetrar
por los poros del gel, por lo que tendrán que
desplazarse por espacios sinuosos y viajar
más a través de la columna, que las proteínas grandes, las cuales, al no poder penetrar
por el retículo del gel, son excluidas por motivos estéticos. En consecuencia, una mez-
cla de proteínas se separa en función del tamaño saliendo primero las proteínas más
grandes y a continuación las más pequeñas,
las cuales se retardan por tener que viajar por
el retículo del gel (fig. 3.21).
Figura 3.21 Filtración en gel o cromatografía de
exclusión molecular en columna
El bioquímico tiene para elegir varios tipos de sephadex para preparar columnas.
Así, el sephadex G-25 excluye compuestos
de peso molecular de 3,500-4,500, sephadex
G-50 para PM de 8-10,000 y sephadex G-75
para 40-50,000 de PM. Los geles de sephadex G-100 y G-200 se utilizan para separar
proteínas de alto peso molecular.
3.6.3.
Electroforesis
El movimiento de una partícula cargada en
un campo eléctrico externo, hacia el electrodo de carga opuesta se denomina electroforesis. La electroforesis de proteínas se ha
llevado a cabo de acuerdo al principio desarrollado por el sueco Tiselius en 1937. Según esta técnica, se hace pasar durante un
cierto tiempo, una corriente eléctrica a tra-
vés de un tubo en U (un electrodo en cada
extremo) lleno con una proteína disuelta en
un amortiguador con la misma fuerza iónica, pH y conductividad. Durante la electroforesis, las diferentes proteínas migran hacia
el electrodo de carga opuesta. El grado de
migración depende de las cargas de la proteínas, del P.M. y de la forma. El sitio donde
se concentra la proteína en el tubo puede ser
determinado por un proceso óptico. La luz
refractada nos da un patrón de picos, cada
pico representa la separación entre la molécula proteica y el amortiguador (fig. 3.22).
El aparato de Tiselius se utilizó para determinar el punto isoeléctrico y la movilidad
electroforética de las proteínas. Una modificación altamente simplificada de la técnica
electroforética de Tiselius es la llamada
eléctroforesis de zona. En ésta, la separación electroforética se realiza sobre un soporte inerte como papel, almidón, agar,
acetato de celulosa y, el más reciente gel de
poliacrilamida. La medida de la concentración de cada proteína separada se hace por
revelado y lectura en un densitómetro.
Variantes más desarrolladas de la eléctroforesis simple son la inmunoelectroforesis y
el isoelectroenfoque. La primera combina la
separación electroforética con la especificidad de las reacciones inmunológicas. Es especialmente útil para separar proteínas y
otras sustancias antigénicas con carga,
particularmente las proteínas plasmáticas
(fig. 3.23). El isoelectroenfoque ofrece una
resolución sumamente elevada. En esta técnica se utilizan mezclas de anfolitos formados
por ácidos poliamino-policarboxílicos con un
intervalo de pl definido para establecer un
gradiente de pH a través del campo eléctrico
aplicado. Una proteína cargada se desplazará a través del gradiente de pH en el campo
eléctrico hasta que alcance una región de pH
en el gradiente igual al valor de su pl. En este punto la proteína se mantiene estacionaria
en el campo eléctrico y puede visualizarse o
eliminarse de la columna (fig. 3.24).
3.7. PROTEÍNAS DE IMPORTANCIA
MÉDICA
En esta sección, se estudiarán algunas proteínas con importantes funciones biomédicas. Se han escogido las proteínas de
transporte, hemoglobina y mioglobina, proteínas protectoras como las inmunoglobulinas, las proteínas plasmáticas, proteínas
estructurales como el colágeno y proteínas
contráctiles como la tropomiosina, como
ejemplo de proteínas cuya estructura y función es esencial estudiar para una correcta
comprensión de sus procesos bioquímicos
normales y de su mal funcionamiento en las
enfermedades.
3.7.1.
Hemoglobina y mioglobina-
Las hemoglobinas son proteínas globulares,
presentes en los glóbulos rojos, que fijan
oxígeno en los pulmones y lo transportan
por la sangre hacia los tejidos; al volver a los
pulmones desde los capilares, actúan como
transporte de CO2 y de iones hidrógeno.
La hemoglobina (Hb) está formada por la
proteína globina (una histona) y el grupo
prostético hemo. La proteína globina desde
el punto de vista de su estructura cuaternaria
es un tetrámero, es decir, la constituyen 4
subunidades, cada una de ellas formada por
cadenas polipeptídicas con dos estructuras
primarias diferentes y cada subunidad con
su grupo hemo. En la forma más común de
hemoglobina humana adulta, HbAí, las dos
subunidades de una clase se denominan cadenas a y los otros dos monómeros de la
misma clase se designan como cadenas p.
Así, la fórmula tetramérica de la HbAí es
0 ^ 2 - La hemoglobina fetal (HbF) es 0,272»
la hemoglobina de las células falciformes
(HbS) es ct2£2 y la hemoglobina menor del
adulto (HbA2) es a252- Se conoce la secuencia completa de aminoácidos de las cadenas
a(141 aminoácidos) y de las cadenas p , y y 6
(146) aminoácidos). El PM de la hemoglobina, incluyendo el grupo hemo, es de aproximadamente 67,000. La hemoglobina fue la
primera proteína analizada por difracción de
rayos X, identificada como una molécula casi esférica con un diámetro de 5.5 nm (fig.
3.25). Su concentración en la sangre humana es de 16 g por 100 mi.
La mioglobina (Mb) es una proteína que
almacena 02 en el tejido muscular rojo. A
diferencia de la hemoglobina, la mioglobina
está compuesta por una sola cadena polipeptídica (monómero) y un solo centro de fijación de 02 (hemo). La cadena polipeptídica
consta de 153 aminoácidos y tiene un PM de
17,000. El polipéptido P de la Hb es muy semejante a la mioglobina. Su distribución especial es el de una superficie polar y el
interior no polar, patrón característico de las
proteínas globulares.
El grupo prostético hemo es una molécula
de porfirina, un tetrapirrol cíclico, que contiene un átomo de hierro en su centro. El tipo
de porfirina de la hemoglobina y la mioglobina corresponde a la protoporfirina IX con
dos propionilos, dos vinilos y cuatro metilos
como cadenas laterales unidos a los grupos
pirrólicos (fig. 3.26). El átomo de hierro,
tanto en la hemoglobina como en la mioglobina, se encuentra en estado ferroso (Fe2*).
El quinto enlace de coordinación del átomo ferroso de los hemos es con el nitrógeno
imidazólico de una histidina {histidina proximal de la apoproteína). En las cadenas polipeptídicas con 02 ligado, esta molécula
Figura 3.25 Estructura cuaternaria de la hemoglobina.
forma un sexto enlace coordinado con el
Fe 2+ y el segundo imidazol de una histidina
distal de la globina. El hemo se sitúa dentro
de un espacio hidrofóbico en cada una de las
subunidades de globina. De esta manera, las
4 subunidades se disponen en un arreglo espacial tetraédrico preciso, con las cadenas
en contacto con las P; los grupos hemo se localizan en la periferia.
Cinética de oxigenación de hemoglobina
y mioglobina
La hemoglobina se combina con el oxígeno
y se transforma en oxihemoglobina (Hb0 2 );
en realidad fija ocho átomos de oxígeno por
tetrámero (dos por cada subunidad). Esta
combinación se lleva a cabo sin alterar la valencia del hierro que sigue como ferroso, es
decir, no es una oxidación sino una oxigenación. Cuando la hemoglobina se oxida químicamente, el hierro pasa de ferroso a
férrico (Fe 2+ —• Fe 3+ ) y se denomina metahemoglobina (MHb); en estas condiciones
no transporta oxígeno. Normalmente se forma
menos del 1 % de MHb, pero puede producirse un exceso si se ingieren sulfonamidas,
nitritos, fenacetina u otros oxidantes.
La curva de saturación de oxígeno con hemoglobina es sigmoidea. Esto se debe a que
una vez fijado el primer átomo de 0 2 facilita
la unión del siguiente. Así, la hemoglobina
muestra una cinética cooperativa de fijación. En cambio, la mioglobina muestra una
curva de saturación de oxígeno de tipo hiperbólica (fig. 3.27), lo que indica que la
mioglobina tiene mayor afinidad por el 0 2
que la hemoglobina y es una molécula inadecuada como transportadora de 0 2 pero eficaz para almacenarlo. Bajo condiciones de
escasez de oxígeno (como en el ejercicio intenso), la p 0 2 del tejido muscular puede disminuir hasta 5 mm Hg. A esta presión, la
mioglobina cede con facilidad su oxígeno
para apoyar la síntesis oxidativa de ATP en
las mitocondrias musculares.
La cooperatividad positiva de la hemoglobina depende de la integridad de la estructura cuaternaria; si el tetrámero se
disgrega en monómeros, la cooperatividad
desaparece y la curva de saturación de oxígeno adquiere forma hiperbólica. Los datos
de cristalografía con rayos X indican que la
hemoglobina tiene dos estructuras cuaternarias. Las dos formas son de conformación
desoxi, llamada "tensa" o estado conformacional T; al fijarse el oxígeno a las subunidades, la conformación pasa del estado T al R
("relajado"). La constante de afinidad del 0 2
es mayor en el estado R que en el estado T
(fig. 3.28). T y R se emplean también para
describir las estructuras cuaternarias de las
enzimas alostéricas, donde el estado T tiene
afinidad menor por el sustrato. En la unidad
II, sobre equilibrio ácido base, ya habíamos
señalado la influencia del oxígeno sobre el
pKa de la hemoglobina:
H H b + 4 0 2 — Hb(0 2 ) 4 +H + ; es decir, la
forma T es más acida. Por tanto, cuando la Hb
oxigenada se encuentra a pH bajo (ácido) y
C 0 2 alto, tiende a liberar su oxígeno y representa un aumento de oxigenación en tejidos
metabólicamente activos. La reducción de la
afinidad oxígeno-hemoglobina en un pH bajo se denomina efecto Bohr (fig. 3.29).
El efecto Bohr puede encajar en la definición de un mecanismo alostérico, según el
cual, en la proteína existe un sitio de fijación
para el sustrato y otro para el efector alostérico (positivo o negativo). La fijación del
efector en el sitio alostérico influye sobre la
conformación del sitio del sustrato (sitio activo). En la hemoglobina el sitio activo es
ocupado por el oxígeno y el sitio alostérico
es ocupado por el hidrogenión. Al ocupar su
sitio el ion H, desplaza a la Hb a la forma T,
de afinidad más baja por el oxígeno.
El efecto Bohr, por lo tanto, tiene consecuencias fisiológicas importantes. Las células
con metabolismo rápido y con requerimientos elevados de 0 2 , producen ácido carbónico
y ácido láctico que incrementan la concen-
tración de H+ en la célula. Dado que el H+
fuerza alostéricamente hacia la conformación T de la hemoglobina, disminuye la afinidad C>2-Hb y se disocia una mayor
cantidad de O2 hacia los tejidos. En los pulmones, la concentración de H+ disminuye,
el pH sube, los protones son liberados de la
hemoglobina favoreciendo la forma R y la
captación de oxígeno. La mioglobina no
presenta efecto Bohr.
En resumen, un incremento de hidrogeniones provoca liberación de oxígeno, en
tanto que un incremento en el oxígeno causa
la liberación de hidrogeniones.
La hemoglobina fetal (HbF) tiene mayor
afinidad por el oxígeno que la adulta (Hb A)
lo que le permite extraer O2 de la HbA de la
sangre placentaria. Después del parto, la
HbF es inadecuada, ya que su elevada afinidad por el oxígeno la haría ceder menos O2 a
los tejidos.
En los tejidos periféricos, una disminución de O2 hace que se acumule el 2, 3-difosfoglicerato (2,3-DPG), el cual es un
efector alostérico de la hemoglobina cuando
ésta se encuentra en la forma T. Cuando la
liberación de oxígeno está alterada como en
el ascenso a grandes alturas o en la enfermedad pulmonar crónica, el eritrocito aumenta
la producción de 2,3-DPG el cual se une a la
forma T de Hb, la estabiliza, y reduce su afinidad por el oxígeno. Por lo tanto, un aumento en el contenido de 2,3-DPG de los
eritrocitos hace que la hemoglobina ceda
una porción mayor de su oxígeno a los tejidos.
La hemoglobina se combina con el monóxido de carbono (CO) para formar carboxihemoglobina. En virtud de la mayor
afinidad de la hemoglobina por el CO (210
veces), a tensiones iguales de O2 y CO, la fijación del CO a la Hb excede con mucho a la
del oxígeno. La carboxihemoglobina (HbC0) tiene un color rojo brillante característico. Para desplazar el CO de la Hb-CO en las
personas intoxicadas con este gas se requiere el uso de la oxigenoterapia hiperbárica
(O2 puro a 3 o más atmósferas de presión)
para forzar la expulsión del monóxido de
carbono.
Además de transportar el oxígeno de los
pulmones a los tejidos, la hemoglobina facilita el transporte de CO2 de los tejidos a los
pulmones. Aproximadamente el 15% del
CO2 es transportado como carbodioxihemoglobina o carbaminohemoglobina (HbCO2). La interacción del CO2 con la
hemoglobina afecta también la transición
del estado T al R. El CO2 forma radicales
carbamilados reversiblemente con los extremos amino de las cadenas polipeptídicas de
hemoglobina cuando ésta cede su O2.
Hb-NH2+C02
-*
Hb-NH-COO-+H+
Cuando están carbamilados, los extremos
tienen carga negativa y pueden formar enlaces iónicos que estabilizan la estructura cuaternaria. Los H+ son captados por la Hb que
actúa como amortiguadora.
En los pulmones el proceso descrito se invierte y conforme el oxígeno se une a la hemoglobina, los H+ se liberan y se unen al
HCO3 para formar H2CO3. Por tanto, la fijación del O2 obliga a la expulsión del CO2 de
acuerdo al efecto de Bohr que ya revisamos.
Hemoglobinas humanas mulantes
Las mutaciones en los genes que codifican
las cadenas a y P pueden afectar la función
transportadora de la hemoglobina; cuando
esto ocurre, el trastorno se conoce como una
hemoglobinopatía. Muchas de las imitantes
pueden ser asignadas a una de las cuatro clases siguientes:
Hemoglobina M. Hemos mencionado que
en la hemoglobina normal, el grupo hemo
funciona con Fe2+ pero pequeñas cantidades
se oxidan a férrico (Fe3+)y se transforma en
metahemoglobina. En las variantes de hemoglobina M, los residuos His proximal y
distal son reemplazados por Tir la cual estabiliza el Fe en forma oxidada, férrica. En
consecuencia se presenta metahemoglobinemia, la afinidad por el oxígeno está disminuida y puede faltar el efecto Bohr.
Hemoglobinas mutantes con afinidad mayor de lo normal por el oxígeno. En estas
mutantes se favorece la forma R, por tanto,
no cederá suficiente oxígeno a los tejidos.
La hipoxia producida conduce a policitemia.
Las proteínas mutantes no muestran cooperatividad en la fijación del oxígeno ni efecto
Bohr.
Hemoglobina S (hemoglobina falciforme). La sustitución de un solo aminoácido
de la cadena P (Glu por Val) produce una
hemoglobina que, al cambiar un aminoácido
polar (Glu) por uno no polar (Val) se genera
en la superficie de la cadena p una zona adherente. Esta zona, que se presenta en la
HbS desoxigenada, tiene una zona complementaria en la forma oxigenada de la HbA.
La unión de zonas complementarias y adherentes hace que la HbS desoxigenada se polimerice y forme precipitados fibrosos
largos que distorsionan mecánica y físicamente al eritrocito, causando lisís. Los eritrocitos deformados se denominan células
falciformes (forma de hoz) y su lisis al pasar
por las sinuosidades esplénicas produce
anemia. Así, esta enfermedad hereditaria se
conoce también como anemia de células falciformes. Los individuos homocígotos (genotipo S/S) presentan anemia pero los
heterocigotos (genotipo A/S) tienen el rasgo
En el caso de la histidina, las formas iónicas
posibles son las observadas en la fig. 3.7.
Obsérvese que la histidina con un pK R = 6.0,
muy próximo al pH fisiológico, es el único
aminoácido que puede actuar como amortiguador en los líquidos corporales. Precisamente, la hemoglobina contiene una elevada
proporción de histidina y posee así un alto poder amortiguador en los eritrocitos. Por otro
lado, este comportamiento excepcional de la
histidina le confiere un papel único en las proteínas enzimáticas como activador fisiológico.
Por ejemplo, una enzima puede requerir un
imidazol de una histidina que es esencial en su
forma básica para que exista actividad catalítica. A pH 6.0, la mitad de las enzimas estarán
en forma básica (imidazol) activa y la mitad
en forma acida (imidazolio) inactiva.
A pH 7.0 , el pH es una unidad (10 veces)
por encima del pK del imidazolio y el cociente imidazol/imidazolio es 10:1; debido a
esta proporción la enzima mostrará el 91%
de su actividad potencial máxima.
aunque en general no están anémicos. El gene vienen células sanguíneas denominadas linpara la HbS manifiesta elevada incidencia focitos T (que maduran en el timo), que acen poblaciones expuestas endémicamente al túan directamente o bien a través de
paludismo; esto proporciona cierta protec- sustancias por ellas liberadas llamadas linfoción contra el parásito, que se desarrolla cinas. En la respuesta humoral intervienen
dentro del eritrocito, debido a que las células los linfocitos B (de bursa o bolsa de Fabricio
infectadas requieren más oxígeno que las no de las aves), y su acción se ejerce a través de
infectadas y al adquirir la forma semilunar los anticuerpos (inmunoglobulinas) que cé(de hoz) son eliminadas de la circulación.
lulas derivadas de estos linfocitos B segreHemoglobinas inestables. En estas mu- gan.
tantes, la sustitución de un aminoácido denLas moléculas de anticuerpos (Ab) son
tro del espacio para el hemo reduce la proteínas que pertenecen a las inmunogloafinidad de la subunidad con el grupo pros- bulinas. Cuando se introduce al organismo
tético. Las hemoglobinas mutantes son ines- una sustancia extraña como una proteína, un
tables y destruidas porque el hemo que polisacárido o un ácido nucleico, las células
normalmente estabiliza la conformación plasmáticas, derivadas de un linfocito B,
proteínica no puede unirse a la apoproteína.
producen anticuerpos. La molécula de anticuerpo se asocia de forma no covalente con
la sustancia extraña y la elimina del organisTalasemias
mo. Las sustancias que inducen la producción de anticuerpos en un organismo se
Normalmente, las cadenas a y p se produ- denominan antígenos (Ag).
cen en una proporción de 1:1. En estas enPara que una sustancia actúe como antígefermedades, la síntesis de las cadenas a-o no en un organismo debe poseer una estruclas p de la hemoglobina está disminuida. En tura química distinta de los constituyentes
consecuencia, se presenta aumento de pro- propios de ese organismo. Por ejemplo, la
ducción de la cadena complementaria que albúmina de cualquier mamífero, excepto la
precipita intracelularmente y da lugar a la humana, es antigénica para el hombre cuando
destrucción prematura del eritrocito; esto se la introduce parenteralmente. Un antígeconduce a formas severas de anemia.
no puede contener múltiples determinantes
antige'nicos, que son pequeñas regiones de
la molécula de antígeno que inducen específicamente la producción de un anticuerpo.
3.7.2. Estructura y función de los
En las proteínas, por ejemplo, un determianticuerpos
nante antigénico puede comprender sólo
La inmunología estudia todos los fenóme- seis o siete aminoácidos en total de la proteínos bioquímicos y fisiológicos de defensa na. Un antígeno puede poseer decenas o migracias a los cuales el organismos distingue les de estos grupos determinantes, de tal
lo propio (nuestros tejidos y células) de lo manera que inducirán múltiples tipos de anno propio (bacterias, virus, hongos, parási- ticuerpos, cada uno de ellos capaz de recotos, células tumorales, trasplantes, etc.) y es n o c e r y u n i r s e a c a d a u n o de los
determinantes (fig. 3.30).
capaz de destruir a las sustancias extrañas.
Todas las acciones de respuesta a material
En general, un determinante antigénico
extraño se denominan respuesta inmune. solo o una molécula pequeña, no determinan
Esta respuesta puede ser de tipo celular y de la formación de anticuerpos pero, al unirse
tipo humoral. En la respuesta celular inter- covalentemente a moléculas grandes, facili-
Cada anticuerpo se une al determinante
antigénico frente al que se ha formado.
ANTICUERPOS (Igs)
Figura 3.30 Esquema de un antigeno, que puede ser una proteína y donde se muestran distintos e hipotéticos
determinantes antigénicos y cómo a ellos se pueden unir diferentes anticuerpos de manera especifica.
tan la génesis de anticuerpos dirigidos específicamente contra la molécula pequeña. A
estas moléculas pequeñas se les conoce como haptenos. Es el caso, por ejemplo, de
péptidos sintéticos o el 2, 4-dinitrofenol,
DNP-glicina, etc. Al tiempo que un hapteno
requiere la unión a una molécula grande para producir anticuerpos, una vez separado de
su portador, el hapteno conserva su capacidad de unirse al anticuerpo.
Al estimularse los linfocitos B con un antígeno se induce una serie de cambios que
los hace transformarse en células plasmáticas. Estas poseen la función de sintetizar y
secretar inmunoglobulinas a las cuales en un
principio, se les denominó anticuerpos; lúe-
go, al descubrirse la electroforesis, y ver que
emigraban en la fracción gamma, se les dio
el nombre de gammaglobulinas. Sin embargo, al conocerse con precisión su estructura
y función en 1965, se le denominó inmunoglobulinas (Ig).
constituyen una clona (células provenientes
de una misma estirpe) y por tanto, los anticuerpos producidos son idénticos, homogéneos. En realidad, las proteínas de
Bence-Jones son las cadenas ligeras de las
inmunoglobulinas que, por su bajo PM, aparecen fácilmente en la orina. La proteína de
Bence-Jones es homogénea para cada individuo con mieloma, aunque es diferente
Estructura de ¡nmunoglobulinas
cuando se comparan entre sí las proteínas de
La heterogeneidad de las inmunoglobulinas diferentes enfermos de mieloma.
fue durante años un serio obstáculo para esCada inmunoglobulina está formada por
tudiarlas químicamente. Al aislar anticuer- una "unidad básica" tetramérica construida
pos contra un solo antígeno, se obtenía una por cuatro cadenas polipeptídicas unidas por
pequeña cantidad de una mezcla de globuli- puentes disulfuro (fig. 3.31). Dos de estas
nas. El conocimiento cada vez más avanzado cadenas son de bajo peso molecular y se les
de ios mielomas y la cantidad anormalmente denomina cadenas ligeras, L (del inglés
alta de una proteína presente en la orina de light); las de mayor PM se denominan cadeestos pacientes, la proteína de Bence-Jones, nas pesadas, H (del inglés heavy). En la incontribuyeron a vencer el obstáculo.
munoglobulina más común, la IgG, su
El mieloma múltiple es un tipo de cáncer cadena pesada tiene aproximadamente 440
en que se presenta la multiplicación descon- aminoácidos (PM 50,000) y sus cadenas litrolada de multitud de células provenientes geras contienen la mitad de aminoácidos
de una sola célula productora de anticuerpos. (PM 25,000). En la estructura tridimensioTodas las células del tumor son idénticas, nal de los anticuerpos, cada cadena H está
asociada con una cadena L (fig. 3.32). La
conformación que adopta la molécula completa es de una T o una Y.
La porción central de las cadenas H es una
zona (de unos 15 aminoácidos) de gran flexibilidad, llamada bisagra o gozne, por donde
se deforma la molécula cuando se produce
la unión antígeno-anticuerpo (Ag-Ab).
Las cadenas L constan de dos regiones de
estructura primaria bien definidas y diferenciadas: una región de gran variabilidad en
número y secuencia de aminoácidos, denominada región variable (V); dentro de la región variable hay zonas hipervariables, con
grupos de aminoácidos siempre distintos,
determinados por cada antígeno particular.
Estos son los sitios de combinación donde
se realiza la unión de la inmunoglobulina
con su antígeno; en cierto modo comparables al sitio activo de una enzima.
Otra parte de las inmunoglobulinas muestra una composición fija en número y orden
de aminoácidos que se denomina región
constante (C). Las regiones constantes de
las cadenas H son las que determinan la clase a la que pertenece el anticuerpo (ver más
adelante), es la que produce la fijación de las
proteínas del complemento y proporciona la
región necesaria para que los anticuerpos
crucen la membrana placentaria. La parte
constante de las cadenas ligeras puede ser de
dos tipos, de ahí que existan dos tipos de cadenas ligeras: kappa (K) y lambda (X). En las
cadenas pesadas, la parte constante determina cinco tipos: alfa (a), gamma (y), delta
(5), mu (ji), y épsilon (e), a los que se refie-
ren las cinco clases diferentes de inmunoglobulinas. Cada clase de inmunoglobulinas
sólo contienen un tipo de cadenas pesadas
pero pueden contener uno u otro tipo de cadena ligera.
Clases de inmunoglobulinas
Las inmunoglobulinas pueden ser de las clases siguientes: IgG, IgM, IgA, IgD e IgE, según posean las cadenas pesadas gamma,
mu, alfa, delta y épsilon, respectivamente,
(tabla 3.6).
IgG. Esta clase de Ig se encuentra en el
plasma a elevadas concentraciones y es la
que se forma en mayor cantidad durante la
respuesta secundaria a antígenos extraños.
Los anticuerpos IgG pueden promover la fagocitosis y también activar el complemento;
Tienen la propiedad de atravesar activamente las membranas biológicas. El alto nivel de
IgG en el feto se debe a que esta Ig atraviesa
la placenta. Este hecho, en determinadas circunstancias, puede tener consecuencias nefastas para el feto, cuando la madre Rh (-)
produce anticuerpos anti Rh ( + ) contra el feto en la llamada enfermedad hemolítica del
recién nacido. Se han reconocido 4 subclases de IgG.
IgM. Se encuentran principalmente en el
plasma, y son los primeros anticuerpos que
actúen contra un antígeno extraño (respuesta
primaria). La IgM tanto en sangre como en
otros líquidos se encuentra como tetrámero
o pentámero, (unidos estos por puentes disulfuro) de una estructura cova lente básica
[(LH)2]5; de ahí que esta Ig sea la de mayor
PM (900,000). Debido a esa estructura pentamérica que determina 10 sitios de unión
con el antígeno, la IgM es un anticuerpo
muy efectivo. Los anticuerpos como los presentes en la artritis reumatoide (anti IgG)
son de esta clase. Al igual que las IgG, las
IgM pueden promover la fagocitosis de microorganismos por los macrófagos y leucocitos polimorfonucleares y son potentes
activadores del complemento. Se han identificado 2 subclases de IgM.
IgA. Las Ig de esta clase se encuentran
principalmente en las secreciones extravasculares (secreciones mucosas, bronquial,
nasal, intestinal, urinaria, lágrimas, leche y
calostro). Como tales, estas inmunoglobulinas son la defensa inicial contra los antígenos virales y bacterianos invasores, con
anterioridad a su entrada en el plasma. Se
presentan habitualmente como un dímero de
la estructura básica (LH2)2- Actúan en forma
sinérgica con otras secreciones (lisozima y
complemento) para destruir a ciertos microorganismos.
Tanto a los dímeros de IgA como a los
pentámeros de IgM se pueden unir dos péptidos adicionales que son la pieza de secreción y la cadena J. La pieza de secreción es
una glicoproteína que se sintetiza en células
epiteliales de mucosas y glándulas exócrinas; es la que permite a IgA e IgM salir a las
secreciones biológicas.
IgD. Está presente en la superficie de los
linfocitos del recién nacido. Parece participar en la diferenciación de linfocitos B a células plasmáticas.
IgE. Aunque presente en plasma en concentraciones bajísimas es la inmunoglobulina que determina las reacciones alérgicas y
anafilácticas, como son asma bronquial, rinitis alérgica, urticaria, ciertos casos de dermatitis, incluso el más grave de todos, el
choque anafiláctico. La IgE posee la capacidad de unirse por su extremo Fe (ver adelante) a los mastocitos o células cebadas.
Cuando los mismos antígenos que indujeron
su formación vuelven a entrar, se unen por
el extremo Fab, se producen cambios alostéricos y se liberan grandes cantidades de histamina, serotonina, leucotrienos y otras
sustancias vasoactivas que producen vasodilatación periférica o broncoconstricción; esto puede acarrear la muerte del individuo
por hipotensión e insuficiencia respiratoria.
Fijación de antígeno por molécula de
anticuerpo
Las regiones variables de las cadenas L y H
constituyen un centro de fijación de anticuerpo. Dado que cada unidad básica de anticuerpo contiene dos pares de cadenas
(LH)2, existen dos centros de fijación de antígeno por molécula de anticuerpo. Esta característica ha podido ser estudiada tratando
las Ig con papaína, enzima que divide la
molécula en tres fragmentos (fig. 3.33), dos
de los cuales son iguales entre sí y comprenden la porción NH 2 - terminal de la cadena H
y toda la cadena L. Estos fragmentos se designan fragmentos Fab (antigen binding) y
pueden fijar antígenos con una afinidad similar a la del anticuerpo completo. El otro
Ag por molécula de Ab) situados en los extremos amino-terminales de las cadenas H y L
que comprende las secuencias variables de
aminoácidos. La valencia 2 que tiene cada
molécula de Ab permite que cada Ab fije
dos Ag diferentes. Esta propiedad favorece
la aglutinación y precipitación clásicas de la
reacción antígeno-anticuerpo (Fig. 3.34). La
fuerza de asociación entre Ag y Ab se debe a
fuerzas no covalentes.
Es evidente que existen sobradas razones
para hablar más extensamente de los fenómenos inmunológicos en medicina; basta
mencionar la inmunidad a las infecciones,
las reacciones de hipersensibilidad y alergia,
la autoinmunidad, los trasplantes y el cáncer. Sin embargo, escapa a los objetivos de
este texto de bioquímica cubrir estos trascendentales aspectos que pueden consultarse en obras dedicadas a esas disciplinas.
3.7.3. Proteínas plasmáticas
Figura 3.33 Hidrólisis de la IgG en los fragmentos
Fab y uno Fe por la enzima proteolítica papaina.
fragmento conocido como Fe (cristalizable), es la mitad COOH- terminal de las cadenas H y no puede fijar antígeno, por lo que
se deduce que hay dos centros de fijación de
El plasma es el medio líquido de suspensión
de los elementos sólidos de la sangre (eritrocitos, leucocitos, plaquetas, etc.). Si se toma
una muestra de sangre, se deja coagular y se
separa el coágulo, el líquido remanente es el
suero; éste no contiene elementos figurados
(células) ni fibrinógeno, proteína involucrada en la formación del coágulo. Por el contrario, si se impide la coagulación de la
sangre y se separan las células, el líquido resultante es el plasma, que contiene lo mismo
que el suero y además fibrinógeno. En resumen, la sangre sin elementos celulares es el
plasma y el plasma sin fibrinógeno es el suero.
Aunque en el plasma se encuentran más
de 200 proteínas, muchas no son estrictamente "plasmáticas" ya que se encuentran
ahí sólo transitoriamente o experimentando
parte de su catabolismo. El término proteínas plasmáticas se restringe a unas 50 moléculas que realmente llevan a cabo funciones
Figura 3.34 Unión de anticuerpo a antígenos en reacciones de precipitación (a) y en reacciones
de aglutinación (b).
específicas en el plasma: de transporte, nutritiva, reguladora del equilibrio hídrico y
ácido base, inmunitaria, etc.
La facilidad con la que pueden obtenerse
muestras de sangre ha permitido que el estudio de sus constituyentes sea uno de los pilares más importantes del desarrollo de la
bioquímica en general y, en particular, de la
bioquímica clínica.
Las proteínas plasmáticas son una mezcla
muy heterogénea que comprende no solo
proteínas simples, sino también conjugadas,
como las glucoproteínas y lipoproteínas.
Las primeras técnicas de separación, electroforesis e inmunoelectroforesis, permitió
separarlas en diferentes componentes: albúmina^lobulinas^y fibrinógeno (ver subcapítulos 3.6.3). A medida que las técnicas de
fraccionamiento se hicieron más resolutivas,
se identificaron subgrupos de globulinas (a,
p y y) que con las primeras técnicas migraban juntas. Hasta hoy se han aislado puras
unas 70 proteínas plasmáticas; seguramente
quedan muchas por descubrir y caracterizar.
En la tabla 3.7 se muestran las principales
proteínas plasmáticas, ordenadas de acuerdo
a su movilidad electroforética. Como se podrá observar, la mayoría contiene un resto
glucídico.
F'realbúmina. Esta es una de las proteínas
que une y transporta hormonas tiroideas,
aunque también fija algunos fármacos como
aspirina y barbitúricos.
Albúmina. Es una de las pocas proteínas
del plasma que carecen de carbohidratos. Es
la más abundante (55%) y tiene un PM muy
bajo (69,000); por lo tanto, la albúmina es
responsable del 80% de la presión osmótica
coloidal total deljílasma. Está compuesta
por 610 aminoácidos en una sola cadena polipeptídica con 50% de a-hélice y 15% de
estructura p. Se sintetiza exclusivamente en
el hígado a razón de 20g al día y tiene una
vida media de 10 días.
Además de contribuir a la presión osmótica coloidal, la albúmina actúa como molécula transportadora de bilirrubina, ácidos
grasos, oligoelementos y algunos fármacos:
cafeína, salicilatos, fenilbutazona, antibióticos, digitálicos, barbitúricos, etc. También
se fija a la albúmina el triptófano, hecho importante porque un incremento de su concentración libre repercute sobre el
funcionamiento cerebral (por aumento de
serotonina cerebral).
Su función nutritiva consiste en proveer
de aminoácidos utilizables para la síntesis
de proteínas del organismo. En casos de
desnutrición grave, disminuye la síntesis de
proteínas y se presenta hipoalbuminemia.
Esta hipoalbuminemia repercute, sobre todo, en la función coloidosmótica; en las enfermedades renales y hepáticas que también
se acompañan de hipoalbuminemia, se presenta edema tisular (ver unidad 2, subcapítulo 2.2.2.1). Además, la albúmina a pH 7.4
posee 17 cargas negativas que, por el efecto
Gibbs-Donnan, aumentan la concentración
plasmática de cationes y ocasiona indirectamente un aumento de presión osmótica.
ok\-glucoproteína acida. Contiene un alto
contenido en carbohidratos, sobre todo ácido siálico, responsable éste del bajo punto
isoeléctrico (3.5) de la proteína, el más bajo
de todas las plasmáticas. Se sintetiza en el
hígado y por su abundancia en plaquetas se
le ha relacionado con la coagulación.
ai-antitripsina. Forma parte de otras proteínas antiproteásicas; ésta posee el 90% de
la capacidad antiproteásica total del plasma.
Su actividad antiproteasa es polivalente
(tripsina, quimotripsina, colagenasa, elastasa, etc.) pero sobre todo sobre la elastasa de
origen neutrófüo. Según la teoría elastasaantielastasa del enfisema (destrucción de alveolos pulmonares y ensanchamiento de
bronquiolos), los neutrófilos pulmonares liberan elastasa de sus lisosomas; en ausencia
de al-antitripsina, las células pulmonares
son sensibles a la proteasa que destruye la
elastina de las fibras y disminuye la elasticidad pulmonar, ocasionando insuficiencia
respiratoria crónica. Contribuye a la enfermedad el humo de tabaco que inhibe a la antitripsina. Sería interesante prevenir a
fumadores potenciales con fenotipos predisponentes al efisema.
a\-Fetoglobulina. Llamada también a l fetoproteína, posee gran afinidad por los estrógenos. Su concentración aumenta en
tumores digestivos, carcinoma hepático y
tumor embrionario del testículo. En líquido
amniótico se ha encontrado elevada en embarazos que conllevan fetos anencefálicos.
a\-Antiquimotripsina. Es otra de las antiproteasas plasmáticas. Se ha sugerido un papel protector de las mucosas, dada su
concentración en la secreción bronquial.
Transcortina- Se denomina también globulina fijadora de corticosteroides.
Globulina fijadora de tirosina. Incorpora
las dos terceras partes de las hormonas tiroideas circulantes.
Inter-al-inhibidor de la tripsina. Da
cuenta del 3% de la capacidad antiproteasa
plasmática.
Proteína ligadora de retinol. Su papel es
transportar la vitamina A.
al-Macroglobulina. Es la proteína plasmática de mayor peso molecular, se une
prácticamente a todas las endopeptidasas.
^-Globulina ligadora de esteroides. Se une
específicamente a los esteroides testosterona, androstanolona y estradiol.
Haptoglobina. Constituye el 25% de las
proteínas plasmáticas. Su función es unirse
irreversiblemente a la hemoglobina con lo que
se excede el umbral renal de excreción; se logra así un ahorro de hierro y se protege al riñon
del efecto nocivo de la hemoglobina libre.
Hemopexina. Su papel consiste en la fijación del grupo hemo con lo cual se impide
su excreción urinaria y contribuye al ahorro
de hierro, que es reutilizado por el hígado.
$2-Microglobulina. Es sintetizada por las
células linfoides. Es una proteína de membrana de linfocitos, plaquetas, células PMN
y de cultivos de carcinoma mamario, pulmón embrionario, etc. Aumenta en enfermedades malignas y en pacientes con riñones
trasplantados.
Otras proteínas de la fracción a-globulínica son la ceruloplasmina, que transporta
cobre y parte de las lipoproteínas. En la
fracción fi-globulínica se encuentran también la P1 -glucoproteína específica del embarazo, la proteína C reactiva (que aumenta
en procesos infecciosos y denominada así
porque precipita al polisacárido C del neumococo), parte de las lipoproteínas, la
transferrina, que transporta hierro, y las
proteínas relacionadas con la coagulación.
Fracción y-globulínica. Está integrada
por las inmuno globulinas que se trataron en
el subcapítulo 3.7.2.
Lipoproteínas plasmáticas. Dentro de las
proteínas plasmáticas se encuentra este grupo complejo de proteínas y lípidos unidos
por fuerzas no covalentes, que por su importancia en el transporte de lípidos es más
conveniente tratar en el capítulo correspondiente al metabolismo de estas sustancias.
Factores de la coagulación
Se define como hemostasia el cese de la hemorragia que sigue a la interrupción traumática de la integridad vascular. La coagulación
sanguínea es uno de los tres mecanismos que
contribuyen al proceso fisiológico de la hemostasia. El primero de estos mecanismos es
la constricción del vaso dañado con objeto de
frenar la salida de sangre de la herida; la segunda fase consiste en la formación de un trombo o coágulo blanco de plaquetas en el lugar
del daño; la tercera fase es la formación de un
coágulo sanguíneo insoluble o trombo rojo.
En la primera fase participan sustancias
vasconstrictoras locales cuya acción es lúe-
Las proteínas son moléculas formadas por
aminoácidos por un enlace particular (enlace
peptídico) que bloquea los grupos ct-amino
y a-carboxilo, excepto en el aminoácido inicial y el terminal. De esta manera, en las
proteínas la existencia de grupos ionizables
dependerá de las cadenas R laterales de los
aminoácidos, y el valor del pl característico
de una proteína dependerá de las concentraciones relativas de los diferentes grupos ácidos y básicos. En virtud de que el pH
isoeléctrico de una proteína es difícil de calcular a partir de los valores de pK de sus
aminoácidos constituyentes, los valores de
pl de las proteínas se miden experimenta 1mente determinando el pH en el que la proteína no se mueve en un campo eléctrico.
Al igual que con los aminoácidos, a un pH
superior al pl, la proteína tendrá una carga
neta negativa. A un pH inferior al pl la proteína tendrá una carga neta positiva. La importancia del cálculo del pl de una proteína
se tratará más adelante en este capítulo.
3.7.3. Reacciones químicas de los
aminoácidos
Los aminoácidos pueden presentar reacciones químicas a tres niveles: en el grupo a amino, en el a-carboxilo y en los grupos
activos de la cadena lateral R. No obstante
que no es objetivo primordial de este texto
revisar exhaustivamente el alto número de
reacciones posibles, se considerarán aquellas reacciones importantes de identificación
de aminoácidos.
3.13.1. Reacciones del grupo a -carboxilo
El grupo carboxilo a puede esterificarse con
alcoholes o formar amidas en presencia de
amoniaco.
El grupo carboxilo de un aminoácido puede reaccionar con el grupo amino de otro para formar, por medio de un enlace peptídico,
un dipéptido.
go amplificada por serotonina, adrenalina, y
una potente sustancia vasoconstrictora derivada de prostaglandinas, el tromboxano A2
que, en conjunto con el ADP liberado del tejido colágeno, contribuyen a la agregación
plaquetaria para formar el tapón laxo de
plaquetas que constituye la segunda fase.
Esta fase de la hemostasia se mide mediante
el tiempo de sangrado.
La coagulación sanguínea o tercera fase,
que culmina con la formación del trombo
rojo de eritrocitos y fibrina, se puede llevar a
cabo a través de dos vías {extrínseca e intrínseca) que convergen en una ruta final
común que, al activar el factor X, la protrombina se transforma en trombina, la cual
cataliza la transformación de fibrinógeno
(soluble) en el coágulo de fibrina (insoluble).
La vía extrínseca es la que sigue a una lesión en respuesta al daño tisular, debido a la
presencia de sustancias que no están presentes normalmente en la sangre. La vía intrínseca se inicia a través del contacto de la
sangre con una superficie distinta de los va-
sos sanguíneos, por ejemplo, una pared vascular anormal o un área de circulación sanguínea restringida. A causa de una herida se
desencadenan ambos mecanismos, pues la
sangre entra en contacto con una superficie
ajena a los vasos y, además, con otras sustancias de los tejidos que interaccionan con
ella. Las dos vías convergen en el camino
común y finalmente se forma el coágulo.
El elevado número de factores plasmáticos de la coagulación ha obligado a establecer por parte de un Comité Internacional,
una nomenclatura para los mismos. En ésta,
cada factor se designa por un número romano de acuerdo al orden cronológico de su
descubrimiento pero que no tiene relación
con el orden en el cual actúa (tabla 3.8).
Vía extrínseca. Esta vía es sumamente rápida en respuesta al daño tisular. Se inicia
con la liberación de un factor tisular, la
tromboplastina, que forma un complejo activo, en presencia de Ca 2+ , con el factor Vlla
(activado) plasmático. La tromboplastina tisular es una lipoproteína que se encuentra
ampliamente distribuida en las membranas
de los tejidos, especialmente cerebro, pulmones y capas del endotelio vascular.
Vía intrínseca. Esta es una vía lenta, porque en ella intervienen un número mayor de
factores que, al operar en un mecanismo de
cascada, generan el factor Xa (activado). Se
inicia con la fase de contacto en la cual se
activa parcialmente el factor XII, enzima
que cataliza la transformación de prekalikreína (factor Fletcher) en kalikreína, enzima autocatalítica, que ataca al factor XII y lo
activa totalmente (Xlla). El sustrato principal del factor Xlla es el factor XI el cual es
activado (Xla). La acción del factor Xla
constituye la última etapa del sistema intrínseco; su sustrato es el factor IX el cual se activa en dos etapas con participación de Ca 2+ .
La activación del factor X constituye la
etapa clave y vía común de la coagulación al
estar regulada por las vías extrínseca e intrínseca. La activación del factor X, catalizada por el factor IXa, es acelerada 500
veces por la presencia del factor VIII o factor antihemofílico; este último factor es activado previamente por trombina (fíg. 3.35).
La formación de la red de fibrina se inicia
con el paso de protrombina a trombina, catalizado por el complejo Xa-Ca 2+ -Va-FL. La
velocidad de activación de la protrombina
por el factor Xa aumenta 50 a 100 veces en
presencia de fosfolípidos (FL) y Ca 2+ . El cofactor Va acelera el proceso unas 350 veces.
El valor global del complejo activador de
protrombina es de 20,000 veces.
El paso de fibrinógeno a fibrina se produce
por la acción proteolítica de la trombina sobre
el fibrinógeno, que se encuentra a una alta
concentración en el plasma. El fibrinógeno
pasa, así, a la forma de monómero de fibrina;
estos monómeros se asocian y forman una
fibra polimerizada conocida como coágulo
blando cuyo paso a la estructura insoluble llamada coágulo duro o red de fibrina requiere la
presencia del factor XHIa como catalizador.
En situación normal, los procesos de formación del coágulo están bloqueados por
sustancias inhibidoras de la coagulación
que aseguran la ausencia de trombos intravasculares. Estas sustancias son principalmente la heparina, las antiproteasas descritas
anteriormente y, fundamentalmente, la antitrombina III; el efecto de la antitrombina es
potenciado varios cientos de veces por heparina. La heparina se localiza en los granulos
metacromáticos de las células cebadas que
se localizan en la pared vascular, por lo que
su distribución es muy amplia.
El proceso de disolución del coágulo a los
pocos días de su formación, llamado^fer/ndlisis, se inicia con la activación del plasminógeno plasmático a plasmina, que es una
serinproteasa capaz de digerir tanto al fibrinógeno como a la fibrina. El activador del
plasminógeno es una serinproteasa tisular
catalíticamente inactiva hasta que se expone
a la fibrina; cuando la plasmina digiere a la
fibrina, el activador ya no manifiesta actividad y la fibrinólisis cesa. Existe interés
terapéutico en este activador tisular del plasminógeno, para reducir el daño de una trombosis coronaria aguda. Así mismo, la urocinasa
serinproteasa sintetizada en el riñon y la estreptocinasa del estreptococo p-hemolítico,
estimulan la activación del plasminógeno.
Las propiedades anticoagulantes de la estreptocinasa se utilizan a nivel terapéutico.
Otros factores anticoagulantes de uso terapéutico incluyen a los cumarínicos, que
inhiben la carboxilación, dependiente de vitamina K, de los residuos de glutamato a
carboxiglutamato (Gla) en las regiones
NH2-terminales de los factores II, VII, IX y
X. El dicumarol, antagonista de la vitamina
K, se usa como anticoagulante en pacientes
predispuestos a formar coágulos intravasculares.
3.7.4.
Glicoproteínas y proteoglicanos
Las glicoproteínas y proteoglicanos son moléculas constituidas por proteínas a las cua-
les se han agregado cadenas de oligosacáridos unidos por covalencia. Casi todas las
proteínas plasmáticas, excepto la albúmina,
son glucoproteínas. Muchas proteínas de
membrana, los grupos sanguíneos y algunas
hormonas, son glucoproteínas. Muchos investigadores del cáncer piensan que el fenómeno de la metástasis se debe, por lo menos
en parte, a alteraciones de las glucoproteínas
de la superficie de las células cancerosas.
Las glicoproteínas forman la mayor parte
del mucus secretado por las células epiteliales que permite la lubricación de los conductos del cuerpo. Las glucoproteínas son
proteínas con pesos moleculares que van de
15,000 a más de un millón, a las cuales se
unen una o varias cadenas de oligosacáridos
(menos de 15 azúcares) que contribuyen con
60%. Los proteoglicanos son de mayor tamaño en comparación con la glucoproteínas, su PM es de varios millones, tienen
90-95% de carbohidratos, con múltiples cadenas de glicosaminoglicanos. La heparina
es un proteoglicano en la que más de la mitad de las serinas se encuentran enlazadas
con cadenas de polisacáridos. Además de
anticoagulante, la heparina se une a la lipoproteinlipasa de la pared capilar y causa su
liberación.
En el aspecto estructural, es importante la
unión entre la glicoproteína colágena y los
proteoglicanos con sulfato y carboxilato
(ver más adelante).
Por defectos hereditarios en la enzima
lisosomal encargada de hidrolizar los glicosaminoglicanos presentes en los proteoglicanos, se produce un grupo de enfermedades,
clasificadas dentro de los errores innatos del
metabolismo, llamadas mucopolisacaridosis; (ver unidad de carbohidratos).
Es de particular interés el estudio de estos
compuestos en medicina, en particular de la
microbiología, en virtud de que la pared
bacteriana está construida por peptidoglicanos, entre otras moléculas. Las bacterias gram
positivas tienen una pared que contiene peptidoglicanos y ácido teicoico, cuya síntesis
es bloqueada por penicilina. La especificidad de las reacciones inmunológicas a las
bacterias depende de los peptidoglicanos
de su pared.
3.7.5 Colágeno y proteínas contráctiles.
El colágeno, principal proteína del tejido
conectivo es la proteína más común en el
mundo animal y más abundante del cuerpo
humano. Es una proteína insoluble en agua,
rígida y muy resistente a la tensión; es la que
proporciona fuerza estructural y forma a
todos los tejidos y órganos del cuerpo. Predomina en el tejido conjuntivo o conectivo
donde forma parte de los tendones, cartílagos, cristalino, piel, etc. (tabla 3.9). La gelatina, proteína de uso común, se obtiene
como alimento desnaturalizando el colágeno por el calor.
Se denomina sustancia fundamental o basal a la estructura de carácter gelatinoso
compuesta de fibrillas de colágeno incrustadas en un matriz de polisacáridos aminados
y glicoproteínas.
En la estructura del colágeno predomina
la glicina (35%), prolina (10.12%), alanina
(11 %) y los aminoácidos derivados hidroxiprolina (10%) y 5-hidroxilisina (10%). No
posee triptófano ni cisterna. La unidad molecular básica del colágeno en las fibrillas
contiene tres cadenas polipeptídicas, con una
glicina cada tercer aminoácido, que se denomina tropocolágeno, o según la terminología más reciente, simplemente colágeno.
Existen por lo menos 5 tipos distintos de
colágeno en los tejidos por lo que se considera una familia de moléculas que comparten numerosas propiedades. La propiedad
más definida es la triple hélice, estructura
enrollada de tres subunidades polipeptídicas
unidas entre sí por puentes de hidrógeno. La
prolina determina su arreglo helicoidal y el
pequeño tamaño de la glicina asegura la íntima unión de las tres cadenas que permite
una estructura de superhélice (fig. 3.36).
Síntesis de colágeno. El colágeno maduro
es una proteína extracelular pero su síntesis
es de inicio intracelular bajo la forma de una
molécula precursora llamada preprocolágeno. Este precursor pierde una secuencia guía
de 100 aminoácidos (péptido señal) y se
transforma en procolágeno; en está forma
las hidroxilasas de prolina y lisina las transforma en hidroxiprolina e hidroxilisina respectivamente. Estas enzimas requieren
oxígeno molecular, a-cetoglutarato, hierro
ferroso y, sobre todo, ácido ascórbico; durante la adolescencia hay una gran demanda
de vitamina C para este tipo de reacciones.
En ausencia de ácido ascórbico, se forma un
colágeno con dificultad para formar fibras,
ocasionando fragilidad de los tejidos y la
aparición de lesiones de la piel, huesos,
dientes y vasos sanguíneos, todas ellas características del escorbuto. Posteriormente,
el procolágeno es glicosilado, con glucosa o
galactosa, en las hidroxilisinas. En una etapa
posterior, se forman puentes disulfuro entre
cadenas de procolágeno y se integra una triple hélice que sale de la célula. Después de
la formación de triple hélice, no puede ocurrir una hidroxilación ulterior de los residuos de prolina y lisina.
Después de este proceso intracelular, el
procolágeno glicosilado alcanza el exterior;
las enzimas extracelulares amino y carboxiproteasas remueven los propéptidos amino y
carboxilo terminal, donde se encuentran las
cisternas, responsables de los puentes disulfuro (-S-S-), y se forman unidades de tropocolágeno que se ensambla espontáneamente
en fibrillas de colágeno inmaduro. Sin embargo, estas fibrillas no tienen la fuerza tensora del colágeno maduro hasta que se
forman enlaces covalentes en forma cruzada; en este entrecruzamiento participan condensaciones aldólicas con el e-amino de la
lisina que se desamina oxidativamente a un
6-aldehído (al-lisina) y forma bases de
Schiff con otros e-NH 2 de lisinas o hidroxilisinas.
El resultado es la fibra de colágeno madura. En el latirismo, enfermedad que se debe
a la ingestión del frijol Lathyrus, no pueden
formarse con facilidad los enlaces covalentes y el colágeno se vuelve muy frágil.
En el cartílago, los proteoglicanos y el colágeno son biológica y mecánicamente interdependientes. El cartílago es una matriz
extracelular en la cual el colágeno contribuye a su fuerza tensora y los proteoglicanos
son los causantes de su notable elasticidad.
Enfermedades del colágeno
Las enfermedades del colágeno pueden resultar de defectos adquiridos o hereditarios;
entre los primeros podemos ubicar al escorbuto y el latirismo. Las enfermedades hereditarias por defectos en la síntesis o el
ensamble sirven muy bien para ilustrar las
consecuencias de diferentes tipos de mutaciones. La consideración de los pasos de
biosíntesis del colágeno (fig. 3.37) es necesaria para entender estas enfermedades.
Osteogénesis imperfecta. Es el nombre
que se da a un grupo de 4 enfermedades caracterizadas por múltiples fracturas (fragilidad
ósea) que dan como resultado deformidades
óseas; se debe a síntesis defectuosa de una
de las cadenas del colágeno tipo I. En esta
enfermedad se impide la formación normal
de la triple hélice con la consiguiente degradación de todas las cadenas, fenómeno denominado con propiedad "suicidio proteico".
Síndrome de Ehlers - Danlos. Con este
nombre se designa a un grupo de al menos
10 enfermedades que comparten entre todas
ellas síntomas de debilidad estructural en el
tejido conectivo. Por ejemplo, el síndrome
de Ehlers-Danlos tipo IV, está causado por
defectos en el colágeno tipo III; los síntomas
son graves por el embarazo o el parto y tendencia a sufrir contusiones. El síndrome de
Ehlers-Danlos tipo V, llamada también cutis
laxa, se manifiesta por piel suelta, que aparece excesivamente arrugada y cuelga en
pliegues. En el síndrome de Ehlers-Danlos
tipo VI hay una deficiencia de lisil-hidroxilasa; las características clínicas incluyen
marcada hiperextensibilidad de la piel y las
articulaciones, difícil curación de las heridas
y deformaciones músculo-esqueléticas. En
el tipo VII del síndrome la piel se magulla
fácilmente y es hiperextensible.. pero la principal manifestación es la dislocación de las
articulaciones como la cadera y rodillas.
Síndrome de Marfán: Es una enfermedad
que se caracteriza por síntomas relacionados
con esqueleto, ojo y corazón, que suelen ter-
minar con accidentes vasculares, en especial
con ruptura de la aorta. Se ha identificado el
colágeno tipo I como el posible factor donde
reside la base de esta enfermedad.
Síndrome de Menkes. Se caracteriza porque el cabello toma aspecto rizado. Hay deficiencia de lisinoxidasa y los enlaces
cruzados son defectuosos; esta asociado a
un metabolismo anormal del cobre.
Proteínas contráctiles
El movimiento es una característica esencial
de todas las formas vivas, desde el movimiento de cilios y flagelos hasta el más fino
de la mano humana. Las moléculas responsables de esta importante propiedad son las
proteínas contráctiles. El mecanismo contráctil del músculo esquelético de los vertebrados es el mejor conocido.
el)
Diámetro de 1 5 A
Prolina
Figura 3.37 Estructura de! colágeno desde la secuencia primaria hasta la fibrilla.
Para que se realicen los movimientos de
una célula (pseudópodos) o de un organismo
(contracción muscular) se requiere de un
mecanismo disparador del proceso (el Ca 2+ ),
una fuente de energía (el ATP) y un sistema
transductor (el músculo). El músculo es el
principal transductor bioquímico que convierte la energía (química) potencial en
energía (mecánica) cinética. Este sistema mecanoquímico es la maquinaria más eficiente y
versátil de conversión energética jamás conocida.
Un transductor químico-mecánico debe
satisfacer varios requerimientos: 1) suministro constante de energía; 2) debe haber un
sistema regulador de la actividad mecánica;
3) debe existir un operador, función cubierta
por el sistema nervioso y 4) que la máquina
pueda regresar a su estado original. Estos requerimientos son satisfechos, en el hombre,
por tres tipos de músculos: esquelético, cardiaco y liso. El músculo esquelético y cardiaco aparecen estriados en el microscopio;
el músculo liso no es estriado. El músculo
esquelético se encuentra bajo control nervioso voluntario, el músculo cardiaco y liso
es de control involuntario.
El tejido muscular es el más abundante del
cuerpo humano. Más del 40% de la masa muscular de un individuo adulto es músculo esquelético. Durante una actividad muscular intensa,
los músculos pueden consumir 85% o más
del ATP total producido en el metabolismo.
Todos los músculos estriados del cuerpo
están formados por gran número de fibras.
Cada fibra muscular contiene millares de
miofibrillas, ordenadas en paralelo, las cuales poseen a su vez unos 2,500 filamentos
que se encuentran inmersos en un citoplasma soluble (sarcoplasma), rodeados por una
membrana celular (sarcolema). La célula
muscular posee un abundante retículo endoplásmico (sarcoplásmico) poco rugoso, lo
cual habla de una síntesis proteica muscular
poco activa; su contenido en mitocondrias
es muy variable, los músculos aeróbicos de
actividad continua son muy abundantes en
mitocondrias, mioglobina y citocromos, son
los llamados músculos rojos; en cambio, los
músculos blancos son poco abundantes en
mitocondrias y mioglobina y su metabolismo es anaeróbico.
Las miofibrillas son la maquinaria contráctil del músculo y su unidad es la sarcómera.
Cuando se examinan cortes de una miofibrilla
al microscopio óptico o electrónico presentan
un aspecto estriado. Este se debe a la alternancia de bandas oscuras y claras; la banda
oscura, banda A, es anisotrópica, birrefringente a la luz polarizada, lo cual sugiere un
ordenamiento geométrico regular de las moléculas; la banda I es isotrópica, no es refringente, lo que indica un ordenamiento más al
azar. Dentro de la banda A se distingue una
zona de poca densidad a los electrones o zona H con una línea central muy densa, linea
M. Dentro de la banda I se define una línea
muy densa a los electrones o línea Z; dos líneas Z delimitan una sarcómera (fig. 3.38).
Detrás de la estructura microscópica de la
miofibrilla subyace una estructura molecular de sus componentes. Cada sarcómera está
formada por filamentos gruesos, confinados
a la zona H de la banda A y que constan de
la proteína miosina; los filamentos delgados
se localizan en la banda I pero se extienden
hasta la banda A y consisten en las proteínas
acuna, tropomiosina y troponina. La línea Z
es un material amorfo de a-actinina al cual
se unen los filamentos delgados y la línea M
es un ensanchamiento de los filamentos
gruesos formada por proteína M. Al corte
transversal, cada filamento grueso está rodeado por seis filamentos delgados y cada
filamento delgado está rodeado por tres filamentos gruesos (fig. 3.39).
Proteínas musculares
La actina, descubierta por Straub, es una
proteína globular que representa el 25% en
peso de la proteína muicular. La forma globular monomérica es la actina-G, la cual se
prolimeriza, en presencia de Mg 2 + para formar un filamento de doble hélice, insoluble,
llamado actina-F. Ninguna de las dos formas (G o F) muestra actividad catalítica.
La tropomiosina, descubierta por Bailey,
es una molécula en forma de varilla o bastón
que se encuentra asociada con filamentos de
actina. Constituye el 2.5% de las proteínas
musculares. La otra proteína ligada a la actina es la troponina. Mientras que la tropomiosina existe en todos los músculos, la
troponina es exclusiva del músculo estriado.
La troponina consta de tres subunidades diferentes: la troponina-C, proteína fijadora de
calcio; la troponina-I, inhibe la interacción
actina-miosina y también la actividad
ATPasa; la troponina-T, interviene en el ensamble de las subunidades C e I al complejo
actina-tropomiosina (fig. 3.40).
El componente fundamental del filamento
grueso es la miosina descubierta por Kuhne,
es la proteína más abundante del músculo
esquelético (55% de la proteína muscular).
La miosina está compuesta por dos cadenas
pesadas entrelazadas helicoidalmente con
una cabeza globular en cada extremo, lo cual
le da un aspecto característico (fig. 3.41).
Además, cada cabeza globular está asociada
a dos cadenas ligeras. La porción globular
de la miosina tiene actividad ATPasa y se
combina con la actina.
Cuando la miosina es digerida con tripsina, se forman 2 fragmentos denominados
meromiosinas. La meromiosina pesada posee la porción globular y parte de la porción
fibrosa; conserva la actividad ATPasa y se
une a la actina-F. La meromiosina ligera
contiene la porción fibrosa y no muestra actividad ATPasa ni se une a la actina-F. La
actividad ATPasa se incrementa 100 a 200
veces por la adición de actina-F.
Actomiosina. Hace ya más de 30 años que
Szent-Gyórgyi mezcló en un tubo de ensayo
actina con miosina y observó la formación
de un complejo actomiosina que aumentó la
viscosidad de la solución. La fibra de actomiosina preparada por Engelhardt, posee un
comportamiento óptico de doble refracción
análogo a la fibra muscular intacta; esto justificó el considerar que una fibra de actomiosina preparada es, en efecto, un modelo
molecular de la fibrilla muscular.
Bases moleculares de la contracción
muscular
La contracción muscular se inicia con la llegada del impulso nervioso y con ello la acetilcolina que despolariza la membrana
muscular y se alcanza el potencial crítico o
de acción que se propaga por el sarcolema.
Esta despolarización provoca aumento de
permeabilidad al Ca 2+ . En ausencia de calcio la interacción actinamiosina está inhibida por la troponina-I y el músculo está en
reposo, relajado. Al entrar el Ca 2 + al sarcoplasma, se une a la troponina-C y se produce
un cambio conformacional que afecta a las
otras subunidades de troponina y a la tropomiosina que se desplaza de su lugar y permite interaccionar a las cabezas globulares de
la miosina con las moléculas de actina.
En conjunto, se produce un deslizamiento de
filamentos de actina sobre los de miosina y con
ello un acortamiento, no de filamentos, sino de
la zona H (fig. 3.42). Al acortarse la zona H,
se acorta la sarcómera, la miofibrilla y el
músculo completo. La energía que aporta fuerza para la contracción muscular es la hidrólisis del ATP (ver capítulo Bioenergética). La
característica de este ciclo bioquímico de contracción es que la actina posee poca afinidad
por el complejo miosina-ATP (fibra-relajada);
al hidrolizarse el ATP, se produce la contracción por la elevada afinidad de la actina por el
complejo miosina-ADP (fibra contraída). En
términos simples, la energía producida por
hidrólisis de ATP se usa para que se produzca la unión-desunión de actina y miosina.
La relajación de músculo tiene lugar con
el cese del impulso nervioso y el retorno del
sarcolema a su estado polarizado original lo
cual se logra por bombeo de Na+ hacia afuera y de K+ hacia dentro de la célula por me-
dio de una Na+-K+-ATPasa. En esta fase de
relajación interviene también el ATP para
bombear Ca2+, contra un gradiente de concentración, hacia afuera de la célula por una
C 1+-M | + -ATPasa.
El grupo carboxilo puede ser químicamente descarboxilado para dar la correspondiente amina.
te detectar cantidades del orden de 1 microgramo ó 3 * 10~9 moles de un aminoácido.
La fluorescamina reacciona con los aminoácidos a temperatura ambiente dando un
producto fluorescente, cuya concentración
5.13.2. Reacciones del grupo a -amino
puede medirse con un espectrofluorímetro.
Este es un reactivo aún más sensible (10 a
El grupo amino de los aminoácidos reaccio- 100 veces mayor que la ninhidrina), ya que
na con la ninhidrina en caliente para dar un permite detectar cantidades de nanogramos
compuesto púrpura intenso (excepto la de un aminoácido o 10-10 a 10"11 moles.
prolina que da un derivado amarillo) que
La reacción con dinitrofluoro benceno
absorbe al máximo la luz con longitud de (reactivo de Sanger) fue muy utilizada hace
onda de 570 nm (el amarillo de la prolina a años para identificar aminoácidos N-termi440 nm).
nales, hoy, casi en desuso. Los a -aminoáciEl color obtenido con la ninhidrina es la dos en presencia del reactivo dan lugar a los
base de una prueba colorimétrica que permi- dinitrofenil derivados.
3.13.3. Reacciones de la cadena lateral
Un buen número de reacciones químicas
pueden ser utilizadas para cuantificar cadenas laterales específicas en una solución de
aminoácidos libres o proteínas desnaturalizada.
El reactivo de Ellman (ácido ditiobis-nitrobenzoico) reacciona con el tiol de la cadena lateral de la cisterna a pH 8.0 dando un
producto, el ácido tionitrobenzoico, que absorbe intensamente a 412 nm.
La reacción de Sakaguchi se utiliza para
cuantificar espectrofotométricamente el
grupo guanidino de la arginina. El reactivo
de Ehlrich es un ensayo colorimétrico para
el grupo indol del triptófano. El reactivo de
Pauly da un color rojo con el imidazol de la
histidina y el fenol de la tirosina.
3.1.4.
Clasificación
Entre las diferentes clasificaciones estructurales de los aminoácidos, quizá la más extendida
es la que los agrupa según las propiedades
fisicoquímicas de su cadena lateral, en particular, en cuanto a su polaridad. Los aminoácidos se denominan en forma sistemática o
trivial. La más extendida es la denominación trivial o común, fruto del material donde se aislaron por primera vez (asparagina