Examen de física y química 1º Bachillerato Teoría atómico
Anuncio

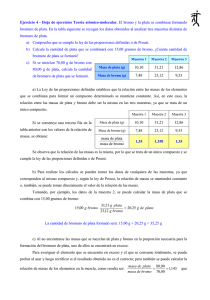
Teoría atómico-molecular Teoría cinética. Examen de física y química 1º Bachillerato 1. El bromo y la plata se combinan formando bromuro de plata. En la Muestra 1 Muestra 2 Muestra 3 tabla siguiente se recogen los datos Masa de plata (g) 10,10 31,21 12,86 obtenidos al analizar tres muestras Masa de bromo (g) 7,48 23,12 9,53 distintas de bromuro de plata. a) Comprueba que se cumple la ley de las proporciones definidas o de Proust. b) Calcula la cantidad de plata que se combinará con 15 gramos de bromo. ¿Cuánta cantidad de bromuro de plata se formará? c) Si se mezclan 70 g de bromo con 80 g de plata, calcula la cantidad de bromuro de plata que se formará. 2. Tenemos dos recipientes idénticos, de 20 litros de volumen. En uno de ellos se introduce butano (C4H10) y en el otro nitrógeno (N2), ambos en las mismas condiciones de presión y temperatura. Explica si las siguientes afirmaciones son verdaderas o falsas. a) Contienen el mismo número de moles. b) Contienen el mismo número de moléculas. c) Contienen el mismo número de átomos. d) Tienen la misma masa. 3. Una cierta cantidad de amoniaco (NH3) ocupa un volumen de 4 litros a una presión de 650 mmHg y 20 °C. Calcula: a) La cantidad de gas en mol. b) El número de moléculas gaseosas. c) El número de átomos de hidrógeno y de nitrógeno. Masas atómicas(u): H = 1; N = 14. R = 0'082 atm·l mol ·K 4. Responde a los siguientes apartados: a) Justifica, según la teoría cinético-molecular, por qué aumenta la presión de un gas, al disminuir el volumen, manteniendo constante la temperatura. b) Define presión de vapor de un líquido. c) ¿Puede hervir agua por encima de 100 °C? ¿Y hacer que hierva a 60 °C? 5. Al analizar un determinado compuesto se ha obtenido la siguiente composición centesimal: 71,8 % de cloro, 24,2 % de carbono y 4,0 % de hidrógeno. Deduce su fórmula empírica y molecular, si se sabe que al introducir 2,780 g del compuesto en un recipiente de 1 litro a una temperatura de 127 °C, la presión es de 700 mmHg. Masas atómicas(u): H = 1; C = 12; Cl = 35,5. R = 0'082 atm·l mol ·K