Ejercicio 4 - Hoja de ejercicios Teoría atómico
Anuncio
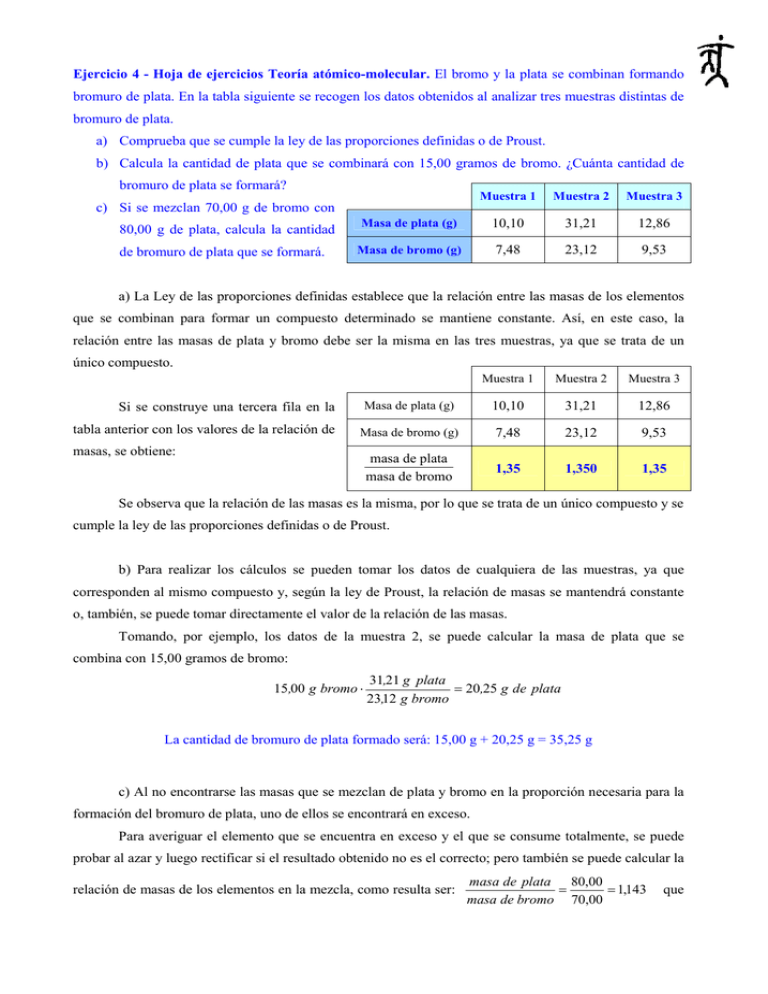
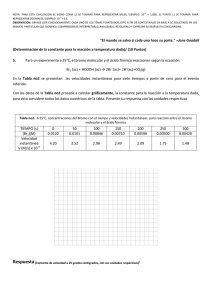
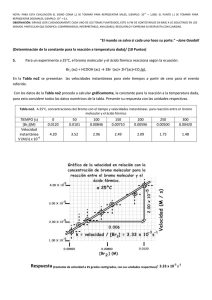
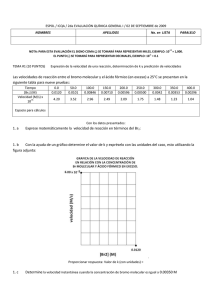
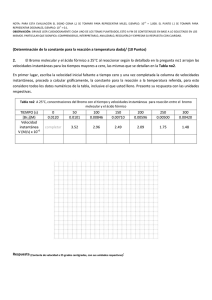
Ejercicio 4 - Hoja de ejercicios Teoría atómico-molecular. El bromo y la plata se combinan formando bromuro de plata. En la tabla siguiente se recogen los datos obtenidos al analizar tres muestras distintas de bromuro de plata. a) Comprueba que se cumple la ley de las proporciones definidas o de Proust. b) Calcula la cantidad de plata que se combinará con 15,00 gramos de bromo. ¿Cuánta cantidad de bromuro de plata se formará? Muestra 1 Muestra 2 Muestra 3 Masa de plata (g) 10,10 31,21 12,86 Masa de bromo (g) 7,48 23,12 9,53 c) Si se mezclan 70,00 g de bromo con 80,00 g de plata, calcula la cantidad de bromuro de plata que se formará. a) La Ley de las proporciones definidas establece que la relación entre las masas de los elementos que se combinan para formar un compuesto determinado se mantiene constante. Así, en este caso, la relación entre las masas de plata y bromo debe ser la misma en las tres muestras, ya que se trata de un único compuesto. Muestra 1 Muestra 2 Muestra 3 Masa de plata (g) 10,10 31,21 12,86 Masa de bromo (g) 7,48 23,12 9,53 masa de plata masa de bromo 1,35 1,350 1,35 Si se construye una tercera fila en la tabla anterior con los valores de la relación de masas, se obtiene: Se observa que la relación de las masas es la misma, por lo que se trata de un único compuesto y se cumple la ley de las proporciones definidas o de Proust. b) Para realizar los cálculos se pueden tomar los datos de cualquiera de las muestras, ya que corresponden al mismo compuesto y, según la ley de Proust, la relación de masas se mantendrá constante o, también, se puede tomar directamente el valor de la relación de las masas. Tomando, por ejemplo, los datos de la muestra 2, se puede calcular la masa de plata que se combina con 15,00 gramos de bromo: 15,00 g bromo ⋅ 31,21 g plata = 20,25 g de plata 23,12 g bromo La cantidad de bromuro de plata formado será: 15,00 g + 20,25 g = 35,25 g c) Al no encontrarse las masas que se mezclan de plata y bromo en la proporción necesaria para la formación del bromuro de plata, uno de ellos se encontrará en exceso. Para averiguar el elemento que se encuentra en exceso y el que se consume totalmente, se puede probar al azar y luego rectificar si el resultado obtenido no es el correcto; pero también se puede calcular la relación de masas de los elementos en la mezcla, como resulta ser: masa de plata 80,00 = = 1,143 masa de bromo 70,00 que es menor que la del compuesto, se puede deducir que el elemento que se consumirá totalmente es la plata y el bromo permanecerá en exceso. Por tanto, se procederá como en el apartado anterior, pero considerando que se combinan totalmente los 80,00 g de plata: 80 ,00 g plata ⋅ 23,12 g bromo = 59,26 g de bromo 31,21 g plata La cantidad de compuesto formado será: masa de bromuro de plata = 80,00 g + 59,26 g = 139,26 g Y quedará sin reaccionar una masa de 70,00 g – 59,26 g = 10,74 g de bromo