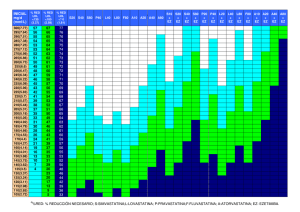
Proyecto - Fundación Hipercolesterolemia Familiar
Anuncio

REDES TEMÁTICAS DE INVESTIGACIÓN COOPERATIVA Subdirección General de Investigación Sanitaria Fondo de Investigación Sanitaria SOLICITUD DE CONSTITUCIÓN Y FINANCIACIÓN DE REDES DE GRUPOS Convocatoria del Ministerio de Sanidad y Consumo de 22-03- 2002 («B.O.E.» de 3 de abril de 2002) Expediente Nº TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. TEMÁTICA ESPECÍFICA DE INVESTIGACIÓN DE LA RED: HIPERLIPEMIAS GENÉTICAS RELACION DE CENTROS QUE COMPONEN LA RED Cumplimente el siguiente cuadro por cada uno de los centros que componen la red. Añada tantos cuadros de datos como sea preciso. Código del Centro DATOS DEL CENTRO Denominación: CLINICA MUESTRA SEÑORA DE LA CONCEPCION. FUNDACIÓN JIMÉNEZ DÍAZ Domicilio: AV. REYES CATOLICOS 2 Población MADRID PROVINCIA MADRID Dependencia: Código postal 28040 Teléfono: 915504910 Código del Centro DATOS DEL CENTRO Denominación: INSTITUTO ARAGONES DE CIENCIAS DE LA SALUD Domicilio: ED. PIGNATELLI Pº Mª AGUSTIN 36 Población ZARAGOZA PROVINCIA ZARAGOZA Dependencia: DIPUTACIÓN GENERAL ARAGÓN Teléfono: Código postal 50004 976-714306 Código del Centro DATOS DEL CENTRO Denominación: INST. CIENCIAS CARDIOVASCULARES CATALUÑA/INST. INVEST. CARDIOVASCULAR BARCELONA Domicilio: Población BARCELONA S. ANTONI Mº CLARET 167 PROVINCIA BARCELONA Dependencia: ILMO. SR. DIRECTOR DEL INSTITUTO DE SALUD CARLOS III Teléfono: Código postal 08025 93-2919285 Código del Centro DATOS DEL CENTRO Denominación: HOSPITAL UNIVERSITARIO REINA SOFIA Domicilio: AVDA MENÉNDEZ PIDAL S/N Población CÓRDOBA PROVINCIA CÓRDOBA Dependencia: Código postal 14004 Teléfono: 957-010449 Código del Centro DATOS DEL CENTRO Denominación: INSTITUTO DE INVESTIGACIONES BIOMÉDICAS Domicilio: AUGUST PI I SUNYER C/ VILLARROEL 170 Población BARCELONA PROVINCIA BARCELONA Dependencia: Código postal 08036 Teléfono: 93-2275410 Código del Centro DATOS DEL CENTRO Denominación: CIUDAD SANITARIA Y UNIVERSITARIA DE BELLVITGE Domicilio: C/ FEIXA LLARGA S/N Población L'HOSPITALET DE LLOBREGAT PROVINCIA BARCELONA Dependencia: INSTITUTO CATALAN DE LA SALUD Código postal 08907 Teléfono: 93-2607664 Código del Centro DATOS DEL CENTRO Denominación: FACULTAD DE FARMACIA, UNIVERSIDAD DE BARCELONA Domicilio: AVDA. DIAGONAL 643 Población BARCELONA PROVINCIA BARCELONA Dependencia: Teléfono: Código postal 08028 93-4024531 Código del Centro DATOS DEL CENTRO Denominación: HOSPITAL DE LA SANTA CREU I SANT PAU Domicilio: Población BARCELONA SANT ANTONI Mª CLARET 167 Dependencia: PROVINCIA BARCELONA Teléfono: Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Relación de centros que componen la red Código postal 08025 93-2919104 Página 2 de 97 Código del Centro DATOS DEL CENTRO Denominación: HOSPITAL CLÍNICO UNIVERSITARIO DE VALENCIA Domicilio: AVDA. BLASCO IBAÑEZ 17 Población VALENCIA PROVINCIA VALENCIA Dependencia: Código postal 46010 Teléfono: 96-3862665 Código del Centro DATOS DEL CENTRO Denominación: INSTITUTO DE INVESTIGACIONES EN CIENCIAS DE LA SALUD Domicilio: C/SANT JOAN S/N Población REUS PROVINCIA TARRAGONA Dependencia: Código postal 43201 Teléfono: 977-314399 Código del Centro DATOS DEL CENTRO Denominación: FACULTAD DE MEDICINA, UNIVERSIDAD DE CANTABRIA Domicilio: C/ CARDENAL H ORIA S/N Población SANTANDER PROVINCIA CANTABRIA Dependencia: Código postal 39011 Teléfono: 94-2201953 Código del Centro DATOS DEL CENTRO Denominación: MEDPLANT GENETICS Domicilio: EL CARMEN 38 Población BARACALDO PROVINCIA VIZCAYA Dependencia: Teléfono: Código postal 48901 902-100394 Código del Centro DATOS DEL CENTRO Denominación: HOSPITAL UNIVERSITARIO VIRGEN DEL ROCIO Domicilio: Población SEVILLA AVDA. MANUEL SIUROT S/N Dependencia: PROVINCIA SEVILLA Teléfono: Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Relación de centros que componen la red Código postal 41013 95-5013457 Página 3 de 97 Código del Centro DATOS DEL CENTRO Denominación: HOSPITAL RAMON Y CAJAL Domicilio: CTRA DE COLMENAR, Km 9.1 Población MADRID PROVINCIA MADRID Dependencia: INSTITUTO MADRILEÑO DE LA SALUD Código postal 28034 Teléfono: 91-3368000 Código del Centro DATOS DEL CENTRO Denominación: Domicilio: Población PROVINCIA Dependencia: Código postal Teléfono: Código del Centro DATOS DEL CENTRO Denominación: Domicilio: Población PROVINCIA Dependencia: Código postal Teléfono: Añadir cuadro de datos Eliminar cuadro de datos Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Relación de centros que componen la red Página 4 de 97 Expediente Nº RTIC-G ESTRUCTURA ORGANIZATIVA DE LA RED TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. La Red temática en Hiperlipemias Genéticas está constituida por 16 nodos, pertenecientes a 14 Centros del Sistema Sanitario Nacional y Universitario. Uno de los nodos es emergente y está tutelado por el Dr. Gomez Coronado (Hospital Ramón y Cajal). El total de nodos representan a 7 Comunidades Autónomas ( Andalucía, Aragón, Cantabria, Cataluña, Madrid, Valencia, País Vasco). La distribución de nodos por Comunidad Autónoma es la siguiente: Andalucía: 2 ; Aragón: 2; Cantabria: 1 ; Cataluña: 6; Madrid: 3 ( Un nodo emergente ) ; Valencia: 1; País Vasco: 1 Se dispone de un registro de filiación de los miembros de cada nodo integrante de la Red. En cada nodo hay un coordinador local que corresponde al Investigador Principal. En el apartado de Plan de Trabajo se detallan los 16 nodos y centros a los que pertenecen, así como el investigador responsable del grupo y el total de investigadores que componen cada uno de ellos. El Coodinador de la red es el Dr. Pedro Mata (Madrid) , y el encargado del Programa de Docencia y Formación de la red es el Dr. Francisco Perez Jiménez (Córdoba). La Red cuenta con el apoyo de 72 clínicas de lípidos del Sistema Nacional de Salud, distribuídas por todo el territorio nacional, que siguen protocolos comunes de recogida de datos para el diagnóstico de las hiperlipemias genéticas (Se adjunta mapa con la relación de las Unidades). En 1999 se inició el Registro Nacional de Hipercolesterolemia Familiar, propiedad de la Fundación Hipercolesterolemia Familiar (www.colesterolfamiliar.com), una institución benéfico-asistencial. El Presidente de la Fundación es el Dr. Pedro Mata, y varios miembros del comité científico forman parte de la red de nodos (Dra. Badimón, Dr. Mata, Dr. Pocovi, Dr. Perez Jiménez, Dra. Clotilde Vazquez). La red cuenta con una Base de Datos del Registro de pacientes centralizada en Madrid (coordinadores, Dr. Pedro Mata, Dr. Rodrigo Alonso), y de un banco de ADN y seroteca únicos centralizados en la Universidad de Zaragoza (Dr. Miguel Pocovi). Para el presente proyecto, tanto la base de datos como el banco de DNA seguirán en la misma localización, y se creará un laboratorio centralizado para los análisis bioquímicos en el Hospital Sant Pau de Barcelona (Dr.Blanco). Además, se creará un Registro Nacional para la Hiperlipemia Familiar Combinada con la misma estructura organizativa que el anterior registro. Para la consecución de los objetivos del Proyecto coordinado, el suministro de datos y de muestras biológicas se proporcionará a los diferentes nodos desde los distintos bancos de datos y muestras preservando la confidencialidad del paciente según la legislación vigente (Ver Antecedentes). Se trabajará de manera integrada y coordinada, utilizando criterios diagnósticas y metodología comúnes para toda la red. Para la consecución de los objetivos, pueden interactuar varios nodos en función de la complejidad metodológica. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Estructura organizativa de la red página 5 Expediente Nº RTIC-G PLAN ESTRATÉGICO CONJUNTO CON PROYECTO CIENTÍFICO DE TRES AÑOS TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Se presenta un Proyecto científico único de 3 años de duración con el fin de profundizar en el estudio de las hiperlipemias hereditarias en España, desde el punto de vista genético, metabólico, clínico, terapéutico y epidemiológico (ver apartado Objetivos) . Este proyecto se enmarca dentro de las prioridades del Sistema Nacional de Salud para la prevención de la enfermedad cardiovascular en estos pacientes. Su puesta en marcha tendrá un importante impacto social. Para llevar a cabo este Proyecto, se presenta una Red cooperativa y multidisciplinaria, participada por 16 grupos pertenecientes a Centros del Sistema Nacional de Salud, de Universidades , y con apoyo de organismos y empresas privadas farmacéuticas y de tecnología. Uno de los grupos es emergente y está tutelado por el Dr. Gomez Coronado, responsable del nodo 15, del mismo centro. Los distintos grupos que forman la red cuentan con suficiente experiencia en el diagnóstico, tratamiento e investigación en las hiperlipemias genéticas. Y algunos de sus miembros han participado previamente en proyectos coordinados con financiación pública en esta area. Los Centros de Investigación representan a 7 Comunidades Autónomas . Para la consecución de los objetivos propuestos, la Red cuenta con el apoyo de la Fundación Hipercolesterolemia Familiar, y las 72 Clínicas de Lípidos que colaboran en el Registro Nacional de Hipercolesterolemia Familiar, pertenecientes al Sistema Nacional de Salud, y representativas de todas las Comunidad Autónomas de España. Además, España a través de los datos del registro Español de HF colabora con el Programa Internacional MEDPED dependiente de la OMS. Los distintos grupos participarán de forma coordinada e integrada en función a su experiencia clínica, docente e investigadora con el fin de conseguir el adecuado desarrollo del Proyecto. La interacción intelectual queda reflejada en el apartado de Formación en Investigación que propone la red. Se incluye un programa de formación de tercer ciclo (desarrollo de curso de doctorado y tesis doctorales), y de formación continuada a los investigadores, fomentando el intercambio de investigadores entre los distintos grupos. Además, la red considera necesaria la realización de cursos de formación continuada para los miembros de la red de Clínicas de Lípidos que colaboran en el registro ya existente y a médicos del Sistema Nacional de Salud implicados en la detección de pacientes con hiperlipemias genéticas. En el Proyecto se incluye también, el desarrollo y evaluación de un programa de educación y difusión para la población afecta de hiperlipemia genética. La Red cuenta con los siguientes recursos que serán utilizados y compartidos por todos los grupos que lo requieran para la consecución de los objetivos: 1. Un Registro nacional de pacientes con Hipercolesterolemia Familiar formado por 2050 casos índice (un miembro por familia) incorporados en una Base de Datos protegida de acuerdo a la legislacion vigente con la aprobación de la Agencia Nacional de Protección de Datos. Este Registro fue creado en el año 1999 por la Fundación Hipercolesterolemia Familiar. El Presidente de la Fundación es el Dr. Pedro Mata, y miembros del Comité Científico participan en este Proyecto integrado (L Badimón, R Carmena, P Mata, F Perez-Jiménez, J LopezMiranda, M Pocovi, C Vazquez). Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Plan estratégico Página 6 2. Un banco de ADN, suero y plasma de los pacientes incluidos en el registro. Previamente a la obtención de la muestra se ha firmado un consentimiento informado. 3. Un registro de filiación de todo el personal que participa en el Proyecto (se adjunta a continuación). Este Proyecto ampliará el registro de pacientes con HF ya existente, que se enmarca dentro del estudio de la cohorte, y creara un nuevo registro para la HFC. Así mismo se creará un banco de ADN y de sueros para los pacientes con HFC. Las distintas actuaciones necesaria para el desarrollo y consecución del proyecto serán coordinadas por el Coordinador de la Red (Dr. Mata). Los responsables de los recursos disponibles y de los programas a desarrollar en el proyecto son: Base de datos y registros (Dr. Mata, Dr. Alonso) Banco de ADN y seroteca de pacientes con HF y HFC (Dr. M. Pocovi) Laboratorio centralizado análisis bioquímicos (Dr. F. Blanco) Metodología Estudio no invasivo Aterosclerosis preclínica (Dr. E. Ros) Banco de tejidos , tejido adiposo, etc. (Dr. J Ribalta, Dr. J Villar) Docencia y Formación (Dr. F. Perez Jimenez) Educación a Pacientes (Dra. J Panisello, Dra. Clotilde Vazquez) Todos los resultados serán incorporados en una base de datos única para su posterior análisis y podrán ser compartidos por todos los grupos que participan en el proyecto. Todos los nodos participarán en el proyecto de una forma coordinada e integrada, compartiendo la base de datos y bancos de muestras o tejidos que se desarrollen durante el proyecto. La interacción entre los grupos estará determinada en función de los objetivos y la experiencia de cada grupo (ver apartado de Plan de Trabajo). Con el fin de promover la interacción entre los grupos, se realizará al menos una reunión semestral, o cuando el desarrollo del proyecto lo precise. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Plan estratégico Página 7 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. RESUMEN (Objetivos y metodología del proyecto) Las hiperlipemias genéticas son un trastorno frecuente en la población general, caracterizadas por el desarrollo de enfermedad cardiovascular prematura. Objetivos: a) Estudio y seguimiento a largo plazo de una cohorte de hipercolesterolemia familiar(HF)con diagnóstico genético. Se determinará el riesgo y la supervivencia en función de las características clínicas y genéticas; b) Valorar la aterosclerosis preclínica; c)Identificar mutaciones distintas a las del receptor LDL; d)Analizar la interacción gen-gen, gen-factores ambientales y metabólicos;e) Crear un registro de pacientes con Hiperlipemia familiar combinada (HFC), y validar los criterios diagnósticos;f)determinar el riesgo cardiovascular de la HFC;g) identificar genes implicados en el desarrollo de HFC. Métodos: a) Se utilizarán los datos del registro español de HF y se incluirán en la cohorte 4000-5000 familiares sanos y afectos de HF. Se cumplimentará un protocolo homogéneo y se extraeran muestras de ADN y suero para análisis bioquímicos. Los pacientes seguirán visitas cada 2 años. b)aterosclerosis preclínica: medida por ecografía carotídea; c) Bioquímica: perfil ipídico mediante métodos enzimáticos en autoanalizador y ultracentrifugación, apo B, tamaño de LDL; d)ácidos grasos: cromatografía de gases; e) análisis genéticos: biochips, PCR, SSCP, secuenciación y análisis de restricción, PCR larga, arrays de expresión génica; f) funcionalidad: citometría de flujo; g) homocisteína: HPLC; h) factores trombogénicos y LDLox: ELISA, EIA; i) cultivos celulares; j) análisis de expresión de proteínas: isoelectroenfoque y electroforesis. TITLE: GENETIC, METABOLIC, CLINICAL, THERAPEUTIC AND EPIDEMIOLOGYCAL STUDY ON HEREDITARY HYPERLIPIDAEMIA IN SPAIN. SUMMARY (Objectives and methodology) Genetics hyperlipidemia are very frequent in general population and they are characterized by premature cardiovascular disease. Objectives: a) To study and follow up of a large cohort of families with genetic diagnosis of Familial Hypercholesterolaemia (FH). Cardiovascular risk and survival will be determined; b)to evaluate subclinic atherosclerosis; c) To identify mutations in loci others than LDL-receptor gen. d)to evaluate the interactions among LDL-r mutations and other genetics, metabolic and enviromental factors. d) To establish a registry of patients with Familial Combined Hyperlipidaemia (FCH) and to validate the diagnosis criteria; e) to determine cardiovascular risk factors in FCH, and to identify gene involved in the developmente of FCH. Methods: a)From the database of the Spanish registry on FH, patients with genetic FH, and their first degree relatives (affected or not) wil be included in the cohort (around 4.000-5.000 subjects). Homogeneous criteria will be used, and blood sample will be obtained for DNA isolation and biochemical analyses. Subjects will be followed each 2 years; b) subclinic atherosclerois will be measured by carotid ultrasound; c) biochemistry: lipid profile by enzimatic methods in autoanalyzer and ultracentrifugation, apo B, LDL size; d) fatty acids by gas chromatograpgy; e) genetic analysis: biochips, PCR, SSCP, sequentiation, restriction analysis, large PCR, gene expresion arrays; f) Function: flow citometry; g) homocysteine: HPLC; h) Trombogenic factors and oxidized LDL: ELISA, EIA; i) cells culture; j) protein expresion analysis: isoelectricfocusing, electrophoresis. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Página 8 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Antecedentes Las hiperlipemias de base hereditaria son un trastorno frecuente, estimándose su prevalencia en un 2% de la población general. Esto significa que en España existen de 600.000 a 800.000 personas con una hiperlipeima genética. Este término engloba a la Hipercolesterolemia Familiar y otros tipos de Hipercolesterolemia Autosómica Dominante monogénica, y a la Hiperlipemia Familiar Combinada. HIPERCOLESTEROLEMIA FAMILIAR AUTOSÓMICAS DOMINANTES (HAD) (HF) E HIPERCOLESTEROLEMIAS Características clínicas, bioquímicas y genéticas Las HAD son desórdenes del metabolismo lipídico, que se caracterizan por un aumento plasmático de lipoproteinas de baja densidad (LDL) y enfermedad coronaria prematura. Se calcula que la HAD acorta la esperanza de vida, en mas de 25 años, con respecto a la población general. Hace 38 años Goldstein y Brown observaron que las HAD eran consecuencia de defectos en el receptor de las lipoproteínas de baja densidad (r-LDL) y la denominaron hipercolesterolemia familiar (HF, MIM 143890) habiéndose descrito en la actualidad mas de 700 mutaciones en el gen del r-LDL asociadas a HAD (1). La HF es el trastorno hereditario monogénico más frecuente. Se transmite con carácter autosómico dominante, con una penetrancia de casi el 100%. La mutación se produce en el gen que codifica el receptor para las LDL, por lo cual hay una menor expresión de receptores funcionales para las LDL en el hígado. Esto produce un incremento en las concentraciones plasmáticas de estas lipoproteinas, y del colesterol total. En 1987 Innerarity y col (2) demostraron la heterogeneidad genética de la HAD observando que había pacientes con actividad normal del r-LDL y afinidad disminuida de su apolipoproteína B100, denominando a esta hiperlipidemia apo B100 defectuosa familiar (FDB, MIM 144010). La existencia de una mayor heterogeneidad en las HAD nunca ha sido formulada de forma precisa. Varios estudios han encontrado familias en las cuales el defecto responsable de la HAD no está localizado ni en el gen del r-LDL ni en el gen de la apoB-100. En un estudio reciente se identificó un nuevo locus en el cromosoma 1, región p34.1-p32, implicado en la HAD. Se calcula que en dependencia de la población estudiada entre un 15 y un 20% de las HAD están localizados en loci sin identificar (3). Recientemente se ha publicado la base genética de la hipercolesterolemia autosómica recesiva (ARH) (4). Se trata de una enfermedad que cursa con hipercolesterolemia, a veces difícil de distinguir de la propia HF. La ARH es debida a mutaciones en el gen que codifica una proteína denominada por extensión ARH. La estructura de esta proteína se desconoce, pero un análisis detallado de su secuencia sugiere que el gen ARH podría codificar una proteína citoplasmática cuya principal característica es un dominio PTB de unión a fosfotirosina. PTB es un dominio característico de numerosas proteínas adaptadoras que interacciona con secuencias consenso NPXY, presentes en los dominios citoplasmáticos de receptores de la superficie celular, entre los que se encuentra el propio r-LDL, así como los receptores de insulina , EGF, TrkA etc. La proteína Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Antecedentes y estado actual del tema Página 9 Antecedentes ARH podría por tanto jugar un papel importante en la inducción de la expresión génica iniciada por la unión de apoE al r- LDL. Clínicamente, la HF se caracteriza por concentraciones muy elevadas de colesterol total y colesterol en LDL (c-LDL) presentes desde el nacimiento, que afecta al menos a la mitad de los miembros de una familia, tanto a varones como a mujeres. La exploración física puede mostrar depósitos de colesterol en los tendones (Xantomas) y en el ojo (Arco Corneal). Tiene un elevado riesgo de desarrollar enfermedad cardiovascular (ECV) prematura, especialmente coronaria. Se calcula que el 75% de los varones y el 50% de las mujeres con HF sin tratar, sufren un evento coronario antes de los 60 años. Por lo tanto, la HF acorta la esperanza de vida de 20 a 30 años respecto a la población general (5). Según los datos del Registro Español de HF, el 55% de los varones y el 22% de las mujeres con HF incluídos en el mismo, han desarrollado alguna manifestación de ECV antes de los 60 años (6) Diagnóstico de la HF La gran variabilidad interindividual de la HF hace que el diagnóstico basado en las concentraciones de colesterol total o c-LDL no permita realizar una identificación inequívoca de estos pacientes. Un estudio reciente ha demostrado que el error diagnóstico al utilizar las concentraciones de c-LDL es cercano al 30%, por lo que se sugiere que ante la sospecha clínica, hay que realizar un análisis genético (7). Los metodos de diagnóstico basados en el análisis del gen son los métodos recomendados por la OMS en el programa MedPed (Make Early Diagnosis to Prevent Early Deaths in MEDical PEDigrees) para la búsqueda de pacientes con HF (8). Sin embargo, estos métodos presentan también una serie de inconvenientes debido a : 1) la gran heterogeneidad de las mutaciones, ya que se conocen más de 700 distintas, y la mutación responsable de la HF en una determinada familia puede ser cualquiera de las descritas o alguna nueva autóctona de la zona, país o raza, y 2) el gran tamaño del gen (45 Kb), ya que la mutación puede estar localizada en cualquier sitio del mismo o ser cualquiera de los diferentes tipos. Gracias a los avances de la biología molecular hoy en día es posible abordar el diagnóstico de la HF mediante estas técnicas de polimorfismos de conformación de cadena sencilla (SSCP) o electroforesis en geles con gradiente desnaturalizante (DGGE) que permite detectar cambios pequeños en la secuencia del DNA, de hasta una base pero tienen el inconveniente que son muy laboriosas y difíciles de aplicar al diagnóstico rutinario. Por otra parte, estas técnica no permiten la detección de grandes deleciones o inserciones, determinación que requiere del uso de la técnica de Southern o la realización de PCR largas. Además las técnicas de SSCP o DGGE requieren de una secuenciación posterior para la caracterización de la mutación. En la actualidad se están desarrollando “biochips”, diseñados para detectar mutaciones de forma rápida y sencilla. Sin embargo, también para la fabricación de un “biochip” es necesario disponer de la información previa del número y características de las mutaciones que se quiere determinar así como de la tecnología y herramientas apropiadas. Hasta el momento no está disponible ningún biochip para el diagnóstico genético de la HF. Actualmente, el grupo proponente de este proyecto dispone desde 1999 de un Registro Español de HF (propiedad de la Fundación Hipercolesterolemia Familiar) en el cual participan hasta este momento 72 clínicas de lípidos del Sistema Nacional de Salud de todo el país. Este registro está aprobado y registrado en la Agencia Nacional de Protección de Datos Informáticos LORTAD (Nº de Registro: 1982050017). Hasta la fecha, se han recibido los datos clínicos y muestras biológicas de 2050 pacientes (un caso por familia) con diagnóstico clínico de HF y se ha procedido a la identificación de las mutaciones en el gen del r-LDL. En España, se han identificado 120 mutaciones distintas en el gen del r-LDL, una mutación en el gen de la apo B-100 (R3500Q) y otra Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Plan estratégico Página 10 de 97 Antecedentes en el gen de apo E que están asociadas con HAD (9). Factores que influyen sobre el curso de la HF y son responsables de la gran variabilidad en las manifestaciones clínicas. 1.- Variabilidad fenotipica de la HF debida a la mutación del r-LDL Numerosos estudios han demostrado que la concentración de c-LDL “per se” es un factor determinante para el fenotipo de la HF. Se han observado diferencias significativas en cuanto a expresión fenotípica y respuesta a tratamiento hipolipemiante entre los sujetos afectados de HF con diferente tipo de mutación en el r-LDL (10). Un hecho importante a la hora de explicar la variabilidad fenotipica de la HF asi como la respuesta individual al tratamiento con inhibidores de la HMGCoA reductasa en la HF es la actividad residual de la proteina mutada del r-LDL. La mutaciones en el gen del r-LDL que dan lugar a la HF pueden afectar de distinta forma a la actividad del receptor. Estas mutaciones que causan HF se subdividen en 5 clases principales en dependencia que afecten a la síntesis de la proteína (Clase 1), al transporte del receptor desde el retículo endoplásmico hasta el aparato de Golgi (Clase 2), a la unión de la partículas lipoprotéicas (Clase 3), a la formación de la vesícula endocítica (Clase 4), o al reciclado del receptor (Clase 5) (1). Por lo tanto, no es de extrañar que en dependencia del tipo de mutación heredada se produzca una expresión fenotípica y un grado de respuesta al tratamiento hipolipemiante diferentes, que dependerá del efecto del alelo no defectuoso y de la actividad residual del alelo defectuoso. Por otra parte, el riesgo de ECV varia de forma considerable entre los diferentes tipos de mutación, siendo los portadores de alelos nulos los que presentan un mayor riesgo cardiovascular que determinados tipos de mutación de cambio de aminoácido o en pauta de lectura que poseen una importante actividad residual (10). Para el control de la hipercolesterolemia se persigue la estimulación de la actividad del r-LDL. Habitualmente esto se consigue administrando estatinas, inhibidores de la hidroximetilglutaril coenzima A reductasa. Como respuesta a la reducción en la cantidad de colesterol en el retículo endoplásmico que ello produce, se activa SREBP, el cual estimula la transcripción de, entre otros, el gen del receptor de LDL (11). En ciertos pacientes, por razones aún desconocidas la respuesta a las estatinas no es suficientemente eficaz (10). El incremento de la dosis de estos fármacos para mejorar la respuesta puede comprometer la disponibilidad de mevalonato que, como precursor de ubiquinona, dolicol, farnesol y geranilgeraniol, además de colesterol, es esencial para múltiples funciones celulares. Por ello, es importante profundizar en el conocimiento de otras vías de estimulación del receptor de LDL. 2.-Variabilidad debida a otros factores genéticos Aparte del c-LDL, se piensa que otros aspectos del metabolismo lipídico pueden ejercer un impacto importante sobre el fenotipo de la HF. El nivel de colesterol tranportado por las LDL depende además de la funcionalidad de proteinas tales como la apo B100, proteinas de transporte implicadas en la absorción intestinal y en la excreción hepática de colesterol en la bilis (ABCG5/ABCG8) y de la ARH, proteína estabilizadora del receptor LDL. La caracterización de identificación de los mecanismos de regulación del colesterol plasmático serían de gran utilidad para el diagnóstico y manejo clínico de pacientes con HAD. La concentración de colesterol en la población general es el resultado de complejas interacciones entre el ambiente y múltiples genes, y es probable que lo mismo ocurra en los sujetos con HF, aunque con menor intensidad dado el efecto importante del locus del r-LDL. Sin embargo, en cuanto al riesgo de ECV es probable que dado el elevado riesgo que poseen estos pacientes debido a su elevado c-LDL, el efecto adicional de otros genes pueda ser mucho mas pronunciado que el observado en la población general (10). Entre estos genes candidatos estan los implicados en el Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Plan estratégico Página 11 de 97 Antecedentes metabolismo lipídico y energético ABPs (muscular, cardiaca, adipocítica e intestinal) CEPT, LCAT, MTP, Apolipoproteínas (AI-II, B, CI-IV, D, E), PON1 y PON2, PPARs (alfa y gamma), ABCs (A1, C6, G1, G5 y G8), UCPs. Por otra parte, el reciente progreso de la genómica funcional está permitiendo desentrañar las bases genéticas de enfermedades de etiología compleja. Este es muy probablemente el caso de la diferente expresión de la ECV en estos pacientes. Las técnicas genómicas de screening de amplio espectro, como son los microarrays de cDNA, pueden permitir la identificación de genes implicados en el riesgo, la susceptibilidad y la patogenia de la ECV. Así mismo, estos estudios proporcionan la posibilidad de conocer cómo se asocian determinados patrones de expresión génica con el grado de respuesta al tratamiento. Actualmente se está proponiendo la utilización de muestras de sangre, dada su accesibilidad, para los estudios sistemáticos de genética funcional en diversas enfermedades humanas, entre ellas la HF. Expresión diferencial de proteínas en Hipercolesterolemias genéticas. La hipercolesterolemia modifica profundamente la biología de la pared vascular, y provoca alteraciones significativas en los niveles séricos de diferentes moléculas. La evolución y manifestaciones clínicas de la aterosclerosis son muy variadas tanto en la población general como entre los pacientes con hipercolesterolemia familiar y/o hipercolesterolemia familiar combinada en particular que presentan hipercolesterolémia y/o hipertrigliceridémia. Actualmente es ya evidente que más allá del postulado un gen=una proteína, defectos que afectan a un solo gen pueden traducirse en alteraciones de múltiples proteínas. La proteómica como ciencia emergente aporta un abordaje especialmente interesante en patologías multigénicas, como las enfermedades vasculares, en las que se produce una compleja interacción entre factores genéticos y ambientales. Actualmente sólo se conoce un reducido número de proteínas del plasma que además no caracterizan suficientemente la fisiopatología de los procesos asociados a la enfermedad ni tienen valor predictivo sobre su evolución 3.- Factores ambientales que influyen sobre la variabilidad El profundo trastorno metabólico existente en estos pacientes hace que la hipercolesterolemia sea su factor de riesgo fundamental. Por ello el tratamiento farmacológico hipolipemiante es hoy el eje principal de su manejo. Sin embargo, datos del Registro Español muestran que factores nutricionales, como es el sobrepeso, pueden ser claves como predictores de un mayor riesgo. Por ello la alimentación saludable puede ser un elemento clave en su manejo. Existen dos hechos fundamentales en torno al efecto preventivo de la dieta: la gran variabilidad de la respuesta individual y un nuevo paradigma, el que los nutrientes ejercen múltiples efectos biológicos, que van más allá de su beneficio sobre el colesterol. El primer aspecto se enmarca dentro de la variabilidad dependiente de la interacción genéticoambiental en la expresión del colesterol plasmático, escasamente conocido en los pacientes con HF. Uno de los factores genéticos, sobre el que se está centrando el interés, es el de las variantes en los genes de los transportadores ABCG5 y ABCG8. Ambos se han implicado en la absorción de los esteroles de la dieta y en la regulación del transporte lipídico intracelular(12, 13). Con respecto a los efectos pleiotrópicos de los nutrientes, es importante conocer si estos pacientes se benefician de una dieta sana (tipo mediterránea), no sólo por su efecto sobre el colesterol sino por su potencial efecto sobre otras variables predictivas, relacionadas con la dieta. Entre ellas se incluyen, el tamaño de la LDL, la oxidación de lipoproteinas, el metabolismo postprandial de triglicéridos y factores hemostáticos. Se han propuesto distintos factores adicionales que condicionan el riesgo cardiovascular, entre ellos la homocisteína (14). Así, el exceso de homocisteína es un factor de riesgo cardiovascular independiente y tiene un efecto sinérgico con otros factores aterogénicos. La homocisteína favorece Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Plan estratégico Página 12 de 97 Antecedentes la lipoperoxidación y la trombosis e influye en los mecanismos que regulan la biosíntesis de colesterol. Las concentraciones homocisteína dependen de la ingesta de metionina, de la actividad de las enzimas que intervienen en su metabolismo y de las vitaminas que actúan como cofactores (ácido fólico, cobalamina y piridoxina). Se han identificado distintas variantes de los genes que codifican para estos enzimas relacionadas con concentraciones elevadas de homocisteína. Una de las más frecuentes es la mutación C677T del gen de la MTHFR, que se presenta con carácter homocigoto en un 13 % de la población general. HIPERLIPEMIA FAMILIAR COMBINADA (HFC) Características clínicas y bioquímicas La HFC es una enfermedad frecuente. Se calcula que la padece el 1-2% de la población y aunque no hay datos específicos sobre España, esto supondría en nuestro país entre 400.000 y 800.000 afectados. La HFC presenta una herencia compleja y practicamente desconocida y que confiere una gran riesgo aterotrombótico (alrededor de un 30% de pacientes con infarto agudo de miocardio la padecen) (15). El diagnóstico de la HFC también es complejo por cuanto el paciente puede presentar diversos fenotipos hiperlipémicos (IIa, IIB y IV) a lo largo del tiempo y se necesitan datos clínicos y bioquímicos no sólo del paciente sino de los familiares para establecer el diagnóstico (ya que uno de los criterios diagnósticos es la presencia en éstos de un fenotipo hiperlipémico diferente al del paciente). Aunque clasicamente se consideraba que la enfermedad no se manifiesta hasta los 20 años, hasta un 40% de los niños de estas familias presenta alteraciones lipídicas (16). Por otra parte, y también recientemente, diversos estudios han cuestionado la eficacia del uso de los criterios lipídicos clásicos (colesterol y triglicéridos) para distinguir entre afectos y no afectos en familias con HFC, ya que el error podría llegar a ser del 40% (15). Estos estudios han sugerido que se podría clasificar mejor a los sujetos afectos añadiendo a la determinación de triglicéridos, las de apoB y el tamaño de las partículas de LDL (15,17). El tratamiento de la HFC también presenta dificultades derivadas del riesgo de tratar a la vez con fibratos y estatinas la hipertrigliceridemia y la hipercolesterolemia (respectivamente) o de ir variando estos fármacos en función del fenotipo hiperlipémico que en ese momento presente el paciente. Fisiopatología La característica fisiopatológica fundamental de la HFC es la sobreproducción de VLDL (15). Esta parece ser consecuencia de una sobreproducción de apoB hepática como respuesta a una mayor llegadoa de ácidos grasos libres al hígado en ayunas (por falta de retención de los mismos a nivel de tejido adiposo) y/o en período postprandial (por defecto de captación de los mismos por el tejido adiposo) (18).Se han descrito como alteraciones frecuentes asocidas a la HFC el enlentecimiento del catabolismo de quilomicrones y la insulino-resistencia (19,20). Genética Los “scans” genómicos realizados en familias con la enfermedad de diferentes paises han dado resultados poco consistentes, con la excepción parcial de las señales que proceden del cromosoma 1q21-23 (21,22), en las cercanías de donde se encuentra el gen de la apolipoproteína A-II. Resulta especialmente relevante que el animal modificado genéticamente por sobreexpresar esta proteína presente las características propias de la HFC (23). En conjunto, estos estudios demuestran que esta enfermedad no es de herencia autosómica dominante, sino oligogénica. Es posible que los errores de diagnóstico bioquímico y clínico sean responsables en parte de los resultados modestos obtenidos en la búsqueda sistemática de los genes causantes de HFC. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Plan estratégico Página 13 de 97 Antecedentes Tratamiento de las Hiperlipemias Genéticas. El tratamiento modifica profundamente el fenotipo clínico de las hiperlipemias genéticas. La introducción de los inhibidores de la hidroxy metil glutaryl coenzimo A reductasa (estatinas) ha revolucionado el tratamiento de las hiperlipemias genéticas, especialmente de la HF. El impacto clínico de las estatinas fue confirmado en una cohorte de pacientes con HF. El riesgo relativo para la mortalidad coronaria disminuyó a partir de 1992, y fue especialmente manifiesto en el grupo de edad másjóven (de 20 a 59 años) (24).Además, el tratamiento con estatinas tiene otros efectos beneficiosos en la hipercolesterolemia familiar. Un estudio reciente ha demostrado un efecto beneficioso en el tratamiento con estatinas a largo plazo sobre la función endotelial de pacientes con HF (25). Estos hallazgos enfatizan la importancia del tratamiento con estatinas en los pacientes con hipercolesterolemia familiar. Sin embargo, la respuesta al tratamiento farmacológico no siempre es homogénea. Esto se puede deber en parte a las diferentes mutaciones en el gen del rLDL, explicándo la disminución de la eficacia en los portadores de mutaciones más severas. Por tanto, se necesitan estudios amplios en los que se analice el efecto del tratamiento en función del defecto genético tanto a nivel individual como familiar. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Plan estratégico Página 14 de 97 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Bibliografía más relevante 1.- Goldstein, J. L., H. H. Hobbs, and M. S. Brown. 2001.Familial hypercholesterolemia. In: The metabolic and molecular basis of inherited disease. C.R. Scriver, A.L. Beaudet, W.S. Sly, and D. Valle, editors. McGraw-Hill, New York. Vol. II, Chapter: 120: 2863-2913. Se trata de un capítulo publicado uno de los libros de mayor prestigio sobre enfermedades hereditarias que abarca desde la fisiopatologia, genética, diagnóstico y tratamiento de la HF publicado por tres autores que son probablemente los que tengan un mayor conocimiento de la HF, dos de ellos Goldstein y Brown, fueron galardonados con el premio Nobel por sus trabajos sobre la HF. 2.- Innerarity TL, Weisgraber KH, Arnold KS. Mahley RW, Krauss RM, Vega GL, Grundy SM. Familial defective apolipoprotein B-100: low density lipoproteins with abnormal receptor binding. Proc Natl Acad Sci USA 1987; 84: 6919-6923. Estos autores fueron los primeros en observar que determinado pacientes con hipercolesterolemias autosómicas dominantes tenian los r-LDL funcionales y que sus LDL tenían una capacidad disminuida de unión a lor r-LDL, lo cual era sugestivo de que exitía un defecto genetico no localizado en el locus del gen r-LDL 3.- Varret M, Rabès J.P, Saint-Jore B, Cenarro A, Marioni J.C, Civeira F, et al. A third major locus for autosomal hypercholesterolemia maps to 1p34.1-p32. Am J Hum Genet 1999; 64: 1378-1387 En este artículo del que son autores tres miembros del equipo investigador del presente proyecto demostramos que aparte de la HF cuyo defecto se encuentra localizado en el gen del r-LDL, cromosoma 19, y de la apo B defectuosa familiar (defecto en el gen de la apo B, cromosoma 2), hay otros loci genéticos que están implicados en la expresión de hipercolesterolemias de transmisión autosómicas dominantes, uno de ellos esta situado en cromosoma 1 región p34.1-p32 4.- Garcia CK, Wilund K, Arca M, Zuliani G, Fellin R, Maioli M, Calandra S,Bertolini S, Cossu F, Grishin N, Barnes R, Cohen JC, Hobbs HH. Autosomal recessive hypercholesterolemia caused by mutations in a putative LDL receptor adaptor protein. Science 2001;292: 1394-8. Mapeo del locus ARH y descripción de las principales mutaciones que generan hipercolesterolemia autosómica recesiva encontradas hasta la fecha. 5.- Familial Hypercholesterolemia (FH). Report of a World Health Organization Study Group. Human genetics Programme. Geneva, 1998. 6.- Alonso R, Castillo S, Civeira F, Puzo J, de la Cruz, Pocovi M, Mata M. Hipercolesterolemia familiar heterocigota en España. Estudio descriptivo de 819 Casos no relacionados. Med Clin (Barc) 2002; 118 :487-492 Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Bibliografía más relevante Página 15 Bibliografía más relevante Se trata de un articulo de publicado por miembros del Equipo Investigdor en donde se analizan las características clínicas de la HF en un amplio grupo de pacientes no relacionados correspondientes al Registro Español de HF. 7.- Umans-Eckenhausen MAW, Defesche JC, Sijbrands EJG, Scheerder RLJM, Kastelein JJP. Review of first 5 years of screening for familial hypercholesterolemia in the Netherlands. Lancet 2001; 357: 165-168 En este artículo los utores cuesionan en base de sus resultados el error (diagnóstico equivocado) que se comete utilizando como criterio de diagnóstico de HF la determinación de CT o c-LDL en plasma incluso en familias en las que previamente se sabe que hay un paciente con HF por diagnóstico genético. 8.- WHO. Human Genetics Program. Familial Hypercholesterolaemia, a global perspective. Ginebra: WHO 1999 Se trata de un informe auspiciado por la Organización Mundial de la Salud dosnde se analiza la problematica de la HF en su programa MedPed (Make Early Diagnosis-Prevent Early Deaths in MEDical PEDigrees) abordando temas tan diversos que abarcan desde el diagnóstico a la calidad de vida de los pacientes con HF 9.- Mata P, Alonso R, Castillo S, Pocovi M, MedPed and the Spanish Familial Hypercholesterolemia Foundation. Atherosclerosis 2002; Suppl 3: 9-11 En este artículo se presentan las caracteristicas de la Red de unidades de lípidos, de la forma de funcionamiento de Grupo Español del estudio dela HF y los tipos de mutaciones encontradas. 10.-Jansen ACM, van Wissen S, Defesche, JC, Kastelein JJP. Phenotypic variability in familial hypercholesterolemia: an update. Curr Opin Lipidol 2002;13:165-171 Se trata de un articulo de revisión publicado recientemente donde se analizan la variabilidad del fenotipo de la HF y los posibles factores que intervienen. 11.- Edwards PA, Tabor D, Kast HR, Venkateswaran A. Regulation of gene expression by SREBP and SCAP. Biochim Biophys Acta 2000; 1529: 103-113. Este artículo discute como se regula la expresión por las proteinas que se unen a loselementos de respuesta a esteroles entre ellos el del promotor del gen del r-LDL 12- Berge KE, Tian H, Graf GA, Yu L, Grishin NV, Schultz J et al. Accumulation of dietary cholestgerol in sitosterolemia caused by mutations in adjacent ABC transporters. Science 2000; 290: 1771-1775 13.- Allayee H, Bryan A, Lusis AJ. An absorbing study of cholesterol. Science 2000; 290:1709-11. Las dos referencias anteriores se corresponden al descubrimiento de los transportadores ABCG5 y Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Bibliografía más relevante Página 16 Bibliografía más relevante ABCG8 y su implicación en el transporte intestinal y hepático de esteroles. La segunda referencia es la editorial del citado articulo en la que se resalta la importancia de estos dos genes en la variabilidad del colesterol en la población y no solo en casos raros de sitosterolemia. 14.-Tonstad S, Refsum H, Ueland PM. Association between plasma total homocysteine and parental history of cardiovascular disease in children with familial hypercholesterolemia. Circulation 1997;96:1803-8 Los autores observan que los niños conHF que tienen mas elevada la homocisteina plasmatica proceden de familias con una mayor agregación de enfermedad coronaria. 15.- Veerkamp MJ, de Graaf J, Bredie SJH, Hendriks JCM, Demacker PNM, Stalenhoef AFH. Diagnosis of familial combined hyperlipidemia based on lipid phenotype expression in 32 families. Arteriosclerosis, Thrombosis and Vascular Biology 2002; 22: 274-282. Los autores demuestran que tras una reevaluación de 32 familias con HFC, tras cinco años de un primer estudio, la clasificación en afectos y no afectos es menos consistente de lo esperado y deseable. El 26% de los considerados afectos no lo serían según el segundo análisis, mientras que un 14% de no afectos en elprimero pasarían a serlo en el segundo. Si a los criterios lipídicos utilizados (colesterol y triglicéridos mayores del percentil 90) se les añade la concentración de apoB y el tamaño de partículas de LDL, la consistencia del diagnóstico HFC en el tiempo aumenta notablemente. 16.-Ribalta J, La Ville AE, Plana N, Masana L. Hiperlipemia familiar combinada: detección y caracterización del fenotipo hiperlipémico en niños y adolescentes. Medicina Clínica 1997; 109: 161-164. Trabajo de miembros del grupo investigador que demuestra que, en contra de la opinión generalizada previa, el 43% de los hijos de familias con HFC presentan hiperlipemia antes de los 20 años. 17.-Sniderman AD, Castro Cabezas M, Ribalta J, Carmena R, de Bruin TWA, de Graaf J, Erkelens DW, Humphries SE, Masana L, Real JT, Talmud P, Taskinen MR. A proposal to redefine familial combined hyperlipidemia. European Journal of Clinical Investigation 2002; 32: 71-73. Los autores reunidos en un simposium internacional sugieren la necesidad de redefinir la HFC como una enfermedad caracterizada fundamentalmente por el aumento de la concentración plasmática de triglicéridos y de apoB. 18.- Arner P. Is familial combined hyperlipidemia a genetic disorder of adipose tissue?. Current Opinion in Lipidology 1997; 8: 89-94 Propuesta de que el defecto fisiopatológico fundamental de la HFC se encuentra a nivel del tejido adiposo, bien por deficiencia de captación de ácidos grasos libres por los adipocitos durante el período postprandial, bien por su deficiente retención en ayunas. En cualquiera de los casos, se originaría un aumento del flujo de ácidos grasos libres al hígado, que incrementa la síntesis y secreción de VLDL por este órgano. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Bibliografía más relevante Página 17 Bibliografía más relevante 19.-Ascaso JF, Real JT, Merchante A, Rodrigo A, Carmena R. Lipoprotein phenotype and insulin resistance in familial combined hyperlipidemia. Metabolism 2000; 49: 1627-31. Demostración, por miembros del grupo investigador, que la insulino-resistencia acompaña a cualquiera de los tres fenotipos hiperlipémicos que puede presentar la HFC y que ello puede hacer aconsejable el tratamiento simultáneo de la misma con el de la hiperlipemia. 20.- Meijssen S, Castro Cabezas M, Twickler TB, Jansen H, Erkelens DW. In vivo evidence of defective postprandial and postabsortive free fatty acid metabolism in familial combined hyperlipidemia. Journal of Lipid Research 2000; 41: 1096-1102. Demostración de que existe un incremento notable de triglicéridos y ácidos grasos libres en el período postprandial de pacientes con HFC. Ello es una demostración de una de las hipótesis de Arner (ref. número 17) si bien el número de pacientes estudiado es pequeño. 21.- Pajukanta P, Nuotio I, Terwilliger JD, Porkka KVK, Ylialo K, Pihlajamäki J, Suolalainen AJ, et al. Linkage of familial combined hyperlipidemia to chromosome 1q21-q23. Nature Genetics 1998; 18: 369-372. Primera demostración en familias con HFC finlandesas (de una alta homogeneidad étnica y cultural) de que existe un locus en el cromosoma 1q21-q23 (cerca de donde se encuentra el gen de la apoA-II) que se asocia con la enfermedad. Pese a ello, resulta evidente de que el LOD score obtenido demuestra que la HFC no es, como se pensaba, autosómica dominante sino oligogénica. 22.-Myers RH, Borecki IB, Arnett DK, Hunt SC, Province MA, Djousse L, Leppert MF. Replication of linkage of familial combined hyperlipidemia to chormosome 1q with additional heterogenous effect of apolipoprotein A-I/C-III/A-IV locus. Arteriosclerosis Thrombosis and Vascular Biology 2000; 20: 2275-2280 Los resultados del estudio anterior se han reproducido en la mayoría de estudios efectuados en otros países como en USA (este estudio), China, Alemania y Reino Unido. 23.-Escolà-Gil JC, Julve J, Marzal-Casacuberta À, Ordóñez-Llanos J, González-Sastre F, BlancoVaca F. Expression of human apolipoprotein A-II in apolipoprotein E-deficient mice induces features of familial combined hyperlipidemia. Journal of Lipid Research 2000; 41: 1328-1338. Demostración de que los ratones transgénicos de apoA-II poseen todas las características Bioquímicas y fisiopatológicas para ser considerados un buen modelo animal de HFC. 24.- Mortality in treated heterozygous familial hypercholesterolemia: implications for clinical management. Scientific Steering Committee on behalf of teh Simon Broome Register Group. Atherosclerosis 1999; 142:105-112. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Bibliografía más relevante Página 18 Bibliografía más relevante 25.- Alonso R, Mata P, De Andrés R, et al. Sustained long-term improvement of arterial endothelial function in heterozygous familial hypercholesterolemia patients treated with simvastatin. Atherosclerosis 2001; 157:423-429. Por primera vez, el efecto de un tratamiento a largo plazo con estatinas es estudiado en pacientes con HF. No solo el efecto hipolipemiante explican el efecto beneficioso encontrado sobre la función endotelial. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Bibliografía más relevante Página 19 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Hipótesis Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Hipótesis Página 20 Hipótesis HIPERCOLESTEROLEMIA FAMILIAR. 1. Aunque la HF es un trastorno monogénico, la expresión fenotípica en términos de comienzo y severidad de la enfermedad aterosclérotica, varía considerablemente. El tipo de mutación puede explicar en parte la variabilidad en la expresión fenotípica de la HF. También, la presentación clínica de la HF difiere sustancialmente, incluso entre sujetos de la misma familia que comparten el mismo defecto genético. La influencia de factores ambientales como la dieta, el tabaco, el sobrepeso y el ejercicio físico pueden ser muy importantes en la expresión fenotípica de la HF. Otros factores genéticos y metabólicos emergentes pueden también afectar la expresión clínica de la HF. El tamaño de la partícula de LDL, los remanentes de lipoproteinas ricas en triglicéridos, los niveles de Lp(a), la proteína C reactiva , la homocisteína, y determinados polimorfismos de genes implicados en el metabolismo lipídico como lipoprotein lipasa, apolipoproteina E, proteína transferidora de ésteres de colesterol y la paraxonasa, son algunos de los factores propuestos para explicar el desarrollo de enfermedad cardiovascular en la HF. Sin embargo, el papel de muchos de estos factores necesita ser bien definido y para esto es preciso disponer de una población numerosa. Por otra parte, la detección de la aterosclerosis preclínica mediante la medición del engrosamiento carotídeo, junto con la caracterización de otros factores de riesgo clásicos y emergentes, pueden ayudar a predecir el riesgo cardiovacular de esta población tanto a nivel individual como familiar. Por tanto, la hipercolesterolemia familiar es un excelente modelo para los estudios futuros de interacciones complejas entre genes y entre genes y ambiente. 2. La caracterización genética y la utilización de las modernas técnicas de genómica y proteómica aplicadas a los pacientes con HF, pueden aportar avances significativos en el mejor conocimiento de la HF. El descubrimiento de las mutaciones en el gen del receptor LDL en España, va a permitir el desarrollo de un biochip para el diagnóstico rápido de la HF y ayudará a diseñar nuevas estrategias terapéuticas. El descubrimiento de otros genes implicados en la etiología de las hipercolesterolemias familiares, permitirá un mejor conocimiento del metabolismo lipídico y ayudará en el diseño de nuevas herramientas diagnósticas y en el diseño de nuevos tratamientos. La determinación cuantitativa de nuevas proteínas séricas en pacientes con HF con o sin presencia de enfermedad cardiovascular, permitirá identificar nuevos biomarcadores de riesgo cardiovascular, así como nuevas dianas terapéuticas. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Hipótesis Página 21 Hipótesis HIPERLIPEMIA FAMILIAR COMBINADA 3. Existen deficiencias importantes en el diagnóstico clínico y bioquímico de la Hiperlipemia Familiar Combinada y existen métodos asequibles para subsanar estas deficiencias. En concreto, al distinción de afectos y no afectos con HFC es mejorable incorporando las determinaciones de apolipoproteina B y el tamaño de las partículas de LDL. Los estudios genéticos a realizar también serán analizados comparando los dos criterios bioquímicos de identificación de afectos (el clásico y el que incorpora a la apolipoproteina B y el tamaño de LDL. 4. La aplicación de las modernas técnicas de la genómica y la proteómica aplicadas tanto a pacientes con HFC como a modelos animales de la enfermedad pueden aportar avances significativos en la investigación de la HFC. Una aproximación de gran interés es la determinación cuantitativa de la expresión global de genes (bien a RNAm o a proteínas) en tejido de pacientes o modelos animales, por cuanto puede servir de gran ayuda para definir los mecanisoms moleculares implicados en el desarrollo de la HFC y también para la búsqueda de genes causantes de HFC (al buscar por ejemplo, coincidencias entre genes de expresión suprimidas en tejidos – por ejempo el adiposo – y cuya localización cromosómica coincide con la que ha originado señales significativas en los scans cromosómicos realizados en familias con HFC). En particular se hiptetiza que existen genes/proteínas (como la apolipoproteina A-II, que se encuentra en el cromosoma 1q21-23) cuya variabilidad está involucrada en el origen y/o desarrollo de la enfermedad. 5. Es posible deteminar que pacientes con HFC tienen mayor riesgo cardiovascular y para ello es necesario caracterizar los factores de riesgo, losmecanismos por los que actuan y tratarlos siempre que sea posible. La ecografía carotídea constituye un medio para valorar el grado de progresión de la aterosclerosis, es posible y necesario valorar el resto de factores de riesgo cardiovascular (clásicos y emergentes, genéticos y ambientales) y tratarlos siempre que sea posible. Se restará especial atención a los factores que conducen a este aumento de riesgo coom la resistencia a la insulina, la hiperhomocisteinemia y el incremento del estrés oxidativo, y el efecto del tratamiento intensivo de estos factores de riesgo debería traducirse en una disminución de la placa carotídea valorable mediante ecografís. Se hipotetiza que puede predecirse la respuesta al tratamiento en términos de la aterosclerosis carotídea en función de la variación de la expresión de genes de macrófagos antes y después del tratamiento (Farmacogenética). Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Hipótesis Página 22 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Objetivos El Proyecto estudiará desde un punto de vista multidisciplinario e integrado las hiperlipemias genéticas en España en el marco de la estrategia prioritaria de prevención de las enfermedades cardiovasculares. El objetivo final es avanzar en el conocimientogenético, metabólico, manejo clínico y terapéutico, así como en la epidemiología de las hiperlipemias hereditarias en España, con el fin conseguir un mejor diagnóstico y tratamiento de estos pacientes. Los objetivos se presentan como específicos para la Hipercolesterolemia Familiar y para la Hiperlipemia Familiar Combinada. A.- HIPERCOLESTEROLEMIA FAMILIAR 1. Desarrollar un programa de seguimiento y evaluación periódica a largo plazo de familias con diagnóstico genético de Hipercolesterolemia Familiar heterocigota (HFh), y determinar la incidencia y recurrencia de enfermedad cardiovascular en España. Se utilizará y ampliará el Registro Español de HFh y la red de Unidades de Lípidos que colaboran con la Fundación Hipercolesterolemia Familiar. 1.a) En un subgrupo, se estudiará la presencia de aterosclerosis preclínica (grosor de la íntima carotidea) mediante métodos no invasivos, y se analizará su relación con el defecto genético, otros factores de riesgo aterogénicos y el efecto del tratamiento con fármacos hipolipemiantes. 1.b) Así mismo, en un subgrupo de pacientes, se evaluará la capacidad cognitiva y su relación con la enfermedad cardiovascular, la presencia de otros factores de riesgo y el efecto del tratamiento farmacológico. 1.c) Se desarrollarán ecuaciones predictivas de riesgo cardiovascular de acuerdo con la interacción entre genes y factores ambientales, tanto a nivel individual como familiar. 1.d) Se analizará la eficacia y los determinantes clínicos, bioquímicos y genéticos de la respuesta al tratamiento médico (dieta y fármacos), y en un subgrupo de pacientes con HFh se analizará la expresión de genes de monocitos/macrófagos antes y después del tratamiento con fármacos hipolipemiantes. 2. Conocer la interacción del tipo de mutación en el gen del receptor LDL con otros factores de riesgo aterogénicos (clásicos y emergentes) de origen metabólico y genético y su influencia en la expresión fenotípica de la HFh. 2.a) Estudiar el papel de una alimentación mediterránea en la expresión clínica de la HFh, y evaluar la relación entre el perfil de ácidos grasos en plasma y en lipoproteinas con el desarrollo de enfermedad cardiovascular. 2.b) En un subgrupo de pacientes con HFh, se analizará el metabolismo lipoproteico postprandial y su influencia sobre mecanismos trombogénicos. 2.c) En un subgrupo, se estudiará la interacción entre la ingesta de colesterol y las variantes genéticas en los transportadores de colesterol ABCG5 y ABCG8, y su influencia en las concentraciones de colesterol en plasma 2.d) Valorar el estado oxidativo y el papel predictivo de otros factores de riesgo emergentes como la proteína C reactiva, la homocisteína, y polimorfismos genéticos en el desarrollo de la Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Objetivos Página 23 Objetivos enfermedad cardiovascular en pacientes con HFh. 2.e) Estudiar la interacción entre la mutación en el gen del receptor LDL y otros genes en la expresión fenotípica de la HFh 3. Se identificarán nuevos loci asociados con hipercolesterolemia de transmisión autosómica dominante del Registro Español de HF, en aquellos sujetos en los cuales se ha descartado la existencia de mutaciones en el gen del receptor LDL y apo B 100. 4. Se caracterizarán funcionalmente las mutaciones del gen del receptor LDL, apo B 100 y de los nuevos loci identificados que se asocian a Hipercolesterolemia autosómica dominante 5. Identificar la presencia de biomarcadores y dianas terapéuticas a partir del análisis de los patrones proteicos séricos de pacientes con hiperlipemias genéticas. Asimismo, se analizará la expresión y/o contenido de las proteínas identificadas en lesiones ateroscleróticas de la pared vascular en distintos estadios evolutivos. 6. Desarrollo de microarrays de expresión de genes relevantes en el metabolismo lipídico, y estudio de la expresión diferencial de los mencionados genes en sangre y células mononucleares de pacientes con hiperlipemias genéticas. 7. Desarrollar y evaluar un programa educativo dirigido a pacientes afectos de HFh y a todos sus familiares, tanto afectos como no afectos. HIPERLIPEMIA FAMIILAR COMBINADA 1) Crear un registro de pacientes y familias con HFC en España utilizando la Red de Unidades de Lípidos que colaboran con la Fundación Hipercolesterolemia Familiar. Simultaneamente, se creará un banco de muestras de ADN y sueros. 2) Avanzar y validar los criterios diagnósticos de la HFC. Se comparará las determinaciones clásicas (colesterol, triglicéridos y perfil lipoproteico) y las recientemente propuestas (apoB, triglicéridos y fenotipo de LDL). 3) Determinar el riesgo cardiovascular de los pacientes con HFC, sus predictores y el efecto del tratamiento médico tanto a nivel ecográfico, bioquímico, genético (Farmacogenética) y clínico 3.a) En un subgrupo, se valorará la aterosclerosis preclínica (grosor de la íntima carotídea) y su relación con factores de riesgo clásicos y emergentes (homocisteína, proteína C reactiva, polimorfismos genéticos que confieren riesgo cardiovascular, como por ej. los relacionados con la insulino-resistencia y los sistemas antioxidantes). 3.b) se analizará la eficacia y los determinantes clínicos y bioquímicos de la respuesta al tratamiento médico (dieta, fármacos) y en un subgrupo de pacientes con HFC se analizará la expresión de genes de monocitos/macrófagos antes y después del tratamiento con fármacos hipolipemiantes. 4) Identificar genes y proteínas implicados en el desarrollo de HFC. 4.a) se estudiará la influencia de la variabilidad genética del cromosoma 1q21-q23, y más especificamentre la presente en el gen de la apoA-II y genes colidantes, en la presencia cualitativa de la enfremedad y en la expresión fenotípica de la HFC. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Objetivos Página 24 Objetivos 4.b) se estudiará la expresión de genes y proteínas en tejido adiposo de enfermos con HFC y se comparará con la de controles, al tiempo que se estudiará la expresión en hígado, músculo y grasa de genes y proteínas de un modelo animal de la enfermedad (ratón transgénico de apoA-II) Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Objetivos Página 25 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Metodología La metodología que proponemos para la consecución de los objetivos es la siguiente: 1.- Metodología para consecución del objetivo A.1: Programa de seguimiento y evaluación periódica de una cohorte de HF. I) A partir del Registro de la Fundación Hipercolesterolemia Familiar, RFHF ( propiedad de la Fundación Hipercolesterolemia Familiar, responsable Dr. Pedro Mata) ya existente de casos índice de pacientes con hipercolesterolemia familiar (HF) identificados y remitidos por Unidades de Lípidos de toda España (n= 72), se localizará y contactará con todos los familiares de primer grado vivos en el momento de iniciarse el programa (padres, hijos y hermanos) de aquellos con diagnóstico genético. Se calcula como media que el número de familiares de primer grado por caso índice es de 4-5, con lo que la cohorte estará constituida por unos 4.000-5.000 individuos. Todos los familiares de primer grado de cada caso índice identificados y localizados, serán invitados a una visita en la Unidad de Lípidos de su zona correspondiente, la cual incluirá una entrevista médica estructurada, un examen clínico estandarizado y una analítica del perfil lipídico para descartar o confirmar la presencia de hipercolesterolemia y evaluar su riesgo CV global. Con la estrategia de búsqueda de nuevos casos familiares aquí propuesta, y en base a experiencias previas, se estima que sería posible identificar alrededor de 2.000 nuevos casos de HF (50% de los familiares de primer grado de los casos índice). Por tanto, el nº final de expuestos (con HF) en la cohorte estaría constituida por unos 3.000 sujetos y el de no expuestos (sin HF) por unos 2.000. Dado que la tasa de complicaciones cardiovasculares en los sujetos expuestos (con HF) se estima que es 5 veces superior a la de la población general, el tamaño de esta cohorte se considera adecuado para proporcionar un número suficiente de eventos cardiovasculares mayores (ACVs e IAMs letales y no letales) para estimar con precisión tasas de incidencia y de riesgo en un máximo de 5 años. Igualmente dicha cohorte tendrá la potencia estadística suficiente para calcular las frecuencias de distribución de los principales genotipos a nivel individual y familiar, así como estimar su contribución a la ecuación de riesgo CV. II) Las muestras de sangre de los familiares de los casos índices serán enviadas por las distintas Unidades de Lípidos participantes al Laboratorio de Bioquímica, Biol Mol y Celular de la Universidad de Zaragoza, responsable Dr. M Pocoví (Laboratorio Centralizado de Recepción de Muestras, LCRM) para su fraccionamiento, alicuotado, obtención de ADN y distribución a los otros nodos de la Red. III) Una alicuota de suero y otra de plasma de cada individuo se enviarán desde el LCRM al Laboratorio Centralizado de Bioquímica del Hospital San Pablo de Barcelona(LCB), responsable Dr F. Blanco para las determinaciones bioquímicas (CT, TG, c-HDL, apoAI. Apo B, Lp(a), TSH,..) correspondientes. Todos los resultados serán remitidos al RFHF. IV) Los datos demográficos, de evaluación clínica y “outcomes” (desenlaces y eventos) serán Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 26 Metodología enviados desde las Unidades de Lípidos a la Fundación Hipercolesterolemia Familiar en Madrid, donde se establecerá una Oficina Central de Coordinación (OCC) del proyecto de la cohorte, responsable Dr P. Mata. Posteriormente, todos los datos (demográficos, clínicos, analíticos y genéticos) se incorporarán a la base central y única de datos. El cuaderno de recogida de datos se basará y se ajustará a las directrices del programa Internacional Med-Ped, lo que permitirá la comparación de los datos españoles con otros internacionales actualmente en marcha. V) En el examen inicial y periódicamente en los sucesivos, se hará especial hincapié en la información sobre la historia familiar de hipercolesterolemia (pedigree genético familiar), en las complicaciones cardiovasculares precoces individuales y familiares, en la evaluación exhaustiva de los FRCV clásicos (dislipemia, diabetes, hipertensión, tabaquismo, obesidad, etc.) y emergentes (serología frente a agentes infecciosos, marcadores y reactantes biológicos, niveles plasmáticos de antioxidantes, vitaminas, homocisteinemia, etc), en los hábitos y patrones nutricionales del individuo, en el estudio de “clusters” familiares y geográficos de los distintos genotipos de HF, en distintos parámetros de funcionalidad endotelial y de expresión molecular, así como en la evaluación objetiva de la afectación de los distintos territorios arteriales (coronarias, carótidas) mediante cuantificación objetiva de la extensión y severidad de las lesiones ateroscleróticas con técnicas no invasivas como la resonancia magnética y la ecografía arterial. VI) En todos los miembro de la familias cuyo caso índice ya tenga identificada la mutación del rLDL, la mutación se analizará con el biochip prototipo (si es una de las 20 que analiza el biochip). Si es una mutación conocida pero no analizable por el biochip prototipo, se analizarán mediante PCR y análisis de restriccón y/o heteroduplex (Mozas P y col. Hum Mutat 2000 15:483-4; Cenarro A y col.. Methods in Molecular Medicine. Molecular Biology of Vascular Disease. Humana Press 1999. Totowa NJ, USA . VII) En las familias en que no se conozca la mutación responsable de la HAD se analizará en el caso índice: - La mutación R3500Q en el gen de apoB y el análisis de su región de unión al receptor se determinará según Castillo S. et al. Clin Invest. Arteriosclerosis 1999,11:205. - El gen del r-LDL. Las mutaciones puntuales del r-LDL se identificarán: 1) Utilizando el biochip HF prototipo disponible(Med Plant Genetics). 2) De no identificarse la mutación con el biochip prototipo se analizará por PCR, SSCP, secuenciación y análisis de restricción según (Cenarro A et al Hum.Mutat 1998,11:413) y los grandes reordenamientos por PCR larga y análisis de restricción. VIII) Seguimiento y evaluación de la cohorte de HF El seguimiento clínico de los casos índices y familiares se plantea a largo plazo. La periodicidad de las visitas y exámenes médicos será en principio bianual y tras la aparición de cualquier evento o complicación CV. La citación y visitas de los participantes (casos índices y familiares) se realizarán en cada una de las 72 Unidades de Lípidos colaboradoras. Dichas unidades contarán con el apoyo de la OCC para el contacto con los participantes, recuerdo de citas y recopilación de información epidemiológica. Al mismo tiempo se pondrá en marcha un sistema de vigilancia epidemiológico activo para la indagación de eventos cardiovasculares (desarrollo de angor de reciente comienzo, IAM, ictus, revascularización de cualquier territorio arterial, hospitalizaciones y muerte de cualquier causa). La identificación y notificación de eventos cardiovasculares (IAM, Angina, Ictus y AIT) que se produzcan, se realizará a través de un sistema mixto de búsqueda activa (“en caliente”) y de notificación pasiva (“periódico, en frío”) siguiendo metodología MONICA-OMS. El estatus vital de los participantes (información sobre fallecimiento, fecha y causa) se obtendrá anualmente a través del INE. Para todo ello será necesario la colaboración estrecha y continuada entre la OCC y las unidades Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 27 Metodología participantes, así como el establecimiento de un comité independiente de confirmación de eventos de acuerdo a los criterios OMS-MONICA internacionalmente aceptados. El programa permitirá calcular los riesgos relativos para diferentes eventos cardiovasculares a lo largo de los años según la presencia o ausencia de HF, el genotipo de la misma y la concomitancia otros factores que pueden afectar la expresión de la HF (comorbilidad, presencia de otros Factores de Riesgo Cardiovascular (FRCV) asociados o penetrancia familiar de la mutación. Además del riesgo de desarrollo de eventos clínicos, este diseño hará posible evaluar mediante métodos objetivos el grado de afectación y extensión de lesiones ateroscleróticas del árbol arterial (afectación subclínica arteriosclerótica), así como la respuesta a distintas intervenciones farmacológicas, particularmente de los distintos agentes hipolipemiantes. 2 Metodología para la consecución del objetivo A 1.a Estudio transversal de factores de riesgo cardiovascular y aterosclerosis preclínica en pacientes con HF, seguido de estudio prospectivo de la evolución de la aterosclerosis preclínica en función de la eficacia del tratamiento hipocolesterolemiante. I) Se seleccionaran 300 pacientes con HF y 100 voluntarios sanos de ambos sexos sin hipercolesterolemia. Tanto los pacientes como los voluntarios sanos procederán de varios nodos de la red. El entrenamiento para una metodología común en ecografía arterial, y la lectura se centralizará en el nodo a cargo del Dr. E. Ros. II) En situación basal se obtendrá muestras de sangre periférica y se remitirá al LCRM para determinación de esteroles vegetales y precursores de la síntesis de colesterol (medida indirecta de absorción intestinal y síntesis hepática de colesterol) para genotipo apo E, polimorfismos de genes ABCG5 y ABCG8 y estudio de mutaciones del gen r-LDL y Apo B 3500 Tras al menos dos determinaciones lipídicas con el tratamiento con estatinas a la dosis máxima prescrita y habiendo comprobado con los datos recibidos desde el RFHF la estabilidad de la respuesta del cLDL, se obtendrá plasma de nuevo que se remitirá de nuevo al LCRM para la determinación de esteroles vegetales y precursores de la síntesis de colesterol. En situación basal y anualmente tras instituir tratamiento hipolipidemiante con el intento de conseguir los objetivos de cLDL según riesgo individual, se obtendrán: - Datos antropométricos y presión arterial. Historia de tabaquismo. Encuesta dietética. Perfil lipídico, incluyendo Lp(a) y apos AI y B, Ac anti ox-LDL, RLP-C, homocisteína, ácido fólico, vitamina B12 y PCR-hs. Los datos clínicos y demográficos serán enviados de la base de datos central. - Ecografía de carótidas y femorales, junto con medidas y estructura del tendón de Aquiles. Estudio morfológico por imagen de la pared arterial de las carótidas: El estudio morfológico se realizará en el territorio carotídeo (carótida primitiva, bifurcación carotídea y carótida interna en su porción proximal, 1-2 cm. distal a la bifurcación) de ambos lados, según método publicado (Med Clin 1995;105:761-767). Posteriormente se realizará el examen con doppler color (alta energía/direccional) ajustando los parámetros técnicos (ganancia, rango de velocidades) según las velocidades existentes en el vaso. Se evaluarán los siguientes parámetros: Diámetro de la carótida primitiva, Grosor del complejo íntima-media (CIM) en la carótida primitiva, Placas de ateroma, Grado de estenosis vascular, En las secciones transversales y en las secciones longitudinales. 3. Metodología para la consecución del objetivo A 1.b Ensayo clínico longitudinal y prospectivo en un subgrupo de pacientes, para evaluar la relación entre el Deterioro Cognitivo Leve (DCL) y la HF con el tratamiento de un inhibidor de la HMG Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 28 Metodología CoA reductasa. Los pacientes se dividirán en dos grupos: - Prevención Primaria (pacientes que no han tenido ningún evento vascular pero presentan un factor de riesgo y niveles de LDL = ó <160-130). - Prevención Secundaria (Pacientes que ya han presentado un evento vascular y presentan 2 o más factores de riesgo y niveles de LDL < 100). Estos pacientes recibirán tratamiento farmacológico necesario para conseguir objetivo en cLDL. Todos los pacientes deberán acudir a 6 visitas durante un periodo de 1 año (visita basal, al mes, a los 2 meses, a los 3 meses, a los 6 meses y a los 12 meses de la visita basal). Para detectar una diferencia mínima de 3 puntos en el cuestionario Mini-Mental, con 11 desviaciones estándar, un nivel de significación de 0,05 y un poder estadístico de 0,80, se requiere una muestra de 107 pacientes, suponiendo un 10% de pérdidas de seguimiento o pacientes no válidos se deberían evaluar 118 pacientes que cumplan con los siguientes criterios de selección: Criterios de inclusión: - Hombres y mujeres con edades superiores a 50 años - cLDL comprendida entre 130 - 300. - Nivel de triglicéridos inferior ó igual a 600 mg/ml. - Obtener una puntuación mayor o igual a 24 en el MMSE (Mini Mental State Examination). - Obtener una puntuación en el GDS (Global Deterioration Scale) menor o igual a 3. - Que de su consentimiento escrito. - Presencia de Deterioro Cognitivo Leve. Criterios de exclusión: Los habituales para este modelo de estudio. Se excluyen por causas médicas, por presencia de variables concomitantes y por causas psiquiátricas. Valoración neuropsicológica: La aplicación de las pruebas cognitivas las realizará un neuropsicólogo especialista en envejecimiento previo entrenamiento. Las pruebas se centralizaran en centros especializados de la Red. Pruebas neuropsicológicas: MMSE (Mini mental State Examination) BNT (Boston Naming Test) GDS (Global Deterioration Scale) RAVLT (Rey Auditory Verbal Learning Test) 7 Minute Neurocognitive Screening Battery Verbal Paired Associated (Wechsler Memory Scale) Logical Memory (Wechsler Memory Scale) Set Test TMT (Trail Making Test): Parte B 4.- Metodología para la consecución del objetivo A 1.c Dado que la tasa de complicaciones cardiovasculares en los sujetos expuestos (con HF) se estima que es 5 veces superior a la de la población general, el tamaño de esta cohorte se considera adecuado para proporcionar un número suficiente de eventos cardiovasculares mayores (ACVs e IAMs letales y no letales) para estimar con precisión tasas de incidencia y de riesgo a partir de los datos del RFHF (Responsable Dr. Pedro Mata). Igualmente dicha cohorte tendrá la potencia estadística suficiente para calcular las frecuencias de distribución de los principales genotipos a nivel individual y familiar, así como estimar su contribución a la ecuación de predicción del riesgo CV. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 29 Metodología 5.- Metodología para la consecución del objetivo A 1.d I)Analizaremos por cromatografía de gases la concentración plasmática de esteroles vegetales (sitosterol, campesterol, avenasterol) y colestanol según (Meittinen y col Arterioscl Thromb Vasc Biol. 2000, 20:1340) en un subgrupo de pacientes hiporrespondedores (n= 50) e hiperrespondedores (n=50) al tratamiento hipolipemiante con estatinas . Ambos subgrupos serán seleccionados del estudio de la cohorte (apartado A-1) II) Determinaremos en plasma la concentración de precursores de la síntesis de colesterol incluidos escualeno, colestenol, desmosterol y latosterol por cromatografía de gases (Meittinen y col Arterioscl Thromb Vasc Biol. 2000, 20:1340) en el mismo subgrupo de pacientes descritos en el apartado anterior. III) Analizaremos estadísticamente los resultados de para conocer si existen determinados subgrupos de pacientes con HF cuya respuesta hipolimemiante dependa de mecanismos de hiperabsorción intestinal o sobreproducción hepática de colesterol. IV) Se determinará la modificación de la expresión génica en cultivos de células monocíticas/macrófagos tras la adición de LDL oxidadas y fármacos hipolip emiantes, estatinas y fibratos, en forma aislada o en combinación. En una primera fase se utilizarán células THP-1 de origen humano, realizándose las incubaciones con fármaco de forma simultánea o en combinación a la adición de LDL oxid adas. Se utilizarán arrays, de expresión. U133 Affymetrix. Aquellos genes cuya expresión se modifique de forma significativa, se verificaran mediante técnicas de RTPCR o northern. En una segunda fase, se realizarán estudios similares en monocitos/macrófagos aislados de 25 pacientes con HF seleccionados del RFHF, obteniéndose las muestras antes del inicio del tratamiento farmacológico y al cabo de seis semanas del mismo. Paralelamente, para cada diseño experimental, se comprobará la carga celular de colesterol libre y esterificado mediante cromatografía de gases V) Se comparará el patrón de expresión y actividad de las distintas isoformas de PPAR y SREBP y de genes diana de los mismos en muestras hepáticas, musculares y de tejido adiposo de ratones control wild type y ratones transgénicos para la apo AII humana, en dos condiciones dietéticas: dieta control, de mantenimiento, y dieta aterogénica tipo western o cafetería. Se utilizarán técnicas clásicas de RT-PCR, western blots, y ensayos de retardación y superretardación electroforética. Igualmente, se determinará el perfil lipídico plasmático completo de los animales en estudio por las técnicas habituales, así como la actividad de síntesis hepática de ácidos grasos y esteroles mediante marcadores radioactivos. 6.- Metodología para la consecución del objetivos A 2.a , 2b y 2c I) Diseño del estudio de intervención dietética. Se trata de un estudio transversal. La población inicial consistirá en 100 pacientes con HF heterocigota, pertenecientes al RFHF con una edad comprendida entre 18 y 75 años y sin padecer otras enfermedades que afecten al metabolismo lipoproteico. Se seleccionaran por tener todos una mutación de similar significado funcional a partir del RFHF II) Estudio de la interacción entre ingesta de colesterol y la presencia de distintas variantes genéticas en los transportadores ABCG5 y ABCG8, como determinante de los niveles de LDL colesterol, en pacientes con HF y con una mutación de similar efecto funcional. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 30 Metodología Si los pacientes seleccionados se dividirán en dos grupos, según exista o no la mutación en el transportador ABCG5 y en todos ellos se hará un estudio de su modelo de alimentación con un cuestionario dietético semicuantitativo.. En todos se harán uso de los niveles de colesterol LDL y se analizarán las siguientes variables del estudio. -Determinación de los polimorfismos Q604E y Y54C en los genes de los transportador ABCG5 y ABCG8 respectivamente. Se realizaran mediante PCR y análisis de restricción -Determinación del tamaño de las LDL por electroforesis en geles de poliacrilamida. Los geles serán escaneados y analizados mediante el programa Scion Image para Windows (Scion Corporation, USA). Los tamaños de las LDL de los sujetos serán determinados interpolando la migración de las LDL en una curva de regresión, tamaño de los patrones (nm) vs migración. Resistencia a la oxidación “in vitro” de las LDL. Se determinará en las LDL aisladas de cada uno de los sujetos sometidos a intervención dietética al final de cada uno de los periodos de dieta según el método de Esterbauer. Determinación de los anticuerpos anti-LDL oxidada. Se determinará mediante ELISA. Determinación de la homocisteína plasmática mediante HPLC en fase inversa y detección de fluorescencia de los derivados SBDF. Determinación del cociente fibrinolítico de plasma (tPA/PAI-1): el tPA se determinará por ELISA con un kit comercial y el PAI-1 por ensayos inmunoenzimáticos. III) Diseño experimental e intervención dietética postprandial en un subgrupo de 40 pacientes con HF: - Durante los 7 días previos a la curva postprandial, los participantes serán informados para seguir una alimentación donde la fuente grasa principal deberá ser aceite de oliva virgen extra; la cena del día anterior a la experiencia será sin grasas. No podrán consumir alcohol durante los 3 días anteriores al estudio. - Tras 12 h de ayuno, se administrará un desayuno consistente en una rebanada de pan y aproximadamente 80 g de aceite de oliva virgen. - Antes (tiempo cero) y cada hora durante 8 h tras el desayuno se tomarán muestras de sangre venosa. Se utilizará un aceite de oliva virgen cuya composición en ácido olecico sea igual o superior al 80% y cuyo contenido de componentes “minoritarios” el mayor del mercado. Aislamiento y caracterización de las TRL remanentes postprandiales: Tras la obtención del suero las TRL remanentes postprandiales se separarán mediante inmunoafinidad, utilizando anticuerpos monoclonales humanos anti-Apo AI y anti-Apo B100. En estas lipoproteínas se determinará la composición lipídica y proteica. Determinaciones analíticas en suero/plasma antes y durante el metabolismo postprandial: Composición en ácidos grasos de los ésteres de colesterol en plasma. Lípidos y lipoproteínas: separación mediante ultracentrifugación de las fracciones y determinación de colesterol y triglicéridos por métodos enzimáticos. PAI-1 y t-PA, Factor Tisular y moléculas de adhesión de monocitos mediante inmunoensayo. 7.- Metodología para la consecución del objetivo A 2.d Se estudiará en un subgrupo de pacientes con diagnóstico de certeza de HF incluidos en el estudio de la cohorte de HF. Todos estos pacientes pertenecerán al grupo de pacientes con HF que se les ha hecho el estudio de aterosclerosis preclínica (apartado A1.a) y se dispondrá de todas sus variables clínicas, factores de riesgo cardiovascular convencionales y de las variables de enfermedad cardiovascular, así como de las determinaciones bioquímicas de rutina incluidas en la analítica general del RFHF. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 31 Metodología .- Se efectuará la determinación de la concentración de homocisteína mediante HPLC en fase inversa y detección de fluorescencia de los derivados SBDF , Las concentraciones de vitamin B12 y folato se determinarán mediante radioensayo (Simultrac, Becton Dickinson and Co.) y las de piridoxal fosfato mediante HPLC y detección de fluorescencia (Chromsystem kit). Determinación de las concentraciones de tocoferol, ubiquinol y ubiquinona mediante HPLC con detección electroquímica y de malondialdehido con detección ultravioleta. .- Además, se estudiarán los polimorfismos genéticos a partir de las muestras de DNA del LCRM El DNA se amplificará mediante PCR y se analizará mediante digestión con el correspondiente enzima de restricción y electroforesis. Se estudiarán las variantes relativamente comunes de los genes CBS: 699 C->T, 844ins68 y 1080 C->T (Krauss et al., Genomics 52: 312-324, 1998), MTHFR: 677 C->T (Frost et al., Nat Genet 1995;10:111-3) y 1298 C->A (van der Put et al Am J Hum Genet, 62: 1044-51, 1998), MS: 2756 A->G (Brody et al. Mol Genet Metab, 67: 324-333, 1999), MSR: 66 A->G (Wilson et al., Mol Genet Metab, 67: 317-323, 1999) y GCPII: H475Y (Devlin et al. Hum Mol Genet, 9: 2837-44, 2000), asociadas a la hiperhomocisteinemia y al riesgo cardiovascular. Estudio de los polimorfismos genéticos a partir de las muestras de DNA del LCRM . El DNA se amplificará mediante primers según el método de Frosst et al (Frost P, et al. Nat Genet 1995;10:111-3). Se emplearán enzima de restrición específicos para el estudio de las mutaciones de los distintos genes y los productos resultantes se analizarán mediante electroforesis en gel de poliacrilamida. Se realizará un análisis estadístico descriptivo sobre las concentraciones de homocisteína, vitaminas y de la prevalencia de los polimorfismos de los genes relacionados en la población del estudio. Se analizará la relación entre las concentraciones de homocisteína y vitaminas, y de los polimorfismos genéticos con la presencia de enfermedad cardiovascular clínica y subclínica con carácter transversal y prospectivo. 8 Metodología para la consecución del objetivo A.2.e Se estudiaran los pacientes pertenecientes al RFHF haciendo uso de los datos clínicos de dicho registro , del material genético . Se realizaran nuevos estudios de tolerancia a glucosa y resistencia a insulina en aquellos individuos que se estudien a lo largo del estudio. Tipo de estudio: estudio transversal. Parámetros bioquímicos: En situación de 12-14horas de ayuno, se determinará por métodos estandarizados los ácidos grasos libres, la glucosa e insulina basal (definición de RI por HOMA IR). Parámetros genéticos: Se analizaran los siguientes polimorfismos: -Angiotensinogeno: C-532T y A-6G -Renina: BglI (intrón 1) -Proteína de Unión a la Renina: T61C. -Enzima conversor de la angiotensina (ACE): I/D y A-240T -Receptor 1 de la angiotensina II (AT1): C-521T, C573T y A1166C -Receptor 2 de la angiotensina II (AT2): A-1332G y G+1675A - UCP1: A-3826G y Met229Leu - UCP2: Ala55Val y polimorfismo de Inserción/deleción. - UCP3: C-55T - PON1: C(-107)T, Leu55Met y Gln192Arg - PPAR alfa: Leu162Val - PPAR gamma: Pro12Ala y Pro115Gln - R1268Q en ABCC6, G2457A en ABCG1, D19H y 400K en ABCG8. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 32 Metodología - Ala54-Thr en FABP intestinal, Se buscarán y caracterizarán polimorfismos en los genes ABCG5, ABCC6, ABCA1, FABP cardiaca, hepatica y adipocitica. La detección se realizará mediante secuenciación directa de regiones “interesantes” de cada uno de los genes (promotor y exones, incluyendo regiones intronicas contiguas, en un grupo de 10 individuos de cada patología), dando prioridad a aquellas zonas donde haya polimorfismos posibles en las bases de datos públicas. Se seleccionaran para su estudio aquellos que se localicen en el promotor, supongan un cambio de aminoácido o esten muy próximos a las regiones consenso de “splicing” Los polimorfismos se analizaran mediante el sistema de multiplex por PCR y detección de los polimorfismos mediante ASO PCR o LDR aplicado a SNPs e inserciones y deleciones, para su estudio en un secuenciador automático 9.- Metodología para la consecución del objetivo A 3 I)En las familias del RFHF en que no se identifique la mutación ni en el gen de apo B ni en el gen del r-LDL se realizará un análisis de ligamiento “linkage analysis” a través de los polimorfismos del gen del r-LDL polimorfismos : SfaNI en exon 2, TaqI en intron 4, StuI en exon 8, Hinc II en exon 12, AvaII en exon 13, MspI en exon 15, y NcoI in exon 18 según (Mozas P y col. Hum Mutat 2000 15:483-4) . Gen de apo E (polimorfismos del promotor ) región codificante (genotipos de apoE) y de la intergénica entre apo E y apoCI . Gen de apo B con los polimorfismos XbaI, MspI, EcoRI y 3HVR según (Castillo et al Atherosclerosis 2002) II) En aquellos casos en que se observe segregación con alguno de los genes se procederá: a) Secuenciación de todo el gen del r-LDL(promotor , exones y nexos exón-intrón), región de unión al r-LDL del gen de apo B y todo el gen de apo E según resultados de análisis de segregación. B) En el caso de no identificarse la mutación se realizará el estudio de RNAm del r-LDL, procedente de los linfocitos de los pacientes por si fuera consecuencia de una mutación que hubiese creado un sitio de críptico de ayuste, para ellos se obtendrá el cDNA y se clonara en se secuenciará. III) En un total 50 casos índice de HAD cuyo defecto genético no esté asociado a loci conocidos Determinaremos en plasma la concentración de esteroles vegetales (sitosterol, campesterol, avenasterol) y colestanol así como la concentración precursores de la síntesis de colesterol incluidos escualeno, colestenol, desmosterol y latosterol por cromatografía de gases (Meittinen y col Arterioscl Thromb Vasc Biol. 2000, 20:1340) con objeto de ver si su hipercolesterolemia se debe a mecanismos de hiperabsorción intestinal o síntesis hepática de colesterol . IV) Caso de no observarse segregación con r-LDL, apoB , apo E y no estén implicados deficiencias en los mecanismos de absorción y síntesis hepática de colesterol) se realizará un estudio de la funcionalidad del r-DL y de capacidad de unión de partículas LDL de este tipo de pacientes (ver apartado10) V). Identificación de nuevos genes. La identificación de nuevos genes causantes de la HAD se llevará a cabo analizando los perfiles de SNPs en los pacientes de HAD y sus familiares. La herramienta empleada para el análisis de los SNPs da cada una de las muestras será la amplificación por PCR de cada una de las regiones genómicas en las que se localice el SNP, su marcado con un fluoróforo y su detección posterior en un DNA-chip (Affymetrix Genechip) donde están representadas todas las sondas que identifican cada uno de los alelos de cada SNP. De este modo, en un único experimento, se puede determinar el perfil genético de un individuo. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 33 Metodología Alternativamente, aquellos SNPs que no aparezcan representados en el DNA-chip y que se deseen analizar debido a que se describan con posterioridad al diseño del DNA-chip, se pueden procesar empleando la herramienta de Pyrosequencing. En este caso se secuencian unos pocos nucleótidos que comprenden el SNP empleando una unidad robótica que puede procesar hasta 20.000-25.000 SNPs en 24 horas. Al incorporar cada deoxinucleótido la polimerasa que extiende la hebra genera pirofosfato. Este pirofofosfato es transformado en ATP, que en presencia de luciferasa emite luz. De este modo es posible averiguar qué nucleotido se incorpora y, por tanto, el alelo de cada SNP 10.- Metodología para la consecución del objetivo A 4 I ) En el RFHF hay en este momento de 23 mutciones del r-LDL, todavía sin caracterizar. Para llevar a cabo esta caracterización se clonarán los genes mutantes en un vector de expresión bajo el control del promotor de citomegalovirus (CMV) y las construcciones se utlizarán para transfectar células ldlA7 (una línea celular derivada de CHO que carece de LDLr). Los transfectantes estables se utilizarán en estudios de tipo funcional ( apartado 10.II) Por otra parte el grupo que propone este proyecto ha descrito una mutacion en el gen de apoE (delta149L) asociada con HAD. Los mutantes de esta apo E se expresarán en un sistema de expresión en Drosophila consistente en cultivos de la línea celular SL-2, que ya hemos utilizado en estudios previos (Mozas y cols 2002). Los cDNAs correspondientes a las apoE mutantes se clonarán en el vector pAc5/V5-His y los plásmidos se transfectarán a cultivos de células SL-2 utilizando el plásmido pCoHygro para seleccionar con higromicina. Las proteínas expresadas se purificarán en columnas de afinidad utlizando las colas de histidinas y se realizarán los estudios funcionales. (apartado 10.b) II) Caracterización funcional de proteínas mutantes causantes de HAD. Actividad funcional de las formas mutantes del receptor de LDL. - Se estudiará la actividad del receptor de LDL en linfocitos de pacientes portadores de mutaciones de cambio de aminoácido o en pauta de lectura no caracterizadas previamente en dicho receptor. Se obtendrán las células mononucleadas de la sangre de los pacientes para el estudio de la unión y captación de DiI-LDL en células viables y la expresión del receptor en la membrana mediante citometría de flujo, así como la proliferación en respuesta a LDL mediante incorporación de [3 H]timidina. Asimismo, se caracterizará funcionalmente la actividad del receptor de LDL en células CHO-ldl A (deficientes de receptor de LDL) transfectadas con el gen para el receptor mutantes - Distribución subcelular de las formas mutantes del receptor de LDL. Se estudiará mediante la utilización de anticuerpos específicos y microscopía confocal, y se comparará con la distribución subcelular de DiI-LDL mediante el mismo método descrito en el apartado anterior . III) Caracterización funcional de las formas mutantes de la apo E y la apo B-100. Se determinarán la unión y captación de las lipoproteínas portadoras de formas mutantes de la apo E o la apo B-100 por células HL-60. Se realizará una caracterización lipídica y apolipoproteica de los plasmas correspondientes, que incluirá el perfil (FPLC) y la composición de las lipoproteínas y las concentraciones de distintos esteroles precursores del colesterol y de fitosteroles (HPLC y cromatografía de gases). Las formas recombinantes de los mutantes de apo E (producidas en10 b) que se consideren más interesantes se incorporarán a liposomas para proceder a los antedichos estudios funcionales. IV) Estimulación de la actividad del receptor de LDL mediante la manipulación de la homeostasis intracelular del colesterol. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 34 Metodología Se estudiarán los efectos de la inhibición del tráfico intracelular de colesterol con agentes como tamoxifeno y fitoestrógenos, y de la activación de los factores de transcripción LXR y PPAR amma, con oxiesteroles y glitazonas respectivamente, en combinación o no con lovastatina, sobre la actividad del receptor de LDL y su expresión en membrana y la del mRNA (Northern blot) en líneas celulares con diferentes demandas de colesterol (promielocitos HL-60, monocitos THP-1, macrófagos J774, etc.). Se determinarán distintos parámetros de homeostasis intracelular de colesterol, como contenido en esteroles, colesterogénesis, etc. Las células control y tratadas se utilizan en el apartado 12 para determinar la expresión diferencial de distintos genes mediante microarrays de espresión. V) Estudio en células de individuos heterozigotos para la hipercolesterolemia familiar. En función de los resultados obtenidos en el apartado anterior, se abordará el estudio de los efectos de aquellos agentes y sus combinaciones en linfocitos de pacientes heterozigotos para la hipercolesterolemia familiar, portadores de distintas mutaciones en uno de los alelos para el receptor de las LDL. VI) La purificación de la proteína ARH se llevará a cabo utilizando dos estrategias de expresión alternativas. En primer lugar se intentará la expresión en vectores bacterianos pET29c y posterior purificación en columnas de afinidad. Además se llevará a cabo la expresión en cultivos de SL-2 utilizando al misma metodología descrita para el objetivo 3. Una vez optimizados los procesos de expresión, uno de nosotros se se finalizará la purificación y se comenzarán los estudios estructurales en colaboración con el Dr.Javier Sancho del Depart Bioquim, Biol Mol y Cel , Zaragoza. 11. Metodología para la consecución del objetivo A 5 Identificacion de biomarcadores y dianas terapèuticas a partir de los analisis de los patrones protéicos de pacientes con HF I) 2-DE : Los sueros serán pretratados para eliminar los lípidos y proteínas mayoritarias como la albumina mediante columnas de afinidad. Alícuotas de dichos sueros (≅200 mg de proteína) se desnaturalizarán y se someterán a isoelectroenfoque utilizando geles comerciales con gradientes inmovilizados de pH (Immobiline DryStrip gel, Amersham) en cubetas especiales (IPGphor IEF System, Amersham). Posteriormente la electroforesis en segunda dimensión se realizará en geles de poliacrilamida comerciales utilizando un sistema de electroforesis vertical (Ettan DALT II System, Amersham). De acuerdo con los patrones obtenidos se seleccionará los rangos de pH así como los tiempos del isoelectroenfoque y los porcentajes de acrilamida necesarios para optimizar la separación de las proteínas diferenciales (Hanash SM. Electrophoresis 2000;21:102-109). Para visualizar las proteínas los geles serán teñidos con un colorante fluorescente (SYPRO Ruby, Molecular Probes). Este sistema permite resolver prácticamente el espectro completo de proteínas básicas y ácidas con fines analíticos o preparativosLos geles serán escaneados a diferentes resoluciones con un densitómetro. Las imágenes digitalizadas serán analizadas (ImageMaster 2D, Amersham) para detectar y cuantificar los proteínas diferenciales presentes en los sueros. El análisis de mapas de referencia permitirá determinar diferencias cualitativas y cuantitativas en los perfiles proteícos y la identificación de proteínas expresadas diferencialmente. Aquellas proteínas de interés serán escindidas de los geles, digeridas y analizadas mediante espectrometría de masas (MS). Eventualmente, cuando sea necesario para identificar las proteínas, tambien se realizará microsecuenciación. La identificación se llevará a cabo en el Servicio de Proteómica y Bioinformática del instituto de Biotecnología y Biomedicina de la Universidad Autónoma de Barcelona, que dispone de los equipos necesarios para ello. La MS es la técnica de lección para obtener la “huella digital” de las proteínas separadas mediante 2-DE por su gran Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 35 Metodología capacidad de análisis y porque detecta modificaciones post-traducionales como la fosforilación o la glicosilación, que in vivo pueden tener importantes consecuencias fisiopatológicas. II) Análisis de bancos de datos: Se establecerá la identidad de las proteínas expresadas diferencialmente a partir de la información de bancos de datos como SWISS-PROT y TrEMBL, y de las secuencias tag (secuencias proteícas parciales traducidas a partir de secuencias de DNA) de las cuales hay más de 2 millones en la actualidad, número que se incrementa constantemente. Toda esta información permiten identificar prácticamente cualquier proteína detectada mediante 2-DE (Neubauer G et al. Nat Genet 1998;20:46-50). III) Obtención de anticuerpos: Las secuencias de aminoácidos de las proteínas identificadas en el objetivo 1, determinada mediante MS, será la información utilizada para la síntesis de péptidos sintéticos para la elaboración de anticuerpos específicos de acuerdo con protocolos desarrollados previamente (Royo T, Vidal M, Badimon L. Thromb Haemost 1998;80:667-685). IV) Inmunohistoquímica de lesiones coronarias humanas: Los anticuerpos específicos desarrollados contra las proteínas identificadas en el objetivo 1 se utilizarán para el análisis inmunohistoquímico de lesiones ateroscleróticas de coronarias humanas, de acuerdo con protocolos desarrollados previamente (Badimon JJ, et al. Circulation 1999;99:1780-1787; Martínez-González J, et al . Eur J Clin Invest 2001; 31: 939-949.). Brevemente, a partir de bloques de arterias coronarias humanas con diferentes grados de lesión, fijadas y congelados en OCT (Miles Inc.), se generarán mediante un criostato secciones consecutivas (5 m) que se montarán sobre portaobjetos tratados con gelatina, sobre los que se efectuará las incubaciones con los anticuerpos primarios. Se utilizarán anticuerpos secundarios marcados con fluorescencia (FITC o TRITC) o ligados a sistemas enzimáticos (fosfatasa alcalina o peroxidasa) según la sensibilidad requerida para una correcta detección de las entidades antigénicas analizadas. Para identificar estructuras vasculares se realizará la tinción tricrómica de Mason; para localizar lípidos la tinción Oil red O; e inmunotinciones con anticuerpos contra marcadores celulares específicos [anti- -actina de musculo liso (célula muscular lisa), anti-CD31 (célula endotelial); CD68 (monocito/macrófago) y anti-CD45RO (linfocitos T)] para identificar los tipos celulares secretores de tales proteínas. V) Captación y análisis de imagen: Los cortes histológicos teñidos con los anticuerpos se evaluarán mediante microscopio de fluorescencia (Vanos AHBT3, Olympus), las imágenes se digitalizarán (cámara Sony 3CCD) y se cuantificarán las áreas ocupadas por las proteínas analizadas mediante un sistema de análisis de imagen (Visilog 4.1.5, Noesis). VI)Validación : Los anticuerpos específicos obtenidos contra las proteínas de interés identificadas en el objetivo 1 se utilizarán para determinar mediante ensayos de proteínas (EIAs, etc.) los niveles de estas proteínas en los sueros de los pacientes sometidos a transplante cardíaco 12.- Metodología para la consecución del objetivo A 6 En primer lugar estudiaremos la expresión diferencial de genes en “pool de monocitos” de un grupo reducido de pacientes HF, con y con HFC y en controles sanos utilizando microarrays comerciales U133 de 20.000 genes de Affymetrix. Se seleccionarán aquellos genes cuya expresión varíe significativamente respecto a los controles. Una vez seleccionados aquellos genes candidatos generaremos chips de DNA que los contengan, utilizando librerías comerciales de cDNA o alternativamente oligonucleótidos de 50 bases del extremo 3´ según secuencia del Genebank. Además, a estas colecciones de genes se añadirán, de no encontrarse ya incluidos, los siguientes genes de interés en el metabolismo lipídico: Enzimas de la Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 36 Metodología ruta de síntesis de colesterol DHCR24, HMG-CoA reductasa, DHCR7, esterol C5 desaturasa.Factores de transcripción como SREBP-1, SREBP-2, LXR, FXR, RXR. PPAR. Transportadores de esteroles como ABCA1, ABCG1, ABCG4, OSBP. Receptores para lipoproteínas como el de LDL, LRP y receptores scavenger (SR-A, CLA-1/SR-BI, CD36, etc.). Apolipoproteínas como apo B-100, apo E, apo Cs, apo A-I. Otras proteínas implicadas en el metabolismo lipídico cómo LPL, HSL, adipofilina, perilipina, ACAT1 y ACAT2. Estas sondas se obtendrán mediante sintesis de los oligos de 50 bases correspondientes de la zona 3´. Se estima que el microchip contendrá un número total de entre 400 y 600 genes. El RNA se extraerá de sangre total preservada mediante “PAXgene Blood RNA System” de Gibco y de células mononucleadas de sangre periférica aisladas mediante gradiente de percoll. De estas muestras de extraerá el RNA total con Trizol (Gibco). El RNA se amplificará utilizando transcriptasa reversa marcándose fluorescentemente con dUTP conjugado con los fluoroforos Cy3 o Cy5. El cDNA así marcado se hibridará con los microarrays siguiendo los protocolos recomendados. A continuación se procederá a la lectura de los micrroarays y a su análisis utilizando el adecuado soporte informático. 13.- Metodología para la consecución del objetivo A 7 Metodología del programa educativo: Estudio prospectivo para evaluar la utilidad de un programa educativo. Se estudiarán los pacientes del RFHF (considerados casos índice) del área de Anoia y todos sus familiares, tanto los afectos como los no afectos de HF. Cada nuevo paciente será randomizado en uno de dos diferentes grupos: un grupo control (G1) y un grupo de intervención (G2) sujeto al programa educativo. Este programa consta de una primera parte teórica (con soporte audiovisual) de dos horas de duración, en la que se imparten conocimientos teóricos sobre la aterosclerosis, sobre los factores de riesgo cardiovascular, en especial las hiperlipemias, y sobre la hipercolesterolemia familiar heterocigótica. La parte práctica consta de dos talleres de 2,5 horas de duración cada uno. En el primero se exponen las recomendaciones dietéticas para la prevención de la aterosclerosis en este subgrupo poblacional de alto riesgo. En el segundo se instruye a los pacientes en cómo gestionar el carrito de la compra y en cómo deben juzgar los ingredientes y la composición de los alimentos elaborados o semielaborados. Este segundo taller se realiza en un supermercado simulado a tales efectos en las dependencias adscritas a nuestra unidad de lípidos. Anualmente se hará una charla de dos horas de duración con la finalidad de recordar los principales conceptos y de aclarar dudas. Se estudiara a los pacientes y a sus familiares basalmente, a los 3-6 meses y al año y, a partir de ese momento, anualmente. Y se correlacionarán los resultados con los datos demográficos, clínicos y analíticos del registro central. Posteriormente, se hará una extensión del programa a otros nodos de la red y a la red de Unidades de Lípidos. Un análisis comparativo se realizará a los 3 años. 14.- Metodología para la consecución del objetivo B.1 Creación de un registro (banco de muestras) de pacientes y familias de HFC en España utilizando la Red de Unidades de Lípidos de la Fundación para la Hipercolesterolemia Familiar. Este registro al y gual que el RFHF estará centralizado en la Fundación Hipercolesterolemia familiar y será responsable del mismo el Dr Pedro Mata. El registro contendrá datos de los pacientes diagnosticados en base a unos criterios diagnósticos consensuados y comunes para todos los miembros de la red. Se solicitarán los permisos correspondientes a la Agencia Nacional de Protección de Datos. Se hará una genoteca, plasmateca y seroteca (banco de muestras ) de pacientes y familias con HFC centralizada y ubicado en el LCRM . Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 37 Metodología 15.- Metodología para la consecución del objetivo B.2 Avanzar y validar en los criterios de diagnóstico de la HFC. Para ello, por una parte, se centralizarán los análisis bioquímicos en el laboratorio LCB ( Resposable Dr Blanco)., con el objetivo de confirmar el diagnóstico bioquímico realizado en las diferentes unidades de la red. Por otra, se analizará la concordancia (o discordancia) de los resultados al clasificar como afectos o no afectos a los miembros de las familias con HFC utilizando determinaciones clásicas (colesterol y triglicéridos) y las propuestas más recientemente (apoB, triglicéridos y fenotipo de LDL). 16.- Metodología para la consecución del objetivo B.3 Determinar el riesgo cardiovascular de los pacientes con HFC, sus predictores y el efecto del tratamiento médico tanto a nivel ecográfico, bioquímico, genético (Farmacogenética) y clínico I) Se estudiará la aterosclerosis preclínica en 75 de pacientes con HFC (utilizando la misma metodologia que en el apatado 2 de esta sección).y su relación con factores de riesgo convencionales y no convencionales (homocisteína, proteína C reactiva, polimorfismos genéticos que confieren riesgo cardiovascular, como los relacionados con la insulino-resistencia y los sistemas antioxidantes presentes en los enfermos con HFC (utilizando la misma metodología que hemos descrito en los apartados 2,7 y 8 de esta sección). II) se analizará la eficacia y los determinantes clínicos y bioquímicos de la respuesta al tratamiento médico (dieta, ejercicio, fármacos) y en 100 de pacientes con HFC se analizará la expresión de genes de monocitos/macrófagos aislados de pacientes con HFC antes y después de ser tratados con fármacos hipolipemiantes y se verificará si el grado de mejoría ecográfica conseguida se relaciona con alguno de estos parámetros (utilizando la misma metodología que la que hemos descrito en los apartados 2,5 y 6 de esta sección). 17.- Metodología para la consecución del objetivo B.4 Identificar genes y proteínas implicados en el desarrollo de HFC (Genómica/Proteómica). I) Se estudiará la variabilidad del gen de la apoA-II humana en miembros afectos y no afectos (clasificados por los criterios clásicos o por de concentración de apoB y triglicéridos) de familias con hiperlipemia familiar combinada. Estableceremos haplotipos y su relación cualitativa (afecto/no afecto) o cuantitativa con diferentes parámetros (concentraciones de apoA-II, apoB, triglicéridos, glucosa, insulina, índice cadera/cintura etc). Pretendemos hacer un análisis inicial con no menos de 50 familias de al menos tres personas y también comparar los casos índices con pacientes con diabetes tipoII II) Se estudiará la expresión de genes hepáticos en ratones transgénicos de apoA-II de ratón y apoA-II humana. Los ratones a estudiar habrán pasado una noche en ayunas o estarán en un momento bien determinado del período postprandial (2 h. después de ingerir 100 µl de aceite de oliva). Se emplearán microchips de Affymetrix y este estudio e interpretación se hará con lel software que dispone la empresa Medplant Genetics. III) Se obtendrá mediante biopsia muestra de tejido adiposo de pacientes HFC (n=20) y de individuos normolipémicos (n=20) del mismo sexo, edad y características antropométricas . Se obtendrá el RNA total de cada una de las muestras y se analizará la expresión génica mediante un array que contiene todos los genes catalogados más los ESTs provenientes de RNA mensajero (unos 22.000 en total) (según metodologia descrita en apartado 12). Se agruparan las muestras de RNA en dos pools de 10 muestras cada uno que se analizaran en dos experimentos separados. Se intentará que el grupo de pacientes FCH sea lo más homogéneo y "puro" posible. Por puro Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 38 Metodología entendemos que el defecto primario esté lo menos enmascarado posible por alteraciones adaptativas (individuos relativamente jóvenes, del mismo sexo-varones, sin sobrepeso, sin diabetes, etc). Las diferencias en los niveles de expresión génica detectadas serán posteriormente validadas individualmente, es decir para cada gen e individuo, mediante RT-PCR y PCR a tiempo real. Se contrastarán los resultados obtenidos con los valores lipídicos de estos pacientes,clínicos y los parámetros referentes a la acción insulínica IV) Siguiendo el mismo diseño del objetivo 2, se procederá al análisis de las proteínas expresadas en el tejido adiposo de estos pacientes mediante electroforesis bidimensional ( utilizando la misma metodología descrita en el apartado 11). Está aproximación permitirá diferencias en la expresión de determinadas proteínas o la identificación de nuevas proteínas relacionadas con la FCH Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Metodología Página 39 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Plan de trabajo La Red está constituida por 16 nodos, de 14 centros distintos que se detallan a continuación. Para cumplir los objetivos del Proyecto único se han asignado las tareas a cada nodo de acuerdo a la experiencia de los investigadores que forman parte de cada uno. Se presenta la asignación de tareas por nodo en tres años. Será el coordinador del centro el que vele por el cumplimiento de las tareas asignadas por parte de los investigadores de su centro. Se mantendrá informado permanentemente al Coordinador de la Red. RELACIÓN DE NODOS INTEGRANTES DE LA RED. COORDINADOR DEL CENTRO Y NÚMERO DE INVESTIGADORES POR CENTROS. NODO 1: Clínica Nstra Señora de la Concepción. Fundación Jiménez Díaz (FJD) Dr Pedro Mata Investigadores: 3 NODO 2: Instituto Aragonés de Ciencias de la Salud (UNIZAR 1). Dr Miguel Pocovi Investigadores: 3 NODO 3: Instituto Aragonés de Ciencias de la Salud (UNIZAR2) Dr. Fernadno Civeira Investigadores: 3 NODO 4: Instituto Ciencias Cardiovasculares de Cataluña. (IICB) Dra. Lina Badimón Investigadores: 4 + 1 Becaria predoc NODO 5 : Hospital Reina Sofía, Córdoba (HRS) Dr. Francisco Perez Jiménez Investigadores: 7 + 2 Becarias NODO 6: Instituto de Ciencias Biomedicas de Barcelona (HCB) Dr. Emili Ros Invesigadores: 5 NODO 7: Hospital de Bellvitge, Barcelona (Hbel) Dr. Xavier Pintó Investigadores: 2 + 5 colaboradores NODO 8: Facultad de Farmacia, Universidad de Barcelona (FarmaBna) Dr. Juan Carlos Laguna Investigadores: 4 NODO 9: Hospital de Santa Creu y Sant Pau Barcelona (HSP) Dr.Francisco Blanco Investigadores: 4 NODO 10: Hospital Clínico Universitario de Valencia (HCV) Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Plan de trabajo Página 40 Plan de trabajo Dr. Felipe Chaves Investigadores: 7 + 1 enfermera NODO 11: Instituto de Investigación en Ciencias de la Salud (HSJ) Dr. Jusep Ribalta Investigadores: 12 NODO 12: Facultad de medicina, Universidad de Cantabria (UNICAN) Dr. José Carlos Rodriguez Rey Investigadores: 3 NODO 13: Medplant Genetics (MedPlant) Dr. Antonio Martinez Investigadores: 4 NODO 14: Hospital Universitario Virgen del Rocío (HVR) Dr. José Villar Investigadores: 6 NODO 15: Hospital Ramón y Cajal (HRyC1) Dr. Diego Gomez Coronado Investigadores: 3 NODO 16: Hospital Ramón y Cajal (HRyC2) GRUPO EMERGENTE Dr. Javier Martinez-Botas Investigadores: 3 Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Centros: Memoria del proyecto científico: Bibliografía más relevante Página 41 de 97 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Experiencia de los grupos integrantes de la red La red de Hiperlipemias hereditarias esta formada por 16 nodos interdisciplinares formados por investigadores de los campos clínico y básico-aplicado. Cinco nodos de la Red tienen experiencia previa de colaboración en proyectos de investigación , ya que han participado en varios proyectos coordinados (DGES/ FEDER Cod 2FD97-2142-CO3 y PGE/FEDER cod SAF 2001-2466-CO5) que han conducido a importantes avances en el diagnóstico, clínica y tratamiento de la hipercolesterolemia familiar. La experiencia de cada grupo en la investigación en hiperlipemias hereditarias se puede resumir de la siguiente forma: El grupo de la Fundación Jiménez Díaz (Nodo 1), dirigido por el Dr. Pedro Mata cuenta con una amplia experiencia en registros de pacientes y fue pionero en España en la elaboración de un Registro de pacientes de Hipercolesterolemia Familiar, coordinando una red de 72 Unidades de Lípidos distribuidas por todas las Comunidades Autónomas. A su vez este grupo posee una gran experiencia en la investigación clínica de pacientes con hiperlipemias hereditarias y ha llevado a cabo numerosos estudios de intervención con dieta y fármacos sobre el metabolismo lipídico y la función vascular. El grupo de investigación del Instituto Aragonés de Ciencias de la Salud (Nodo 2), dirigido por el Dr Miguel Pocoví es especialista en el estudio de marcadores genéticos asociados a trastornos del metabolismo lipídico. Ha caracterizado 48 mutaciones en el receptor LDL (no descritas con anterioridad) que son responsables de hipercolesterolemia familiar, siendo pionero en el estudio del gen del r-LDL en la población española. Conjuntamente con el grupo de la Fundación Hipercolesterolemia Familiar , Med Plant Genetics y la empresa Lacer SA estan desarrollando un “biochip” para el diagnóstico de HF en España, contando ya en la actualidad con un prototipo que analiza las 20 mutaciones mas frecuentes del r-LDL en nuestro país. El grupo de investigación del Instituto Aragonés de Ciencias de la Salud que dirige el Dr Fernando Civeira (Nodo 3) es un grupo interdisciplinar que estudia marcadores genéticos asociados tanto a enfermedad coronaria como a trastornos del metabolismo lipídico. Este grupo posee una amplia experiencia en genética molecular de dislipemias y e interaciones gen –gen. El grupo del Instituto de Investigación Cardiovascular de Barcelona (Nodo 4) que dirige la Dra Lina Badimón es el grupo español de referencia en estudios de función vascular y ha estudiado tanto in vitro (cultivos de células musculares lisas y células endoteliales, humanas y de modelos de experimentación animal) como in vivo (arterias humanas y de modelos animales de hipercolesterolemia e hiperlipemia combinada (conejo y cerdo) el efecto de la hipercolesterolemia y/o hipertrigliceridemia produce sobre los niveles/actividad de diferentes proteínas relevantes a nivel de la pared vascular. El grupo del Hospital Reina Sofía de Córdoba (Nodo 5) que dirige el Dr Francisco Pérez Jiménez Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Experiencia de los grupos integrantes de la red Página 42 Experiencia de los grupos integrantes de la red posee una amplia experiencia en estudios de la interacción entre genes y dieta, como determinantes de los niveles de colesterol plasmático y de la expresión de otros factores de riesgo cardiovascular, incluyendo estudios de función endotelial, oxidación de LDL, tamaño de LDL El grupo del Hospital Clínico de Barcelona (Nodo 6) dirigido por el Dr. Emili Ros tiene una amplia experiencia en la evaluación y tratamiento de pacientes dislipémicos. Este grupo es especialista en la valoración de la aterosclerosis subclínica, metabolismo lipídico, epidemiología clínica, estudios de intervención farmacológica y dietética. El grupo del Hospital de Bellvitge (Nodo 7) que dirige el doctor Xavier Pinto, posee una amplia experiencia en el área la epidemiología cardiovascular, el diagnóstico y tratamiento de los factores aterogénicos, y ha identificado de las mutaciones causantes de la homocistinuria en pacientes españoles Este grupo mantienen una estrecha colaboración con el Laboratorio de Metabolopatías del Hospital de San Juan de Dios y con el Departamento de Genética de la Facultad de Biología de la Universidad de Barcelona. A su vez realiza actividades docentes en relación con los factores de riesgo cardiovascular El grupo de la Unidad de Farmacología (Nodo 8) de la Facultad de Farmacia de Barcelona, que dirige el Dr. Juan Carlos Laguna posee una amplia experiencia en estudios del efecto de derivados fíbricos sobre enzimas lipogénicas, activación de PPAR , por fibratos, modificación de la composición y oxidabilidad de las lipoproteínas plasmáticas por fibratos y de los mecanismos implicados en el efecto hipotrigliceridemiante de estatinas. El grupo del Hospital de Sant Pau (Nodo 9) , Barcelona que dirige el Dr. Francisco Blanco ha destacado por su contribución al estudio de las defiencias hereditarias de HDL, de la hiperquilomicronemia familiar y de la hipercolesterolemia familiar. Por otra parte, ha desarrollado un ratón transgénico de apoA-II que constituyen un buen modelo animal de hiperlipemia familiar combinada. y han propuesto que la zona cromosómica donde se encuentra la apoA-II (1q21-23) puede estar relacionada con el desarrollo de hiperlipemia familiar combinada. Como parte de los miembros del grupo desarrollan actividad asistencial en la especialidad de Bioquímica Clínica, en el área de los análisis de lípidos y lipoproteínas, su experiencia puede ser utilizada para constituir el laboratorio de referencia de Bioquímica Clínica para la red. La Unidad Mixta de Investigación del Hospital Clínico Universitario de Valencia (Nodo 10) que coordina el Dr. Chaves tiene una amplia experiencia en el estudio de las hiperlipemias primarias. Esta Unidad realiza pruebas funcionales metabólicas y posee un Laboratorio que se dedica de forma exclusiva al estudio de las lipoproteínas. Trabaja conjuntamente con la Unidad de Genética Molecular del Instituto de Investigaciones Citológicas de Valencia; mediante esta colaboración se inició el estudio genético de las hiperlipemias primarias, permitiendo diseñar procedimientos y métodos para realizar un diagnóstico genético de la HF y del DFB en nuestro país. El grupo del Instituto de Ciencias de la Salud de Reus y Facultad de Medicina de la Universidad Rovira i Virgili (Nodo 11), que coordina el Dr Josep Ribalta se dedica al estudio del metabolismo de los lípidos, las hiperlipemias y su relación con el riesgo vascular abordando los aspectos de balance oxidativo y arteriosclerosis, y bases genéticas de hiperlipemias hereditarias. El grupo de la Facultad de Medicina de la Universidad de Cantabria (Nodo 12) que dirige el Dr. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Experiencia de los grupos integrantes de la red Página 43 Experiencia de los grupos integrantes de la red José C. Rodríguez Rey se dedica al estudio de la expresión de los genes involucrados en el desarrollo de la placa de ateroma. También aborda el estudio de las regiones reguladoras y de caracterización funcional de de mutaciones del receptor de LDL El grupo de la empresa de biotecnología Medplant Genetics (Nodo 13) que dirige el Dr. Antonio Martínez es especialista en el diseño y fabricación de microarrays tanto para estudios de expresión como para el diagnóstico de mutaciones. Este grupo ha desarrollado microarrays de genes implicados en cáncer de vejiga, cáncer de páncreas o esclerosis múltiple. Algunos de estos genes están siendo validados clínicamente como marcadores en sistemas de diagnóstico no invasivo, o como potenciales dianas terapéuticas Conjuntamente la Fundación Hipercolestereolemia Familiar, Medplant genetics y la empresa Lacer SA, con el apoyo del grupo del Dr M Pocoví están desarrollando un biochip para el diagnóstico de HF, contando ya en la actualidad con un prototipo que analiza las 20 mutaciones mas frecuentes del r-LDL en nuestro país. El grupo del Hospital Virgen del Rocío (Nodo 14) que dirige el Dr. José Villar es un equipo multidisciplinar que colabora con el Instituto de la Grasa (CSIC) y es pionero en abordar estudios de composición y distribución asimétrica de lípidos en membrana celular. Este grupo ha realizado numerosos estudios del metabolismo postprandial en humanos y de la interacción de lipoproteinas con células vasculares humanas, determinado rutas de señalización intracelular asociadas con respuestas mitogénicas y apoptóticas. El grupo del Hospital Ramón y Cajal de Madrid ( Nodo 15) que coordina el Dr. Diego Gómez Coronado es especialista en la caracterización funcional de formas mutantes del r-LDL, la apo A-I y LCAT. Desarrolla estudios acerca de la utilización del colesterol lipoproteico para fines metabólicos y, en especial, para la proliferación celular. Ha colaborado en la caracterización funcional de los receptores scavenger CLA-1 y CD36. El grupo “emergente” del Hospital Ramón y Cajal (Nodo 16), está dirigido por el Dr. Javier Martínez-Botas, con contrato de investigador del Programa Ramón y Cajal. Este grupo es de reciente formación y el Dr Martínez Botas durante su estancia posdoctoral en el laboratorio del Dr. Lawrence Chan en Baylor College of Medicine (Houston, Texas), se ha familiarizado con las técnicas básicas de biología molecular y especialmente aquéllas relacionadas con la generación y caracterización de ratones knockout y en expresión génica diferencial del metabolismo lipídico mediante microarrays. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Experiencia de los grupos integrantes de la red Página 44 Expediente Nº RTIC-G MEMORIA DEL PROYECTO CIENTÍFICO TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Aplicabilidad de la configuración de la Red al Sistema Nacional de Salud En un reciente informe de la OMS sobre la HF, se describieron una serie de medidas prácticas con el fin de mejorar la identificación, el tratamiento y el seguimiento crónico de personas con HF. Estas medidas pueden utilizarse para sentar las bases de una Red dedicada al estudio de la HF a nivel nacional: 1. 2. 3. 4. 5. 6. 7. 8. Identificación de casos índice con HF Detección de nuevos casos en los familiares. Creación de un registro nacional Educación a los pacientes y médicos para un correcto tratamiento Seguimiento adecuado a los pacientes. Crear una organización y asociación de pacientes. Implicación y apoyo de las autoridades sanitarias. Coordinación y promoción de la investigación en todos las áreas (básica, clínica, educativa, etc) en HF. La Red temática en Hiperlipemias Genéticas, con el apoyo de la Fundación Hipercolesterolemia Familiar, cumple las premisas descritas. La Fundación cuenta con una Asociación de más de 5000 pacientes a quienes se les envía periodicamente un boletín de difusión e información. Recientemente, la Fundación ha establecido un Convenio de Colaboración tripartito con el Centro Nacional de Investigación Cardiovascular (CNIC) y el Instituto de Salud Carlos III (ISCIII) para promover la investigación en la HF. Además, la importancia socio-sanitaria de la HF ha sido reconocida por el Parlamento Español, aprobándose por unanimidad la aportación reducida al tratamiento farmacológico crónico que necesitan los pacientes con diagnóstico de certeza de HF (ver Diario de Sesiones del Congreso de los Diputados con fecha 10 de abril de 2002). ANÁLISIS DE ESTIMACIÓN COSTE-EFICIENCIA DEL PROYECTO Y DE LA RED Cualquier intervención que tenga un impacto sobre la salud es susceptible de ser analizada desde un punto de vista económico, a fin de evaluar el impacto de ésta sobre el bienestar de la sociedad. Su objetivo último es el de ayudar a la toma de decisiones para apoyar o rechazar la derivación de fondos públicos para la financiación de estas intervenciones, de tal forma que esta decisión sea racional y coherente, en función de los objetivos y de los recursos disponibles. Dado que el bienestar de la sociedad es un objetivo público que no se puede medir directamente y que los recursos siempre son limitados, la evaluación económica debe centrarse en la identificación de los efectos que se esperan de una determinada intervención sobre la salud y compararla con otras opciones, en términos de EFICIENCIA (beneficio sobre la salud a un coste asumible por la comunidad) y EFICACIA CLÍNICA (beneficio clínico basado en evidencias científicas contrastadas). Por tanto, sería razonable destinar fondos públicos a la financiación de intervenciones sobre la salud que hayan demostrado ser eficaces y que además, los costes que supongan sean asumibles por la comunidad. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Aplicabilidad de la configuración de la Red al SNS Página 45 Aplicabilidad de la configuración de la Red al Sistema Nacional de Salud A continuación se plantea la rentabilidad para el Sistema Nacional de Salud de la decisión d eapoyo a esta red temática y al proyecto propuesto de detección, seguimiento e investigación de hiperlipemias genéticas en España, con el objetivo final de un mejor tratamiento y prevención de la enfermedad cardiovascular. BENEFICIOS PREVISTOS: Disminución del riesgo de ECV precoz Disminución del riesgo de muerte por ECV. BENEFICIO SOCIAL Muertes evitadas y años de vida ganados en cantidad y en calidad. Se calcula que si todos los pacientes con HF de nuestro país estuviesen diagnosticados y tratados de forma correcta, los años de vida anados serían “teoricamente” 2.000.000 de años. BENEFICIO ECONÓMICO Teniendo en cuenta que la población incluída en el Registro Español tiene una edad media inferior a 50 años, y que hay evidencia de ECV a partir de los 30 años de edad, las medidas de prevención aplicadas a este grupo poblacional, evitándo la ECV, generaría una “riqueza-país” a través de 2 vías significativas: - De una parte, lo que corresponde a la propia vida cotidiana de las personas en la que se incluye tanto el rendimiento personal y empresarial. - Aumento de la población activa. Los beneficios mencionados justifican plenamente los recursos que requiere la Red para el desarrollo del Proyecto. Además, con el programa de formación propuesto, se contribuirá a modificar la actitud de la clase médica en general en la aproximación y tratamiento de las hipercolesterolemias familiares. Esto es importante, ya que existe una escasa formación médica en el tema de las hiperlipemias genéticas tanto en la formación del pre como del postgrado. En Conclusión, La consecución de este Programa permitiría a una parte de la población española expuesta a un elevado riesgo cardiovascular a: - conocer su condición predisponente a la incapacidad o muerte prematura conocer las posibilidades terapéuticas de reducir este riesgo colaborar en la difusión de este tipo de enfermedades en la población general, a fin de favorecer la detección de errores genéticos (mutaciones) aún no detectadas conocer la posibilidad de que su riesgo se incremente debido a su condición genética y la concomitancia con otras enfermedades. Conocer si, dada su información genética, podría responder mejor a un tipo de tratamiento u otro. Esta Red temática permitirá realizar una investigación competitiva a nivel Europeo y repercutirá en la Salud de los ciudadanos aumentando su calidad de vida . En definitiva, la inversión realizada en salud retorna en el bienestar de la sociedad. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Memoria del proyecto científico: Aplicabilidad de la configuración de la Red al SNS Página 46 Expediente Nº RTIC-G RELACIÓN DE REGISTROS, B. DE DATOS, BANCOS DE TEJIDOS,.... COMPARTIDOS POR LA RED TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. La Red cuenta para el desarrollo de este Proyecto de: 1. Un Registro y base de datos de 2050 pacientes con HF (casos índice). Este registro y la base de datos cumpen la normativa vigente en cuanto a protección de datos de acuerdo a la Agencia Nacional de Protección de datos. El presente proyecto ampliará este registro y base de datos mediante el estudio de cohorte. Los responsables del registro y de la base de datos (Dr. Mata y Dr. Alonso) velarán en todo momento en las medidas de seguridad de las mismas. La base de datos única estará a disposición de los grupos integrantes de la red con el fin de cumplir los objetivos propuestos en el mismo, siempre cumpliendo las normativas vigentes en cuanto al tratamiento y traspaso de datos y muestras biológicas. 2. Un Banco de ADN y seroteca (4 alicuotas de cada paciente con HF) incluídos en el Registro. Las muestras están almacenadas en el Lab. Biología Molecular, Universidad de Zaragoza, a cargo del Dr. Pocoví, y estarán a disposición de los nodos integrantes de la red en función de los objetivos, y manteniendo los controles legales y de seguridad en cuanto a la transferencia de material biológico. 3. En este proyecto se creará un registro de pacientes con HFC, y un banco de muestras de ADN y seroteca (centralizado en Lab Biología molecular, Universidad de Zaragoza). Los datos del registro HFC y las muestras estarán a disposición de los nodos integrantes de la red para la consecución de los objetivos, cumpliendo la normativa vigente en seguridad. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Relación de Registros, B. de datos, Bancos de tejidos,... compartidos por la red Página 53 Expediente Nº RTIC-G PLAN DE FORMACIÓN EN INVESTIGACIÓN TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. PLAN DE FORMACION EN INVESTIGACION La red elaborará un programa formativo, dirigido tanto a alumnos del tercer ciclo como a la formación continuada de los investigadores de los distintos grupos. Se desarrollará con el siguiente esquema: PROGRAMA DE TERCER CICLO: En el momento de constitución de la red existen distintos programas de tercer ciclo, ya establecidos. En ellos se incluyen alumnos de primero y segundo año, además de los que están en la fase de elaborar su tesis doctoral. Desde la red se potenciará el intercambio entre los grupos, a lo largo de todo el proceso, de acuerdo con el siguiente diseño: 1.- Primer año del programa: Los investigadores de cada grupo impartirán 1 crédito en otro programa distinto al propio, lo que supondrá un intercambio total de 16 créditos. 2.- Desarrollo de la tesis doctoral: Cada año se establecerá un turno rotatorio, para que 8 doctorandos realicen una estancia de tres meses en otro grupo de la red, para la realización de un trabajo complementario a su tesis doctoral. FORMACION CONTINUADA DE LOS INVESTIGADORES: La formación continuada y el intercambio de información, entre los miembros de la red, se desarrollará a dos niveles: 1.- Programa de intercambio de tipo virtual: Se elaborará una página web, especificamente destinada a incluir toda la información científica producida por la propia red, así como una selección mensual de las publicaciones afines, de otros grupos. Además, se pondrá en marcha un servicio de alerta, que difundirá por correo la información más relevantes relacionada con las líneas de investigación de la red. 2.- Programa de intercambio de investigadores: Se establecerá un turno rotatorio, entre todos los centros, para que un total de 8 investigadores hagan, cada año, una estancia mínima de 3 meses en otro nodo de la red. 3.- Reunión anual: Cada año se celebrará una reunión conjunta, de todos los investigadores de la red, para presentar los progresos científicos que se hayan producido durante ese tiempo, discutiendo las nuevas líneas de trabajo y promoviendo la interacción entre los grupos. FORMACION CONTINUADA A MEDICOS. Se desarrollará un programa de formación en Hiperlipemias genéticas para los médicos que conforman la red de Unidades de Lípidos y a otros médicos del SNS implicados en la detección de pacientes con hiperlipemias genéticas. En este sentido, algunos miembros de la Red Temática (Drs Mata, Alonso, Pocovi, Civeira, Perez Jiménez, López Miranda, Panisello) han participado con anterioridad en cursos de formación en Hipercolesterolemia Familiar avalados por el Ministerio de Sanidad y Consumo con 2.7 créditos. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Plan de formación en investigación Página 54 Expediente Nº RTIC-G HISTORIAL CIENTÍFICO DE LA RED TÍTULO DEL PROYECTO CIENTÍFICO: ESTUDIO GENÉTICO, METABÓLICO, CLÍNICO, TERAPÉUTICO Y EPIDEMIOLÓGICO DE LAS HIPERLIPEMIAS HEREDITARIAS EN ESPAÑA. Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años La Red de grupos en Hiperlipemias genéticas cuenta con 16 nodos, de los cuales uno es emergente (Nodo nº 16). Se incluyeron aquellos nodos o grupos de investigación con experiencia en el tema de las hiperlipemias genéticas, y que tuviesen un índice de impacto en las publicaciones en revistas indexadas de los últimos 5 años superior a 30. El índice de impacto total de la red en los úlitmos años es de: 1451,082. El nivel de excelencia científica de la red queda avalado por las Ayudas externas, publicaciones recientes y patentes obtenidas en los últimos 5 años como se muestra a continuación y más detallademente en los curriculum vitae adjuntos para cada investigador: PROYECTOS DE INVESTIGACIÓN FINANCIADOS POR AGENCIAS EXTERNAS : TOTAL 110 FIS: CICYT: EUROPEAS (FEDER, etc): DGA: OTRAS (CCAA, FUNDACIONES, INDUSTRIA): 39 28 10 3 30 PUBLICACIONES EN LOS ULTIMOS 5 AÑOS: (Revistas indexadas, según se detalla a continuación) 478 PATENTES : 4 Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 55 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años AYUDAS EXTERNAS DE LOS DISTINTOS NODOS QUE COMPONEN LA RED TEMÁTICA EN LOS ÚLTIOMS AÑOS. NODO 1 1. Beca del FISS, exp.93/0428. Efecto del Diferente Grado de Saturación de la Grasa de la Dieta sobre la Modificación Oxidativa de las LDL y la Trombogénesis (1993-1995). Investigador Principal: Pedro Mata 2. Beca del FISS , exp. 95/0838. Papel del Grado de Oxidación de las LDL en la Adhesión de Monocitos al Endotelio Vascular.(1995). Investigador Principal: Pedro Mata. 3. Beca del Ministerio, exp OLI96/2210. Comparación en sujetos sanos de tres dietas enriquecidas en ácidos grasos monoinsaturados y poiinsaturados n-6 y n-3 sobre las propiedades aterogénicas y trombóticas del endotelio vascular. (1997-1999) Investigadro responsbale: Pedro Mata. 4. Proyecto 30604/00108 (MSD - España ). Marcadores Clínicos y biológicos de disfunción endotelial en la hipercolesterolemia familiar. Efecto del tratamiento con simvastatina. ( 1998) Investigador Responsable: Pedro Mata. 5. Proyecto Coordinado FEDER 2FD97-2142-C03-03. Mapa de mutaciones del receptor LDL y desarrollo de un sistema de diagnóstico de las hipercolesterolemias familares. (2000-2001) Investigador Responsable: Pedro Mata. 6. SAF 2001-2466-C05-02. Estudio de Intervención Farmacológica en función del genotipo del receptor LDL y del transportador ABCG5. (2002-2004) Investigador Responsable: Pedro Mata. NODO 2 y 3 . 7. CICYT SAF 96-0264-CO2-01. Estudio genético y funcional de mutaciones asociadas a hipoalfalipoproteinemia y riesgo aterogénico (1996-1999). Investigador Principal: Miguel Pocoví Mieras 8. FIS 97/0527. Estudio clínico, enzimático y genético de la enfermedad de Gaucher. (1997-1999). Investigador Principal: Juan I. Pérez Calvo 9. DGA. PCM 1094. Estudio enzimático y genético de la enfermedad de Gaucher en la Comunidad Autónoma de Aragón. (1997-1999). Investigador Principal: Pilar Giraldo Castellanos 10. FIS 99/0048-01. Estudio de los factores genéticos antiaterogénicos asociados a la expresión de la apolipoproteína E. (1999-2001).Investigador Principal: Miguel Pocoví Mieras 11. FIS 00/0546. Análisis de factores genéticos que modifican la expresión y la respuesta al tratamiento enzimático sustitutivo en pacientes con la enfermedad de Gaucher-. (2000-2002). Investigador Principal: Pilar Giraldo Castellanos 12. DGES/FEDER 2FD97-2142-CO3. Mapa de Mutaciones del receptor LDL y desarrollo de un sistema de diagnóstico de las Hipercolesterolemias Familiares (1999-2001). Investigador Principal: Miguel Pocoví Mieras 13. PGE/FEDER SAF 2001-2466-Co5-01. Estudios genéticos en hipercolesterolemias familiares autosómicas dominantes. (2001 –2004). Investigador Principal: Miguel Pocoví Mieras Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 56 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años NODO 4 2 Proyectos de Investigación BIOMED II - C.E.E. 6 Proyectos de Investigación Nacionales (FIS, PNS) NODO 5 14. Junta de Andalucía, 1997, NºR. 57. Acción de la dieta mediterránea (dieta rica en grasa monoinsaturada) sobre diversos factores de la coagulación de riesgo trombogénico. 15. Junta de Andalucía,1997, NºR: 58.Efecto de las variaciones genéticas en los genes de las apolipoproteinas AI y AIV sobre los cambios inducidos por la dieta en la proteína transferidora de ésteres de colesterol. 16. FIS, 98/1531. Efecto de las variaciones en los locus genéticos de las apolipoproteinas AI, CIII, AIV, B y lipoprotein lipasa sobre la susceptibilidad a las LDL. 17. Junta de Andalucía, 1998. NºR: 132. Efecto de una dieta rica en grasa monoinsaturada sobre la expresión de factor tisular en monocitos en personas sanas. 18. Junta de Andalucía, 1998, NºR: 126. Efecto de una dieta rica en grasa monoinsaturada sobre la función endotelial in vitro. 19. Junta de Andalucía,1999, NºR: 165. Interacción genes-dieta como determinante de la resistencia a la insulina en personas sanas de ambos sexos. 20. Junta de Andalucía, 1999. NºR: 116. Efecto de la dieta Mediterránea rica en aceite de oliva sobre la función endotelial en enfermos con hiperlipemia primaria. 21. FIS 99/0949. Efecto de las variaciones genéticas en la región promotora del PAI-1 sobre las modificaciones plasmáticas de estas proteínas tras el consumo de una dieta rica en aceite de oliva (dieta Mediterránea). 22. AECI 99/26. Los polifenoles del aceite de oliva virgen. Su papel contra las enfermedades cardiovasculares. 23. Junta de Andalucía, CTS-212. Estudio de la influencia genética en la expresión de los factores y mecanismos principales relacionados con la arteriosclerosis. 24. Junta de Andalucía, 2000. NºR: 39Las variaciones en los locus genéticos de las apolipoproteinas AI,CIII, AIV, B y lipopreotin lipasa pueden influir en la susceptibilidad a la oxidación de las LDL durante el consumo de una dieta mediterránea rica en aceite de oliva. 25. Junta de Andalucía, 2000, NºR: 212 Efecto de la dieta mediterránea rica en aceite de oliva sobre la captación "in vitro" de las LDL oxidadas por macrófagos. 26. CGICYT. SAF2001-2466-C05-04. Interacción entre la mutación en el receptor LDL y el polimorfismo en el gen del transportador ABCG8, sobre el riesgo aterogénico en pacientes con hipercolesterolemia. 27. CGICYT. SAF2001-0366. Efecto de la dieta Mediterránea rica en aceite de oliva sobre las características aterogénicas de las lipoproteinas de baja densidad (LDL). 28. FIS, 2001/ 0449. Efecto de la alimentación mediterránea sobre la respuesta lipémica postprandial y sus repercusiones sobre la función endotelial. 29. Junta de Andalucía,2002. NºR: 239. Efecto de la alimentación mediterránea sobre la respuesta lipémica postprandial. 30. Junta de Andalucía, 2002. NºR: 243. Efecto de la dieta Mediterránea rica en aceite de oliva y polifenoles sobre la función endotelial y la producción de óxido nítrico. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 57 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años NODO 6 31. CICYT OLI96/2132. "Lipemia postprandial, subfracciones lipoproteicas, oxidación de las lipoproteínas de baja densidad y control glucémico en la diabetes mellitus no insulinodependiente. Efectos de una dieta rica en ácidos grasos monoinsaturados a base de aceite de oliva virgen frente a una dieta baja en grasa y con un alto contenido en carbohidratos" Investigador Principal: E. Ros. 32. CICYT 97/0215. "Susceptibilidad humana a la proliferación peroxisómica por fibratos hipolipidemiantes. Relación con la activida delta-9 desaturasa". Investigador Principal: JC. Laguna 33. Telemaratón TV3 1999 Diabetes. Proyecto 2 años: “Estudi pilot de la lipèmia i glucèmia postprandials domiciliàries en persones amb xifres de triglicèrids entre 100 i 200 mg/dl, amb i sense glucèmia alterada en dejú. Relació amb el fenotip de les VLDL i LDL, l’oxidabilitat de les LDL, i la disfunció endotelial i la presència d’aterosclerosi carotídea mesurades per ecografia.” Investigador Principal: E. Ros. 34. FISS 00/0992. Proyecto 3 años: “Estudio piloto de la lipemia y glucemia postprandiales domiciliarias en personas con cifras de triglicéridos entre 100 y 200 mg/dl. Relación con sensibilidad a la insulina, oxidación de LDL y disfunción endotelial.”. Investigador Principal: E. Ros. NODO 7 35. Marató TV3/2000/Coordinado. Homocisteína y enfermedad: estudios genéticos, bioquímicos y clínicos de la homocistinuria y del riesgo cardiovascular. (2000-2002) .Investigador Principal: Susana Balcells/MªAntònia Vilaseca/Xavier Pintó 36. FIS 95/0040-01. Diagnóstico y seguimiento de las enfermedades del metabolismo energético mitocondrial en la infancia. Investigado Principal: Mercedes Pineda Marfa. 37. Fundación Areces, 1995-1998. Caracterización molecular de las mutaciones en los genes de la hmg-coa liasa, acil-coa deshidrogenasa de cadena media y hmg-coa sintasa mitocondrial, que causan deficiencias geneticas hereditarias. Investigador Principal: Fausto García Hegardt. 38. FIS 2000. Implicación de la ubiquinona-10 en la fisiopatología de la fenilcetonúria. Invetigador Principal. Jaume Campistol Plana 39. DGICYT SAF 97-0074. Análisis molecular de la enfermedad de Gaucher y de la enfermedad de Sanfilippo (tipos A y B). Correlación entre los datos genéticos, bioquímicos y clínicos. Estudios de expresión y optimización de vectores para terapia génica. (1997-2000). Investigador Principal: Lluïsa Vilageliu 40. Fundació La Marató de TV3. 98-1220. Expresión y caracterización de alelos mutantes causantes de la enfermedad de Gaucher, de la leucodistrofia metacromática y de la gangliosidosis GM2. Estudios preliminares para terapia génica. (1999-2001). Investigador Principal: Daniel Grinberg/Amparo Chabás 41. DGICYT SAF2000-0200. Caractarización molecular de la enfermedad de Gaucher, leucodistrofia metacromatica y las mucopolisacaridosis I y IIIA. Detección, expresión y caractarización de alelos mutados. Optimización de vectores adenos y retrovíricos para terapia génica. (2000-2003). Investigador Principal: Daniel Grinberg Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 58 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 42. FIS P102084 (en fase de evaluación). Estudio controlado con placebo, doble ciego, de grupos paralelos y aleatorizado para evaluar el efecto del tratamiento con ácido fólico-vitamina B12, con vitamina B6 y con la combinación de ambos sobre el metabolismo de la homocisteína. (2002-2003). Investigador Principal: Dra. María J. Castiñeiras Lacambra NODO 8. 43. CICYT SAF97-0215. Susceptibilidad humana a la proliferación peroxisómica por fibratos hipolipemiantes. Relación con la actividad delta-9 desaturasa (2000). Investigador Principal: Juan Carlos Laguna. 44. CICYT SAF98-0105. Implicación de la MTP en la reducción de la secreción hepática de triglicéridos inducida por estatinas y fibratos (2000) Investigador Principal: Rosa M. Sánchez C. 45. FIS 2000/1124 . Regulación del metabolismo lipídico por agonistas del receptor PPARαβ en tejido hepático, adiposo, muscular y en monocitos/macrófagos. El receptor PPARβ como modulador de la actividad PPARα. (2002). Investigador Principal: JC Laguna. 46. CICYT SAF2000-0201Efecto de los fibratos sobre el metabolismo lipídico en músculo, tejido adiposo, hígado y monocitos /macrófagos. Nuevas posibilidades terapéuticas de los agonistas PPAR. (2003). Investigador Perincipal: M. Vázquez 47. FIS 01/0075-01 C. Estudio mediante técnicas de array del efecto de estatinas y activadores PPAR sobre el patrón de modificación génica inducido por LDL oxidadas en células THP-1 (2003). Investigador Principal: M. Alegret. NODO 9. 48. Telemaratón TV3-Enfermedades cardiovasculares. "Susceptibilidad a la arteriosclerosis de ratones transgénicos para apoA-II humana y su descendencia tras cruzarlos con otros tipos de ratones modificados geneticamente y que desarrollan arteriosclerosis masiva (knock-outs de apoE y receptor de LDL y transgénicos de PTEC)". (1997-1999). Investigador principal: F. Blanco Vaca . 49. CICYT. "Prevención y regresión de la arteriosclerosis mediante tratamiento con difenilhidantoína, un fármaco que aumenta las HDL, y evaluación de los mecanismos moleculares implicados utilizando ratones geneticamente modificados que desarrollan arteriosclerosis masiva".(1988-2001). Investigador principal: F. González Sastre. 50. CICYT. "Papel de las HDL en la prevención de la modificación oxidativa de las LDL y de la arteriosclerosis: estudios en ratones transgénicos para apoA-II humana y en pacientes con arteriosclerosis coronaria". (1999-2002). Investigador principal: F. Blanco Vaca 51. Telemarató de TV3. "Caracterización fisicoquímica y funcional de la subfracción modificada, electronegativa de las lipoproteínas de baja densidad (LDL(-)) en la diabetes mellitus. Influencia del perfil glicémico". (2000-2002). Investigador principal: J. Ordóñez Llanos. 52. Telemarató TV3 Trasplantes. "Estudio comparativo de los efectos y mecanismos por los que los inmunosupresores ciclosporina A, tacrolimus, y mofetil micofenolato actuan sobre el desarrollo de hiperlipemia, hiperhomocisteinemia, arteriosclerosis común y posttrasplante".(2001-2003). Investigador principal: F. Blanco Vaca Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 59 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 53. FIS 2001-2004. “Patología molecular de la hiperlipemia familiar combinada: continuación del análisis de un modelo animal (ratones transgénicos de apoA-II humana) y estudio de genes "candidato". Investigador principal: F. Blanco Vaca. 54. CICYT .. “Lipoproteínas circulantes modificadas (LDL electronegativa, LDL(-)) y respuesta inflamatoria endotelial. Bases estructurales y mecanismos celulares implicados”. (2001-2003). Investigador principal: Jordi Ordóñez Llanos 55. FIS 2002. “Identificación de genes implicados en el metabolismo de triglicéridos y en la sensibilidad a la insulina en animales modificados geneticamente mediante la utilización de biochips”. Investigador principal: Josep Julve Gil. NODO 10. 56. FIS 96/2063: “Dislipemias primarias: Diagnóstico y epidemiología de factores genéticos que influyen en la cardiopatía isquémica. Investigador principal: Dra. M.E. Armengod. 57. FIS 99/0300. “Estudio de la resistencia a la insulina en sujetos no obesos y no diabéticos, su relación con la grasa abdominal y el consumo de oxígeno. Modificación con el ejercicio moderado. Investigador principal: Dr. Juan F. Ascaso Gimilio. 58. FIS 99/0008-01: “ Estudio de diferentes factores genéticos y bioquímicos de riesgo cardiovascular en las dislipemias primarias: hipercolesterolemia familiar e hiperlipemia familiar combinada”. (1999 –2001). Investigador principal: Dr. Carmena Rodríguez. 59. FIS 01/0056-02.: “ Parámetros antropométricos y bioquímicos que influyen en el fenotipo lipoproteico y en la respuesta terapéutica a estatinas en la hipercolesterolemia familiar heterocigota”. (2001-2003). Investigador Principal: F. Javier Chaves Martinez 60. Generalitat de Valencia.GV01-46: “Defecto familiar de unión de apo B 100: efecto fundador, fenotipo lipoproteico y diferencias clínico-biológicas con la hipercolesterolemia familiar heterocigota. (2002-2004). Investigador principal: Jose T. Real Collado 61. Generalitat de Valencia. GV00-074-12. “Estudio del impacto sobre daño renal de los polimorfismos presentes en los genes que codifican la sintasa de oxido nitrico, nadh oxidasa y xantin oxidasa. (2001-2002). Investigador principal: Dr. F. Javier Chaves Martínez. 62. FIS 01/0069-01.: “Estudio de la relación entre estrés oxidativo, hipertensión esencial y daño orgánico: efecto de polimorfismos genéticos, niveles de expresión y actividad de los sistemas superóxido dismutasa, catalasa y glutation”. (2001-2003).Investigador Principal: F. Javier Chaves Martinez 63. FIS 01/3047: “Genes reguladores de la respuesta al estrés oxidativo en enfermedades con alto riesgo cardiovascular”. (2002- 2004). Investigador Principal: F. Javier Chaves Martinez NODO 11 64. Direcció General de Recerca 1995SGR-00336. Unitat de Lípids i Nutrició.(1995 – 1997). Investigador Principal: Lluis Masana Marin 65. Fundación La Marató TV3. Estudio del papel regulador de los ácidos grasos en la expresión de los genes que controlan el metabolismo lipoproteico y la proliferación celular (1996 – 1998). Investigador Principal: Lluis Masana Marin Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 60 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 66. Direcció General de Recerca1997PIR-74 . Equipo de infraestructura (1997). Investigador Principal: Lluis Masana Marin 67. CICYT SAF98-0081. Caracterización, clonaje y expresión génica de una nueva familia de receptores lipoproteicos implicados en la regulación de la trombogenicidad de la lesión aterotrombótica. (1998 – 2001). Investigador Principal: Javier Pedreño Egea 68. Instituto de Cooperación con el Mundo Árabe. Estudio molecular de la Hipercolesterolemia Familiar. Aplicación clínica en la enfermedad cardiovascular. (1999 – 2000). Investigador Principal: Lluis Masana Marin 69. Instituto de Cooperación con el Mundo Árabe.Efectos hipolipemaintes y antioxidantes del aceite (l'huile d'argan) en pacientes con enfermedad cardiovascular. (1999 – 2000) Investigador Principal: Rosa Solà Alberich 70. FIS 98/0228. Papel de los aldehidos derivados de la oxidación de los ácidos grasos en la patogénia de la arteriosclerosis. Estudio in vitro e in vivo. 1998-2001. Investigador Principal: Luis Masana Marín 71. FIS 99/0945. Análisis de la secuencia de los genes de los receptores nucleares PPAR alfa, PPAR gamma y RXR alfa en pacientes con hiperlipemia familiar combinada y estudio de la regulación de su funcionalidad por la vitamina A.(1999 – 2002). Investigador Principal: Josep Ribalta Vives 72. Comisión de la Comunidad Europea QLK1-1999-CT-00830. Vitamin A, vitamin E and carotenoid status metabolism during ageing: Fuctional and metabolism during ageing: Functional and nutritional consequences (VITAGE). (2000 – 2003). Investigador Principal: Josep Ribalta Vives 73. FIS 01/398. Estudio de las variaciones genéticas en las regiones promotora y catalítica de los genes de enzimas antioxidantes y su relación con la enfermedad vardiovascular en la diabetes mellitus tipo 2. (2001-2003). Investigador Principal: Luis Masana Marín NODO 12 74. CICYT SAF96- 0264- C02-02 "Estudio genético y funcional de mutaciones asociadas a hipoalfalipoproteinemia y riesgo aterogénico”. 75. FIS 99/0048-02 “Estudio de factores genéticos antiaterogénicos asociados a la expresión de apoE”. NODO 13 76. Unión Europea. V Programa Marco QLRT-2001-00435 Solvent-tolerant bacteria allowing a broader perfomance of biotransformation of organic compounds in two-phases fermentation Systems (2002-2005) 77. Unión Europea. V Programa Marco GRD1-2001-41861. Development of Smart Nanorobot for Sensor-based Handling in a Scanning Electron Microscope. Applications in Pharmacogenomics. (2002-2005) 78. Unión Europea. Programa Marie Curie MCFI-2001-0068. A functional genetic approach to understanding the plant hypersensitive response.(2002-2003) 79. Ministerio de Ciencia y Tecnología. Programa PROFIT FIT-010000-2000-87. Desarrollo de DNA-chips para el diagnóstico precoz y tratamiento del cáncer (2000) Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 61 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 80. Ministerio de Ciencia y Tecnología. Programa PROFIT IBEROEKA. FIT-010000-200162.Desarrollo de sistemas de diagnóstico precoz e identificación de dianas terapéuticas mediante tecnología DNA-Chip.(2001-2003) 81. Ministerio de Ciencia y Tecnología. Programa PROFIT. FIT-010000-2001-96.Diseño de un microchip de cDNA para la detección de resistencia a la Quimioterapia en pacientes con cáncer de pulmón. (2001-2003) 82. Ministerio de Ciencia y Tecnología. Programa PETRI95-0538-OP Sistema de transfección basado en un péptido sintético (2002-2003) 83. Ministerio de Ciencia y Tecnología. Plan Nacional (P4) AGL2000-0394-P4-04. Desarrollo de chips de DNA para la detección específica y simultánea de agentes pitopatógenos y genes de respuesta a la infección en Solanum tuberosum. (2001-2004). 84. Ministerio de Ciencia y Tecnología. Plan Nacional (P4) AGL2000-0067-P4-03 Producción y técnicas de formulación de Penicillium oxalicum para el control biológico de enfermedades.(2001-2004) NODO 14 85. CICYT ALI96-0456. Influencia de los triglicéridos y los componentes menores del aceite de oliva virgen y girasol alto-oleico sobre el metabolismo lipídico: estudios in vitro e in vivo. (1996-1998) 86. FIS 96/0447. Influencia del polimorfismo de la Apo E en la hipercolesterolemia y composición lipídica de la membrana celular en la hipertensión arterial esencial. (1996-1998) 87. CICYT OLI96-2126. Modificaciones de la membrana de células endoteliales y vasculares, su respuesta a factores de crecimiento y citoquinas, por la fracción glicerídica del aceite de oliva. (1997-1999) 88. Junta de Andalucía 1997, REF 5. Influencia de la composición de esfingomielina de la memberana plasmática sobre factores celulares predictores de riesgo cardiovascular (1998). 89. FIS 99/00305. Modificación del estrés oxidativo en pacientes hipertensos tratados con simvastatina y/o enalapril. (1999-2000) 90. INIA CA99-006. Efectos beneficiosos de las dietas ricas en aceite de oliva virgen sobre modelos de inflamación aguda y crónica. Influencia sobre el sistema inmunológico. Modificación de la respuesta y función de leucocitos polimorfonucleares. (1999-2001) 91. FEDER 1FD97-2288. Modificación por la dieta de factores de riesgo cardiovascular en ancianos. Importancia de los triglicéridos del aceite de oliva virgen. (2000-2002) 92. FIS 99/ .Determinantes genéticos de la hipertrofia del ventrículo izquierdo en la hipertensión arterial esencial. (2000-2002). 93. CICYT ALI99-0863. Efecto de lipoproteínas postprandiales procedentes de la ingesta rica en ácidos grasos monoinsaturados sobre mecanismos celulares implicados en la arteriosclerosis. (2000-2003). 94. CICYT AGL2001-0584. Aterotrombogenicidad de las lipoproteínas remanentes ricas en triglicéridos y su modulación por factores nutricionales.(2001-2004) NODO 15 95. CICYT SAF96-0011. Acción antioxidante de los flavonoides. Aproximación a su efecto protector de la arteriosclerosis y la proliferación celular.(1996-1998). I.P.: M.A. Lasunción. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 62 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 96. FIS, 97/0389. Repercusión del metabolismo lipídico sobre la respuesta del macrófago en relación con la aterogénesis: efecto de los hipolipemiantes. (1997-1999). I.P.: D.Gómez-Coronado. 97. Comunidad Autónoma de Madrid 08.4/0006/1997. Dieta, lípidos y antioxidantes en plasma en población infantil de la Comunidad de Madrid.(1998-1999). I.P.: M.A. Lasunción. 98. FIS 99/0286. Efecto de la inhibición de la síntesis de colesterol sobre la secreción de citocinas proinflamatorias: Estudio en células en cultivo y en pacientes con hipercolesterolemia familiar..(1999-2001). I.P.: M.A. Lasunción. 99. FIS, 00/0229. Papel de la vía del mevalonato en la respuesta inmune Th1 en relación con la aterogénesis. Efecto regulador de las estatinas.(2000-2002). I.P.: D.Gómez-Coronado. 100. Ministerio de Ciencia y Tecnología (INIA), VIN00-0004. Efecto del suplemento dietético con antioxidantes de la uva en pacientes con insuficiencia renal.(2000-2002). I.P.: M.A. Lasunción. 101. Consejería de Educación de la CAM 08.4/0037/2001.Acciones del colesterol y sus análogos estructurales sobre el ciclo celular. (2002-2003). I.P.: M.A. Lasunción. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 63 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años ARTICULOS CIENTÍFICOS PUBLICADOS EN REVISTAS INDEXADAS, ÚLTIMOS AÑOS. NODO 1 1. Ordovás JM, López-Miranda J, Mata P, Perez-Jimenez F, Lichtenstein AH, Schaefer EJ. Genediet interaction in determining plasma lipid response to dietary intervention. Atherosclerosis 1995;118:S11-S27. 2. Carmena R, De Oya M, Gómez-Gerique J, Mata P, et al. Pravastatin, Cholestyramine, and Bezafibrate in patients with heterozygous familial hypercholesterolemia: The Spanish Multicenter Pravastatin Study. Cardiovasc Risk Factors 1996;6:55-61. 3. Mata P, Alonso R, López-Farré A, et al. Effect of dietary fat saturation on low density lipoprotein oxidation and monocyte adhesion to human endothelial cells in vitro. Arterioscler Thromb Vasc Biol 1996;16:1347-1355. 4. Alvarez-Sala LA, Mata P, Blazquez E, Garrido JA, Ordovás JM, Rubio MJ, De Oya M. Pravastatina aumenta la actividad de receptores LDL en linfocitos de individuos con hipercolesterolemia familiar heterocigota. Rev Clin Esp 1997;197:317-322. 5. Mata P, Varela O, Alonso R, Lahoz C, De Oya M, Badimon L. Monounsaturated and polyunsaturated n-6 fatty acid-enriched diets modify LDL oxidation and decrease human coronary smooth muscle cell DNA synthesis. Arterioscler Thromb Vasc Biol 1997;17:20882095. 6. Lahoz C, Alonso R, Ordovás JM, López-Farré A, De Oya M, Mata P. Effects of dietary fat saturation on eicosanoid production, platelet aggregation and blood pressure. Eur J Clin Invest 1997;27:780-787. 7. Sanchez L, Casado S, Farré J, Garcia M, Rico L, Monton M, Romero J, Bellver T, Sierra M, Guerra J, Mata P, Esteban A, López-Farré A. Comparison of in vitro effects of trifusal and acetysalicylic acid on nitric oxide synthesis by human neutrophils. Eur J Pharmacol 1998;343:57-65. 8. Gonzalez F, Lopez-Farré A, Rodriguez-Feo JA, Mata P, Millas I, Garcia-Duran M, et al. Expression of inducible nitric oxide synthase after endothelial denudation of rat carotid artery: role of platelets. Circulation Research 1998;83:1080-87. 9. Lahoz C, Alonso R, Porres A, Mata P. Efecto de la saturación de la grasa de la dieta sobre la concentración plasmática de la lipoproteina (a) y de los lípidos plasmáticos. Med Clin (Barc) 1998;110:641-645. 10. Ordovas JM, Lopez-Miranda J, Mata P, Perez-Jimenez F. Gene-environment interactions in lipoprotein metabolism. Nutr Metab Cardiovasc Dis 1998;8:47-61. 11. Mata P, Lopez-Miranda J, Pocoví M, et al. Human apolipoprotein A-I gene promoter mutation influences plasma low density lipoprotein cholesterol response to dietary fat saturation Atherosclerosis 1998;137:367-376. 12. Colome C, Alonso R, Mata P, Badimon L. Effects of dietary fatty acids and vitamin E levels in HL-60 cell proliferation. Eur J Clin Invest 1999;29:129-138. 13. Plaza I,Villar F, Mata P, et al. Control de la colesterolemia en España 2000. Un instrumento para la prevención cardiovascular. Rev Esp Cardiol 2000;53:815-837. 14. Alonso R, Mata P , de Andrés R, Villacastín BP, Royo T, Badimón L. Sustained long-term improvement of arterial endothelial function in heterozygous familial hypercholesterolemia patients treated with simvastatin. Atherosclerosis 2001; 157:423-429. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 64 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 15. Alonso R, Castillo , Civeira F, Puzo J, de la Cruz J, Pocovi M, Mata P. Hipercolesterolemia familiar heterocigota en España. Estudio descriptivo de 819 casos no relacionados. Med Clin (Barc), 2002;118:487-92 16. Mata P, Alonso R, Castillo S, Pocovi M. MEDPED and the Spanish familial hypercholesterolemia foundation. Atherosclerosis 2002;2(suppl):9-11. 17. Montoya MT, Porres A, SerranoS, Fruchart JC, Mata P, Gerique JA, Castro GR. Fatty acid saturation of the diet and plasma lipid concentration, lipoprotein particle concentration, and cholesterol efflux capacity. Am J Clin Nutr 2002; 75: 484-91. 18. Perez-Jiménez F, Lopez-Miranda J, Mata P. Protective effects of dietary monounsaturated fat on atherosclerosis: beyond cholesterol. Atherosclerosis 2002; 163: 385-398. 19. Castillo S, Tejedor D, Mozas P, Reyes G, Civeira F, Alonso R, Ros E, Pocovi M, Mata P on behalf of the Spanish FH Study group. The apolipoprotein B R3500 gene mutation in Spanish subjects with a clinical diagnosis of familial hypercholesterolemia. Atherosclerosis 2002 (in press) 20. Castillo S, Reyes G, Tejedor D, Mozas P, Suarez Y, Lasunción MA, Civeira F, Alonso R, Mata P, Pocovi M. A double mutant (2393del9+N543H) allele in the LDL-r gene in patients witj heterozygous, homozygous and compound heterozygous familial hypercholesterolemia: Effect on plasma cholesterol levels and coronary heart disease. Hum Mut 2002 (accepted) 21. Mozas P, Castillo S, Reyes G, Tejedor D, Civeira F, García-Alvarez I, Puzo J, Cenarro A, Alonso R, Mata P and M. Pocoví. Apo E genotype is not associated with cardiovascular disease in heterozygous subjects with Familial Hypercholesterolemia. Am Heart J (accepted).Clave: A NODO 2 y 3. 22. Castillo S, Tejedor D, Mozas P, Reyes G, Civeira F, Alonso R, Ros E, Pocovi M, Mata P. The apolipoprotein B R3500Q gene mutation in Sapnish subjects with a clinical diagnosis of familial hipercolesterolemia. Atherosclerosis (aceptado publicación) 23. Garcia Otín AL, Civeira F, Aristegui R, Díaz C, Recalde D, Sol JM, Masramon X, Hernández G, Pocoví M. Allelic Polymorphism –491 A/T in apo E gene modulates the lipid-lowering response in the treatment of combined hyperlipidemia. Eur J Clin Invest 2002; 32: (en prensa) 24. Rite S, Baldellou A, Giraldo P, Labarta JI, Giralt M, Rubio-Felix D, Guallar A, Perez-Calvo JI, Mayayo E, Ferrandez A, Pocovi M. Insulin-Like Growth factors in choldhood-onset Gaucher Disease. Pediatr Res (aceptado publicación) 25. Torralba MA, Alfonso P, Pérez-Calvo JI, Cenarro A, Pastores GM, Giraldo P, Civeira F, and Pocoví M. High prevalence of the 55bp deletion (c.1263del55) in exon 9 of Glucocerebrosidase gene causing misdiagnosis (for homozygous N370S (c.1226A>G) mutation) in Spanish Gaucher disease patients.Blood Cell Mol Dis (aceptado para publicación). 26. Alonso R, Castillo S, Civeira F, Puzo J, La Cruz JJ, Pocovi M, Mata P. Heterozygous familial hypercholesterolemia in Spain. Description of 819 non related cases Med Clin (Barc). 2002;118:487-92. 27. Recalde D, Cenarro A, García Otín AL, Gómez Coronado D, Civeira F, Pocoví M. Analysis of apolipoprotein A-I, lecithin:cholesterol acyltransferare and glucocerebrosidase genes in hypoalphalipoproteinemia. Atherosclerosis 2002; 163:49-58 (en prensa) 28. Mata P, Alonso R, Castillo S, Pocovi M. MEDPED and the Spanish familial hypercholesterolemia foundation. Atheroscler Suppl. 2002 Mar;2(3):9-11. 29. Mozas P, Galetto R, Albajar M, Ros E, Pocovi M, Rodriguez-Rey JC. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 65 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años A mutation (-49C>T) in the promoter of the low density lipoprotein receptor gene associated with familial hypercholesterolemia..J Lipid Res. 2002;43:13-8. 30. Alfonso P, Cenarro A, Perez-Calvo JI, Giralt M, Giraldo P, Pocovi M. Mutation Prevalence among 51 Unrelated Spanish Patients with Gaucher Disease: Identification of 11 Novel Mutations. Blood Cells Mol Dis. 2001;27:882-91. 31. Giraldo P, Cenarro A, Alfonso P, Perez-Calvo JI, Rubio-Felix D, Giralt M, Pocovi M. Chitotriosidase genotype and plasma activity in patients type 1 Gaucher's disease and their relatives (carriers and non carriers). Haematologica. 2001;86:977-84. 32. Martorell L, Virgos C, Valero J, Coll G, Figuera L, Joven J, Pocovi M, Labad A, Vilella E. Schizophrenic women with the APOE epsilon 4 allele have a worse prognosis than those without it. Mol Psychiatry. 2001;6:307-10. 33. Canudas J, Cenarro A, Civeira F, Garci-Otin AL, Aristegui R, Diaz C, Masramon X, Sol JM, Hernandez G, Pocovi M. Chitotriosidase genotype and serum activity in subjects with combined hyperlipidemia: effect of the lipid-lowering agents, atorvastatin and bezafibrate. Metabolism. 2001;50:447-50. 34. Torralba MA, Perez-Calvo JI, Pastores GM, Cenarro A, Giraldo P, Pocovi M. Identification and characterization of a novel mutation c.1090G>T (G325W) and nine common mutant alleles leading to Gaucher disease in Spanish patients. Blood Cells Mol Dis. 2001;27:489-95. 35. Recalde D, Velez-Carrasco W, Civeira F, Cenarro A, Gomez-Coronado D, Ordovas JM, Pocovi M. Enhanced fractional catabolic rate of apo A-I and apo A-II in heterozygous subjects for apo A-I(Zaragoza) (L144R). Atherosclerosis. 2001;154:613-23. 36. Perez Calvo JI, Inigo Gil P, Giraldo Castellano P, Torralba Cabeza MA, Civeira F, Lara Garcia S, Pocovi M. Transforming growth factor beta (TGF-beta) in Gaucher's disease. Preliminary results in a group of patients and their carrier and non-carrier relatives. Med Clin (Barc). 2000;115:601-4 37. Giraldo P, Pocovi M, Perez-Calvo J, Rubio-Felix D, Giralt M. Report of the Spanish Gaucher's disease registry: clinical and genetic characteristics. Haematologica. 2000 ;85:792-9. 38. Perez-Calvo J, Bernal M, Giraldo P, Torralba MA, Civeira F, Giralt M, Pocovi M. Co-morbidity in Gaucher's disease results of a nationwide enquiry in Spain. Eur J Med Res. 2000;5:231-5. 39. Mozas P, Cenarro A, Civeira F, Castillo S, Ros E, Pocovi M. Mutation analysis in 36 unrelated Spanish subjects with familial hypercholesterolemia: identification of 3 novel mutations in the LDL receptor gene. Hum Mutat. 2000;15:483-4. 40. Recalde D, Cenarro A, Civeira F, Garcia-Otin AL, Pocovi M. A novel DNA polymorphism (4886C>T) in the human LCAT gene. Hum Mutat. 2000;15:298. 41. Garcia-Otin AL, Civeira F, Peinado-Onsurbe J, Gonzalvo C, Llobera M, Pocovi M. Acquired lipoprotein lipase deficiency associated with chronic urticaria. A new etiology for type I hyperlipoproteinemia. Eur J Endocrinol. 1999;141:502-5. 42. Sarria AJ, Giraldo P, Perez-Calvo JI, Pocovi M. Detection of three rare (G377S, T134P and 1451delAC), and two novel mutations (G195W and Rec[1263del55;1342G>C]] in Spanish Gaucher disease patients. Mutation in brief no. 251. Online. Hum Mutat. 1999;14(1):88. 43. Acton S, Osgood D, Donoghue M, Corella D, Pocovi M, Cenarro A, Mozas P, Keilty J, Squazzo S, Woolf EA, Ordovas JM. Association of polymorphisms at the SR-BI gene locus with plasma lipid levels and body mass index in a white population. Arterioscler Thromb Vasc Biol. 1999 ;19:1734-43. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 66 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 44. Civeira F, Cenarro A, Ferrando J, Puzo J, Garcia-Otin AL, Mozas P, Pocovi M. Comparison of the hypolipidemic effect of gemfibrozil versus simvastatin in patients with type III hyperlipoproteinemia. Am Heart J. 1999 ;138:156-62. 45. Cenarro A, Casao E, Civeira F, Jensen HK, Faergeman O, Pocovi M. P1A1/A2 polymorphism of platelet glycoprotein IIIa and risk of acute coronary syndromes in heterozygous familial hypercholesterolemia. Atherosclerosis. 1999;143:99-104. 46. Cenarro A, Jensen HK, Casao E, Civeira F, Gonzalez-Bonillo J, Rodriguez-Rey JC, Gregersen N, Pocovi M. Identification of recurrent and novel mutations in the LDL receptor gene in Spanish patients with familial hypercholesterolemia. Mutations in brief no. 135. Online. Hum Mutat. 1998;11:413. 47. Varret M, Rabes JP, Saint-Jore B, Cenarro A, Marinoni JC, Civeira F, Devillers M, Krempf M, Coulon M, Thiart R, Kotze MJ, Schmidt H, Buzzi JC, Kostner GM, Bertolini S, Pocovi M, Rosa A, Farnier M, Martinez M, Junien C, Boileau C. A third major locus for autosomal dominant hypercholesterolemia maps to 1p34.1-p32. Am J Hum Genet. 1999;64:1378-87. 48. Cenarro A, Pocovi M, Giraldo P, Garcia-Otin AL, Ordovas JM. Plasma lipoprotein responses to enzyme-replacement in Gaucher's disease. Lancet. 1999;353:642-3. 49. Joven J, Simo JM, Vilella E, Camps J, Masana L, de Febrer G, Camprubi M, Richart C, Bardaji A, Casao E, Pocovi M, Civeira F. Lipoprotein(a) and the significance of the association between platelet glycoprotein IIIa polymorphisms and the risk of premature myocardial infarction. Atherosclerosis. 1998;140:155-9. 50. Civeira F, Castillo JJ, Calvo C, Ferrando J, de Pedro C, Martinez-Rodes P, Pocovi M. Achilles tendon size by high resolution sonography in healthy population. Relationship with lipid levels. Med Clin (Barc). 1998;111:41-4. 51. Garcia-Ribes M, Gonzalez-Lamuno D, Hernandez-Estefania R, Colman T, Pocovi M, DelgadoRodriguez M, Garcia-Fuentes M, Revuelta JM. Polymorphism of the platelet glycoprotein IIIa gene in patients with coronary Stenosis. Thromb Haemost. 1998;79:1126-9. 52. Pocovi M, Cenarro A, Civeira F, Torralba MA, Perez-Calvo JI, Mozas P, Giraldo P, Giralt M, Myers RH, Cupples LA, Ordovas JM. Beta-glucocerebrosidase gene locus as a link for Gaucher's disease and familial hypo-alphalipoproteinaemia. Lancet. 1998;351:1919-23. 53. Cenarro A, Recalde D, Anibarro C, Albajar M, Martin I, Pocovi M, Rodriguez-Rey JC. Polymorphisms in the human apolipoprotein aiv gene detected by PCR and SSCP/heteroduplex analysis. Mol Cell Probes. 1998 ;12:117-20. 54. Mata P, Lopez-Miranda J, Pocovi M, Alonso R, Lahoz C, Marin C, Garces C, Cenarro A, Perez-Jimenez F, de Oya M, Ordovas JM. Human apolipoprotein A-I gene promoter mutation influences plasma low density lipoprotein cholesterol response to dietary fat saturation. Atherosclerosis. 1998;137:367-76. 55. Varret M, Rabes JP, Thiart R, Kotze MJ, Baron H, Cenarro A, Descamps O, Ebhardt M, Hondelijn JC, Kostner GM, Miyake Y, Pocovi M, Schmidt H, Schuster H, Stuhrmann M, Yamamura T, Junien C, Beroud C, Boileau C. LDLR Database (second edition): new additions to the database and the software, and results of the first molecular analysis. Nucleic Acids Res. 1998 ;26:248-52. 56. Giraldo P, Perez-Calvo JI, Giralt M, Pocovi M. Clinical characteristics of type I Gaucher's disease in Spain. Preliminary results of national Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 67 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años survey. Spanish Group on Gaucher's Disease Med Clin (Barc). 1997;109:619-22. 57. Virgos C, Martorell L, Valero J, Figuera L, Civeira F, Joven J, Labad A, Vilella E. Association study of schizophrenia with polymorphisms at six candidate genes. Schizophr Res. 2001;49:65-71. 58. Gomez-Gerique JA, Ros E, Olivan J, Mostaza JM, Vilardell M, Pinto X, Civeira F, Hernandez A, da Silva PM, Rodriguez-Botaro A, Zambon D, Lima J, Diaz C, Aristegui R, Sol JM, Chaves J, Hernandez G. Effect of atorvastatin and bezafibrate on plasma levels of C-reactive protein in combined (mixed) hyperlipidemia. Atherosclerosis. 2002;162:245-51. NODO 4 59. Vinals M, Martinez-Gonzalez J, Badimon JJ, Badimon L. HDL-induced prostacyclin release in smooth muscle cells is dependent on cyclooxygenase-2 (Cox-2). Arterioscler Thromb Vasc Biol. 17:3481-8; 1997 60. Martinez-Gonzalez J, Vinals M, Vidal F, Llorente-Cortes V, Badimon L. Mevalonate deprivation impairs IGF-I/insulin signaling in human vascular smooth muscle cells. Atherosclerosis. 135:213-23; 1997 61. Mata P, Varela O, Alonso R, Lahoz C, de Oya M, Badimon L. Monounsaturated and polyunsaturated n-6 fatty acid-enriched diets modify LDL oxidation and decrease human coronary smooth muscle cell DNA synthesis. Arterioscler Thromb Vasc Biol. 17:2088-95; 1997 62. Badimon L. Models to study thrombotic disorders. Thromb Haemost. 78:667-71; 1997 63. Badimon JJ, Meyer B, Feigen LP, Baron DA, Chesebro JH, Fuster V, Badimon L. Thrombosis triggered by severe arterial lesions is inhibited by oral administration of a glycoprotein IIb/IIIa antagonist. Eur J Clin Invest. 7:568-74; 1997 64. Toschi V, Gallo R, Lettino M, Fallon JT, Gertz SD, Fernandez-Ortiz A, Chesebro JH, Badimon L, Nemerson Y, Fuster V, Badimon JJ. Tissue factor modulates the thrombogenicity of human atherosclerotic plaques. Circulation. 95:594-9; 1997 65. Llorente-Cortés V, Martínez-González J, Badimon L.Esterified cholesterol accumulation induced by aggregated LDL is reduce by HMG-CoA reductase inhibitors in human vascular smoth muscle cells. Arteriosclerosis, Thrombosis and Vascular Biology 18: 738-746; 1998 66. Meyer BJ, Badimon JJ, Chesebro JH, Fallon JT, Fuster V, Badimon L. Dissolution of mural thrombus by specific thrombin inhibition with r-hirudin: comparison with heparin and aspirin. Circulation. 97:681-5; 1998 67. Vidal F, Colomé C, Martínez-González J, Badimon L.Atherogenic concentrations of native low density lipoproteins downregulate nitric oxide synthase mRNA and protein levels in endothelial cells.European Journal of Biochemistry 252: 378-384; 1998 68. Badimon JJ, Ortiz AF, Meyer B, Mailhac A, Fallon JT, Falk E, Badimon L, Chesebro JH, Fuster V. Different response to balloon angioplasty of carotid and coronary arteries: effects on acute platelet deposition and intimal thickening. Atherosclerosis. 140:307-14; 1998 69. Llorente V, Badimon L. Cellular and molecular bases of cholesterol accumulation in the vascular wall and its contribution to the progression of atherosclerotic lesion. Rev Esp Cardiol. 51:633-41; 1998 70. Varela O, Martinez-Gonzalez J, Badimon L. The response of smooth muscle cells to alphathrombin depends on its arterial origin: comparison among different species. Eur J Clin Invest. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 68 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 28:313-23; 1998 71. Palazon CP, Alfon J, Gaffney P, Berrozpe M, Royo T, Badimon L. Effects of reducing LDL and increasing HDL with gemfibrozil in experimental coronary lesion development and thrombotic risk. Atherosclerosis. 136:333-45; 1998 72. Royo T, Vidal M, Badimon L. Purification of the porcine platelets GP IIb/IIIa complex and propolypeptide of von Willebrand factor. Thrombosis and Haemostasis 80 (2): 302-309; 1998 73. Royo T, Vidal M, Badimon L. Porcine platelet von Willebrand Antigen II (vW AgII) : Inhibitory effect on collagen induced aggregation and comparative distribution with human platelets.Thrombosis and Haemostasis 80: 677-685; 1998 74. Badimon JJ, Lettino M, Toschi V, Fuster V, Berrozpe M, Chesebro JH, Badimon L. Local inhibition of tissue factor reduces the thrombogenicity of disrupted human atherosclerotic plaques. Effects of TFPI on plaque thrombogenicity under flow conditions. Circulation 99 : 1780-1787; 1999 75. Alfon J, Pueyo-Palazón C, Royo T, Badimon L. Effects of statins in thrombosis and aortic lesion development in a dyslipemic rabbit model. Thrombosis and Haemostasis 81: 822-827; 1999 76. Badimon L, Bayés-Genís A.Effects of progestogens on thrombosis and atherosclerosis Human Reproduction Update 5 (3): 191-199; 1999 77. Llorente-Cortés V, Martínez-González J, Badimon L Differential cholesteryl ester accumulation in two human vascular smooth muscle cell subpopulations exposed to aggregated LDL : Effect of PDGF-stimulation and HMG-CoA reductase inbition. Atherosclerosis 144 : 335-342; 1999 78. Badimon L, Martinez-Gonzalez J, Royo T, Lassila R, Badimon JJ. A sudden increase in plasma epinephrine levels transiently enhances platelet deposition on severely damaged arterial wall--studies in a porcine model. Thromb Haemost. 82:1736-42; 1999 79. Roque M, Badimon L, Badimon JJ. Pathophysiology of unstable angina. Thromb Res. 95:V514; 1999 80. Bayes-Genis A, Guindo J, Oliver A, Badimon L, Fiol M, Mateo J, Souto JC, Dominguez JM, Fontcuberta J, Bayes de Luna A. Elevated levels of plasmin-alpha2 antiplasmin complexes in unstable angina.Thromb Haemost. 81:865-8; 1999 81. Johnson GJ, Griggs TR, Badimon L. The utility of animal models in the preclinical study of interventions to prevent human coronary artery restenosis: analysis and recommendations. On behalf of the Subcommittee on Animal, Cellular and Molecular Models of Thrombosis and Haemostasis of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Thromb Haemost. 81:835-43; 1999 82. Colome C, Alonso R, Mata P, Badimon L. Effects of dietary fatty acids and vitamin E levels in HL-60 cell proliferation. Eur J Clin Invest. 29:129-38; 1999. 83. Alfon J, Guasch JF, Berrozpe M, Badimon L. NOSII gene expression correlates with atherosclerotic intimal thickening. Preventive effects of HMG-CoA reductase inhibitors.Atherosclerosis 145: 325-331; 1999 84. Alfon J, Royo T, García-Moll X, Badimon L. Platelet deposition on eroded vessel wall at stenotic shear rate is inhibited by lipid-lowering treatment with atorvastatin.Arteriosclerosis, Thrombosis and Vascular Biology 19(7) : 1812-1817; 1999 85. Badimon L. Dynamics and control of atherosclerotic plaque. Rev Neurol. 29(9):863; 1999 86. Viñals M, Martínez-González J, Badimon L. Regulatory effects of HDL on smooth muscle cell prostacyclin release. Arteriosclerosis Thrombosis and Vascular Biology 19: 2405-2411; 1999 87. Colomé C, Martínez-González J, Vidal F, de Castellarnau C, Badimon L. Small oxidative Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 69 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años changes in atherogenic LDL concentrations closely and irreversiblely regulate adhesiveness of human endothelial cells. Ffect of the lazaroid U74500A. Atherosclerosis 149 : 295-302; 2000 88. Llorente-Cortés V, Martínez-González J, Badimon L. LDL receptor-related protein mediates uptake of aggregated LDL in human vascular smooth muscle cells. Arteriosclerosis, Thrombosis and Vascular Biology 20: 1572-1579; 2000 89. Bayes-Genis A, Mateo J, Santaló M, Oliver A, Guindo J, Badimon L, Martínez-Rubio A, Fontcuberta J, Schwartz RS, Bayés de Luna A. D-dimer is an early diagnostic marker of coronary ischemia in patients with chest pain. American Heart Journal 140 (3); 379-384; 2000 90. Royo T, Alfon J, Berrozpe M, Badimon L Effect of gemfibrozil on peripheral atherosclerosis and platelet activation in a pig model of hyperlipidemia. European Journal of Clinical Investigation 30: 843-852; 2000 91. Pedreño J, Hurt-Camejo E, Wiklund O, Badimon L, Masana L. Platelet function in patients with familial hypertriglyceridemia : evidence that platelet reactivity is modulated by apolipoprotein E content of very-low-density lipoprotein particles. Metabolism 49 (7): 942-949; 2000 92. Hayes R, Chesebro JH, Fuster V, Dangas G, Fallon JT, Sharma SK, Coller BS,Badimon L, Marmur JD, Badimon JJ. Antithrombotic effects of abciximab. Am J Cardiol. 85:1167-72; 2000 93. Badimon L. Concluding remarks. Eur J Clin Invest. 30(S2):25; 2000 94. Rodriguez-Campos A, Ruiz-Enriquez P, Badimon L. Vascular smooth muscle cell p53 is lost before entering migration and proliferation. Arteriosclerosis, Thrombosis and Vascular Biology 21: 214-219; 2001 95. Martínez-González J, Llorente-Cortés V, Badimon L. Cellular and molecular biology of atherosclerotic lesions. Revista Española de Cardiologia 54: 218-231;2001 96. Rodriguez-Sinovas C, Martínez-González J, Sánchez-Gómez S, Badimon L. LDL downregulate CYP51 in vascular endothelial cells and in the arterial wall through a SREBP-2 dependent mechanism. Circulation Research 88: 268-274; 2001 97. Pedreño J, Hurt-Camejo E, Wiklund O, Badimon L, Masana L. Low-density lipoprotein (LDL) binds to a G-protein coupled receptor in human platelets. Evidence that the proaggregatory effect induced by LDL is modulated by down-regulation of binding sites and desensitization of its mediated signaling. Atherosclerosis 155: 99-112; 2001 98. Martínez-González J, Raposo B, Rodríguez C, Badimon L. 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibition prevents endothelial NO synthase downregulation by atherogenic levels of native LDLs. Balance between transcriptional and post-transcriptional regulation. Arteriosclerosis, Thrombosis and Vascular Biolgy 21: 804-809; 2001 99. Alonso R, Mata P, de Andres R, Villacastín BP, Martínez-González J, Badimon L Sustained long-term improvement of arterial endothelial function in heterozygous familial hypercholesterolemia patients treated with simvastatin Atherosclerosis 157 : 423-429; 2001 100. Badimon L. Atherosclerosis and thrombosis. Lessons from animal models. Thrombosis and Haemostasis 86: 356-365; 2001 101. Badimon L, Vilahur G, Sánchez S, Duran X. Atheromatous plaque formation and thrombogenesis : formation, risk factors and therapeutic approaches. European Heart J Supplements 3 (suppl I):I16-I22; 2001 102. Martínez-González J, Alfón J, Berrozpe M, Badimon L. HMG-CoA reductase inhibitors reduce vascular monocyte chemotactic protein-1 expression in early lesions from hypercholesterolemic swine independently of their effect on plasma cholesterol levels. Atherosclerosis 157 : 423-429; 2001. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 70 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 103. Martínez-González J, Berrozpe M, Varela O, Badimon L. Heterogeneity of smooth muscle cells (SMC) in advanced human atherosclerotic plaques : intimal SMC expressing a fibroblast surface protein are highly ativated by platelet-released products. European Journal of Clinical Investigation 31:939-49; 2001 104. Levi M, Dorffle-Melly J, Johnson GJ, Drouet L, Badimon L. Usefulness and limitations of animal models of venous thrombosis. Thromb Haemost. 86:1331-3; 2001 105. Badimon L. New challenges in the etiopathogenesis of atherothrombosis. Cerebrovasc Dis.11 Suppl 1:80-4; 2001 106. LLorente-Cortés V, Otero M, Hurt-Camejo E, Martínez-González J, Badimon L. Human coronary smooth muscle cells uptake versican-modified LDL through both the low density lipoprotein receptor-related protein and the LDL receptor. Arteriosclerosis, Thrombosis and Vascular Biology 22:387-93; 2002 107. Badimon L. Fisiopatología de los síndromes coronarios agudos. Papel de la rotura de la placa arteriosclerótica. Revista Española de Cardiologia (En prensa) NODO 5 108. Zambrana JL, Velasco F, Castro P, Concha M, et al. Comparison of bezafibrate vs lovastatin for lowering plasma insulin, fibrinogen, and plasminogen activator inhibitor-1 concentration y hyperlipemic heart transplant patients. Am J Cardiol 1997; 80:836-840. 109. Jansen S, López-Miranda J, et al. Effect of 360-His mutation in apolipoprotein A-IV on plasma HDL-cholesterol response to dietary fat. J Lipid Res 1997; 38:1995-2002. 110. Jansen S, López-Miranda J, et al. Effect of 347-Serine Mutation in Apoprotein A-IV on plasma LDL-C response to dietary Fat. Arterioscler Thromb Vasc Biol 1997; 17:1532-1538. 111. López-Miranda J, et al. Influence of the SstI Polymorphism at the Apolipoprotein C-III Gene on plasma LDL Cholesterol response to Dietary Fat. Am J Clin Nutr 1997; 66:97-103. 112. López-Miranda J, et al. Dietary Fat Clearance in normal subjects is modulated by genetic variation at the apolipoprotein B gen locus. Arterioscler Thromb Vasc Biol 1997; 17:17651773. 113. Ostos MA, López-Miranda J, et al. Dietary Fat Clearance is Modulated by Genetic Variation in Apolipoprotein A-IV Gene Locus. J Lipid Res 1998. 39:2493-2500. 114. Mata P, López-Miranda J, et al. Human apolipoprotein A-I gene promoter mutation influences plasma low density lipoprotein cholesterol response to dietary fat saturation. Atherosclerosis 1998; 137:367-376. 115. Salas J, Jansen S, López-Miranda J, et al. The Sst-I polymorphism of the apo C-III gene determines the insulin response after the oral glucose tolerance test when consuming a diet rich in saturated fats. Am J Clin Nutr 1998. 68:396-401. 116. Zambrana Jl, López-Miranda J, et al. Bezafibrate and Lovastatin decrease the oxiddizability of low density lipoproteins in hyperlipemic heart transplant patients. J Heart and Lung Transpl 1998; 17:1213-9. 117. Jansen S, López-Miranda J, et al. Plasma lipid response to hypolipidemic diets in young healthy non-obese men varies with body mass index. J Nutr 1998. 128:1144-1149. 118. Blanco-Molina A, Castro G, Martín-Escalante D, Bravo D, et al. Effects of different dietary cholesterol concentrations on lipoprotein plasma levels and on cholesterol efflux from Fu5AH cells. Am J Clin Nutr 1998; 68: 1028-33. 119. Jansen S, López-Miranda J, Salas J, Castro P, Paniagua JA, et al. Body mass index Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 71 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años determines plasma lipid response to hyperlipidemic diets in young healthy non obese males. J Nut 1998;128:1144-49. 120. Ruiz-Gutiérrez V, Morgano N, Prada JL, Pérez-jiménez et al. Composition of human VLDL triacylglicerols after ingestion of olive oil and high oleic sunflower oil. 1998; 128:570-76. 121. Ordovás JM, López-Miranda J, Mata P, Pérez-Jiménez F. Gene-envioronment in lipoprotein metabolism. Nutr Metab Cariovasc Dis 1998; 8:47-61. 122. Vallvé JC, Alonso-Villaverde C, Ribalta J, Pérez-Jiménez F, et al. Exon 4, and in particular codon 152 of the LDL receptor gene, is a hot sport for point mutations. Atherosclerosis 1998; 140:191-2 123. Pérez-Jiménez F, Castro P, López-Miranda J, et al. Circulating levels of endothelial function are modulated by dietary monounsaturated fat. Atherosclerosis 1999; 145:351-358. 124. Gonzalez-Amieva A, López Miranda J, Fuentes F, Castro P, et al. Genetic variations of the apolipoprotein E gene determine the plasma triglyceride levels after heart transplantation. J Heart Lung Transpl 2000; 19: 765-770. 125. Castro P, López-Miranda J, et al. Comparison of an oleic acid enriched-diet vs NCEP-I diet on LDL susceptibility to oxidative modification. Eur J Clin Nutr 2000; 54:61-7 126. Jansen S, López-Miranda J, Castro P, López F, et al. A low fat and a Mediterranean high monounsaturated fat diets decrease plasma cholesterol ester transfer protein concentrations in young normolipemic men. Am J Clin Nutr 2000; 72: 36-41. 127. Blanco A, Martín MD, Bravo D, Gonzáles JA, et al. HDL lipoproteins protect endothelial cells from apoptosis induced by oxidized LDLs. Protoplasma. 2000; 211:198-206. 128. Paniagua JA, López- Miranda J, at al. Metabolic control of type II diabetic patients increases in HDL3 binding activity. Metabolism 2000; 49:692-697. 129. López-Miranda J, Marín C, Castro P, Goméz P, at al. The effect of apolipoprotein XbaI polymorphism on plasma lipid response to dietary fat. Eur J Clin Invest 2000; 30: 678-684. 130. Ostos MA, López-Miramda J, Pérez-Jiménez F, et al. The apolipoprotein The AIV-360His polymorphism determines the dietary fat clearance in normal subjects. Atherosclerosis 2000; 153: 209-211. 131. Paniagua JA, Blanco J, Espino A, Jiménez JA, et al. Increased high-density lipoprotein-3 ninding to leukocytes following weigh loo and improved glycemic in type 2 diabetic patients. Metabolism 2000; 49:696-97. 132. Fuentes F, López-Miranda J, et al. Mediterranean and low-fat diets improve endothelial function in hypercholesterolaemic men. Ann Intern Med 2001; 134: 1115-1119. 133. López-Miranda J, Pinillos MD, Gómez P, Montilla P, et al. A Mediterranean and a highcarbohydrates diet improve glucose metabolism in healthy young persons. Diabetología 2001: 44:2038-43. 134. P. Pérez-Martínez, P. Gómez, E. Paz, C. Marín, E. Gavilán, J. López-Miranda, JM. Ordovás, R.A. Fernández de la Puebla, and F. Pérez-Jiménez. Interaction between smoking and the SstI polymorfism of the apo C-III gene determines plasma lipid response to diet. Nutr Metab Cardiovasc Dis 2001; 11:237-43. 135. Marín C, López-Miranda J, et al. Effects of the human apolipoprotein AI promoter G/A mutation on postprandial lipoprotein metabolism. Am J Clin Nutr 2002 (in press). 136. González Amieva A, López-Miranda J, Marín C, Pérez Martínez P, Gómez P, Paz-Rojas E, Arizón JM, Jiménez Perepérez JA, Concha M and Pérez-Jiménez F. The Apo AI gene promoter region polymorphism determines the severity of hiperlipidemia after heart transplantation. Clinical Transplantation 2002 (in press). 137. Pérez-Jiménez F, López-Miranda J, Gómez P, Velasco MJ, Marín C, Pérez-Martínez P, Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 72 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años Moreno JA, Paniagua JA. The SstI polymorphism of the apo CIII gene is associated with insulin sensitivity in young males. Diabetologia 2002 (in press). 138. Paniagua JA, López-Miranda J, Escribano A, Berral FJ, Marín C, bravo D, Paz-Rojas E, barcos M, Moreno JA, Pérez-Jiménez F. Cerivastatin improves insulin sensitivity and insulin secretion in early state obese type 2 diabetes mellitus. Diabetes 2002 (in press). 139. P Pérez-Martínez, Jose M Ordovas, J López-Miranda, P Gómez, C Marín, JA Moreno, F Fuentes, RA Fernández de la Puebla, F Pérez-Jiménez. Polymorphism exon 1 variant at the SRBI gene locus: influence on LDL cholesterol plasma levels during the comsumption of diets with different fat content in healthy subjects. Am J Clin Nutr 2002 (in press). 140. López-Miranda J, et al. Lipemia postprandial y arteriosclerosis. Clin Invest Arteriosclerosis 1997; 9:158-172. 141. Gonzalez-Amieva A, Zambrana JL, Lopez A, Concha M, López-Miranda J, et al. Influencia de la variación genética en la región promotora del gen de la apoproteina AI sobre los niveles de lípidos en pacientes trasplantados de Corazón. Med Clin 1998;111:321-4 142. López-Miranda J, et al. Interacción genes-dieta como determinante de los niveles plasmáticos de colesterol. Med Clin 1998; 111:546-551. 143. Martín Escalante MD, Blanco Molina A, López Miranda J, et al. Mecanismos antiaterogénicos de las HDL, independientes de su participación en el eflujo de colesterol. . Clin Invest Arteriosclerosis 1998;10:185-189. 144. Pérez-Jiménez F, Blanco A. HDL oxidada: otra cara de la misma moneda. Clin Invest Arteriosclerosis. Editorial. 1998; 10: 17-18 145. Zambrana JL, López-Miranda J, Pérez-Jimenez F. Hiperlipemia postrasplante cardiaco. Mecanismos patogénicos y tratamiento. Med Clin 1999;112:303-7. 146. Sánchez E, Jansen S, Castro P, Blanco A, López-Miranda J, et al. La dieta mediterránea mejora el perfil lipídico en los varones fumadores en comparación con la dieta recomendada por el programa Americano de Colesterol (NCEP-I). Med Clin (Barc) 1999;112:206-210. 147. Salas J, López Miranda J, Jansen S, Zambrana JL, Castro P, Paniagua J, Blanco A, Lópz F, JA Jiménez Perepérez, Pérez-Jiménez F. La dieta rica en grasa monoinsaturada modifica beneficiosamente el metabolismo de los carbohidratos y la presión arterial. Med Clin (Barc) 1999; 113:765-769. 148. Sánchez E, Jansen S, Castro P, Blanco A, et al. La dieta Mediterránea mejora el perfil lipídico en los varones fumadores, en comparación con la dieta recomendada por el programa de colesterol americano Med Clin (Barc) 1999; 112:206-210 149. Giménez R, Blanco A, Martínez L, Jiménez J, et al. Enfermedad por embolismo de colesterol: una rara complicación de la arterioesclerosis. Clin Invest Arterioescler 1999; 11:189-92. 150. Alfonso-Villaverde C, Sardá P, Vallvé J, Heras M, et al. Manifestaciones clínicas de la hipercolesterolemia familiar en una población mediterránea. Med Clin (Barc) 1999; 113:521525. 151. Salas J, López Miranda J, Jansen S, Zambrana JL, et al. La dieta rica en grasa monoinsaturada modifica beneficiosamente el metabolismo de los carbohidratos y la presión arterial. Med Clin (Barc) 1999; 113:765-769 152. Pérez Jiménez F, Fernández Dueñas A, López Miranda J, Jiménez Perepérez JA. El aceite de oliva: alimento saludable desde la época califal al umbral del nuevo milenio. Med Clin (Barc) 2000;114:219-21. 153. López Miranda J, Gómez P, Castro P, Marín C; Paz E, Bravo MD, Blanco J, Jiménez J, Fuentes F, Pérez-Jiménez F. La dieta mediterránea mejora la resistencia a la oxidación de las Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 73 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años lipoproteinas de baja densidad. Med Clin (Barc) 2000; 115:361-365 154. Pérez-Jiménez F, Pérez Martinez P, López-Miranda J. Grasa de la dieta y riesgo de arteriosclerosis. Clin Invest Arteriosclerosis 2000; 12 (supl 2): 13-19. 155. Pérez-Jiménez F, López-Miranda J. Aceite de Oliva y riesgo cardiovascular. JANO 2000: 12-16. 156. Fernandez Puebla R, Ceballos P, Pérez Martínez P, Carmona J, López-Miranda J, et al. Actividad coagulante del factor VII (FVIIc) en ancianos con cardiopatía isquémica. Med Clin 2000; 115:654-657. 157. Plaza I, Villar F, Mata P, Pérez-Jiménez F, et al. Control de la colesterolemia en España, 2000. Un instrumento para la prevención cardiovascular. Rev Esp Cardiol. 2000; 53: 815-837. 158. Fernández de la Puebla RA, Carmona J, Fuentes F, Marín C, Gomez P, López-Miranda, Pérez-Jiménez F. Grado de la respuesta del colesterol LDL a la alimentación en varones sanos con hipercolesterolemia según sus valores basales. Med Clin (Barc) 2002 (in press). 159. Fuentes F, de la Torre J, Pérez-Jiménez F. Lipodistrofias. Med Clin 2002 (in press). NODO 6 160. Vázquez M, Zambón D, Hernández Y, Adzet T, Merlos M, Ros E, Laguna JC. Lipoprotein composition and oxidative modification during therapy with gemfibrozil and lovastatin in patients with combined hyperlipidemia. br j clin pharmacol 1998;45:265-269. 161. Sanllehy C, Casals E, Rodríguez-Villar C, Zambón D, Ojuel J, Ballesta AM, Ros E. Lack of interaction of apolipoprotein E phenotype with the lipoprotein response to lovastatin or gemfibrozil in patients with primary hypercholesterolemia. Metabolism 1998;47:560-565. 162. Zambón D, Ros E, Rodríguez-Villar C, Laguna JC, Vázquez M, Sanllehy C, Casals E, Sol JM, Hernández 163. G. Randomized crossover study of gemfibrozil versus lovastatin in familial combined hyperlipidemia: 164. Additive effects of combination treatment on lipid regulation. Metabolism 1999;48:47-54. 165. Alonso-Villaverde C, Sardà P, Vallbé JC, Heras M, Pérez-Jiménez F, Pedro-Botet JC, Ros E, Masana L . Manifestaciones clínicas de la hipercolesterolemia familiar en una población mediterránea. Med Clin (Barc) 1999;113:521-525. 166. Ros E. Digestión y absorción de las grasas. Posibilidades de modulación dietética y farmacológica. Med Clin (Barc) 1999;113:337-348. 167. Cofán F, Zambón D, Rodríguez C, Laguna JC, Vázquez M, Casals E, Torregrosa J, Ros E, Oppenheimer F. Fatty acid composition in low-density lipoproteins from renal transplant recipients. Tansplant Proc 1999;31:2330-2332. 168. Cofán F, Zambón D, Rodriguez C, Laguna JC, Vázquez M, Casals E, Torregrosa J, Ros E, Oppenheimer F. Oxidation of low-density lipoproteins in renal transplant recipients. Tansplant Proc 1999;31:2333-2334. 169. Zambón D, Sabaté J, Muñoz S, Campero B, Casals E, Merlos M, Laguna JC, Ros E. Substituting walnuts for monounsaturated fat improves the serum lipid profile of hypercholesterolemic men and women. A randomized crossover trial. Ann Intern Med 2000;132:538-546. 170. Mozas P, Cenarro A, Civeira F, Castillo S, Ros E, Pocovi M. Mutation analysis in 36 unrelated Spanish subjects with familial hypercholesterolemia: Identification of three novel mutations in the LDL receptor gene. Hum Mutat 2000;15:483-484. (Mutation in Brief #326 Online). Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 74 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 171. Couch SC, Cross AT, Kida K, Ros E, Plaza I, Shea S, Deckelbaum R. Rapid "westernization" of children’s blood cholesterol levels in 3 countries: evidence for nutrient-gene interactions? Am J Clin Nutr 2000;72(supl):1266S-1274S. 172. Rodríguez-Villar C, Manzanares JM, Casals E, Pérez-Heras A, Zambón D, Gomis R, Ros E. High-monounsaturated fat, olive oil-rich diet has effects similar to a high-carbohydrate diet on fasting and postprandial state and metabolic profiles of patients with type 2 diabetes. Metabolism 2000;49:1511-1517. 173. Ros E. Intestinal absorption of triglyceride and cholesterol. Dietary and pharmacological inhibition to reduce cardiovascular risk. Atherosclerosis 2000; 151:357-379. 174. Cofán F, Núñez I, Gilabert R, Zambón D, Ros E, Cofán M, Muray S, Mansilla E, Bru C, Oppenheimer F. Increased prevalence of carotid and femoral atherosclerosis in renal transplant recipients. Transplant Proc 2001;33:1254-1256. 175. Castell C, Ros E, Pintó X, Vilaseca J, Martín-Zurro A. Cribado de la hipercolestrerolemia en las personas mayores. En nº monográfico: Actividades preventivas en las personas mayores. Salleras Ll, ed. Med Clin 2001;116 (supl. 1):50-58. 176. Ros E. Susceptibilidad de las lipoproteínas de baja densidad a la oxidación y dieta mediterránea (ed). Med Clin (Barc) 2000;115:379-380. 177. Ros E. Introducción a los alimentos funcionales (ed). Med Clin (Barc) 2001;116: 617-619. 178. Muñoz S, Merlos M, Zambón D, Rodríguez C, Sabaté J, Ros E, Laguna JC. A walnutenriched diet increases the association of LDL from hypercholesterolemic men to human hepatoma HEPG2 cells. J Lipid Res 2001; 42:2069-2076. 179. Mozas P, Galetto R, Albajar M, Ros E, Pocoví M, Rodríguez-Rey JC. A mutation (-49C>T) in the promoter of the low density lipoprotein receptor gene associated with incomplete dominance of familial hypercholesterolemia. J Lipid Res 2002;43: 13-18. 180. Elizalde JI, Piqué JM, Moreno V, Morillas JD, Elizalde I, Bujanda L, de Argila CM, Cosme A, Castiella A, Ros E. Influence of Helicobacter pylori infection and eradication on blood lipids and fibrinogen. Aliment Pharmacol Ther 2002;16: 577-586. 181. Cofan F, Zambon D, Laguna JC, Ros E, Casals E, Cofan M, Campistol JM, Oppenheimer F. Fatty acid composition of low-density lipoprotein in renal transplant recipients treated with cyclosporine. Transplant Proc 2002;34:374-376. 182. Cofan F, Zambon D, Laguna JC, Ros E, Casals E, Cofan M, Campistol JM, Oppenheimer F. Oxidation of low-density lipoproteins in renal transplant recipients treated with tacrolimus. Transplant Proc 2002;34:377-378. 183. Cofan F, Gilabert R, Zambon D, Nunez I, Ros E, Cofan M, Campistol JM, Bru C, Oppenheimer F. Effect of pravastatin treatment on the evolution of extracoronary atherosclerosis in renal transplant patients. Transplant Proc 2002;34:384-388. 184. Cofan F, Zambon D, Laguna JC, Casals E, Ros E, Cofan M, Campistol JM, Oppenheimer F. Pravastatin improves low-density lipoprotein oxidation in renal transplantation. Transplant Proc 2002;34:389-391. 185. Cofan F, Gilabert R, Nunez I, Zambon D, Ros E, Casals E, Cofan M, Muray S, Campistol JM, Bru C, Oppenheimer F. Influence of renal post-transplantation dyslipidemia on the degree and severity of carotid and femoral atherosclerosis evaluated by B-mode ultrasound. Transplant Proc 2002;34:412-414. 186. Gómez-Gerique JA, Ros E, Oliván J, Mostaza JM, Vilardell M, Pintó X, Civeira F, Hernández A, Marqués da Silva P, Rodriguez-Botaro A, Zambón D, Lima J, Díaz C, Aristegui R, Sol JM, Chaves J, Hernández G, for the ATOMIX Investigators. Effect of atorvastatin and bezafibrate on plasma levels of C-reactive protein in combined (mixed) hyperlipidemia. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 75 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años Atherosclerosis 2002;162: 245-251. NODO 7 187. Pena R, Lahoz C, Mostaza JM, Jimenez J, Subirats E, Pinto X, Taboada M, Lopez-Pastor A. Effect of apoE genotype on the hypolipidaemic response to pravastatin in an outpatient setting. J Intern Med. 2002 Jun;251(6):518-525. 188. Gomez-Gerique JA, Ros E, Olivan J, Mostaza JM, Vilardell M, Pinto X, Civeira F, Hernandez A, da Silva PM, Rodriguez-Botaro A, Zambon D, Lima J, Diaz C, Aristegui R, Sol JM, Chaves J, Hernandez G. Effect of atorvastatin and bezafibrate on plasma levels of C-reactive protein in combined (mixed) hyperlipidemia. Atherosclerosis. 2002 Jun;162(2):245-51. 189. Salazar A, Mana J, Pinto X, Argimon JM, Hurtado I, Pujol R. Corticosteroid therapy increases HDL-cholesterol concentrations in patients with active sarcoidosis and hypoalphalipoproteinemia. Clin Chim Acta. 2002 Jun;320(1-2):59-64. 190. Salazar A, Pinto X, Mana J. Serum amyloid A and high-density lipoprotein cholesterol: serum markers of inflammation in sarcoidosis and other systemic disorders. Eur J Clin Invest. 2001 Dec;31(12):1070-7. 191. Meco JF, Vila R, Pujol R, Bros R, Domenech P, Fiol C, Pinto X. Improvement in endothelial dysfunction in patients with hypoalphalipoproteinemia and coronary artery disease treated with bezafibrate. J Cardiovasc Pharmacol. 2001 Aug;38(2):250-8. 192. Iraculis E, Cequier A, Sabate M, Pinto X, Antoni Gomez-Hospital J, Mauri J, Garcia Del Blanco B, Fernandez-Nofrerias E, Palom X, Jara F, Esplugas E. [Improvement of endothelial function in patients with hypercholesterolemia and normal coronary arteries with lipid-lowering therapy. Rev Esp Cardiol. 2001 Jun;54(6):685-92. Spanish. 193. Pena R, M Mostaza J, Lahoz C, Jimenez J, Subirats E, Pinto X, Taboada M, Lopez-Pastor A, del Estudio RAP g. Apolipoprotein E polymorphism and coronary disease. Med Clin (Barc). 2001 May 19;116(18):681-5. 194. Formiga F, Meco JF, Pinto X, Jacob J, Moga I, Pujol R. Lipid and lipoprotein levels in premenopausal systemic lupus erythematosus patients. Lupus. 2001;10(5):359-63. 195. Ballantyne CM, Pazzucconi F, Pinto X, Reckless JP, Stein E, McKenney J, Bortolini M, Chiang YT. Efficacy and tolerability of fluvastatin extended-release delivery system: a pooled analysis. Clin Ther. 2001 Feb;23(2):177-92. 196. Pinto X, Vilaseca MA, Garcia-Giralt N, Ferrer I, Pala M, Meco JF, Mainou C, Ordovas JM, Grinberg D, Balcells S. Homocysteine and the MTHFR 677C--&gt;T allele in premature coronary artery disease. Case control and family studies. Eur J Clin Invest. 2001 Jan;31(1):24-30. 197. Salazar A, Mana J, Fiol C, Hurtado I, Argimon JM, Pujol R, Pinto X. Influence of serum amyloid A on the decrease of high density lipoprotein-cholesterol in active sarcoidosis. Atherosclerosis. 2000 Oct;152(2):497-502. 198. Meco JF, Pinto X, Quintana E, Fiol C, Castineiras MJ, Pujol R. Efficacy of hygienic and dietary therapy in coronary patients with isolated hypoalphalipoproteinemia. An Med Interna. 1999 Dec;16(12):620-5. 199. Pinto X. Genes, hypercholesterolaemia and carotid atherosclerosis. Eur J Clin Invest. 1998 Dec;28(12):980-2. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 76 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 200. Meco JF, Pinto X, Escriba JM, Vela M, Jara F, Pallares C, Castineiras MJ, Pujol R. Cardiovascular risk factors associated with clinically isolated and diffuse atherosclerosis in Spanish patients with coronary artery disease. Eur J Clin Invest. 1998 Aug;28(8):643-50. 201. Salazar A, Mana J, Pinto X, Argimon JM, Castineiras MJ, Fiol C, Pujol R. Low levels of high density lipoprotein cholesterol in patients with active sarcoidosis. Atherosclerosis. 1998 Jan;136(1):133-7. 202. Blanco-Vaca F, Qu SJ, Fiol C, Fan HZ, Pao Q, Marzal-Casacuberta A, Albers JJ, Hurtado I, Gracia V, Pinto X, Marti T, Pownall HJ. Molecular basis of fish-eye disease in a patient from Spain. Characterization of a novel mutation in the LCAT gene and lipid analysis of the cornea. Arterioscler Thromb Vasc Biol. 1997 Jul;17(7):1382-91. 203. Pinto X, Fiol C, Simeon JM, Capdevila JM, Barjau E, Argimon JM, Moga I, Pujol R. Risk factors of arteriopathy of the lower extremities: lipid and not lipid Factors. Med Clin (Barc). 1997 Jun 7;109(2):41-4. 204. Brotons C, Server M, Pinto X, Roura P, Martin-Zurro A. Impact of consensus conferences of hypercholesterolemia and hypertension in Spain. Med Clin (Barc). 1997 Jan 11;108(1):9-15. NODO 8 205. M. Vázquez, D. Zambón, Y. Hernández, T. Adzet, M. Merlos, E. Ros, J.C. Laguna. Lipoprotein composition and oxidative modification during therapy with gemfibrozil and lovastatin in patients with combined hyperlipidaemia Br. J. Clin. Pharmacol 1998; 45: 265-269. 206. MJBM Vervoordelonk, Gerda SAT Van Rosumm, RM Sánchez, FW neys, H. Van den Bosch. Half-life of interleukin-1b-inducedgroup II phospholipase A2 in rat mesangial cells. Biochim. Biophys Acta 1997; 1355: 315-322. 207. M. Vázquez, M. Merlos, T. Adzet, J.C. Laguna. Influence of lipid profile and fatty acid composition on the oxidation behavior of rat and guinea pig low density lipoprotein. Comp. Biochem. Physiol. 1998;119: 311-316 208. M. Alegret, J.C. Verd, C. Díaz, G. Hernández, T. Adzet, R.M. Sánchez, J.C. Laguna. Effect of hypolipidemic drugs on key enzyme activities related to lipid metabolism in normolipidemic rabbits Eur.J.Pharmacol 1998;347: 283-291. 209. D Zambón, E Ros, C Rodríguez-Villar, JC Laguna, M Vázquez, C Sanllehy, E Casals, JM Sol, G Hernández. Randomized crossover study of gemfibrozil versus lovastatin in familial combined hyperlipidemia: Additive effects of combination treatment on lipid regulation. Metabolism 1999; 48: 47-54 210. A. Cabrero, G. Llaverías, N. Roglans, M. Alegret, R. Sánchez, T. Adzet, J. C. Laguna, M. Vázquez. Uncoupling protein-3 mRNA levels are increased in white adipose tissue and skeletal muscle of bezafibrate-treated rats Biochem. Biophys. Res. Commun. 1999; 260: 547-556. 211. A. Cabrero, M. Alegret, R. Sánchez, T. Adzet, J. C. Laguna, M. Vázquez. Etomoxir, sodium 2[6-(4-chlorophenoxy)hexyl]oxirane-2-carboxylate, up-regulates uncoupling protein-3 mRNA levels in primary culture of rat preadypocites Biochem. Biophys. Res. Commun.1999; 263, 8793. 212. J.C. Verd, C. Peris, M. Alegret, C. Díaz, G. Hernández, T. Adzet, J.C. Laguna, R.M. Sánchez. Different effect of simvastatin and atorvastatin on key enzymes involved in VLDL synthesis and catabolism in high fat/cholesterol fed rabbits Br.J.Pharmacol 1999;127:14791485. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 77 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 213. A. Cabrero, M. Alegret, R. Sánchez, T. Adzet, J. C. Laguna, M. Vázquez. PPAR-alfa activators, Bezafibrate and Wy-14,643, increase uncoupling protein-3 mRNA levels without modifying the mitochondrial membrane potential in primary culture of rat preadipocytes. Arch. Biochem. Biophys.2000;380:353-359 214. Rodríguez C., Noé V., Cabrero A., Ciudad C.J., Laguna J.C. Differences in the formation of PPARα-RXR/acoPPRE complexes between responsive and nonresponsive species upon fibrate administration. Mol. Pharmacol. 2000;58:185-193 215. Zambon D; Sabate J; Muñoz S; Campero B; Casals E; Merlos M; Laguna JC; Ros E. Substituting walnuts for monounsaturated fat improves the serum lipid profile of hypercholesterolemic men and women - A randomized crossover trial. Ann. Intern. Med. 2000; 132:538-546 216. Cabrero, M. Alegret, R. Sánchez, T. Adzet, J. C. Laguna, M. Vázquez. Down regulation of uncoupling protein-3 and –2 by thiazolidinediones in C2C12 myotubes. FEBS Lett.2000; 484: 37-42 217. Pedraza, N.; Solanes, G.; Carmona, M.C;Iglesias, R.; Viñas, O.; Mampel, T.; Vazquez, M.; Giralt, M.; Villarroya, F. Impaired expression of the uncoupling protein-3 gene in skeletal muscle during lactation. Fibrates and troglitazone reverse lactation-induced down-regulation of the uncoupling protein-3 gene. Diabetes 2000; 49:1224-1230. 218. Pedraza, N.;Solanes, G.; Iglesias, R.;Vázquez, M.; Giralt, M.; Villarroya, F. Differential regulation of expression of genes encoding uncoupling proteins 2 and 3 in brown adipose tissue during lactation in mice. Biochemical Journal 2001; 3355, 105-111. 219. M. Vazquez, N. Roglans, A. Cabrero, C. Rodriguez, T. Adzet, M. Alegret, R.M. Sanchez, J.C. Laguna. Bezafibrate induces acyl-CoA oxidase mRNA levels and fatty acid peroxisomal beta-oxidation in rat white adipose tissue. Mol. Cell. Biochem. 2001; 216: 71-78. 220. C. Rodríguez, A. Cabrero, N. Roglans, T. Adzet, R.M. Sánchez, M. Vázquez, C.J.Ciudad, J.C. Laguna. Differential induction of stearoyl-CoA desaturase and acyl-CoA oxidase genes by fibrates in HepG2 cells Biochem. Pharmacol.2001; 61: 357-364 221. N. Roglans, C. Peris, J.C. Verd, M. Alegret, M. Vázquez, R.M. Sánchez, J.C. Laguna. Increase in hepatic expression of SREBP-2 by gemfibrozil administration to rats. Biochem. Pharmacol.2001; 62: 803-809. 222. Cabrero A., Alegret M., Sánchez R.M., Adzet A., Laguna J.C., Vázquez M. Uncoupling protein-3 mRNA up-regulation in C2C12 myotubes after etomoxir treatment. Biochim. Biophys. Acta 2001;1532:195-202. 223. Cabrero A., Alegret M., Sánchez R.M., Adzet A., Laguna J.C., Vázquez Carrera M.. Bezafibrate reduces mRNA levels of adipocyte markers ans increases fatty acid oxidation in primary culture of adipocytes. Diabetes 2001;50:1883-1890. 224. Muñoz S, Merlos M, Zambón D, Rodriguez C, Sabate J, Ros E, Laguna JC. Walnutenriched diet increases the association of LDL from hypercholesterolemic men with human HepG2 cells. J. Lipid Res. 2001;42:2069-2076 225. Cabrero A., Alegret M., Sánchez R.M., Adzet A., Laguna J.C., Vázquez Carrera M.. Increased reactive oxygen species production down-regulates peroxisome proliferator-activated α pathway in C2C12 skeletal muscle cells. J. Biol. Chem., 2001; 277: 10100-10107. 226. N. Roglans, E. Sanguino, C. Peris, M. Alegret, M. Vázquez, T. Adzet, C. Díaz, G. Hernández, J.C. Laguna, R.M. Sánchez. Atorvastatin treatment induced peroxisome proliferator-activated receptor α expression and decreased plasma nonesterified fatty acids and liver triglyceride in fructose-fed rats. J. Pharmacol. Exp. Ther. 2002;302 (en prensa) 227. N. Roglans, J.C. Verd, C. Peris, M. Alegret, M. Vázquez, T. Adzet, C. Díaz, G. Hernández, Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 78 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años J.C. Laguna, R.M. Sánchez. High doses of atorvastatin and simvastatin induce key enzymes involved in VLDL production. Lipids 2002;37 (aceptado en prensa) NODO 9 228. La hiperhomocisteinemia, un nuevo marcador de riesgo vascular: territorios vasculares afectados, papel en la patogénesis de la arteriosclerosis y la trombosis y tratamiento. A. Córdoba, F. Blanco Vaca, F. González Sastre. Medicina Clínica 1997; 109: 715-725. 229. Role of neuropeptides in heart failure: Preliminary information or knowledge?. Martínez A, Wägner AM, Ordóñez J. (Editorial) Eur J Clin Invest 2000;30:561-562. 230. Role of apoA-II in lipid metabolism and atherosclerosis. Advances in the study of an enigmatic protein. F. Blanco-Vaca, J.C. Escolà-Gil, J.M. Martín-Campos, J. Julve. Journal of Lipid Research 2001; 42: 1727-1739. 231. Guindo J, Santaló M, Ordóñez J. Marcadores biológicos de daño miocárdico. Utilidad en el síndrome coronario agudo. Medicina Clínica 2002 (en prensa). 232. Puig T, Bolíbar I, Marzo M y grupo de trabajo Picmalcor (J. Ordóñez). Medicina Clínica 2002 (en prensa). 233. Calculation of LDL cholesterol using apolipoprotein B for phenotypical classification of non-chylomicronemic dyslipemia. Planella T, Cortés M, Martínez C, González-Sastre F. Clinical Chemistry 1997; 43: 808-815. 234. LDL from aerobically-trained subjects shows higher resistance to oxidative modification than LDL from sedentary subjects. Sánchez-Quesada JL, Ortega H, Payés-Romero A, SerratSerrat J, González-Sastre F, Lasunción MA, Ordóñez-Llanos J. Atherosclerosis 1997; 132: 207213. 235. Improvement of glycemic control in diabetes decreases the atherogenic small dense LDL particles. Caixàs A, Ordóñez J, de Leiva A, Payés A, Rigla M, Homs R, Pérez A. Diabetes 1997; 46: 1207-1213. 236. Molecular basis of Fish Eye Disease in a patient from Spain: characterization of a novel mutation in the LCAT gene and lipid analysis of the cornea. F. Blanco-Vaca, S.-J. Qu, C. Fiol, H.-Z. Fau, À. Marzal, I. Hurtado, V., Gracia, X. Pintó, T. Martí, H.J. Pownall. Arteriosclerosis, Thrombosis and Vascular Biology 1997; 17: 1382-1391. 237. Effect of intensive insulin therapy using a short-acting analog (insulin Lispro) vs regular insulin on lipid metabolism in IDDM. Caixàs A, Pérez A, Payés A, Otal C, Carreras G, Ordóñez-Llanos J, Reviriego J, Anderson J, de Leiva A. Metabolism 1998; 47: 371-376. 238. Plasma lipoprotein (a) levels are not influenced by glycemic control in insulin-dependent diabetes. Pérez A, Carreras G, Caixàs A, Castellví A, Caballero A, Bonet R, Ordóñez-Llanos J, de Leiva A. Diabetes Care 1998; 21: 1517-1520. 239. Ascorbic acid inhibits the increase of LDL susceptibility to oxidation and electronegative LDL proportion induced by intense aerobic exercise. Sánchez-Quesada JL, Jorba Ò, PayésRomero A, Otal C, González-Sastre F, Ordóñez-Llanos J. Coronary Artery Disease 1998; 9: 249-255. 240. Human apolipoprotein A-II is a pro-atherogenic molecule when it is expressed in transgenic mice at a level similar to that in humans: evidence of a potentially relevant species-specific interaction with diet. J.C. Escolà, À. Marzal, J. Julve, B.Y. Ishida, J. Ordóñez, L. Chan, F. González-Satre, F. Blanco-Vaca. Journal of Lipid Research 1998; 39: 457-462. 241. Plasma homocysteine is related to albumin excretion rate in patients with diabetes mellitus. A new link between diabetic nephropathy and cardiovascular disease? A. Chico, A. Pérez, A. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 79 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años Córdoba, R. Arcelus, G. Carreras, A. de Leiva, F. González-Sastre, F. Blanco-Vaca. Diabetologia 1998; 41: 684-693. 242. Molecular diagnosis of lecithin:cholesterol acyltransferase deficiency in a presymptomatic proband. S. Cirera, J. Julve, I. Ferrer, C. Mainou, R. Bonet, J.M. Martín-Campos, F. GonzálezSastre, F. Blanco-Vaca. Clinical Chemistry and Laboratory Medicine 1998; 36: 443-448. 243. Identification of a novel mutation in exon 5 of the multiple endocrine neoplasia type I gene. A. Chico, L. Gallart, E. Mato, C. Mayoral, J.M. Martín-Campos, L. Catassús, J. RodríguezEspinosa, X. Matías-Guiu, F. Blanco-Vaca, A. de Leiva. Journal of Molecular Medicine 1998; 76: 837-839. 244. Moderate hyperhomocysteinemia is a high prevalent defect in spanish patients with venous thromboembolic disease. Y. González, J.C. Souto, J. Mateo, A. Córdoba, F. Blanco-Vaca, J. Fontcuberta. Haematologica 1998; 83: 1126-1127. 245. Free cholesterol deposition in corneas of human apoA-II transgenic mice with functional LCAT deficiency. J. Julve, E. Ruiz-Pérez, À. Marzal, J.C. Escolà, F. González-Sastre, F. Blanco-Vaca. Metabolism 1999; 48: 415-421. 246. Pitfalls of direct high-density lipoprotein cholesterol measurements in mouse models of hyperlipidemia and atherosclerosis. J.C. Escolà-Gil, O. Jorba, J. Julve-Gil, F. González-Sastre, J. Ordóñez-Llanos, F. Blanco-Vaca. Clinical Chemistry 1999; 45: 1567-1569. 247. AM Wägner, A Pérez, F Calvo, R Bonet, A Castellví, J Ordóñez. Apolipoprotein B identifies dyslipidemic phenotypes associated with cardiovascular risk in normocholesterolemic type 2 diabetic patients. Diabetes Care 1999; 22 (5): 812-17. 248. Simvastatin decreases the proportion of electronegative LDL in hypercholesterolemic patients. C. Otal, J.L. Sánchez Quesada, O. Jorba, M. Franco, E. Alonso, R. Bonet, F. González Sastre, F. Blanco-Vaca, J. Ordóñez American Journal of Cardiology 1999; 84: 655-659. 249. Distribution of oleoyl-estrone in rat plasma lipoproteins.Virgili J, Casals J, Peinado-Onsurbe J, Esteve M, Julve-Gil J, Fernández-López A, Remesar X, Alemany M. Horm Metabol Res 1999; 31: 597-601. 250. Molecular pathology of the multiple endocrine neoplasia type I (MEN1): report of two novel germline mutations and updated classification of mutations affecting the MEN1 gene. J.M. Martín-Campos, Ll. Catasús, A. Chico, C. Mayoral, E. Lagarga, L. Gallart, E. Mato, J. Rodríguez-Espinosa, X. Matías-Guiu, A. de Leiva, F. Blanco-Vaca. Diagnostic Molecular Pathology 1999; 8: 195-204. 251. Plasma homocysteine levels in patients with the nephrotic syndrome. J. Joven, R. Arcelus, J. Camps, J. Ordóñez-Llanos, E. Vilella, F. González-Sastre, F. Blanco-Vaca. Journal of Molecular Medicine 2000; 78: 147-154. 252. Effect of physical exercise on lipoprotein (a) and LDL modifications in type 1 and type 2 diabetic patients. Rigla M, Sánchez-Quesada JL, Ordóñez-Llanos J, Prat T, Caixàs A, Jorba Ò, Serra JR, de Leiva A, Pérez A. Metabolism 2000; 49: 640-644. 253. Effects of fasting on hepatic lipase activity in the liver of the developing rat. PeinadoOnsurbe J, Julve J, Galan X, Llobera M, Ramirez I. Biology Neonate 2000; 77: 131-138. 254. Usefulness of the I/D angiotensin-converting enzyme genotype for detecting the risk of left ventricular hypertrophy in pharmacologically treated hypertensive men. J. López Contreras, F. Blanco-Vaca, X. Borrás, F. Carreras, G. Pons-Lladó, F. Gallego, M.J. Solé, S. Cirera, M.T. Benet, E. Negredo, A. Roca-Cusach. Journal of Human Hypertension 2000; 14: 327-331. 255. Comparison of the Abbott IMx and a high-performance liquid chromatography method for measuring total plasma homocysteine. F. Blanco-Vaca, R. Arcelús, F. González-Sastre, J.M. Queraltó-Companyó. Clinical Chemistry and Laboratory Medicine 2000; 38: 327-329. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 80 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 256. Expression of human apolipoprotein (apo) A-II in apoE-deficient mice induces features of familial combined hyperlipidemia gene. J.C. Escolà-Gil, J. Julve-Gil, À. Marzal-Casacuberta, J. Ordóñez-Llanos, F. González-Sastre, F. Blanco-Vaca. Journal of Lipid Research 2000; 41: 1328-1338. 257. Electronegative LDL (LDL(-)) from normolipemic subjects induces interleukin-8 and monocyte chemotactic protein secretion by human endothelial cells. Arterioscler, Thromb and Vasc Biol 2000; 20: 2281-2287. De Castellarnau C, Sánchez-Quesada, Benitez S, Rosa R, Caveda L, Vila L, Ordóñez-Llanos J. 258. Increased production of very-low-density lipoproteins in transgenic mice overexpressing human apolipoprotein A-II. J. Julve-Gil, J.C. Escolà-Gil, À. Marzal-Casacuberta, J. OrdóñezLlanos, F. González-Sastre, F. Blanco-Vaca. Biochimica Biophysica Acta, 2000; 1488: 233244. 259. Inaccuracy of calculated LDL cholesterol in type 2 diabetes: consequences for patient risk classification and therapeutic decisions. A.M. Wägner, J.L. Sánchez-Quesada, A. Pérez, M. Rigla, M. Cortés, F. Blanco-Vaca, J. Ordóñez-Llanos Clinical Chemistry 2000; 46: 1830-1832. 260. Anomalous lipoproteins in obese Zucker rats. Peinado-Onsurbe J, Blay M, Julve J, Rodriguez V, Fernández-López JA; Remesar X, Alemany M. Diabetes, Obesity and Metabolism 2001; 3: 259-270. 261. Homocyst(e)ine and the C677T mutation of the methylenetetrahydrofolate reductase in survivors of premature myocardial infarction. C. Virgos, J. Joven, J.M. Simó, E. Vilella, J. Camps, R. Arcelús, F. Blanco-Vaca, L. Figuera, L. Martorell. Clinical Biochemistry 2000; 33: 509-512 262. Genetic susceptibility to thrombosis and its relationship with physiological risk factors: the GAIT Study. J.C. Souto, L. Almasy, M. Borrell, F. Blanco-Vaca, J. Mateo, J.M. Soria, I. Coll, I. Coll, R. Felices, W. Stone, J. Fontcuberta, J. Blangero. American Journal of Human Genetics 2000; 67: 1452-1459. 263. Which cholesterol are we measuring with Roche's direct, homogenous LDL-C Plus assay?. J. Ordóñez-Llanos, A. Wägner, R. Bonet-Marqués, J.L. Sánchez-Quesada, F. Blanco-Vaca, F. González-Sastre Clinical Chemistry, 2001; 47: 124-126. 264. Expression of human apolipoprotein A-II in cholesteryl ester transfer protein mice causes severe hypertriglyceridemia due to increased VLDL-triglyceride production and impaired VLDL-triglyceride clearance. J.C. Escolà-Gil, J. Julve-Gil, À. Marzal-Casacuberta, J. OrdóñezLlanos, F. González-Sastre, F. Blanco-Vaca Journal of Lipid Research, 2001; 42: 241-248. 265. Low density lipoprotein particle size, triglyceride-rich lipoproteins and glucose tolerance in non-diabetic men with essential hypertension. J. Rubies-Prat, J. Ordóñez-Llanos, S. Martin, F. Blanco-Vaca, L. Molina, A. Goday, J. Pedro-Botet. Clinical and Experimental Hypertension 2001; 23: 489-500. 266. Effect of glycemic optimization on electronegative LDL (LDL(-)) in diabetes. Relation to non-enzymatic glycosilation and oxidative modification. Sánchez-Quesada JL, Pérez A, Caixàs A, Rigla M, Payés, Benitez S, Ordóñez-Llanos J. J Clin End Metabol 2001; 86: 3243-3249. 267. Changes in low-density lipoprotein electronegativity and oxidizability after aerobic exercise are related to the increase in associated non-esterified fatty acids. S. Benitez, J.L. SánchezQuesada, L. Lucero, R. Arcelús, V. Ribas, O. Jorba, A. Castellví, E. Alonso, F. Blanco-Vaca, J. Ordóñez-Llanos. Atherosclerosis 2002; 160: 223-232. 268. ApoA-IMALLORCA impairs LCAT activation and induces dominant form of familial hypoalphalipoproteinemia. J.M. Martín-Campos, J. Julve, J.C. Escolà-Gil, J. Ordóñez-Llanos, J. Gómez, J. Binimelis, F. González-Sastre, F. Blanco-Vaca. Journal of Lipid Research 2002; 43: Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 81 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 115-123. 269. Tromboplastin-thrombomodulin-mediated time and serum folate levels are genetically correlated with the risk of thromboembolic disease : results from the Gait Project . Souto, L. Almasy, M. Borrell, W.H. Stone, F. Blanco-Vaca, J.M. Soria, J. Blangero, J. Fontcuberta. Thrombosis and Haemostasis 2002; 87: 68-73. 270. Density distribution of electronegative LDL (LDL(-)) in normolipemic and hyperlipemic subjects. J.L. Sánchez-Quesada, S. Benitez, C. Otal, M. Franco, F. Blanco-Vaca, J. OrdóñezLlanos. Journal of Lipid Research 2002; 43: 699-705. 271. Hipercolesterolemia familiar heterocigota en España. Descripción de 819 casos no relacionados. Alonso R, Castillo S, Civeira F, Puzo J, La Cruz JJ, Pocoví M, Mata P, por el grupo del estudio de la hipercolesterolemia familiar en España. Medicina Clínica 2002; 118: 487-492. 272. Reply. Chico A, Pérez A, Córdoba A, Arcelús R, Carreras G, de Leiva A, González Sastre F, Blanco-Vaca F. Diabetologia 1998; 42: 383 273. Low cholesterol in severe hypothyroidism? AM Wägner, M Rigla, J Ordóñez, R Corcoy. Endocr J 1999; 46: 347-48 . 274. On the mechanisms by which human apolipoprotein gene variability relates to hypertriglyceridemia. Julve J, Blanco-Vaca F, Escolà-Gil JC. Circulation 2002; 105:pe129. 275. Overexpression of human apolipoprotein A-II in transgenic mice does not increase their susceptibility to insulin resistance and obesity. Escolà-Gil JC, Blanco-Vaca F, Julve J. Diabetologia 2002; 45: 600-601. 276. Apolipoprotein B and prediction of fatal myocardial infarction. [carta] Wägner AM, Ordóñez-Llanos J. Lancet 2002 (en prensa). NODO 10 277. Ascaso JF, Real JT, Sánchez C, Ampudia J, Romero G, Carmena – Ramón, R Carmena R. Plasma lipoprotein compositional differences in primary hypercholesterolaemias. Nutr Metab Cardiovascular Dis 1997; 7: 38-43. 278. Ascaso JF, Lorente R, Merchante A, Real JT, Priego A, Carmena R. Insulin resistance in patiens with familial combined hyperlipidaemia and ischemic heart disease: Am J. Cardiol. 1997; 80: 1584 – 1487. 279. Ascaso JF, Sales J, Priego MA, Merchante A, Carmena-Ramón R, Carmena R. Alteración de la secreción de la insulina en la hiperlipemia familiar combinada. Med Clin 1997; 108: 530533. 280. Ascaso JF, Merchante A, Lorente RI, Real JT, Martínez-Valls J, Carmena R. A study of insulin resistance using the minimal model in nondiabetic familial combined hyperlipidemic patients. Metabolism 1998; 47: 1-7. 281. Carmena-Ramón R, Ordovás JM, Ascaso JF, Real J, Priego MA, Carmena R. Influence of genetic variation at the apo A-I gene locus on lipid levels and response to diet in familial hypercholesterolemia. Atherosclerosis 1998; 139: 107-113. 282. Carmena-Ramón R, Ascaso JF, Real JT, Ordovás JM, Carmena R. Genetic variation at the apo A IV gene locus and response to diet in familial hypercholesterolemia. Arterioscler Thromb Vasc Biol 1998; 18: 1266-1274. 283. von Eckardstein A, Yadong H, Kastelein JJP, Geisel J, Real JT, Kuivenhoven JA, Miccoli R, Noseda G, Assmann G. Lipid-free apolipoprotein (apo) A-I is converted into alphamigrating high density lipoproteins by lipoprotein-depleted plasma of normolipidemic donors Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 82 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años and apo A-I-deficient patients but not of Tangier disease patients. Atherosclerosis 1998; 138: 25-34. 284. von Eckardstein A, Chirazi A, Schuler-Luttmann S, Walter M, Kastelein JJ, Geisel J, Real JT, Miccoli R, Noseda G, Hobbel G, Assmann G. Plasma and fibroblasts of Tangier disease patients are disturbed in transferring phospholipids onto apolipoprotein A-I. J Lipid Res 1998; 39: 987-998. 285. Real JT, Ascaso JF, Chaves FJ, Tenés S, Priego MA, Puig O, Armengod ME, Carmena R. Plasma Lp(a) values in familial hypercholesterolemia and its relation to coronary heart disease. Nutr Metab Cardiovasc Dis 1999; 9: 41-44. 286. Assmann G, Carmena R, Cullen P, Fruchart JC, Jossa F, Lewis B, Mancini M, Paoletti R. Coronary heart disease: reducing the risk: a worldwide view. International Task Force for the Prevention of Coronary Heart Disease. Circulation. 1999 2;100:1930-8. 287. Lluch I, Ascaso JF, Mora F, Minguez M, Peña A, Hernández A, Benages A. Gastroesophageal reflux in diabetes mellitus. Am J Gastroenterology 1999; 94: 919-924. 288. Real JT, Chaves FJ, Ascaso JF, Armengod ME, Carmena R. Estudio del defecto familiar de apo B-100 en sujetos con el diagnóstico clínico de hipercolesterolemia primaria: identificación de la primera familia afectada en España. Med Clin (Barc) 1999; 113: 15-17. 289. Rust S, Rosier M, Funke H, Real J, Amoura Z, Piette JC, Deleuze JF, Brewer HB, Duverger N, Denefle P, Assmann G. Tangier disease is caused by mutations in the gene encoding ATPbinding cassette transporter 1. Nature genetics 1999; 22: 352-355. 290. Carmena-Ramón R, Real JT, Ascaso JF, Ordovás JM, Carmena R. Effect of apolipoprotein E genotype on lipid levels and response to diet in familial hipercolesterolemia. Nutr Metab Cardiovasc Dis 2000; 10 :7-13. 291. Carmena R, Roy M, Roederer G, Mimich A, Davignon J. Coexisting dysbetalipoproteinemia and familial hypercholesterolemia. Clinical and laboratory observations. Atherosclerosis 2000; 148: 113-124. 292. Ascaso JF, Real JT, Merchante A, Rodrigo A, Carmena R. Lipoprotein phenotype in familial combined hyperlipidemia. Metabolism 2000; 49: 1627-31. 293. Real JT, Chaves JF, Civera M, García-García AB, Ascaso JF, Armengod ME, Carmena R. Influencia de las mutaciones HF Valencia 1 y 2 del gen del receptor de LDL sobre la respuesta terapéutica a simvastatina en sujetos con hipercolesterolemia familiar heterocigota caracterizados molecularmente. Med Clin (Barc) 2001; 116: 81-85. 294. Real JT, Chaves FJ, Martínez-Usó I, García-García AB, Ascaso JF, Carmena R. Importance of HDL colesterol levels and total to HDL colesterol ratio as risk factor for coronary Heart disease in molecularly defined heterozygous familial hypercholesterolemia. Eur Heart J 2001; 22: 465-471. 295. Chaves FJ, Real JT, García-García AB, Puig O, Ordovas JM, Ascaso JF, Carmena R, Armengod ME. Large rearrangements of the LDL receptor gene and lipid profile in a Spanish familial hypercholesterolemic population. Eur J Clin Invest 2001; 31: 309-317 296. Carmena-Ramón R, Ascaso JF, Real JT, Najera G, Ordovás JM, Carmena R. Association between the TaqIB polymorphism in the CETP gene locus and plasma lipoprotein levels in familial hypercholesterolemia. Metabolism 2001; 50: 651-656. 297. Chaves FJ, Real JT, García-García AB, et al. Genetic diagnosis of familial hypercholesterolemia in a south European outbreed population: influence of low density lipoprotein (LDL) receptor gene muations on treatment response to simvastatin in total, LDL and high density lipoprotein cholesterol. J Clin Endocrin Metab 2001; 86: 4926-4932. 298. García-García AB, Real JT, Puig O, Cebolla E, Martín-García P, et al. Molecular genetics of Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 83 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años familial hipercolesterolemia in Spain: ten novel LDLR mutations and population analysis. Human Mutat 2001; 454: 1-9. 299. Ascaso JF, Romero P, Real JT, Priego A, Valldecabres C, Carmena R. Cuantificación de la insulinoresistencia con los valores de insulina basal e índice HOMA en una población no diabética. Med Clin (Barc) 2001; 117: 530-533. 300. Carmena R, Ascaso JF, Real JT. Impact of obesity in primary hyperlipidemias. Nutr Metab Cardiovasc Dis 2001; 11: 354-359. 301. Real JT, Ascaso JF, Chaves FJ, González C, Puig O, Armengod ME, Carmena R. Asociación de factores lipídicos, genotipo de APOE y tipos de mutación del gen del receptor de LDL con el infarto agudo de miocardio en sujetos con hipercolesterolemia familiar heterocigota. Med Clin (Barc) 2002; 118: 681-685. 302. Redon J. Chaves FJ, Liao Y, Pascual JM, Rovira E, Armengod ME, Cooper RS. Influence of the I/D polymorphism of the angiotensin-converting enzyme gene and the outcome of microalbuminuria in essential hypertension. Hypertension 2000; 35: 490-495. 303. Giner V, Corella D, Chaves FJ, Pascual JM, Portoles O, Marin P, Lozano JV, Armengod ME, Redon J. Renin-angiotensin system genetic polymorphisms and essential hypertension in the Spanish population. Med Clin (Barc). 2001;117(14):525-9. 304. Poch E, La Sierra Ad A, Gonzalez-Nunez D, Oriola J, Redon J, Chaves FJ, Marin P, Giner V, Pamies E, Villar J, Ramirez R, Stiefel P, Rodriguez Perez JC, Rodriguez Esparragon F, Martinez E, Carrion L, Sanchis C, Divison JA. Genetic polymorphisms of the renin-angiotensin system and essential hypertension. Med Clin (Barc). 2002;118(15):575-9. 305. Chaves FJ, Giner V, Corella D, Pascual JM, Marin P, Armengod ME, Redon J. Body weight changes and the A-6G polymorphism of the angiotensinogen gene. Int J. Obesit, 2002; 26: 1-6. NODO 11 306. La Ville AE, Sola R, Motta C, Plana N, Heras M, Ribalta J, Masana L. Physicochemical changes in HDL3 after bezafibrate treatment: influence on free cholesterol efflux from human fibroblasts. Cardiovasc Drugs Ther. 1997 Nov;11(5):653-8. 307. Ribalta J, LaVille AE, Girona J, Vallve JC, Masana L. Low plasma vitamin A concentrations in familial combined hyperlipidemia. Clin Chem. 1997 Dec;43(12):2379-83 308. Ribalta J, La Ville AE, Heras M, Plana N, Masana L. [Familial combined hyperlipidemia: detection and characterisation of the hyperlipidemic profile among children and adolescents] Med Clin (Barc). 1997 Jun 28;109(5):161-4. 309. Ribalta J, La Ville AE, Vallve JC, Humphries S, Turner PR, Masana L. A variation in the apolipoprotein C-III gene is associated with an increased number of circulating VLDL and IDL particles in familial combined hyperlipidemia. J Lipid Res. 1997 Jun;38(6):1061-9. 310. Sola Alberich R, Jammoul A, Masana L. Henoch-Schonlein purpura associated with acetylsalicylic acid. Ann Intern Med. 1997 Apr 15;126(8):665. 311. Valtuena S, Sola R, Salas-Salvado J. A study of the prognostic respiratory markers of sustained weight loss in obese subjects after 28 days on VLCD. Int J Obes Relat Metab Disord. 1997 Apr;21(4):267-73 312. Girona J, La Ville AE, Heras M, Olive S, Masana L. Oxidized lipoproteins including HDL Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 84 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años and their lipid peroxidation products inhibit TNF-alpha secretion by THP-1 human macrophages. Free Radic Biol Med. 1997;23(4):658-67 313. Sola R, La Ville AE, Richard JL, Motta C, Bargallo MT, Girona J, Masana L, Jacotot B. Oleic acid rich diet protects against the oxidative modification of high density lipoprotein. Free Radic Biol Med. 1997;22(6):1037-45 314. Tilly-Kiesi M, Lichtenstein AH, Joven J, Vilella E, Cheung MC, Carrasco WV, Ordovas JM, Dolnikowski G, Schaefer EJ. Impact of gender on the metabolism of apolipoprotein A-I in HDL subclasses LpAI and LpAI:AII in older subjects. Arterioscler Thromb Vasc Biol. 1997 Dec;17(12):3513-8 315. Matas C, Joven J, Vilella E, Cliville X, Cabre M, Prats E, Camps J. Lipoprotein alterations in liver cirrhosis: a possible contribution to changes in plasma oncotic pressure and viscosity. J Hepatol. 1997 Oct;27(4):639-44. 316. Joven J, Vilella E. The influence of apoprotein epsilon 2 homozygosity on nephrotic hyperlipidemia. Clin Nephrol. 1997 Sep;48(3):141-5 317. Joven J, Cliville X, Camps J, Espinel E, Simo J, Vilella E, Oliver A. Plasma protein abnormalities in nephrotic syndrome: effect on plasma colloid osmotic pressure and viscosity. Clin Chem. 1997 Jul;43(7):1223-31. 318. Jimenez-Exposito MJ, Garcia-Lorda P, Alonso-Villaverde C, de Virgala CM, Sola R, Masana L, Arija V, Izquierdo V, Salas-Salvado J. Effect of malabsorption on nutritional status and resting energy expenditure in HIV-infected patients. AIDS. 1998 Oct 22;12(15):1965-72. 319. Joven J, Simo JM, Vilella E, Camps J, Masana L, de Febrer G, Camprubi M, Richart C, Bardaji A, Casao E, Pocovi M, Civeira F. Lipoprotein(a) and the significance of the association between platelet glycoprotein IIIa polymorphisms and the risk of premature myocardial infarction. Atherosclerosis. 1998 Sep;140(1):155-9. 320. Vallve JC, Alonso-Villaverde C, Ribalta J, Perez-Jimenez F, Masana L. Exon 4, and in particular codon 152 of the LDL receptor gene, is a hot spot for point mutations. Atherosclerosis. 1998 Sep;140(1):191-2. 321. Ribalta J, La Ville AE, Vallve JC, Girona J, Masana L. Evidence against alterations in Lecithin: cholesterol acyltransferase (LCAT) activity in familial combined hyperlipidemia. Atherosclerosis 1998;138(2):383-9. 322. Simó JM, Castellano I, Ferre N, Joven J, Camps J. Evaluation of a homogeneous assay for high-density lipoprotein cholesterol: limitations in patients with cardiovascular, renal, and hepatic disorders. Clin Chem. 1998 Jun;44(6 Pt 1):1233-41. 323. Paul A, Calleja L, Vilella E, Martinez R, Osada J, Joven J. Reduced progression of atherosclerosis in apolipoprotein E-deficient mice with phenylhydrazine-induced anemia. Atherosclerosis. 1999 Nov 1;147(1):61-8. 324. Calleja L, Paris MA, Paul A, Vilella E, Joven J, Jimenez A, Beltran G, Uceda M, Maeda N, Osada J. Low-cholesterol and high-fat diets reduce atherosclerotic lesion development in ApoE-knockout mice. Arterioscler Thromb Vasc Biol. 1999 Oct;19(10):2368-75. 325. Alonso-Villaverde C, Sarda P, Vallbe JC, Heras M, Perez-Jimenez F, Pedro-Botet JC, RosRahola E, Masana L. [Clinical manifestations of familial hypercholesterolemia in Mediterranean population] Med Clin (Barc). 1999 Oct 30;113(14):521-5. 326. Ferre N, Girona J, Cabre M, Joven J, LaVille A, Masana L, Paternain JL, Camps J. Hepatic production of apolar aldehydes in rats with carbon tetrachloride-induced cirrhosis. Mol Cell Biochem. 1999 Aug;198(1-2):57-60. 327. Pedreno J, Vila M, Masana L. Mechanisms for regulating platelet high density lipoprotein type3 binding sites: evidence that binding sites are downregulated by a protein kinase Cdependent mechanism. Thromb Res. 1999 Apr 1;94(1):33-44. 328. Jimenez-Exposito MJ, Alonso-Villaverde C, Sarda P, Masana L. Visceral leishmaniasis in HIV-infected patients with non-detectable HIV-1 viral load after highly active antiretroviral Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 85 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años therapy. AIDS. 1999 Jan 14;13(1):152-3. 329. Waterworth DM, Ribalta J, Nicaud V, Dallongeville J, Humphries SE, Talmud P. ApoCIII gene variants modulate postprandial response to both glucose and fat tolerance tests. Circulation. 1999 Apr 13;99(14):1872-7. 330. Girona J, La Ville AE, Sola R, Plana N, Masana L. Simvastatin decreases aldehyde production derived from lipoprotein oxidation. Am J Cardiol. 1999 Mar 15;83(6):846-51 331. Ribalta J, Girona J, Vallve JC, La Ville AE, Heras M, Masana L. Vitamin A is linked to the expression of the AI-CIII-AIV gene cluster in familial combined hyperlipidemia. J Lipid Res. 1999 Mar;40(3):426-31. 332. Camps J, Simo JM, Guaita S, Ferre N, Joven J. Altered composition of lipoproteins in liver cirrhosis compromises three homogeneous methods for HDL-cholesterol. Clin Chem. 1999 May;45(5):685-8. 333. Gomez F, Camps J, Simo JM, Ferre N, Joven J. Agreement study of methods based on the elimination principle for the measurement of LDL- and HDL-cholesterol compared with ultracentrifugation in patients with liver cirrhosis. Clin Chem. 2000 Aug;46(8 Pt 1):1188-91. 334. van Oostrom AJ, Castro Cabezas M, Ribalta J, Masana L, Twickler TB, Remijnse TA, Erkelens DW. Diurnal triglyceride profiles in healthy normolipidemic male subjects are associated to insulin sensitivity, body composition and diet. Eur J Clin Invest. 2000 Nov;30(11):964-71. 335. Siest G, Bertrand P, Qin B, Herbeth B, Serot JM, Masana L, Ribalta J, Passmore AP, Evans A, Ferrari M, Franceschi M, Shepherd J, Cuchel M, Beisiegel U, Zuchowsky K, Rukavina AS, Sertic J, Stojanov M, Kostic V, Mitrevski A, Petrova V, Sass C, Merched A, Salonen JT, Tiret L, Visvikis S. Apolipoprotein E polymorphism and serum concentration in Alzheimer's disease in nine European centres: the ApoEurope study. ApoEurope group. Clin Chem Lab Med. 2000 Aug;38(8):721-30. 336. Tahvanainen E, Molin M, Vainio S, Tiret L, Nicaud V, Farinaro E, Masana L, Ehnholm C. Intestinal fatty acid binding protein polymorphism at codon 54 is not associated with postprandial responses to fat and glucose tolerance tests in healthy young Europeans. Results from EARS II participants. Atherosclerosis. 2000 Oct;152(2):317-25. 6 337. Pedreno J, Hurt-Camejo E, Wiklund O, Badimon L, Masana L. Platelet function in patients with familial hypertriglyceridemia: evidence that platelet reactivity is modulated by apolipoprotein E content of very-low-density lipoprotein particles. Metabolism. 2000 Jul;49(7):942-9. 338. Pedreno J, Sanchez-Quesada JL, Cabre A, Masana L. Molecular requirements in the recognition of low-density lipoproteins (LDL) by specific platelet membrane receptors. Thromb Res. 2000 Jul 1;99(1):51-60. 339. Solans R, Motta C, Sola R, La Ville AE, Lima J, Simeon P, Montella N, Armadans-Gil L, Fonollosa V, Vilardell M. Abnormalities of erythrocyte membrane fluidity, lipid composition, and lipid peroxidation in systemic sclerosis: evidence of free radical-mediated injury. Arthritis Rheum. 2000 Apr;43(4):894-900. 340. Osada J, Joven J, Maeda N. The value of apolipoprotein E knockout mice for studying the effects of dietary fat and cholesterol on atherogenesis. Curr Opin Lipidol. 2000 Feb;11(1):25-9. 341. Rock E, Winklhofer-Roob BM, Ribalta J, Scotter M, Vasson MP, Brtko J, Brigelius-Flohe R, Bronner A, Azais-Braesco V. Vitamin A, vitamin E and carotenoid status and metabolism during ageing: functional and nutritional consequences (VITAGE PROJECT). Nutr Metab Cardiovasc Dis. 2001 Aug;11(4 Suppl):70-3 342. Sniderman AD, Ribalta J, Castro Cabezas M. How should FCHL be defined and how should we think about its metabolic bases? Nutr Metab Cardiovasc Dis. 2001 Aug;11(4):259Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 86 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 73. 343. Hurt-Camejo E, Paredes S, Masana L, Camejo G, Sartipy P, Rosengren B, Pedreno J, Vallve JC, Benito P, Wiklund O. Elevated levels of small, low-density lipoprotein with high affinity for arterial matrix components in patients with rheumatoid arthritis: possible contribution of phospholipase A2 to this atherogenic profile. Arthritis Rheum. 2001 Dec;44(12):2761-7. 344. Girona J, Vallve JC, Ribalta J, Heras M, Olive S, Masana L. 2,4-Decadienal downregulates TNF-alpha gene expression in THP-1 human macrophages. Atherosclerosis. 2001 Sep;158(1):95-101. 345. Ostos MA, Conconi M, Vergnes L, Baroukh N, Ribalta J, Girona J, Caillaud JM, Ochoa A, Zakin MM. Antioxidative and antiatherosclerotic effects of human apolipoprotein A-IV in apolipoprotein E-deficient mice. Arterioscler Thromb Vasc Biol. 2001 Jun;21(6):1023-8. 346. Paul A, Calleja L, Joven J, Vilella E, Ferre N, Camps J, Girona J, Osada J. Supplementation with vitamin E and/or zinc does not attenuate atherosclerosis in apolipoprotein E-deficient mice fed a high-fat, high-cholesterol diet. Int J Vitam Nutr Res. 2001 Jan;71(1):45-52. 347. Lievre M, Menard J, Bruckert E, Cogneau J, Delahaye F, Giral P, Leitersdorf E, Luc G, Masana L, Moulin P, Passa P, Pouchain D, Siest G. Premature discontinuation of clinical trial for reasons not related to efficacy, safety, or feasibility. BMJ. 2001 Mar 10;322(7286):603-5. 348. Pedreno J, Hurt-Camejo E, Wiklund O, Badimon L, Masana L. Low-density lipoprotein (LDL) binds to a G-protein coupled receptor in human platelets. Evidence that the proaggregatory effect induced by LDL is modulated by down-regulation of binding sites and desensitization of its mediated signaling. Atherosclerosis. 2001 Mar;155(1):99-112. 349. Masana L, Febrer G, Cavanna J, Baroni MG, Marz W, Hoffmann MM, Shine B, Galton DJ. Common genetic variants that relate to disorders of lipid transport in Spanish subjects with premature coronary artery disease. Clin Sci (Lond). 2001 Feb;100(2):183-90 350. Pedreno J, de Castellarnau C, Masana L. Platelet HDL(3) binding sites are not related to integrin alpha(IIb)beta(3) (GPIIb-IIIa). Atherosclerosis. 2001 Jan;154(1):23-9. 351. Ferre N, Camps J, Prats E, Girona J, Gomez F, Heras M, Simo JM, Ribalta J, Joven J. Impaired vitamin E status in patients with parenchymal liver cirrhosis: Relationships with lipoprotein compositional alterations, nutritional factors, and oxidative susceptibility of plasma. Metabolism. 2002 ;51:609-15. 352. Simo JM, Camps J, Vilella E, Gomez F, Paul A, Joven J. Instability of lipoprotein(a) in plasma stored at -70 degrees C: effects of concentration, apolipoprotein(a) genotype, and donor cardiovascular disease. Clin Chem. 2001 Sep;47(9):1673-8. 353. Simo JM, Joven J, Vilella E, Ribas M, Figuera L, Virgos C, Sundaram IM, Hoover-Plow J. Polymorphisms in human apolipoprotein(a) kringle IV-10 and coronary artery disease: relationship to allele size, plasma lipoprotein(a) concentration, and lysine binding site activity. J Mol Med. 2001 Jun;79(5-6):294-9. 354. Simo JM, Joven J, Vilella E, Ribas M, Pujana MA, Sundaram IM, Hammel JP, HooverPlow JL. Impact of apolipoprotein(a) isoform size heterogeneity on the lysine binding function of lipoprotein(a) in early onset coronary artery disease. Thromb Haemost. 2001 Mar;85(3):4127. 355. Sniderman AD, Castro Cabezas M, Ribalta J, Carmena R, de Bruin TW, de Graaf J, Erkelens DW, Humphries SE, Masana L, Real JT, Talmud PJ, Taskinen MR. A proposal to redefine familial combined hyperlipidaemia -- third workshop on FCHL held in Barcelona from 3 to 5 May 2001, during the scientific sessions of the European Society for Clinical Investigation. Eur J Clin Invest. 2002 Feb;32(2):71-3. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 87 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 356. Murphy MM, Vilella E, Ceruelo S, Figuera L, Sanchez M, Camps J, Cuco G, Ferre N, Labad A, Tasevska N, Arija V, Joven J, Fernandez-Ballart J. The MTHFR C677T, APOE, and PON55 gene polymorphisms show relevant interactions with cardiovascular risk factors. Clin Chem. 2002 Feb;48(2):372-5. 357. Ferre N, Camps J, Prats E, Vilella E, Paul A, Figuera L, Joven J. Serum paraoxonase activity: a new additional test for the improved evaluation of chronic liver damage. Clin Chem. 2002 Feb;48(2):261-8. 358. Negredo E, Ribalta J, Paredes R, Ferré R, Salazar J; Tural C, Romeu J, Sirera G, Reiss P, Masana L, Clotet B.Reversal of atherogenic lipoprotein profile in HIV-1 infected patients with lipodistrophy after replacing protease inhibitors by nevirapine. AIDS. 2002 (en prensa) 359. Ribalta J, Figuera L, Fernández-Ballart J, Vilella E, Castro Cabezas M, Masana L, Joven J. The newly identified apolipoprotein AV gene predisposes to high plasma triglycerides in familial combined hyperlipidemia. Clin Chem. 2002 (en prensa). 360. Vallvé, JC.; Uliaque, K.; Cabré, A.; Girona, J.; Ribalta, J.; Heras, M.; Masana, M. Unsaturated fatty acids and their oxidation products stimulate CD36 gene expression in human macrophages. Atherosclerosis 2002 (en prensa) 361. Paredes S, Girona J, Hurt-Camejo E, Vallvé JC, Olivé S, Heras M, Benito P, Masana L. Antioxidant vitamins and lipid peroxidation in patients with rheumatoid arthritis:association with inflammatory markers. J Rheumatol 2002 (en prensa) NODO 12 362. Ojeda, JL., Berciano MT, Polanco, JI., Lafarga M. and Rodríguez JC. 1997. Insulin-like growth factor I receptor gene expression during postnatal development of rabbit kidney. Anat.Rec. 249, 187- 195. 363. Cenarro A., Jensen H.K., Casao E., Civeira F., Gonzalez- Bonillo J., Rodriguez -Rey J.C., Gregersen N., Pocovi M.1998. Identification of recurrent mutations in the LDL receptor gene in Spanish patients with familial hypercholesterolemia . Hum. Mutat. Mutation in Brief #135. 364. Recalde, D., Martín I., Añíbarro, C., Albajar, M., Cenarro, A., Pocoví M. and Rodríguez-Rey, JC. 1998. Polymorphisms in the human apolipoprotein AIV gene detected by PCR and heteroduplex analysis. Mol Cell Probes. 12, 117- 120. 365. Piedra, ME., Icardo JM, Albajar, M, Rodríguez-Rey JC and Ros MA. 1998. Pitx2 participates in the late phase of the pathway controlling left- right asymmetry. Cell 94, 319- 324. 366. Berciano MT, Fernández R, Pena E, Calle E, Villagra NT, Rodríguez-Rey JC and Lafarga, M. 2000. Formation of intranuclear crystalloids and proliferation of the smooth endoplasmic reticulum in schwann cells induced by tellurium treatment: Association with overexpression of HMG CoA reductase and HMG CoA synthase. Glia. 29, 246- 259. 367. Fernández -Terán M, Piedra ME, Kathiriya IS, Srivastava D, Rodríguez-Rey JC and Ros MA. 2000. D-Hand regulates anterior-posterior polarity in limb development. Implications for the shh pathway. Development. 127, 2133-2142. 368. Galetto, R., Albajar M, Polanco JI, Zakin MM and Rodríguez-Rey JC. 2001. Identification of a peroxisome-proliferator activated receptor (PPAR)- gamma response element in the apolipoprotein E gene control region. Biochem J. 357, 521–527. 369. Mozas P., Galetto, R., Albajar, M., Ros, E., Pocoví, M. and Rodríguez- Rey, JC. 2002. A mutation (-49 C>T) in the low density lipoprotein receptor gene promoter .J Lipid Res. 43: 1318 Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 88 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años NODO 13 370. Simon-Buela L, Osaba L, Garcia JA, Lopez-Moya JJ.Preservation of 5'-end integrity of a potyvirus genomic RNA is not dependent on template specificity. Virology. 2000 Apr 10;269(2):377-82. 371. Simon-Buela L., and Garcia-Arenal F. Virus particles of cucumber green mottle mosaic tobamovirus move systemically in the phloem of infected cucumber plants. Mol. Plant Microbe Interact. 1999. 12(2):112-8. 372. Fernandez A., Guo H.S., Saenz P., Simon-Buela L., Gomez de Cedron M., and Garcia J.A. The motif V of plum pox potyvirus CI RNA helicase is involved in NTP hydrolysis and is essential for virus RNA replication. Nucleic Acids Res. 1997. 25(22):4474-80. 373. Simon-Buela L., Guo H.S., and Garcia J.A. Cap-independent leaky scanning as the mechanism of translation initiation of a plant viral genomic RNA. J. Gen. Virol. 1997. 78 (10):2691-9. 374. Allen C., Gay J., and Simon-Buela L. A regulatory locus, pehSR, controls polygalacturonase production and other virulence functions in Ralstonia solanacearum. Mol. Plant Microbe Interact. 1997. 10(9):1054-64 375. Simon-Buela L., Guo H.S., and Garcia J.A. Long sequences in the 5' noncoding region of plum pox virus are not necessary for viral infectivity but contribute to viral competitiveness and pathogenesis. Virology. 1997. 23;233(1):157-62. 376. Schneider J, Pollán M, Jiménez E, Marenbach K, Martínez N, Volm M, Marx D, Meden H. nm23-H1 expression defines a high-risk subpopulation of patients with early-stage epithelial ovarian carcinoma. British Journal of Cancer 2000;82:1662-1670. 377. Redondo P, Jiménez E, Pérez A, García-Foncillas J. N-Acetylcysteine downregulates vascular endothelial growth factor production by human keratinocytes in vitro. Arch Dermatol Res 2000;292:621-628. 378. Schneider J, Jiménez E, Marenbach K, Romero H, Marx D, Meden H. Immunohistochemical detection of HSP-60 expression in human ovarian cancer. Correlation with survival in a series of 247 patients. Anticancer Research 1999;19:2141-2146. 379. Schneider J, Pollán M, Ruibal A, Jiménez E, Lucas AR, Núñez MI, Sánchez J, Tejerina A. Histologic grade and CD44 are independent predictors of axillary lymph node invasion in early (T1) breast cancer. Tumor Biology 1999;20:319-330. 380. Schneider J, Moragues D, Martínez N, Romero H, Jiménez E, Pontón J. Cross reactivity between Candida albicans and human ovarian carcinoma as revealed by monoclonal antidodies PA10F and C6. British Journal of Cancer 1998;77:1015-1020. 381. Schneider J, Jiménez E, Rodríguez F, González de Tanago J. Oncogenic activation (c-myc, c-erb-B2, nm23 and p53) in human endometriosis. Oncology Reports 1998;5:49-52. 382. Schneider J, Jiménez E, Marenbach K, Marx D, Meden H. Co-expression of the MDR1 gene and HSP27 in human ovarian cancer. Anticancer Research 1998; 18:2967-71. 383. Schneider J, Jiménez E, Marenbach K, Ruibal A, Núñez MI, Marx D, Tejerina A, Meden H. Heat shock protein expression and oncogenic activation in breast and ovarian cancer. Anticancer Research 1998; 18:4946. 384. Schneider J, Centeno M, Jiménez E, Rodriguez-Escudero FJ, Romero H. Correlation of MDR expression and oncogenic activation in human epithelial carcinoma. Anticancer Research 1997;17:2147-52. 385. Martínez N, Jiménez E, Castresana JS, Schneider J. Detection of p53 mutations in Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 89 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años gynecologic tumors by means of a simple, nonradioactive minigel method of PCR-SSCP analysis. Oncology Reports 1997;4:359-361. 386. Margareto J., Rivero I., Monge A., Aldana I, Marti A., Martínez J.A. Changes in UCP2, PPARgamma2, and c/EBPalpha gene expression induced by a neuropeptide Y (NPY) related receptor antagonist in overweight rats. Nutritional Neuroscience 2002 Feb;5(1):13-7 387. Margareto J., Marti A., Martínez J.A. Modification of RXRalpha expression according to the duration of a cafeteria diet.”. J Physiol Biochem. 2001 Dec;57(4):347-8. 388. Martínez J.A., Margareto J., Marti A., Milagro F.I., Larrarte E., Moreno Aliaga M.J. Resistin overexpression is induced by a beta3 adrenergic agonist in diet-related overweightness”..J Physiol Biochem. 2001 Sep;57(3):287-88 389. Divergent effects of an alpha2-adrenergic antagonist on lipolysis and thermogenesis: interactions with a beta3-adrenergic agonist in rats” J. Gomez-Ambrosi, G. Fruhbeck, M. Aguado, F.I. Milagro, J. Margareto, J.A. Martínez. International Journal of Molecular Medicine, 2001 Jul;8(1):103-9. 390. Upregulation of thermogenesis related genes (UCP´s) and downregulation of adipocyte transcription factors (PPAR and RXR in adipose tissue are involved in the 3 -adrenergic agonists antiobesity effects” J. Margareto, E. Larrarte, A. Marti, J.A. Martínez. Biochemical Pharmacology, 2001 Jun 15;61(12):1471-8. 391. Margareto J., Gómez-Ambrosi J., Marti A., Martínez J.A.. Time dependent effects of a high energy yielding-diet on the regulation of specific white adipose tissue genes. Biochemical and Biophysical Research Communications, 2001;283(1):6-11 392. Margareto J., Marti A., Martínez J.A.. Changes in UCPs mRNA expression levels in brown adipose tissue and skeletal muscle after feeding a high-energy diet and relationships with leptin, glucose and PPAR The Journal of Nutritional Biochemistry, 2001 Mar;12(3):130-137. 393. Margareto J., Aguado M., Osés-Prieto J.A., Rivero I., Monge A., Aldana I., Marti A. A new NPY-antagonist strongly stimulates apoptosis and lipolysis on white adipocytes in an obesity model. Life Science, 2000 Nov 24;68(1):99-107. 394. Corbalán M.S., Margareto J., Martínez J.A., Marti A. High-fat feeding reduced muscle uncoupling protein 3 expression in rats. Journal of Physiology and Biochemistry, 1999 Jun;55(2):67-72. 395. Matamoros MA, Baird LM, Escuredo PR, Dalton DA, Minchin FR, Iturbe-Ormaetxe I, Rubio MC, Moran JF, Gordon AJ, Becana M. (1999). Stress-induced legume root nodule senescence. Physiological, biochemical, and structural alterations. Plant Physiol 121(1):97-112 396. Parrado J, Escuredo PR, Conejero-Lara F, Kotik M, Ponting CP, Asenjo JA, Dobson CM. (1996). Molecular characterisation of a thermoactive beta-1,3-glucanase from Oerskovia xanthineolytica. Biochim Biophys Acta 5;1296(2):145-51 397. Manzano C., Aguirre A.I., Madoz P., Ribó G., Osaba L., Moreno P. & De la Rua C. New Contribution to the Genetics of the Basques: Heterogeneity in the Esterase D Subtype Distribution Human Heredity, 43: 219-222 (1993) 398. Aguirre A.I., Sanz P., Osaba L., Manzano C., Estomba A., Mazón L., De la Rua C. & Vicario A. Alpha-2-HS-Glycoprotein Gene Frequencies in Basques Human Heredity, 44: 220224 (1994) 399. Manzano C., Aguirre A.I., Iriondo M., Martín M., Osaba L. & De la Rua C. Genetic polymorphisms of the Basques from Gipuzkoa: genetic heterogeneity of the Basque population. Annals of Human Biology, 23 (4): 285-296 (1996) 400. Osaba L., Aguirre A., Alonso A & Graf U. Genotoxicity testing of six insecticides in two crosses of Drosophila wing spot test. Mutation Research, 439: 49-61 (1999) Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 90 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 401. del Pozo L.; Osaba L., Corchero J. & Jiménez A. A single nucleotide change in the MNR1 (VCX1/HUM1) gene determines resistance to manganese in Saccharomyces cerevisiae. Yeast, 15 (5): 371-375 (1999) 402. Osaba L., Rey M.J., Aguirre A., Alonso A. & Graf U. Evaluation of genotoxicity of captan, maneb and zineb in the wing spot test of Drosophila melanogaster: role of nitrosation Mutation Research, 518 (1): 95-106 (2002) 403. Sáenz P., Cervera M., Dallot S., Quiot L., Quiot J.B., Riechmann J.L. y García J.A.. Identification of a pathogenecity determinant of Plum pox potyvirus in the sequence encoding the C- terminal region of protein P3+6K1 . Journal of General Virology, 2000, 81,557-566 404. Dallot S., Quiot-Douine L., Sáenz P., García J.A. and Quiot J.B.. Identification of Plum pox virus genetic determinants implicated in specific interactions with Prunus species. Journal of General Virology, 2000, 81,557-566. 405. Sáenz P., Quiot L., Quiot J.B., Candresse T. and García J.A. Pathogenicity determinants in the complex virus population of a Plum pox potyvirus isolate. Molecular Plant Microbe Interactions, 2001, 14(3) 278-287. 406. Saenz P., Salvador B., Simon-Mateo C., Kasschau K.D., Carrington J.C., Garcia J.A. Hostspecific involvement of the HC protein in the long-distance movement of potyviruses. J. Virol. 2002 Feb;76(4):1922-31. NODO 14 407. Ruiz-Gutiérrez V, Pérez-Zarza MC, Muriana FJG. Lipid and fatty acid composition of internal organs and muscle from ruvettus pretiosus. Journal of fish biology 1997, 50: 13531357 408. Martín-Sanz V, Pamies E, Muñiz O, Stiefel P, Miranda ML, Villar J, Jiménez L, García Pesquera F, Carneado jsubpoblaciones de hipertensos definidas por la respuesta natriurética a la deambulacion. Med Clin 1997, 108: 50-53. 409. Muriana FJG, Ruiz-Gutiérrez V, Guerrero A, Montilla C, León M, Villar J Olive oil normalizes the altered distribution of membrane cholesterol and na/li countertransport activity in erythrocyte of hypertensive patients. Journal of nutritional biochemistry 1997, 8: 205-210 410. Muriana FJG, Villar J, Ruiz-Gutiérrez V. Intake of olive oil can modulate the transbilayer movement of human erythrocyte membrane cholesterol. Cellular and molecular life sciences 1997, 53: 496-500 411. Ruiz-Gutiérrez V, Muriana FJG, Guerrero A, Villar J. Olive oil and high-oleic sunflower oil oh human plasma and erythrocyte membrane lipids. Nutrition research 1997, 17: 1391-1399 412. Ruiz-Gutiérrez V, Muriana FJG, Guerrero A, Villar J. Role of dietary oleic acid from two different source on fatty acid composition of erythrocyte membrane and blood pressure in healthy subjects. Journal of nutritional biochemistry 1997, 8: 689-695. 413. Stevenson A, Buchanan A, Aabia RA. Simple in vitro fermentation system for polysaccharides. the effects of fermenter fluid surface area/fluid volume and amount of substrate. Journal of the science of food and agriculture 1997, 73: 101-105 414. 981-09 study group. efficacy and safety of atorvastatin compared to pravasctatin in patients with hypercholesterolemia. Atherosclerosis 1997, 130: 191-197. 415. van Dijk MCM, Muriana FJG, de Widt J, Hilkmann H, van Blitterswijk WJ. Involvement of phosphatidylcholine-specific phosph0lipase c in platelet-derived growth factor–induced activation of the mitogen-activated protein kinase pathway in rat-1 fibroblasts Journal of Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 91 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años biological chemistry 1997, 272: 11011-11016 416. van Dijk MCM, Muriana FJG, Van der Hoeven PCJ, de Widt J, Schaap D, Moolenaar W, van Blitterswijk WJ. Diacylglycerol generated by exogenous phospholipase c activates the mitogen-activated protein kinase pathway independent of ras- and phorbol ester-sensitive protein kinase c: dependence of protein-kinase c-ç. biochemical journal 1997, 323: 693-699. 417. Blaya JA, Vázquez CM, Muriana FJG, Ruiz-Gutiérrez V, Bolufer J. Folate transport by prawn hepatopancreas brush-border membrane vesicles Bioscience reports 1998, 18: 9-17 418. Blaya JA, Vázquez CM, Muriana FJG, Ruiz-Gutiérrez V, Bolufer J Alfa-methylglucoside and d-glucose transport by hepatopancreatic brush-border membrane vesicles from the prawn. journal of physiological chemistry 1998, 54: 1-8. 419. Ruiz-Gutiérrez V, Muriana FJG, Villar J. El aceite de oliva virgen y las enfermedades cardiovasculares. perfil lipidico y composición lipídica de la membrana de eritrocitos humanos. Grasas y aceites 1998, 49: 9-29. 420. Muriana FJG, Ruiz-Gutiérrez V. El aceite de oliva virgen y la distribucion y movimiento transmembrana del colesterol en la membrana de eritrocito humano Grasas y aceites 1998, 49: 139-150. 421. Ruiz-Gutiérrez V, Morgado N, Prada JL, Pérez-Jiménez F, Muriana FJG. Composition of human vldl triacylglycerols after ingestion of olive and high oleic sunflower oil.Journal of nutrition 1998, 128: 570-576. 422. Ruiz-Gutiérrez V, Perona JS, Pacheco YM, Villar J, Muriana FJG. Incorporation of dietary triacylglycerols from olive oil and high-oleic sunflower oil into vldl triacylglycerol of hypertensive patients. Eur J Clin Nutr 1999, 53: 687-693. 423. Abia R, Perona JS, Pacheco YM, Montero E, Muriana FJG, Ruiz-Gutiérrez V. Postprandial triacylglycerols from dietary virgin olive oil are selectively cleared in human. J Nutr 1999, 129: 2184-2191 424. Pamies E, Palmero C, García-Lozano R, Stiefel P, Miranda ML, Martín-Sanz V, Villar J, Nuñez A, Carneado J. Influencia de los polimorfismos m235t del angiotensinógeno e i/d de la enzima conversiva de la angiotensina sobre la hipertensión arterial y otros factores de riesgo cardiovascular. Med Clin 1999, 113: 164-168. 425. Stiefel P, Pamies E, Miranda ML, Martín-Sanz V, Fernández-Moyano A, Villar J Cryptococcal peritonitis: report of a case and review of the literature.” Hepato-gastroenterology 1999, 46: 1618-1622 426. Stiefel P, Ruiz-Gutiérrez V, Gajón E, Acosta D, García-Donas MA, Madrazo J, Villar J, Carneado J. Sodium transport kinetics, cell membrane lipid composition, neural conduction and metabolic control in type 1 diabetic patients. Annals of nutrition & metabolism 1999, 43: 113120. 427. Stiefel P, Montilla C, García-Morillo S, Pamies E, Miranda ML, Villar J Prevalencia de dislipemias y de sus distintos fenotipos en la hipertension arterial esencial de comienzo reciente. Med Clin 2000, 115: 52-54 428. Pamies E, García-Lozano R, Palmero-Palmero C, García-Morillo D, Alonso A, Stiefel P, Carneado J, Villar J. Genetic variation in the beta-3-adrenergic receptor in essential hypertension . Life sciences 2000, 67: 391-397. 429. Stiefel P, Jiménez L, García-Morillo JS, Leal A, Villar J, Carneado J. Disminucion de la actividad de la 11-β-hidroxiesteroide deshidrogenasa en pacientes con sindrome de cushing. Med Clin 2000, 115: 90-92 430. Stiefel P, García-Morillo JS, Miranda ML, García-Donas MA, Pamies E, Villar J, Carneado Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 92 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años J. Gordon’s syndrome: increased maximal rate of the na+-k+-cl- cotransport and erythrocyte membrane replacement of sphyngomyelin by phosphatidylethanolamine. Journal of hypertension 2000, 18: 1-4 431. Stiefel P, Montilla C, Muñiz O, García-Lozano R, Alonso A, Miranda ML, Pamies E, Villar J. Apolipoprotein e gene polymorphism is related to metabolic abnormalities but it does not influence on erythrocyte membrane lipid composition or sodium-lithium countertransport activity in essential hypertension Metabolism 2001, 50: 157-160 432. Márquez-Contreras E, Casado-Martínez JJ, Martínez-Vázquez MM, Moreno-García JP, Fernández-Ortega A, Villar J , Castillo JR. Analisis de la influencia del cumplimiento terapeutico farmacológico en las presiones arteriales y grado de control de la hta, mediante monitorizacion ambulatoria de la presión arterial, Med Clin 2001, 116: 114-121 433. Abia R, Pacheco YM, Perona JS,Montero E, Muriana FJG, Ruiz-Gutiérrez V. The metabolic availability of dietary triacylglycerols from two high-oleic oils during the postprandial period does not depend on the amount of oleic acid ingested by healthy men. Journal of nutrition 2001, 131: 59-65 434. Abia R, Fry SC. Degradation and metabolism of 14c-labelled proanthocyanidins from carob (ceratonia seliqua) along the gastrointestinal tract in the rat Journal of the science of food and agriculture 2001, 81: 1156-1165 435. Pacheco YM, Abia R, Perona JS, Reina M, Montero E, Ruiz-Gutiérrez V, Muriana FJG. Triacylglycerol-rich lipoproteins interact with human vascular cells in a lipid-dependent fashion. Journal of agricultural and food chemistry 2001, 49: 5653-5661. 436. Grupo español para el estudio de la hipercolesterolemia familiar Hipercolesterolemia familiar heterocigotica en españa: descripcion de 819 casos no relacionados. Med Clin 2002, 118: 487-492 437. Grupo español de genética e hipertensión arterial de la seh/lelha. Polimorfismos geneticos del sistema renina-angiotensina e hipertension arterial. Med Clin 2002, 118: 575-579. 438. Pacheco YM, Abia R, Perona JS, Meier KE, Montero E, Ruiz-Gutiérrez V, Muriana FJG. Triacylglycerol-rich lipoproteins have mitogenic effect in vascular cells. Life sciences 2002, en prensa 439. Carneado J, Alvarez de Sotomayor M, Perez-Guerrero C, Jimenez L, Herrera MD, Pamies E,Martin-Sanz V, Stiefel P, Miranda ML. Simvastatin improves endothelial function in spontaneously hypertensive rats through a superoxide dismutase mediated antioxidant effect. Journal of hypertension 2002, 20:429-437. NODO 15 440. Teruel JL, Lasunción MA, Rivera M, Aguilera A, Ortega H, Tato A, Marcén R, Ortuño J. Nandrolone decanoate reduces serum Lp(a) concentrations in hemodialyzed patients. Am J Kidney Dis 29:569-575, 1997. 441. G. Castellano, C. Garfia, D. Gómez-Coronado, J. Arenas, J. Manzanares, F. Colina y J.A. Solís-Herruzo. Diffuse fatty liver in familial heterozygous hypobetalipoprotinemia. J. Clin. Gastroenterol. 25: 379-382, 1997. 442. Sánchez-Quesada JL, Ortega H, Payés-Romero A, Serrat-Serrat J, González-Sastre F, Lasunción MA, Ordóñez-Llanos J. LDL from aerobically-trained subjects shows higher resistance to oxidative modification than LDL from sedentary subjects. Relation with the antioxidant content. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 93 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años Atherosclerosis 132: 207-213, 1997. 443. D. Calvo, D. Gómez-Coronado, M.A. Lasunción y M.A. Vega. CLA-1 is a 85-kD plasma membrane glycoprotein that acts as a high-affinity receptor for both native (HDL, LDL and VLDL) and modified (OxLDL and AcLDL) lipoproteins. Arterioscler. Thromb. Vasc. Biol. 17: 2341-2349, 1997. 444. P. Carrero, H. Ortega, J. Martínez-Botas, D. Gómez-Coronado y M.A. Lasunción. Flavonoidinduced ability of minimally modified low-density lipoproteins to support lymphocyte proliferation. Biochem. Pharmacol. 55: 1125-1129, 1998. 445. D. Calvo, D. Gómez-Coronado, Y. Suárez, M.A. Lasunción y M.A. Vega. Human CD36 is a high affinity receptor for native lipoproteins HDL, LDL, and VLDL. J. Lipid Res. 39: 777-788, 1998. 446. J. Martínez-Botas, J.A. Ferruelo, Y. Suárez, D. Gómez-Coronado y M.A. Lasunción. Induction of apoptosis in p53-null HL-60 cells by inhibition of lanosterol 14demethylase. Biochimie 80: 887-894, 1998. 447. Chaves FJ, Real JT, Puig O, Ascaso JF, Teruel JL, Lasunción MA, Carmena R, Armengod ME. Hipercolesterolemia familiar: Identificación y caracterización molecular del primer homocigoto compuesto español. Med Clin (Barc) 110:300-302, 1998. 448. Navarro JF, Teruel JL, Lasunción MA, Mora-Fernández C, Ortuño J. Relationships between serum parathyroid hormone levels and lipid profile in hemodialysis patients. Evolution of lipid parameters after parathyroidectomy. Clin Nephrol 49:303-307, 1998. 449. T.Y. Ahn, D. Gómez-Coronado, V. Martínez, P. Cuevas, I. Goldstein e I. Sáenz de Tejada. Enhanced contractility of rabbit corpus cavernosum smooth muscle by oxidized low density lipoproteins. Int. J. Impot Res. 11: 9-14, 1999. 450. J. Martínez-Botas, Y. Suárez, A. Reshef, P. Carrero, H. Ortega, D. Gómez-Coronado, J.L. Teruel, E. Leitersdorf y M.A. Lasunción. Impact of different low-density lipoprotein (LDL) receptor mutations on the ability of LDL to support lymphocyte proliferation. Metabolism 48: 834-839, 1999. 451. J. Martínez-Botas, Y. Suárez, A.J. Ferruelo, D. Gómez-Coronado y M.A. Lasunción. Cholesterol starvation decreases P34cdc2 kinase activity and arrests the cell cycle at G2. FASEB J 13: 1359-1370, 1999. 452. D. Gómez-Coronado, J.J. Álvarez, A. Entrala, J.M. Olmos, E. Herrera y M.A. Lasunción. Apolipoprotein E polymorphism in men and women from a Spanish population: allele frequencies and influence on plasma lipids and apolipoproteins. Atherosclerosis 147: 167-176, 1999. 453. Rodríguez Artalejo F, Garcés C, Gil A, Lasunción MA, Martín Moreno JM, Gorgojo L, de Oya M. Estudio Cuatro Provincias: principales objetivos y diseño. Rev Esp Cardiol 52:319-326, 1999. 454. de Luis DA, Garcia Avello A, Lasuncion MA, Aller R, Martin de Argila C, Boixeda de Miquel D, de la Calle H. Improvement in lipid and haemostasis patterns after Helicobacter pylori infection eradication in type 1 diabetic patients. Clin Nutr 18::227-231, 1999. 455. G.F. Maldonado Castro, H.F. Escobar-Morreale, H. Ortega, D. Gómez-Coronado, J.A. Balsa Barro, C. Varela y M.A. Lasunción. Effects of normalization of GH on lipoprotein(a) and other lipoprotein serum levels in acromegaly. Clin. Endocrinol. 53: 313-319, 2000. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 94 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 456. M.T. Montero, O. Hernández, Y. Suárez, J. Matilla, A.J. Ferruelo, J. Martínez-Botas, D. Gómez-Coronado y M.A. Lasunción. Hydroxymethylglutaryl-coenzyme A reductase inhibition stimulates caspase-1 activity and Th1-cytokine release in peripheral blood mononuclear cells. Atherosclerosis 153: 303-313, 2000. 457. Herrera E, Lasunción MA, Huertas L, Martín-Hidalgo A. Plasma leptin levels in mother and offspring during pregnancy and lactation in the rat. Biol Neonate 78:315-320, 2000. 458. Escobar-Morreale HF, Lasunción MA, Sancho J. Treatment of hirsutism with ethinyl estradiol–desogestrel contraceptive pills has beneficial effects on the lipid profile and improves insulin sensitivity. Fertil Steril 74: 816-819, 2000. 459. D. Recalde, W. Vélez-Carrasco, F. Civeira, A. Cenarro, D. Gómez-Coronado, J.M. Ordovás y M. Pocoví. Enhanced fractional catabolic rate of apo A-I and apo A-II in heterozygous subjects for apo A-IZaragoza (L144R). Atherosclerosis 154: 613-623, 2001. 460. J. Martínez-Botas, A.J. Ferruelo, Y. Suárez, C. Fernández, D. Gómez-Coronado y M.A. Lasunción. Distinct requirement of cholesterol and non-sterol mevalonate derivatives for cell cycle progression. Biochim Biophys Acta. Mol. Cell. Biol. Lipids. 1532: 185-194, 2001. 461. Y. Suárez, C. Fernández, B. Ledo, A.J. Ferruelo, M. Martín, M.A. Vega, D. Gómez-Coronado y M.A. Lasunción. Differential effects of ergosterol and cholesterol on Cdk1 activation and SERdriven transcription. Sterol specificity for cell cycle progression in human cells. Eur J Biochem. 269: 1761-1771, 2002. 462. D. Gómez-Coronado, A. Entrala, J.J. Álvarez, H. Ortega, J.M. Olmos, M. Castro, A. Sastre, E. Herrera y M.A. Lasunción. Influence of apolipoprotein E polymorphism on plasma vitamin A and vitamin E levels. Eur J Clin Inves 32: 251-258, 2002. 463. Gagné C, Guadet D, Bruckert E, for the Ezetimibe Study Group (Lasunción MA.et al.). Eficacy and safety of ezetimibe coadministered with atorvastatin or simvastatin in patients with homozygous familial hypercholesterolemia. Circulation 105: r101-r107, 2002. 464. D. Recalde, A. Cenarro, F. Civeira, D. Gómez-Coronado, A.L. García-Otín y M. Pocoví. Analysis of apolipoprotein A-I, lecithin:cholesterol acyltransferase and glucocerebrosidase genes in hypoalphalipoproteinemia. Atherosclerosis 2002. En prensa. 465. C. Fernández, Y. Suárez, A.J. Ferruelo, D. Gómez-Coronado y M.A. Lasunción. Inhibition of cholesterol biosynthesis by 22 -unsaturated phytosterols through competitive inhibition of sterol 24 -reductase in mammalian cells. Biochem J. 2002. En prensa. 466. Garcés C, Lasunción MA, Ortega H, López Cubero L, Benavente M, Rubio R., del Barrio JL, Rodríguez Artalejo F, Gómez-Coronado D, de Oya M, en nombre de los investigadores del Estudio Cuatro Provincias.Factores metabólicos en población escolar asociados a la mortalidad cardiovascular en los adultos. Estudio Cuatro Provincias. Med Clin 2002. En prensa. 467. Garcés C, Benavente M, Ortega H, Rubio R, Lasunción MA, Rodríguez Artalejo F, del Barrio JL, Fernández Pardo J, de Oya M. Influence of birth weight on the Apo E genotype contribution to plasma lipid levels in children. Pediatric Res 2002. Aceptado. NODO 16 468. Carrero, P., H. Ortega, J. Martinez-Botas, D. Gomez-Coronado, and M.A. Lasuncion, Flavonoid-induced ability of minimally modified low-density lipoproteins to support lymphocyte proliferation. Biochem Pharmacol, 1998. 55(7): p. 1125-9. 469. Hercberg, S., P. Galan, P. Preziosi, M.J. Alfarez, and C. Vazquez, The potential role of antioxidant vitamins in preventing cardiovascular diseases and cancers. Nutrition, 1998. 14(6): p. 513-20. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 95 Proyectos de investigación financiados por Agencias externas, artículos científicos y patentes en los últimos 5 años 470. Martinez-Botas, J., A.J. Ferruelo, Y. Suarez, D. Gomez-Coronado, and M.A. Lasuncion, Induction of apoptosis in p53-null HL-60 cells by inhibition of lanosterol 14-alpha demethylase. Biochimie, 1998. 80(11): p. 887-94. 471. Cebrian, A., J.L. Herrera-Pombo, J.J. Diez, O. Sanchez-Vilar, J.I. Lara, C. Vazquez, A. Pico, A. Osorio, B. Martinez-Delgado, J. Benitez, and M. Robledo, Genetic and clinical analysis in 10 Spanish patients with multiple endocrine neoplasia type 1. Eur J Hum Genet, 1999. 7(5): p. 585-9. 472. Martinez-Botas, J., Y. Suarez, A.J. Ferruelo, D. Gomez-Coronado, and M.A. Lasuncion, Cholesterol starvation decreases p34(cdc2) kinase activity and arrests the cell cycle at G2. Faseb J, 1999. 13(11): p. 1359-70. 473. Martinez-Botas, J., Y. Suarez, A. Reshef, P. Carrero, H. Ortega, D. Gomez-Coronado, J.L. Teruel, E. Leitersdorf, and M.A. Lasuncion, Impact of different low-density lipoprotein (LDL) receptor mutations on the ability of LDL to support lymphocyte proliferation. Metabolism, 1999. 48(7): p. 834-9. 474. Martinez de Icaya, P., C. Fernandez, C. Vazquez, D. del Olmo, V. Alcazar, and M. Hernandez, IGF-1 and its binding proteins IGFBP-1 and 3 as nutritional markers in prepubertal children. Ann Nutr Metab, 2000. 44(4): p. 139-43. 475. Martinez-Botas, J., J.B. Anderson, D. Tessier, A. Lapillonne, B.H. Chang, M.J. Quast, D. Gorenstein, K.H. Chen, and L. Chan, Absence of perilipin results in leanness and reverses obesity in Lepr(db/db) mice. Nat Genet, 2000. 26(4): p. 474-9. 476. Montero, M.T., O. Hernandez, Y. Suarez, J. Matilla, A.J. Ferruelo, J. Martinez-Botas, D. Gomez-Coronado, and M.A. Lasuncion, Hydroxymethylglutaryl-coenzyme A reductase inhibition stimulates caspase-1 activity and Th1-cytokine release in peripheral blood mononuclear cells. Atherosclerosis, 2000. 153(2): p. 303-13. 477. Martinez-Botas, J., A.J. Ferruelo, Y. Suarez, C. Fernandez, D. Gomez-Coronado, and M.A. Lasuncion, Dose-dependent effects of lovastatin on cell cycle progression. Distinct requirement of cholesterol and non-sterol mevalonate derivatives. Biochim Biophys Acta, 2001. 1532(3): p. 185-94. 478. Serra-Majem, L., L. Ribas, J. Ngo, J. Aranceta, M. Garaulet, E. Carazo, J. Mataix, C. PerezRodrigo, M. Quemada, R. Tojo, and C. Vazquez, Risk of inadequate intakes of vitamins A, B1, B6, C, E, folate, iron and calcium in the Spanish population aged 4 to 18. Int J Vitam Nutr Res, 2001. 71(6): p. 325-31. Impreso normalizado de solicitud de constitución y financiación de Redes TIC de Grupos: Historial científico de la red Página 96