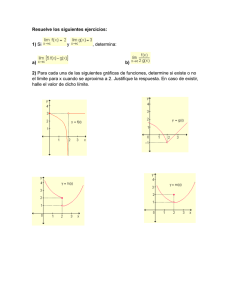
H pi 2m V r Z V ,T = Z1 V ,T N !
Anuncio

Física Estadística 2013 Licenciatura en Física Médica FCE-UNLP Práctica 5 1) Un poro tiene 3 configuraciones con los siguientes niveles de energía: 0, U 0, 2U0. El poro está en equilibrio térmico con su entorno a temperatura T. a) Halle las probabilidades p1, p2 y p3 de estar en cada nivel. b) Calcule las probabilidades del ítem a cuando T=300K y U 0=0,4142 10-20 J. c) idem si U0 fuera el doble. 2) Cuando una partícula de spin ½ es introducida en un campo magnético H, sus niveles de energía se desdoblan en –μH y +μH y tiene un momento magnético μ y –μ respectivamente en la dirección del campo magnético. Suponga que un sistema formado por un número N (del orden del número de avogadro) de tales partículas está en un campo H a una temperatura T. a) Halle la función de partición del sistema y calcule la energía libre F, la energía E, la entropía S y el calor específico C v. b ) Halle el momento magnético total M y compruebe que en el límite T>>μH/k se cumple la ley de Curie del paramagnetismo: χ=(∂M/∂H)H 0 = C/T 3) [Modelo para el ADN] Una molécula de ADN consiste de dos polímeros lineales entrelazados en una hélice doble. De cada monómero se desprenden una de las cuatro bases llamadas adenina (A), guanina (G), timina (T), o citosina (C), los que conforman los distintos enlaces que unen ambos ejes. El ADN tiene M enlaces, cada uno de los cuales puede estar en dos estados. Supondremos que el estado abierto tiene asociada energía nula, y el cerrado una energía ∆. El desentrelazado de la hélice doble se asemeja a la apertura de un cierre: un enlace puede abrirse solamente si todos los que están arriba ya se han abierto, como se ilustra en la figura. Debido a fluctuaciones térmicas, los puentes se pueden abrir o cerrar espontáneamente. El sistema está compuesto por N >> 1 de estas moléculas diluidas en un medio líquido; supondremos que estas no interactúan entre sí. a. Calcule la función de partición y la energía media del sistema. b. ¿Cuál es el número promedio de enlaces abiertos por molécula a temperatura T? c. Mostrar que a baja temperatura el número de enlaces abiertos por molécula es proporcional a e-β∆. 4) En la hélice doble de ADN, los enlaces correctos son A-T y G-C; se caracterizan por ser más fuertes que los enlaces incorrectos. La probabilidad de que ocurra un error a 300 K es del orden de 10-9 por par. Suponga que esta probabilidad está determinada por un factor de Boltzmann, llamando ε a la energía extra que requiere un error: i. Estime la energía ε. ii. Si estos errores fueran la única causa de mutación en un organismo, ¿cuánto cambiará el ritmo de mutación si la temperatura se incrementara en 20 C? 5) Calcule la función de partición canónica Z N V , T para un gas monoatómico. Suponga que el gas se encuentra a densidades tan bajas que puede ser modelado por el hamiltoniano N 2 p H N =∑ i V r i , donde V(ri) es un potencial que vale 0 dentro de una caja cúbica de i=1 2m volumen V, y es infinito fuera de la caja. Muestre que como las moléculas no interactúan Z 1 V , T N y derive la termodinámica, es decir obtenga expresiones para F, U, S y Z N V , T = N! PV=NkT. Compare los resultados con las ecuaciones termodinámicas de un gas ideal. 6) La masa típica de un virus pequeño es de 10 attogramos, es decir 10x10-21 kg. Suponiendo a los virus como partículas en equilibrio térmico con el aire, estimar cómo varía su concentración con la altura, suponiendo que su concentración a nivel del suelo es C(0). Evalúe la altura característica a la que dejaría de ser esperable encontrar este tipo de virus. Compare este resultado con el que correspondería al de una bacteria de E. coli, cuya masa es de 665 femtogramos (0,665x10 -18kg). 7) Las concentraciones de varios iones se miden tanto dentro como fuera de una célula nerviosa. Cuando el potencial eléctrico dentro de la célula es de -70 mV respecto de su exterior se miden las concentraciones de la tabla incluida debajo. En base a estos valores, comentar sobre qué especies tienen concentraciones que son consistentes con la hipótesis de que pueden pasar libremente por la pared de la célula. Considerar que T = 300 K. Cl- Ion Na+ K+ VInterior (mmol/l) 9 15 150 VExterior (mmol/l) 125 145 5