otras sustancias de interés biológico
Anuncio

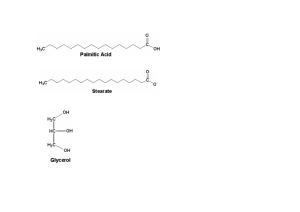
OTRAS SUSTANCIAS DE INTERÉS BIOLÓGICO GLÚCIDOS, HIDRATOS DE CARBONO O AZÚCARES Son los materiales más abundantes en la mayoría de las plantas. Se obtienen en las plantas a partir de la fotosíntesis: fotosíntesis Energía solar + 6CO2 + 6 H2O C6H12O6 + 6O2 Los animales realizan el proceso contrario para obtener energía. Ejemplos de glúcidos: Glucosa (C6H12O6) llamada azúcar de uva Fructosa (C6H12O6) llamada azúcar de fruta Sacarosa (C12H22O11) llamada azúcar de caña. Las moléculas sencillas pueden unirse, con separación de agua, para dar lugar a otras más complejas. También es posible el proceso inverso: las moléculas complejas se pueden descomponer al recuperar el agua que se desprende en su formación (hidrólisis). Estas hidrólisis se llevan a cabo con la participación de enzimas adecuadas. Almidón, glucógeno y celulosa son polímeros de elevada masa molecular. sacarosa + H2O glucosa + fructosa almidón + (n-1)H2O n glucosa Los glúcidos se puede clasificar en monosacáridos (moléculas simples no hidrolizables, por ejemplo la glucosa), disacáridos (por hidrólisis dan dos moléculas de monosacraridos, por ejemplo la sacarosa) y polisacáridos (almidón, celulosa, etc.). Los monosacaridos tienen un grupo aldehído o cetona y varios grupos alcohol. Se clasifican pues en aldosas (glucosa) y cetosas (fructosa). Según el número de carbonos pueden ser biosas, triosas, tetrosas, pentosas, hexosas. Los más importantes son las pentosas (ribosa) y las hexosas (glucosa, fructosa). CH2OH-CHOH-CHOH-CHOH-CHOH-CHO (aldosa) CH2OH-CHOH-CHOH-CHOH-CO-CH2OH (cetosa) La presencia de carbonos asimétricos en las moléculas de monosacáridos implica la existencia de numerosos isómeros ópticos. La celulosa es la sustencia orgánica más abundante en la Tierra. Los tallos jóvenes son casi exclusivamente celulósicos. Por hidrólisis se descompone (como el almidón y el glucógeno) dando glucosa. Las cadenas son muy largas (más de 10000 moléculas de glucosa). El hombre no tiene las enzimas necesarias para llevar a cabo la hidrólisis de la celulosa por lo que no puede alimentarse con este polisacárido. LÍPIDOS Son compuestos formados por C,H y O. Son insolubles en agua pero solubles en disolventes orgánicos (éter, benceno, etc.). Los lípidos más importantes son las grasas y los lipoides. GRASAS Son los ésteres de la glicerina (propanotriol) con diferentes ácidos grasos superiores con un número de átomos de carbono comprendido generalmente entre 12 y 24. Si son sólidas se llaman mantecas o sebos (manteca de cerdo, mantequilla, manteca de cacao, etc.). Las grasas líquidas se denominan aceites (aceite de oliva, girasol, etc.). En la hidrólisis de las grasas siempre aparecen la glicerina y diversos ácidos como: CH3-(CH2)12-COOH ác. palmítico CH3-(CH2)16-COOH ác. esteárico CH3-(CH2)7-CH=CH-(CH2)7-COOH ác. oléico CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH ác. linoleico La reacción de hidrólisis es del tipo: CH2OH R-COO-CH2 │ │ R-COO-CH + 3 H2O 3 R-COOH + CHOH │ │ R-COO-CH2 CH2OH Los ácidos de las grasas naturales tienen siempre un número par de átomos de carbono ya que en los procesos de formación y descomposición en los seres vivos siempre se unen y se separan los átomos de carbono de dos en dos. En las grasas sintéticas se pueden encontrar átomos de carbono impares. Cuando los ácidos contienen dobles enlaces (ácidos no saturados) las grasas son más blandas y funden más fácilmente. Los dobles enlaces no permiten que se aproximen mucho las moléculas. El aceite de oliva contiene hasta un 80% de ácido oleico (no saturado) por lo que es líquido a temperatura ambiente. La industria transforma aceites vegetales y de pescado en mantecas mediante la hidrogenación de los enlaces dobles de los ácidos no saturados. Saponificación de las grasas Se pueden saponificar las grasas con una disolución de NaOH. Se obtienen las sales alcalinas de los ácidos grasos y glicerina. Las sales alcalinas son los jabones. CH3-(CH2)16-COO-CH2 CH2OH │ CH3-(CH2)16-COO-CH + 3 NaOH │ 3 CH3-(CH2)16-COONa + CHOH │ │ CH3-(CH2)16-COO-CH2 CH2OH También se pueden obtener jabones saponificando con agua y neutralizando los ácidos grasos con Na2CO3 2 R-COOH + Na2CO3 2 R-COONa + CO2 + H2O Los jabones irritan la piel y los ojos debido a que su reacción es fuertemente alcalina. Además no actúan bien en aguas ácidas ni en aguas duras donde precipitan las sales de calcio y magnesio. Para solucionar estos problemas se fabrican los detergentes. Los detergentes son sales sódicas de ésteres del ácido sulfúrico con alcoholes superiores o ácidos sulfónicos NaOH R-CH2OH + HO-SO3H R-CH2-O-SO3H (ésteres) R-CH2-O-SO3Na NaOH R-H + HO-SO3H R-SO3H R-SO3Na (ácido sulfónico) Un ejemplo de detergente es el p-dodecilbencensulfonato de sodio CH3-(CH2)11-C6H4-SO3Na Los detergentes son bases muy débiles y además sus sales de Ca y Mg son solubles. Algunos resisten el ataque de lsa bacterias (no son biodegradables) y contaminan las aguas formando grandes cantidades de espumas. LIPOIDES Son sustancias de aspecto parecido a las grasas que se encuentran abundantemente en el cerbro, en la yema de huevo y en muchas plantas. Forman parte de la membrana plasmática de las células. Los más importantes son: Esterinas. Como el colesterol y la ergosterina de la que deriva la vitamina D Fosfátidos. Como la lecitina de la yema de huevo. Carotinoides. Como la carotina que es un pigmento presente en el tomate, zanahoria del que deriva la vitamina A.