- Ninguna Categoria
Teoría
Anuncio
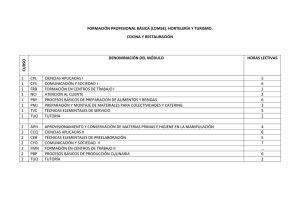
Reacciones químicas no elementales CAPITULO 6 – REACCIONES QUÍMICAS NO ELEMENTALES 6.1 INTRODUCCIÓN • Hemos mencionado que si una reacción es elemental, la velocidad de reacción debe presentar órdenes de reacción coincidentes con la estequiometría de la misma. Si los órdenes no coinciden con la estequiometría, la reacción es no elemental. • En el capítulo 5 hemos visto cómo estimar parámetros cinéticos de una reacción no elemental utilizando datos experimentales. En este capítulo veremos que una reacción no elemental puede descomponerse en una serie de etapas elementales, y a la vez que a partir de la cinética de las etapas elementales es posible determinar la cinética global de una reacción no elemental. • La cinética global de la reacción no elemental obtenida teóricamente debe comprobarse experimentalmente para que tenga absoluta validez. 6.2 FUNDAMENTOS Consideremos la siguiente reacción de descomposición de azometano (azo): (CH 3 )2 N 2 →C2H6 + N 2 La evidencia experimental indica que la velocidad de producción de nitrógeno es proporcional a la concentración de AZO para presiones mayores que 1 atm (i.e., relativas altas concentraciones): rN 2 ∝ C AZO Sin embargo, para presiones bajas (bajas concentraciones) la reacción es de segundo orden: rN 2 ∝ C AZO 2 Por lo pronto podemos asegurar que para bajas presiones, la reacción no es elemental. Por tal razón su cinética no condice con la estequiometría de la reacción. 6.2.1 Intermediarios Para el ejemplo anterior el AZO se descompone en dos productos, esta reacción puede llevarse en etapas, las cuales podrían resumirse a continuación: Capítulo 6 – Reacciones químicas no elementales 6.1 Reacciones químicas no elementales k 1 → (CH 3 )2 N 2 + (CH 3 )2 N 2 * 2(CH 3 )2 N 2 ← [ ] (6. 1) k2 k [(CH3 )2 N2 ]* → C 2 H6 + N 2 3 (6. 2) En la ecuación (6.1) se supone que dos moléculas colisionan entre sí, al hacerlo la energía cinética de las moléculas se transforma en energía vibracional lo que hace la generación de una especie intermediaria activa, la cual se llama comúnmente radical libre. También la colisión de dos moléculas pueden conducir a otras especies químicas que tengan carácter inestable. Simultáneamente el radical libre puede volver a su estado normal (por esta razón la reacción (6.1) tiene carácter reversible) o bien puede formar los productos de la reacción (ecuación 6.2). Es importante señalar que la serie de reacciones (6.1) y (6.2) representan un mecanismo de reacción propuesto. Si ambas etapas son elementales, podemos expresar la velocidad de formación de nitrógeno como sigue rN 2 = k 3C AZO * (6. 3) La concentración del intermediario es muy difícil de ser medida, de manera que tenemos que relacionar la concentración de esta especie con la concentración de otras especies que sean medibles. Para cumplir con este objetivo, vamos a plantear la velocidad de la especie AZO*. Esta especie aparece y desaparece en las reacciones (6.1) y (6.2), debemos tener en cuenta todos los caminos de producción o desaparición de esta especie: r AZO* = k 1C 2 AZO − k 2 C AZO* C AZO − k 3 C (6. 4) AZO* Si bien la formulación (6.4) es correcta, aún no tenemos expresada la C AZO* en función de concentraciones de especies medibles, es el momento de introducir aproximaciones que nos van ayudar a cumplir el objetivo mencionado. 6.3 HIPÓTESIS DE PSEUDO ESTADO ESTACIONARIO Debido a que las especies intermedias son inestables, se producen y a la vez desaparecen. Si la velocidad con que se producen las especies es idéntica a la velocidad que desaparecen podemos decir que la velocidad neta de esta especie es cero para todo tiempo o condición de reacción. En otras palabras: r AZO* = 0 = k 1C 2 AZO − k 2 C Capítulo 6 – Reacciones químicas no elementales AZO* C AZO − k 3 C AZO* (6. 5) 6.2 Reacciones químicas no elementales A partir de la ecuación (6.5) se puede despejar C AZO* = C AZO* : k 1C 2 AZO k 2 C AZO + k 3 (6. 6) Si sustituimos la ecuación (6.6) en la (6.3), resulta: rN2 = k 3 k 1C 2 AZO k 2 C AZO + k 3 (6. 7) Observemos la ecuación (6.7), si C AZO es muy grande (o k 2 C AZO >> k 3 ), la velocidad de reacción se reduce a: rN2 = k 3k 1 C AZO = kC AZO k2 (6. 8) La ecuación (6.8) está de acuerdo con los datos experimentales obtenidos a baja concentración, i.e. que la velocidad de reacción es proporcional a la C AZO elevada a orden 1. Si en la ecuación (6.7) C AZO es muy pequeña: rN2 = k 1C 2 AZO (6. 9) La ecuación (6.9) también está en buen acuerdo con la información experimental para concentraciones de reactivo bajas. De manera que podemos concluir que el mecanismo propuesto es correcto. Capítulo 6 – Reacciones químicas no elementales 6.3 Reacciones químicas no elementales Ejemplo 6.1 La formación de etileno a partir de etano es una reacción muy importante en nuestra región. En efecto, el etileno es una materia prima para producir polietileno (PBB-Polisur) y también para producir PVC (Solvay-Indupa). El etano que proveen las empresas TGS y MEGA, proviene del gas natural de pozos que transportan desde el sur (mediante gasoductos) hasta nuestra ciudad. El etileno se obtiene a partir de la pirólisis (o craqueo, o descomposición térmica) del etano. La secuencia que se cree como probable para la reacción es: k 1 C2 H6 → 2CH 3* (6. 10) k 2 CH 3* + C 2 H6 → CH 4 + C 2 H 5* (6. 11) k 3 C2 H 5* → C2H 4 + H * (6. 12) k 4 H * + C 2 H 6 → H 2 + C 2 H 5* (6. 13) k 5 2C2H5* → C4H10 (6. 14) Use el método de pseudo estado estacionario para determinar la velocidad de formación de etileno. La velocidad de formación de etileno está dada por: rC 2 H 4 = k 3CC H * (A) 2 5 No podremos estimar la velocidad de etileno hasta que expresemos el radical C 2 H 5* en función de concentraciones medibles. En este ejemplo existen varios * radicales libres: CH 3* , C 2 H 5 y H * . Para todas estas especies intermediarias podemos determinar la velocidad de cada una de ellas e igualarla a 0 por aceptar la hipótesis de pseudo estado estacionario: rCH * = 2k1CC 2 H 6 − k 2CCH * CC 2 H 6 = 0 3 3 (B) rC H * = k 2CCH * CC 2 H 6 − k 3CC H * + k 4CH * CC 2 H 6 − 2k 5CC H * 2 = 0 2 5 3 2 5 2 5 rH * = k 3CC H * − k 4CH * CC 2 H 6 = 0 2 5 (C) (D) Del sistema de ecuaciones (B) a (D) se puede estimar los intermediarios. De la ecuación (B) resulta: CCH * = 3 2k 1 k2 (E) Capítulo 6 – Reacciones químicas no elementales 6.4 Reacciones químicas no elementales Sumemos ahora las ecuaciones (C) y (D): 0 = k 2CCH * CC 2 H 6 − 2k 5C 2 C 2 H 5* 3 (F) Reemplazando (E) en (F) resulta: CC H * = 2 5 k1CC 2 H 6 (G) k5 Reemplazando la ecuación (G) en (A) resulta: rC 2 H 4 = k 3 k1CC 2 H 6 k5 velocidad de formación de etileno. 6.4 METODO DE LA ETAPA CONTROLANTE Cuando una reacción no elemental se plantea como una secuencia de etapas elementales, puede ser que uno conozca que alguna de ellas sea comparativamente más lenta que las otras. Como la reacción global procede con una única velocidad global, la velocidad seguramente será muy similar a la de la etapa controlante. El tiempo total necesario para producir una molécula de producto es simplemente la suma de los tiempos discretos necesarios para que se lleve a cabo cada etapa elemental del mecanismo global. Por lo tanto el tiempo de reacción promedio para la reacción global puede escribirse como: t promedio = t1 + t 2 + ... + t n (6. 15) n representa la existencia de n etapas elementales para definir la reacción global. ti corresponde a los tiempos efectivos necesarios para llevar a cabo la etapa i del mecanismo. La velocidad de reacción global será inversamente proporcional al tiempo promedio, i.e. cuanto más tardo para llevar a cabo la reacción global menor será la velocidad del proceso: r = 1 t promedio = 1 t1 + t 2 + ... + t n (6. 16) Haciendo un razonamiento análogo al anterior, los tiempos involucrados en cada una de las etapas están relacionados con la velocidad de reacción de cada una de las etapas: Capítulo 6 – Reacciones químicas no elementales 6.5 Reacciones químicas no elementales r = 1 1 1 1 + + ... + r1 r2 rn (6. 17) Si una de las etapas es muy lenta, su velocidad de reacción será muy baja y por lo tanto actuará como la mayor resistencia del proceso. Por esta razón la velocidad de la reacción global se iguala a la de la etapa más lenta: r = rlenta (6. 18) Si existe una reacción mucho más lenta que las demás, las reacciones elementales deben ser consideradas como extremadamente rápidas. Si las reacciones rápidas son reversibles, se asume que han llegado al equilibrio. Veremos como aplicar este método en el marco del ejemplo que sigue: Ejemplo 6.2 La reacción global que conduce a la formación de nitrógeno a través de la hidrogenación de óxido nítrico es: 2NO + 2H 2 → N 2 + 2H 2O (6. 19) Los datos de laboratorio indican que la velocidad de reacción tiene la siguiente expresión: 2 rN 2 = kCNO CH 2 (6. 20) Se han propuesto dos mecanismos diferentes: Mecanismo A k 1 2NO + H 2 → N 2 + H 2O2 (lenta) k 2 H 2O2 + H 2 → 2H 2O (rápida) (6. 21) (6. 22) Mecanismo B k 3 → 2NO N O (rápida) ← 2 2 (6. 23) k4 k 5 N 2O2 + H 2 → N 2 + H 2O2 (lenta) k 2 H 2O2 + H 2 → C4 H10 (rápida) (6. 24) (6. 25) Demuestre que ambos mecanismos están de acuerdo con los datos experimentales. Utilice para esto el método de las cadenas largas. Capítulo 6 – Reacciones químicas no elementales 6.6 Reacciones químicas no elementales Solución Mecanismo A k 1 2NO + H 2 → N 2 + H 2O2 (lenta) k 2 H 2O2 + H 2 → 2H 2O (rápida) dado el mecanismo anterior, la velocidad de formación de nitrógeno está dada por: 2 rN 2 = k1CNO CH 2 no se necesitan más pasos para completar la definición de la velocidad de reacción global. Por lo tanto, el mecanismo A está de acuerdo con los datos experimentales. Mecanismo B k 3 → 2NO N O (rápida) ← 2 2 k4 k 5 N 2O2 + H 2 → N 2 + H 2O2 (lenta) k 2 H 2O2 + H 2 → C4 H10 (rápida) dado el mecanismo anterior, la velocidad de formación de nitrógeno está dada por: rN 2 = k 5CN 2O2 CH 2 (A) debido a que la reacción anterior no queda expresada en función del reactivo de la reacción global, debemos encontrar una función que relaciones la CN 2O2 con CNO . Para esto podemos suponer que la primera reacción que ocurre muy rápidamente, se encuentra prácticamente en equilibrio. Por lo tanto la velocidad de N2O2 puede igualarse a 0: 2 0 = k 3CNO − k 4CN 2O2 k 2 CN 2O2 = 3 CNO k4 si reemplazamos esta última ecuación en la expresión de velocidad de reacción (A) resulta: k k 2 rN 2 = 5 3 CNO CH 2 k4 El resultado anterior indica que el mecanismo B también es consistente con los datos experimentales. Como conclusión adicional puede mencionarse que es posible que dos mecanismos diferentes conduzcan a una cinética que represente adecuadamente las experiencias. Capítulo 6 – Reacciones químicas no elementales 6.7 Reacciones químicas no elementales Ejemplo 6.3 Considere la siguiente reacción global: 2N 2O5 → O2 + 4NO2 (6. 26) Se supone que la reacción ocurre en los siguientes pasos elementales: k 1 → N 2O5 NO2 + NO3 (rápida) ← (6. 27) k2 k 3 NO3 + NO2 → NO + O2 + NO2 (lenta) k 4 NO + NO3 → 2NO2 (rápida) (6. 28) (6. 29) Determine una expresión cinética global basada en el mecanismo arriba detallado. Solución: Método de la etapa controlante: Debido a que la reacción (2) es la etapa controlante, la velocidad de reacción viene dada por: rO2 = k 3CNO3 CNO2 (A) planteando que la reacción (6.27): 0 = k1CN O − k 2CNO2 CNO3 (B) 2 5 de la ecuación (B) resulta: k CNO2 CNO3 = 1 CN O (C) 2 5 k2 reemplazando (C) en (A): k k rO2 = 1 3 CN O 2 5 k2 Método de pseudo estado estacionario Resolvamos ahora el mismo problema pero utilizando el método de pseudo estado estacionario. Las especies NO y NO3 no figuran en la reacción global, por lo tanto ambas especies pueden considerarse que aparecen y desaparecen con igual velocidad por lo tanto: Capítulo 6 – Reacciones químicas no elementales 6.8 Reacciones químicas no elementales Para el NO3 resulta: 0 = k1CN 2O5 − k 2CNO2 CNO3 − k 3CNO2 CNO3 − k 4CNOCNO3 (A) Para el NO resulta: 0 = k 3CNO2 CNO3 − k 4CNOCNO3 (B) de esta última ecuación resulta: k CNO = 3 CNO2 (C) k4 reemplazando la ecuación (C) en (A) resulta: 0 = k1CN 2O5 − k 2CNO2 CNO3 − k 3CNO2 CNO3 − k 3CNO2 CNO3 CNO3 = k1CN 2O5 (k 2 + 2k 3 )CNO2 (D) recordando que la velocidad de reacción viene dada por: rO2 = k 3CNO3 CNO2 (E), y reemplazando (D) en (E): rO2 = k1k 3CN 2O5 (k 2 + 2k 3 ) (F) . Comparando la ecuación (F) obtenida con el método de pseudo estado estacionario con la ecuación cinética obtenida por el método de la etapa controlante, vemos que la ecuación (F) puede igualar a la obtenida por el método de la etapa controlante si k2>>2k3. Lo cual indica que k3 es muy pequeña. En otras palabras, la cinética obtenida con mediante el método de estado estacionario iguala a la obtenida por el método de la etapa controlante si se asume que el segundo paso elemental propuesto es muy lento. 6.5 METODO DE LAS CADENAS LARGAS Las reacciones en cadena son ejemplos de reacciones complejas. En una reacción en cadena una especie intermediaria se produce en una etapa. En una etapa siguiente se consume y en otra se vuelve a producir, de manera que la especie intermediaria que se genera una vez puede participar en numerosos ciclos posteriores. Los intermediarios para este caso particular suelen llamarse portadores de cadena, algunas veces pueden ser radicales o también iones. En el caso de la fisión nuclear se trata de neutrones. Existen diversas etapas en una reacción en cadena, veamos las siguientes: Iniciación de la cadena El proceso de una reacción en cadena puede iniciarse a causa de un efecto térmico, fotolítico o bien por el agregado a la mezcla de reacción de un iniciador. En los casos que no Capítulo 6 – Reacciones químicas no elementales 6.9 Reacciones químicas no elementales se agrega el iniciador de manera externa, lo que ocurre es la ruptura de un enlace de una molécula ya sea por calor o por absorción de luz. Por ejemplo: Br2 → 2Br • I2 → 2 I • I+M→R• e.g., caso por descomposición térmica e.g., caso iniciado por iniciador externo, I (iniciador), M (reactivo), R • (radical que interviene en la etapa de propagación) Propagación En esta etapa el portador de la cadena genera otro portador: Br • + H2 → HBr + H • H • +Br2 → Br • + HBr Como se puede ver el radical generado en la etapa de iniciación genera otro que en la siguiente etapa vuelve a liberar el radical original. En la etapa de propagación es común que se observe una secuencia cerrada para algún radical, es decir que se consume en la primera reacción de propagación y aparece en las segunda de las reacciones. En esta etapa en general se consumen reactivos y se genera producto (la reacción general para este ejemplo es Br2 + H2 → 2HBr ) . La etapa de propagación comúnmente es mucho más rápida que la de iniciación, pueden darse muchos ciclos de propagación por un ciclo de iniciación. Terminación En la etapa de terminación, los radicales se combinan para dar especies estables. Por lo tanto se pierden los portadores de cadena. Para nuestro ejemplo: 2B r • → Br2 Existen otras etapas dentro del mecanismo global de las reacciones en cadena, como por ejemplo la etapa de transferencia de cadena donde un radical forma otro radical que participa en las reacciones de propagación, etapas de retardo o bien de inhibición. Sin embargo, se han enunciado las más comunes para cinéticas simples. La etapa de terminación corresponde a una reacción relativamente mucho más lenta que las de propagación, en efecto si calculamos la relación entre la velocidad de propagación con respecto a la de terminación ( o bien la de iniciación) resulta: Capítulo 6 – Reacciones químicas no elementales 6.10 Reacciones químicas no elementales rpropagació n riniciación (rter min ación ) >>>> 1 La relación anterior suele llamarse longitud de la cadena. La secuencias de etapas puede anteriores permiten obtener la cinética de la reacción. Una metodología sería aplicar el método de pseudo estado estacionario de los radicales presentes para determinar la expresión cinética, lo cual es válido. Sin embargo si se trata de un reacción en cadena, también puede aplicarse otra metodología: la aproximación de las cadenas largas que veremos a continuación. 6.5.1 Aproximación de las cadenas largas En el mecanismo se debe distinguir correctamente la etapa de propagación, identificando la secuencia cerrada descripta anteriormente. Esta distinción permite separar las etapas de propagación de las restantes. Las velocidades de las etapas de iniciación y terminación son similares, de manera que la primera ecuación que me permitirá expresar radicales en función de especies estables es la siguiente: rR • ( en las etapas de iniciación ) = rR • (en las etapas de ter min ación ) (6. 30) Si esta ecuación es insuficiente para determinar todos los radicales, se puede aplicar el concepto de pseudo estado estacionario a los radicales incógnitas sólo en las etapas de propagación. Es decir, se plantea el concepto de pseudo estado estacionario en etapas de igual velocidad (terminación e iniciación por un lado, y propagación por otro. Ejemplo 6.4 k 1 Br2 → 2Br • Iniciación k 2 Br • + H2 → HBr + H • k 3 H • +Br2 → Br • + HBr Propagación k 4 → Br Terminación 2Br • 2 Use el método de las cadenas largas para estimar la velocidad de HBr. Capítulo 6 – Reacciones químicas no elementales 6.11 Reacciones químicas no elementales Solución rHBr = k 2 CBr • C H2 + k 3 CH• CBr2 Para definir la velocidad de reacción en función de especies estables debemos plantear dos ecuaciones, la primera de ellas igualaremos la velocidad de formación del radical bromuro a la iniciación y terminación: rBr • iniciación = rBr • ter min ación 2k 1CBr2 = 2k 4 C 2Br • CBr • = k 1CBr2 k4 Como nos falta una ecuación determinamos, la concentración del radical H de la etapa de propagación: rH• propagación =0 k 2 CBr • CH2 − k 3 CBr2 CH• = 0 k2 CH • = k 1CBr2 k4 CH2 k 3 CBr2 1/ 2 rHBr k = k 2 1 k4 rHBr k = k 2 1 k4 (CBr2 ) 1/2 1/ 2 C H2 + k 3 (CBr2 )1/2 C H2 + k 2 1/ 2 k rHBr = 2k 2 1 k4 k2 k 1CBr2 k4 CH2 k 3CBr2 k 1CBr2 k4 CBr2 CH2 = (CBr2 )1/2 C H2 Capítulo 6 – Reacciones químicas no elementales 6.12 Reacciones químicas no elementales Ejemplo 6.5 Consideremos el siguiente mecanismo de reacción también propuesto para la formación de etileno a partir de etano. k 1 1) C 2H6 → 2CH3* k 2 2) CH3* + C 2H6 → CH4 + C 2H5 * * k 3 C 2H 4 + H * 3) C 2H5 → k 4 →H + C H * 4) H* + C 2H6 2 2 5 * k 5 C 2H 6 5) H* + C 2H5 → Use el método de las cadenas largas para estimar la velocidad de formación de etileno, compare los resultados con los que se obtengan usando el método de estado estacionario. Solución a) Cadenas largas: 1) Distinguir etapas de propagación: Para hacerlo se necesita distinguir la secuencia cerrada de un radical. Observando las reacciones dadas, se puede decir que las etapas de propagación son las reacciones 3 y 4, siendo el radical C2H5* el que se consume en la reacción 3 y reaparece en la reacción 4. La etapa de terminación es la 5, mientras que el proceso se inicia por la 1, y existe una etapa de transferencia donde se genera un nuevo radical (etapa 2). Esta etapa es lenta comparada con la de propagación, de manera que la etapa de transferencia puede considerarse como una de iniciación en lo que respecta a su velocidad. 2) Cálculo de velocidad de reacción: La velocidad de formación de etileno está dada por: rC2H4 = k 3 C * C2H5 Ahora planteamos que la velocidad del radical C2H5* en la iniciación y terminación son iguales: k 2 C * C C2H6 − k 5 CH * C * =0 C2H5 CH3 C C2H5* = k 2C * C C2H6 CH3 k 5 CH * Para poder expresar la concentración de este radical adecuadamente necesitamos encontrar las concentraciones de los radicales CH3* y H*. Para ello planteamos el método de pseudo estado estacionario en la etapa de iniciación de para el CH3*: Capítulo 6 – Reacciones químicas no elementales 6.13 Reacciones químicas no elementales r * CH3 C = 2k 1C C2H6 − k 2 C =0 2k 1 k 2 = * CH 3 * C C2H6 CH3 Para obtener el radical H*, planteamos el método de pseudo estado estacionario sólo en la etapa de propagación: k 3C C H* C2H5* = − k 4 C * C C2H = 0 6 H k 3C C2H5* k 4CC2H 6 Para determinar el radical C C2H5* , reemplazamos en el las expresiones de los dos radicales ya halladas: k2 C C2H5* = k5 C C2H5* 2k 1 C C2H6 2k 1C 2 C2H6 2k 1k 4 C 2 C2H6 k2 = = k 3C k 3k 5 C k 3k 5 C * C H * C H * 2 5 k 4 C C2H 2k k = 1 4 k 3k 5 C2H5 2 5 k4 6 1/ 2 C C2H6 Ahora podemos reemplazar este radical en la expresión de velocidad de reacción de formación de etileno: rC2H4 2k k = k 3 1 4 k 3k 5 1/ 2 C C2H6 2k k k = 1 3 4 k5 Capítulo 6 – Reacciones químicas no elementales 1/ 2 C C2H6 6.14 Reacciones químicas no elementales b) Método de pseudo estado estacionario La velocidad de formación de etileno está dada por: rC2H4 = k 3 C C2H5* radical C2H5* ): k 2 C * C C2H6 CH3 − k 3C C2H5* 2k 1C C2H6 − k 2 C radical CH3*): radical H*): k 3C + k 4 CH * C C2H6 − k 5 CH * C * C C2H6 CH3 C2H5* = 0 (B) − k 4 C * C C2H − k 5 C * C C2H * = 0 C2H5* 6 H = 0 (A) H 5 (C) De la ecuación B) resulta: C * CH3 = 2k 1 k2 Sumando (A) +(C): k 2C C * C C2H6 CH3 = C2H5* k 2C − 2k 5 CH * C C2H5* =0 * C C2H6 CH3 2k 5 CH * De la ecuación C) C H* k 3C = C2H5* k 4 C C2H + k 5 C C2H * 6 5 Reemplazando D) y G) en (E): k2 C C2H5* = 2k 5 2k 1 C C2H6 k2 k 3C * C2H5 k 4 C C2H + k 5 C C2H * 6 5 2k 5k 3 C 2 C2H5* = 2k 1k 4 C 2 C2H 6 + 2k 5k 1C C2H6 C C2H * 5 k 5k 3 C 2 C2H5* C C2H * = − k 5k 1C C2H6 C C2H * −k 1k 4 C k 5k 1C C2H6 ± 5 2 C2H 6 =0 (k 5k1CC2H6 )2 + 4k 5k 3k1k 4C2C2H6 5 2k 5 k 3 La raíz factible la da el signo +: C C2H * = k 5k 1C C2H6 + (k 5k1CC2H6 )2 + 4k 5k 3k1k 4C2C2H6 5 Capítulo 6 – Reacciones químicas no elementales 2k 5k 3 6.15 Reacciones químicas no elementales C C2H * = (k 5k1 )2 + 4k 5k 3k1k 4 k 5k 1C C2H6 + 5 k k + 5 1 C C2H 6 2k 5k 3 (k 5k1 )2 + 4k 5k 3k1k 4 2k 5 k 3 = C C2H 6 reemplazando esta expresión en la de velocidad de reacción: k k rC2H4 = k 3 5 1 + 2k 5k 3 rC2H4 k = k 3 1 + 2k 3 (k 5k1 )2 2 4k 5 k 3 k 12 4k 3 2 + 2 + 4k 5k 3k 1k 4 C 2 2 C2H 6 4k 5 k 3 k 1k 4 CC H Expresión final por método de est.est. k 5k 3 2 6 Ahora si asumimos que k1/2k3<<<<1, lo cual es lo mismo que asumir que la etapa 3 es mucho más veloz que la de iniciación resulta: rC2H4 = k 3k 4k 1 C C2H6 , expresión que depende de las mismas variables que k5 cuando supusimos cadenas largas. Como conclusión de las tareas desarrolladas, podemos decir que el método de estado estacionario es siempre aplicable. En ciertas situaciones las cinéticas resultantes pueden ser complejas, de modo que si conocemos otra propiedad del mecanismo puede ser que se vea simplificada la versión final. La versión simplificada da cinéticas que están de acuerdo con los otros métodos de aproximación. Capítulo 6 – Reacciones químicas no elementales 6.16
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados