FICHA TÉCNICA SOTALOL TEVA 80 mg COMPRIMIDOS EFG
Anuncio

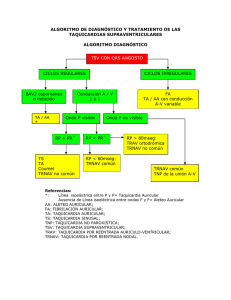
FICHA TÉCNICA 1. Nombre del medicamento Sotalol Teva 80 mg Comprimidos EFG 2. Composición cualitativa y cuantitativa Cada comprimido ranurado contiene 80 mg de sotalol hidrocloruro. Para consultar la lista completa de excipientes, ver sección 6.1. 3. Forma farmacéutica Comprimidos. 80 mg: comprimidos celestes, ovalados, con una ranura en un lado y marcados con los números “93” y “61” a cada lado de la ranura, lisos por el otro lado. Los comprimidos se pueden dividir en mitades iguales. 4. Datos clínicos 4.1. Indicaciones terapéuticas Profilaxis de: - taquicardias ventriculares amenazantes para la vida; - taquicardias ventriculares sintomáticas y no sostenidas documentadas en ausencia de fallo cardíaco no controlado; - taquicardias supraventriculares documentadas en ausencia de fallo cardíaco no controlado cuando sea necesario un tratamiento (por ejemplo, mantenimiento del ritmo sinusal tras el cambio de fibrilación atrial o flutter atrial). 4.2. Posología y forma de administración El inicio del tratamiento o la modificación de la posología se harán tras una valoración médica adecuada, incluyendo control del ECG con medida del intervalo QT ajustado y de los niveles de potasio, evaluación de la función renal y teniendo en cuenta la medicación concomitante (ver sección 4.5) Como con otros antiarrítmicos, se recomienda iniciar el tratamiento con sotalol y aumentar las dosis controlando el ECG, ya que los efectos proarrítmicos pueden producirse no solamente al inicio del tratamiento sino también cada vez que se modifique la posología. El tratamiento de taquicardias ventriculares amenazantes para la vida debe iniciarse bajo control hospitalario. La dosis inicial es de 80 mg administrados en 1 sola dosis o dividida en 2 dosis administradas cada 12 horas. Los aumentos de dosis deben estar separados por intervalos de 2 o 3 días hasta alcanzar el estado estacionario y permitir la monitorización del intervalo QT. CORREO ELECTRÓNICO [email protected] Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima) C/ CAMPEZO, 1 – EDIFICIO 8 28022 MADRID La mayoría de los pacientes responden a una posología comprendida entre 160 y 320 mg administrados divididos en dos dosis (por ejemplo 2 x 160 mg) o tres dosis (por ejemplo 3x 80 mg) al día. En determinados pacientes con arritmias con amenaza para la vida, la dosis puede aumentarse hasta 480 mg o 640 mg al día, no obstante, estas dosis solo deberían prescribirse cuando el posible beneficio compense el riesgo de que aumenten las reacciones adversas, en particular las proarrítmias. Posología en pacientes con insuficiencia renal: la posología debe ajustarse en función del aclaramiento de la creatinina, ya que sotalol se excreta principalmente en la orina. También habría que tener en cuenta el ritmo cardíaco (no debería ser inferior a 50 latidos por minuto) y el efecto clínico. Aclaramiento de creatinina (ml/min) > 60 30 – 60 10 - 30 < 10 Posología recomendada Dosis habitual Media dosis Un cuarto de la dosis Evitar sotalol Fórmula de Cockcroft y Gault: Hombres: (140 - edad) × peso (kg) 72 × creatinina sérica (mg/dl) Mujeres: igual fórmula x 0,85. Si la creatinina se expresa en µmol/l, su valor se divide por 88,4 (1 mg/dl = 88,4 µmol/l). Posología en pacientes con insuficiencia hepática: No se requieren ajustes de la posología. Ancianos: La posología inicial no tiene que adaptarse con la edad. Puede ser necesario modificar la dosis si debido a la edad se produce insuficiencia renal. (ver también Posología en insuficiencia renal). Niños: Debido a la falta de datos, no está indicado el uso de sotalol en niños. Los comprimidos deben tomarse con una cantidad suficiente de líquido (por ejemplo un vaso de agua) e ingerirse enteros. MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios 4.3. Contraindicaciones Sotalol está contraindicado en las situaciones siguientes: - Síndromes QT prolongados (congénitos o adquiridos) - Torsades de pointes - Hipersensibilidad conocida a sotalol, sulfonamidas o alguno de los excipientes de la formulación - Asma bronquial y enfermedad pulmonar obstructiva crónica - Insuficiencia cardíaca no controlada. - Shock cardiogénico - Bloqueo atrioventricular de 2° y 3° grado, sin marcapasos - Angina de pecho Prinzmetal - Enfermedad del seno (incluyendo bloqueo sino-atrial) sin marcapasos - Bradicardia (< 50 latidos/minuto) Fenómeno de Raynaud y alteraciones circulatorias periféricas Feocromocitoma no tratado Hipotensión arterial (excepto cuando se debe a arritmias) Anestesia, que produce depresión del miocardio Insuficiencia renal grave (aclaramiento de creatinina < 10 ml/min) Acidosis metabólica Combinación con sustancias que causan torsades de pointes: Antiarrítmicos clase Ia (quinidina, hidroquinidina, disopiramida…), Antiarrítmicos clase III (amiodarona, dofetilida, ibutilida…), Algunos neurolépticos (tioridazina, clorpromazina, levomepromazina, trifluoperazina, ciamemazina, sulpirida, sultoprida, amisulprida, tiaprida, pimozida, haloperidol, droperidol…), - 4.4. Otros principios activos como bepridil, cisaprida, difemanilo, eritromicina IV, mizolastina, vincamina IV, moxifloxacino… Floctafenina (ver sección 4.5). Advertencias y precauciones especiales de empleo Advertencias: No interrumpir nunca el tratamiento bruscamente en pacientes con angina de pecho: podría causar arritmias graves, infarto de miocardio y muerte súbita, o podría desenmascarar una enfermedad cardíaca coronaria latente. Se recomienda controlar los pacientes, especialmente si sufren isquemia cardíaca, y disminuir la dosis gradualmente en 1-2 semanas. MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios Los efectos adversos más graves de los principios activos antiarrítmicos son el empeoramiento de arritmias preexistentes o provocar nuevas arritmias. Los principios activos que prolongan el intervalo QT, incluyendo sotalol, pueden provocar torsades de pointes. Se han identificado los factores que favorecen este efecto: - largo intervalo QT espontáneo (> 450 ms) antes del tratamiento - bradicardia (< 60 pulsaciones por minuto) - hipokaliemia o hipomagnesemia (especialmente en tratamiento concomitante con diuréticos proximales) - altos niveles en sangre de sotalol, por sobredosis, o por acumulación debido a insuficiencia renal del paciente - asociación con otros medicamentos que favorecen torsades de pointes (ver sección 4.3 y sección 4.5) - arritmias ventriculares graves - en las mujeres parece aumentar el riesgo de torsades de pointes La incidencia de torsades de pointes depende de la dosis. Las proarrítmias se producen con más frecuencia durante la primera semana de tratamiento o debido a ajustes de dosis. No obstante, puede ocurrir tras un largo periodo de tratamiento incluso sin cambiar la dosis. Puede ser sintomático (síncopes), puede desaparecer espontáneamente o en casos más raros progresar a fibrilación ventricular. En estudios clínicos de pacientes con arritmias ventriculares amenazantes para la vida (taquicardias ventriculares sostenidas o fibrilación ventricular), la incidencia de proarrítmias graves (torsades de pointes o nuevas taquicardias ventriculares o fibrilación ventricular) era menor a 2 % para dosis de hasta 320 mg. La incidencia es más del doble para dosis mayores. El mayor riesgo de desarrollar proarrítmias graves con sotalol (7 %) se presenta en pacientes con taquicardia ventricular sostenida y fallo cardíaco. El riesgo de proarrítmias puede reducirse iniciando el tratamiento con 80 mg y aumentando la dosis progresivamente. Durante el tratamiento, debe efectuarse un control médico estricto y del electrocardiograma (ECG) a intervalos regulares. Si los parámetros ECG se deterioran (por ejemplo prolongación del intervalo QRS o QT del 25% o superior, prolongación del intervalo PQ del 50% o superior o si el intervalo QTc supera 480 ms) o si la frecuencia y gravedad de las arritmias aumenta, debería efectuarse una nueva evaluación de la relación beneficio riesgo. Como este medicamento contiene lactosa, no es adecuado para pacientes con galactosemia congénita, síndrome de malabsorción de glucosa o galactosa o deficiencia de lactasa. Precauciones de empleo: MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios - Bradicardia Si el ritmo cardíaco desciende a 50-55 pulsaciones por minuto en reposo y los pacientes presentan síntomas relacionados con bradicardia, debe disminuirse la dosis. La bradicardia aumenta el riesgo de torsades de pointes. - Bloqueo atrioventricular de primer grado Dado su efecto dromotrópico negativo, sotalol debe administrarse con precaución a pacientes con bloqueo atrioventricular de primer grado. - Insuficiencia cardiaca Se aconseja precaución al inicio del tratamiento con sotalol y durante el ajuste de dosis, en pacientes con insuficiencia ventricular izquierda en tratamiento (con inhibidores de la enzima convertidora de angiotensina, diuréticos, digitalis...). Debido a sus propiedades beta-bloqueantes, sotalol puede disminuir adicionalmente la contractibilidad del miocardio y precipitar una descompensación repentina de la insuficiencia cardiaca grave. - Infarto de miocardio reciente En los pacientes que han sufrido infarto de miocardio con la función ventricular izquierda disminuida, debe evaluarse la relación beneficio/riesgo del tratamiento con sotalol. Si el tratamiento es realmente necesario, durante el inicio y cualquier modificación posterior de la posología es fundamental la monitorización. Debe evitarse sotalol en pacientes con una fracción de eyección ≤ 40% sin arritmias ventriculares graves. - Alteraciones electrolíticas No debe emplearse sotalol en pacientes con hipokaliemia o hipomagnesemia antes de corregir el desequilibrio. Debe controlarse estrechamente el balance electrolítico y ácido-base en pacientes con diarrea grave o crónica, o en pacientes que estén en tratamiento concomitante con medicamentos que provocan depleción de magnesio y/o potasio. -Anafilaxia Debido a sus propiedades beta-bloqueantes, sotalol puede agravar las reacciones anafilácticas y causar resistencia al tratamiento con dosis normales de adrenalina en pacientes propensos a reacciones anafilácticas graves de cualquier origen, y especialmente si son debidas a floctafenina o a contrastes iodados (ver sección 4.5) o aparecen durante la terapia de desensibilización. - Tirotoxicosis Debido a sus propiedades beta-bloqueantes, sotalol puede enmascarar los signos cardiovasculares de tirotoxicosis. - Psoriasis MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios Tiene que reconsiderarse su prescripción, ya que se ha descrito la exacerbación de esta enfermedad con beta-bloqueantes. - Ancianos Deben respetarse estrictamente las contraindicaciones. Se debe intentar iniciar el tratamiento con dosis bajas y asegurar un estricto seguimiento. - Insuficiencia renal En pacientes con insuficiencia renal, la posología debería adaptarse a la función renal. - Diabetes mellitus Informar al paciente y aumentar el auto-control de la glucemia al inicio del tratamiento. Los signos de hipoglucemia pueden estar enmascarados, en concreto taquicardia, palpitaciones y sudor. - Cambios en el electrocardiograma Si se observa una excesiva prolongación del intervalo QT (> 480 min.), se requiere un control estricto y una nueva evaluación de la relación beneficio/riesgo. El riesgo de torsades de pointes es proporcional al grado de prolongación del intervalo QT. - Anestesia general Debido a sus propiedades beta-bloqueantes, sotalol puede disminuir la taquicardia refleja y aumentar el riesgo de hipotensión. La continuación del tratamiento con sotalol disminuye el riesgo de arritmia, isquemia miocardiaca y crisis hipertensivas. Hay que informar al anestesista que el paciente está en tratamiento con sotalol. Si se juzga necesario interrumpir el tratamiento, se considera suficiente un plazo de 48 horas para recuperar la sensibilidad a las catecolaminas. En algunos casos, no puede interrumpirse el tratamiento con sotalol. En pacientes con isquemia cardiaca o enfermedad coronaria, es preferible continuar el tratamiento hasta la intervención, dado el riesgo asociado a la interrupción brusca de los beta-bloqueantes. En caso de urgencia o si es imposible interrumpir el tratamiento, se debe administrar previamente al paciente una cantidad suficiente de atropina para evitar predominancia vagal, volviéndola a administrar en función de las necesidades. Deben emplearse anestésicos con una mínima acción depresora del miocardio y debe compensarse cualquier pérdida de sangre. - GENERALMENTE NO SE RECOMIENDA sotalol en combinación con halofantrina, pentamidina, esparfloxacino, o metadona (ver sección 4.5), ni durante la lactancia. - Generalmente no se recomienda sotalol asociado con determinados medicamentos (ver sección 4.5 "Asociaciones no recomendadas”). - Tampoco se recomienda con medicamentos que puedan inducir hipertensión (por ejemplo IMAOs). 4.5. Interacción con otros medicamentos y otras formas de interacción Las características especiales de sotalol pueden causar arritmias graves (torsades de pointes), especialmente en casos de hipokaliemia y/o bradicardia. En cuanto a las MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios interacciones con otros medicamentos, debería tenerse en cuenta que es un antiarrítmico. La combinación con otros medicamentos es por tanto MUY DELICADA, si no CONTRAINDICADA, y requiere un estrecho control clínico y del ECG. Asociaciones contra-indicadas: - Floctafenina: en caso de shock o hipotensión inducida por floctafenina, sotalol impide el mecanismo de compensación cardiovascular. - Medicamentos inductores de torsades de pointes: principios activos antiarrítmicos clase Ia (quinidina, hidroquinidina, disopiramida), y principios activos antiarrítmicos clase III (amiodarona, dofetilida, ibutilida…), algunos neurolépticos (tioridazina, clorpromazina, levomepromazina, trifluoperazina, ciamemazina, sulpirida, sultoprida, amisulprida, tiaprida, pimozida, haloperidol, droperidol…), bepridil, cisaprida, difemanilo, eritromicina IV, mizolastina, vincamina IV, moxifloxacino… Aumentan el riesgo de arritmias ventriculares, particularmente torsades de pointes. Asociaciones no recomendadas: - Halofantrina, pentamidina, esparfloxacino, metadona: Aumentan el riesgo de arritmias ventriculares, particularmente torsades de pointes. - Si es posible, hay que interrumpir los medicamentos inductores de torsades de pointes, a no ser que se trate de un antiinfeccioso. Si no se puede evitar la combinación, debe medirse el intervalo QT previamente y controlarse el ECG. - Diltiazem, verapamilo: Como con otros beta-bloqueantes, pueden aparecer alteraciones en el automatismo (bradicardia excesiva, parada sinusal), alteraciones de la conducción atrioventricular y sinoatrial y fallo cardíaco (efecto sinérgico). Este tipo de combinación sólo deberá utilizarse con estrecho control clínico y del ECG, especialmente en ancianos y al inicio del tratamiento Asociaciones que requieren precauciones de empleo: - Medicamentos hipokaliemiantes (diuréticos ahorradores de potasio, laxantes estimulantes, glucocorticoides, tetracosactida, amfotericina B (IV)): Aumentan el riesgo de arritmias ventriculares, particularmente torsades de pointes. Debería corregirse cualquier disminución en los niveles de potasio antes de administrar el producto. Es necesario control clínico, electrolítico y del ECG. - -Medicamentos inductores de bradicardia (antagonistas del calcio inductores de bradicardia: diltiazem, verapamilo; antihipertensivos de acción central tales como clonidina, guanfacina, alfa-metildopa; glucósidos digitálicos incluyendo digoxina; antiarritmicos de clase Ia y Ic; mefloquina; inhibidores de la colinesterasa tales como los utilizados en la enfermedad de Alzheimer p. ej. donepezilo, rivastigmina, tacrina, galantamina, neostigmina, piridostigmina, ambemonio; pilocarpina, otros agentes beta-bloqueantes) Aumentan el riesgo de arritmias ventriculares, particularmente torsades de pointes, dado que las propiedades de sotalol también inducen torsades de pointes. Es necesario el control clínico y del ECG. MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios Adicionalmente, para los antihipertensivos de acción central, puede producirse hipertensión de rebote si se interrumpen bruscamente. - Anestésicos volátiles halogenados: sotalol disminuye el mecanismo de compensación cardiovascular (los beta-agonistas pueden emplearse durante el procedimiento para ayudar a los beta-bloqueantes). Como regla general, no debería interrumpirse el tratamiento con sotalol y nunca debe interrumpirse bruscamente. Se debe informar al anestesista de que el paciente está en tratamiento con sotalol. - Insulina, sulfonamidas hipoglucemiantes: Todos los beta-bloqueantes pueden enmascarar ciertos signos de hipoglucemia: palpitaciones y taquicardia. La mayoría de los beta-bloqueantes no cardioselectivos aumentan la incidencia y gravedad de la hipoglucemia. Informar al paciente y aumentar el autocontrol sanguíneo, especialmente al inicio del tratamiento. - Propafenona: Alteraciones de la contractibilidad, automatismo y conducción (inhibición de los mecanismos simpaticomiméticos compensatorios). Es necesario el control clínico y del ECG. - Baclofeno: Aumento del efecto antihipertensivo. Debe controlarse la tensión arterial y ajustarse si es necesario la dosis del antihipertensivo. - Lidocaína (administración intravenosa): Aumento de los niveles plasmáticos de lidocaina, con posibles efectos adversos neurológicos y cardíacos (por disminución del aclaramiento hepático de lidocaina) Se requiere control clínico y del ECG. Asociaciones a tener en cuenta: - AINES (se extrapolan los datos de indometacina): Disminuyen el efecto antihipertensivo (los AINES inhiben las prostaglandinas vasodilatadoras; los AINES pirazólicos retienen sodio y agua). - Antidepresivos del grupo de la Imipramina (tricíclicos), neurolépticos fenotiazínicos, amifostina: Aumento del efecto antihipertensivo y riesgo de hipotensión ortostática (efecto aditivo). - Bloqueantes de los canales de calcio (dihidropiridinas): hipotensión, fallo cardíaco en pacientes con insuficiencia cardíaca latente o incontrolada (efecto inotrópico negativo de dihidropiridinas (in vitro), más o menos marcado dependiendo del producto, y susceptible de adicionarse al efecto inotrópico negativo de sotalol). La presencia de sotalol puede también minimizar la reacción refleja simpática que se produce por la excesiva repercusión hemodinámica. - Dipiridamol (administración intravenosa): Aumenta el efecto antihipertensivo - Interacciones con pruebas de laboratorio: La presencia de sotalol en la orina puede dar un falso aumento de la metanefrina urinaria cuando se mida con métodos fotométricos. La orina de pacientes tratados con MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios sotalol susceptibles de padecer feocromocitoma debe analizarse mediante HPLC con fase de extracción sólida. - 4.6. Debe advertirse a los deportistas que este medicamento contiene un principio activo que puede inducir falsos positivos en las pruebas de dopaje. Embarazo y lactancia Embarazo: No hay estudios bien controlados del uso de sotalol en mujeres embarazadas. Los estudios en animales con hidrocloruro de sotalol no muestran evidencia de efectos teratogénicos u otros efectos dañinos en el feto tras el empleo de sotalol a dosis terapéuticas. En humanos, sotalol atraviesa la placenta. Debido a sus propiedades farmacológicas, pueden aparecer efectos adversos en el feto y neonato si se utiliza sotalol al final del embarazo. En neonatos de madres tratadas con sotalol, la acción beta-bloqueante del medicamento puede estar todavía presente varios días después del nacimiento. Se puede manifestar como bradicardia, distress respiratorio, o hipoglucemia. En general, este hecho no es clínicamente significativo. No obstante, es posible que, al disminuir los mecanismos de compensación cardiovascular se produzca fallo cardiaco que requiera hospitalización y cuidados intensivos (ver sección 4.9). En estos casos, deben evitarse los expansores plasmáticos (riesgo de edema pulmonar agudo). Por tanto, sólo si es realmente necesario puede administrarse sotalol durante el embarazo. Debería hacerse un cuidadoso control del neonato durante las primeras 48-72 horas después del parto, si no fue posible interrumpir el tratamiento materno con sotalol 2-3 días antes del parto. Lactancia: Sotalol se excreta en la leche materna en cantidades relativamente grandes. Se ha descrito hipoglucemia y bradicardia en lactantes cuyas madres estaban siendo tratadas con algunos beta-bloqueantes con baja unión a proteínas plasmáticas. Por consiguiente, no se aconseja la lactancia durante el tratamiento. 4.7. Efectos sobre la capacidad para conducir y utilizar máquinas Sotalol puede afectar las reacciones individuales de tal forma que puede llevar a disminuir la capacidad de conducir o utilizar maquinaria o de trabajar con las medidas de seguridad apropiadas. 4.8. Reacciones adversas Clínicas: Las reacciones adversas más frecuentes de sotalol derivan de sus propiedades betabloqueantes. Son normalmente transitorios, y raramente se precisa la interrupción del MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios tratamiento. Normalmente desaparecen al disminuir la dosis. Las reacciones adversas más graves son aquellas debidas a los efectos proarrítmicos, incluyendo las torsades de pointes (ver sección 4.4) Las reacciones adversas más frecuentes son: - Trastornos de la sangre y del sistema linfático: trombocitopenia, eosinofilia, leucopenia; - Trastornos del metabolismo y de la nutrición: hipoglucemia; - Trastornos psiquiátricos: depresión, ansiedad; - Trastornos del sistema nervioso: mareos, dolor de cabeza, alteraciones del sueño, parestesia, fatiga, astenia - Trastornos oculares: trastornos visuales; - Trastornos cardiovasculares: bradicardia sinusal, trastornos de la conducción atrioventricular, disnea, dolor torácico, palpitaciones, edema, anormalidades en el ECG, hipotensión, proarritmia, síncope, fallo cardiaco, presíncope, Síndrome de Raynaud; agravación de claudicación intermitente preexistente; - Trastornos respiratorios, torácicos y mediastínicos: bronconconstricción, disnea, especialmente en pacientes con insuficiencia respiratoria obstructiva; - Trastornos gastrointestinales: naúseas, vómitos, diarrea, dispepsia, dolor abdominal, flatulencia; - Trastornos de la piel y del tejido subcutáneo: diversas manifestaciones cutáneas, incluyendo erupciones tipo psoriasis o exacerbación de la psoriasis (ver sección 4.4), exantema, rash, prurito, fotosensibilidad, diaforesis; - Trastornos musculoesqueléticos, del tejido conjuntivo y huesos: calambres musculares, artralgia, mialgia; Trastornos del aparato reproductor y de la mama: alteraciones de la función sexual; Trastornos generales y alteraciones en el lugar de la administración: fiebre. - Exploraciones complementarias: En raras ocasiones, se ha notificado la formación de anticuerpos anti-nucleares, acompañados excepcionalmente de manifestaciones clínicas como síndrome tipo lupus que desaparece al interrumpir el tratamiento. 4.9. Sobredosis La sobredosis accidental o intencionada con sotalol es raramente letal. La hemodiálisis reduce en gran medida los niveles plasmáticos de sotalol. Los síntomas más comunes de sobredosis son los siguientes: bradicardia, insuficiencia cardíaca congestiva, hipotensión, broncoespasmo, hipoglucemia. En caso de ingestión masiva intencionada (2 - 16 g) de sotalol, se han descrito los síntomas siguientes: hipotensión, bradicardia, bloqueo atrioventricular, prolongación del MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios intervalo QT, complejos ventriculares prematuros, taquicardia ventricular, torsades de pointes. En caso de: - Bradicardia o excesiva disminución de la tensión arterial, se recomienda administrar 0,5 - 2 mg de atropina por vía IV y 1 mg de glucagón, seguido si es necesario por una inyección lenta de 25 microgramos de isoprenalina o 2,5 a 10 microgramos /kg/min de dobutamina. Si es preciso pueden administrarse dosis mayores de glucagón. - Bloqueo atrioventricular de 2° o 3° grado: tratamiento mediante marcapasos electrosistólico; - Broncoespasmo: tratamiento con teofilina o aerosol 2-agonista. - Torsades de pointes: tratamiento con electro-shock; marcapasos electrosistólico y/o sulfato magnésico. En caso de descompensación cardíaca en neonatos, si la madre se ha tratado con sotalol: - 0,3 mg/kg de glucagón; - Hospitalización en cuidados intensivos; - Isoprenalina y dobutamina: como las dosis son generalmente altas y el tratamiento prolongado, es necesario un control especializado (ver sección 4.6 ) La sobredosis se asocia con riesgo de arritmias ventriculares graves (torsades de pointes) 5. Propiedades Farmacológicas 5.1. Propiedades farmacodinámicas Grupo farmacoterapéutico: beta-bloqueante, no selectivo- Sotalol Código ATC: C07A A07 Sotalol es un antiarrítmico con propiedades de la clase II (bloqueante de receptores betaadrenérgicos no selectivo, debido a su actividad simpaticomimética intrínseca o efecto estabilizador de membrana) y propiedades de la clase III (prolongación de la duración del potencial de acción cardíaco) Electrofisiología: Sotalol ralentiza el ritmo cardíaco y la velocidad de conducción atrioventricular (prolongación del intervalo PR), aumenta el periodo refractario de la unión atrioventricular, aumenta los intervalos QT y QTc, sin modificar la despolarización ventricular (sin cambios significativos en la duración de QRS). Prolonga los periodos refractarios atrial, ventricular y otros periodos refractarios de vías accesorias (en direcciones anterógrada y retrógrada). MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios Hemodinamia: Debido a sus propiedades beta-bloqueantes, sotalol tiene un efecto inotrópico negativo. Al contrario, sus propiedades de clase III causan un efecto inotrópico positivo. A pesar de que sotalol es bien tolerado normalmente desde el punto de vista hemodinámico, se recomienda precaución en presencia de función ventricular alterada. Como otros beta-bloqueantes, sotalol disminuye la tensión arterial sistólica y diastólica en pacientes hipertensos. 5.2. Propiedades farmacocinéticas Absorción La concentración plasmática máxima se alcanza las 2,5 - 4 horas después de la administración oral y el estado estacionario se alcanza en 2 - 3 días. La biodisponibilidad es superior al 90 % y muestra muy poca variabilidad inter-individual. Puede observarse una buena correlación entre la dosis administrada y las concentraciones plasmáticas. La biodisponibilidad se reduce en un 20 % si el producto se administra con alimentos. Distribución El volumen aparente de distribución es de 1,2 a 2,4 l/kg. La unión a proteínas plasmáticas es insignificante, facilitando la difusión tisular de sotalol. Atraviesa difícilmente la barrera hemato-encefálica (concentración en el fluido cerebroespinal < 10 % de la concentración plasmática). Metabolismo Sotalol no se metaboliza. Semi-vida plasmática 10 a 20 horas en un individuo con función renal normal. Excreción Sotalol se elimina por vía renal. Aproximadamente el 80 - 90 % de la dosis administrada se excreta inalterada en orina. Es preciso ajustar la dosis en caso de insuficiencia renal (ver sección 4.2). La edad no altera de forma significativa los parámetros farmacocinéticos a pesar de que la función renal en personas ancianas puede disminuir la eliminación, favoreciendo la acumulación de sotalol. Paso a través de la barrera placentaria: Sotalol atraviesa la barrera placentaria. La proporción de la concentración en sangre del cordón umbilical /sangre materna es 1,05/1. La excreción en leche materna es alta. La proporción de la concentración leche /plasma es 5/1. MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios 5.3. Datos preclínicos sobre seguridad Los datos preclínicos no muestran ningún riesgo en humanos, basándose en los estudios convencionales de seguridad farmacológica, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad en la reproducción. 6. Datos farmacéuticos 6.1. Lista de excipientes 80 mg: Monohidrato de lactosa Almidón de maíz Carmín índigo (E132) Povidona (K-30) Estearato magnésico 6.2. Incompatibilidades No procede 6.3. Periodo de validez 3 años 6.4. Precauciones especiales de conservación Conservar en el embalaje exterior para protegerlo de la luz. 6.5. Naturaleza y contenido del envase 80 mg: Blisters de aluminio PVC/PVdC con 20, 28, 30, 40, 50, 60 y 100 comprimidos ranurados. 50 comprimidos en blisters EAV (envase hospitalario). Puede que solamente estén comercializados algunos tamaños de envases. 6.6. Instrucciones de uso/manipulación Ninguna especial 7. Titular de la autorización de comercialización TEVA PHARMA S.L.U. C/ Anabel Segura, 11, Edificio Albatros B, 1ª planta 28108 Alcobendas (Madrid), España MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios 8. Número(s) de autorización de comercialización 65.347 9. Fecha de la primera autorización/renovación de la autorización Fecha de autorización: Abril 2003 Fecha de revalidación: 20 septiembre 2006 10. Fecha de la revisión del texto: Noviembre 2006 MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos sanitarios