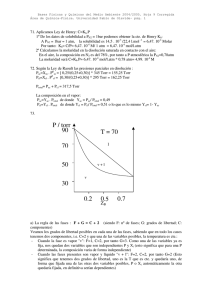
Cual será la fracción molar de cada gas?.
Anuncio

1. Un gas ideal se comprime desde 2,5L a 1,5 L y se calienta desde 25ºC hasta 50ºC. Si su presión inicial era 1,10 atm, ¿Cuál será su presión final? 2. Un gas ideal a 650 torr ocupa una ampolla de volumen desconocido. Se retira una cantidad de gas que ocupaban 1,52 cm3 a 1atm. La presión de gas que quedó en la ampolla fue 600 torr. Suponiendo que todas las mediciones se realizan a la misma temperatura, calcúlese el volumen de la ampolla. Sol: V=23,10 cm3 3. Si se colocan 2 gr. de He y 2 gr. de H2 en una ampolla de 15 L ¿Cual será la fracción molar de cada gas?. Si la ampolla se mantiene a 30ºC, ¨ cuáles serán sus presiones parciales y presión total? Sol: P(He)=0,82 atm. P(H2)=1,66 atm. 4. El cuerpo humano produce unos 960 g. de CO2 por día. Si la cabina de un astronauta tiene un volumen de 7600 litros y la presión parcial del CO2 debe mantenerse por debajo de 4'1 torr siendo la temperatura de la cabina de 27ºC, ¿Qué peso de CO2 debe eliminarse durante el primer día de viaje? (Supóngase que la presión parcial inicial de CO2 es cero). Sol: 886,76 g. 5. Se recoge oxígeno sobre agua a 24ºC. El volumen es de 880 ml y la presión total, 758 mm Hg. Si el agua tiene una presión de vapor a esa temperatura de 22,4 mm Hg, a) ¿Cuál es el volumen de oxígeno seco recogido, medido en condiciones normales de presión y temperatura?. b)¿Cuantos moles de oxígeno hay? c)¿Cuantos moles de vapor de agua hay?. 6. Determine el volumen que ocupa 1 mol de nitrógeno a 400 atm y 0 °C. Pc=33.5 atm. Tc= 126 °K. 7. Un tanque rígido contiene 50 kg de agua como líquido saturado a 90°C. Determine el volumen en el tanque y la presión en el mismo. 8. Determine las propiedades faltantes del agua en la siguiente tabla: T, °C P, kPa u, kJ/kg x Descripción de fases (a) 200 0.6 (b) 125 1600 (c) 1000 2950 (d) 75 500 (e) 850 0.0