CutePDF Printer, Job 3 - Universidad Pablo de Olavide, de Sevilla
Anuncio

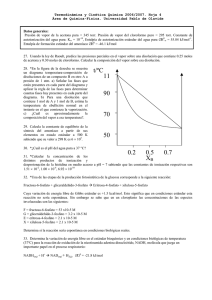
Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Universidad Pablo de Olavide- pág. 1 71. Aplicamos Ley de Henry: C=Kh.P 1º De los datos de solubilidad a PN2 = 1bar podemos obtener la cte. de Henry Kh: A PN2 = 1bar ≈ 1 atm, la solubilidad es 14,5 . 10-3 /22,4 l.mol -1 = 6,47. 10-4 Molar Por tanto: Kh= C/P= 6,47. 10-4 M/ 1 atm = 6,47. 10-4 mol/l.atm 2º Calculamos la molaridad en la disolución saturada en contacto con el aire: En el aire, la composición en N2 es del 78%, por tanto a P atmosférica la PN2=0,78atm La molaridad será C=Kh.P= 6,47. 10-4 mol/l.atm * 0,78 atm= 4,99. 10-4 M 72. Según la Ley de Raoult las presiones parciales en disolución : Pac=Xac . P0ac = [ 0,25/(0,25+0,30)] * 345 Torr = 155,25 Torr Pcl=Xcl . P0cl = [0,30/(0,25+0,30)] * 295 Torr = 162,25 Torr Ptotal= Pac + Pcl = 317,5 Torr La composición en el vapor: Pac=Yac . Ptotal de donde Yac = Pac/ Ptotal = 0,49 Pcl=Ycl . Ptotal de donde Ycl = Pcl/ Ptotal = 0,51 o lo que es lo mismo Ycl= 1- Yac 73. P / torr 90 T = 70 l 70 50 30 v+l v 0.2 0.5 ZB 0.7 a) La regla de las fases : F + G = C + 2 (siendo F: nº de fases; G: grados de libertad; C: componentes) Veamos los grados de libertad posibles en cada una de las fases, sabiendo que en todo los casos tenemos dos componentes, i.e. C=2 y que una de las variables posibles, la temperatura es cte.: - Cuando la fase es vapor "v": F=1, C=2, por tanto G=3. Como una de las variables ya es fija, nos quedan dos variables que son independientes P y Xi (esto significa que para una P determinada, la composición varia de forma independiente) - Cuando las fases presentes son vapor y líquido "v + l": F=2, C=2, por tanto G=2 (Esto significa que tenemos dos grados de libertad, uno es la T que es cte. y quedaría uno, de forma que fijada una de las otras dos variables posibles, P o Xi, automáticamente la otra quedaría fijada, en definitiva serían dependientes) Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Universidad Pablo de Olavide- pág. 2 - Cuando la fase es líquido "l": F=1, C=2, por tanto G=3. Estariamos ante la situación "todo como vapor". Como una de las variables ya es fija, nos quedan dos variables que son independientes P y Xi (esto significa que para una P determinada, la composición varia de forma independiente) b) Para una disolución que contiene 1mol de A y 1 mol de B, las fracciones molares serán: XA= 0,5 y XB= 0,5, Si nos fijamos en la gráfica se comprueba que aproximadamente la presión de vapor en el instante en que comienza la vaporización cuando las composiciones son XA= 0,5 y XB= 0,5 es de aprox. 60 Torr. P / torr 90 T = 70 l 70 60 Torr 50 30 v+l v 0.2 0.5 0.7 ZB c)Para las composiciones XA= 0,5 y XB= 0,5, la presión de vapor cuando queda la última gota de líquido es aproximadamente de 40 Torr P / torr 90 T = 70 l 70 50 v+l 40 Torr 30 v 0.2 0.5 ZB 0.7 Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Universidad Pablo de Olavide- pág. 3 74. t/ºC 110 v 90 l+v 70 50 l 0.2 0.5 XB 0.7 a) La regla de las fases : F + G = C + 2 (siendo F: nº de fases; G: grados de libertad; C: componentes) Al igual que en el ejercicio anterior, veamos los grados de libertad posibles en cada una de las fases, sabiendo que en todo los casos tenemos dos componentes, i.e. C=2 y que una de las variables posibles, la presión, es cte.: - Cuando la fase es vapor "v": F=1, C=2, por tanto G=3. Como una de las variables ya es fija, nos quedan dos variables que son independientes T y Xi (esto significa que para una T determinada, la composición varia de forma independiente) - Cuando las fases presentes son vapor y líquido "v + l": F=2, C=2, por tanto G=2 (Esto significa que tenemos dos grados de libertad, uno es la P que es cte. y quedaría uno, de forma que fijada una de las otras dos variables posibles, T o Xi, automáticamente la otra quedaría fijada, en definitiva serían dependientes) - Cuando la fase es líquido "v": F=1, C=2, por tanto G=3. Estaríamos ante la situación "todo como líquido". Como una de las variables ya es fija, nos quedan dos variables que son independientes P y Xi (esto significa que para una T determinada, la composición varia de forma independiente) b) Para una disolución que contiene 1mol de A y 1 mol de B, las fracciones molares serán: XA= 0,5 y XB= 0,5, Si nos fijamos en la gráfica se comprueba que aproximadamente la T de ebullición normal en el instante en el que comienza la vaporización es de aprox. 60ºC. Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Universidad Pablo de Olavide- pág. 4 t/ºC 110 v 90 l+v 70 60 ºC l 50 0.2 0.5 XB 0.7 c) Si no fijamos en la gráfica, la composición del vapor a T= 60ºC, es aproximadamente de XB= 0.9 y XA= 0.1 t/ºC 110 v 90 60 ºC l+v 70 50 l 0.2 0.5 XB 0.7 XB= 0.9 XA= 0.1 Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Universidad Pablo de Olavide- pág. 5 75. Se trata de un caso de la Ley de Raoult, por tanto: Pagua= xagua. Pagua0 ; 31,2 mmHg = xagua. 31,82 mmHg, será: xagua = 0,98 por tanto la fracción molar del agua Teniendo en cuenta como se define la xi para un compuesto: xagua= nagua / (nagua+ nformamida) Y que nagua= g/Pm=100/18= 5,56 moles, podemos calcular nformamida= 0,11 moles Sabuendo que tenemos 5 g de formamida y el nº de moles (n calculamos el Pm = 45 g.mol-1 formamida= g formamida/Pmformamida) 76. La presión osmótica π = P1-P2= M . R. T Por tanto, ( teniendo en cuenta que Torr = mmHg y que 1 atm= 760 mmHg): 527/760 atm= Molaridad * 0,082 atm. l.K-1..mol *(25+273) K de donde Molaridad= 0.0283 M Por tanto en los 100 ml de disolución, habrá 2,83. 10-3 moles de azúcar+droga Para obtener las fracciones molares tendremos en cuenta la dos ecuaciones siguientes: 1º) nº total de moles: nd + na = 2,83. 10-3 moles 2º) nº total de gramos: gd + ga = 1; nd* Pmd+ na * Pma=nd* 369 g/mol+ na * 342 g/mol De estas dos ecuaciones se obtiene nd= 1,19.10-3 moles y na= 1,63.10-3 moles Calculamos fracciones molares: Xd=nd/ nd + na =0,42 Xa= na/ nd + na= 0,58