Actividades sustancias puras con solución
Anuncio

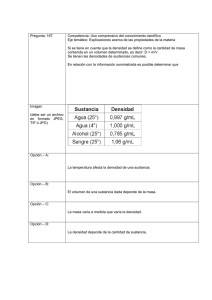
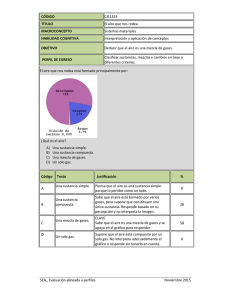
IES Menéndez Tolosa 3º ESO (Física y Química) 1 Completar: • Un sistema material homogéneo constituido por un solo componente se llama___________________. • Un sistema material homogéneo formado por dos o más componentes se llama ________________________ o bien ____________________. • Las dos técnicas para separar los componentes de un compuesto son la _______________ ____________ y la _____________ por ________________. Solución: Completar: • Un sistema material homogéneo constituido por un solo componente se llama SUSTANCIA PURA. • Un sistema material homogéneo formado por dos o más componentes se llama MEZCLA HOMOGÉNEA o bien DISOLUCIÓN. • Las dos técnicas para separar los componentes de un compuesto son la DESCOMPOSICIÓN TÉRMICA y la DESCOMPOSICIÓN por ELECTROLISIS 2 ¿Crees que el gráfico corresponde a una sustancia pura? ¿De qué tipo? ¿Qué ocurriría si la sometemos a electrolisis? Solución: En efecto, es una sustancia pura formada sólo por partículas de un solo tipo. Si la sometemos a electrolisis no ocurrirá nada, ya que no puede descomponerse en otras sustancias más simples. Es, por tanto, un elemento. 3 Localizar la afirmación correcta: a) Una sustancia pura es aquella que se puede descomponer en otras más sencillas. b) Si una sustancia compleja se puede descomponer en otras se llama sustancia pura. c) Toda sustancia que resulte de la descomposición de otras se llama elemento. d) Toda sustancia pura que se puede descomponer en otras se llama compuesto. Solución: La respuesta correcta es la d). 1 4 ¿Qué ocurriría si sometemos la siguiente sustancia a electrolisis o la calentamos fuertemente? ¿Qué tipo de sustancia es? Solución: La sustancia está formada por átomos de dos tipos, de modo que es posible que al someterla a alguno de los procedimientos mencionados, la sustancia se descompusiera en otras sustancias más sencillas. Esta es una prueba de que se trata de una sustancia pura compuesta. Se quiere determinar si una sustancia pura es un elemento o un compuesto, para lo cual se somete a algunos procesos que se resumen en los gráficos siguientes. Interpretar los gráficos, redactar y explicar, y extraer una conclusión. SUSTANCIA “C” 40 30 20 10 T (ºC) 10 20 30 40 50 60 Solubilidad (g/100 cm3 de agua) SUSTANCIA “A” Solubilidad (g/100 cm3 de agua) 5 40 30 20 10 T (ºC) 10 20 30 40 50 60 Solución: Se calienta la sustancia pura para comprobar si se descompone en otras más sencillas, pero esto es muy difícil de comprobar ya que, según el esquema, la sustancia que inicialmente se coloca en el crisol desprende un gas (que puede pasarnos desapercibido) y deja como residuo otra sustancia del mismo color. Procedemos entonces a medir una propiedad característica de las sustancias A y C, que es su solubilidad, y resultan gráficas completamente diferentes: la sustancia A tiene una solubilidad a 20ºC de 8 g/100 cm3 de agua, aproximadamente. En cambio, la sustancia C a esa temperatura tiene una solubilidad de 34 g/100 cm3 de agua, aproximadamente: Conclusión: la sustancia A se ha descompuesto en otras dos, de modo que se trata de un compuesto. El gas que aviva las combustiones es oxígeno. El proceso representado es el siguiente: CLORATO POTÁSICO ⇒ CLORURO POTÁSICO + OXÍGENO 2 6 ¿Cuáles de las siguientes características son propias de las sustancias puras? a) Todas ellas son sistemas homogéneos. b) Sus propiedades características son las mismas en cualquier estado. c) Sus propiedades características se mantienen constantes en los posibles cambios de estado. Solución: Las afirmaciones asociables a las sustancias puras son a) y c). La b) no tiene sentido, las propiedades características tales como la temperatura de fusión no son propias de un estado. 7 Interpretar la secuencia siguiente: Relacionar sustancia pura y propiedades específicas de las sustancias. Solución: Para separa los componentes de un compuesto se usan dos tipos de técnicas: a) descomposición térmica y b) electrólisis. En este caso se ha calentado una sustancia A, con lo que ha cambiado de aspecto (B) y ha vuelto a su apariencia original (C). La prueba determinante de si la sustancia original era o no un compuesto es que el resultado final debería tener propiedades diferentes de las iniciales y no es así. Resulta la misma densidad, luego C es lo mismo que A. Probablemente al calentar hemos pasado A a fase líquida (B) y al enfriar ha vuelto a lo que era. Es decir, la sustancia pura A es un elemento. 8 Localizar la afirmación correcta: a) Toda sustancia pura está formada por un solo elemento. b) La unión de dos elementos para formar un compuesto es un proceso de mezcla homogénea. c) El óxido de mercurio es una sustancia pura que recibe el nombre de compuesto. d) El oxígeno no es una sustancia pura sino un elemento. Solución: La respuesta correcta es la c). 9 Se han hecho dos representaciones de un sistema que se ha sometido a calentamiento y después se ha dejado enfriar. Un alumno ha dibujado el esquema a) y otro ha dibujado el esquema b). ¿Crees que se refieren al mismo acontecimiento? ¿Por qué? Relacionar los esquemas con los tipos de sustancias puras. a) 3 Solución: Esquema a): se refiere a una sustancia que tras sufrir calentamiento ha cambiado de aspecto (B) y ha vuelto a su apariencia original (C). La prueba determinante de si la sustancia original era o no un compuesto es que el resultado final debería tener propiedades diferentes de las iniciales y no es así. Resulta la misma densidad, luego C es lo mismo que A. Probablemente al calentar hemos pasado A a fase líquida (B) y al enfriar ha vuelto a lo que era. Es decir, la sustancia pura A es un elemento Esquema b): Las partículas del primer esquema no son iguales que las del segundo. Se ve que ha habido un reajuste interno que hace que las sustancias iniciales hayan desparecido para formar otras nuevas. Esto quiere decir que la sustancia inicial es un compuesto que ha sido descompuesto mediante calor para dar otras sustancias más simples. El resultado final es distinto del inicial y no puede tener las mismas propiedades. Por tanto, los esquemas a) y b) se refieren a procesos distintos. 10 El químico inglés Priestley (1733-1804) tomó mercurio y lo calentó en aire, con lo que obtuvo óxido de mercurio. Luego puso un poco de este óxido en una retorta y lo calentó con una lente que concentraba los rayos del sol. Aparecieron gotitas brillantes de mercurio en el extremo frío del tubo. mercurio + oxígeno del aire = calcinado rojo: óxido de mercurio rayos solares lupa gotitas mercurio CALOR óxido de mercurio rojo a) A partir de ahí completar las siguientes definiciones: - El óxido de mercurio es ___________________ que mediante transformaciones puede ser convertida en otras sustancias más simples y recibe el nombre de __________________. - Se llama _____________ a aquella __________________ que no se puede descomponer en otras más simples. - La unión de dos o más ____________ para formar __________________ es de un tipo totalmente distinto al proceso de mezcla y da lugar a nuevas ________________ de propiedades enteramente diferentes. b) ¿Cuáles de los sistemas materiales dibujados son sustancias puras, cuáles elementos y cuáles compuestos? c) Comparar los dos dibujos y establecer una relación entre ellos. ¿Se conservará la masa en el último proceso descrito? ¿Por qué? 4 Solución: a) El óxido de mercurio es UNA SUSTANCIA PURA que mediante transformaciones puede ser convertida en otras sustancias más simples y recibe el nombre de COMPUESTO. - Se llama ELEMENTO a aquella SUSTANCIA PURA que no se puede descomponer en otras más simples. - La unión de dos o más ELEMENTOS para formar UN COMPUESTO es de un tipo totalmente distinto al proceso de mezcla y da lugar a nuevas SUSTANCIAS PURAS de propiedades enteramente diferentes. b) Todos los sistemas materiales dibujados son sustancias puras. Sólo el óxido de mercurio es, además, compuesto. El mercurio y el oxígeno son elementos. c) El segundo proceso es el reverso del primero. Sería, de hecho, lo que nosotros realizaríamos en el laboratorio para comprobar si el óxido de mercurio es un elemento o un compuesto. Y si uno es el reverso del otro, en el segundo proceso faltará un elemento que se desprende en forma de gas (el oxígeno), por lo que la masa de la retorta con las gotitas de mercurio en su extremo es menor, salvo que el experimento se hiciera con el matraz cerrado. 11 Queremos saber si la sustancia que tenemos en un vaso es o no una sustancia pura. Para ello la calentamos y vamos anotando el valor de la temperatura que adquiere frente al tiempo. El resultado es la siguiente tabla de datos: tiempo (minutos) 0 2 4 6 8 10 11 12 13 Temperatura (ºC) 18 37 68 90 105 106 107 108 110 a) Representar los datos. b) Extraer una conclusión. Temperatura (ºC) Solución: a) Representación: 100 75 50 25 2 4 6 8 10 t 12 (min) b) En la tabla se aprecia suficientemente el hecho de que no hay una temperatura estabilizada para el cambio de estado. En primer lugar se ve que la temperatura de ebullición no es la característica del agua pura. Y en segundo lugar y más determinante aún (más determinante porque la temperatura de ebullición puede afectada por las condiciones de presión, por ejemplo), el hecho de que ésta no permanece constante a lo largo del cambio de estado. En conclusión, la sustancia del vaso no es una sustancia pura. 12 Decir si la siguiente afirmación es verdadera o falsa y explicar por qué: "Si un sistema material es no homogéneo en su composición pero es homogéneo a los cambios de estado, se trata de una sustancia pura". 5 Solución: La primera parte de la frase es falsa: si un sistema material no es homogéneo ya no hay posibilidad de que sea una sustancia pura: será una mezcla. Sin embargo, la segunda parte de la frase tiene sentido: que una sustancia sea homogénea a los cambios de estado significa que mantiene dichas propiedades invariables mientras reproduce un cambio de estado. Por ejemplo, la temperatura de fusión es una propiedad que se mantiene invariable mientras una sustancia pura cambia de estado sólido a estado líquido. La frase quedaría perfecta de este modo: "Si un sistema material es homogéneo en su composición y es homogéneo a los cambios de estado, se trata de una sustancia pura". 13 Se coloca un poco de dicromato amónico (color naranja) en un tubo de ensayo, se cierra y se pesa. A continuación se calienta con un mechero bunsen y tiene lugar un proceso muy vistoso cuyo resultado se resume así: 1) El volumen final es mayor que el inicial. 2) El sistema final tiene menos masa que el inicial. 3) El sistema final es de color verde. 4) En la parte superior del tubo aparecen unas gotitas de líquido incoloro que podría ser agua. Representar el proceso y a partir de esos hechos, responder: a) ¿Por qué hay menos masa? ¿Puede haber más volumen? Extraer una conclusión. b) Decir si el sistema inicial es: una sustancia pura, un elemento, una mezcla... c) Organizar los datos del enunciado en forma de tabla: SISTEMA INICIAL SISTEMA FINAL Color Masa Volumen Estado de agregación 6 Solución: El proceso queda descrito en el propio enunciado y sería así: a) Si hay menos masa significa que ha tenido lugar una reacción y ha desaparecido un componente. Perfectamente puede ocurrir que el volumen final, sin embargo, sea mayor. De ahí se concluye que la densidad del producto final es muy distinta de la inicial; al ser ésta una propiedad característica, significa que se trata de sustancias distintas. b) El sistema inicial tienen toda la apariencia de ser una sustancia pura, si bien habría que realizar experimentos para saberlo a ciencia cierta. Sin embargo, el resultado del proceso nos permite concluir que con toda probabilidad se trata de una sustancia pura compuesta que, tras ser sometida a calentamiento, se descompone en otras más simples, de propiedades (color, densidad,...) totalmente diferentes. c) Tabla de datos: Color Masa Volumen Estado de agregación SISTEMA INICIAL naranja M V sólido SISTEMA FINAL verde + incoloro <M >V sólido + líquido + posible gas 14 Disponemos de dos materiales X e Y que queremos investigar para saber cuál de ellos es una sustancia pura y cuál no. Para ello los calentamos y observamos el comportamiento a medida que cambian de estado. Ambos son sólidos y las siguientes tablas de datos reflejan su evolución: X) estado sólido sólido+líquido líquido Temperatura (ºC) 73 75 78 80 80 80 84 86 90 Y) estado sólido sólido+líquido líquido Temperatura (ºC) - 11 - 10 -7 -6 -5 -4 -3 0 4 a) Dibujar el perfil de ambas gráficas. b) ¿Alguno de ellos es una sustancia pura? ¿Por qué? 7 Solución: a) El perfil de cada una de las evoluciones es el siguiente: X Y b) La sustancia X mantiene una temperatura de fusión constante en todo el proceso, por lo que se trata de una sustancia pura con una propiedad característica (t.f. = 80ºC) definida y constante. Por el contrario, la sustancia Y no cumple esa condición, ya que su temperatura de cambio de estado no se estabiliza, no adquiere un valor definido y constante, y por tanto no se trata de una sustancia pura. 15 Para determinar qué tipo de sustancia pura es el agua, se ha llevado a cabo la siguiente experiencia: hidrógeno oxígeno – + Explicar en qué consiste y extraer conclusiones. Solución: El experimento que nos permite demostrar qué tipo de sustancia es el agua es la electrólisis, que puede resumirse así: Se dispone un aparato de electrólisis en el que se coloca agua con un poco de ácido sulfúrico (que la hace conductora) y se conecta a una pila de corriente continua. El agua se descompone en dos gases, hidrógeno y oxígeno, y al recogerlos sobre sendos tubos resulta que el volumen del primero es justamente el doble. En consecuencia el agua es una sustancia pura compuesta de otras más sencillas, que en este caso son elementos. 8