Neuroendocrinología - Dr. Mendoza Ladrón de Guevara
Anuncio

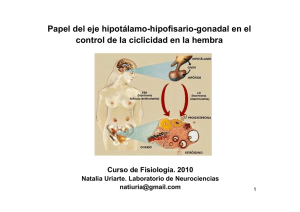
Neuroendocrinología de la reproducción. Contenidos Neuroendocrinología Objetivos de la reproducción Otras influencias endocrinas sobre el ciclo ovárico El ovario desde el nacimiento a la senectud. 1. Repasar y actualizar los conocimientos sobre los mecanismos neuroendocrinos que regulan el ciclo ovárico 2. Actualizar los conocimientos sobre los mecanismos endocrinos extra ováricos que regulan el ciclo ovárico 3. Comprender la endocrinología de la senectud ovárica Neuroendocrinología de la reproducción La conexión entre el hipotálamo y la adenohipófisis se realiza solo a través de un sistema venoso portal, de manera que no existe una conexión nerviosa directa entre ellos. Así, la influencia hipotalámica se lleva a cabo por medio de neurohormonas, productos liberados por las neuronas al torrente circulatorio. Hasta hace relativamente poco tiempo se pensaba que existía un factor hipotalámico liberador de cada una de las gonadotrofinas y que en la adenohipófisis existían unas células gonadotropas productoras de hormona folículo estimulante (FSH) y otras distintas productoras de hormona lútea (LH). Ahora conocemos que existe un solo factor hipotalámico liberador de gonadotrofinas (GnRH) producido por las neuronas del núcleo arqueado, y liberado al sistema portal hipofisario, donde tiene solo acciones positivas en la adenohipófisis (síntesis, almacenamiento, activación y secreción de gonadotrofinas). Lo hace sobre una sola célula gonadotropa, que produce FSH o LH dependiendo de cómo sean los pulsos de secreción del GnRH y los mecanismos de retroalimentación endocrinos, paracrinos o autocrinos para cada una de ellas: la secreción de FSH ocurre cuando la frecuencia de los pulsos de GnRh es baja y la de LH cuando es alta. Aparte de las células gonadotropas, existen otros tipos de células en la adenohipófisis que responden a las neurohormonas hipotalámicas y muestran relaciones paracrinas íntimas: células lactotropas (PRL), tirotropas (TSH), corticotropas (ACTH) y somatotropas (HC). Además, la secreción hipofisaria está muy relacionada con el aparato olfativo. Un ejemplo de esta vinculación se presenta en el síndrome de Kallman, donde coexisten defectos del olfato y de la liberación de GnRH. La liberación de feromonas (fundamentalmente por las axilas) justifica su influencia sobre la secreción de gonadotrofinas y la sincronía de los ciclos en mujeres que viven o trabajan bajo el mismo techo. En la Hipófisis posterior las neuronas de los núcleos supraóptico y paraventricular liberan oxitocina y vasopresina. Aunque en este caso se trate de una acción neuronal, también se liberan en el sistema portal hipofisario, por eso repercuten en la fisiología adenohipofisaria: La vasopresina está relacionada con la osmolaridad, la diuresis (hormona antidiurética) y algunos procesos del aprendizaje y la memoria. En la adenohipófisis aumenta la liberación de ACTH. La oxitocina es la hormona del parto y la salida de la leche, aunque también interviene en el orgasmo y se libera en el coito por estimulación del cérvix y la vagina o tras estímulos olfativos, auditivos o visuales. En la adenohipófisis aumenta la liberación de FSH y LH. Nicolás Mendoza Ladrón de Guevara, 2015. NEUROENDOCRINOLOGÍA REPRODUCTIVA. 5 Regulación hipotalámica de la secreción gonadotrófica Las acciones de la GnRH sobre receptores en la hipófisis activa múltiples mensajeros, provocando: la liberación inmediata de las gonadotropinas, su síntesis y almacenamiento (pool de reserva) y su movimiento desde el pool de reserva al pool de secreción. Estas 3 acciones varían a lo largo de ciclo, en respuesta a los esteroides ováricos. Así, las concentraciones estrogénicas bajas aumentan la síntesis y el almacenamiento de las dos gonadotrofinas, pero inhiben la secreción de FSH y apenas tienen efectos sobre la secreción de LH. Por el contrario, las concentraciones estrogénicas altas inducen la elevación de la LH (mecanismo de retroalimentación positiva). Por otra parte, la progesterona, a concentraciones bajas potencia la respuesta de la LH a la GnRH y es responsable del pico de FSH en mitad del ciclo; mientras que en concentraciones altas inhibe la secreción de las dos gonadotrofinas a través de los opioides endógenos, que inhiben los pulsos de GnRH. Profundizando en cómo ejercen este feedback las hormonas sexuales, se han detectado receptores estrogénicos en múltiples áreas cerebrales, pero en determinados núcleos neuronales existe una gran producción de la enzima 2 hidroxilasa, que los metaboliza a catecolestrógenos. Aunque el estradiol y la estrona se pueden detectar en estos tejidos, sus concentraciones son menores que las de sus metabolitos catecolestrógenos, que son los que actúan como verdaderos neurotrasnmisores para inhibir la secreción pulsátil de GnRH. Otros mediadores de la acción de las hormonas sexuales, principalmente de la progesterona, son los opioides endógenos, sintetizados de forma cíclica en respuesta al estímulo hormonal en los lóbulos anterior e intermedio de la hipófisis. Existen tres clases de OE: encefalina, endorfina y dinorfina; todos ellos inhiben la secreción de GnRH. Como las hormonas esteroideas, empiezan a elevarse durante la fase folicular y su concentración es máxima durante la fase lútea, para luego disminuir bruscamente en la menstruación. La pulsatilidad de la GnRH es muy sensible a la concentración de la progesterona o sus derivados. Esta retroalimentación negativa está claramente mediada por los OE (junto a otros mecanismos aún por descubrir) y en ella se fundamentan los anticonceptivos hormonales para frenar el pico mesocíclico de LH. Nicolás Mendoza Ladrón de Guevara, 2013 NEUROENDOCRINOLOGÍA REPRODUCTIVA. 5 Es también atractivo pensar que las hormonas sexuales estimulan la actividad de los OE. De hecho, se ha observado que disminuyen tras la menopausia y se recuperan con el tratamiento hormonal. El efecto del ejercicio físico sobre el eje gonadal también se explica por su influencia sobre la secreción de OE, quizá por eso también se incremente la euforia después de la práctica deportiva, y cuando se practica en exceso es responsable de su cese. Regulación de la secreción del GnRH El ciclo ovárico depende claramente de la secreción pulsátil del GnRH y de que ésta se mantenga en unos valores concretos de frecuencia y amplitud. Tanto la fisiología como la fisiopatología del ciclo ovárico, al menos en cuanto al control cerebral se refieren, se pueden explicar por mecanismos que afectan a dicha secreción pulsátil: Los pulsos de GnRH están bajo la influencia directa de un sistema catecolaminérgico doble: del mesencéfalo y troncoencéfalo inferior proceden unas neuronas productoras de noradrenalina (NA) que favorecen los pulsos, y del propio núcleo arqueado otras neuronas que producen dopamina (DA) e inhiben la secreción de GnRH. A su vez, este doble sistema catecolaminérgico está influenciado por la actividad de los opioides endógenos (OE) y de otras estructuras cerebrales superiores. Precisamente, los efectos de la retroalimentación negativa que ejercen las hormonas sexuales están mediados por alguno de estos sistemas: bien por medio de mensajeros producidos en el mismo cerebro (catecolestrógenos), bien por el efecto de los OE, o bien por otros neurotransmisores (serotonina) producidos como respuesta al estímulo hormonal. Aunque las células productoras de GnRH no disponen de receptores para los estrógenos, investigaciones recientes han descrito varios eslabones entre el estímulo estrogénico y la secreción-liberación de GnRH. El más interesante es el formado por la Kisspeptina y su receptor -la GPR54- que, entre otras cosas, están relacionados con el pico de LH preovulatorio, el dimorfismo cerebral y el comportamiento sexual. Nicolás Mendoza Ladrón de Guevara, 2013 NEUROENDOCRINOLOGÍA REPRODUCTIVA. 5 Otras influencias endocrinas sobre el ciclo ovárico Sobre la integridad funcional del ovario, esto es, sobre la ovulación, intervienen no sólo las sustancias producidas en el cerebro o por sus propias células, sino que participan casi todos los tejidos del organismo con función hormonal, en otras palabras, la ovulación necesita de un engranaje endocrinológico perfecto, y la merma en cualquiera de sus eslabones justifica la anovulación y la amenorrea. Particularmente, existe un interés creciente en la relación entre la insulina y el ovario, desde que se aislasen receptores en las células intersticiales del ovario para insulina y se viese su relación con el síndrome del ovario poliquístico. A grandes rasgos, la insulina ejerce por varios mecanismos (estimulación directa, aumento de las IGF-I, inhibición de las SHBG y las IGFBP) una acción favorecedora de la síntesis intraovárica de andrógenos y, en consecuencia, evita el desarrollo folicular adecuado y su fin último: la ovulación. Por otro lado, conocemos la participación de la leptina (la hormona del tejido adiposo) en el inicio de la pubertad y el desarrollo sexual, y se han aislado receptores ováricos en las células foliculares, inhibiendo a la IGF1en presencia de LH, o sea, una acción antagónica de la insulina. Además, interviene en los mecanismos de retroalimentación entre ovario e hipófisis, e incluso se la ha implicado en el desarrollo embrionario precoz. El ovario desde el nacimiento a la senectud El envejecimiento de esta glándula es un fenómeno que comienza desde el mismo momento de su formación. De entrada, sabemos que en el ovario concurren dos fenómenos fisiológicos paralelos en el tiempo: la acción hormonal y la función reproductiva. Su complementariedad hace que sufran un envejecimiento sincrónico, aunque se ha marcado un desfase (calculado en unos ocho años) entre la desaparición completa de la función reproductiva y la de la producción hormonal. Por eso, podemos adivinar que el primer signo del declinar ovárico será precisamente la dificultad reproductiva. El Ovario fetal Entre la sexta y la octava semana de gestación comienza una rápida multiplicación mitótica de las células germinales del ovario primitivo (ovogonias), alcanzando los 6-7 millones hacia la 20ª semana. Estas ovogonias se transforman en ovocitos cuando entran en la primera división meiótica y se rodean de una capa de células de pregranulosa originadas en el mesénquima: la unidad resultante es el folículo primordial. Como sabemos, los ovocitos se detienen en la 1ª profase y solo uno completará las dos divisiones de la meiosis: la primera justo antes de la ovulación y la segunda, la que le da la condición haploide, cuando penetra el espermatozoide. A veces, debido al fuerte estímulo hormonal materno, algunos folículos primordiales pueden evolucionar a preantrales e incuso a antrales durante el embarazo. El ovario en la transición menopáusica Desde una perspectiva cuantitativa, en los trabajos sobre reproducción asistida se observa un descenso de la cantidad de ovocitos reclutados en las mujeres de más de 38 años, pero la mayoría de ellas conservan sus ciclos ovulatorios hasta casi la siguiente década. Paralelo al declinar en la Nicolás Mendoza Ladrón de Guevara, 2013 NEUROENDOCRINOLOGÍA REPRODUCTIVA. 5 reserva ovocitaria, también se observa una disminución de la calidad. De hecho, se acepta que esta dificultad reproductiva viene dada más por cuestiones de calidad ovocitaria que de cantidad de folículos. Porque, en ausencia de daño espermático, la calidad embrionaria depende de la calidad ovocitaria, y de ella, la probabilidad de implantación, de embarazo y de gestación evolutiva. Está probado que el factor determinante de la calidad embrionaria es el incremento de las aneuploidías (portar un número impar de cromosomas) que se produce con la edad. Las más frecuentes son las trisomías y se deben a alteraciones de los mecanismos de regulación del huso meiótico de los ovocitos. No tenemos muy claro cuál o cuáles son los factores que predisponen a los ovocitos humanos a padecer aneuploidías, por qué unas veces se presentan tras la separación prematura de las cromátidas durante la primera meiosis, y otras como resultado de la no disyunción en la segunda meiosis. Pero, dentro de las hipótesis postuladas para justificarlas, las más interesantes abogan por una menor disponibilidad de energía celular proporcionada por las mitocondrias. No olvidemos que los ovocitos son las células más grandes del organismo y requieren un gran consumo energético. En este sentido, puede que el envejecimiento ovárico no comience en el propio ovocito (o sólo en él), pues esta disminución en el número de mitocondrias también se advierte en las células de la granulosa de mujeres mayores de 38 años. En consecuencia, e independientemente de quién ostente esta responsabilidad primera, conocemos que el aumento de las aneupliodías es responsable de la alta tasa de fallos de implantación embrionaria, del elevado porcentaje de abortos espontáneos, del mayor riesgo de malformaciones congénitas y de los retrasos mentales infantiles. Si los métodos de la Teleología, doctrina filosófica que estudia las causas finales de las cosas, pudieran aplicarse a la fisiología del ovario, se esgrimirían razones para el declinar reproductivo y hormonal de la mujer. Como que su correcto funcionamiento fuese un bien que pretendiese reservar para la mujer joven las mejores condiciones de desarrollo, nutrición y bienestar cuando quisiera concebir un nuevo ser. Pero, para cuando las condiciones corporales ya no fuesen las idóneas, se programaría un deterioro de las funciones reproductiva y endocrina encargadas del mantenimiento de esta nueva vida. Así entendido, teleológicamente la menopausia es un hito que nos marca el final de la función hormonal y principia el envejecimiento, y el periodo previo a ella sería una etapa donde se relega la reproducción, ya sea de manera cuantitativa (menos embarazos) como cualitativa (más abortos). Endocrinología de la senectud ovárica A nivel endocrino, la primera manifestación del envejecimiento ovárico es su insensibilidad a la estimulación de las gonadotrofinas. La elevación de la FSH justifica que los niveles estrogénicos y el porcentaje de ciclos ovulatorios sean semejantes a las mujeres más jóvenes, pero la progresiva reducción folicular, y con ello la menor disponibilidad de células de la granulosa, disminuye la secreción de los péptidos ováricos que controlan su producción, fundamentalmente la inhibina B. El progresivo aumento de la FSH será, a su vez, responsable de la maduración irregular de los folículos que van quedando y con ello de una alteración de su desarrollo. Esto se traduce en una reducción de la fase folicular, sustrato biológico del acortamiento del ciclo en las mujeres de esta edad. Ambas gonadotrofinas seguirán elevándose con la edad aunque no de una manera afín: la FSH lo hace de una forma más precoz e intensa que la de la LH, diferencia que se explica por tener una mayor cantidad de sustancias ováricas inhibidoras que la regulan y por su mayor vida media plasmática. Por el contrario, los niveles de LH fluctúan mucho más al ser más sensibles a la acción estrogénica. En cuanto al GnRH, su secreción también empieza a hacerse irregular como respuesta a la disminución de los niveles periféricos de los péptidos ováricos. Antes del desgaste total de los folículos en desarrollo, el aumento de la LH estimula en la teca la producción de testosterona, que será en la postmenopausia el principal andrógeno. Por esta Nicolás Mendoza Ladrón de Guevara, 2013 NEUROENDOCRINOLOGÍA REPRODUCTIVA. 5 causa muchas mujeres antes de la menopausia se quejan de signos androgénicos y empiezan a mostrar patrones masculinos de metabolismo lipídico, de tensión arterial y de distribución grasa, que son capaces de incrementar el riesgo de padecer una enfermedad cardiovascular. Con los años, los cada vez más escasos folículos son también menos sensibles al estímulo de las gonadotrofinas y se pasa a un estado de anovulación mantenida, con la reducción consecuente de la síntesis de progesterona. Este descenso, aparte de modificar el patrón cíclico de los cambios endometriales, altera la secreción de la LH, y se produce una luteinización prematura de los folículos en desarrollo. El resultado final es una disminución de la síntesis de todos los esteroides ováricos. Como consecuencia, el endometrio no prolifera y se prolonga el periodo de amenorrea. El final es la menopausia. Puntos clave Es absolutamente necesaria para la reproducción normal una secreción pulsátil de GnRH con valores de frecuencia y amplitud muy precisos. La GnRH tiene solo acciones positivas sobre la adenohipófisis: síntesis, almacenamiento, activación y secreción de gonadotrofinas. Las gonadotrofinas se secretan de manera pulsátil en respuesta a la liberación pulsátil del GnRH: Frecuencias bajas favorecen la secreción de FSH, frecuencias altas la de LH. Concentraciones estrogénicas bajas aumentan la síntesis y almacenamiento de las Gonadotrofinas, aunque apenas tienen efectos sobre la secreción de LH Concentraciones estrogénicas altas inducen el pico de LH en la mitad del ciclo. Concentraciones de progesterona bajas potencian la respuesta de la LH a la GnRH y son responsables del pico de FSH en mitad del ciclo. Concentraciones de progesterona altas inhiben la secreción de gonadotrofinas al inhibir los pulsos de GnRH. Nicolás Mendoza Ladrón de Guevara, 2013