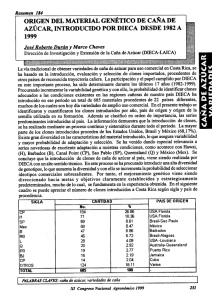
objetivos - Bodegas Naranjo
Anuncio

0.- PRESENTACION Y OBJETIVOS DEL TRABAJO: Tras 6 años de trabajo con la variedad Cencibel en la Mancha Occidental, parece necesario poner de manifiesto los avances conseguidos en el conocimiento de la maduración, el comportamiento enológico, la ampelometría y ampelografía de algo tan importante y tan nuestro como la principal variedad autóctona de producción de vinos de calidad en España. De 2001 a 2004 realizamos estudios de maduración y seguimiento de plantaciones de Cencibel en espaldera y en vaso, controlando diversos parámetros cuantitativos y cualitativos que nos han llevado a propuestas en la mejora del cultivo, vendimia y elaboración que ya han sido objeto de publicación. En 2005 se realizó un primer estudio ampelográfico de las plantaciones viejas de cencibel para intentar fijar los caracteres más representativos y diferenciadores de la variedad de los que haremos una breve reseña. En 2006 y 2007 hemos profundizado en caracteres ampelométricos de clones de plantaciones viejas comparándolos con clones de Tempranillo de nuevas plantaciones en espaldera. Hemos estudiado las diferencias interanuales en los caracteres y las diferencias de los caracteres en campo y en la colección en maceta que ya tiene 2 años. Durante 2007 hemos firmado un contrato de investigación con una empresa para instalar un campo de comparación de clones y una plantación policlonal de Cencibel con criterios principalmente conservacionistas. En 2007 se pusieron los portainjertos y en 2008 hemos procedido a la recolección de madera y al injerto de campo. 1.-JUSTIFICACION: 1.1.-Importancia histórica de la vid y de la variedad Cencibel. Algunos autores sitúan los orígenes de la vid en Asia Central, mientras otros aseguran que su origen es europeo, donde existía ya en la era terciaria. Lo que sí se puede afirmar, es que el cultivo de la vid y la elaboración del vino eran conocidos de todos los pueblos antiguos, desde la India, pasando por Egipto hasta la Galia e Iberia. La revelación de dicho proceso se atribuye míticamente a Osiris, entre los egipcios, y a Dionisos , entre los griegos. Por su parte los hebreos afirman que fue Noé el primero en cultivar la vid y el vino ha ocupado entre ellos un lugar preeminente en sus ritos y costumbres, así como en las fiestas de los primitivos griegos y romanos (Hidalgo, 1999). La viticultura debe gran parte de su desarrollo a la propagación del cristianismo por ser el vino necesario para la celebración de la misa. Desde el Imperio Romano y soportando la crisis de las invasiones bárbaras y la edad Media, el cultivo de la vid y el vino permaneció unido al quehacer diario de los monasterios. 1 Con el avance de la Reconquista en España, los monjes comenzaron la repoblación de cepas y las Órdenes Monásticas se convirtieron en celadores de la viticultura, manteniéndola y difundiéndola. En Castilla La Mancha esta labor recayó sobre la Orden de Calatrava. Esta Orden tiene su origen en 1158 y recibe el nombre del castillo de Calatrava la Vieja donde fue fundada por el monje cisterciense francés Raymond de Citeaux. Fue aprobada por el Papa Alejandro III que estableció un sistema en el que los colonos, vasallos libres de servidumbre, podían acceder a la propiedad de la tierra siempre que plantaran viñedos. Desde entonces y con altibajos podemos considerar el cultivo de la viña en Castilla-La Mancha de forma continua y documentada por múltiples referencias históricas y literarias (Sanchez, 2001). Muy probablemente los monjes cistercienses trajeron, junto con sus ritos, sarmientos de las vides cultivadas en sus tierras de origen y Cencibel tenga un origen próximo al Pinot Noir, al Cabernet Franc o, más fácilmente, al Merlot. . 1.2.- La variedad Cencibel en la viticultura actual. En la actualidad, por continentes, la mayor superficie del viñedo corresponde a Europa, seguido de Asia, América, África y Oceanía. La mayor superficie de viñedo por países corresponde a España, seguida de Italia y Francia en Europa. En el continente americano el país con mayor superficie de viña es Estados Unidos, seguido por Argentina y Chile. La mayor superficie de viñedo en Asia corresponde a Turquía; en África a Sudáfrica y en Oceanía a Australia. Sólo entre España, Francia e Italia se concentran más de 3 millones de hectáreas de viñedo. Junto con otros países mediterráneos y algunos países del este de Europa constituyen el núcleo de lo que conocemos como “modelo de Viticultura Tradicional”. California, Chile, Argentina, Sudáfrica, Australia y Nueva Zelanda constituyen con más de 1 millón de hectáreas el “modelo vitícola del Nuevo Mundo”. El cultivo de la vid se da prácticamente en todas las provincias españolas, representa el 3% de la superficie total geográfica, y el 7,5% de la cultivada. Es solo superado en extensión por los cereales y el olivo. El cultivo es especialmente intenso en Castilla-La Mancha (Tabla Nº 1). Castilla La Mancha tiene una superficie de 79.230Km2, lo que representa un 15,7% del territorio nacional y el 2,17% de la Unión Europea, siendo la tercera comunidad autónoma de España en cuanto a extensión, después de Castilla León y Andalucía. El 50% de la superficie de viñedo en España se encuentra en Castilla La Mancha, especialmente concentrado en Ciudad Real y Toledo donde la vid se ha cultivado tradicionalmente bajo sistemas de producción típicos de secano. En los últimos años se está produciendo un avance muy importante de la superficie de viñedo regada, lo que explica que con una disminución de superficie se haya producido un importante incremento de producción. La estructura de la viticultura de la región se caracteriza porque su destino preferente es la producción de uva para transformación. Sin embargo, el rasgo más importante actualmente en Castilla-La Mancha puede la reconversión varietal y de sistemas de conducción. 2 Comunidad autónoma Andalucía Aragón Canarias Castilla La Mancha Castilla León Cataluña Comun. Valenciana Extremadura Galicia Islas Baleares La Rioja Madrid Murcia Navarra País Vasco Principado de Asturias TOTAL Hectáreas 43.312 44.674 7.096 564.739 74.861 61.405 86.527 89.489 28.004 3.498 45.178 13.829 45.560 29.714 11.842 21 1.149.749 Hectolitros 1.268.000 1.116.000 87.400 21.350.700 1.532.300 2.897.000 2.471.300 3.158.000 1.268.000 40.600 2.455.000 267.300 742.000 1.001.400 742.000 1.100 40.398.100 Tabla 1.-Superficie y producción de vid en España por Comunidades Autónomas. Fuente: La semana vitivinícola 2006 La reconversión varietal cabe calificarla positivamente en términos generales: Constituye un esfuerzo sin precedentes en la etapa postfiloxérica para adecuar la oferta a la demanda. Sustancialmente se han plantado variedades tintas y en la mayor parte de los casos variedades de calidad y prestigiosas: Tempranillo (Cencibel), Cabernet Sauvignon, Merlot, Syrah,... Por otra parte, casi la totalidad de las plantaciones nuevas se han hecho en espaldera y con riego por goteo, en la mayor parte de los casos siguiendo patrones de diseño conservadores y rutinarios (marcos de plantación, densidad, forma de poda, sistema de conducción, mantenimiento del suelo, dosis de riego, etc...). Respecto al material vegetal utilizado conviene saber que las variedades tradicionales estaban compuestas por una mezcla de clones fenotípicamente uniformes y su adaptación a un medio ecológico se producía lentamente, con muchas interacciones y una cierta selección masal por parte de los viticultores. A partir de los años 70 en España, en Europa antes, se produjo un proceso de selección clonal-sanitaria de las principales variedades de producción de vinos de calidad. Dicha selección sirvió en la mayor parte de los casos para dotar al mercado de material vegetal sano (libre de virus) y con garantía varietal. Este material es el que se ha venido empleando en los procesos de reestructuración del viñedo ya que, para cobrar subvenciones, la administración exige factura de planta certificada. La selección de los años 1.970 a 1.990 se realizó con criterios sanitarios y generalmente productivos: Las plantas más productivas eran generalmente las más sanas. Por ello las nuevas plantaciones se han realizado prácticamente todas ellas con unos pocos clones seleccionados casi siempre por su productividad. En Castilla-La Mancha las nuevas plantaciones han hecho cambiar la distribución varietal de nuestro viñedo. Como se puede observar en la Figura 1, para el horizonte 2010, se 3 habrá equilibrado en Castilla-La Mancha la producción blanco-tinto y casi la mitad de ese tinto será Tempranillo, por lo que nos centraremos durante este estudio en su problemática. EVOLUCION VARIETAL EN CASTILLA-LA MANCHA 1980 2000 2010 En OTRAS CHARDONNAY SAUVIGNON B. 100% MERLOT 90% MACABEO 80% CABERNET S. 70% SYRAH 60% TINTORERA 50% MONASTREL 40% GARNACHA 30% BOBAL 20% TEMPRANILLO 10% AIREN 0% Figura 1.- Distribución varietal porcentual en Castilla-La Mancha. (Nota: Los datos del gráfico aparecen en porcentaje y proceden de diversas fuentes: UCAMAN, JJCC Castilla-La Mancha, elaboración propia, etc…. Los datos de 2010 son previsiones a la vista de las reestructuraciones solicitadas.) este marco tan complicado (Tabla 2) y tan cambiante situamos el trabajo actual que pretende conjugar modernidad y rigor científico con tradición y recuperación de recursos genéticos autóctonos. 2.-ANTECEDENTES: 2.1.-Genética de la viña y problemática actual: La vid (Vitis sp) es una planta con flores, esto es, una angiosperma, de la clase de las dicotiledóneas, de la subclase con flores mas simples (Choripetalae), pero en el grupo dotado de cáliz y corola (Dyalypetalae), es decir, el mas avanzado. Es una planta trepadora, con tronco retorcido, vástagos nudosos y flexibles, hojas alternas, grandes y partidas en cinco lóbulos puntiagudos, flores verdosas en racimos y cuyo fruto es la uva. Tabla 2: Principales variedades cultivadas en Castilla-La Mancha. Variedades Tintas Superficie (Has) Variedades Blancas Superficie (Has) 4 Tempranillo(Cencibel) Bobal Garnacha Monastrell Garnacha Tintorera Syrah Cabernet Sauvignon Tinto Pámpana Blanca Merlot Tinto Velasco Moravia Rojal Tinto Garnacha Peluda Petit Verdot Moravia Agria Tinto Basto Cabernet Franc Forcallat Mazuela Coloraillo Graciano Malbec Otras Totales 71.752 53.376 24.639 19.694 12.585 8.368 6.130 4.876 2.316 2.219 2.166 1.317 737 687 535 472 425 310 304 267 91 29 3.571 216.866 Airen Macabeo Pardillo Jaen Verdoncho Verdejo Sauvignon Blanc Chardonnay Malvasia Albillo Moscatel Grano Menudo Malvar Forcallat Blanco Moscatel Pedro Ximenez Parellada Messeguera Garnacha Blanca Palomino Fino Viognier 285.654 5.070 3.914 2.773 2.301 1.202 834 507 346 313 162 158 146 139 117 107 40 31 15 11 Otras Totales 5.088 308.928 Fuente: U.C.M.A.N. y J.C.C.M. 2006 Su clasificación científica es: Reino: Plantae División: Magnoliophyta Clase: Magnoliopsida Orden: Vitales Familia: Vitaceae Género: Vitis Especie: V. vinifera Subespecie: V.v. vinifera La familia de las vitáceas comprende 12 géneros, entre los que destaca el género vitis. A éste género pertenecen las vides cultivadas y esta dividido en dos secciones o subgéneros: Euvitis (2n=36) y Muscadinia (2n=40). En el subgénero Muscadinia , la única especie cultivada es V.rotundifolia. En el subgénero Euvitis distinguimos tres grupos: las variedades procedentes de América del Norte, que son resistentes a la filoxera y se utilizan fundamentalmente para la producción de patrones (V.riparia, V. rupestris, V. brelandieri, V. cordifolia, V. labrusca, V. candicans y V. cinerea), y las cultivadas en Europa y en Asia occidental, donde una única especie presenta grandes cualidades para la producción de vino es el V.vinifera, sensible a filoxera y a las enfermedades criptogámicas (Hidalgo, 1999). 5 Los patrones son híbridos entre especies americanas (V.riparia, V.rupestris y V.berlandieri) y/o éstas con viníferas (V. vinífera), con objeto de conseguir material resistente a la filoxera para poder ser injertado La clasificación de las variedades cultivadas que componen la especie de Vitis vinífera es difícil. Las variedades actuales proceden de la evolución, selección, adaptación al cultivo de las lambruscas (vides silvestres) y del cruzamiento natural entre plantas hermafroditas de origen asiático, introducidas por el hombre, con las poblaciones dioicas europeas de vides silvestres (variedad intervarietal). Por otro lado, estos cultivares europeos actuales, posiblemente procedan de un grupo de plantas muy semejantes extraídas de la flora silvestre, lo que justificaría plenamente el origen policlonal de nuestros actuales cultivares, que por lo tanto deben ser considerados como autenticas viníferas población. Dada esta variabilidad intravarietal, donde cada variedad está constituida por un conjunto de individuos que no presentan caracteres idénticos en los aspectos morfológicos, agronómicos y organolépticos, es posible seleccionar cabezas de clon dentro de las variedades. El cultivo de la vid tiende hacia un número limitado de variedades “universales” que pone en peligro el patrimonio genético vitícola. Tras la terrible plaga de filoxera que asoló los viñedos europeos en el siglo XIX, los métodos de cultivo han cambiado de forma radical: modificación de las técnicas de cultivo y creación de viveros de selección y multiplicación de material vegetal. Esta situación ha provocado una gran perdida de riqueza genética en muchas de las variedades empleadas, incluso pueden desaparecer genotipos autóctonos o variedades enteras que son minoritarias en cuanto a superficie de cultivo (Duque, 2003). 2.2.- La Selección Clonal Masal en Francia e Italia: La selección masal comenzó a realizarse en Francia en 1965 (Boidron, 1995). Desde entonces las diferentes vías de actuación han desembocado en la selección sanitaria por la aparición de nuevas virosis, como los virus GFLV (entrenudo corto), GLRV (enrollado), RW (madera rizada), GFKN (jaspeado), etc…También se ha buscado aumentar la producción o la calidad de los vinos. La selección clonal necesita de una serie de pasos como son una primera preselección, determinación de la sanidad mediante el método Indexage, una comparación de clones y una posterior conservación y multiplicación. El origen de las variaciones clonales viene dado por virus, mutaciones, retroceso a estados juveniles o a orígenes policlonales. Estas variaciones clonales tienen las siguientes consecuencias: • La diferente morfología entre unas cepas y otras podemos apreciarla debido a la densidad de pelos postrados en hojas y brotes (por ejemplo, Aramon); presencia de coloración antociánica (por ejemplo Chenin); niveles de clorofila en hoja, lo que provoca riqueza en azúcar y coloraciones más verdes (por ejemplo, Moscatel de Alejandría); profundidad de los senos foliares (Pinot noir)... • La diferente fenología: como la diferencia de fecha en el desborre (Garnacha); o la diferencia en la fecha de la maduración (Merlot o Cabernet Franc). • La diferencia en el vigor pues cada clon puede tener diferente vigor (Sauvignon Blanc). 6 • Diferencias en el rendimiento: diferencias de fertilidad, cuajado, tamaño de la baya, número de bayas y de racimos, etc. • Diferencias en el potencial tecnológico: presencia o ausencia de compuestos fenólicos (Nebbiolo), lo que repercute en la expresión del vino. En otro estudio en Champagne (Barillere, 1995) se centró la atención hacia la preservación de la variabilidad genética y la diversidad en la aplicación de la biotecnología. Por ejemplo se ha visto que Pinot Noir tiene gran variabilidad en la región de Champagne, donde encontramos tres grupos de esta variedad con diferentes producciones. Debemos tener en cuenta que un clon que hoy es poco interesante, puede ser muy interesante en el futuro. La tipicidad y la calidad son mejores cuando la producción disminuye. En un estudio realizado en el norte de Italia (Mannini, 1995) sobre la variedad Nebbiolo nos muestra que esta variedad esta constituida por clones genéticamente heterogéneos evidenciado por un buen conocimiento del polimorfismo morfológico de las hojas, probablemente debido a la acumulación de mutaciones somáticas. Las subvariedades tienen diferencias ampelográficas (caracteres vitícolas y enológicos) como son: Hojas más pequeñas con senos más profundos, racimos más pequeños y cónicos, bayas pequeñas y bayas de colores más claros, una sumidad fuerte y de color rojo y fuertes diferencias externas del vigor vegetativo afectando a la calidad del vino. Resulta interesante señalar que cepas infectadas con GFLV presentan modificaciones en su comportamiento vegetativo (menos vigor) que mejoran la calidad de los vinos obtenidos, concretamente los del subtipo “Michet”. Cuando se intentaron sanear estos biotipos por termoterapia, los resultados fueron peores en cuanto a calidad del vino obtenido. En cambio, plantas libres de otras virosis (GLRaVs y GVA) han mostrado mayores concentraciones de antocianos, lo que beneficia la calidad de los vinos. Un estudio realizado sobre 5 biotipos de Sangiovese diferentes en la región de la Toscana (Paoletti, 1995) observa cómo la morfología del racimo cambia de un año para otro, por lo que deduce que no es un buen descriptor de la variedad. No obstante hay que prestarle atención al racimo, el cual debe ser tan pequeño como sea posible, conteniendo bayas pequeñas. La piel debe ser de color intenso incluso cerca del peciolo (la madurez de Sangiovese se produce en el tercer periodo, a finales de septiembre – octubre). Esta variedad puede dar vinos rosados, tintos o crianzas. Se analizan los antocianos monómeros para intentar diferenciar subtipos dentro de la variedad. Las bases para una buena selección de los clones de Sangiovese en la Toscana vienen regidas por estos cinco principios: Búsqueda y evaluación de nuevos clones: basados en la producción y en la calidad de los vinos. Tolerancia a enfermedades Selección en los viñedos con producciones más reconocidas. Los clones han de ser diversos, tanto agronómicamente como enológicamente. Deben estar libres de virus. 7 Los análisis de ADN son válidos para diferenciar variedades pero no clones. (Bandinelli, 1995). En un estudio realizado sobre 12 clones de Sangiovese “grosso” (Silverstroni, 1995), se seleccionaron 4 cepas por clon, de las que se cogieron 6 hojas por cepa (a partir del racimo) durante la etapa de cuajado. También se seleccionaron 4 racimos en la madurez. De esta forma se obtuvieron 24 caracteres foliares muy bien definidos y 7 descriptores sobre el racimo relacionados con los caracteres carpométricos. Se realizó un análisis multivariante siguiendo en método de las componentes principales, donde se obtuvo un gráfico que agrupaba a las cepas de los diferentes clones. También se realizó un “cluster análisis” con los cinco grupos obtenidos. Respecto al eje “x” se agrupaban dependiendo del número de dientes de cada hoja (siendo más elevado este número cuanto más a la izquierda se localice). En cuanto al eje “y” vemos que cuanto más arriba se localicen tendrán unos senos laterales más profundos y unos dientes más alargados. Una base para la selección clonal, realizada en la caracterización de biotipos de Sangiovese (Calò, 1995) esta basada en la descripción ampelográfica (sumidad y racimo), en el análisis ampelométrico de las hojas, (se escogen 15 hojas desde el décimo nudo de cada planta). También se realizó un estudio isoencimático, el cual no dio diferencias significativas. También se realizó una estimación de los antocianos de la piel de las bayas. Se realizó también un análisis de ADN (RAPD markers). Analizando los resultados podemos establecer diferentes grupos, según atendamos a uno u otro carácter estudiado; así, si tenemos en cuenta la sumidad vemos que en unos aparecen pigmentaciones y en otros no. En cuanto al racimo observamos que agrupa los resultados en función del tamaño. Igual ocurre con las bayas ya que las agrupa en redondas u ovaladas. En cuanto a las medidas de las hojas la realización de un análisis cluster nos arroja un resultado de 5 grupos que se corresponden con 5 perfiles. Respecto a los antocianos observamos cómo se agrupan subvariedades caracterizadas por un elevado porcentaje de cianidina y malvidina, que pueden variar dependiendo de condiciones agronómicas y climáticas, produciéndose la aparición de dos grupos principales. En otro estudio realizado se ha observado que el peso de las bayas es un carácter suficiente para mejorar la selección en poblaciones de Sangiovese. Así podemos diferenciar entre biotipos “grosso” y “piccolo” (Campostini, 1995). Observamos cómo en los próximos años debe llevarse a cabo una fuerte reconversión para preservar la variabilidad y la calidad de Sangiovese. Es muy importante el estudio de las características diferenciales de cada clon pero también es fundamental comprobar que esa característica no varía sustancialmente en distintas vendimias. 8 2.3.- Estado actual de la variedad Cencibel: La variedad “Cencibel” es la que produce tradicionalmente vinos tintos de calidad en La Mancha y Valdepeñas. Dicha variedad tiene múltiples sinonimias (Chomé, 2003): “Tempranillo” en La Rioja es la más extendida, “Tinta Roriz” en la zona de Douro en Portugal y “Aragoés” más al sur (Alentejo). Dentro de España “Jacivera” en Manchuela, “Tinto fino” en Ribera de Duero, “Tinto del país”,”Tinta de Toro” y “Ull de llebre” en Cataluña. Por el propio sistema de multiplicación de la vid, las variedades tradicionales están constituidas por una mezcla de “ecotipos” o “clones” (Amorós, 1990) de cierta uniformidad pero con genotipos y fenotipos algo diferentes. Durante los últimos años del siglo pasado y continuando actualmente se han emprendido en muchas Regiones Vitícolas procesos de Selección Clonal Sanitaria de distintas variedades de vid (Duque, 2003). Dicha selección ha culminado con la obtención de clones selectos que han reproducido los viveros y que se encuentran a disposición de los viticultores que quieren hacer nuevas plantaciones. En muchos casos y fomentado por los programas de reestructuración (R.C.E. 1227/2000) se ha procedido a la introducción masiva de estos clones con el consiguiente beneficio productivo y algunas veces de calidad. Las nuevas plantaciones, junto con una productividad alta y un buen estado sanitario (Amorós, 2006), presentan una elevada uniformidad genética muy distinta de las viejas “variedades población”. Esta erosión genética se ha acentuado especialmente en Castilla-La Mancha ya que unido a la intensa reestructuración existe una gran escasez de clones autóctonos de “Cencibel” en los viveros que sirven planta a nuestros viticultores. Además existe la tendencia a hacer las plantaciones con un solo clon, sacrificando la diversidad genética a la comodidad de manejo. En trabajos recientemente presentados (Martins, 2004) sobre prospecciones realizadas en La Rioja, Douro, Alentejo y Valdepeñas, se apunta la hipótesis de que la posible zona de origen de la variedad sea Valdepeñas ya que presenta el más alto valor del coeficiente de variación genotípico de todos los clones (225 en total) de la colección establecida en Reguengos de Monsaraz en 1986. También puede emplearse un procedimiento estadístico para orientar las primeras etapas de la selección clonal de la variedad “Tinto del País” realizado en Castilla y León. Se puede realizar un ACP para las primeras etapas en las selección clonal de Vega Sicilia con variables ligadas a la producción, siendo las tres más importantes: kg./cepa, acidez total, peso de madera. Así se consigue reducir el número de variables a estudiar en cada planta desde las primeras etapas de selección. Podría decirse que el problema de este sistema radica en que para la selección se tienen en cuenta criterios exclusivamente productivos. Así se consiguen eliminar los individuos de más acidez y menor rendimiento. El método sirve para eliminar individuos y seleccionar las variables a medir (Judéz, 1995). Visto lo anterior, cabe afirmar el interés de conocer y preservar la variabilidad fenotípica y genotípica de nuestras viejas y cada vez más escasas plantaciones de Cencibel. 9 3.- MATERIAL Y METODOS: 3.1. Material vegetal y parcelas: El material vegetal objeto de estudio corresponde a diferentes parcelas de cepas viejas (más de 35 años) de la variedad tinta Cencibel que han sido seleccionadas en la zona de La Mancha occidental. Las parcelas estudiadas se describen a continuación y se nominan en clave: o FL (tres parcelas): Municipio: Almagro. Polígono: 25.Parcelas: 11b, 47 y 12a. o HC: Municipio: Fernancaballero. Polígono: 4.Parcela: 7. o HRS: Municipio: Carrión de Calatrava. Polígono: 40.Parcela: 76. o EFV:Municipio: Fernancaballero. Polígono: 3.Parcela: 25 o SO: Municipio: Carrión de Calatrava. Polígono: 24. Parcela: 73. o GRT: Municipio: Carrión de Calatrava. Polígono: 31.Parcela:545 a y b. o VA: Municipio: Valdepeñas. Polígono:52 . Parcela:87 a y b. o VI: Municipio: Villarrubia de los Ojos. Polígono:12.Parcela:22. o TEHU: Municipio: Torralba de Calatrava. Polígono:10. Parcela: 81. o TEGAL: Municipio: Ciudad Real. Polígono:. Parcela:. o TEVAL: VA5. Municipio . Valdepeñas: Polígono:142. Parcela:24. La ubicación de las parcelas y las cepas marcadas dentro de cada parcela aparecen en el Anejo 1. De dichas parcelas, durante 2003 y 2004, se marcaron cuatro cepas dispuestas de forma cuadrangular, excepto en los casos de la parcela HC y la HRS que se marcaron tres cepas, ya que las que hubiesen hecho la cuarta cepa no estaban en condiciones óptimas para la toma de muestras, pues esta selección se hizo en base a las cepas que mejor representarían los caracteres a medir y las más representativas de la parcela, con vigor y desarrollo medios. El marcado de cepas y la toma de material vegetal se realizó en varias jornadas, puesto que según la fecha, las muestras a tomar eran distintas. La parcela SO sólo se siguió durante 2 años ya que luego fue abandonada por su dueño. La parcela de Villarrubia sólo fue seguida en 2005 ya que en 2006 sufrió daños devastadores por una tormenta de pedrisco. Las parcelas con TE son las que se han tomado 10 como referencia de clones de comparación de Tempranillo ya que nos consta el año de plantación y el clon utilizado. 3.2. Métodos ampelográficos: La descripción se realizó a lo largo del año 2005-2006, utilizando un total de 35 caracteres ampelográficos, siguiendo los Códigos de los Caracteres de las variedades y especies de género Vitis establecido por la O.I.V. (Organización Internacional de la Viña y el Vino), con algunas modificaciones del Código UPOV (Unión Internacional para la Protección de las Obtenciones Vegetales) y de 6 caracteres ampelométricos, aunque estos últimos no han sido utilizados en este primer estudio. La «Organización Internacional de la Viña y el Vino» (O.I.V), que remplaza a la Oficina Internacional de la Viña y el Vino, fue creada por el Acuerdo del 3 de Abril de 2001. La OIV se define en dicho Acuerdo como un organismo intergubernamental de carácter científico y técnico, con una competencia reconocida en el campo de la viña, el vino, las bebidas a base de vino, las uvas de mesa, las uvas pasas y otros productos derivados de la vid. Actualmente está compuesto por 41 Estados miembros a los cuales se añaden en calidad de Estados observadores los antiguos Estados miembros de la Oficina Internacional de la Viña y el Vino. La Unión Internacional para la Protección de las Obtenciones Vegetales (UPOV) es una organización intergubernamental con sede en Ginebra (Suiza). La UPOV fue creada por el Convenio Internacional para la Protección de las Obtenciones Vegetales. El Convenio fue adoptado en París en 1961, y fue revisado en 1972, 1978 y 1991. El objetivo del Convenio es la protección de las obtenciones vegetales, con miras al desarrollo de nuevas variedades vegetales para beneficio de la sociedad. Pero, naturalmente, para distinguir las cepas vecinas será necesario hacer uso de otros caracteres: forma y profundidad de los senos laterales, forma del seno peciolar, vellosidad del limbo, estado de la superficie de la hoja,… Descripción de caracteres: Para la descripción de caracteres ampelográficos se hizo uso del Manual de Variedades de Vid del Ministerio de Agricultura, Pesca y Alimentación (M.A.P.Y.A) (CHOMÉ et al, 2003). Esta descripción asocia una escala de valores a cada carácter, de forma que dentro de cada uno de ellos, a las distintas posibilidades de un mismo carácter le corresponde un número. En este Manual cada carácter viene expresado según dos códigos, el código U.P.O.V. y el código O.I.V. (Figura 2). 11 Figura 2.- Ejemplo de carácter ampelográfico (Chomé, P. 2003). Pámpano joven: • Color de la cara dorsal del nudo (CDN): el pámpano joven puede tomar coloraciones verdes (1), verdes con rayas rojas (2) y rojas (3) (OIV 009). • Color de la cara ventral del nudo (CVN): puede tomar las mismas coloraciones que en la cara dorsal del nudo, es decir, coloraciones verdes (1), verdes con rayas rojas (2) y rojas (3) (OIV 010). • Densidad de los pelos postrados de los nudos (PPN): se distinguen nula o muy baja (1), baja (3), media (5), alta (7) o muy alta (9) (OIV 080). • Densidad de los pelos postrados de los entrenudos (PPE): puede ser nula o muy baja (1), baja (3), media (5), alta (7) o muy alta (9) (OIV 014). 12 Hoja joven: • Densidad de los pelos postrados entre los nervios principales del envés (PPP): la densidad puede ser nula o muy baja (1), baja (3), media (5), alta (7) o muy alta (9) (OIV 053). • Densidad de los pelos postrados sobre los nervios principales del envés (PSN): se encuentra en un rango entre 1 y 9 según sea nula o muy baja (1) y muy alta (9), pasando por baja (3), media (5) y alta (7) (OIV 055). Hoja adulta: • Tamaño del limbo (LTM): el limbo puede ser muy pequeño (1), pequeño (3), medio (5), grande (7) o muy grande (9) (OIV 065). • Forma del limbo (LFM): nos encontramos forma cuneiforme (1), cordiforme (2), pentagonal (3), orbicular (4) y reniforme (5) (OIV 067). • Número de lóbulos (NLO): puede aparecer hoja entera (un único lóbulo, correspondiente al 1), con tres (2), cinco (3), siete (4) o más de siete (5) (OIV 068). • Profundidad de los senos laterales superiores (SLP): se distinguen entre muy superficiales (1), superficiales (3), medios (5), profundos (7) o muy profundos (9) (UPOV 24). • Disposición de los lóbulos de los senos laterales superiores (DLS): pueden ser abiertos (1), cerrados (2), con lóbulos ligeramente superpuestos (3) o con lóbulos muy superpuestos (4) (OIV 082). • Disposición de los lóbulos del seno peciolar (SPL): hay un amplio abanico de posibilidades, como son, muy ampliamente abierto (1), muy abierto (2), abierto (3), poco abierto (4), cerrados (5), con lóbulos ligeramente superpuestos (6), con lóbulos superpuestos (7) y con lóbulos muy superpuestos (8) (OIV 079). • Seno peciolar limitado por nervios (SPC): caben dos posibilidades, o bien ninguno (1), o bien que sí esté limitado (2) (OIV 081). • Forma de la base del seno peciolar (SPB): dos posibilidades, en U (1) o en V (2) (OIV 080). • Longitud de los dientes (DLG): podemos encontrarnos dientes muy cortos (1), cortos (3), medianos (5), largos (7) o muy largos (9) (OIV 077). • Relación longitud/anchura de los dientes (DLA): existen tres posibilidades, que sean más anchos que largos (1), que sean más largos que anchos (2) o que sean iguales (3). 13 • Forma de los dientes (DFR): los dientes pueden tener los dos lados cóncavos (1), lados rectilíneos (2), lados convexos (3) o un lado cóncavo y un lado convexo (4) (OIV 076). • Pigmentación antociánica de los nervios principales del haz (NPG): los nervios principales del haz pueden presentar pigmentación muy débil o nula (1), débil (3), media (5), fuerte (7) o muy fuerte (9) (OIV 070). • Densidad de los pelos postrados entre los nervios principales del envés (NPI): puede ser muy baja o nula (1), baja (3), media (5), alta (7) o muy alta (9) (OIV 084). • Densidad de los pelos erguidos sobre los nervios principales del envés (NPN): puede ser muy baja o nula (1), baja (3), media (5), alta (7) o muy alta (9) (OIV 087). • Relación nervio principal/pecíolo (PEL): puede ocurrir que el nervio tenga mayor longitud que el pecíolo (1), que el nervio tenga menor longitud que el pecíolo (2) o que sean de la misma longitud (3). Racimo: • Tamaño (pedúnculo excluido) (RTM): el racimo puede ser muy pequeño (1), pequeño (3), medio (5), grande (7) o muy grande (9) (UPOV 036). • Compacidad (RCP): nos podemos encontrar con un racimo muy suelto (1), suelto (3), medio (5), compacto (7) o muy compacto (9) (OIV 204). • Longitud del pedúnculo (RLP): el pedúnculo puede ser muy corto (1), corto (3), mediano (5), largo (7) o muy largo (9) (OIV 206). Baya: • Tamaño de la baya (BTM): puede ser muy pequeña (1), pequeña (3), media (5), grande (7) o muy grande (9) (OIV 039). • Forma de perfil (BFP): hay una amplia gama, puede ser aplastada (1), ligeramente aplastada (2), esférica (3), elíptica corta (4), ovoide (5), troncoviode (6), acuminada (7), cilíndrica (8), elíptica larga (9) o en forma de cuerno (10) (OIV 223). • Uniformidad del tamaño (BUT): puede que sea no uniforme (1) o uniforme (2) (OIV 222). 14 • Color de la epidermis (sin pruina) (BCE): puede tomar coloraciones verdeamarillas (1), rosas (2), rojas (3), roja-grises (4), roja-violeta oscura (5) o negraazules (6) (UPOV 41). • Facilidad de separación del pedicelo (BSP): puede ser muy difícil de separar (1), difícil (3), dificultad media (5), fácil (7) o muy fácil (9) (OIV 240). • Grosor de la piel (BGP): puede tener la piel muy delgada (1), delgada (3), mediana (5), gruesa (7) o muy gruesa (9) (OIV 228). • Pigmentación antociánica de la pulpa (BPA): la pulpa puede tener coloración muy débil o no estar coloreada (1), coloración débil (3), coloración media (5), coloración fuerte (7) o coloración muy fuerte (9) (OIV 240). • Consistencia de la pulpa (BCP): la pulpa puede tener muy poca consistencia (1), poca consistencia (3), consistencia media (5), consistencia alta (7) o consistencia muy alta (9) (OIV 235). • Suculencia de la pulpa (BSC): la pulpa puede ser poco jugosa (1) o jugosa (2) (OIV 232). • Sabores particulares (SPS): puede que no tenga ningún sabor particular (1), gusto a moscatel (2), gusto a foxé (3) o un gusto especial (4) (OIV 236). • Formación de pepitas (FPS): puede que no haya pepitas (1), que sean rudimentarias (2) o que estén presentes y bien formadas (3) (OIV 241). 3.3. Métodos ampelométricos: Nuestro trabajo en Ampelografía nos sirvió para realizar una primera aproximación, pero la posible subjetividad en la apreciación de algunas variables nos llevó a centrarnos en el estudio de las medidas ampelométricas en hoja. La hoja de la vid constituye por ella misma un excelente órgano de determinación y clasificación de las especies o de las variedades. Para establecer las formas de hojas, se han retomado los principios enunciados por Ravaz en 1902, modificándolos y completándolos; es lo que constituye la Ampelometría, ciencia que utiliza la medida de ángulos formados por los nervios principales entre ellos completados por la relación de sus longitudes. Se realizó durante el año 2005 un seguimiento de las 7 plantaciones de más de 35 años de edad en la zona occidental de La Mancha con el fin de determinar las diferencias más importantes entre clones. Durante 2006 incrporaron 3 nuevas parcelas en Fernancaballero, Vilarrubia de las Ojos y Valdepeñas. Se visitaron las plantaciones en 3 ocasiones, durante 2006, y en la última semana de mayo se tomaron las muestras. Las cepas ya estaban seleccionadas y marcadas del año anterior. Se procuró coger las hojas situadas enfrente del primer racimo siempre que no 15 estuvieran dañadas o presentaran alguna deformidad extraña. Estas hojas se escanearon, para alargar el tiempo de medición y prevenir el deterioro, con una rejilla de fondo de 1 cm de lado para no perder la referencia de tamaño (Ver Anejo 2). Las medidas se hicieron mediante una regla (graduada en mm) y un transportador de ángulos (en grados). De ésta selección de hojas se midieron 23 caracteres ampelométricos OIV (Figura 3). Procuramos eliminar el efecto del tamaño tomando, siempre que ha sido posible tomando medidas relativas al nervio principal N1. Con los datos de las 5 hojas de cada planta se hizo la media para el clon obteniendo al final un conjunto de 25 posibles clones (individuos) y 23 variables. (Anejo 2) Figura 3: Medidas ampelométricas en hoja. (Silvestroni, 1995) La toma manual de medidas ampelométricas, además de ser tediosa, está sujeta a errores por lo que en 2007 utilizamos el programa WINFOLIA ( V2006 ©Regents Instruments) de tratamiento de imágenes en el que sólo tenemos que marcar los puntos de referencia de la imagen escaneada de la hoja. Durante 2007 decidimos comprobar si los caracteres ampelométricos variaban de un año a otro por lo que repetimos las mediciones realizadas en los clones controlados en 2006 (Anejo 3). También, y aprovechando la colección de clones de Cencibel en maceta que se ha instalado en la Finca Galiana, se decidió controlar los caracteres ampelométricos de los clones en la colección en maceta (Anejo 4). 16 3.4. Métodos estadísticos multivatiantes: El Análisis Multivariante, es una rama de la estadística que integra todo un conjunto de técnicas para analizar datos, caracterizados por un gran número de variables con una finalidad esencialmente descriptiva. El análisis de componentes principales se ocupa de explicar la estructura de la variabilidad de un conjunto de datos a través de unas cuantas combinaciones lineales de las variables originales. Sus objetivos son reducir datos y eliminar variables aleatorias irrelevantes. El Análisis de Componentes Principales (ACP) pertenece a un grupo de técnicas estadísticas multivariantes, eminentemente descriptivas. En el presente trabajo se aplicó el ACP según el criterio de la Escuela Francesa. (Júdez, 1989). El ACP permite reducir la dimensionalidad de los datos, transformando el conjunto de p variables originales en otro conjunto de q variables no correlacionadas (q < p) llamadas componentes principales. Las p variables son medidas sobre cada uno de los n individuos, obteniéndose una matriz de datos de orden np (p < n). Las q nuevas variables (componentes principales) son obtenidas como combinaciones lineales de las variables originales. Las componentes se ordenan en función del porcentaje de varianza explicada. En este sentido, la primera componente será el más importante por ser el que explica mayor porcentaje de la varianza de los datos. El análisis se realiza en el espacio de las variables y, en forma dual, en el espacio de los individuos. Se acostumbra a representar gráficamente los puntos-variables y lo puntosindividuos tomando como ejes de coordenadas las componentes principales. A veces, puede facilitar la interpretación de los resultados, el observar la similar ubicación de los puntos en los planos respectivos. Aunque el plano de puntos-variables no se superpone al plano de puntos-individuos, es de gran utilidad “interpretar” la cercanía de un grupo de puntosindividuos, a ciertas variables. En la práctica es frecuente que se disponga de información adicional que amplía la matriz de datos originales. Se puede tener otras medidas de los individuos de la muestra, o también nuevos individuos para los que se conozcan las variables analizadas. A estos datos adicionales se les llama suplementarios o ilustrativos porque no intervienen en la formación de los componentes. En estos casos se calculan las coordenadas de cada punto individuo o variable respecto a los ejes y se representan en los gráficos. Esto permite analizar las relaciones de la información suplementaria con los componentes principales. Generalmente la introducción de estos datos en el análisis se hace porque facilita la interpretación de los resultados. El análisis Factorial Discriminante (AFD) tiene como punto de partida un cuadro de doble entrada con n individuos y p variables, similar al del ACP, en el que suponemos que existe una partición previa de los n individuos en I grupos > 1. 17 Utilizaremos el AFD con fines descriptivos (Júdez, L. 1989): Deseamos una representación del conjunto de observaciones que nos permita verificar si estamos realmente en presencia de grupos bien diferenciados. También pretendemos encontrar la variable o conjunto de variables que mejor discriminan a los I grupos preestablecidos de observaciones. Para estudiar la variabilidad del conjunto de puntos se obtienen los factores discriminantes de los baricentros o centroides de cada grupo I de observaciones. Para analizar los resultados obtendremos al final una tabla de pertenencia de los individuos a los grupos iniciales comparada con su pertenencia real a los grupos finales. Viendo el número de observaciones reclasificadas nos haremos idea de la bondad de nuestra suposición previa de partición del conjunto. El AFD se puede utilizar con finalidad decisional para reclasificar observaciones mal clasificadas en un principio o para clasificar nuevas observaciones. Al conjunto de datos se le aplicó el Análisis Multivariante del software XLSTAT_Pro version 7.5© 1995-2006 Addinsoft y XLSTAT_3DPlot version 3.0 © 1995-2006 Addinsof. 4.-RESULTADOS Y DISCUSION: 4.1. AMPELOGRAFIA (2004-2005): 4.1.1. Datos de partida Los datos de partida corresponden a los 35 caracteres ampelográficos medidos en el laboratorio, correspondientes al pámpano joven, a las hojas, tanto jóvenes como adultas, a los racimos y bayas. De los datos obtenidos en la medida de los caracteres ampelográficos, no todos son significativos puesto que en algunos de ellos todos los clones coinciden, por esta razón, de los 35 caracteres de partida, nos quedamos con 22, que son los que presentan diferencias de unos clones de otros. Los datos de partida para realizar el ACP pueden observarse en el Anejo 1. 4.1.2. Análisis de la matriz de correlación La matriz de correlación es un cuadro de doble (ver Anejo 1) entrada que nos indica las correlaciones que existen, dos a dos, entre nuestras variables. Los valores de esta matriz oscilan entre -1 y 1, de forma que cuanto más cerca estén de éstos, más correlacionadas están esas variables dos a dos. En principio tendremos en cuenta las correlaciones mayores de 0,5 y -0,5; correlaciones menores de 0,5 y -0,5 no nos aportan información suficiente sobre la posible relación entre las variables. La variable PPN, que corresponde a la densidad de pelos postrados de los nudos, está correlacionada negativamente con SLP (profundidad de los senos laterales superiores) (-0.747), DFR (forma de los dientes) (-0.827) y NPG (pigmentación antociánica de los nervios principales del haz) (-0.803), y correlacionada positivamente con PSN (densidad de los pelos postrados sobre los nervios principales del envés) (0.539). Nos indica 18 que la influencia de la densidad de pelos postrados en los nudos es negativa con respecto a la profundidad de los senos laterales superiores, a la forma de los dientes y a la pigmentación antociánica de los nervios principales del haz. Igualmente nos indica que la densidad de estos pelos sí está relacionada con la densidad de los pelos postrados sobre los nervios principales del envés. De igual forma podemos observar que PPP (densidad de los pelos postrados entre los nervios principales del envés en pámpano joven) está correlacionada positivamente con NPI (densidad de los pelos postrados entre los nervios principales del envés en hoja adulta) (0.672), es decir, las densidades de los pelos postrados del envés, tanto los que se encuentran entre los nervios principales como los que están en el envés de la hoja adulta están relacionadas, de forma que si hay pelos de un tipo, podemos pensar que también habrá del otro tipo. La variable PSN (densidad de los pelos postrados sobre los nervios principales del envés) está correlacionada negativamente con NPN (densidad de los pelos erguidos sobre los nervios principales del envés). Lo cual nos indica que la aparición de pelos postrados sobre los nervios principales del envés y los erguidos es inversa, aunque está relación no es muy significativa (-0.501). En cuanto a LTM (tamaño del limbo), está correlacionada positivamente con BTM (tamaño de la baya) (0.504). Es decir, es una relación directa la que existe entre los tamaños del limbo y de la baya. La profundidad de los senos laterales superiores, SLP, está correlacionada positivamente con DFR (forma de los dientes) (0.646) y con NPG (pigmentación antociánica de los nervios principales del haz) (0.716). Con lo cual podemos deducir que la variable profundidad de los senos laterales superiores influye en las otras dos. La disposición de los lóbulos del seno peciolar, SPL, está correlacionada positivamente con SPB, forma de la base del seno peciolar. La correlación es alta (0.815), por lo que influye bastante la disposición de los lóbulos del seno peciolar en la forma de la base del mismo. DGL, la longitud de los dientes, está correlacionada positivamente con NPG, pigmentación antociánica de los nervios principales del haz (0.559). Es decir, existe una relación directa entre las dos variables. En cuanto a la variable DFR (forma de los dientes), está correlacionada positivamente con NPG (pigmentación antociánica de los nervios principales del haz). Podemos asegurar que la influencia es significativa puesto que la correlación es elevada (0.880). El tamaño del racimo (RTM) está correlacionado positivamente con RCP (compacidad del racimo) (0.398) y con BTM (tamaño de la baya) (0.419). Podemos observar que el tamaño del racimo está condicionado por el tamaño de la baya y por la compacidad del racimo, en menor medida. 19 Se observa que la variable RCP (compacidad del racimo) está correlacionada positivamente con BTM (tamaño de la baya) (0.511) y con BUT (uniformidad del tamaño de la baya) (0.491). Existe una relación directa entre la compacidad del racimo con respecto al tamaño de la baya y a la uniformidad del tamaño de la baya. La variable BGP (grosor de la piel) está correlacionada positivamente con BPA (pigmentación antociánica de la pulpa). Esta correlación (0.523) es interesante, puesto que hace referencia a que según sea más gruesa la piel, mayor pigmentación antociánica tiene. 4.1.3. Componentes principales y variables La tabla de componentes principales (Anejo 1) es obtenida como una combinación lineal de las variables originales. En el programa informático nos aparece un total de 22 componentes principales, las cuales se ordenan en función del porcentaje de varianza explicada. Para una mejor observación en los gráficos vamos a elegir una representación en el plano; para lo cual escogemos las 2 primeras componentes principales (Figura 4). Las tres primeras componentes reflejan alrededor del 53% de la varianza total. Podemos observar que las variables relacionadas positivamente con la componente 1 (eje X) son: Densidad de los pelos postrados de los nudos (PPN) Relación nervio principal/pecíolo (PEL) Pigmentación antociánica de la pulpa (BPA) Densidad de los pelos postrados sobre los nervios principales del envés (PSN) 0.880 0.646 0.569 0.469 Las variables relacionadas negativamente con la componente 1 son: Pigmentación antociánica de los nervios principales del haz (NPG) Profundidad de los senos laterales superiores (SLP) Forma de los dientes (DFR) Longitud de los dientes (DLG) -0.820 -0.786 -0.757 -0.621 Para la componente 2 (eje Y), las variables correlacionadas positivamente son: Densidad de los pelos erguidos sobre los nervios principales del envés (NPN) Longitud del pedúnculo (RLP) Densidad de los pelos postrados entre los nervios principales del envés (NPI) Tamaño del racimo (RTM) 0.734 0.548 0.541 0.492 Y las correlacionadas negativamente con la componente 2 son: 20 Disposición de los lóbulos del seno peciolar (SPL) Forma de la base del seno peciolar (SPB) Forma de los dientes (DFR) Consistencia de la pulpa (BCP) -0.673 -0.624 -0.565 -0.523 De acuerdo con estos resultados, podemos observar que las variables densidad de los pelos postrados de los nudos (PPN) y relación nervio principal/pecíolo (PEL) son las que más influyen en la componente 1, de forma positiva y la pigmentación antociánica de los nervios principales del haz (NPG) y la profundidad de los senos laterales superiores (SLP), de forma negativa. Estos resultados representados en el gráfico (Figura 4) nos indican que las variables que más influyen en la componente 1 son las que se encuentran más próximas al eje X y más alejadas del centro. En cuanto a la componente 2, observamos que las variables que más influyen positivamente son la densidad de los pelos erguidos sobre los nervios principales del envés (NPN) y la longitud del pedúnculo (RLP). Y negativamente, las variables que más influyen son la disposición de los lóbulos del seno peciolar (SPL) y la forma de la base del seno peciolar (SPB). En el gráfico son las más alejadas del centro y las más cercanas al eje Y. Representación de las Variables 1 NP N 0,5 DLA B TM NP I R LP R TM LTM PPP DGL 0 B UT B GP RCP P EL PPN BP A SLP NP G -0,5 P SN BCP DF R SP L SP B -1 -1 -0,5 0 0,5 1 F irst C o mp. Figura 4.-Representación de las Variables. Podemos establecer como los caracteres más discriminantes a la densidad de pelos postrados en los nudos (OIV 080), ya descrita en cv. Aramón (Boidron, R, 1995), profundidad de senos laterales superiores (UPOV 24), apuntada en cv. Nebbiolo (Mannini, F.,1995), forma 21 de los dientes (OIV 076, UPOV 30), pigmentación antociánica de los nervios (OIV 070, UPOV 31) y pigmentación antociánica de la pulpa (OIV 240, UPOV 44) señalados en cv. Sangiovese (Paoletti, A., 1995). 4.1.4. Estudio de los individuos respecto a las componentes principales Estudiaremos a continuación los individuos, que corresponden a las cepas estudiadas. Al igual que en el caso de las componentes, procederemos a su representación gráfica en función de las dos componentes principales que explican mayor porcentaje de varianza total (Figura 5). Representación de Individuos 8 HC2 6 4 2 TGR4 HRS2 SOT4 0 HRS3 -2 EFV4 EFV2 EFV1 -4 FL33FL24FL23 FL34 FL13 TGR3 FL14 FL22 SOT2 HRS1 TGR2 FL31 FL21FL11 HC3 SOT3 TGR1 FL12 SOT1 HC1 -6 -8 -6 -4 -2 0 2 4 6 -- First Comp.--> Figura 5.- Representación de los individuos. Podemos observar cuatro zonas claramente diferenciadas (Amorós, 2006) en el gráfico anterior, en el cual observamos la agrupación de individuos. Cada zona nos indica individuos de características similares con respecto a los caracteres estudiados. 22 La primera zona, situada a la derecha del gráfico, agrupa a trece cepas, diez de las cuales pertenecen a FL. La segunda zona, situada en el gráfico a la izquierda y por debajo del eje X, agrupa a tres cepas, todas ellas de EFV. Este grupo lo denominaremos EFV. La tercera zona, situada en el extremo superior izquierdo del gráfico, contiene únicamente una cepa, que corresponde a HC 2. La cuarta zona, que corresponde a la zona central del gráfico, agrupa a individuos de los cuales no se puede asegurar que posean características determinantes para su diferenciación, por tanto, para poder establecer su identificación tendríamos que realizar medidas de otros caracteres que nos permitan realizar su diferenciación. Estos individuos corresponden a las parcelas de HRS, SO y TGR. La diferenciación entre clones de una misma variedad, incluso cultivada durante mucho tiempo y en zonas alejadas, es siempre difícil y depende con frecuencia de pocas variables. Estas diferencias pueden ser significativas, ya que pueden influir en ellas diversos factores como las labores culturales, el clima y la edad del cultivo, entre otros. En estudios realizados en Castilla y León y La Rioja (Martínez de Toda, 1995 y 2002), se encontraron diferencias entre clones de Tempranillo y clones de Tinta del país y Tinta de Toro, sobre todo, en cuanto a la densidad de pelos en los nervios del envés y a la intensidad de la pigmentación, así como en el tamaño de la hoja, en su perfil y en el tamaño de los dientes. En cuanto a los caracteres ampelográficos más discriminantes de Tempranillo en La Rioja, resultaron ser la vellosidad del pámpano joven, color del haz de la hoja adulta, color de la baya y profundidad de los senos laterales de la hoja. Hay coincidencias con estos resultados en nuestro trabajo, puesto que en Cencibel hemos determinado como algunos de los caracteres más discriminantes la profundidad de los senos laterales de la hoja, la vellosidad del pámpano joven, la forma de los dientes y la pigmentación antociánica tanto de los nervios como de la pulpa. Hemos establecido clones diferentes en las distintas parcelas en las que se ha llevado a cabo el estudio, resultando cuatro grupos de los 28 individuos estudiados. Podemos asegurar que las plantaciones no provienen del mismo clon, excepto en el caso de EFV, que sí corresponde al mismo clon. También podemos asegurar la existencia de otro clon en FL y otro en HC 2. El resto de individuos están agrupados sin que podamos establecer claras diferencias. Para poder determinar las diferencias entre clones de una variedad, los estudios ampelográficos se deben completar con estudios ampelométricos, aunque la forma más eficaz de determinar la variabilidad de un cultivar es la identificación molecular, ya que estas técnicas están en auge y cada vez más mejoradas. 23 4.2.-AMPELOMETRIA (2005-2006): Al conjunto de datos compuesto por 23 variables ampelométricas (reflejados en la Figura 3) y 25 clones se ha aplicado el análisis de componentes principales como técnica multivariante de tratamiento de datos (Júdez, 1989). En el Anejo 2 aparecen las variables definidas con sus unidades, media, desviación típica y coeficiente de variación. 4.2.1.- Estudio de las variables LL*LW: Superficie de la hoja (LL: altura y LW: anchura). Tiene un valor medio de 302,5cm2 y una desviación típica de 82,059. El valor máximo y mínimo es 390,1 y 180,5 respectivamente. Hay que destacar un valor muy superior al máximo de 537,8cm 2, perteneciente a tempranillo-regadío. Según ésta variable, el tamaño de la hoja depende del medio (riego, luz, nutrientes…). LL/LW: Esbeltez de de la hoja. Tiene un valor medio de 1,101 y una desviación típica de 0,054. El valor máximo es de 1,221 y el mínimo de 1,016. P: Longitud del peciolo. Con un valor medio de 9,2cm. Valor máximo de 12,5cm y mínimo de 6,5cm. La desviación típica es de 1,6. N2/N1: Longitud vena secundaria entre longitud vena primaria. El valor medio es de 0,8 y la desviación típica 0,054. Tiene un valor máximo de 0,960 y un mínimo de 0,725. N3/N1: Longitud vena terciaria entre longitud vena primaria. Su valor medio es de 0,589 y la desviación típica de 0,060. El máximo y mínimo es de 0,815 y 0,459 respectivamente. N4/N1: Longitud vena cuaternaria entre longitud vena primaria. Tiene un valor medio de 0,373 y una desviación típica de 0,032. Los valores máximo y mínimo están comprendidos entre 0,299 y 0,425. N5/N1: Longitud vena quinta entre longitud vena primera. Tiene un valor medio de 0,199 y una desviación típica de 0,025. El valor máximo es de 0,254 y el mínimo de 0,138. Sp/N1: Longitud del seno peciolar entre longitud vena primaria. Su valor medio es de 0,375 y la desviación típica de 0,053. Tiene un valor máximo de 0,468 y un mínimo de 0,212. SA/ N1: Anchura del seno peciolar entre longitud vena primaria. Su valor medio es de 0,004 y la desviación típica de 0,011. El valor máximo es 0,051 y el mínimo 0; lo que equivale a seno peciolar completamente cerrado, ya que no hemos considerado valores negativos. Ss/N1: Seno lateral superior entre vena primaria. Tiene un valor medio de 0,355 y una desviación típica de 0,052. El valor máximo es de 0,470 y el mínimo de 0,291. 24 Si/N1: Seno lateral inferior entre vena primaria. Tiene un valor medio de 0,356 y una desviación típica de 0,039. Sus valores máximo y mínimo son de 0,420 y 0,246 respectivamente. α (a): Angulo comprendido entre vena primaria y secundaria. Su valor medio es de 52,8º y la desviación típica de 4,6. El valor máximo y mínimo ésta comprendido entre 61,4º y 40,8º. σ (s): Ángulo desde la vena primaria hasta la terciaria. Tiene un valor medio de 118,4º y una desviación típica de 7,7. El valor máximo es de 131,6º y el mínimo 101,2º. γ (g): Ángulo comprendido entre la vena terciaria y la cuaternaria. Su valor medio es de 54,7º y la desviación típica de 4,6. Tiene un valor máximo de 65,4º y un mínimo de 47º. Σ (S): Suma de ángulos desde la vena primera hasta la vena quinta. Tiene un valor medio de 166,7º y una desviación típica de 9,3. Su valor máximo es de 182,2º y el mínimo de 146,8º. T4: Nº de dientes desde “0” hasta la vena cuaternaria. Tiene un valor medio de 3,552 y una desviación típica de 0,424. Su valor máximo es de 4,6 y el mínimo de 2,6. T3: Nº de dientes comprendido entre la vena cuaternaria (N4) y la terciaria (N3). Su valor medio es de 6,328 y la desviación típica 0,590. El valor máximo es de 7,8 y el mínimo de 5,2. T2: Nº de dientes comprendido entre la vena terciaria y la secundaria. Su valor medio es de 9,912 y la desviación típica 1,238. El máximo valor está en 11,6 y el mínimo en 8. T1: Nº de dientes comprendido entre la vena secundaria y la primaria. Tiene un valor medio de 10,072 y una desviación típica de 1,029. El valor máximo es de 11,800 y el mínimo de 7,200. B2: Base del diente situado al final de la vena secundaria. Este diente está dividido en dos partes por dicha vena. Tiene un valor medio de 1,533cm y una desviación típica de 0,218cm. Su valor máximo es de 1,880cm y el mínimo de 1,040cm. h2/B2: Longitud entre anchura del diente situado al final de la vena secundaria. Tiene un valor medio de 0,674 y una desviación típica de 0,103. Su valor máximo está en 0,844 y el mínimo en 0,478. B4: Base del diente situado al final de la quinta vena, también dicha vena divide al diente en dos partes simétricas. Tiene un valor medio de 1,295cm y una desviación típica de 0,200cm. Sus valores máximo y mínimo son 1,800cm y 0,980cm respectivamente. h4/B4: Longitud del diente situado al final de la quinta vena entre la anchura de dicho diente. Su valor medio es 0,653 y la desviación típica 0,126. Tiene un valor máximo de 1022 y un valor mínimo de 0,4 25 4.2.2. Matriz de correlación En el Anejo 2 podemos observar la correlación simple entre las variables estudiadas. En negrita aparecen las que son significativas y pasamos a comentar a continuación las que consideramos más interesantes: 1.- El tamaño de la hoja (LL*LW) mantiene una correlación alta y positiva (0.769) con el tamaño del peciolo (P) y con la anchura del diente inferior (B4) (0.707) y su esbeltez (h4/B4). Luego las hojas grandes tienen peciolo grande y el diente B4 más grande. 2.- La longitud del nervio 2 (N2/N1) y la del nervio 3 (N3/N1) están correlacionadas (0.600) lo que da una idea de hoja más ensanchada. 3.- La profundidad del seno peciolar (SP/N1) se correlaciona negativamente (-0.654) con su anchura (SA/N1) lo que indica que cuanto más profundo es el seno peciolar, menos ancho es en principio. Consecuentemente los senos profundos y estrechos aparecen correlacionados con ángulos más abiertos entre los nervios Σ (0.500) y sobre todo σ (0.681). 4.- La profundidad del seno lateral inferior (Si/N1) tiene correlaciones negativas con los ángulos entre los nervios σ (-0.507), α (-0.416) y γ (-0.449). 5.- La anchura de las dientes parece mantenerse bastante constante en el contorno de la hoja ya que B2 correlaciona positivamente (0.429) con B4. 4.2.3. Componentes principales De todas las posibles combinaciones de variables en el espacio n-dimensional, las que explican más la variabilidad de todo el conjunto son las dos primeras componentes y por lo tanto el plano definido por ellas será el que mejor nos represente las relaciones entre las variables entre sí y con los individuos. La primera componente representa un 23.44% de la varianza total, estando correlacionada positivamente con el ángulo S y con SP/N1. La correlación es negativa con P, LL*LW y Si/N1. La segunda componente representa sólo el 12.76% de la varianza total estando correlacionada positivamente con B4 y LL*LW. Su correlación es negativa con T2 fundamentalmente. 4.2.4. Análisis de variables De la observación de la Figura 6, donde aparecen representadas las variables por la proyección de los vectores propios sobre las dos primeras componentes principales, podemos obtener las siguientes conclusiones: 1.- La primera componente (eje X), aparece correlacionada positivamente con las variables SP/N1 (profundidad del seno peciolar), ángulos entre los nervios principales de las hojas, Σ sobre todo, aunque también σ, α y γ muestran correlaciones altas y positivas. 26 2.- Correlación negativa con el eje X muestra la variable SA/N1 (Anchura del seno peciolar), S1/N1(Profundidad de senos laterales) y LL/LW (esbeltez de la hoja). 3.- El eje Y tiene mucho menor poder discriminante pero aparecen B 2 y B4 (Anchura del diente) correlacionados negativamente con T2 (número de dientes). Luego en la parte de arriba del gráfico tenderán a aparecer los individuos con hojas de dientes más anchos y menos dentadas; lo contrario hacia abajo. 4.- Las hojas más grandes aparecerán arriba a la izquierda, entorno a la variable LL*LW y a la derecha y abajo aparecerán los individuos con hojas más pequeñas. 1 B4 LL*LW h4/B4 N5/N1 0,5 B2 P N4/N1 Sg a s N3/N1 h2/B2 Ss/N1 T4 Si/N1 LL/LW 0 SP/N1 N2/N1 SA/N1 T1 T3 -0,5 T2 -1 -1 -0,5 0 0,5 1 -- eje F1 (23,44 %) --> Figura 6.- Representación de las variables en el plano formado por las dos primeras componentes principales . 27 4.2.5. Observación de Individuos (clones) De la observación de la Figura 7 de individuos podemos extraer las siguientes conclusiones: 5 4 VI1 3 2 F L2C 3C 3 F L1 VITE F L1 C1 VI2 F L3C 1 VA 3 1 VA 4 VA VA2 1 GA LTEF E V3 F L3C 4 0 -1 TEHU SO1 -2 SO2 VA 5 HC 3 EF V1 EF V2 F L2C 2 HC 2 HR S3 -3 HR S1 -4 -5 -5 -4 -3 -2 -1 0 1 2 3 4 5 -- eje F 1 (23,44 %) --> Figura 7.- Representación de los individuos en el plano definido por las dos primeras componentes. 1.- Los clones de Tempranillo aparecen acumulados en la parte izquierda del gráfico, formando un grupo no muy compacto al que podríamos sumar los clones de Villarrubia VI1 y VI2 (área sombreada). Este grupo se caracterizaría por la anchura del seno peciolar (SA/N 1), poca longitud de dicho seno (SP/N 1), senos inferiores bastante profundos (Si/N 1), ángulos entre los nervios relativamente pequeños (σ, α y γ) y hoja más bien alargada (LL/LW). Además aparecen hacia la parte de abajo los individuos con hojas más dentadas (correlación con la variable T2). 2.- Los 4 clones de Valdepeñas (VA) constituyen un grupo compacto a la derecha del gráfico, con los caracteres diferenciales opuestos al grupo anterior, por lo que podríamos definir este clon como el autóctono más puro de Cencibel en contraposición con los tempranillos estudiados. 3.- Aparecen como clones claramente diferentes HRS (1 y 3) por un lado, SO (1 y 3) por otro y un grupo conjunto formado por HC (2 y 3) y EFV (1 y 2). 4.- Los clones FL de las 3 parcelas constituyen un grupo central bastante compacto y similar entre sí en el que para establecer diferencias habría que hacer estudios más detallados con otras variables para intentar diferenciarlos. 28 4.2.6. Diferencias entre Cencibel y Tempranillo Los caracteres diferenciales de Tempranillo y Cencibel que podemos señalar con el estudio realizado son: 1.- El seno peciolar en Cencibel es más profundo y absolutamente cerrado, en cambio en Tempranillo el seno peciolar es menos profundo y algo abierto en muchas hojas. 2.- El seno lateral inferior es mayor y está mejor perfilado en Tempranillo que en Cencibel. Figura 8.- Hoja típica de Cencibel (VA42) izquierda y de Tempranillo (TEHU3) derecha. 3.- Las hojas de Tempranillo aparecen más alargadas (LL/LW=1.54) que las de Cencibel (LL/LW=1.06), lo que es corroborado por la longitud relativa del nervio N 3/N1 (0.6 en Cencibel y 0.56 en Tempranillo). 4.- Los ángulos entre los nervios son mayores en Cencibel que en Tempranillo. Se repite en todos los ángulos pero baste como ejemplo el que forma N 1 con N3 que es 120.4º en Cencibel y 110.3º en Tempranillo. 5.- Los dientes son comparativamente más anchos y menos apuntados en Cencibel que en Tempranillo. El número de dientes es en general mayor en Cencibel que en Tempranillo. 29 En el Anejo 2 aparecen separados los grupos propuestos de Cencibel y Tempranillo con sus datos en cada variable. 4.2.7. Posibles clones de Cencibel detectados y sus diferencias 1.- Los 4 clones de Valdepeñas (VA) constituyen un grupo compacto a la derecha del gráfico, con los caracteres diferenciales más opuestos al Tempranillo, por lo que podríamos definir este clon como el autóctono más puro de Cencibel. 2.- Aparecen como clones claramente similares HRS (1 y 3) por un lado, SO (1 y 3) por otro, originarios ambos de Carrión de Calatrava y muy valorados cualitativamente por las bodegas. Son poco productivos y muy adaptados a suelos calizos. 3.-El conjunto formado por HC (2 y 3) y EFV (1 y 2) constituyen un grupo originario de Fernancaballero que presentan un aspecto bastante vigoroso y muy buena adaptación a suelos arcillosos. 4.- Los clones FL de las 3 parcelas constituyen un grupo central bastante compacto y similar entre sí que será objeto de ulteriores estudios. En cualquier caso muestra muy buena adaptación a suelos pobres y una notable aptitud enológica. 40 30 20 FL HC EFV FL3C1 FL2C2 FL1C1 FL3C4 FL1C3 FL2C3 10 SO EFV3 EFV1 EFV2 HC2 HC3 SO2 HRS3 HRS1 SO1 1 0 2 3 4 HRS VA3 VA4 VA1 VA2 5 -10 TEHU VI2 VITE VI1 GALTE VA5 TE VA -20 -30 -40 -40 -30 -20 -10 0 -- eje F 1 (82,39 %) --> 10 20 30 40 Figura 9.- Análisis Factorial Discriminante con los 5 grupos de clones. 30 4.2.8. Discusión La diferenciación entre clones de una variedad, incluso cultivada durante mucho tiempo en zonas alejadas, es siempre difícil y depende con frecuencia de unas pocas variables. En estudios realizados en Castilla y León no se encontraron diferencias entre Tempranillo, Tinta del País y Tinta de Toro (Rubio, 2004). Sin embargo, dentro de La Rioja se han puesto de manifiesto diferencias entre Tempranillo Peludo y Tempranillo Lampiño por la densidad de vellosidad en el envés de las hojas y por diferentes aptitudes productivas (Hernández, 1993). Las labores culturales pueden influir en algunos aspectos como el tamaño de la hoja que normalmente es mayor en regadío (Carrión, 2006) como nos ocurre a nosotros: En nuestro caso, las hojas de los clones riojanos de Tempranillo, al estar en regadío, son de mayor tamaño (383.6 cm2 de superficie media) que las de los clones de Cencibel (275.7 cm 2), exceptuando los clones de Villarrubia de los Ojos que provienen de unas condiciones similares al regadío. La aplicación de ampelometría en hoja se ha mostrado útil en la variedad italiana Sangiovese. Utilizando técnicas de ACP similares a las nuestras sobre 24 variables y 24 clones consiguieron establecer diferencias por la profundidad de los senos laterales y la longitud de los dientes (Silvestroni, 1995). Con medidas similares llegaron a determinar 5 perfiles de hoja diferentes utilizando Cluster Análisis. El interés de la diferenciación de clones de Cencibel y Tempranillo en hoja debe ser corroborada con diferencias carpométricas (tamaño y forma del racimo, tamaño y forma de la baya, coloración y distribución del color) (Caló, 1995) y con análisis cualitativos (perfil de antocianos monómeros y flavonoles) y el mantenimiento de esas características a través de los años. Tal como se apuntó en el estudio ampelográfico preliminar (apartado 4.1.) aparecen como clones diferentes los de la parcelas SO y HRS, los de HC y EFV y FL. Habría que añadir el clon (o grupo de clones muy similares) procedente de Valdepeñas VA dejando como posibles Tempranillos los demás, incluida la parcela de Villarrubia de los ojos. Hasta que las técnicas moleculares se muestren eficaces en la diferenciación entre clones de una misma variedad, como ha sucedido en Garnacha de distintos orígenes (Meneghetti, 2006) o en Tanat (Gonzalez-Techera, 2004), tendremos que seguir utilizando métodos de estudio fenotípico para preservar la variabilidad de un cultivar tan importante en La Mancha. 4.3. RESULTADOS AMPELOMETRIA 2007-2008: 4.3.1. Ampelometría en colección: Como hemos comentado anteriormente, en 2005 se inició una colección de clones de Cencibel en maceta con el fin de tener más a mano y en condiciones más controladas los clones estudiados y algunos más proporcionados por el IVICAM. 31 Figura 10.- Colección en maceta ubicada en la Finca Galiana. Las condiciones de la colección (riego por goteo, sustrato rico en nutrientes, sombreo parcial con malla, etc…) pensamos que pueden alterar los caracteres ampelométricos por lo que planteamos el estudio comparativo de los clones en la colección con los del campo. Los resultados generales del estudio aparecen en el Anejo 3. En la figura 11 se muestra el ACP conjunto de los clones en maceta y en campo en 2007. Una vez realizado el análisis de variables (datos no mostrados), podemos ver a la derecha las plantas con mayor desarrollo foliar (altos valores de n2, n3 y n4) que corresponden a las macetas con clones HC y HRS plantadas en 2005. A la izquierda aparecen las plantas en maceta de sólo un año (plantadas en 2005) por lo que no han adquirido su desarrollo normal. En la parte intermedia y hacia arriba están las plantas en campo 2007 con los ángulos a1, a2, y a3 más abiertos que el resto ya que se recogieron aproximadamente un mes más tarde. Respecto a la ampelometría en colección respecto a la de campo, podemos afirmar que por ahora depende mucho del año de plantación de la maceta ya que en el primer año muestran un desarrollo muy débil. Ya en el segundo año de plantación muestran desarrollo satisfactorio y en general el tamaño de la hoja es mayor que en campo, tal como cabía esperar (Carrión, 2006) por estar en riego y con sombreo parcial. 32 Observaciones (ejes F1 y F2: 80,57 %) 5 4 3 X_HC-1 X_SO-4 2 X_HC -2 X_HC-3 X_F L3-C4 X_HR S-2 X_F L3-C3 X_TR G X_F L2-C 2 1 X_HR S-1 X_F L3-C1 HR S-2 0 SO-4 HR S-1 X_F L2-C1 HC-3 HC -2 -1 F L2-C2 F L3-C1 HC-1 F L3-C3 TR G F L3-C4 FL2-C1 -2 F L2-C 4 X_F L2-C4 -3 -4 -5 -5 -4 -3 -2 -1 0 1 2 3 4 5 -- eje F 1 (59,55 %) --> Figura 11.- Análisis Componentes Principales 2007 conjunto campo y colección. 4.3.2. Comparación ampelométrica 2005-2007: El mantenimiento en el tiempo de los caracteres ampelométricos es condición necesaria para validar el estudio de diferenciación de clones. No tiene sentido trabajar sobre variables que cambian según el año. Por ello planteamos la comparación de los caracteres ampelométricos los años 2006 (descritos en el apartado. 4.2.) con nuevas medidas realizadas en 2007. Aplicamos la misma metodología descrita salvo el método de medición (con programa informático de tratamiento de imágenes y medida automática en lugar de medidas manuales). Los resultados de partida aparecen en el Anejo 4. Eliminamos algunas variables de 2005 ya que en 2007 sólo tomamos medidas estrictamente de longitudes y ángulos. Se realizaron ACP por separado y conjuntos con los siguientes resultados: Los resultados 2006 cambian algo de aspecto en el ACP al eliminar algunas variables pero se mantienen los grupos apuntados en el apartado anterior (4.2.5.). Los resultados 2007 mantienen sustancialmente los grupos de 2005 (Figura 12), salvo que los clones de Tempranillo aparecen algo más mezclados con el resto. Sin embargo, aparecen claramente separados en el AFD aplicado, manteniendo los grupos similares a los obtenidos con todas las variables (ver figuras 15 y 16). 33 Observaciones (ejes F1 y F2: 66,64 %) 8 6 HC2 4 TEHU-1 2 HC3 EFV3 VA-3 VA-1 F L1C1 VA-4 SO4 FL1C3 VA-2 TVR HC4 0 -2 F L1C4 SO3 SO2 HRS2 HC1 TEGAL R-1 TEGAL1 EF V1 FL3C4 EFV2 FL2C2 FL2C1 HRS4 HRS1 FL3C3 HRS3 F L2C3 F L2C4 FL3C1 -4 -6 -8 -8 -6 -4 -2 0 2 4 6 8 -- eje F1 (45,48 %) --> Figura 12.- Análisis de Componentes Principales 2007. Al practicar el ACP conjunto a los dos años de estudio nos encontramos con la sorprendente Figura 13 en la que podemos advertir la clara separación entre 2006 (notación eXXX) con los mismos clones 2007 (notación XXX). La imagen es casi simétrica respecto al eje vertical del gráfico. La consecuencia inmediata de dicha figura es que existe un fuerte efecto debido al año que nos impediría mantener los caracteres ampelométricos de un año a otro. En cualquier caso, no parece razonable que la diferencia de un año a otro de algo tan fundamental como la forma y tamaño de la hoja sea tan grande. Por ello hemos reflexionado sobre cuál podría ser el problema de esa separación y para ello recurrimos al gráfico de las variables y su relación con las componentes principales. 34 Observaciones (ejes F1 y F2: 59,11 %) 5 e_EF V1 4 3 EF V1 F L2C3 e_VA 4 2 e_EF V3 F L3C1 1 F L2CF2L3C4 HRS3 HRS1 EFV2 0 e_F L1e_VA C1 3 HC 3 F L1C1EFV3 VA F L1-1 C3 TEHU-1 VA-4 SO2 VA -3 -2 e_HC 3 e_HRS3 e_FL3C 1 e_FL1C3 e_FL2C 3 e_F e_FL2C2 L3C4 e_TEHUe_HC2 e_EF V2 e_HRS1 e_SO2 VA -2 HC 2 -1 e_VA 1 2 -3 -4 -5 -5 -4 -3 -2 -1 0 1 2 3 4 5 -- eje F 1 (38,14 %) --> Figura 13.- Análisis de Componentes Principales conjunto 2005 y 2007. En un principio nos sorprendimos por la diferencia que aparentemente nos marcaba una diferencia sustancial entre los dos años y buscamos las razones en el gráfico de las variables (Figura 14) viendo que la separación entre los dos años era debida al tamaño de los ángulos entre los nervios principales a1, a2 y a3 y al tamaño del seno peciolar (SA/N1) y del peciolo (P/N1). Variables (ejes F1 y F2: 59,11 %) 1 N3/N1 N2/N1 0,5 N5/N1 SP /N1 N4/N1 a1 N1 a3 0 a2 SA /N1 P /N1 -0,5 -1 -1 -0,5 0 0,5 1 -- eje F 1 (38,14 %) --> Figura 14.- Relación de las variables con los ejes en el análisis conjunto 2005 y 2007. 35 La sistemática de recogida de las hojas fue idéntica en 2006 y 2007 salvo en la fecha que fue algo más tardía en 2007 ya que climatológicamente el año fue más tardío (temperaturas más bajas) que 2006. Resulta trascendental por lo tanto tomar la muestra de hoja en idéntico estado fenológico todos los años que se vaya a medir sobre todo para los caracteres de ángulos entre los nervios principales, que se van abriendo, y apertura del seno peciolar, que se va cerrando. Al ser 2007 un año más lluvioso que 2006 hemos comprobado que las hojas han experimentado un significativo incremento de tamaño que es perfectamente eliminado al tomar medidas siempre relativas a N1. Para confirmar la validez del análisis ampelométrico hemos sometido los datos de 2006, los de 2007 y los conjuntos a Análisis Factorial Discriminante (AFD). Suponiendo la partición previa del conjunto de observaciones en los grupos de clones obtenidos en el apartado 4.1.: Grupo HC y EFV (2), grupo FL (1), grupo HRS, SO y TE (4) y grupo VA (3). TE constituye un solo grupo (5) en el AFD conjunto. Los resultados obtenidos de pueden ver en las figuras 15, 16 y 17. Observaciones (ejes F1 y F2: 93,47 %) 5 e_VA 1 2 4 e_VA 4 3 2 e_VA3 e_FL1 C1 1 e_HRS3 e_FL3C4 e_FL1 C3 e_FL2C3 1 2 0 e_FL3C1 -1 e_SO2 e_FL2C2 e_TEHU e_HRS1 e_EFV2 -2 3 4 e_HC3 -3 e_HC2 e_EFV1 e_EFV3 -4 -5 -5 -4 -3 -2 -1 0 1 2 3 4 5 -- eje F1 (49,47 %) --> Figura 15.-AFD 2006: Sólo un individuo aparece mal clasificado a posteriori, con lo que el error aparente de la matriz de confusión es sólo del 5.26%. 36 Observaciones (ejes F1 y F2: 89,63 %) 6 4 EFV2 HC2 EFV1 2 EFV3 HC3 0 1 HRS1 TEHU-1 FFL2C2 L2C3 FL1C1 2 3 VA -2 -2 VA-1 VA-4 F L3C4 F L3C1 FL1C3 SO2 4 HRS3 VA-3 -4 -6 -6 -4 -2 0 2 4 6 -- eje F1 (65,07 %) --> Figura 16.-AFD 2007: Sucede de manera similar que en 2005 ya que sólo un individuo aparece mal clasificado en grupo distinto al grupo supuesto “a priori”. Observaciones (ejes F1 y F2: 84,97 %) 4 TEHU-1 3 EFV3 e_HC 2 HC2 e_TEHU EF C V1 e_VA 4 e_FL1 1 e_F L3C 1 FL1CF1L2C 2FL3C4 e_EFV3 e_EF e_FV1 L1C3 e_F L2C 3 HC 3 FL2C 3 e_SO2 e_FL2C2 FL1C3 e_EFV2 EFV2 -2 3 VAVA -3 e_HC VA -1 e_HRS3 e_F L3C4 e_VA 3 FL3C1 HR S1 HR S3 VA -4 SO2 e_VA 1 2 2 1 0 -1 -2 1 2 3 4 5 e_HRS1 -3 -4 -4 -3 -2 -1 0 1 2 3 4 -- eje F 1 (55,34 %) --> Figura 17.-AFD CONJUNTO. A pesar del problema de distinto desarrollo foliar en los años 2005 y 2007, con el consiguiente aumento de tamaño de la hoja, el resultado de adscripción a grupos es muy bueno salvo en el caso EFV+HC que han sufrido alguna alteración que a nosotros se nos escapa. 37 Los resultados son satisfactorios en cuanto a clasificación: En los AFD separados 2006 y 2007 sólo 1 individuo aparece mal clasificado. En el análisis conjunto 2006 y 2007 los resultados son menos ajustados: La tasa de error aparente de la matriz de confusión (Tabla 4) es de 21.05% que se concentra sobre todo en el grupo 2 antes apuntado con un 50% de errores de clasificación. El resto de grupos aparece razonablemente bien clasificado. a1 a2 a3 a4 a5 Suma 9 2 1 0 0 12 23,68% 5,26% 2,63% 0,00% 0,00% 31,58% de 2 2 5 2 0 1 10 5,26% 13,16% 5,26% 0,00% 2,63% 26,32% de 3 0 0 8 0 0 8 0,00% 0,00% 21,05% 0,00% 0,00% 21,05% de 4 0 0 0 6 0 6 0,00% 0,00% 0,00% 15,79% 0,00% 15,79% de 5 0 0 0 0 2 2 0,00% 0,00% 0,00% 0,00% 5,26% 5,26% Suma 11 7 11 6 3 38 28,95% 18,42% 28,95% 15,79% 7,89% 100,00% Tabla 4.-Tasa de error aparente (tasa de resustitución en los datos de aprendizaje): 21,05 % de 1 5. CONCLUSIONES: 1.- Los estudios ampelográficos y ampelométricos se han mostrado útiles para diferenciación de clones de Cencibel en plantaciones de la Mancha occidental. 2.- Hemos diferenciado los clones autóctonos de los Tempranillos más utilizados en los planes de reestructuración procedentes de La Rioja. 3.- Los clones identificados constituyen al menos 4 grupos: El más diferenciado procede de Valdepeñas (VA) y es utilizado en la actualidad para la obtención de vinos ecológicos de calidad. El grupo SO y HRS tiene unas características enológicas muy apreciadas por las bodegas de la zona. El grupo FL presenta muy buena adaptación a terrenos calizos y pobres. Por fin el grupo HC y EFV presenta más vigor y producción y mejor adaptación a suelos arcillosos. Corolario: La mayor parte de los pequeños viticultores castellano-manchegos han optado por reestructurar con Tempranillo como opción más conservadora. De todos es conocido que se ha producido en los últimos años una bajada en el precio de las uvas tintas y, algo que hasta hace poco era inconcebible en nuestra zona, la destilación de algunos vinos tintos. Las causas de la situación pueden ser entre otras: 38 • Sobreoferta de tintos cuando nuestras estructuras comerciales estaban preparadas para comercializar blancos. • La calidad de los tintos ofertados ha sido mediocre por proceder de plantaciones jóvenes, no tener sistemas de elaboración adecuados y buscar altos rendimientos para intentar recuperar la inversión en las nuevas plantaciones. Hemos empezado a valorar, probablemente porque ya casi no quedan, nuestras viejas plantaciones de Cencibel, de Garnacha, de Moravia, incluso las de Bobal. Por cierto...¿debemos renunciar a un patrimonio tan suculento como nuestra variedad Cencibel?: No cabe duda de que La Rioja ha prestigiado su Tempranillo a nivel nacional e internacional pero no debemos olvidar el antiguo origen de nuestro “cultivar Cencibel” que, si bien muy semejante, probablemente tiene adaptaciones específicas a la zona Valdepeñas y La Mancha después de varios siglos de cultivo. Tampoco debemos renunciar por completo a nuestros sistemas tradicionales de conducción en vaso que han contrastado su calidad y adaptación a las condiciones difíciles de nuestro medio. Por lo tanto es interesante que, a la vista de una situación tan cambiante y efervescente, no apostemos todo nuestro futuro a una sola carta. Un solo modelo de reestructuración, por muy contrastado que esté, puede llevarnos a un gran fracaso. Recuperar con inteligencia nuestro patrimonio puede ser la mejor apuesta por el futuro. Ciudad Real, Marzo 2008. 39 6. REFERENCIAS: Amorós. J.A. 1990. “Variedades y Clones, Alternativas para una Viticultura Moderna”. S.E.V.I. 2314. Pgs. 5733-5741. Amorós, J.A. 2006. “Deriva varietal: consecuencias Mancha”.Semana Vitivinícola 3109. 11/03/2006. Pgs.726-730. en Castilla- La Amorós, J.A., Bravo, S., Márquez, E. 2006.”Ampelographic Differentiation Between Vitis Vinífera L. Clones cv. Cencibel in West La Mancha” IX ESA Congress 2006 Varsovia Polonia. ISSN: 0860-4088. pgs. 757-758. Bandinelli, R., Pisani, P., Ferrini, F y Mattii, G. 1995. « Clonal Selection Carried Out on Sangiovese in Tuscany ». Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2.Pgs.114-117. Bariellere, J.M. y col. 1995. “Clonal selection in Champagne” Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 09630711-2-2. pgs.33-39. Boidron, R. 1995. “Clonal selection in France. Methods, organization and use”. Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2.Pgs. 1-7. Calò, A., Costacurta, a., Paludetti, G., Crespan, M., Giust, M., Borsa, D., y Di Stefano, R.1995. “Characterization of biotypes of Sangiovese as a basis for clonal selection”. Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2. Pgs. 99-104. Campostrini, F., De Micheli, L., Bogoni, M. y Scienza, A. 1995. “Study of Genetic Variabiliity of Sangiovese Ecotypes as a Tool for new Strategies in Clonal Selection”. Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2.Pgs. 105-110. Carrión, M.E., Cutanda, M.C., Botella, O., Montero, F.J. 2006. “Influencia del Sistema de cultivo en la morfología de los órganos de Vitis Vinífera L.”. Actas XXIX Congreso Mundial de la Viña y el Vino. Logroño 25-30 junio 2006. NIPO: 251-06-0275. Chome, P. y col., 2003. “Variedades de vid. Registro de variedades comerciales”. M.A.P.A., ISBN: 84-491-0559-5. 303 págs. Duque, C., Yañez, F., Montero, F.J. 2003. “Selección clonal vitícola en CastillaLa Mancha”. Servicio de Publicaciones U.C.L.M. Ciencia y Técnica nº 42. I.S.B.N.: 84-8427-242-8. 95 págs. González-Techera, A., Jubany, S., Ponce de León, I., Boido, L., Dellacassa, E., Carrau, F., Hinrichsen, P. y Gaggero, C. 2004. “Molecular diversity within clones of cv. Tannat (Vitis vinifera)”. Vitis 43 (4), 179-185. 40 Hernández, M. 1993. “Diferencias entre Tempranillo peludo y lampiño en La Rioja”. La Semana Vitivinícola, nº 2427 (1993). Hidalgo, L. 1999. “Tratado de Viticultura General”. Ed. Mundiprensa. Madrid. I.S.B.N.: 84-7114-802-1. 1171 pgs. Júdez, L. 1989. “ Técnicas de Análisis de Datos Multidimensionales“. M.A.P.A. Madrid. I.S.B.N. : 84-7479-768-3. 301pgs. Júdez, L. Y col. 1995. “Une procédure statistique pour orienter les premères étapes de sélection clonale de la variéte Tinta del pais” Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2. Martínez de Toda, F. et al, 2002. “Caracterización de biotipos de la variedad de vid Tempranillo en La Rioja”. p. 39-41. Mannini, F. 1995 “Grapevine Clonal Selection in Piedmont (Northwest Italy): Focus on Nebbiolo and Barbera”. Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2.Pgs. 20-32.. Martins, A. Y col. 2004. “Primeiros resultados da Quatificaçao de variabilidade genética e da selecçao da casta Aragoés a escala das regioes de Rioja, Valdepeñas, Douro e Alentejo” Actas de Congreso de Vitivinicultura del Alentejo. Evora 2004. pgs. 1-6. Meneghetti, S., Costacurta, A., Caló, A., Sotés, V., Gianetto, S. y Crespan, M. 2006. “ Studio Della variabilitá Della Garnacha Tinta difusa in Italia, Spagna e Francia”. Actas XXIX Congreso Mundial de la Viña y el Vino. Logroño 25-30 junio 2006. NIPO: 251-06-027-5. Paoletti, A. 1995. “Sangiovese in Tuscany”. Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2.Pgs.6069. Rubio, J.A. and Yuste, J. 2004. “Ampelographic Differentiation of Tempranillo Clones from Different Area of Origin, According to Their Synonyms”. Acta Hort. 652, ISHS 2004.Pgs. 73-79. Sánchez, E., 2001. “El gran libro de los vinos de Castilla-La Mancha”. Antonio Pareja Ediciones. I.S.B.N.: 84-95453-15-0. 283 págs. Silvestioni, O. y Interini, I. 1995. “Ampelometric assessment of clonal variability in the Sangiovese winegrape cultivar”. Proceedings of the International Symposium on Clonal Selection. Porland, Oregon USA. ISBN: 0-9630711-2-2.Pgs. 137-142. 41