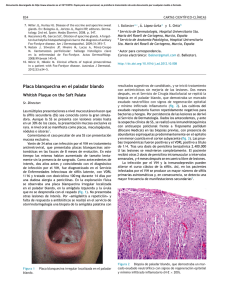
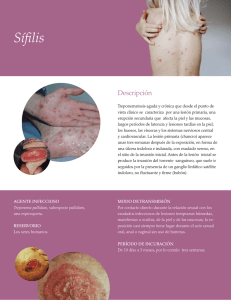
Ver/Abrir
Anuncio

Departamento de Microbiología y Virología Facultad de Biología Universidad de La Habana Trabajo de Diploma En opción al título de Licenciado en Microbiología y Virología Diagnóstico molecular, subtipaje y detección de resistencia a macrólidos de Treponema pallidum en Cuba Nelvis Matos Salazar Instituto de Medicina Tropical “Pedro Kourí” La Habana, 2015 Departamento de Microbiología y Virología Facultad de Biología Universidad de La Habana Trabajo de Diploma Diagnóstico molecular, subtipaje y detección de resistencia a macrólidos de Treponema pallidum en Cuba Autor: Nelvis Matos Salazar Tutores: Lic. Islay Rodríguez González, Dr C Lic. Angel A. Noda Ramos, Ms C La Habana, 2015 Al único que es digno de recibir toda la gloria y la honra: JHA Jiréh…….. Resumen Treponema pallidum subespecie pallidum (T. pallidum) es el agente causal de la sífilis, una infección reemergente de transmisión sexual de gran importancia para la salud pública y considerada por tanto de declaración obligatoria. Desde el año 2010 ha existido un notable aumento en el número de casos de la infección con sífilis notificados en La Habana, Cuba, en la mayoría de los casos en pacientes coinfectados con VIH y ocurriendo en hombres que tienen sexo con hombres. Para la detección molecular de T. pallidum se utilizó una PCR convencional que amplifica el gen polA de T. pallidum según Liu et al.(Liu et al., 2001) a partir de lesiones en piel sugerentes a sífilis, procesándose un total de 144 muestras clínicas de diferentes sitios anatómicos correspondiéndose a 107 pacientes entre junio del 2012 y abril del 2015. De estas muestras el 26,4% resultó ser positivo para la detección de este gen correspondientes a 31 pacientes, los resultados fueron comparados con las pruebas serológicas treponémicas y no treponémicas. A los 31 pacientes diagnosticados con sífilis mediante la PCR se les realizaron estudios de subtipificación molecular y de detección de mutaciones puntuales que le confieren resistencia a los macrólidos el tratamiento alternativo en pacientes alérgicos a la penicilina. Las cepas de T. pallidum fueron genotipificadas a partir de métodos de tipificación molecular analizando el número de repeticiones de 60-pb en el gen de repeticiones proteicas acídicas (arp) y los polimorfismos en el gen de las repeticiones de T. pallidum (tpr). La detección de los puntos de mutación A2058G y A2059G en el ARNr 23S de T. pallidum fue realizado con el uso de enzimas de restricción MboII y BsaI respectivamente. De los 31 pacientes diagnosticados con sífilis mediante PCR el 54,8% presentó la mutación A2058G y no hubo ningún caso con presencia de la mutación A2059G. De estos pacientes con la mutación A2058G el 64,5% correspondió a pacientes co-infectados con VIH. De las 31 muestras tipiadas se identificaron 8 subtipos de T. pallidum. El subtipo 14f (21,4%) fue el más común en los aislamientos seguido de los subtipos 14d (17,8%), 12f (14,3%) y 10f (14,3%). No se encontró ninguna relación entre la identificación de un subtipo y la presencia de ambos puntos de mutación que le confiere resistencia a los macrólidos, aunque se observó que los subtipos 14f y 14d se encontraron en pacientes coinfectados con VIH. Por primera vez se informa en Cuba la existencia de la mutación A2058G asociada a fallas en el tratamiento con los macrólidos y la circulación de estos subtipos, informándose por vez primera para América Latina y el Caribe, los subtipos 7f (10,7%) y 17d (3,6%). Relación de tablas: Tabla Encabezado de la tabla Página Tabla 1 Secuencias de los cebadores utilizados para la PCR que amplifica un 27 fragmento del gen de la β-globina humana Tabla 2 Secuencias de los cebadores utilizados para la PCR que amplifica un 28 fragmento del gen polA de T. pallidum Tabla 3 Secuencias de los cebadores utilizados para la subtipificación molecular de 29 T. pallidum Tabla 4 Determinación del subtipo de T. pallidum de acuerdo al número de 31 repeticiones en el gen arp estimado según la talla de los amplicones Tabla 5 Subtipos de T. pallidum atendiendo a las tallas de los fragmentos obtenidos 33 por PCR-RFLP del gen tpr (TruI esquisómero de MseI) Tabla 6 Secuencia de los cebadores para la PCR de resistencia que amplifica un fragmento de 629 pb : 34 Relación de figuras: Figura Pie de figura Página Figura 1 Lesión cutánea de sífilis primaria: A) chancro genital 6 en el hombre, B) chancro genital en la mujer C) chancro extragenital. Lesión cutánea de sífilis secundaria: D) exantema diseminado o erupción granulomatosa. Figura 2 Comportamiento de la sífilis venérea en Cuba (2000- 24 2015) Figura 3 Representación esquemática de patrones de 32 restricción obtenidos por RFLP con la enzima MseI del gen tpr de T. pallidum Figura 4 Electroforesis submarina en gel de agarosa al 2% de 39 los productos amplificados por PCR convencional del gen polA de T. pallidum. Líneas 1 y 11: patrones de peso molecular escalera 100 pb; línea 2: control positivo (ADN de cepa de referencia Nichols), línea 10: control negativo (agua ultrapura estéril); líneas 3 al 9: resultados de la amplificación a partir de los extractos de ADN de las muestras en estudio Figura 5 Electroforesis submarina en gel de agarosa al 1,5% 47 de amplicones obtenidos por amplificación del gen arp. Línea 1: patrón de peso molecular (1kb); línea 2: muestra clínica correspondiente al subtipo 7; línea 3: muestra clínica correspondiente al subtipo 12; línea 5: muestra clínica correspondiente al subtipo 17; línea 5: muestra clínica correspondiente al subtipo 14; línea 7: control positivo (ADN de la cepa de referencia Nichols (subtipo 14). Figura 6 Electroforesis submarina en gel de agarosa al 2% de 49 los patrones obtenidos de PCR-RFLP con la enzima MseI del gen tpr. Línea 1: Patrón de peso molecular (escalera de 1kb); línea 2: muestra clínica correspondiente al subtipo a; línea 3: muestra clínica correspondiente al subtipo d; líneas 4 y 5: muestras clínicas correspondientes al subtipo f, línea 6: control positivo (ADN de cepa de referencia Nichols) correspondiente al subtipo a Figura 7 Prevalencia de los subtipos de T. pallidum 51 encontrados en el estudio entre junio/2012 y abril/2015 Figura 8 Distribución de los subtipos encontrados en el estudio 52 en comparación a lo informado en la literatura internecional (2000-2015) Figura 9 Electroforesis submarina en gel de agarosa al 1% de 57 la digestión enzimática con MboII de los productos amplificados por PCR para la detección de la mutación A2058G. Línea 1: patrón de peso molecular (100 pb); línea 2: ADN de cepa de referencia Nichols (sensible a los macrólidos); líneas 3 y 4: muestras clínicas sin la mutación A2058G; líneas 5, 6,7 y 8: muestras clínicas con la mutación A2058G Figura 10 Frecuencia de subtipos de T. pallidum resistentes a macrolidos en las muestras en estudio 63 Glosario: Análisis de restricción: La obtención del ADN, la digestión con enzimas de restricción, su posterior análisis por medio de la electroforesis sobre gel de agarosa, suministra información genética valiosa para la identificación de los microorganismos. Esta información conocida como "fingerprinting" (huella dactilar) es un patrón que identifica al microorganismo. Enfermedad re-emergente: Enfermedades que resurgen después de haber logrado un control que proporciono una considerable declinación de sus incidencias en la mayoría de los países y que en estos momentos aumentan significativamente. Enzimas de restricción: Enzimas que reconocen secuencias (específicas para las del tipo II) en el ADN bicatenario (generalmente palíndromes), las cuales cortan y separan el ADN de acuerdo a la cantidad de cortes que producen en el mismo. Por tanto un ADN puede definirse con respecto a una enzima particular de acuerdo al número y la talla de los fragmentos que esta produce. Epidemiología molecular: La epidemiología molecular está basada en la epidemiología clásica general y utiliza a la Biología Molecular para definir la distribución de la enfermedad y de sus determinantes etiológicos dentro de las familias y a través de las poblaciones. La epidemiología molecular en el diagnóstico de enfermedades infecciosas permite establecer patrones epidemiológicos más precisos que complementen o substituyan los métodos tradicionales. Infección: Proceso mediante el cual un microorganismo es capaz de atravesar las barreras de defensa de un individuo y multiplicarse en sus tejidos, pudiendo o no provocarle daño. Presencia, sobrevivencia y multiplicación de microorganismos en tejidos vivos humanos, animales o vegetales. Un tipo particular es la colonización. Linfocito: Uno de los tipos de glóbulos blancos de los vertebrados. Son de pequeño tamaño y de forma esférica, con citoplasma relativamente escaso. Es no fagocítico y su síntesis ocurre en el tejido linfoide, constituyendo del 20 al 25% de los glóbulos blancos en el hombre. PCR: Método in vitro para sintetizar de manera enzimática secuencias específicas de ADN. La reacción utiliza dos oligonucleótidos (entre 15 y 40 pb) como cebadores que hibridizan en extremos opuestos de la secuencia que se quiere amplificar. La elongación de estos cebadores es catalizado por una ADN Polimerasa termoestable (Ej. Taq polimerasa). Una serie repetida de ciclos que involucra, la desnaturalización del molde, la hibridización de los cebadores y la elongación de los cebadores por la polimerasa, resulta en la acumulación exponencial del fragmento de ADN a amplificar. La especificidad de la reacción está dada por la secuencia de los oligonucleótidos cebadores y en esto radica el éxito y la gran utilidad de esta técnica. Plásmidos: Son los vectores más utilizados para la clonación de sondas, ya que son fácilmente manipulables y su multiplicación en Escherichia coli es altamente productiva. Permite la clonación de fragmentos entre 0.1 y 5 Kb. En ocasiones su eficiencia es baja. Prevalencia: Número de casos de una enfermedad dada, registrado en un tiempo concreto y expresado como una proporción de la población en estudio. Pruebas serológicas: Constituyen pruebas de diagnóstico basadas en la reacción antígeno-anticuerpo. RFLP (Polimorfismos de Longitud de Fragmentos de Restricción): Secuencias específicas de nucleótidos en el ADN que son reconocidas y cortadas por las enzimas de restricción (también llamadas endonucleasas de restricción) y que varían entre individuos. En un cromosoma humano, una enzima de restricción puede producir un gran número de cortes en los lugares donde reconozca la secuencia específica para hacerlo. Las secuencias de restricción presentan usualmente patrones de distancia, longitud y disposición diferentes en el ADN de diferentes individuos de una población, por lo que se dice que la población es polimórfica para estos fragmentos de restricción. Los RFLP son marcadores genéticos del ADN y se pueden encontrar en regiones que codifican proteínas o exones, en los intrones o en el ADN que separa un gen de otro. Lo único que se necesita para que puedan ser marcadores genéticos es que sean polimórficos teniendo más de un alelo. Serodiagnóstico: Procedimiento de diagnóstico en el cual se usa suero sanguíneo como medio de reacción. Temperatura de hibridación (anneling): Temperatura a partir de la cual los oligonucleótidos se unen a sus secuencias específicas por complementación de bases, la polimerasa se une al ADN y usando el oligonucleótido como cebador comienza a polimerizar, oscila fundamentalmente entre 45ºC y 60 ºC. Microlesiones: Mutaciones puntuales que involucran un pequeño número de bases en una secuencia de nucleótidos. Mutación: Cualquier cambio o alteración en la información genética del material hereditario que se trasmita a la descendencia. Constituye un cambio estable en la información genética que se va a perpetuar a través de la descendencia. Cualquier variación que no llegue a estabilizarse en la molécula del DNA no constituye una mutación. Estas alteraciones son eventos raros, de baja frecuencia y que generalmente se producen al “azar”. Mutación puntual: Cambio de un solo nucleótido en el ADN, especialmente en una región del ADN que codifica proteína. Índice Contenido Páginas I. Introducción 1 II. Revisión Bibliográfica 5 II.1 Características generales de la sífilis 5 II.1.1 Patogénesis de la enfermedad 7 II.2 Agente causal y características generales 9 II.2.1 Taxonomía 10 II.2.1.2 Características genómicas 11 II.3 Diagnóstico 11 II.3.1 Diagnóstico indirecto 12 II.3.1.1 Pruebas no treponémicas 12 II.3.1.2 Pruebas treponémicas 13 II.3.2 Diagnóstico directo 14 II.4 Tratamiento y resistencia a macrólidos 18 II.4.1 Mecanismos de acción de los macrólidos 19 II.4.1.1 Resistencia microbiana a los macrólidos III. 20 II.4.2 Identificación de subtipos de T. pallidum 21 II.5 Situación actual de la sífilis 22 Materiales y Métodos 25 III.1 Diseño del estudio 25 III.1.1 Recolección de la información 25 III.2 Toma y procesamiento de las muestras 25 III.3 Detección molecular de T. pallidum subespecie pallidum 26 III.3.1 Extracción de ADN 26 III.3.2 Evaluación de la ausencia de inhibidores 27 III.3.3 PCR para T. pallidum subespecie pallidum III.4Subtipaje molecular de T. pallidum subespecie pallidum III.4.1 Determinación del número de repeticiones del gen arp III.4.2 Análisis por PCR-RFLP de los genes tpr 28 29 30 31 III.4.2.1 Análisis de los patrones de restricción obtenidos para el gen tpr 32 III.5Determinación de la resistencia de T. pallidum subespecie pallidum a macrólidos 33 III.6 Diagnóstico serológico de sífilis 35 III.7 Análisis estadístico 35 III.8 Consideraciones éticas de la investigación 35 IV. Resultados y Discusión 37 V. Conclusiones 66 VI. Recomendaciones 67 I. Introducción La sífilis es una Infección de Transmisión Sexual (ITS), causada por Treponema pallidum subespecie pallidum (T. pallidum) (García et al., 2011). Es considerada una enfermedad reemergente debido al incremento en los índices de incidencia de la misma a nivel mundial, afectando tanto a países desarrollados como subdesarrollados (Gayet-Ageron et al., 2015). La sífilis se caracteriza por cuatro etapas clínicas bien definidas, conocidas como sífilis primaria, secundaria, latente y terciaria; cada una con manifestaciones clínicas variadas (Cabie et al., 2010) y con ubicaciones anatómicas específicas (Azzato et al., 2012). La Organización Mundial de la Salud ha informado que la cuarta parte de todos los casos que anualmente se informan de la infección con sífilis, ocurren en América Latina y el Caribe, con una mayor incidencia en pacientes coinfectados con el Virus de Inmunodeficiencia Humana (VIH) y en hombres que tienen sexo con hombres (HSH) (Cruz et al., 2010). En Cuba la sífilis es una Enfermedad de Declaración Obligatoria y de acuerdo a estudios diversos, se informa mayor incidencia de esta infección en la población joven sexualmente activa, que oscila entre los 15-45 años de edad, existiendo un aumento de 1,9% de los casos diagnosticados para el año 2010, con un aumento significativo al cierre del 2014 con una tasa de incidencia de 36,2/100 000 habitantes (MINSAP, 2013; IPK 2014). El diagnóstico de la sífilis se realiza teniendo en cuenta los criterios clínicos, epidemiológicos y de laboratorio. Entre las muestras a utilizar se encuentran la linfa de las lesiones primarias y secundarias, el líquido cefalorraquídeo (LCR), el suero, las biopsias de las lesiones y el líquido amniótico. También se utiliza la sangre periférica, los granulocitos purificados y la eyaculación de los pacientes con sífilis (Damasceno et al., 2011). Las pruebas que se realizan en el diagnóstico de laboratorio, se clasifican en pruebas directas e indirectas. Dentro del diagnóstico indirecto o el serodiagnóstico se utilizan dos tipos principales de pruebas serológicas: las no treponémicas o inespecíficas (VDRL/RPR) para la detección de anticuerpos no específicos o “reagínicos”, que reaccionan con antígenos no treponémicos y las treponémicas o específicas (TPHA) que utilizan un antígeno treponémico para la detección de anticuerpos treponémicos; diferenciándose en los antígenos utilizados y en el tipo de anticuerpo a determinar (Gayet-Ageron et al., 2013). El diagnóstico directo se realiza por examen directo en campo oscuro constituyendo el único método inmediato y específico para el diagnóstico de la sífilis a partir de la identificación positiva de T. pallidum, mediante el uso de lesiones procedentes de un individuo infectado (Vulcano et al., 2011). Uno de los problemas que enfrenta el diagnóstico de laboratorio es la falta de sensibilidad y especificidad en el periodo pre-serológico de la sífilis primaria, ya que al no existir una respuesta inmunológica del hospedero, no existe una detección temprana de anticuerpos por las pruebas serológicas no treponémicas y treponémicas en un periodo de dos a cuatros semanas, siendo en este periodo el diagnóstico inespecífico y poco concluyente; sin embargo el examen directo de campo oscuro es no recomendable, ya que de acuerdo al sitio anatómico no es posible diferenciar entre treponemas patógenos y no patógenos. Debido a estos problemas que enfrenta el diagnóstico de laboratorio de la sífilis se ha propuesto recientemente en algunos países la utilización de técnicas de biología molecular como diagnóstico confirmatorio de la sífilis durante la sífilis primaria y secundaria; y como diagnóstico exclusivo en etapas temprana de la sífilis primaria donde existe un fallo en las pruebas serológicas con compromiso de la especificidad reflejando en ocasiones resultados falsos positivos en pacientes coinfectados con otros patógenos o agentes virales (Smajs et al., 2012). En países desarrollados, se ha puesto en práctica el uso de la técnica de Reacción en Cadena de la Polimerasa (PCR, de sus siglas en inglés ¨Polymerase Chain Reaction¨), como diagnóstico confirmatorio para la sífilis, obteniéndose resultados promisorios según el tipo de muestra seleccionada en relación con el estadio de la enfermedad (Peng et al., 2011). Las muestras utilizadas para el diagnóstico molecular de la sífilis varían de acuerdo a la etapa de la enfermedad, siendo las más recomendadas para la sífilis primaria: exudados provenientes de úlceras genitales y extragenitales (anal, oral) sugerentes a chancro; y para la sífilis secundaria: biopsias extraídas de lesiones en piel, y sangre total (Grange et al., 2012). Dentro de los genes dianas que se han sugerido para la amplificación de ADN de T. pallidum, se encuentra el gen que codifica para la proteína de membrana externa de 47kDa y el gen que codifica para la ADN polimerasa I, siendo esta última región la más recomendada para la detección molecular de T. pallidum en lesiones ulceradas debido a su función esencial ampliamente descrita y a su conservación en el genoma bacteriano (Damasceno et al., 2011). Los estudios recientes sobre la sífilis han estado encaminados al uso de técnicas de epidemiología molecular que garanticen una caracterización profunda y exhaustiva del agente causal así como a un control epidemiológico de la enfermedad en todas sus etapas, para dejar al descubierto la información referida a la cadena de transmisión de la sífilis y particularmente a entender el desarrollo y diseminación de cepas resistentes a antibióticos, requiriendo para ello métodos de diferenciación de cepas de T .pallidum (Ho & Lukehart, 2011). Se ha desarrollado un método de tipificación de T. pallidum basado primeramente en la determinación del número de repeticiones de 60 pb en el gen arp (de sus siglas en inglés ``acidic repeat protein``) y luego en la diferencias de secuencias en el gen tpr (de sus siglas en el inglés `` Treponema pallidum repeat ``) de la subfamilia génica II constituidas por los genes ((tprE [tp0313], tprG [tp0317], y tprJ [tp0621])), determinados mediante análisis por RFLP (de sus siglas en inglès ``Restriction Fragment Length Polymorphism``) (Wu et al., 2012). En Cuba, hasta la fecha, no se ha utilizado la PCR como prueba de diagnóstico de la infección por T. pallidum como agente etiológico de lesiones en piel, sugerentes de sífilis. Igualmente no se tiene información sobre los subtipos circulantes y su frecuencia, así como de la presencia de resistencia a macrólidos, aspectos que motivaron a la realización de la presente investigación y para la cual se tuvieron en cuenta los siguientes objetivos: Objetivos: 1. Evaluar la utilidad de la PCR en muestras de pacientes con lesiones sugerentes de sífilis. 2. Determinar la frecuencia de los subtipos de T. pallidum circulantes en los pacientes estudiados. 3. Explorar el comportamiento de la resistencia a macrólidos de los subtipos de T. pallidum identificados. II. Revisión Bibliográfica II.1 Características generales de la sífilis La sífilis es una Infección de Transmisión Sexual (ITS), considerada una enfermedad reemergente (Cabié et al., 2010). Es una infección caracterizada por cuatro etapas bien definidas: sífilis primaria, secundaria, latente y terciaria (Mattei et al., 2012). La etapa primaria de la sífilis se caracteriza por el ingreso del patógeno (la bacteria T. pallidum subespecie pallidum) a la epidermis, a través de heridas, fisuras o diminutas abrasiones ocurridas durante las relaciones sexuales (Heyman, 2010); el microorganismo se reproduce en forma local, antes de diseminarse profusamente, a través de la vía linfático-hematógena, ubicándose en los tejidos subepiteliales y provocando lesiones erosivas indoloras en los genitales llamados chancro duro (Farhi, 2009). Se pueden presentar también chancros extragenitales que suelen aparecer en los dedos, el borde de la lengua, la parte interna de las mejillas, el paladar y, desde luego, en la región ano-rectal. Estos síntomas se evidencian aproximadamente después de tres semanas de haber ocurrido la infección, aunque esta manifestación clínica puede ir de tres a 90 días (Ho & Lukehart, 2011). La sífilis primaria progresa a sífilis secundaria entre dos semanas y dos meses después de la aparición del chancro. La sífilis secundaria constituye el patrón de enfermedad sistémica (Radolf et al., 2006), caracterizada por la aparición de rash cutáneo en palmas de las manos y los pies, exantema sifilítico en el tórax y el abdomen, alopecia, sifílides en la boca, lengua, área genital, anal y perianal y condilomas planos en el área genital; y al igual que el chancro primario todas estas lesiones son particularmente contagiosas (Baughn & Musher, 2005). Ejemplos de estas manifestaciones clínicas típicas de la enfermedad se muestran en la figura 1. Luego de este periodo la enfermedad entra en un período asintomático conocido como sífilis latente en el cual T. pallidum puede seguir diseminándose de forma intermitente a través de la corriente sanguínea. Alrededor del 70% de los pacientes con sífilis latente no tratada no presenta signos clínicos de sífilis tardía, pero no es seguro que se curen de forma espontánea (La Fond, 2006). Durante la etapa secundaria o terciaria se pueden presentar afectaciones del Sistema Nervioso Central (SNC) con manifestaciones variadas, que pueden comprometer en algunos casos al sistema cardiovascular provocando como principales afectaciones cardiacas: aortitis sifilítica y aneurisma sacciforme (Miklossy, 2012). Las manifestaciones cardiovasculares de la sífilis se atribuyen a la endarteritis obliterante de los vasa vasorum que riegan y nutren a los grandes vasos. Los síntomas aparecen de 10 a 40 años después de la infección (Jackman et al., 1989). A) B) C) D) Figura 2.1 Lesión cutánea de sífilis primaria: A) chancro genital en el hombre, B) chancro genital en la mujer C) chancro extragenital. Lesión cutánea de sífilis secundaria: D) exantema diseminado o erupción granulomatosa. II.1.1 Patogénesis de la enfermedad La sífilis es considerada una enfermedad infectocontagiosa, que afecta a diversas regiones anatómicas (Salazar et al., 2002). T. pallidum es capaz de atravesar rápidamente las mucosas íntegras o las erosiones microscópicas de la piel y en pocas horas penetra en los vasos linfáticos y en la sangre produciendo una infección generalizada con focos metastásicos alejados antes de que aparezca la lesión primaria. La sangre de un paciente con sífilis precoz o en fase de incubación es sumamente contagiosa. Se calcula que el tiempo de reproducción in vivo de T. pallidum durante la fase activa de la sífilis precoz es de 30 a 33 h, y el período de incubación de la sífilis es inversamente proporcional al número de microorganismos inoculados. La concentración de los treponemas asciende por lo general a 107, como mínimo, por gramo de tejido antes de que aparezca clínicamente una lesión (Hazlett et al., 2001). El período de incubación (desde la inoculación hasta que aparece la lesión primaria) rara vez supera las seis semanas. Un tratamiento insuficiente durante el período de incubación puede retrasar la aparición de la lesión primaria, pero no es seguro que disminuya las probabilidades de que aparezca a la larga la enfermedad con sus síntomas (Peeling & Hook, 2006). La lesión primaria surge en el sitio de la inoculación, persiste por lo común cuatro a seis semanas, y luego se cura espontáneamente. El examen histológico de esta lesión muestra una infiltración perivascular formada principalmente por linfocitos (incluidas las células CD8+ y CD4+), células plasmáticas y macrófagos, junto con una proliferación del endotelio capilar, que va seguida de oclusión de los vasos sanguíneos pequeños. La infiltración celular ofrece un perfil de citocinas del tipo Th1, congruente con la activación de los macrófagos (Morgan et al., 2002). En este momento se puede demostrar en el chancro la presencia de T. pallidum en los espacios intercelulares de los elementos epiteliales, en las invaginaciones o fagosomas de las células epiteliales, los fibroblastos, las células plasmáticas y las células endoteliales de los capilares pequeños, en el interior de los conductos linfáticos y en los ganglios linfáticos regionales. Al final, los microorganismos son fagocitados y destruidos por los macrófagos activados, lo que produce la desaparición espontánea del chancro (Leader et al., 2007). Las manifestaciones generales parenquimatosas y mucocutáneas de la sífilis secundaria suelen aparecer unas seis a ocho semanas después de desaparecer el chancro, aunque 15% de los pacientes de sífilis secundaria sigue teniendo un chancro que persiste. En otros pacientes, las lesiones secundarias aparecen varios meses después de curar el chancro, y algunos pacientes pueden pasar a la fase latente sin haber tenido nunca lesiones secundarias identificables. Los signos histopatológicos de las lesiones cutáneas maculopapulosas del período secundario son: hiperqueratosis de la epidermis, proliferación capilar con tumefacción endotelial en el corion superficial y afluencia de leucocitos polimorfonucleares en las papilas dérmicas, mientras que en el corion profundo, los treponemas se encuentran en muchos tejidos, incluidos el humor acuoso y el líquido cefalorraquídeo (LCR) (Baughn & Musher, 2007). La invasión del SNC por T. pallidum se produce en las primeras semanas o meses de la infección, y hasta 40% de los pacientes muestra alteraciones de la composición del LCR durante el período secundario. Las manifestaciones clínicas de hepatitis y de glomerulonefritis membranosa inducida por inmunocomplejos son bastante raras pero bien conocidas durante la sífilis secundaria; las pruebas funcionales hepáticas pueden ser anormales hasta en 25% de los pacientes con sífilis precoz. Se notan adenopatías generalizadas no dolorosas en 85% de los pacientes con sífilis secundaria (De Almeida et al., 2010). Antiguamente, la forma más frecuente de sífilis terciaria era el goma sifilítico, que es una lesión granulomatosa por lo común benigna. Hoy en día, los gomas son muy raros. La sífilis cardiovascular, también rara en la actualidad, se debe a una endarteritis obstructiva de los vasos pequeños que suele afectar a los vasa vasorum de la aorta ascendente e inducen la formación de un aneurisma. La afección asintomática del SNC se puede demostrar hasta en 25% de los pacientes con sífilis latente tardía. Se desconocen los factores que favorecen el desarrollo y el empeoramiento progresivo de la sífilis terciaria, aunque se conoce que en el 30% de los casos, después de 7 a 20 años, el paciente puede evolucionar a la fase terciaria caracterizada por manifestaciones cutáneas o viscerales, sobre todo cardiovasculares y nerviosas, dado por una alteración del equilibrio entre el microorganismo y los mecanismos de defensa establecidos, o por la alteración de la inmunidad celular asociada con la edad (Marra, 2009). II.2 Agente causal y características generales T. pallidum subespecie pallidum, es una espiroqueta que responde como negativa a la tinción de Gram, tiene una apariencia espirilar delgada, y es observable solo por microscopía de campo oscuro, debido a sus dimensiones de 0,5 µm de ancho y de 10 a 15 µm de longitud (Madigan et al., 2012). No se tiñe con colorantes de anilina pero sí con Giemsa y métodos de impregnación argéntica, como el de Fontana-Tribondeau que utiliza nitrato de plata, el cual se transforma en plata metálica en la superficie de la espiroqueta y se deposita en forma de placas; esto lo hace más grueso y permite su visualización por el microscopio de luz de campo brillante, aunque provoca la deformación del mismo (Llop et al., 2001). Presenta entre 4 a 14 vueltas de espira de igual tamaño, espaciadas por una distancia de 1 µm, que aumentan en periodicidad y disminuyen en amplitud hacia los extremos, dando a la célula una forma afilada (como un sacacorchos invertido). Por lo regular, el eje largo de la espiral es recto, pero a veces puede estar inclinado, dándole en algunos momentos la forma de un círculo completo y después retorna a su posición recta normal (Larsen et al., 1999). Es considerado un microorganismo microaerófilo, capaz de sobrevivir a una atmósfera de oxígeno de 3 a 5%, por largos periodos. T. pallidum, hasta el momento no es cultivable in vitro (La Fond & Lukehart, 2006), aunque se comprobó que se podía mantener de 4 a 7 días a una temperatura de 25 oC, en un medio anaerobio compuesto por albúmina, bicarbonato de sodio, piruvato, cisteína y un ultrafiltrado de suero bovino (Schiller & Cox, 1977). Esta bacteria es móvil y su viabilidad varía de acuerdo a las condiciones del ambiente a las que está expuesto; en sangre total o plasma almacenada a 4oC, mantiene su viabilidad al menos por 24 horas, en presencia de sustancias reductoras y en una suspensión líquida apropiada manifiesta movilidad en un periodo de 3 a 6 días a 25oC. Si se mantiene fuera del cuerpo en un lugar oscuro y húmedo, no sobrevive más de dos horas. Debido a sus características de bacteria fastidiosa se ha caracterizado por presentar un parasitismo obligado, es un patógeno altamente invasivo, persistente, con pequeña actividad toxigénica (Abbas et al., 2006). Se ha comprobado que muere rápidamente por desecación, y es destruida por acción de arsenicales trivalentes, mercurio y bismuto (sustancias contenidas en los fármacos de interés para el tratamiento de la sífilis). Es sensible a la penicilina y puede ser reactivado por compuestos que tengan grupos surfhidrilos (SH), por ejemplo, cisteína o BAL (dimercaprol) (Joklik et al., 1998). La capacidad metabólica y adaptabilidad de T. pallidum son mínimas, debido a la ausencia de vías metabólicas, que incluyen no solo el ciclo de los ácidos tricarboxílicos, sino también la fosforilación oxidativa, entre otras vías biosintéticas (Giacani et al., 2009). II.2.1 Taxonomía De acuerdo con el Manual de Bergey T. pallidum se ubica taxonómicamente en: Phylum B XVII. Spirochaetes phy. Nov. Clase I. Spirochaetes Orden I. Spirochaetales Familia I. Spirochaetaceae Género IX. Treponema (Garrity et al., 2001). Este género incluye, además, otras especies patógenas humanas tales como: T. pallidum subespecie endemicum, agente etiológico de la sífilis endémica o bejel; T. pallidum subespecie pertenue, agente etiológico del pian o frambesia y T. carateum, agente etiológico de la pinta o mal de pinto. Las mismas son indistinguibles desde el punto de vista morfológico y antigénico. En el hombre se describen varias especies en la cavidad oral como T. vincentii, que puede transformarse en patógeno y producir la angina de Vincent cuando aumenta su número y se asocia con los bacilos fusiformes de la boca (Lemont et al., 2010). T. refringens y T. phagedenis, cuya variedad de fácil cultivo (treponema de Reiter) es de utilidad para el estudio serológico de la sífilis. La especie patógena tipo de este género es T. pallidum, cepa Nichols (La Fond & Lukehart, 2006). II.2.1.1 Características genómicas En el año 1991 mediante técnicas de electroforesis de campo pulsado se llevó a cabo la caracterización del genoma de T. pallidum, por Walker et al., observándose la presencia de un genoma pequeño similar al de especies del género Mycoplasma y Borrelia. La secuenciación del genoma de T. pallidum subespecie pallidum (Nichols) se determinó en el año 1998, utilizando técnicas de secuenciación shot-gun permitiendo la fragmentación al azar del ADN de todo el genoma, una vez obtenidas las secuencias se alinean y se ensamblan basándose en secuencias que se solapan (Norris et al., 2001). El genoma consiste de un cromosoma de simple cadena circular de 1 138 006 pares de bases, el contenido de Guanina + Citocina es de 52,8%, muy superior al de Borrelia burgdorferi que es de 39%. El genoma está formado por un total de 1 041 de marcos abiertos de lectura (ORF, de las siglas en inglés “Open Reading Frames”´); representando el 92,9% del total del ADN genómico (McKevitt et al., 2003). II.3 Diagnóstico Para la realización del diagnóstico es importante tener en cuenta no solo el tipo de muestra a tomar según las diferentes manifestaciones clínicas de la sífilis, sino también, los criterios epidemiológicos, clínicos y de laboratorio. Dentro de las muestras a tomar se selecciona las muestras de suero, linfa de lesiones primarias y secundarias, LCR, líquido amniótico, así como las biopsias de las lesiones. Se pueden tomar otras muestras como sangre periférica, los granulocitos purificados y la eyaculación de los pacientes con sífilis (Damasceno et al., 2011). El criterio del laboratorio es el principal a tener en cuenta para el diagnóstico de la enfermedad, dividiéndose en dos categorías: pruebas de diagnóstico directas y pruebas de diagnóstico indirectas (Vulcano et al., 2011). II.3.1 Diagnóstico indirecto Debido a que T. pallidum no es cultivable in vitro, el diagnóstico serológico reviste gran importancia en la actualidad, sobre todo en aquellos países como Cuba que realizan esta alternativa como las únicas variantes para el diagnóstico. El diagnóstico indirecto agrupa pruebas serológicas que se clasifican en treponémicas y no treponémicas, diferenciadas así a partir del tipo de antígeno que utilizan y los anticuerpos a determinar (Zeltser & Kurban, 2004). II.3.1.1 Pruebas no treponémicas Estas pruebas determinan anticuerpos reagínicos (IgM e IgG). A pesar de que las pruebas no treponémicas son relativamente específicas, no son exclusivas para la sífilis y por tanto, pueden producirse reacciones falsas positivas (Rodríguez et al., 2006). En estas pruebas se utiliza como antígeno la cardiolipina purificada, extraída del corazón de buey. La cardiolipina es un fosfatidilglicerol que requiere la adición de lecitina y colesterol o de otros sensibilizadores para reaccionar con la reagina. La reagina está constituida por una mezcla de anticuerpos IgM e IgG capaces de reaccionar contra antígenos distribuidos en los tejidos normales, y se encuentra en el suero del paciente a partir de la segunda o la tercera semana del inicio de la enfermedad no tratada y en el LCR entre la cuarta y la octava semana (Manavi et al., 2006). Entre las pruebas no treponémicas que se usan en la actualidad se encuentran: la Venereal Disease Research Laboratory (VDRL, por sus siglas en inglés) y la prueba para la detección rápida de reaginas (RPR, de sus siglas en inglés “Rapid Plasma Reagin”). Se trata de pruebas bien controladas, fáciles de realizar y que se pueden semicuantificar con exactitud (Mattei et al., 2012). VDRL y RPR Las pruebas RPR y VDRL tienen una sensibilidad similar y pueden utilizarse para la detección inicial o la cuantificación de los anticuerpos séricos; se caracterizan por una alta sensibilidad pero una baja especificidad, por lo que siempre es necesaria la confirmación por otro método treponémico que presente una mayor especificidad. El título sérico refleja el grado de actividad de la enfermedad. En la evolución de la sífilis inicial puede observarse un incremento al cuádruple o mayor del título. En la sífilis activa la prueba VDRL alcanza niveles de 32 o más durante la sífilis secundaria. Una disminución de dos diluciones o al cuádruple, o más, tras el tratamiento de la sífilis inicial representa un indicio de respuesta adecuada al tratamiento. Los títulos en las pruebas VDRL no se corresponden con los observados en la prueba RPR, y las pruebas cuantitativas secuenciales, como las aplicadas para conocer la respuesta terapéutica, deben estar basadas en el uso de un solo método de medición (Emerson, 2009). Dentro de los grandes inconvenientes de estas pruebas se encuentran la elevada ocurrencia de reacciones falsas positivas, debido a que en estas el antígeno utilizado también se encuentra en los tejidos, y pueden resultar positivas en personas que no presentan infección treponémica, además puede depender de otros factores como la carga bacteriana presente en el organismo así como de las condiciones inmunológicas del organismo (Mattei et al., 2012). II.3.1.2 Pruebas treponémicas Estas pruebas a diferencia de las anteriores, que muestran una declinación en los títulos o se convierten en no reactivas con el tratamiento efectivo, se mantienen reactivas durante años o de por vida. Se basan en la utilización de T. pallidum como antígeno para detectar anticuerpos contra componentes celulares, y pueden ser agrupadas en diferentes categorías: Inmunofluorescencia indirecta: prueba de absorción de anticuerpos fluorescentes contra T. pallidum (FTA-Abs). Hemaglutinación y microhemaglutinación para anticuerpos contra T. pallidum (TPHA, MHA-TP). Pruebas inmunoenzimáticas para la detección de anticuerpos contra T. pallidum. A pesar de que estas pruebas presentan una mayor especificidad desafortunadamente son costosas y técnicamente complejas, por lo que sólo se utilizan para confirmar los resultados obtenidos en las pruebas no treponémicas (Sokolovsky et al., 2009). Pruebas rápidas En la actualidad, existen más de 20 pruebas rápidas en el mercado. La mayoría se hacen en formato de tira reactiva o de flujo lateral. Son exámenes treponémicos sencillos, se realizan en el lugar de la consulta médica y pueden llevarse a cabo fuera de entorno del laboratorio, con una mínima capacitación del personal, sin un equipo especializado y con la recolección, mediante el pinchazo en el dedo, de una cantidad pequeña de sangre completa. No requieren condiciones especiales de almacenamiento o transporte y el resultado es fácil de interpretar, en condiciones ideales, se establece entre 15 a 20 minutos. En cambio, tienen la desventaja de no poder distinguir entre una infección activa y una anterior por lo que requieren de la confirmación mediante las pruebas estándares (Schimelis y Tadesse, 2015). II.3.2 Diagnóstico directo Examen microscópico en campo oscuro El examen microscópico en campo oscuro es esencial para evaluar las lesiones cutáneas húmedas como el chancro que aparece durante la sífilis primaria o los condilomas planos de la sífilis secundaria. Para la toma de la muestra se exprime la lesión para que expulse un trasudado seroso (linfa) y se coloca una gota del mismo en la superficie de un portaobjetos (Bravo, 2002). Si fuera necesario, puede mezclarse una gota de solución salina, sin aditivos de tipo bacteriostático, con el trasudado y se examina de manera inmediata para observar la presencia de T. pallidum con técnica de campo oscuro o de contraste de fase. No se recomienda el diagnóstico de lesiones bucales y las úlceras anales con este método porque es difícil diferenciar T. pallidum de otras espiroquetas que puedan estar presentes; además, en la cavidad oral se encuentran otros treponemas que son anfibiontes de esta cavidad y puede confundir el diagnóstico por esta vía (Singh & Romanowski, 1999; Lemont, 2010). Una prueba negativa no excluye la posibilidad de sífilis. Para lograr la visualización es necesario que en el exudado haya al menos 10 4 treponemas; el uso previo de antisépticos tópicos o del lavado realizado por el paciente puede alterar los resultados. Idealmente, el examen en campo oscuro debe repetirse a los tres días antes de considerarlo negativo (Sanguinetti & Tafur, 2004). Inmunoflourescencia directa La prueba de anticuerpos fluorescentes directos a T. pallidum (DFA-TP, siglas en ingles de “Direct Fluorescent Assay for T. pallidum”), puede llevarse a cabo utilizando un anticuerpo policlonal antitreponémico conjugado con fluoresceína para la detección de T. pallidum en frotis desecados, obtenidos de lesiones orales, rectales o intestinales. Esta técnica detecta y diferencia a los treponemas patógenos de los no patógenos, mediante una reacción antígenoanticuerpo, no requiriendo de la presencia del microorganismo móvil para su realización, siendo una técnica sumamente sensible. Un avance de esta técnica es el uso de un anticuerpo monoclonal específico para treponemas patógenos (Mattei et al., 2012). Inoculación animal Esta es una prueba realizada para medir la sensibilidad de la técnica de PCR (Krause, 1996; Lukehart et al., 2007). Consiste en la inoculación de T. pallidum en los testículos de un conejo. La vía de inoculación más utilizada es la intratesticular, además de la intradérmica, ocular, intravenosa y escrotal. Esta prueba es la de referencia, que determina la sensibilidad y especificidad de las otras pruebas para el diagnóstico de sífilis. Además es el método más antiguo para detectar una infección por T. pallidum. No se utiliza de rutina porque es costoso y representa una dificultad técnica mayor (Morgan et al., 2003; Workowski & Berman, 2010). Inmunoperoxidasa La tinción con inmunoperoxidasa permite demostrar la presencia de espiroquetas en los tejidos fijados con formaldehído de pacientes con sífilis secundaria, esta técnica es más sensible que algunos métodos convencionales y puede usarse como prueba confirmatoria en los casos de sífilis secundaria (Kimberly et al., 2002). Técnicas de biología molecular Debido a las limitaciones de los métodos de diagnóstico disponibles en la actualidad, el diagnóstico de la sífilis es poco específico. En este contexto, se ha planteado el uso de las técnicas de amplificación de los ácidos nucleicos, basados en la PCR para la detección de T. pallidum subespecie pallidum. Estas pruebas se basan principalmente en la detección de dos genes: el gen tpN47 que codifica para la proteína de membrana de 47 kDa y el gen polA que codifica para la ADN polimerasa I (Palmer, 2003; Peng et al., 2011). La PCR dirigida al gen de la proteína de 47 kDa se ha utilizado ampliamente para detectar T. pallidum en distintos tejidos, mostrando sensibilidades similares a la prueba de inoculación en conejos en muestras de úlceras genitales y en sangre total. Sin embargo, su uso en LCR ha demostrado tener sensibilidades menores a éstas, alrededor de 65% y 67%. Por otra parte, el uso de la PCR para el gen polA ha sido reportado con sensibilidad de 95,8% para úlceras genitales y de 41% para sangre total (Rodes, 2001), en cambio no ha sido descrito para muestras de LCR como método diagnóstico de neurosífilis (Damaseno et al., 2011). Se han descrito distintas variantes de la técnica de PCR, tales como PCR anidada, para muestras de lesiones genitales y sangre (Grange et al., 2012); así como PCR múltiple que permita detectar y diferenciar Haemophilus ducreyii, T. pallidum, virus del Herpes Simple tipo 1 y 2 de otras úlceras genitales (Mehta et al., 2012). La técnica de PCR amplifica o replica varias veces secuencias específicas de ADN de una muestra. Se utiliza dos porciones cortas de ADN denominados cebadores o "primers", estos son oligonucleótidos sintéticos de ADN o ARN cuya secuencia es conocida, que luego de fusionarse (hibridizarse) a un ADN complementario, actúan como una plantilla para sintetizar ADN nuevo, esto es un proceso enzimático repetido en varios ciclos térmicos (Wenhai et al., 2004). El proceso se inicia con la separación del ADN de doble cadena mediante calor (desnaturalización), al bajar la temperatura se produce recombinación o emparejamiento de los primers con el ADN original de una sola cadena, se prolongan las secuencias de ADN cebado y por medio de una incubación con la enzima ADN polimerasa se sintetiza una nueva cadena complementaria de ADN. Cada ciclo va duplicando la cantidad de ADN de manera exponencial y por lo general se llevan a cabo unos 30 o 40 ciclos. Esta técnica tiene diferentes variantes, dependiendo del ADN a amplificar, que consiste en modificaciones de alguno de los pasos del proceso básico (Grange et al., 2012). La prueba de la PCR que detecta ADN de T. pallidum es de gran utilidad en el diagnóstico de la sífilis cuando el diagnóstico representa dificultad como en el caso de sífilis congénita. La ventaja de la PCR es que al amplificar ADN específico de T. pallidum, se elimina la posibilidad de detectar falsos positivos, además que puede realizarse en gestación temprana, mediante el estudio del líquido amniótico (Wisconsiva et al., 2006). En muchos estudios, el gen de T. pallidum que codifica para la proteína de 47 kDa ha sido usado como región diana; sin embargo, se ha visto que cuando se usa el gen que codifica para la ADN polimerasa I de T. pallidum como región diana hay un aumento en la sensibilidad de la técnica. La PCR que amplifica el gen que codifica para la proteína de 47 kDa detecta ADN en muestras de tejidos con muy baja sensibilidad, en base a esto se han realizado estudios que describen la utilización de una PCR semi-anidada que amplifique la región que codifica a la ADN polimerasa I, embebiendo los tejidos en parafina (Bherhof et al., 2008). Para un correcto diagnóstico se ha sugerido el uso tanto de técnica de PCR como de la inmunohistoquímica esencialmente para diagnóstico de sífilis secundaria (Buffet et al., 2007). Otros estudios sugieren el uso de una PCR en tiempo real donde se han obtenido sensibilidad de 94% y especificidad de 100%, aun en muestras de LCR (Koek et al., 2006). La sensibilidad de la PCR varía de acuerdo a la temperatura de hibridación, el número de ciclos y la concentración de los cebadores; por lo que estos son parámetros a tener en cuenta al optimizar una PCR (Mikalova et al., 2010). Las técnicas de biología molecular pueden aportar ventajas en el diagnóstico directo de la infección por T. pallidum. Por el momento, no hay técnicas comercializadas, y las descritas en la bibliografía se han desarrollado en centros de referencia. Se han reportado diferentes técnicas que amplifican genes de T. pallidum. Mediante una PCR en tiempo real, que amplifica una región de 366 pb del gen ARNr 16S, se obtiene una extraordinaria sensibilidad. La PCR que amplifica el gen de la ADN polimerasa I presenta una mayor sensibilidad, ya que está basada en las dos características distintivas de este gen: presenta una región que codifica para un alto contenido de cisteínas, que hace que esta región presente una baja homología con regiones similares del gen que codifica para la ADN polimerasa I de otros microorganismos conocidos; el segundo y único rasgo es la presencia de cuatro inserciones en el gen, permitiendo de esta manera que la PCR que amplifica esta región del genoma de T. pallidum, permita diferenciar entre subespecies patogénicas de T. pallidum (Liu et al., 2001). Una de las técnicas más referenciadas es la que amplifica el gen de la proteína de 47 kDa. Su éxito estriba en que se ha presentado en formato múltiple frente a otras dos causas de úlceras genitales: Haemophilus ducreyii y virus del herpes simple (VHS) tipos 1 y 2. Su sensibilidad varía entre 91 y 95%. Esta técnica no se ha comercializado. Otros campos de interés de la biología molecular de T. pallidum son la tipificación mediante el análisis del polimorfismo de los fragmentos de restricción (RFLP, de sus siglas en inglés “Restriction Fragment Length Polymorphism”) de los genes tpr y arp, así como la detección de resistencia a antimicrobianos mediante PCR en tiempo real (Peng et al., 2011). II.4 Tratamiento y resistencia a macrólidos Desde el año 1940 con el advenimiento de la penicilina, esta se ha usado para el tratamiento de la sífilis, persistiendo como el medicamento de elección en todos sus estadios, recomendado por el CDC (de sus siglas en inglés ``Centres for Diseases Control and Prevention``) (Stamm et al., 2000). Las preparaciones usadas: benzatínica, procaínica o cristalina, así como la dosis y duración del tratamiento, dependerán del estadio y las manifestaciones clínicas de la enfermedad. La sífilis ha sido tratada de manera eficiente desde hace 50 años con la penicilina G benzatínica, sin informarse casos de resistencia a este antibiótico (Douglas, 2009); sin embargo, la necesidad de usar un tratamiento alternativo para pacientes alérgicos a la penicilina e intolerantes a inyecciones intramusculares ha traído consigo el desarrollo de una segunda línea de antibióticos con efectos similares para el tratamiento de la enfermedad, como son la doxiciclina, tetraciclina y azitromicina (Wong, 2008). Con el descubrimiento en el año 1952 de la eritromicina se incorpora al arsenal de los antimicrobianos una nueva familia: la de los macrólidos. Este compuesto fue aislado por Mc Guire y colaboradores en los productos metabólicos de una cepa de Streptomyces eruthraeus obtenida en una muestra de suelo recogida en el archipiélago filipino. Más de 3 décadas después, y a pesar de no tener un efecto tan amplio como los β-lactámicos, las quinolonas o los aminoglucósidos, la incorporación de nuevos compuestos a la familia, hace que se consideren de elección contra nueve microorganismos y como primera opción frente a otros 14 (De Jesús et al., 2013). Los macrólidos son un grupo de antibióticos bacteriostáticos que inhiben la síntesis proteica (Vester, & S. Douthwaite, 2001) y que se encuentran muy relacionados entre sí caracterizándose por tener un anillo macrocíclico de lactosa formados por 14 a 16 miembros, al que se une uno o más desoxiazúcares; la diferencia entre los compuestos de esta familia radica en la cantidad de átomos que componen esta molécula (Lewis & Lukhart, 2011), cuyo prototipo y macrólido más utilizado, es la eritromicina. La claritromicina y la azitromicina son derivados sintéticos de la eritromicina, usualmente usados para el control de infecciones donde los pacientes presentan alergia al tratamiento con penicilina (Stamm, 2010). Entre otras propiedades químicas presentan: poca solubilidad en agua, tienen aspecto cristalino blanco, son bases débiles que se inactivan en medio ácido, de ahí que se presenten en forma de sales o ésteres que son más resistentes a los ácidos, así como que en sus presentaciones orales tengan una cubierta entérica para protegerlos de la acción de los ácidos a nivel del estómago (Goodman & Gilman, 1990). Se ha informado que existen diferentes subtipos de T. pallidum que son resistentes a macrólidos (Muller et al., 2012). II.4.1 Mecanismo de acción de los macrólidos Los macrólidos ejercen su actividad antimicrobiana al obstaculizar la síntesis de proteínas en la bacteria a nivel ribosómico, se fijan a la unidad 50S del mismo, e impiden la translocación del aminoacil ARNt y la transpeptidación en la cual la cadena de péptido en crecimiento se desplaza del sitio aceptor al donador, por esta particularidad se proscribe su combinación con otras drogas que compiten con un sitio similar de fijación en el ribosoma (Tenson et al., 2003). Su efecto bactericida o bacteriostático depende de su concentración en el sitio de infección, del microorganismo, del inóculo, su sensibilidad, y de la fase de proliferación en que se encuentren las bacterias. Ellos penetran más fácilmente en las bacterias gram-positivas; la claritromicina es el único que posee actividad sobre bacterias gram-negativas, pero es muy escasa (Calvo & Martínez, 2009). II.4.1.1 Resistencia microbiana a los macrólidos El aumento y ocurrencia de resistencia antimicrobiana está asociado con la prolongación en el uso de un agente antimicrobiano, trayendo consigo el fenómeno de resistencia innata y resistencia adquirida. La resistencia adquirida puede ser resultado de la ocurrencia de mutaciones de novo o de la adquisición de material genético de una bacteria susceptible por conjugación, transformación y transducción (Davies et al., 2010). La resistencia de los microorganismos frente a los macrólidos se produce por diferentes mecanismos. Algunos bacilos gramnegativos son resistentes por incapacidad del medicamento para penetrar en los sitios receptores. En microorganismos sensibles como algunos gram-positivos, la resistencia se produce por mutación o determinantes cromosómicos y otras veces es mediada por plásmidos (sistema de expulsión por bombeo) por vía de desmetilación de adenina en los ribosomas 23S del ARN de los microorganismos (presencia de ARNr metilasa) (Morshed y Jones, 2006). Pueden generarse también enzimas como las esterasas, glicosilasas y fosfotransferasas que inactivan a los macrólidos de 14 carbonos, mecanismo conocido como modificación enzimática (Tenover, 2006). La resistencia a macrólidos está frecuentemente asociada con una alteración del sitio diana (región peptidiltransferasa en el dominio V del ARNr 23S) mediante una dimetilación y adenización de esta proporción del ARN, llevadas a cabo por las proteínas Erm, codificadas por el gen erm (presentes en Staphilococcus, Streptococcus, Enterobacterias, Lactobacillus) (Leclercq, 2002), esta alteración de la conformación trae como resultado la imposibilidad de unión del antibiótico al ribosoma; existen dos tipos de modificaciones: la constitutiva (resistencia de amplio espectro excepto a la Estreptogramicina) y la inducible (resistencia a los macrólidos de 14 y 15 carbonos). También pueden alterar la permeabilidad, por alteraciones de las porinas en la membrana plasmática, disminuyendo la susceptibilidad de entrada de los macrólidos (Stokes & Gilings, 2011). La resistencia a macrólidos en T. pallidum se identifica mediante amplificación por PCR de un fragmento del gen que codifica el ARNr 23S con un subsecuente análisis de digestión con las enzimas de restricción MboII para las mutaciones A2058G y BsaI para las A2059G. El genotipo de resistencia a macrólidos se confirma por secuenciación de los productos de PCR una vez purificados (Lukehart et al., 2004; Mueller et al., 2012). II.4.2 Identificación de subtipos de T. pallidum En los últimos 10 años ha existido un aumento en la población mundial de los casos de sífilis primaria y secundaria, trayendo complicaciones como neurosífilis y sífilis cardiovascular (Wu et al., 2012), por lo que se hace necesario para el control de la enfermedad un diagnóstico eficiente y un tratamiento efectivo (Workowski & Berman, 2010). En la actualidad se ha observado la resistencia a macrólidos (Azzato et al., 2012), mediante el estudio de mutantes y subtipajes moleculares de inóculos de T. pallidum al estudiar la resistencia a azitromicina en pacientes con sífilis (Zhou et al., 2010). La existencia de los métodos de subtipaje ha sido el vehículo para el estudio de la resistencia a macrólidos y de esta forma poder tener el control de la enfermedad (Wu et al, 2012). La subtipificación es una herramienta eficiente para poder determinar la diversidad de los patógenos y la epidemiología de la infección por T. pallidum. En 1998 investigadores del CDC publicaron un método molecular para diferenciar entre subtipos de T. pallidum subespecie pallidum (Pillay et al., 1998). El método está basado en la determinación del número de repeticiones de 60pb en el gen arp (de sus siglas en inglés ``acidic repeat protein``) y en la diferencias en las secuencias en los genes de la Subfamilia II de T. pallidum (tprE [tp0313], tprG [tp0317], tprJ [tp0621]), determinado por RFLP. La designación de los subtipos está dada por el número de repeticiones y por los patrones del RFLP, pudiendo realizarse a partir de diferentes muestras clínicas (Palmer et al., 2009; Marra et al., 2010). Para la determinación del número de fragmentos de 60-pb repetidos en tándem del gen arp se debe aplicar una PCR para la amplificación de un fragmento interno del gen que contiene las repeticiones seguido por secuenciación de ADN (Harper et al., 2008). La familia génica tpr fue descubierta por cuatro mecanismos independientes: por mutagénesis TnPhoA, análisis de secuenciación del genoma, hibridación subtractiva y pesquisa de diferenciación inmunológica. Esta familia está compuesta por 12 genes paralogos o pseudogenes (de tprA a tprL). Estas proteínas pueden ser subdivididas en tres familias variando su talla desde 55,5 kDa hasta 81,5 kDa (Norris et al., 2001). Los estudios realizados sugieren utilizar extractos en los que se detecte material genético de T. pallidum y someterlos a subtipificación molecular mediante la caracterización de los genes repetidos arp y tpr (Martin et al., 2010). Se ha reportado que algunos de los subtipos circulantes están asociados con la resistencia a macrólidos (Flasarová et al., 2012). La subtipificación de T. pallidum basada en la variabilidad de los genes arp y tpr constituye una eficiente técnica epidemiológica (Pope et al., 2005). II.5 Situación actual de la sífilis En los Estados Unidos, las autoridades de salud registraron más de 36,000 casos de sífilis en el 2005, en etapas de sífilis primaria y secundaria. Así mismo, la mitad de todos los casos de sífilis primaria y secundaria en el 2006 se reportaron en 20 condados y dos ciudades, y en su mayoría correspondían a personas de 20 a 39 años de edad. La incidencia más alta de sífilis primaria y secundaria se registró en mujeres de 20 a 24 años de edad y en hombres de 35 a 39 años. Entre el 2004 y el 2005, el número de casos reportados de sífilis primaria y secundaria aumentó en un 11,8%. Entre el 2000 y el 2005 las tasas de sífilis primaria y secundaria en hombres se incrementaron anualmente de 2,6 a 5,7, mientras que en las mujeres esto mismo ocurrió entre el 2004 y el 2005. En el 2006, el 64% de los casos reportados de sífilis primaria y secundaria correspondieron a hombres que tienen relaciones sexuales con hombres (HSH) (Schmid et al., 2009). Durante los últimos 5 años se ha visto un aumento en la tasa de casos de sífilis en Cuba, previa a una disminución que existió entre los años 2000-2009, según se observa en la figura 2. La sífilis es una ITS de declaración obligatoria, constituyendo un importante problema de salud en varias regiones del mundo. Su epidemiología varía en los últimos años, pues se observa una reemergencia de la sífilis primaria y secundaria entre los hombres y las mujeres heterosexuales, situación que lleva también a un dramático incremento de la sífilis congénita. De acuerdo al sexo se ha visto que existe un mayor porcentaje en el sexo masculino que en el femenino, de un 66% y 34% respectivamente. De acuerdo al grupo de edades en provincia Habana se ha observado que entre los años 2009-2011, ha existido una prevalencia mayor en individuos entre 20 y 24 años de edad (MINSAP, 2013; IPK, 2014). En los últimos cuatro años las cifras superan los 3 300 casos en todo el país, con una tasa de 29,6/100 000/habitantes, existiendo un ligero aumento de 1,9% con respecto al año anterior donde la provincia de La Habana notifica 430 casos nuevos para el año 2011, con una tasa de 20,3/100 000/habitantes, situándose como la provincia de mayor tasa en Cuba, según se observa en el gráfico 1 (MINSAP, 2014; IPK, 2015). El fenómeno asociado con este incremento a nivel mundial y en Cuba se debe a una liberación en las relaciones sexuales, con cambios frecuentes de pareja sin protección, al comienzo temprano de las relaciones sexuales y la coinfección con otras ITS, lo que eleva el riesgo en la población, sobre todo entre los más jóvenes (OMS, 2012). Figura 2.2 Comportamiento de la sífilis venérea en Cuba (2000-2015) III. Materiales y Métodos III.1 Diseño del estudio En el Laboratorio Nacional de Referencia de Espiroquetas del IPK (LNRE-IPK) se realizó un estudio de corte transversal, en el periodo comprendido de junio del 2012 a abril del 2015, para la detección molecular, subtipaje y detección de resistencia a macrólidos de T. pallidum en muestras de exudados o biopsias de lesiones de piel y mucosas en pacientes con sospechas clínicas de sífilis, que asistieron a la consulta de ITS del servicio de Dermatología en el Instituto de ”Medicina Tropical Pedro Kourí “(IPK). III.1.1 Recolección de la información A cada uno de los pacientes involucrados en el estudio se les explicó de forma verbal en qué consistía el estudio y se les solicitó su aprobación para la toma de muestras. Además se les aplicó una encuesta epidemiológica (Anexo 1). III.2 Toma y procesamiento de las muestras Para la toma de las muestras de exudados de las lesiones ulceradas se limpió el área de la lesión y presionándola fuertemente desde su base se tomó el exudado con un hisopo estéril, el que se colocó y transportó al laboratorio de espiroquetas en un tubo con 1 mL de Medio Esencial Mínimo Alfa (MEM Alpha) (GIBCO, EUA). Después de homogenizar manualmente el hisopo en el medio se tomaron 500 μL para un nuevo tubo que se conservó a -20ºC hasta su posterior extracción de ADN y el resto se congeló a -70ºC. Para la toma de las muestras de biopsias en piel se anestesió localmente la lesión seleccionada, según criterio dermatológico, y se realizó un ponche de dos milímetros (mm) con ayuda de un punzón de biopsia y se procedió de igual manera que con los exudados. A cada individuo se le realizó extracción de sangre por punción venosa para la obtención del suero por los especialistas del Laboratorio Clínico del Hospital del IPK. Las muestras de sueros fueron trasladadas al LNRE-IPK cumpliendo con las medidas de bioseguridad. III.3 Detección molecular de T. pallidum III.3.1 Extracción de ADN Para la realización de la extracción de ácidos nucleicos se emplearon las muestras conservadas a -20ºC, usando el estuche comercial QIAmp DNA mini kit (QIAGEN, Alemania) siguiendo las orientaciones del fabricante. Una vez descongeladas las muestras se sometieron a centrifugación por 30 minutos a 14 000 revoluciones por minuto (rpm) en la microcentrífuga (Labogene, Korea). Se desechó el sobrenadante y se añadieron 20 μL de solución de proteasa y 600 μL de tampón AL (tampón de lisis), se mezcló inmediatamente mediante vórtex por 15 segundos. Luego se incubó a 56 ºC por 10 minutos en el bloque térmico AccuBlockTM (Labnet International, Inc, Woodbridge, EUA), y se centrifugó a 14 000 rpm, un minuto. Se añadió 600 μL de etanol absoluto (96-100%) frío y se mezcló mediante vórtex. Se aplicaron 700 μL de esta mezcla en una columna QIAampMini contenida en un tubo colector de 2mL, se cerró y se centrifugó a 14 000 rpm, un minuto, y se desechó el filtrado contenido en el tubo colector. Se repitió el paso anterior aplicando 700 μL de la mezcla en la columna, se cerró y se centrifugó a 14 000 rpm, un minuto, y se desechó el filtrado contenido en el tubo colector. Posteriormente se añadió 500 μL del tampón AW1, se centrifugó 14 000 rpm un minuto, desechándose el filtrado contenido en el tubo colector. Se añadió 500 μL del tampón AW2, se centrifugó a 14 000 rpm por 3 minutos, se desechó el filtrado contenido en el tubo colector y se volvió a centrifugar un minuto a 14 000 rpm. Luego se colocaron las columnas en un tubo de microcentrífuga de 1,5 mL, y se añadieron 150 μL del tampón de elución AE, se dejó incubar un minuto a temperatura ambiente y se centrifugó después a 14 000 rpm un minuto. Se tomaron los 150 μL contenidos en los tubos (extractos de ADN) y se conservaron a -70 ºC hasta su uso. III.3.2 Evaluación de la ausencia de inhibidores Para comprobar la ausencia de inhibidores se realizó una PCR para la amplificación de un fragmento de ADN de 268 pb del gen que codifica para la β-globina humana (Talmaci et al., 2004). Esta PCR se realizó a partir de una mezcla de reacción para volúmenes finales de 25 μL, conteniendo 2,5 μL de tampón PCR 10X, 0,5 μL de una mezcla de deoxinucleótidos (dNTP) (10mM), 1,25 μL de cada cebador (10 μM), 0,125 μL de Taq polimerasa (5 U/μL) (QIAGEN, Alemania), 5 μL de la muestra de ADN y suficiente cantidad de agua ultrapura estéril. Se utilizó para cada ensayo un control positivo que consistió en un extracto de ADN a partir de células HeLa, donadas por el Laboratorio de Cultivo de Células del IPK, y un control negativo donde la mezcla de reacción contenía agua ultrapura estéril en lugar del extracto de ácidos nucleicos. Los cebadores empleados fueron sintetizados en el Centro de Ingeniería Genética y Biotecnología, Cuba y sus secuencias se describen en la tabla 1. Tabla 3.1 Secuencias de los cebadores utilizados para la PCR que permite la amplificación de un fragmento del gen de la β-globina humana Nombre del cebador PfL32 PC04 Secuencia 5’- 3’ TAGAATCAAGATCCCAAATCCTCC (24 bases) CAACTTCATCCACGTTCACC (20 bases) Gen diana βglobina humana Talla del amplicón (pb) Referencia Talmaci 628 al., 2004 La amplificación del ADN se realizó en un termociclador "Mastercycler personal" (Eppendorf, Alemania), utilizando una desnaturalización inicial a 94ºC por cinco minutos, seguido de 40 ciclos de desnaturalización a 94ºC por 40 segundos, hibridación a 59ºC por 30 segundos, extensión a 72ºC por un minuto; con una extensión final a 72ºC durante cinco minutos. Los productos de PCR se visualizaron mediante electroforesis submarina en gel de agarosa al 2% utilizando como tampón de corrida Tris-Borato-EDTA (TBE) 0,5X (Anexo 2). La cámara electroforética GNA 100 (Pharmacia Biotech, Suecia) acoplada a la fuente de electroforesis EPS 301 (Amersham Biosciences, Suecia), se ajustó a una diferencia de potencial de 110 V con una intensidad de corriente de 90 mA durante 45 minutos. Se empleó como patrón de peso molecular la escalera de 50 pb (PROMEGA, MADISON, WI, EUA), como colorante de corrida electroforética 5X Green GoTaq Flexi Buffer (Promega, Madison, Wi, EUA) y Bromuro de Etidio (1 μg/mL) como agente intercalante del ADN (Anexo 2). III.3.3 PCR para T. pallidum subespecie pallidum La PCR se realizó a partir de una mezcla de reacción para volúmenes finales de 25 μL, conteniendo 2,5 μL de tampón PCR 10X; 0,5 μL de una mezcla de dNTP (10mM); 2,5 μL de colorante de corrida 10X; 2,5 μL de cada cebador (10 μM); 0,125 μL de Taq et polimerasa (5U/μL) (QIAGEN, Alemania); 5 μL de la muestra de ADN y suficiente cantidad de agua ultrapura estéril. Como control positivo se utilizó ADN de T. pallidum cepa Nichols, donado por el Prof. Jorgen Jensen del Instituto Estatal del Suero de Dinamarca, y como control negativo agua ultrapura estéril. Los cebadores utilizados para la amplificación se describen en la tabla 2. Tabla 3.2 Secuencias de los cebadores utilizados para la PCR que amplifica un fragmento del gen polA de T. pallidum Nombre del cebador Secuencia 5’- 3’ Gen diana Talla del amplicón (pb) F1 TGCGCGTGTGCGAATGGTGTGGTC (24 bases) DNA polimerasa I (polA) 377 R1 CACAGTGCTCAAAAACGCCTGCACG (25 bases) Referencia Liu et al., 2001 Los cebadores fueron sintetizados por el Centro de Ingeniería Genética y Biotecnología (CIGB) de La Habana, Cuba. La amplificación del ADN se realizó en un termociclador "Mastercycler personal" (Eppendorf, Alemania), utilizando una desnaturalización inicial a 94ºC por cinco minutos, seguido de 40 ciclos de desnaturalización a 94ºC por 30 segundos, hibridación a 60ºC por 30 segundos, extensión a 72ºC por un minuto; con una extensión final a 72ºC durante cinco minutos, según el informe original de Liu et al., 2001. Para la visualización de los productos de PCR se realizó el mismo procedimiento descrito anteriormente en el acápite III.2.2. Como patrón de peso molecular se utilizó la escalera de 100 pb (Promega, Madison, Wi, EUA). III.4 Subtipaje molecular de T. pallidum La subtipificación se basó en la amplificación de un fragmento del gen arp para identificar el número del subtipo a partir del número de repeticiones de dicho fragmento en el gen, y en la amplificación por una PCR anidada de un fragmento del gen tpr con posterior digestión enzimática para la determinación de la letra del subtipo según el patrón electroforético obtenido. Para ello se siguió el informe original de Pillay et al., 1998. Los extractos de las muestras que resultaron positivos por la PCR para el gen polA, se sometieron paralelamente a PCR para la amplificación de fragmentos de los genes mencionados anteriormente. Las secuencias de los cebadores utilizados, sintetizados en el CIGB, se muestran en la tabla 3. Tabla 3.3 Secuencias de los cebadores utilizados para la subtipificación molecular de T. pallidum Nombre del cebador Secuencia 5’- 3’ ARP-1 CAAGTCAGGACGGACTGTCC (20 bases) ARP-2 GGTATCACCTGGGGATGC (18 bases) B1 ACTGGCTCTGCCACACTTGA (20 bases) Gen diana Talla del amplicón (pb) arp 60 2 186 A2 CTACCAGGAGAGGGTGAAGC (20 bases) IP6 CAGGTTTTGCCGTTAAGC (19 bases) tpr 1 836 IP7 AATCAAGGGAGAATACCGTC (20 bases) III.4.1 Determinación del número de repeticiones del gen arp Para ello se realizó una PCR cuya mezcla de reacción se preparó en un volumen final de 25 µL, conteniendo 2,5 μL de tampón PCR 10X; 0,5 μL de la mezcla de dNTP (10mM); 2,5 µL de colorante de corrida 10X; 2,5 μL de cada cebador (10 μM); 0,125 μL de Taq polimerasa (5U/μL) (QIAGEN, Alemania); 5 μL de la muestra de ADN y suficiente cantidad de agua ultrapura estéril para completar volumen. La amplificación se realizó según se informa por Pillay et al., 1998: desnaturalización inicial a 94ºC por 4 minutos, seguido de 45 ciclos de desnaturalización a 94ºC por un minuto, hibridación a 62ºC por un minuto, extensión 72ºC por un minuto y la extensión final consistió en un ciclo de 72 ºC por siete minutos. Para la visualización de los productos de amplificación se realizó una electroforesis submarina en gel de agarosa según se describió previamente en acápite III.2.2. Se empleó como patrón de peso molecular la escalera de 1kb y 100 pb (Promega, Madison, Wi, EUA). En dependencia del número de repeticiones del fragmento de 60-pb presentes en el gen arp varió la talla del producto amplificado, la que se determinó a partir del amplicón obtenido por la cepa de referencia (Nichols) de 1 155 pb y que equivale a 14 repeticiones, según Pillay et al., 1998. En la tabla 4 se muestran las tallas aproximadas conocidas e informadas y el número de repeticiones estimadas para ellas. El número que identifica el subtipo se corresponde con el número de repeticiones estimadas. Tabla 3.4 Determinación del subtipo de acuerdo al número de repeticiones en el gen arp según la talla de los amplicones Talla del Número de amplicón repeticiones del (pb) fragmento en el gen arp 735 7 915 10 1099 13 1155 14 1220 15 1274 16 1495 20 1553 21 III.4.2 Análisis por PCR-RFLP de los genes tpr A cada extracto de ADN se le realizó una primera PCR para amplificar un fragmento de 2 186 pb del gen tpr. La mezcla de reacción se preparó para un volumen final de 25 µL, conteniendo 2,5 µL del tampón de la enzima (10X), 0,5 µL de la mezcla de dNTP (10mM), 1,25 µL de los cebadores F3 y R3 (10 μM), 0,125 µL de la enzima Top Taq polimerasa (5U/µL), 5 µL de ADN y suficiente cantidad de agua ultrapura para completar el volumen. El programa de amplificación se realizó según Pillay et al., 1998, con las modificaciones propuestas por Flasarová et al., 2012: desnaturalización inicial a 94ºC por cinco minutos, seguido de 35 ciclos de desnaturalización a 94ºC por 1 minuto, hibridación 64ºC por 1 minuto, extensión a 72ºC por 1 minuto; y luego una etapa de extensión final a 72ºC por cinco minutos. Al producto de amplificación de esta PCR se le realizó una segunda PCR para la amplificación de un fragmento interno de 1 836-pb, cuya mezcla de reacción difirió de la anterior en los cebadores utilizados, en este caso se empleó IP6 y IP7 y como muestra de ADN se añadieron 5 µL del producto amplificado anteriormente. Para la amplificación se realizó una desnaturalización inicial a 94ºC por cinco minutos, seguido de 45 ciclos de desnaturalización a 94ºC por 1 minuto, hibridación a 64ºC por 1 minuto, extensión a 72ºC por 1 minuto; y luego una etapa de extensión final a 72ºC por cinco minutos (Flasarová et al., 2012). Los amplicones obtenidos de esta segunda etapa de PCR se digirieron individualmente con la endonucleasa de restricción MseI, en una mezcla que tenía como volumen final 31 µL. Se utilizaron 2 µL del tampón R (10X), 1 µL de la enzima MseI (ThermoScientific, EUA), 10 µL de los productos de PCR y suficiente cantidad de agua ultrapura para completar volumen. Los fragmentos de restricción fueron separados por electroforesis en gel de agarosa al 2% a 100 V, con una intensidad de corriente de 90 mA por una hora. Se empleó como patrón de peso molecular la escalera de 100 pares de bases (Promega, Madison, Wi, EUA), como colorante de corrida electroforética 5X Green Go Taq Flexi Buffer (Promega, Madison, Wi, EUA) y bromuro de etidio (1 μg/mL) como agente intercalante del ADN. III.4.2.1 Análisis de los patrones de restricción obtenidos para el gen tpr Para la identificación del subtipo de las muestras en estudio según los patrones de restricción obtenidos se compararon los mismos con los descritos en la figura 3.1 y tabla 3.5. Figura 3.1 Representación esquemática de patrones de restricción obtenidos por RFLP con la enzima MseI del gen tpr de T. pallidum (donada gentilmente por el Dr. Etienne Mueller del Centro para VIH e ITS, del Instituto Nacional de Enfermedades Comunicables en Johannesburgo, Sudáfrica). Tabla 3.5 Subtipos de T. pallidum atendiendo a las tallas de los fragmentos obtenidos por PCR-RFLP del gen tpr (TruI esquisómero de MseI) (donado gentilmente por el Dr. Etienne Mueller del Centro para VIH e ITS, del Instituto Nacional de Enfermedades Comunicables en Johannesburgo, Sudáfrica) III.5 Determinación de la resistencia de T. pallidum a macrólidos Para la detección de las mutaciones en las posiciones A2058G y A2059G en el gen ARNr 23S, responsables de la resistencia a macrólidos en T. pallidum dado un cambio en la secuencia génica de adenina por guanina, según informes de Mueller et al., 2012, se realizó una PCR seguida de ensayos con enzimas de restricción. Los cebadores utilizados para la PCR, según informó Lukehart et al., 2004, se describen en la tabla 6. Tabla 3.6 Secuencia de los cebadores para la PCR de resistencia que amplifica un fragmento de 629 pb Nombre del cebador Secuencia 5’- 3’ F5 GTACCGCAAACCGACACAG (19 bases) R5 AGTCAAACCGCCCACCTAC (19 bases) Gen diana Talla del amplicón (pb) ARNr 23S 629 La mezcla de reacción se realizó para 25 μL como volumen final, conteniendo, 5 μL de tampón PCR 10X; 0,5 μL de la mezcla de dNTP (10mM); 1,5 μL de cada cebador (10 μM); 0,125 μL de Taq polimerasa (5U/μL) (QIAGEN, Alemania); 5 μL de la muestra de ADN y suficiente cantidad de agua ultrapura estéril para completar el volumen. La amplificación del ADN se realizó en un termociclador "Mastercycler personal" (Eppendorf, Alemania), utilizando una desnaturalización inicial a 93ºC por tres minutos, seguido de 40 ciclos de desnaturalización a 93ºC por 1 minuto, hibridación a 62ºC por 1 minuto, extensión a 72ºC por un minuto; con una extensión final a 72ºC durante 10 minutos, según Mueller et al., 2012. Los productos de PCR se visualizaron mediante electroforesis submarina en gel de agarosa al 1% empleando las mismas condiciones descritas anteriormente. Se empleó como patrón de peso molecular la escalera de 100- pb (Promega, Madison, Wi, EUA). La digestión enzimática de los amplicones obtenidos del ARNr 23S se realizó usando las enzimas Mbo II (para la mutación A2058G) y Bsa I (para la mutación A2059G). Las mezclas para la digestión enzimática con la enzima MboII se realizaron para un volumen final de 10 µL; compuesta por 1 µL de tampón de la enzima (10X); 0,1 µL de BSA (10X); 1 µL de la enzima MboII; 6 µL de los productos de PCR y suficiente cantidad de agua ultrapura para completar el volumen. Las mezclas se incubaron a 37ºC durante tres horas en un bloque térmico AccuBlockTM (Labnet International, Inc, Woodbridge, EUA). Para la enzima BsaI, las mezclas de reacción tenían igual composición, solo que se añadió la enzima BsaI; y la digestión se realizó a 56ºC durante cuatro horas utilizando el bloque térmico, para evitar la evaporación de la mezcla preparada para la digestión enzimática con la enzima BsaI. Los productos de las digestiones enzimáticas se visualizaron mediante electroforesis submarina en gel de agarosa al 2% como ya se describió anteriormente. Se empleó como patrón de peso molecular la escalera de 100 pb (Promega, Madison, Wi, EUA). Las muestras sin las mutaciones A2058G y A2059G mostraron una sola banda de 629 pb. Las muestras con la mutación A2058G mostraron dos fragmentos de restricción de 449 pb y 180 pb, y las muestras con la mutación A2059G resultan en fragmentos de 432 pb y 197 pb. III.6 Diagnóstico serológico de sífilis Las muestras de sueros de los pacientes involucrados en la investigación formaron parte del diagnóstico de rutina que se realiza en el laboratorio y se sometieron a la prueba VDRL (Centis, Cuba) o RPR (Centis, Cuba) como pruebas de pesquisa de sífilis y a la HATP (Centis, Cuba) como prueba confirmatoria. Las mismas se realizaron según las orientaciones del fabricante. III.7 Análisis estadístico Los resultados se introdujeron en una base de datos diseñada al efecto mediante el empleo del programa Excel (Microsoft Office). A partir de la encuesta epidemiológica se describieron diferentes variables plasmadas en la misma relacionándolas con los resultados de laboratorio obtenidos. Se emplearon medidas de estadística descriptiva como frecuencias absolutas y porcentajes. III.8 Consideraciones éticas de la investigación Se cumplieron las medidas de bioseguridad establecidas para el trabajo, la manipulación del microorganismo y las muestras clínicas, según los niveles de riesgo establecidos por la Comisión Nacional de Seguridad Biológica en la Resolución 38/2006 (CITMA, 2006). La información de la investigación se conservó con carácter confidencial. No se reveló la identidad de los individuos que proporcionaron las muestras clínicas para el estudio. Los resultados de las pruebas de laboratorio se enviaron al médico de asistencia que solicitó los análisis, y se utilizó por el equipo de investigación con fines científicos. Los individuos involucrados en la investigación, conocieron los resultados de las pruebas de diagnóstico microbiológico evaluadas a través de su médico de asistencia. Ninguna de las labores planificadas en el presente trabajo atentó contra la integridad de los individuos involucrados, ellas facilitaron la confirmación de su infección por T. pallidum, lo que contribuyó a la aplicación oportuna y rápida de tratamiento específico, así como al control y prevención de nuevos casos en la comunidad. Se obtuvo el consentimiento informado de los individuos para participar de manera voluntaria y gratuita en el estudio correspondiente a la evaluación de la PCR convencional para confirmar el diagnóstico de sífilis, previa a la explicación en un lenguaje sencillo y claro de cómo se realizaría el mismo, su importancia y los beneficios que proporcionaría dicha evaluación. Los datos de los participantes se mantuvieron bajo estricta confidencialidad, solo accesibles a los investigadores partícipes en el estudio. En general, toda la información relacionada con esta investigación se encuentra en formato electrónico, conservada y protegida en el LNRE-IPK, donde se realizaron además copias (salvas) de la información. IV. Resultados y Discusión IV.1 Características demográficas de los pacientes incluidos en el estudio y muestras analizadas. En la presente investigación se analizaron 144 muestras clínicas de 107 pacientes, tomadas de distintos sitios anatómicos en dependencia de la ubicación de las lesiones. El 59,8% (64/107) de los pacientes eran seropositivos al VIH y el 40,2% (43/107) seronegativos hasta el momento en el que se le realizó la toma de muestra. De estos individuos el 98,1% (105/107) correspondían al sexo masculino y de ellos el 74,3% (78/105) manifestaron ser hombres que tienen sexo con hombres (HSH). El 1,9% (2/107) restante se correspondía con el sexo femenino. El rango de edad osciló entre 15 y 64 años, con una media de 31 año, que se corresponde con la edad sexualmente activa. Como se puede constatar la mayoría de los pacientes son seropositivos al VIH. Es conocido que en pacientes donde se ha informado la coinfección sífilis-VIH el diagnóstico serológico no treponémico de la sífilis puede traer dificultad, particularmente en individuos con bajo conteo de linfocitos CD4, ya que estos pueden presentar síntomas atípicos tales como la ulceración herpetiforme, que puede dificultar la impresión diagnóstica (Pope et al., 2005), por ello la necesidad de pruebas de diagnóstico directo. El problema de la sífilis es más grave en la era del VIH, debido a que las úlceras genitales aumentan la probabilidad de contagio del virus (Palmer et al., 2003). El 79,2% (114/144) de las muestras clínicas estudiadas procedían de lesiones genitales, el 11,1% (16/144) de lesiones orales, el 6,2% (9/144) de lesiones anales, el 2,8% (4/144) de lesiones en piel y el 0,7% (1/144) de lesión en el cuero cabelludo. IV.2 Detección molecular de T. pallidum en las muestras clínicas La amplificación exitosa de una región de interés es dependiente de la calidad y cantidad del ADN templado. Este último tiene que estar libre de inhibidores potenciales de las ADN polimerasas. Frecuentemente los inhibidores lo constituyen restos de reactivos comúnmente usados en la purificación de ácidos nucleicos o restos del material de partida. Estos incluyen sales, proteasas, guanidina, solventes orgánicos y duodecil sulfato de sodio (SDS, de sus siglas en inglés: Sodium Duodecil Sulphate) (Martin et al., 2010). El método de extracción utilizado permitió extraer ADN de calidad y en cantidades suficientes para ser detectado por la PCR. Se comprobó la ausencia de inhibidores en los extractos pues en las PCR de β-globina no se detectaron fallas de amplificación, lo que corroboró la presencia de ADN de células del hospedero y la selección adecuada de las muestras para el estudio molecular. La región polA de T. pallidum presenta características únicas que la diferencian de otros microorganismos al mostrar baja homología con regiones similares en estos, así como la presencia de cuatro inserciones en el gen (Agerón et al., 2015). Precisamente por las características de esta región es que se prefiere para la amplificación y detección por PCR. La ADN polimerasa I es una enzima importante que se encuentra involucrada en la replicación y reparación del ADN, su secuencia ha sido descrita y conservada entre microorganismos, especialmente en los dominios funcionales. Contiene 24 cisteínas representando el 2,4% del total de aminoácidos (Liu et al., 2001). Otros genes de T. pallidum, como el de la proteína de 47 kDa, tienen funciones desconocidas o pobremente caracterizadas y como T. pallidum tiene un genoma relativamente conservado, estos genes pueden tener inserciones o deleciones según se ha informado en artículos recientes de heterogeneidad entre especies de T. pallidum (Ej. genes arp, tpr); afectando la especificidad de los resultados por la PCR (Smajs et al., 2012). La PCR dirigida al gen de la proteína de 47kDa se ha descrito ampliamente para detectar T. pallidum, mostrando sensibilidades similares a la prueba de infectividad en conejos en muestras de úlceras genitales y sangre total (Marfin et al., 2001); sin embargo, recientemente se informa que la PCR que amplifica el gen polA presenta mayor sensibilidad (95,8%) en muestras de lesiones genitales (García et al., 2011). La amplificación del fragmento deseado (gen polA), de aproximadamente 377 pb, a partir del ADN control de la cepa Nichols de referencia permitió comprobar que los cebadores seleccionados, así como la composición de la mezcla de reacción y programa de amplificación permiten amplificar la región de interés según se ha descrito con anterioridad por otros autores (Behrhof et al., 2012; Chi et al., 2015), según se muestra en la figura 4.1. Figura 4.1 Electroforesis submarina en gel de agarosa al 2% de los productos amplificados por PCR convencional del gen polA de T. pallidum. Líneas 1 y 11: patrones de peso molecular escalera 100 pb; línea 2: control positivo (ADN de cepa de referencia Nichols), línea 10: control negativo (agua ultrapura estéril); líneas 3 al 9: resultados de la amplificación a partir de los extractos de ADN de las muestras en estudio. De las muestras evaluadas en el estudio el 27,1% (39/144) resultaron positivas por la PCR; de estas, el 94,9% (37/39) procedían de pacientes con sospechas de sífilis primaria y el 5,1% (2/39) de sífilis secundaria. En cuanto a la positividad según pacientes, el 28,9% (31/107) de los individuos tuvo PCR positiva. Los porcentajes de positividad, tanto según muestras como pacientes, son inferiores a los informados en la literatura, lo cual podría estar dado por concentraciones bacterianas bajas en la lesión y el límite de detección de la PCR empleada. Los estudios que han mostrado resultados superiores utilizaron como herramienta diagnóstica otras variantes de PCR más sensibles como: PCR en tiempo real o PCR anidada (Liu et al., 2001; Flasarová et al., 2012; Chen et al., 2013). De acuerdo a la ubicación anatómica de las muestras clínicas estudiadas el 21,9% (25/114) de las genitales resultaron positivas por la PCR, el 50% (8/16) de las lesiones orales, 44,4% (4/9) de las anales y 50% (2/4) de las de piel. En la lesión del cuero cabelludo no se detectó la presencia de ADN de T. pallidum. Los resultados correspondientes a pacientes con lesiones en piel sugerentes de sífilis secundaria son similares a los encontrados en una investigación realizada en Colombia, en la cual se analizaron 12 muestras procedentes de lesiones en piel, obteniéndose 66% (9/12) de positividad con respecto al total de muestras que resultaron positivas para la PCR (Cruz et al., 2010). Sin embargo, se diferencian de los resultados informados en un estudio realizado en Paris, Francia en el que se obtuvo 35% (103/294) de positividad a pesar de emplear una técnica de biología molecular más sensible, comparando los resultados con pruebas inmunohistoquímicas, y es notable que el tamaño de muestras incluidas en el estudio fue superior al del actual estudio (Grange et al., 2012). En otro estudio, realizado en Francia, se obtuvieron resultados superiores al obtener 75% de positividad. Es de destacar que el número de muestras analizadas fue también limitado; de un total de 12 biopsias realizadas para obtener los ponches de las lesiones en piel, nueve fueron identificados por la PCR y comparados con ensayos serológicos e inmunohistoquímicos, confirmando los resultados obtenidos por PCR (Buffet et al., 2007). Es válido mencionar que en los estudios más recientes y dirigidos a la detección del gen polA en T. pallidum para la confirmación de sífilis secundaria, las técnicas moleculares utilizadas son más sensibles y cuentan con un mayor límite de detección; además ventajosamente se escoge como muestra la sangre en vez de utilizar biopsias de piel, ya que en este estadio la infección adquiere carácter sistémico y existe mayor probabilidad de encontrar alta carga bacteriana en sangre, debido a que ocurre una diseminación y proliferación de T. pallidum por todo el cuerpo, trasladándose de esta manera al sistema nervioso central mediante diseminación por vía hematógena o a través del sistema linfático (Miklossy, 2012). Uno de los estudios realizados en Sur América, específicamente en la ciudad de Cali en Colombia, sugiere la utilización de muestras de sangre en los casos de sífilis secundaria no tratada para PCR cuantitativa, con una sensibilidad de 15 y 150 espiroquetas/mL; de las 26 muestras de sangre analizadas, en el 46% (11/26) se detectó ADN de T. pallidum (Cruz et al., 2010). La prueba utilizada en la presente investigación es una PCR convencional o a punto final para la que se reconoce menor sensibilidad en relación a las PCR anidadas y PCR en tiempo real; no obstante, permitió la detección de la infección en el 50% de los casos. El diagnóstico de la sífilis está basado en la presentación clínica de los casos o antecedentes epidemiológicos y en ensayos no específicos de laboratorio, con confirmación en la serología treponémica (Gracia et al., 2011). Uno de los problemas que enfrenta el diagnóstico serológico es la ocurrencia de falsos positivos en pruebas no treponémicas (VDRL/RPR) en estadios tempranos de la enfermedad como la sífilis primaria (Rodríguez et al., 2013). Estas pruebas tienen como inconveniente una elevada ocurrencia de reacciones falsas positivas; que en ocasiones son el primer indicio de una enfermedad sistémica de tipo inmunológica (Rodríguez et al., 2006). La sensibilidad de estas pruebas varía para los casos de sífilis primaria: VDRL/RPR (70-80%) y TPHA (70-80%). Una respuesta serológica por la presencia de T. pallidum usualmente tarda 1-4 semanas para desarrollarse, y es normalmente presentada en el tiempo en el que se muestra el chancro sifilítico o lesión primaria. La detección serológica temprana monitorea el comienzo de una respuesta de IgM; sin embargo, este monitoreo serológico falla en un 30% de los casos de sífilis primaria. Otro de los problemas que enfrenta el diagnóstico serológico de la sífilis es cuando se presenta una coinfección con el VIH, ya que en estos pacientes la carga baja de linfocitos CD4 influye en los resultados serológicos, así como la liberación de reaginas a sangre producto de la invasión del virus a otras células, reaginas que son detectadas por las pruebas serológicas no treponémicas. De los 31 pacientes que se diagnosticaron por PCR con sífilis primaria o secundaria, el 22,6% (7/31) resultó negativo tanto para la serología no treponémica (VDRL/RPR) como treponémica (TPHA). Estos pacientes manifestaron no tener ningún antecedente de ITS, incluyendo sífilis, aunque en uno de los casos la pareja un año atrás fue diagnosticado con sífilis. La aparición de las lesiones en estos, tanto orales como genitales referentes a manifestaciones clínicas de la sífilis primaria, ocurrieron en un periodo de 2 días a 3 semanas. Para estos casos es de esperar la no detección de anticuerpos ya que estos comienzan a ser detectables en un periodo superior a los 20 días aproximadamente, luego de la aparición del chancro sifilítico (Gayet-Ageron et al., 2013). Es necesario destacar que el tiempo aproximado que transcurre desde la aparición del chancro hasta el estadio de sífilis secundaria es de 4 a 10 semanas (Ho & Lukehart, 2011), y debido a que las pruebas serológicas son tan inespecíficas para el diagnóstico temprano de la sífilis primaria, es necesario contar con pruebas más sensibles y específicas que garanticen un diagnóstico precoz y directo de la enfermedad en este estadio; sobre todo, porque la sífilis en su etapa primaria se puede confundir clínicamente con otras enfermedades de origen sexual, que provocan la aparición de lesiones en genitales y áreas extragenitales. De los siete pacientes con resultados serológicos negativos y PCR positiva, el 71,4% (5/7) eran pacientes coinfectados con VIH. En estos casos es fundamental disponer de un diagnóstico efectivo en etapas tempranas de la sífilis, ya que estos pacientes pueden presentar modificaciones en la evolución clínica de la enfermedad, resultando confusa la impresión diagnóstica de la sífilis; además pueden resultar falsos biológicos positivos y negativos por serología, debido al compromiso del sistema inmune por parte de la infección con el VIH. En los pacientes seropositivos al VIH es más rápida la progresión a neurosífilis que en los seronegativos, lo que puede conllevar a problemas con el tratamiento propuesto en etapas avanzadas de la sífilis, por lo que el correcto diagnóstico en etapas tempranas depende de la disponibilidad de pruebas más sensibles, como la utilizada en el presente estudio. Del 71% (76/107) de los casos clínicos que resultaron negativos a la detección de ADN de T. pallidum por PCR, al 19,7% (15/76) no se les pudo realizar las pruebas serológicas debido a que las muestras de suero no fueron entregadas al Laboratorio Nacional de Referencia de Espiroquetas del IPK. Se conoce que a estos pacientes se le diagnosticó por técnicas de Biología Molecular la presencia del Virus del Herpes Simple tipo 2 (VHS-2) a partir de las mismas muestras (dato no mostrado); además estaban coinfectados con VIH, por lo que se puede hipotetizar que en estos casos pudo no haber existido una falla de la PCR para la detección de T. pallidum sino que las lesiones de estos pacientes se correspondía con las del VHS-2, a pesar de que las úlceras fueran sugerentes de sífilis. Recientemente se ha descrito que en pacientes con VIH las lesiones genitales provocadas por microorganismos y agentes virales causantes de alguna ITS, pueden tener un aspecto diferente a las manifestaciones clínicas de la ITS que se trate, por lo que en esos casos la impresión diagnóstica por el personal médico suele ser difícil y poco concluyente (Mehta et al., 2012). De los casos con resultados negativos por la PCR convencional para la detección de la región polA, a dos de ellos se les realizaron biopsias en diferentes áreas de la piel según las localizaciones de las lesiones sugerentes de sífilis, así como las pruebas serológicas no treponémicas y treponémicas. En ambos casos se obtuvo títulos elevados por serología no treponémica (VDRL/RPR) de 64 y 512 diluciones, con confirmación en la serología treponémica (TPHA), lo que apoya el diagnóstico de sífilis. El resultado negativo por PCR pudo estar dado por la sensibilidad de la prueba y la carga bacteriana en las muestras tomadas. Es importante mencionar que para uno de los pacientes se tomó también muestra de una lesión ulcerada oral para la que se obtuvo amplificación del fragmento de ADN deseado, por lo que podría tratarse de un paciente con sífilis primaria en el que comenzaban a concomitar lesiones del estadio secundario (con baja carga bacteriana), evolución clínica frecuente en pacientes seropositivos al VIH. Lamentablemente no se cuenta con pruebas inmunohistoquímicas como alternativa para comprobar la presencia de treponemas en la muestra de piel, ya que para este tipo de muestra se sugiere la combinación de técnicas moleculares sensibles para la detección de T. pallidum con los ensayos histoquímicos de biopsias. A partir de esta combinación se ha informado la presencia de T. pallidum en el 92% de los casos diagnosticados con sífilis secundaria realizadas en otros estudios (Buffet et al., 2007; Cruz et al., 2010). El otro caso, con resultado negativo por PCR y resultados serológicos positivos (VDRL 512 diluciones), se correspondía a un paciente seropositivo al VIH en fase SIDA, cuya lesión se tomó del cuero cabelludo, localización anatómica no común en casos de sífilis, por lo que quizá la causa etiológica era otra. En la literatura científica revisada no se informan lesiones de sífilis (primarias o secundarias) en cuero cabelludo. Un estudio realizado en Alemania sugiere para los casos de sífilis secundaria, la realización de técnicas moleculares a muestras obtenidas de lesiones en piel pero embebidas en parafina, garantizando de esta manera que no ocurra degradación del ADN en las muestras, y que se puedan obtener resultados más efectivos; aunque también sugieren la combinación del uso de técnicas moleculares con pruebas histoquímicas para un diagnóstico certero. De los 36 casos analizados en ese estudio, el 39% (14/36) resultó corresponder a casos de sífilis secundaria con confirmación serológica (Behrhof et al., 2007). De los 107 pacientes incluidos en el estudio y de los cuales se analizaron 144 muestras clínicas; 19 de estos pacientes presentaron resultados negativos por la PCR que detecta el gen polA de T. pallidum pero sin embargo en todos los casos hubo serología reactiva por las pruebas no treponémicas (VDRL/RPR) y treponémicas (TPHA). El 94,7% (18/19) de estos casos correspondió a pacientes con úlceras genitales y anales sugerentes al chancro primario, según la impresión diagnóstica. De estos pacientes el 16,7% (3/18) refirió estar administrando azitromicina, rosefín y tetraciclina 15 días antes de acudir a la consulta, por lo que esto es un factor a tener en cuenta que pudo intervenir en la detección molecular de ADN de T. pallidum ya que disminuyó la carga bacteriana en la lesión, a pesar de ello por las pruebas serológicas no treponémicas se detectó carga bacteriana debido a que esta prueba detecta una respuesta inmunológica a partir de la tercera semana de la post-infección y al igual que la prueba treponémica es una respuesta que se mantiene constante en el tiempo. En otros dos casos, se obtuvieron resultados de serología reactiva por la prueba treponémica y no reactivo por la prueba no treponémica, lo cual se refiere a una infección pasada no a un caso propio de sífilis ya que las pruebas treponémicas detectan anticuerpos a partir de la semana cinco de la postinfección y se mantiene constante en el tiempo aún luego de haber sido tratada la enfermedad, estos casos resultaron estar co-infectados con VHS-2 y VIH, por lo se trataba de lesiones herpéticas ocasionadas por el VHS-2 y no por T. pallidum (dato no mostrado). El resto de los casos refirió que el tiempo de aparición de la lesión osciló entre los 6 días a las 12 semanas, lo cual refiere que a partir de la cuarta semana de aparición de la lesión la carga bacteriana disminuye, siendo detectable solo por serología o por técnicas de biología molecular más sensibles que la utilizada en la actual investigación. A pesar de los resultados negativos por la PCR convencional, es necesario aclarar que estos no descartan la infección; sin embargo, la positividad encontrada fundamentalmente en los casos de sífilis temprana es de extrema importancia para la confirmación de los mismos, pues durante este estadio de la enfermedad el diagnóstico por la técnicas serológicas de rutina no es concluyente; ello favorecería el tratamiento inmediato de estos casos. La utilidad de esta técnica consiste en dilucidar casos que sean complejos y dudosos, especialmente en los que se sospecha sífilis primaria, donde las características clínicas de la enfermedad pueden confundirse con las de otros patógenos causantes de úlceras, fundamentalmente genitales, y en casos de coinfección con VIH donde las manifestaciones clínicas de la sífilis primaria puede variar; por lo que la aplicación de esta técnica de biología molecular es complementar el diagnóstico de laboratorio de la infección y no sustituir el diagnóstico serológico actual. 4.3 Caracterización molecular de T. pallidum mediante la detección por PCR de las familias génicas arp y tpr El diagnóstico efectivo de la sífilis no solo depende de su detección temprana a partir de herramientas moleculares sensibles que permitan la selección de un adecuado tratamiento para la eliminación de la enfermedad, sino también de un monitoreo epidemiológico molecular, que permita distinguir entre los subtipos de T. pallidum más frecuentes según la región en estudio, su asociación con determinados cuadros clínicos y resistencia a macrólidos; logrando de esta manera una caracterización molecular del agente causal de la sífilis. Estudios recientes en diferentes países han propuesto la caracterización molecular de T. pallidum a partir de la determinación de los patrones obtenidos por la detección del gen arp, repetido en pequeñas secuencias en tándem en el genoma bacteriano con una talla de 60 pb, y que hasta el momento no tiene una función bien dilucidada. En combinación con estos patrones obtenidos por disposición de la familia génica arp en el genoma bacteriano, se ha estudiado la familia génica del gen tpr, que también permite la caracterización molecular de T. pallidum. Actualmente se sugiere que algunos genes pertenecientes a esta familia génica, pueden estar involucrados en los mecanismos de evasión del reconocimiento del sistema inmune en la sífilis latente y la ocurrencia de la persistencia bacteriana, mediante mecanismos de variabilidad genética de esta familia (La Fond & Luckhart, 2006). Por tanto, la caracterización molecular de T. pallidum, constituye sin dudas, una herramienta efectiva para el control epidemiológico de la sífilis. 4.3.1 Reacción en cadena de la polimerasa del gen arp De los 31 pacientes a los que se le detectó ADN de T. pallidum en las muestras tomadas, a partir de la detección del gen polA por PCR, solamente se encontró suficiente cantidad de ADN para la subtipificación del gen arp en 28 muestras, representando el 90,3% (28/31) de los casos en estudio. El gen arp contiene una región variable que presenta secuencias de 60 pb repetidas. La PCR se realizó evaluando los cebadores ARP-1 y ARP-2, a partir del ADN de la cepa de referencia Nichols de T. pallidum, resultando en un amplicón de una talla de 1 155 pb, el cual se corresponde con 14 repeticiones de las secuencias repetidas en tándem en el gen arp. Las tallas de los amplicones resultantes a partir de la amplificación del ADN de las 28 muestras clínicas evaluadas en el presente estudio, variaron desde 735 pb a 1 274 pb, correspondiéndose de 7 a 17 repeticiones, respectivamente. Los productos de PCR de las muestras más representativas se muestran en la figura 4.2. Figura 4.2 Electroforesis submarina en gel de agarosa al 1,5% de amplicones obtenidos por amplificación del gen arp. Línea 1: patrón de peso molecular (1kb); línea 2: muestra clínica correspondiente al subtipo 7; línea 3: muestra clínica correspondiente al subtipo 12; línea 5: muestra clínica correspondiente al subtipo 17; línea 5: muestra clínica correspondiente al subtipo 14; línea 7: control positivo (ADN de la cepa de referencia Nichols (subtipo 14). Basado en el número obtenido de repeticiones, fueron agrupadas las 28 muestras en 5 subtipos, los cuales fueron designados de acuerdo al número de repeticiones, según se ha informado en la literatura, estos subtipos obtenidos fueron: 7, 10, 12, 14 y 17 respectivamente. El subtipo que más se encontró fue el correspondiente a 14 repeticiones, el cual representó el 46,4% (13/28) de las muestras analizadas; el 25% (7/28) correspondió a 12 repeticiones; el 14,3% (4/28) a 10 repeticiones; el 10,7% (3/28) a 7 repeticiones y solamente el 3,6% (1/28) se relacionó con el subtipo correspondiente a 17 repeticiones. El hallazgo de encontrar los subtipos correspondientes a 14 y 12 repeticiones como los de mayor prevalencia está en correspondencia con los informes existentes a nivel internacional. 4.3.1.1 Polimorfismos de longitud de fragmentos de restricción (RFLP) del gen tpr A partir de las muestras que resultaron positivas a la presencia de ADN de T. pallidum, solamente fueron tipificables para la subtipificación del gen tpr 29 muestras realizándose un RFLP a las mismas, representando el 93,5 % (29/31) de los pacientes incluidos en el estudio con resultados positivos para la PCR que detecta el gen polA del agente causal de la sífilis, solamente 2 muestras no presentaron cantidades suficientes de ADN de la bacteria para examinar la heterogeneidad de la familia génica tpr y ser detectados de esta manera por la PCR y los ensayos de digestión enzimática con la enzima MseI. Al realizar el RFLP con la endonucleasa de restricción MseI a los productos obtenidos de la PCR que amplifica el fragmento de la familia génica tpr, se obtuvieron 3 patrones designados con las letras: a, d, f, según se muestra en la figura 4.3. Las diferencias entre los subtipos obtenidos por RFLP se basaron en la presencia o ausencia de fragmentos de ADN con una talla entre 300 pb y 830 pb. El patrón f se encontró en el 55,2% (16/29) de las muestras, seguido de los patrones a y d con un 20,7% (6/29) y un 24,1% (7/29) respectivamente. Los patrones por RFLP de los subtipos obtenidos se representan en la figura 4.3. Figura 4.3 Electroforesis submarina en gel de agarosa al 2% de los patrones obtenidos de PCR-RFLP con la enzima MseI del gen tpr. Línea 1: Patrón de peso molecular (escalera de 1kb); línea 2: muestra clínica correspondiente al subtipo a; línea 3: muestra clínica correspondiente al subtipo d; líneas 4 y 5: muestras clínicas correspondientes al subtipo f, línea 6: control positivo (ADN de cepa de referencia Nichols) correspondiente al subtipo a. 4.3.2 Distribución y prevalencia de los subtipos existentes en Cuba La Organización Mundial de la Salud ha informado que la cuarta parte de todos los casos que anualmente se informan de la infección con sífilis, ocurren en América Latina y el Caribe (Schmid et al., 2009). Estudios publicados recientemente brindan evidencias de que la sífilis venérea no es solo altamente endémica de algunas regiones sino que constituye una importante infección de transmisión sexual en regiones tropicales de América Latina (Clark et al., 2008). El actual estudio ha sido encaminado fundamentalmente a entender el comportamiento de la epidemiología molecular de la sífilis en Cuba. En el mismo se ha demostrado la existencia de una gran heterogeneidad genética en dos regiones diferentes del genoma del agente causal de la sífilis que permiten la diferenciación entre cepas de T. pallidum. A partir de la amplificación por PCR y el análisis por RFLP de estos dos marcadores genéticos diferentes se ha desarrollado un sistema que permite separar aislamientos de T. pallidum dentro de un largo número de subtipos diferentes, sentando de esta manera las bases para un estudio más exhaustivo y profundo de la epidemiologia molecular de la sífilis. Las tallas obtenidas en las regiones repetidas en el gen arp proveen el primer nivel para la diferenciación entre cepas y la subsecuente caracterización molecular según se mostró en la figura 4.2. En un segundo nivel de caracterización fue realizado el análisis por RFLP de los productos de PCR de la familia génica tpr, porque múltiples copias de estos genes están contenidos en el cromosoma de T. pallidum, existiendo disímiles variaciones en copias simples de estos genes. Los resultados reflejados en el presente estudio muestran una alta diversidad de aislamientos de T. pallidum, correspondiéndose con los subtipos que están presentes fundamentalmente en América del Norte y Asia, donde se ha informado que la sífilis suele ser una enfermedad altamente endémica; además los subtipos encontrados coinciden con los que más prevalecen en regiones con cercanía geográfica, tales como: EUA (Marra et al., 2010), Canadá (Martin et al., 2010), y Colombia (Cruz et al., 2010). Al combinar los resultados de la subtipificación por los ensayos de arp y tpr los subtipos que se identificaron fueron: 14f; 14d; 12f; 10f; 12a; 7f; 14a; 17d con índices de prevalencia de 21,4%; 17,8%; 14,3%; 14,3%; 10,7%; 10,7%; 7,1% y 3,6% respectivamente, sugiriendo la alta diversidad genética que existe entre las cepas de T. pallidum (figura 4.4), comparadas con Europa y Sudáfrica. Subtipos circulantes en La Habana, Cuba 25 21,4 17,8 20 15 Frecuencia de subtipos (%) 10 5 14,3 14,3 10,7 10,7 7,1 4 3 4 3 2 12a 14a 5 6 3,6 1 0 7f 10f 12f 14d 14f 17d Subtipaje de T. pallidum por la caracteriziación de los genes arp-tpr Figura 4.4 Prevalencia de los subtipos de T. pallidum encontrados en el estudio entre junio/2012 y abril/2015. Según los resultados mostrados anteriormente el subtipo encontrado con mayor frecuencia es el 14f (21,4%), el cual es de los que ha estado ampliamente distribuido en la región norte y sur de América. En un estudio realizado en los EUA en el estado de Arizona, el subtipo 14f tuvo una prevalencia de un 53,3% al analizar 45 muestras, valor superior al de la presente investigación (Sutton et al., 2001). Otra investigación llevada a cabo también en los EUA, pero en el Norte y Sur de Carolina, al analizar 28 muestras con suficiente ADN de T. pallidum por ambos métodos de subtipificación sugirió también que el subtipo que más predominaba era el 14f con una prevalencia de 52,2% (Pope et al., 2005). Este subtipo también ha sido informado con alta prevalencia en otras regiones del mundo distantes geográficamente; por ejemplo: en el norte, sur y este de China se ha encontrado con una frecuencia de 39%, 34% y 43% respectivamente, según se muestra en la figura 4.5 (Ho & Lukehart, 2011). Figura 4.5 Distribución de los subtipos encontrados en el estudio en comparación a lo informado en la literatura internecional (2000-2015). La relativa alta frecuencia del subtipo 14f sugiere, según se ha documentado en los diferentes estudios, que es el más transmisible respecto al resto de los subtipos encontrados (Peng et al., 2012). En la región de Latinoamérica, hasta la fecha según la literatura revisada, solo se ha realizado un estudio, específicamente en Colombia, en el cual se informó que los subtipos de mayor distribución son el 14d y 16d, ambos con 33,3% de prevalencia (Cruz et al., 2010). Estos resultados difieren con los encontrados en este trabajo, aunque el subtipo 14d fue el segundo en orden de prevalencia encontrado en el actual estudio (17,8%). Precisamente el subtipo 14d es otro de los subtipos de T. pallidum ampliamente distribuidos a nivel mundial, y por primera vez se da a conocer su circulación en Cuba. En una investigación llevada a cabo en los EUA se informó de la prevalencia de este subtipo en pacientes diagnosticados con sífilis en estadios primario y secundario, al emplear también muestras de lesiones en piel, área genital, oral y anal. Los resultados obtenidos en ese estudio reflejaron que la prevalencia del subtipo 14d era de 75,4%, valor superior al obtenido en esta investigación, pero hay que señalar que el número de muestras trabajados fue 69, superior a las analizadas en este trabajo (Katz et al., 2010). Es necesario tener en cuenta que la prevalencia de un subtipo u otro constituye un factor intrínseco de cada región, aunque evidentemente entre regiones cercanas debe existir similitud en cuanto a los subtipos que más circulan. El subtipo 14d también se ha visto distribuido a nivel mundial en países como Canadá (Martin et al., 2010), Sudáfrica (Pillay et al., 2002) y Reino Unido (Cole et al., 2009), los cuales refieren una prevalencia de 87,3%, 27,3% y 75,8% respectivamente. En cada uno de estos estudios el número de muestras estudiadas fue superior, por lo que podría existir mayor probabilidad de encontrar dicho subtipo. Un aspecto importante a tener en cuenta en la variabilidad de subtipos son las recientes migraciones a otros países, así como la entrada de personal extranjero al país. No se puede ignorar tampoco que las personas que practican el sexo transaccional constituyen un importante factor de riesgo en todos los países donde la sífilis es considerada una enfermedad de alta prevalencia; estos pudieran ser un canal de entrada para la alta variabilidad genética, encontrada en los diferentes subtipos distribuidos e informados en la presente investigación. Resulta interesante mencionar que en este estudio los subtipos 14d y 14f, los de mayor prevalencia, fueron encontrados fundamentalmente en pacientes infectados por el VIH, representando el 81,8% (9/11) de los casos notificados con estos subtipos; siendo el 72,7% (8/11) HSH, por lo que se puede estimar que los subtipos 14d y 14f prevalecen en pacientes coinfectados con VIH y en la población de HSH. Si se tiene en cuenta que el 72,2% de los casos diagnosticados con VIH en la población cubana corresponde a HSH (MINSAP, 2014), es de esperar relación entre pacientes HSH con VIH y este subtipo. Esta posible asociación existente entre los subtipos 14d/f y la condición VIH de los pacientes, ha sido señalada en solo un estudio realizado en EUA (Washington), en el cual este fue el principal subtipo y el de mayor prevalencia en pacientes coinfectados con VIH y que además eran HSH. En dicho estudio se señaló de que a pesar de que el subtipo 14d/f es el más distribuido en etapas variadas de la sífilis suele ser común, al menos en esta zona geográfica, en pacientes que presentan neurosífilis (Marra et al., 2010). El subtipo 14a no es de los más informados en la región; sin embargo, algunos autores lo refieren con una baja prevalencia; por ejemplo, en Phoenix, EUA tuvo una prevalencia de 4% (Ho & Luckehart et al., 2011). Las regiones en las que se informa con mayor prevalencia son Pretoria en Sudáfrica (Pillay, 2002; Molepo et al., 2007), Madagascar (Van Damme et al., 2009) y Portugal (Castro, 2009) con cifras de 54%, 15% y 65%, respectivamente. Estos resultados difieren de los obtenidos en el presente estudio. Se trata de regiones distantes geográficamente de Cuba y con las que existe aparentemente poco intercambio de personas o práctica del turismo, por lo que la probabilidad de su introducción en el país es menor. Ello no significa que no pueda existir una emergencia del mismo en América Latina y el Caribe, sino que hasta el momento no ha sido informado en la región con una alta prevalencia. En las investigaciones realizadas a nivel internacional se ha informado la circulación del subtipo 12f, específicamente en Phoenix y Baltimore, condados de los EUA. La frecuencia de este subtipo es menor en comparación a la de los subtipos 14d y 14f, siendo de 11% y 13%, respectivamente en los condados anteriormente mencionados (Ho & Lukehart, 2011), valores que se corresponden con los obtenidos en esta investigación. Hasta la fecha, según la literatura revisada y los resultados que se muestran en este trabajo, parece que T. pallidum subtipo 12f es exclusivo de América del Norte y el Caribe, aunque con baja prevalencia. Otro resultado interesante de la presente investigación es el hallazgo del subtipo 12a, el que se informa por primera vez en América Latina y el Caribe. Este subtipo solamente ha sido encontrado en China y en el estudio realizado en Phoenix, con una prevalencia baja de un 13% en este último (Van et al., 2009), resultado similar al obtenido en la presente investigación. En la figura 4.5 se representó el resto de los subtipos que fueron encontrados en el estudio actual como parte de la caracterización molecular de T. pallidum, donde se muestra el comportamiento de los subtipos 7f, 10f, 10d y 17d en Cuba con respecto a su circulación en otros países, demostrando la gran variabilidad genética de los aislamientos de T. pallidum identificados en las muestras clínicas analizadas en esta investigación. Aunque la frecuencia de circulación de estos subtipos es relativamente baja en comparación con otros subtipos encontrados en América Latina y el Caribe, en otras regiones se ha encontrado algunos de estos subtipos con prevalencias relativamente iguales a la informada en este trabajo. La prevalencia del subtipo 7f en este estudio es superior a la que se informa en una investigación realizada en regiones del este y sur de China, donde se informó un valor de 1% (Peng et al., 2011). Aparentemente la circulación de este subtipo en el continente americano es baja también, ya que hasta el momento ningún estudio ha informado la existencia del mismo. En el estudio realizado en Colombia, encaminado a caracterizar los aislamientos de T. pallidum en pacientes con lesiones características de sífilis secundaria, se encontró una gran variabilidad de subtipos que se informaron por primera vez en la región (es el primer estudio que se realiza); además de los subtipos 14d y 16d, se informaron el 13d y 22a. Es interesante como en la caracterización de aislamientos provenientes de un mismo estadio de la sífilis se encuentra una gran variedad de subtipos, sosteniendo ello el grave problema que representa la sífilis en el mundo actual. Los subtipos 10f y 17d han sido descritos fundamentalmente en el norte y sur de China con una prevalencia de 1% y 3%, respectivamente (Martin et al., 2009). En cambio, en Sudáfrica se ha dado a conocer que el subtipo 17d ha tenido una prevalencia mayor (13%) (Mueller et al., 2012). El subtipo 10f en la muestra de pacientes cubanos estudiados tuvo una prevalencia mayor a la informada en China; sin embargo, es similar con la dada a conocer en un estudio realizado en EUA (9%) (Pope et al., 2005). 4.4 Detección de las mutaciones A2058G y A2059G responsables de la resistencia a los macrólidos en el gen ARNr 23S Para el tratamiento de la sífilis es usado comúnmente a nivel internacional la penicilina G (Grange et al., 2012); sin embargo, durante los últimos 10 años se informa un incremento en el número de pacientes alérgicos a la penicilina. Ello unido a la poca conformidad de los pacientes para administrarse la dosis intramuscular de penicilina G benzatínica hacen que se requiera de tratamientos alternativos (Mateˇ jkova et al., 2009). La relativa baja toxicidad y el fuerte efecto bacteriostático de los macrólidos constituyen razones para el uso de la eritromicina y la azitromicina, así como de las tetraciclinas, para el tratamiento de la sífilis en sus diferentes etapas (Hook et al., 2010). A diferencia de la penicilina los macrólidos representan un riesgo de falla terapéutica en el tratamiento de la sífilis, debido a que se ha informado alta resistencia en T. pallidum codificada en el cromosoma bacteriano, trayendo consigo el subtipo resistente a los macrólidos, causado por un fenómeno de transición en el gen ARNr 23S que ocasiona un cambio de base [Adenina (A) por Guanina (G)] en dos posiciones diferentes del gen (posiciones 58 y 59) y por tanto, la presencia en el genoma de dos puntos de mutación, que le confieren resistencia a los macrólidos (Hook et al., 2002). Para Mycoplasma genitalium se han informado genotipos resistentes a eritromicina y espiramicina (macrólidos), con la presencia de las mutaciones A2058G y A2059G descritas en T. pallidum, del tipo microlesiones, con un cambio de A por G en una secuencia de nucleótidos del gen ARNr 23S del genoma bacteriano (Lucier et al., 1995). Debido a la presencia de estas dos mutaciones tanto en M. genitalium como en T. pallidum, en el presente estudio se realizó un primer ensayo con cepas de referencia de M. genitalium resistentes a los macrólidos con presencia de las mutaciones A2058G y A2059G, una cepa sensible de M. genitalium y la cepa de referencia Nichols de T. pallidum sensible también a los macrólidos, obteniéndose en las cepas resistentes de M. genitalium, luego de la digestión enzimática con las enzimas MboII y BsaI, amplicones de aproximadamente 100 pb y 200 pb, y en la cepa sensible de micoplasma un solo amplicón de 400 pb; en el caso de la cepa de referencia de T. pallidum se obtuvo un amplicón de 629 pb, correspondiéndose con las tallas informadas en la literatura (Martínez et al., 2006). Las condiciones para la realización de la PCR que amplifica el fragmento de 629 pb fueron optimizadas, obteniendo mejores resultados al emplear 0,2 µL de cada cebador (10 µM) en la mezcla de reacción. Utilizando estas condiciones se evaluaron las muestras positivas para la PCR que amplifica el gen polA de T. pallidum correspondientes a 31 pacientes, estudiando solo una de las muestras por paciente, en los casos donde se tomaron duplicadas. Solo una de las muestras no presentó suficiente ADN para ser detectado por la PCR que amplifica el fragmento interno de 629 pb. En la figura 4.6 se muestran los patrones obtenidos por amplificación del gen ARNr 23S, en las muestras donde no hay mutación se observa un único amplicón de 629 pb, y donde hay presencia de la mutación A2058G se observan dos fragmentos de restricción de 449 y 180 pb. Figura 4.6 Electroforesis submarina en gel de agarosa al 1% de la digestión enzimática con MboII de los productos amplificados por PCR para la detección de la mutación A2058G. Línea 1: patrón de peso molecular (100 pb); línea 2: ADN de cepa de referencia Nichols (sensible a los macrólidos); líneas 3 y 4: muestras clínicas sin la mutación A2058G; líneas 5, 6,7 y 8: muestras clínicas con la mutación A2058G. El 56,7% (17/30) de las muestras analizadas resultaron resistentes a los macrólidos, detectándose la mutación A2058G por los ensayos de digestión enzimática con la enzima MboII. Para estas muestras se obtuvieron dos amplicones con tallas de 449 pb y 180 pb, lo que indica la presencia de este punto de mutación. Sin embargo, no se detectó la mutación A2059G al realizar la digestión enzimática con BsaI, pues en todos los casos se obtuvo un solo amplicón correspondiente a 629 pb, lo cual indica la ausencia de este punto de mutación en el genoma de T. pallidum. Estos resultados revelan una alta prevalencia de la resistencia a macrólidos producto de la existencia del punto de mutación A2058G. El porcentaje de resistencia encontrado es superior en relación a otros estudios realizados a nivel internacional durante los últimos cinco años, en los cuales a pesar de utilizarse técnicas moleculares más sensibles los resultados obtenidos para la detección de la mutación A2058G fue de 52,1% (66/129) (Chen et al., 2013). En otros estudios, en los que la metodología realizada ha sido igual a la realizada en la presente investigación, se informó 18,2% (4/22) de casos resistentes a azitromicina en la República Checa (Mateˇ jkova et al., 2009) y 19,4% (7/36) en Canadá (Martin et al., 2010). Solo en un estudio realizado en los EUA, se obtuvo un resultado superior de 67,7 % (42/62) (Katz et al., 2007). Investigaciones realizadas en los últimos años sugieren que los pacientes coinfectados con VIH tienen la tendencia a incrementar el porcentaje de casos con fallos serológicos para el tratamiento de la sífilis (Horberg et al., 2010). Aunque la repercusión de la coinfección con VIH para el tratamiento terapéutico antibacteriano en pacientes con sífilis aún no está bien dilucidado, se piensa que existe una relación entre pacientes coinfectados con VIH y la presencia de cepas de T. pallidum resistentes a azitromicina (Marra et al., 2010). De las 17 muestras que resultaron resistentes a macrólidos, el 52,9% (9/17) resultó ser de pacientes coinfectados con VIH. Este resultado hace pensar en una posible relación entre subtipos resistentes de T. pallidum y la coinfección con VIH, y esto podría verse apoyado por las observaciones de algunos autores cuando han constatado que una respuesta satisfactoria a la terapia antirretroviral provoca una reducción en la velocidad de fallas serológicas para la sífilis en el 65% de los casos, disminuyendo la probabilidad de desarrollar neurosífilis, sugiriendo que la terapia antirretroviral puede mejoramiento en la respuesta inmune local contra T. pallidum traer un y un mejor control de la infección (Poliseli et al., 2008). De los pacientes en los que se detectó la mutación A2058G, uno manifestó haber recibido tratamiento con doxiciclina por otra causa una semana antes de acudir a la consulta y llevaba con la lesión genital solo dos días; se trataba además de un paciente seronegativo al VIH y coinfectado con el VHS-2 (dato no mostrado en el estudio). La doxiciclina, perteneciente al grupo de las tetraciclinas, es otro de los tratamientos alternativos que se utiliza para pacientes alérgicos a la penicilina, y hasta el momento no se han informado fallas terapéuticas con el mismo (Ho & Lukehart, 2011), aunque se informan mecanismos de resistencia comunes para los macrólidos y tetraciclinas en otros microorganismos como Neisseria gonorrhoeae, agente causal de la gonorrea (Lewis & Lukehart, 2011). Conociendo que el periodo de incubación de T. pallidum puede oscilar de 10 a 90 días a partir del contacto del hospedero con el microorganismo, resulta interesante que este antimicrobiano no hubiese tenido efecto sobre el proceso de infección treponémica y la aparición de la lesión. Este es uno de los antibióticos más usados a nivel internacional para el tratamiento alternativo de la sífilis, debido a que se administra por vía oral y porque se mantiene más tiempo circulando en sangre en comparación con los macrólidos. Este hallazgo de posible resistencia se podría apoyar en la existencia, en otros microorganismos, de un punto de mutación en el gen ARNr 16S de la unidad ribosomal 30S que trae consigo la resistencia a la doxiciclina (Stamm et al., 2010). La no detección de la mutación A2059G en las muestras estudiadas se corresponde con un estudio realizado en Sudáfrica en el cual no se obtuvo patrones de resistencia para esta mutación en los pacientes analizados diagnosticados con sífilis, aunque en el 3% de los casos se detectó la mutación A2058G, indicando niveles bajos de resistencia en esta región (Mueller et al., 2012). Algunos estudios han sugerido que la mutación A2059G en el gen ARNr 23S de T. pallidum está relacionada con aislamientos de pacientes con historial clínico de fallas en el tratamiento con espiramicina (Vester & Douthwaite, 2001), el cual constituye un macrólido de 16 átomos de carbono que actúa como inhibidor de la síntesis proteica (Calvo & Martinez-Martinez et al., 2009). Otros autores no concuerdan con este planteamiento y plantean que ambos puntos de mutación están relacionados igualmente con la resistencia a los macrólidos: azitromicina, eritromicina y espiramicina (Zhou et al., 2010). Sin embargo, los datos informados de la determinación de aislamientos resistentes a macrólidos producto de la mutación A2059G en diferentes regiones geográficas en la actualidad son escasos (Katz & Klausner, 2008; Wu et al., 2012), lo cual no indica la ausencia de casos de resistencia a los macrólidos, sino la no detección hasta el momento de este punto de mutación, responsable también de la resistencia a macrólidos. Este constituye el primer estudio que se realiza un Cuba y el segundo en América del Sur, en el cual se estudia la resistencia de aislamientos de T. pallidum a macrólidos; obteniéndose resultados elevados de resistencia, fenómeno que puede estar determinado debido a que la azitromicina es un medicamento frecuentemente utilizado para el tratamiento y prevención de un número elevado de infecciones no sifilíticas, de origen respiratorio y de infecciones de transmisión sexual causadas por Mycoplasma y Chlamydia trachomatis; lo cual podría incidir en el desarrollo de mecanismos de resistencia por T. pallidum (Marra et al., 2006). Uno de los principales problemas a enfrentar por la comunidad científica en el campo del tratamiento de la sífilis, debido a que T. pallidum no es cultivable in vitro, es la evaluación de nuevos grupos o líneas de antibióticos como alternativas terapéuticas; para ello sería necesario realizar ensayos en modelos animales a través de la inoculación de treponemas en testículos de conejos, procedimiento que es sumamente laborioso y que requiere de personal adiestrado. Igualmente será interesante la determinación de nuevos puntos de mutaciones que confieran resistencia a otros tratamientos alternativos como las tetraciclinas. Desde los comienzos de la epidemia del VIH/SIDA, ha existido un aumento significativo del VIH-1 en pacientes con sífilis. Desde el 2002, el CDC informó que el 25% de los casos de sífilis primaria y secundaria ocurre en personas infectadas con VIH, y la incidencia de sífilis en personas infectadas con VIH es mayor que en la población en general. El incremento en la incidencia de la sífilis en pacientes infectados con VIH se debe esencialmente a factores inmunológicos del hospedero y factores bacteriológicos (Workowski & Berman, 2010). La aparición del chancro sifilítico facilita la adquisición y transmisión del VIH por trastornos a las barreras epiteliales y mucosas (Greenblatt, 1988). Además, el influjo de células del sistema inmune aumenta en las lesiones sifilíticas el número de dianas celulares disponibles para la infección por VIH. Las lipoproteínas de T. pallidum incrementan la expresión de CCR5, un miembro de la familia de receptores de las quimiocinas, y la expresión del receptor en macrófagos y células dendríticas que actúan como correceptor para la entrada del VIH al interior de las células CD4+ (Sheffield et al., 2007). Debido a estos aspectos, se ha sugerido que la coinfección con T. pallidum tiene un efecto nocivo en el estado inmunológico y virológico en personas infectadas con VIH, influyendo el tratamiento para la sífilis, aunque estos datos aún no están bien dilucidados (Palacios et al., 2007). Se ha demostrado que el tratamiento con azitromicina como medicamento alternativo presenta fallos terapéuticos asociados a la resistencia de T. pallidum, según informes en diferentes partes del mundo (Katz et al., 2007). A esta situación se le añade que el grupo más vulnerable a contraer la infección por T. pallidum, según lo informado en el presente estudio y otras investigaciones a escala internacional, son los HSH y que a su vez presentan la infección por VIH debido al compromiso del sistema inmune. Esta última condición representa un grave problema de salud, ya que los pacientes con la coinfección sífilis/VIH y que a su vez son resistentes al tratamiento alternativo con azitromicina y alérgicos a la penicilina G, constituye un llamado de alerta a la comunidad científica de salud. La OMS recientemente ha estimado que 10,6 millones de casos nuevos de sífilis son informados cada año, e igualmente ha informado de la emergencia de cepas de T. pallidum resistentes a los macrólidos, resaltando la importancia de las investigaciones en el campo de la epidemiologia molecular (Stamm, 2010). A nivel mundial la tipificación molecular de muestras clínicas de T. pallidum ha ayudado a la caracterización temprana de la sífilis, evaluación de los subtipos asociados con neurosífilis, monitorear la resistencia a macrólidos (Martin et al., 2010), diferenciar entre episodios de recaídas y reinfección y a entender mejor las distribuciones geográficas y temporales de las poblaciones de T. pallidum (Cole et al., 2009). Algunos autores han sugerido una posible relación entre algunos subtipos de T. pallidum y la posible existencia de un punto de mutación u otro o de ambos en los aislamientos clínicos (Marra et al., 2010; Wu et al., 2012). Según los resultados obtenidos en esta investigación se detectó resistencia en todos los subtipos encontrados (figura 4.7), con valores superiores al 50% en cinco de los ocho subtipos (12a, 12f, 14a, 14d, 17d). Figura 4.7 Frecuencia de subtipos de T. pallidum resistentes a macrolidos en las muestras en estudio. En un estudio realizado en Canadá se informó que el subtipo más común fue el 14d y que este se vio mayormente asociado a la presencia de la mutación A2058G, detectado en el 16,6% (5/30) de los aislamientos (Martin et al., 2010). En otro estudio llevado a cabo en China se informó que el subtipo más asociado a la resistencia a los macrólidos fue el 14f detectado en un 50% (9/18) de los aislamientos caracterizados (Wu et al., 2013). En Washington, EUA recientemente se sugirió también que los subtipos 14d/f y 14d/g están mayormente asociados a la resistencia a los macrólidos con los puntos de mutación A2058G y A2059G indistintamente que confieren resistencia a los macrólidos, con una prevalencia de un 88,9% (32/36) (Grimes et al., 2013). En cambio, en un estudio realizado en Sudáfrica se sugirió que el subtipo 14b era el asociado a la mutación A2059G (Mueller et al., 2012), siendo el único que ha informado la relación existente entre este subtipo y el fenómeno de resistencia a macrólidos. Aunque los subtipos informados con mayor prevalencia en cuanto a la resistencia a los macrólidos difieren en la caracterización asignada por tpr, queda claro que el subtipo 14 identificado por la caracterización del gen arp, presenta relación directa con la existencia de las mutaciones A2058G y A2059G. La resistencia a los macrólidos está a menudo asociada con una alteración del sitio diana en el dominio V en la región peptidiltransferasa del ARNr 23S, mediante la ocurrencia de una mutación o una metilación. Estos dos puntos de mutaciones descritos hasta el momento en T. pallidum, son mutaciones puntuales que ocurren en una secuencia de nucleótidos del genoma bacteriano. Estas microlesiones ocurren al azar de forma endógena y espontánea, por lo que es poco probable que se pueda establecer una relación entre la presencia de un punto de mutación de acuerdo a un subtipo determinado ya que la diferenciación entre un subtipo u otro se encuentra en la disposición de los genes arp y tpr en el genoma, y estas disposiciones no están dadas por la selección o no de las cepas de T. pallidum al estar en contacto con el antibiótico. Los análisis de secuencia del genoma de T. pallidum han revelado que este tiene carencia de elementos genéticos como: plásmidos, bacteriófagos, y transposones, comúnmente asociados con los mecanismos de trasferencia horizontal de genes como: transformación, conjugación y transducción, que constituyen una vía para la adquisición de resistencia (Stamm et al., 2010), por lo que la existencia de estas mutaciones son consecuencias de una resistencia intrínseca, que ocurre de manera espontánea y al azar. En la presente investigación se informa por primera vez que el subtipo más común de T. pallidum en los pacientes cubanos objeto de estudio es el 14f y que está relacionado a la resistencia a los macrólidos, y que además es más frecuente en pacientes HSH coinfectados con VIH. Conclusiones 1. Se ratifica la utilidad de la PCR como herramienta complementaria para el diagnóstico temprano de la sífilis, fundamentalmente en pacientes con lesiones primarias y resultados negativos por serología; lo que avala su empleo en el diagnóstico de esta entidad infecciosa. 2. La elevada versatilidad de los subtipos de T. pallidum circulantes en los pacientes estudiados sugiere un patrón de transmisión heterogéneo en Cuba que apunta a futuros estudios de epidemiología molecular. 3. Las altas cifras de resistencia a macrólidos detectadas en los subtipos encontrados constituye un problema para la salud pública cubana, pues este hallazgo conlleva a fallas terapéuticas al emplear los tratamientos alternativos. V. Recomendaciones 1. Informar a las autoridades de Salud Pública de Cuba sobre los resultados encontrados en esta investigación. 2. Implementar herramientas moleculares más sensibles para el diagnóstico de la sífilis temprana en Cuba. 3. Extender la subtipificación molecular y la detección de resistencia a macrólidos a muestras de pacientes de las diferentes regiones del país. Referencias bibliográficas Abbas, K., Lichtman, H y Pillai, S. (2007). Inmunología celular y molecular. (6a ed.). Cap.15, pp.343-361. Azzato, F., Ryan, N., Fyfe, J y Leslie, D.E. (2012). Molecular subtypiun of Treponemapallidum during a Local Syphilis epidemic in men who have sex whth men in Melbourne, Australia.Journal of Clinical Microbiology, 50 (6), 1895-1899. Baughn, R.E y Musher, D.M (2005).Secondary syphilitic lesions. ClinMicrobiol Rev, 18: 205–216. Bherhof, W. (2008).PCR testing for Treponema pallidum in paraffinembedded skin biopsy specimens.test design and impact on the diagnosis of syphilis. J ClinPathol, 61, 390- 395. Bravo, C. T. (2002). Diagnóstico de laboratorio de la sífilis. Rev Mex. Patol. Clin, 50 (2), 82 – 96. Brittain, D. C. (1987).Macrolydes.Med Clin North Am, 3, 1213-20. Buffet, M. (2007). Diagnosing Treponema pallidum in secondary syphilis by PCR and inmunoistochemestry.The Society and Investigative Dermatology, 27. Cabié, A. (2010).Reemergence of syphilis in Martinique, 2001- 2008.Emerg.Infect.Dises, 16(1), 106-109. Calvo, J. y Martinez-Martinez, L. (2009). Mecanismos de acción de los antimicrobianos. EnfermInfeccMicrobiolClin, 27(1), 44–52. Carneiro, L. J., Alcino G. L y Porterb, R. S. (2006).Oral manifestations of syphilis.Clinics, 61(2), 161-6. Castro, R., (2009).Molecular subtyping of Treponema pallidum subsp. pallidum in Lisbon, Portugal.J. Clin. Microbiol, 47, 2510 –2512. Chacón, L., Alvarez, A., Pesant, O. y Sánchez, J. (2004).Libro de consejería en ITS y VIH/SIDA. Informaciónbásica, SaludPública, Cuba. Chi, K-H., Danavall, D., Taleo, F., Pillay, A., Ye, T y Nachamkin, E. (2015).Molecular Differentiation of Treponema pallidum Subspecies in Skin Ulceration ClinicallySuspected as Yaws in Vanuatu Using Real-Time Multiplex PCR and Serological Methods. Am. J. Trop. Med. Hyg, 92(1), 134–138 CITMA. Resolución No. 38/2006. Lista oficial de agentes Biológicos que afectan al hombre, los animales y las plantas. Cole, M.J., Chisholm, S.A., Palmer, H.M., Wallace, L.A y Ison, C.A. (2009).Molecular epidemiology of syphilis in Scotland.Sex Transm Infect, 85(6), 447–451. Cruz, A.R., Pillay, A., Zuluaga, A.V., Ramirez, L.G., Duque, J.E y Aristizabal, G.E. (2010).Secondary syphilis in Cali, Colombia.new concepts in disease pathogenesis. PLoSNegl. Trop. Dis, 4(5), e690. doi.10.1371/journal.pntd.0000690. Damasceno, Ch. A.,Oliveira, M., Brasil, I., da Cunha, E y de Oliveira, C. (2011).Molecular detection of Treponema pallidum sp. pallidum in blood samples VDRL-seroactive women lethal pregnancy retrospective observational study in Northern Brazil. outcome.a Revista de socidadeBrasileira da medicina tropical, 44(4), 451-456. Davies, J y Davies, D. (2010).Origins and evolution of antibiotic resistance.Microbiology and Molecular Biology Reviews, 74, 417-433. De Almeida, S.M., Bhatt, A y Riggs, P.K. (2010). Cerebrospinal fluid human immunodeficiency virus viral load in patients with neurosyphilis.J Neurovirol, 16(1):6-12. Douglas, J. M. (2009). Penicillin treatment of syphilis-clearing away the shadow on the land.JAMA, 301:769–771. Emerson, C.R. (2009). Syphilis: A review of diagnosis and treatment. The Open Infectious Diseases Journal, 3:143-147. Farhi, D., (2009). The epidemiological and clinical presentation ofsyphilis in a venereal disease centre in Paris, France. A cohort study of 284consecutive cases over the period 2000–2007. Eur. J. Dermatol. 19:484–489. Flasarová, M., Pospíšilová, P., Mikalová, L.,Valizova, Z., Dastychova, E y Strnadel, S. (2012).Sequencing-based Molecular Typing of Treponema pallidum Strains in the Czech Republic. All Identified Genotypes are Related to the Sequence of the SS14 Strain. ActaDermVenereol, 92, 669–674. Gayet-Ageron, A., Lautenschlager, S., Ninet, B., Perneger, T.V y Combescre, C. (2013) .Sensitivity, specificity and likelihood ratios of PCRin the diagnosis of syphilis.asystematicreview and meta- analysis.SexTransm Infect, 89, 251–6. Gayet-Ageron, A.,Sednaoui, P., Lautenschlager, S., Ferry, T., ToutousTrellu, L., et al. (2015).Use of Treponema pallidum PCR in Testing ofUlcers for Diagnosis of Primary Syphilis. EmergingInfectiousDiseases, 21(1), 127-129. García, C. (2011).Diagnóstico de la infección por Treponema pallidum en pacientes con sífilis temprana y la neurosífilis mediante reacción de la polimerasa en cadena. Rev. ChilInfect,18(4), 310 – 315. Garrity, G.M., Winters, M. y Seales, D. B. (2001).Taxonomic outline of the Procarioty genera Bergey’s manual of systematic bacteriology. (2aed.). Giacani, L., Lukehart, S y Lara, C. (2009).Syphilis. In: Barrett ADT, Stanberry LR, eds. Vaccines for biodefence and emerging and neglected diseases. Elsevier Ltd, 1193-1218. Grange, P.A., Gressier, L., Dion, P.L., Farhi, D., Benhaddou, N y Gerhardt, P. (2012). Evaluation of PCR test for detection on Treponema pallidum in swabs and blood, Journal of clinical Microbiology, 546-552. Greenblatt, R.M. (1988).Genital ulceration as a risk factor for human immunodeficiency virus infection, AIDS, 2(1), 47–50. Harper, K.N., Liu, H y Ocampo, P.S. (2008).The sequence of the acidic repeat protein (arp) gene differentiates venereal from non venereal Treponema pallidum subspecies, and the gene has evolved under strong positive selection in the subspecies that causes syphilis. FEMS Immunol Med Microbiol, 53, 322–332. Hazlett, K.R., Sellati, T.J y Nguyen T.T. (2001).The TprK protein of Treponema pallidum is periplasmic and is not target of opsonic antibody or protective immunity, J Exp Med, 193(9), 1015-1026. Herremans,T., Kortbeek, L y Notermans, D.W (2010).A review of diagnostic test for congenital syphilis in newborns.Eur J ClinMicrobiol Infect Dis, 29, 495–501. Heymans, R., 2010. Clinical value of Treponema pallidum real-timePCR for diagnosis of syphilis.J. Clin. Microbiol. 48:497–502. Hook, E. W., III, Martin, D. H., Stephens, J., Smith, B. S. & Smith, K. (2002). A randomized, comparative pilot study of azithromycin versus benzathine penicillin G for treatment of early syphilis.Sex Transm Dis, 29, 486–490. Hook, E. W.I., Martin, D. H., Stephens, J., Smith, B. S y Smith, K. (2010). A phase III equivalence trial of azithromycin versus benzathine penicillin for treatment of early Syphilis.J Infect Dis, 201(11), 1729-1735. Ho, E.L &Lukehart, S.A. (2011).Syphilis.using modern approaches tounderstand an old disease. J Clin Invest, 121(12), 4584-4592. Horberg, M.A., Ranatunga, D.K., Quesenberry, C.P., Klein, D.B y Silverberg, M.J. (2010). Syphilis epidemiology and clinical outcomes in HIV-infected and HIV-uninfected patients in Kaiser Permanente Northern California. Sex Transm Dis, 37(1):53–58. Jackman, J. D., Jr y Radolf, J. D. (1989).Cardiovascular syphilis.Am. J.Med, 87, 425–433. Joklik, W.K., Willet, H.P., Amos, D.B y Wilfert, C.M. (1998).Zinsser Microbiología. (20aed.). MédicaPanamericana S.A., USA. Katz, K. A. &Klausner, J. D.(2008).Azithromycin resistance inTreponema pallidum.CurrOpin Infect Dis, 21.83–91. Kimberly, A. (2002).Sexually Transmitted Diseases Treatment Guidelines, 51(6), 69-71. Krause, R.M. (1996).Metchnikoff and syphilis research during a decade of discovery, 1900-1910 Development of an animal model and a preventive treatment set the stage for progress. ASM News, 62, 307-10. Koek, A.G. (2006).Specific and sensitive diagnosis of syphilis using in real-time PCR for Treponema pallidum.Clinical Microbiology and infection, 12(12), 1221-1240. La Fond, E y Lukehart, S.A. (2006).Biological Basis for syphilis.Clinical Microbiological Reviews, 19(1), 29 – 49. LaFond, R.E., Molini, B.J., Van Voorhis, W.C y Lukehart, S.A. (2006). Antigenic variation of TprK V regions abrogates specific antibody binding in syphilis. Infect Immun, 74(11), 6244–6251. Laskaris, G. (1996).Oral manifestations of infectious diseases.Dent Clin North Am, 40, 395-423. Larsen, S.A., Norris, S.J. y Pope, V. (1999).Treponema and other hostassociated spirochetes “in” Manual of Clinical Microbiology, 7th edition, Murray P.R., Baron E.J., Pfaller M.A., Tenover F.C. and Yolken R.H. Eds., American Society for Microbiology Press, Washington DC, 759-776. Leader, B.T., Godornes, C., Van Voorhis, W.C y Lukehart, S.A. (2007). CD4+ Lymphocytes and gamma interferonpredominate in local immune responses inearly experimental syphilis. Infect Immun, 75(6), 3021–3026. Lecrecq, R. (2002).Mechanisms of Resistance to Macrolides and Lincosamides.Nature of the Resistance Elements and Their Clinical Implications.Clinical Infectious Disease, 34, 482 – 492. Lemont,R. (2010).Oral Microbiology at a Glance.(3a ed.).Capítulos 22-25. Lewis, D.A y Lukehart, S.A. (2011). Antimicrobial resistance in Neisseria gonorrhoeae and Treponema pallidum: evolution, therapeutic challenges and the need to strengthen global surveillance. Sex TransmInfect, 87:39-43. Llop, A., Valdés, M.M. Y Zuazo, J.L. (2001).Microbiología y Parasitología Médicas, Tomo1, Ciencias Médicas, Ciudad de la Habana. Lukehart, S.A., Godorness, C., Molini. B., Sonnett, P., Hopkings, S y Mulcay, F. (2004).Macrolide resistance in Treponema pallidum in the United States and Ireland.N Engl J Med,351, 154–8. Lukehart, A.S y Marra, M.C (2007).Insolation and Laboratory Maintenace of Treponema pallidum.Current Protocols in Microbiology, 7. Liu, H., Rodes, B., Chen, Y y Steiner. B. (2001).New Tests for Syphilis.Rational Design of a PCR Method for Detection of Treponema pallidum in Clinical Specimens Using Unique Regions of the DNA Polymerase I Gene, 39(5), 1941–1946. Lucier, T.S., Heitzman, K.,Liu, S.K y Hu, P.C. (1995). Transition mutations in the 23S Rrna of erythromycin-resistant isolates of Mycoplasma pneumoniae.Antimicrob. Agents Chemother, 39:2770-2773. Madigan,T., Martinko, M., Stahl, A, et al. (2012.). Biology of microorganism.(13raed), Capitulo 11, 968-969. Manavi, K., Young, H y McMillan, A. (2006). The sensitivity of syphilis assays in detecting different stages of early syphilis. Int J STD AIDS, 17(11):768-771. Marfin, A. A., Liu, H., Sutton, M.Y., Steiner, B., Pillay, A y Markowitz, L.E. (2001).Amplification ofthe DNA polymerase I gene of Treponemapallidum from whole blood of persons withsyphilis.DiagnMicrobiol Infect Dis, 40(4), 163-6. Marra, C.M., Colina, A.P., Godornes, C., Tantalo, L.C y Puray, M.(2006).Antibiotic selection may contribute to increases in macrolideresistant Treponema pallidum. J Infect Dis, 194, 1771–1773. Marra, C. M. 2009. Update on neurosyphilis. Curr.Infect. Dis. Rep, 11:127–134. Marra, C.M., Sahi, S.K., Tantalo, L.C., Godornes, Ch y Reid, T. (2010).Enhanced molecular typing of Treponema pallidum.geographical distribution of strain types and association with neurosyphilis. J Infect Dis, 202(9), 1380–1388. Martin, I.E., Tsang, R., Sutherlan, K., Tilley, P., Read, R y Anderson, B. (2009). Molecular Characterization of Syphilis in patients in Canada.Azhythromicin resistance and detection of Treponema pallidum DNA in whole-blood samples versus ulcerative swabs.Journal of clinical Microbiology, 47(6), 1668- 1673. Martin, I.E., Gu, W., Yang, Y y Tsang, S. W. (2012).Macrolide Resistance and Molecular Typesof Treponema pallidum Causing Primary Syphilis in Shanghai, China.ClinicalInfectiousDiseases, 49, 515–21. Martínez, R.S., Castillo, T., (2006).Antibioticsusceptibility Celis, of S y Hernández, Mycoplasmahominis L. and Ureaplasmaurealyticum.Revista Médica de la Universidad Veracruzana, 6(2), 11-17. Mattei, P.L., Beachkofsky, T.M., Gilson, R.T y Wisco, O.J. (2012).Syphilis: Reemerging Infection. Am Fam Physician, 86(5):433-440. McKevitt, M., K. Patel, D. Smajs, M. Marsh, M. McLoughlin, S. J. Norris,et al. (2003).Systematic cloning of Treponema pallidum open reading frames for protein expression and antigen discovery.Genome Res, 13:1665–1674. Mehta, S.D., Moses,S., Parker, C.B., Agot, K., Maclean, I y Bailey, R.C. (2012).Circumcision status and incident herpes simplex virus type 2infection, genital ulcer disease, and HIV infection.AIDS, 26(9), 1141–1149. Mikalova, L., Strouhal, M., Cejkava, R., Zobanikova, R., Pospisilova, R y Norris, S. (2010).Genome analysis of Treponema pallidum subsp. pallidum and subsp. pertenue strain.most of the genetic difference and localized in six regions. Intsitut the Pharmacologieet de BiologeStructuraleFrancia, 5(12), 15713. Miklossy, J. (2012).Chronic or Late Lyme Neuroborreliosis. Analysis of Evidence Compared to Chronic or Late Neurosyphilis. The Open NeurologyJournal, 6(1), 146-157. MINSAP. (2004).Infecciones de Transmisión Sexual, pautas para su tratamiento. La Habana. MINSAP. Molepo, J., Pillay, A., Weber, B., Morse, S.A y Hoosen, A.A. (2007).Molecular typing of Treponema pallidum strainsfrom patients with neurosyphilis in Pretoria, SouthAfrica. Sex Transm Infect, 83(3), 189–192. Morgan A. (2002).Segregation of B and T cell epitopes of Treponema pallidum repeat protein K to variable and conserved regions during experimental syphilisinfection. J Immunol, 169, 952. Morgan A. (2003).Protection against syphilis correlates whit specificity of antibodies to the variable regions of Treponema pallidum repeat protein k. Infection and immunity, 71(10), 5605 – 5612. Morshed, M.G y Jones, H.D. (2006).Treponema pallidum macrolide resistance in BC.CMAJ, 174, 349. Muller, E.E., Paz-Bailey, G y Lewis, D.A (2012).Macrolide resistance testing and molecular subtypingofTreponema pallidum strains from southern Africa. Sex Transm Infect, 88, 470–474 New, H.C. (1995).Clinical epidemiology of resistance to macrolides.New macrolides, Azalides and Streptogramins in Clinical Practice. Norris, S.J., Cox, D.L. y Weinstock, G.M. (2001).“Biology of Treponema pallidum.correlation of functional activities with genome sequence data”. JMolMicrobiolBiotechnol, 3(1), 37-62. Palacios, R. (2007).Impact of syphilis infection on HIV viral load and CD4 cell counts in HIV-infected patients.J Acquir Immune DeficSyndr, 44(3), 356–359. Palmer, M.H., Higgins, S.P y Kingston, M.A. (2003).Use of PCR in the diagnosis of early syphilis in the United Kingdom.Sex Transm Infect, 79, 479-483. Pandori, M. W., Gordones, C., Castro, L., Engelman, J., Siedner, M., Lukehart, S. &Klausner, J. (2007).Detection of azithromycin resistance in Treponema pallidum by real-time PCR.Antimicrob Agents Chemother, 51, 3425–3430. Peeling, R.W y Hook, E.W.(2006).The pathogenesis of syphilis: The great mimicker, revisited. Journal of Pathology, 208:224-232. Peng, R.R., Wang, A.L., Li, J., Tucker, J.D, Yin, Y-P y Cheng, X-S. (2011). Molecular typing of Treponemapallidum.A systematic review and Meta- Analysis, 5(11), 1273. Pillay A., Liu, H., Chen, Ch.Y.,Hallloway, B., Sturm, W y Steiner, B. (1998).Molecular subtyping of Treponema pallidum subspecies pallidum.Sex Transm Dis, 25, 408–414. Pillay, A. (2002).Molecular typing of Treponema pallidumin South Africa.cross-sectional studies. J ClinMicrobiol, 40(1), 256–258. Poliseli, R., Vidal, J.E., Penalva De Oliveira, A.C y Hernandez, A.V. (2008).Neurosyphilis in HIV-infected patients: clinical manifestations, serum venereal disease research laboratory titers, and associated factors to symptomatic neurosyphilis. Sex Transm Dis, 35(5):425–429. Pope.V., Fox, K., Liu, H.,Marfin, A.A., Leone, P y Seña, A.C. (2005).Molecular Subtyping of Treponema pallidum from North and South Carolina.Journal of Clinical Microbiology, 43(8), 3743–3746. Radolf, J.D., Hazlett, K.R.O y Lukehart, S.A (2006). Pathogenesis of Syphilis. In: Radolf JD, Lukehart SA, eds. Pathogenic Treponemes: Cellular and Molecular Biology. Norfolk, UK: Caister Academic Press. pp 197–236. Roberts, M.C. (2008).Update on macrolide-lincosamide-streptogramin, ketolides, and oxazolidinone resistance genes. FEMS MicrobiolLett, 282, 147–159. Rodes, B. (2001).New test for syphilis. Rational design of a PCR method for detection of Treponema pallidum in clinical specimens using unique region of the DNA Polymerase I Gene. Center fordisease control and prevention, 39(5), 1941-1946. Rodríguez, I., Fernández, C.M y Martínez, M.B. (2006). Falsos biológicos positivos por VDRL en el diagnóstico serológico de la sífilis. Rev Cubana MedTrop, 58(1), 90-2. Rodriguez, I., Echevarria, E., Noda, A.A., Rivero, M., Hernandez, C.M y Machado, L. (2013).Treponema pallidumhemagglutinationforconfirmation of syphilis in Cuba. Revista Cubana de Medicina Tropical, 65(2), 264-271. Sadiq, S.T. (2005).The effects of early syphilis on CD4 counts and HIV-1 RNA viral loads in blood and semen.Sex Transm Infect, 81(5), 380–385. Salazar, J.C., Hazlett, K.R y Radolf, J.D. (2002).The immune response to infection with Treponema pallidum, the stealth pathogen.Microbes Infect, 4, 1133-40 Sanguineti-D, A. C y Tafur-D, J. R. (2004).Syphilis diagnosis update. DermatolPerú, 14,192-199. Schiller, N.L y Cox, C.D. (1977).Catabolism of glucose and fatty acids by virulent Treponema pallidum. Infect. Immun, 16:60–68. Schmid, G., Rowley, J.T., Samuelson, J., Tun, Y., Guraiib, M., et al. (2009).World Health Organization (WHO) 2005 Global Estimates of the Incidence and Prevalence of Sexually Transmitted Infections (STIs).WHO/CDC Symposium.Congenital Syphilis and the 2005 WHO Estimates of STI Incidence and Prevalence.Using the Second to Help Eliminate the First. Sheffield, J.S., Wendel, G.D., McIntire, D.D y Norgard, M.V. (2007).Effect of genital ulcer disease on HIV-1 coreceptor expression in the female genital tract.J InfectDis,196(10), 1509–1516. Shimelis, T y Tadesse, E. (2015). The diagnostic performance evaluation of the SD BIOLINE HIV/syphilisDuo rapid test in southern Ethiopia:a cross-sectional study. BMJ Open, 5: e007371. doi:10.1136/bmjopen-2014-007371. Singh, A.E y Romanowski, B. (1999).Syphilis: Review with emphasis on clinical, epidemiologic, and some biologic features. ClinMicrobiolRev, 12, 187-209. Sokolovsky, E., Frigo, N., Rotanov, S., Savicheva, A., Dolia, O., Kitajeva, N., et al. (2009). Guidelines for the laboratory diagnosis of syphilis in East European countries.J EurAcadDermatolVenereol.23(6):623-32. Smajs, D., Norris, S.J y Weinstock, G.M. (2012).Genetic diversity in Treponema pallidum.Implications for pathogenesis, evolution and molecular diagnostics ofsyphilis and yaws.Infect Genet Evol, 12, 191– 202. Stamm, L.V. (2010).Global challenge of antibiotic-resistant Treponema pallidum.Antimicrob Agents Chemother, 54, 583–589. Stokes, H.W y Gilings, M.R (2011).Gene flow, mobile genetic elements and the recruitment of antibiotic resistance genes into Gramnegative pathogens.Federation of European Microbiological Societies, 35, 790819. Sutton, M.Y., Liu, H., Steiner, B., Pillay, A., Mickey, T., et al.(2001) Molecular subtyping of Treponema pallidum in an Arizona county with increasing syphilis morbidity.use of specimens from ulcers and blood. J Infect Dis, 183, 1601–1606. Tenover, F.C. (2006).Mechanisms of antimicrobial resistance in bacteria.American Journal of Infection Control, 34, S3-S10. Tenson, T., Lovmar, M y Ehrenberg, M. (2003).The mechanism of action of macrolides, lincosamides and streptogramin B reveals the nascent peptide exit path in the ribosome; Journal of Molécular Biology, 330, 1005 – 1014. Van Damme, K., Behets, F., Ravelomanana, N., Godornes, C., Khan, M., et al. (2009).Evaluation of azithromycin resistance in Treponema pallidum specimens from Madagascar.Sex Transm Dis, 36, 775–776. Vester, B., yDouthwaite, S. (2001).Macrolide resistance conferred by base substitutions in 23S rRNA.AntimicrobAgentsChemother, 45, 1–12. Vulcano, S., Kaynar, V y Levite, V.(2011). Prevención de la transmisión vertical desífilis, hepatitis B y VIH.Recomendaciones para el trabajo de los equipos de salud. Argentina. Dirección de sida y Enfermedades de Transmisión Sexual, 23-55. Wenhai, L., Jianzhong, Z y Cao, Y. (2004).Detection of Treponema pallidum in skin lesions of secondary syphilis and characterization of the inflammatory infiltrate.Dermatology,208(2), 94-7. Wisconsiva, V., Smajs, D., Wehsler, D., Matejkova, P y Flasarova, M. (2006).Detection of Treponema pallidum subsp. pallidum from skin lesions, serum and cerebrospinal fluid in and infant with congenital syphilis after Clindamycin treatment of de mother during pregnancy.Journal of clinical microbiology, 45(2), 659-661. Wong, C.R. (2008). Primary syphilis: Serological treatment response to doxycycline/tetracycline versus benzathine penicillin. AmericanJournal of Medicine, 121, 903-908. Workowski, K.A & Berman, S. (2010).Centers for Disease Control and Prevention (CDC).Sexually transmitted diseases treatment guidelines, Recomm Rep, 59(12), 1–110. Wu, H., Chang, S-Y., Lee, N-Y., Huang, W.C., Hu, B-R y Yang, Ch-J. (2012).Evaluation of macrolide resistance and enhanced molecular typing of Treponema pallidum in patients whit syphilis in Taiwan.a prospective multicenter study. Journal of clinical Microbiology, 5(7), 2299-2304. Zhou, P. (2010).Azithromycin treatment failure among primary and secondary syphilis patients in Shangai.Sex TransmDis, 37, 726-729. Anexos 1. Encuesta epidemiológica Encuesta clínico-epidemiológica para estudio de lesiones genitales Nombre del paciente:_____________________________________________ Fecha: __________Identificación de la muestra:_________ Edad: _______ 1. Sexo:_______ No. Historia Clínica____________________ Mantiene relaciones sexuales con: ___ personas del mismo sexo___ personas del sexo contrario___ personas de ambos sexos ___ siempre con la misma persona ___ con varias personas conocidas, siempre las mismas ___ esporádicamente con personas desconocidas o poco conocidas ___ frecuentemente con personas desconocidas o poco conocidas 2. Usa condón: No____ 3. Es paciente seropositivo al VIH: Sí ____ 4. Ha tenido anteriormente otra infección de transmisión sexual: No____ Sí ____ Sí ____ Siempre____ A veces____ No____ Cuál______________ Cuándo____________ 5. Qué tiempo lleva con la lesión: _________ 6. # lesiones genitales:_______ 7. Localización de la lesión: Hombres:Glande o prepucio_____Cuerpo del pene____ Base del pene____ Otra (cuál)_______ Mujeres:Labios mayores____ Vagina____ Labios menores____ Endocervix____ Otra (cuál)_______ 8. La lesión es dolorosa: Sí ____No ____ 9. Presencia de secreción en la lesión: Sí ____No ____ 10. Ha recibido algún tratamiento con antibióticos o antiviral durante los últimos 15 días: No____ Sí ____ Cuál______________ 11. Mencione otros signos o síntomas clínicos que presente: ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ _________ 2. Preparación de geles y soluciones Alcohol 70% Diluir 70 mL de etanol absoluto en 30 mL de agua bidestilada estéril Identificar y conservar a temperatura ambiente. Tampón Tris-Borato-EDTA (TBE) pH 8 (0,5X) 1. Solución Madre de TBE a 5X, para 1 L se utilizarán: Componentes Cantidad Tris Base 54 g Acido bórico 27,5 g EDTA 0,5M 20 mL H2O bidestilada 800 mL Homogenizar Ajustar pH a 8 Completar con agua bidestilada estéril hasta 1 L. Identificar y conservar a 4oC. 2. Solución de trabajo TBE a 0,5X, para 1 L se utilizarán: 100 mL de TBE 5X 900 mL de H2O bidestilada estéril Identificar y conservar a 4oC. Gel de Agarosa al 2% Pesar 2 g de agarosa para ácidos nucleicos Añadir 100 mL de tampón TBE 0,5X Calentar en baño de María hasta que la solución se torne translúcida totalmente Dejar refrescar hasta una temperatura aceptable por la piel de la mejilla Adicionar cuidadosamente 3 µL de Bromuro de Etidio (10 mg/mL) Homogenizar Verter sobre el molde y colocar el peine (todo sobre una superficie a nivel) Esperar a que solidifique y retirar con cuidado el peine. Gel de Agarosa al 1,5% Pesar 0,9 g de agarosa para ácidos nucleicos Añadir 60mL de tampón TBE 0,5X Calentar en baño de María hasta que la solución se torne translúcida totalmente Dejar refrescar hasta una temperatura aceptable por la piel de la mejilla Adicionar cuidadosamente 3 µL de Bromuro de Etidio (10 mg/mL) Homogenizar Verter sobre el molde y colocar el peine (todo sobre una superficie a nivel) Esperar a que solidifique y retirar con cuidado el peine. Gel de Agarosa al 1% Pesar 0,7 g de agarosa para ácidos nucleicos Añadir 60mL de tampón TBE 0,5X Calentar en baño de María hasta que la solución se torne translúcida totalmente Dejar refrescar hasta una temperatura aceptable por la piel de la mejilla Adicionar cuidadosamente 3 µL de Bromuro de Etidio (10 mg/mL) Homogenizar Verter sobre el molde y colocar el peine (todo sobre una superficie a nivel) Esperar a que solidifique y retirar con cuidado el peine. Bromuro de etidio (10 mg/mL) Usar guantes: Disolver 0,1 g de Bromuro de Etidio en 10 mL de agua destilada Homogenizar con agitador por varias horas hasta que esté todo disuelto y siempre protegido de la luz Alicuotar en volúmenes de 1 mL y cubrir con papel de aluminio. Identificar y conservar a 4oC. Precauciones Importantes: El bromuro de etidio es cancerígeno por lo que debe ser manipulado con extremo cuidado, uso de guantes y naso buco. Los frascos que se utilicen para este reactivo no se emplearán para otro objetivo