Te venceré - IES Sabino Fernández Campo
Anuncio
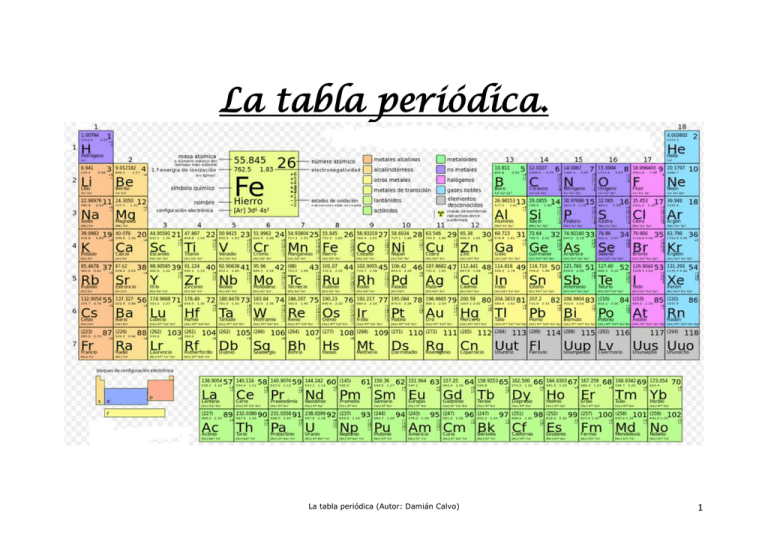
La tabla periódica. La tabla periódica (Autor: Damián Calvo) 1 ÍNDICE 1. Introducción ............................................................................................................... 3 2. Concepto de átomo ................................................................................................... 3 3. Estructura del átomo ................................................................................................. 4 3.1. El núcleo atómico ...................................................................................................... 5 3.2. La corteza electrónica ............................................................................................... 7 3 .2 .1 . Los números cuánticos, definición .............................................................................. 8 3 .2 .2 . Los números cuánticos, formación ............................................................................ 10 3 .2 .3 . Los números cuánticos, configuración electrónica .................................................. 18 3.3. Configuración electrónica y estados de oxidación .............................................. 19 3.4. Configuración electrónica y sistema periódico .................................................... 21 3.5. Origen de los elementos químicos ........................................................................ 22 3.6. Descubrimiento de los elementos químicos ......................................................... 23 3 .6 .1 . Elementos naturales .................................................................................................... 23 3 .6 .2 . Elementos artificiales .................................................................................................. 23 4. Evolución histórica de la clasificación periódica de los elementos .................. 24 5. Tabla Periódica......................................................................................................... 26 5.1. Descripción de los periodos ................................................................................... 26 5.2. Descripción de los grupos ...................................................................................... 27 5.3. 6. 5 .2 .1 . Elementos representativos.......................................................................................... 27 5 .2 .2 . Elementos de transición .............................................................................................. 27 5 .2 .3 . Elementos de transición interna ................................................................................. 27 5 .2 .4 . El hidrógeno ................................................................................................................. 27 Bloques en la tabla periódica ................................................................................. 28 Relación de la periodicidad con la configuración electrónica ............................ 28 6.1. Periodicidad en la configuración electrónica ....................................................... 28 6.2. Periodicidad en las propiedades químicas ........................................................... 31 7. Propiedades periódicas .......................................................................................... 31 7.1. Radio atómico / volumen atómico.......................................................................... 31 7.2. Energía de ionización (o potencial de ionización)................................................ 32 7.3. Afinidad electrónica (o electroafinidad) ................................................................ 32 7.4. Electronegatividad ................................................................................................... 32 7.5. Carácter metálico / no metálico .............................................................................. 33 7.6. Poder oxidante / reductor ....................................................................................... 33 8. Configuración electrónica. Resumen .................................................................... 34 9. Estructura electrónica. Resumen ........................................................................... 35 10. Orbitales atómicos. Forma geométrica y nomenclatura ..................................... 37 La tabla periódica (Autor: Damián Calvo) 2 1. Introducción Mira a tu alrededor, el suelo, la mesa, las plantas, los animales. Siente el aire que te rodea, sabes que está formado por una mezcla homogénea compuesta principalmente de nitrógeno y oxígeno. Mírate tu mismo, tus manos, las uñas … Si quisieras clasificar lo que ves, una primera forma de hacerlo sería entre seres vivos y seres inanimados o no vivos pero … ¿de qué están formados unos y otros? Bueno, a estas alturas de tus estudios sabrás que los seres vivos están formados por células, éstas forman órganos, sistemas y tejidos en los organismos más complicados, o solo son células aisladas como en el caso de las bacterias. Ahora nos queda saber de qué están compuestas las cosas no vivas: la mesa, el bolígrafo, las piedras, etc. La respuesta es fácil: por moléculas, en el caso de los metales podemos considerar todo el metal como una inmensa molécula. Es cierto, pero debemos saber también que las células que forman los seres vivos también están compuestas por moléculas. Por lo tanto, al final todo lo que nos rodea y todo lo que somos nosotros mismos son moléculas, muy diferentes unas de otras, pero moléculas al fin y al cabo. Las cosas inanimadas poseen moléculas mucho más simples que las que tienen los seres vivos, pero siguen siendo moléculas. Fíjate, en unas pocas líneas y casi sin decir nada que tú mismo no supieras ya, hemos llegado a la conclusión que los seres vivos y las cosas inanimadas están formadas por entidades, más o menos complicadas, que tienen el mismo nombre: moléculas. 2. Concepto de átomo Para seguir profundizando, ahora hemos de saber qué es eso que llamamos molécula. Una definición fácil es decir que una molécula es una asociación concreta de átomos. Los átomos pueden asociarse de muchas formas diferentes para formar muchas moléculas diferentes, por eso pueden existir muchos seres vivos diferentes y, en un mismo organismo complejo, existir diferentes tipos de tejidos y órganos. Por otro lado, las cosas inanimadas también están compuestas por moléculas que, por lo tanto, son también asociaciones de átomos. Hemos avanzado un poco más en el camino de simplificar la naturaleza, ahora estamos en el punto en que podemos decir que todo lo que nos rodea, ya sea sólido, líquido o gaseoso, y todo lo que somos nosotros mismos está formado, en última instancia, por entidades bastante simples que tienen el mismo nombre: átomos. La tabla periódica (Autor: Damián Calvo) 3 3. Estructura del átomo (Pulsa para profundizar y practicar) Puede resultar sencillo hablar de átomos y quedarnos tan tranquilos pero, ¿qué es realmente un átomo? ¿Cuántos átomos distintos hay? ¿De qué están formados los átomos? Para responder a la primera pregunta debemos saber que cada elemento químico está formado por átomos y que los átomos de un mismo elemento son iguales entre si y distintos de los átomos que forman cualquier otro elemento. Con la teoría atómica de Dalton, de principios del siglo XIX, se admitió de forma universal que los átomos constituían las partículas mínimas que formaban los elementos químicos. Por lo tanto, podemos definir átomo como aquella materia mínima que no podemos dividir ni alterar sin variar la naturaleza de la sustancia inicial. Esto quiere decir que si tengo, por ejemplo, un trozo de hierro, podré partirlo sucesivamente en trozos más pequeños hasta que llegue a tener un solo átomo, a partir de entonces ya no podré dividirlo más. (Si, por algún procedimiento, dividiera el átomo de hierro, tendría un átomo más pequeño pero ya no sería de hierro, sería de otro elemento, habiendo variado la naturaleza de la sustancia inicial, el hierro, que ya no sería hierro). Respecto de la segunda pregunta, para saber cuántos átomos diferentes hay, y de acuerdo con Dalton, basta con saber cuántos elementos diferentes hay en la naturaleza. Sabiendo esto, basta con averiguar cuántos elementos distintos hay. Detén aquí tu lectura, coge una tabla periódica de los elementos, también llamada sistema periódico, y… cuéntalos, así de simple. ¿Ya lo has hecho? ¿Has contado los elementos de tu tabla periódica? Si lo has hecho contándolos uno a uno has perdido un poco el tiempo. Fíjate que los elementos de la tabla periódica están numerados del 1 al 118 (en las tablas más completas), por lo tanto hay 118 elementos distintos, o lo que es lo mismo, hay 118 átomos distintos en la naturaleza. (Dejando al margen, por ahora, los isótopos). El número que tiene cada átomo recibe el nombre de número atómico, ¿lógico, no? Es necesario remarcar que al decir “en la naturaleza” hay que entender exactamente eso: en la naturaleza. Siendo igual en la Tierra, en el Sol, en una estrella lejana o en cualquier roca de cualquier planeta de cualquier estrella de cualquier galaxia del universo. En todos los lugares nos encontraremos con los mismos átomos que en nuestra casa. De las tres preguntas que nos hicimos, ya solo falta por responder la tercera: ¿De qué están formados los átomos? Con Dalton, la experiencia mostraba que los átomos se mantenían como entidad durante el transcurso de cualquier reacción química, esto significa que La tabla periódica (Autor: Damián Calvo) 4 no se creaban, no se destruían y tampoco se transformaban en las reacciones químicas, por lo que se pensó que eran realmente indivisibles e indestructibles. Esta concepción cambió radicalmente con el descubrimiento de radiactividad, demostrándose que los átomos pueden convertirse unos otros. Al final resulta que el sueño de los alquimistas de la edad media posible, se puede convertir el plomo en oro, o algo parecido. ¿Que por qué se hace?, porque sale muchísimo más caro hacer oro que comprarlo. la en es no Volvamos a nuestra tercera pregunta. ¿De qué están formados los átomos? La respuesta se ha hecho esperar a lo largo del tiempo debido a lo difícil que resulta estudiar algo tan pequeño, pero ahora se conoce bastante bien la estructura de los átomos. Se sabe que, a modo de resumen, están formados por un núcleo y, a su alrededor, una especie de nube de electrones. Estando la casi totalidad de la masa del átomo concentrada en su núcleo. 3.1. El núcleo atómico El núcleo es muy pequeño en relación al tamaño total del propio átomo. Como ejemplo, si comparamos un átomo con una catedral, una mosca que volase por el centro de la catedral sería el núcleo y por los muros de la catedral nos encontraríamos al electrón más externo del átomo. También se sabe que el núcleo está formado por protones, que tienen carga eléctrica positiva, y neutrones, que carecen de carga eléctrica. A pesar de que los protones tienen carga positiva, pueden permanecer juntos, mezclados con los neutrones, debido a una fuerza muy intensa, de hecho es la fuerza más fuerte que existe en la naturaleza, y que se llama fuerza fuerte ¿lógico, no? Esta fuerza no solo compensa, sino que vence con mucho la repulsión electrostática debida a la presencia de las cargas del mismo signo que poseen los protones. Utilizando un poco la nomenclatura científica, el número de protones que tiene un átomo en su núcleo recibe el nombre de número atómico Z, es como la matrícula del átomo, determinando el elemento de que se trata. No hay dos elementos distintos que tengan el mismo número de protones en los núcleos de sus átomos, y no hay dos átomos del mismo elemento que tengan distinto número de protones en sus núcleos. Como ya sabes, además de protones, el núcleo posee también neutrones, (excepto el hidrógeno, como se verá enseguida), el número de neutrones no determina el elemento, pero sí el isótopo del que se trata. ¿Qué es eso de isótopo? Sepamos primero que los elementos, además de su número atómico Z, poseen otro número: el número másico A. Como ya se ha comentado, la masa de un átomo reside en su núcleo, siendo igual al número de protones y de neutrones. Un isótopo es aquel átomo que posee diferente número de neutrones que otro átomo del mismo elemento. Ambos poseen el La tabla periódica (Autor: Damián Calvo) 5 mismo número de protones: Z, el número atómico del elemento, por lo que son átomos del mismo elemento químico, pero poseen diferente número de neutrones y, por tanto, diferente número másico. Por poner un ejemplo, el elemento hidrógeno está formado por átomos que poseen, todos ellos, un solo protón en el núcleo, siendo su número atómico Z=1. Pues bien, aunque todos los átomos de hidrógeno han de tener siempre un protón, y solo uno, (si tuvieran más ya no serían átomos de hidrógeno, lo serían de otro elemento distinto), pueden tener además uno o dos neutrones, o bien ninguno, que es lo más normal. Así decimos que el elemento hidrógeno posee tres isótopos puesto que sus átomos pueden estar compuestos por: 1- Un protón: 1p+ 2- Un protón y un neutrón: 1p+ + 1n 3- Un protón y dos neutrones: 1p+ + 2n Cuando un átomo de hidrógeno no posee ningún neutrón en su núcleo, ese átomo de hidrógeno recibe el nombre de protio, que es el isótopo más habitual del elemento hidrógeno. Si posee, además del necesario protón, un neutrón, su nombre es deuterio. Llamándose tritio al isótopo del elemento hidrógeno que posee en su núcleo un protón y dos neutrones. De forma similar al hidrógeno, el resto de elementos del sistema periódico poseen átomos cuyos núcleos pueden diferenciarse entre si por tener más o menos neutrones, en cuyo caso decimos que ese elemento posee uno o varios isótopos. Recuerda que, aunque el número de neutrones puede variar, quien no puede variar es el número de protones entre los isótopos de un mismo elemento puesto que, si variara, ya no tendríamos un átomo de ese elemento sino de otro elemento químico distinto. Bien, ya conocemos como está formado el núcleo de un átomo cualquiera, solo recordar que prácticamente toda la masa del átomo reside en los protones y en los neutrones, por tanto en el núcleo, siendo la masa de los electrones del orden de mil veces menor, por lo que podemos despreciarla en todos los casos que tratemos en el curso. Por último, tener en cuenta que la masa de un protón es casi igual a la masa de un neutrón, lo que nos permite asumir que la masa de un átomo es la suma de sus protones y sus neutrones. Recuerda que a la suma de los protones y los neutrones del núcleo de un átomo se le denomina número másico A. De esto se deduce fácilmente que el número de neutrones de un átomo es igual a su número másico menos su número atómico: nº de neutrones = A – Z. Como curiosidad, el elemento que más isótopos posee es el cesio: Cs, con número atómico Z=55, que tiene 40 isótopos, aunque solo el 133Cs, cuyo número másico A vale 133, es natural, los 39 restantes son sintetizados en reacciones nucleares controladas por el hombre. ¿Puedes decir cuántos neutrones y cuántos protones posee el 133Cs en su núcleo? La tabla periódica (Autor: Damián Calvo) 6 3.2. La corteza electrónica Cuando se empezaba a estudiar el átomo, y una vez superado el modelo de Thomson, se creía que los electrones estaban dispuestos como los planetas alrededor del Sol. Según este modelo planetario, los electrones estarían en órbitas planas y circulares, dando vueltas alrededor del núcleo atómico: Primeros modelos atómicos Posteriormente, y superado también el modelo propuesto por Niels Bohr, se descubrió que esto no era cierto, en su lugar, tenemos más probabilidad de encontrar a los electrones en unas especies de pieles que envuelven al núcleo llamadas orbitales. Los orbitales no son planos como las órbitas del modelo planetario, sino tridimensionales, como el cuero que envuelve a un balón de fútbol o de rugby. Existen varios tipos de orbitales, teniendo cada tipo una forma diferente. Puedes consultarlos de forma más detallada al final de este texto. Orbitales atómicos La estructura de la corteza electrónica es un poco complicada, pero es necesario entenderla para poder entender la razón de por qué el sistema periódico es como es, para entender la razón de que los estados de oxidación de los elementos son los que son, para entender el motivo por el que los elementos forman un tipo de moléculas y no otros y, en definitiva, para poder entender por qué tú, como yo, y como todas las cosas que ves, existen. Aquí encontrarás algo curioso La tabla periódica (Autor: Damián Calvo) 7 3.2.1. Los números cuánticos, definición Es posible que hayas oído hablar de la mecánica cuántica, física cuántica o química cuántica. Todas estas acepciones responden a un mismo concepto, algo complicado, es cierto, pero su base es relativamente sencilla. Del mismo modo que las matrículas de los coches de un país son únicas e irrepetibles, (no hay dos coches que tengan la misma matrícula), podemos formar una especie de “matrícula” para cada uno de los electrones que posee un átomo, formada por una serie de “cifras” que llamamos números cuánticos. Como en el caso de las matrículas de los coches, los números cuánticos forman la matrícula de un electrón y se determinan siguiendo unas reglas sencillas. (Los tres primeros también “codifican” los orbitales que los albergan). Los números cuánticos son cuatro: n, l, m, s. Se escriben por ese orden, son números sencillos, pequeños y enteros, excepto s que es fraccionario. Sus reglas de formación son las siguientes: Números cuánticos: n, l, m, s Número cuántico n l m s Valor mínimo 1 0 -l -1/2 Valor máximo Sin límite n-1 +l +1/2 Funcionalidad Determina la capa o nivel Determina el orbital Determina el suborbital Determina el sentido de giro del electrón Como puedes ver en esta tabla: El número cuántico principal n, no depende de nadie. El valor máximo para el número cuántico secundario l depende del valor de n. Para el número cuántico magnético m, su valor mínimo y su valor máximo, dependen del valor que tome l. (A veces se le llama ml). El número cuántico de espín s, no depende de nadie. (A veces se le llama ms) Aquí encontrarás más información (Ojo, la simulación solo funciona si tienes Windows 7 o superior. Con Windows XP o inferior no funciona). Y aquí tienes un vídeo para profundizar La tabla periódica (Autor: Damián Calvo) 8 Número cuántico principal: n Indica la capa o nivel donde se sitúa el electrón. Hay que tener en cuenta que los orbitales que existen en torno a un núcleo atómico están dispuestos en capas, también llamadas niveles, siendo la primera la más cercana al núcleo atómico. Su valor puede ir desde 1 hasta infinito. Los nombres de las capas son los siguientes: n=1 Capa más interna: K n=2 Segunda capa: L n=3 Tercera capa: M n=4 Cuarta capa: N, etc. Debes darte cuenta de que todos los nombres siguen un orden alfabético, excluida la Ñ, y son letras mayúsculas. Número cuántico secundario: l También se le llama azimutal o angular. Indica el tipo de orbital, su forma geométrica, ocupado por el electrón. Su valor va desde 0 hasta n-1. Los nombres de los orbitales son los siguientes: l=0 orbital s (sharp) l=1 orbital p (principal) l=2 orbital d (difuso) l=3 orbital f (fundamental) A partir de aquí se sigue por orden alfabético. Debes darte cuenta de que todos los nombres son letras minúsculas. Número cuántico magnético: m (A veces se le denomina por ml) Define el tipo de suborbital. (su diferencia más evidente es la forma que tienen). Su valor va desde -l hasta +l, siendo l e número cuántico secundario. Cada valor que pueda tomar m representa un tipo de suborbital dentro del orbital que determine el valor de l. (Véase más adelante) Sus nombres no van a ser tratados aquí. Debes darte cuenta de que son números positivos, negativos o cero. La tabla periódica (Autor: Damián Calvo) 9 Número cuántico de espín: s (a veces se le denomina por ms) Determina el sentido de giro del electrón sobre su propio eje. Su valor puede ser -1/2 o +1/2, independientemente del valor del resto de números cuánticos. Representando que el electrón puede girar sobre si mismo a derechas o a izquierdas. Dado que el giro a derechas o a izquierdas depende de desde donde miremos al electrón, no es posible asignar sus valores a un sentido concreto del giro. Fíjate que e el único número cuántico fraccionario y que no depende de donde esté el electrón, solo de su sentido de giro de los dos posibles que tiene: a derechas o a izquierdas. 3.2.2. Los números cuánticos, formación La colocación de los electrones se asemeja a la caída de una serie de bolas en una caja. Primero se llenarán los huecos inferiores, después, las bolas que sigamos metiendo en la caja se situarán sobre las primeras, pero no podrán ocupar sus huecos porque están ocupados ya por esas primeras bolas. Si seguimos introduciendo bolas, las nuevas se situarán sobre las que ya están colocadas y así sucesivamente. La razón de que esto ocurra es que las bolas tienden a ocupar las posiciones de menor energía de todas aquellas que les sea posible ocupar. Les sucede como a los humanos, tratamos de conseguir nuestros objetivos con el menor trabajo posible. Al fin y al cabo es una especie de ley de la naturaleza. Para las bolas, la posición de menor energía posible es la que le permita estar lo más cerca posible del centro de la Tierra, por lo tanto, la primera bola caerá hasta el fondo de la caja. La segunda bola, si puede, también se situará en el fondo de la caja. La tercera hará lo mismo pero habrá alguna que ya no quepa en el fondo y tendrá que situarse sobre las anteriores y así sucesivamente hasta que todas las bolas estén dentro de la caja. Los electrones hacen algo parecido. Cuando queremos colocar los electrones alrededor de un átomo, el primero se situará lo más cerca posible del núcleo y los demás se situarán lo más “abajo” posible, o sea, lo más cerca que puedan del núcleo... si es que los anteriores les dejan hueco. Respecto de la energía, con los números cuánticos tenemos una ventaja. Ellos nos dicen cual es la energía de un electrón y, los tres primeros, también nos dicen la energía del orbital que ocupa, solo hay que seguir tres reglas muy fáciles para conocerla, (en ausencia de campo magnético): La tabla periódica (Autor: Damián Calvo) 10 1- La energía de un orbital y, por tanto, de un electrón que esté en ese orbital, viene dada por la suma de los números cuánticos principal y secundario: n + l 2- Si dos orbitales (o sus electrones), tienen igual valor para n + l, la menor energía será para el menor valor de n. 3- Dado que dos o más orbitales (o sus electrones), pueden tener iguales valores de n y l, sus respectivos números cuánticos m serán lo más bajos posibles pero diferentes entre ellos, siempre que esto sea posible. Una vez definidos los números cuánticos vamos a ver como funcionan. Para ello formemos los números cuánticos de los electrones de un átomo cualquiera, por ejemplo el magnesio: Mg, sabiendo que hemos de ir cogiéndolos de forma que su energía sea la menor posible, empezaremos por los menores valores de n y también los menores valores de l, sin que se formen repeticiones del conjunto de los cuatro números cuánticos entre diferentes electrones. (Una forma fácil de hacer esto es seguir el diagrama de Möeller, pero aún no lo conocemos, lo dejamos para más adelante). Muy importante: La formación de los números cuánticos no depende del elemento seleccionado, los números se formarán de la misma forma sea cual fuere el elemento elegido. El hecho de elegir el magnesio, o cualquier otro elemento, solo nos determina el número de electrones que vamos a colocar en torno a su núcleo. Consultando el sistema periódico, podemos encontrar al magnesio en el periodo 3 y grupo 2. Lo primero que necesitamos es saber cuantos electrones tiene nuestro átomo: Vemos que su número atómico Z es 12, por lo que su núcleo posee 12 protones. Dado que todos los átomos son eléctricamente neutros, es imprescindible que el magnesio tenga 12 electrones, así su carga compensará exactamente la de los protones nucleares. Sabiendo ahora que debemos colocar 12 electrones en torno al núcleo de magnesio, vamos a irlos colocando por orden: La tabla periódica (Autor: Damián Calvo) 11 Electrón 1 n: Tomaremos el menor valor de n disponible. Como todavía no hay ningún electrón colocado, será el valor 1, puesto que entrará en la primera capa, la más cercana al núcleo. Ya tenemos el primer número cuántico del primer electrón del magnesio: n=1. l: Dado que el valor de n, para el electrón que estamos estudiando, es 1, el número cuántico l sólo puede valer 0. Ya tenemos el segundo número cuántico del primer electrón del magnesio: l=0. lo que nos indica que el orbital donde está es un orbital s. m: Dado que el valor de l, para el electrón que estamos estudiando, es 0, el número cuántico m sólo puede valer 0. Ya tenemos el tercer número cuántico del primer electrón del magnesio: m=0. s: Independientemente de los valores anteriores de n, l y m, el número cuántico s tendrá el valor -1/2 o 1/2, como las reglas nos obligan a elegir primero el menor, su valor será -1/2. Ya tenemos el cuarto número cuántico del primer electrón del magnesio: s=-1/2. BIEN, ya tenemos los números cuánticos del primer electrón de nuestro átomo de magnesio, estos números son: Electrón Nº 1: 1, 0, 0, -1/2 Antes se ha comentado que el orbital donde está también viene codificada por los tres primeros números cuánticos, por lo que este electrón estará en el orbital de “matrícula” 1,0,0. El nombre de este orbital es: 1s, el 1 porque está en la capa 1 (n=1), y la s porque el número cuántico secundario l vale 0. Ya veremos como influye en el nombre el tercer número cuántico. La tabla periódica (Autor: Damián Calvo) 12 Electrón 2 Siguiendo las reglas anteriores, es fácil deducir que podemos tomar los mismos números cuánticos n, l y m que en el caso del primer electrón si elevamos el valor de s. Puesto que podemos tomar el valor 1/2, ya tenemos los números cuánticos del segundo electrón de nuestro átomo de magnesio: Electrón Nº 2: 1, 0, 0, 1/2 Como ves, las “matrículas” de ambos electrones son distintas y ambas han sido formadas por los menores números cuánticos posibles, siguiendo las reglas de formación antes mencionadas. Como antes, el orbital donde está también viene codificada por los tres primeros números cuánticos, por lo que este electrón estará en el orbital de “matrícula” 1,0,0. El nombre de este orbital es: 1s, exactamente el mismo orbital que el ocupado por el electrón anterior. Como puedes ver, el orbital s de la capa 1 (1,0,0), puede tener dos electrones cuyos números cuánticos son diferentes: 1,0,0,-1/2 y 1,0,0,1/2. Observa que para que dos electrones puedan ocupar el mismo orbital deben girar en sentidos opuestos, uno hacia la derecha y el otro hacia la izquierda, según indica el valor del número cuántico de espín s. La tabla periódica (Autor: Damián Calvo) 13 Electrón 3 n: Tomaremos el menor valor de n disponible. Como ya no podemos formar más combinaciones de números cuánticos diferentes con el valor de n=1, necesitamos tomar el siguiente valor más pequeño de los posibles, será el valor 2. Ya tenemos el primer número cuántico del tercer electrón del magnesio: n=2, que estará en un orbital de la segunda capa. l: Dado que el valor de n, para el electrón que estamos estudiando, es 2, el número cuántico secundario l podrá valer 0 o 1. Como el menor de los valores posibles es 0, será el que tomemos. Ya tenemos el segundo número cuántico del tercer electrón del magnesio: l=0, lo que nos indica que el orbital donde está es un orbital s. m: Dado que el valor de l, para el electrón que estamos estudiando, es 0, el número cuántico m sólo puede valer 0. Ya tenemos el tercer número cuántico del tercer electrón del magnesio: m=0. s: Independientemente de los valores anteriores de n, l y m, el número cuántico s tendrá el valor -1/2 o 1/2, como las reglas nos obligan a elegir primero el menor, su valor será -1/2. Ya tenemos el cuarto número cuántico del primer electrón del magnesio: s=-1/2. BIEN, ya tenemos los números cuánticos del tercer electrón de nuestro átomo de magnesio, estos números son: Electrón Nº 3: 2, 0, 0, -1/2 Como antes, el orbital donde está también viene codificada por los tres primeros números cuánticos, por lo que este electrón estará en el orbital de “matrícula” 2,0,0. El nombre de este orbital es: 2s. Electrón 4 Siguiendo las reglas anteriores, es fácil deducir que podemos tomar los mismos números cuánticos n, l y m que para el tercer electrón si tomamos un valor distinto para s. Puesto que podemos tomar el valor 1/2, ya tenemos los números cuánticos del cuarto electrón de nuestro átomo de magnesio: Electrón Nº 4: 2, 0, 0, 1/2 Como puedes ver, el orbital s de la capa 2 (2,0,0), puede tener dos electrones cuyos números cuánticos son diferentes: 2,0,0,-1/2 y 2,0,0,1/2. Observamos de nuevo que para que dos electrones puedan ocupar el mismo orbital deben girar en sentidos opuestos, uno hacia la derecha y el otro hacia la izquierda. Hasta ahora hemos colocado cuatro electrones, dos en el orbital s de la capa 1 y otros dos en el orbital s de la capa 2, siendo los nombres de estos orbitales 1s y 2s, y los números cuánticos de estos orbitales 1,0,0 y 2,0,0. La tabla periódica (Autor: Damián Calvo) 14 Electrón 5 n: Tomaremos el menor valor de n disponible. Como ya hemos tomado los valores -1/2 y 1/2 para la secuencia 2,0,0…, deberíamos elevar el número cuántico magnético m pero como solo es posible tomar el valor m=0 puesto que l=0, no podemos modificar el valor de m, por lo que la secuencia 2,0… ya está completa. El siguiente paso es tratar de elevar el valor del número cuántico l. Dado que n=2, el valor de l=1 es posible y será el que tomemos. Por lo tanto, es posible continuar con el valor 2 para el número cuántico principal n. Ya tenemos el primer número cuántico del quinto electrón del magnesio: n=2, que estará también en la segunda capa. l: Teniendo en cuenta lo expresado justo arriba, el valor del número cuántico secundario que hemos de tomar es 1. Ya tenemos el segundo número cuántico del quinto electrón del magnesio: l=1. Ahora podemos observar que este electrón no estará en un orbital s sino en uno p, concretamente en el 2p. m: Dado que el valor de l, para el electrón que estamos estudiando, es 1, el número cuántico magnético m podrá valer -1, 0 o 1, siguiendo las reglas, elegiremos el menor de ellos: -1. Ya tenemos el tercer número cuántico del quinto electrón del magnesio: m=-1. Como el orbital puede tener tres números cuánticos magnéticos m distintos, definimos como suborbital a aquellos orbitales que tienen distintos números cuánticos m para el mismo tipo de orbital que diga el número cuántico l. Los tres suborbitales existentes para el orbital p son los siguientes: 1- Para m=-1 suborbital px 2- Para m=0 suborbital py 3- Para m=1 suborbital pz Debes tener en cuenta que llamarles suborbitales es solo una forma de hablar, también podemos decir que hay tres orbitales del tipo p. En nuestro caso, el electrón número 5 estará en el suborbital p x. Siempre podremos decir que el quinto electrón está en un orbital 2p y, si queremos concretar, diremos que está en el orbital 2px. (Recuerda que podemos llamarle también orbital a este tipo de suborbitales). La matrícula de este orbital, o suborbital, tanto da, es 2,1,-1. s: Independientemente de los valores anteriores de n, l y m, el número cuántico s tendrá el valor -1/2 o 1/2, como las reglas nos obligan a elegir primero el menor, su valor será -1/2. Ya tenemos el cuarto número cuántico del quinto electrón del magnesio: s=-1/2. BIEN, ya tenemos los números cuánticos del quinto electrón de nuestro átomo de magnesio, estos números son: Electrón Nº 5: 2, 1, -1, -1/2 La tabla periódica (Autor: Damián Calvo) 15 Electrón 6 n: Es fácil ver que aún quedan combinaciones diferentes que podemos tomar sin variar n, por lo tanto n=2 seguirá siendo el número cuántico principal del sexto electrón. Ya tenemos el primer número cuántico del sexto electrón del magnesio, seguirá siendo n=2. Estará en la capa 2. l: Por la misma razón anterior, podemos mantener el mismo valor de l. Ya tenemos el segundo número cuántico del sexto electrón del magnesio: l=1. Estará en un orbital p, más concretamente en un orbital 2p. m: La combinación de números cuánticos del electrón número 5 comenzaba por 2,1, por lo que el número cuántico magnético m puede valer -1, 0 o 1. Hay ya un electrón con el valor l=-1, el quinto, y es cierto que podemos colocar otro electrón más con l=-1 si hacemos que su número cuántico de espín s valga 1/2, pero tomando en cuenta la regla número 3, antes de asignar este valor de s deberemos tomar el resto de valores posibles para m. Como el valor más bajo disponible es el 0, ya tenemos el tercer número cuántico del sexto electrón del magnesio: m=0, lo que nos dice que estará en el suborbital p y, más concretamente en el 2py, cuyos números cuánticos son 2,1,0. s: Independientemente de los valores anteriores de n, l y m, el número cuántico s tendrá el valor -1/2 o 1/2, como las reglas nos obligan a elegir primero el menor, su valor será -1/2. Ya tenemos el cuarto número cuántico del sexto electrón del magnesio: s=-1/2. BIEN, ya tenemos los números cuánticos del sexto electrón de nuestro átomo de magnesio, estos números son: Electrón Nº 6: 2, 1, 0, -1/2 Electrón 7 Siguiendo el mismo razonamiento que en el caso del sexto electrón, los números cuánticos del séptimo serán: Electrón Nº 7: 2, 1, 1, -1/2 Como el número cuántico principal es n=2, el electrón estará en la capa 2. Como el número cuántico secundario es l=1, el electrón estará en un orbital p. Como el número cuántico magnético es m=1, nuestro electrón estará en el suborbital pz. Los números cuánticos de este orbital 2pz son 2,1,1. La tabla periódica (Autor: Damián Calvo) 16 Electrón 8 Ya hemos colocado los tres valores posibles del número cuántico magnético m para la combinación de n y l dada por 2,1; por lo tanto, el octavo electrón debe volver a tomar el menor valor de m que aún tenga hueco. Ese valor es l=-1, dado que sólo hemos tomado el valor de s=-1/2 y está libre todavía el valor s=1/2. Por lo tanto, los números cuánticos del electrón octavo serán los siguientes: Electrón Nº 8: 2, 1, -1, 1/2 Este electrón estará en el orbital 2,2,-1, que es el orbital 2px que ya tiene un electrón, concretamente el quinto. ¿Cabe el electrón 8 en un orbital que ya contiene al quinto electrón? Para saberlo comprobamos si los números cuánticos de ambos electrones son distintos. Si fueran iguales no podrían estar juntos en este orbital. Los números cuánticos del quinto electrón son 2, 1, -1, -1/2 y los del octavo electrón son 2, 1, -1, 1/2. Como puedes ver son distintos, por lo que ambos electrones pueden estar en el orbital 2px. Nuevamente se cumple que un mismo orbital puede tener dos electrones si estos giran en sentidos opuestos. Siguiendo las normas de formación y los procedimientos seguidos antes, comprueba que los números cuánticos de los electrones que nos quedan por añadir son los siguientes: Electrón 9 10 11 12 Números cuánticos 2, 1, 0, 1/2 2, 1, 1, 1/2 3, 0, 0, -1/2 3, 0, 0, 1/2 Orbital donde está está en el orbital 2py. está en el orbital 2pz. está en el orbital 3s. está en el orbital 3s. Echemos un vistazo a modo de resumen: Tenemos dos electrones en la primera capa, en un orbital s. Tenemos ocho electrones en la segunda capa, dos en un orbital s y seis en tres orbitales p. Por último, tenemos dos electrones en la tercera capa, en un orbital s. En total hemos colocado los doce electrones que tiene el átomo de magnesio. La tabla periódica (Autor: Damián Calvo) 17 3.2.3. Los números cuánticos, configuración electrónica Como ya has visto cuando definimos el número cuántico secundario l, su valor determina el tipo de orbital que ocupa el electrón. Repasémoslo: Tipos de orbitales respecto del valor del número cuántico secundario l: l=0 orbital s, solo hay un tipo de orbital s. l=1 orbital p, hay tres tipos de suborbitales p. l=2 orbital d, hay cinco tipos de suborbitales d. l=3 orbital f, hay siete tipos de suborbitales f. Fíjate: 1- Los orbitales s corresponden al valor 0 del número cuántico secundario l, por tanto, el único valor que puede tener el número cuántico magnético m es 0. Dado que m solo puede tener un valor para este tipo de orbital, quiere decir que sólo hay un tipo de orbital s, no hay suborbitales s. 2- Los orbitales p se corresponden con el valor 1 del número cuántico secundario l, por tanto, el número cuántico magnético m puede tomar tres valores diferentes: -1, 0 y 1. Dado que m puede tener tres valores para este tipo de orbital significa que hay tres suborbitales p, que llamaremos: px, py y pz. 3- Los orbitales d se corresponden con el valor 2 del número cuántico secundario l, por tanto, el número cuántico magnético m puede tomar cinco valores diferentes: -2, -1, 0, 1 y 2. Dado que m puede tener cinco valores para este tipo de orbital significa que hay cinco suborbitales d, que llamaremos: dz2, dxy, dyz, dxz, dx2-y2. 4- Los orbitales f se corresponden con el valor 3 del número cuántico secundario l, por tanto, el número cuántico magnético m puede tomar siete valores diferentes: -3, -2, -1, 0, 1, 2 y 3. Dado que m puede tener siete valores para este tipo de orbital significa que hay siete suborbitales f, que llamaremos: fz3, fxz2, fyz2, fx(x2-3y2), fy(y2-3x2), fz(x2-3y2) y fxyz. Según la tabla anterior, nuestro átomo de magnesio posee: 1- Dos electrones en la capa 1 (K), alojados en un orbital s. Como este orbital s pertenece a la capa 1, le llamaremos orbital 1s, además, como posee dos electrones, le llamaremos 1s2. 2- Ocho electrones en la capa 2 (L), dos de ellos, el tercero y el cuarto, alojados en un orbital s. Como este orbital s pertenece a la capa 2, le llamaremos orbital 2s, además, como posee dos electrones, le llamaremos 2s2. Los otro seis electrones de la capa 2, del quinto al décimo, están alojados en un orbital p (puesto que l=1). Como este orbital pertenece a la capa 2, le llamaremos orbital 2p y los suborbitales que tienen los electrones son p x2 , p y2 y p z2 . En total hay seis electrones en orbitales p de la capa 2, por lo que podemos escribir 2p6, si no tenemos en cuenta los suborbitales. La tabla periódica (Autor: Damián Calvo) 18 3- Dos electrones en la capa 3 (K), alojados en un orbital s. Como este orbital s pertenece a la capa 3, le llamaremos orbital 3s, además, como posee dos electrones, le llamaremos 3s2. Si colocamos el símbolo del elemento que estamos estudiando, encerrado entre corchetes, seguido de los orbitales que tienen electrones, por orden, indicando los electrones que tiene cada uno de ellos y sin tener en cuenta los suborbitales, podemos escribir lo siguiente: [Mg]: 1s2 2s2 2p6 3s2 Pues bien, esta forma de escribir la distribución de los electrones de un átomo se llama configuración electrónica. La configuración electrónica de los átomos es tremendamente importante, ella nos dice mucho sobre las propiedades químicas de los elementos, así como explica la colocación de los elementos en la tabla periódica y nos muestra la causa por la que los elementos que pertenecen a un mismo grupo poseen propiedades muy parecidas. En definitiva, la configuración electrónica de los elementos nos explica la base de las leyes que rigen el comportamiento químico de los elementos, lo que supone que es el fundamento básico de la existencia de la química como ciencia. También se suele escribir la configuración electrónica basándose en la del gas noble inmediatamente anterior y terminando por escribir solo los electrones que le faltan a ese gas noble hasta llegar al elemento que estemos considerando. Para nuestro magnesio tendremos la siguiente configuración electrónica: [Mg]: [Ne] 3s2 Puedes ver que solo se muestran los orbitales de la última capa, llamados electrones de valencia, está claro que en el magnesio son los dos electrones del orbital 3s, siendo la capa 3 la última para este elemento químico. Por último, también se suelen mostrar los electrones mediante pequeñas flechas verticales, dirigidas hacia arriba cuando s=-1/2 y hacia abajo si s=1/2. Dado que el magnesio es demasiado sencillo, veamos el caso del azufre, tendremos lo siguiente: Aquí tienes un interesante vídeo para profundizar Podrás practicar estos y otros temas pinchando en este enlace. La tabla periódica (Autor: Damián Calvo) 19 3.3. Configuración electrónica y estados de oxidación Entre las leyes básicas de la química existe una que nos dice que los átomos tienen la tendencia a tener ocho electrones en su última capa, pudiendo ganar, perder o compartir electrones para conseguirlo. La excepción es el periodo 1 de la tabla periódica, dado que solo pueden tener una capa y esta solo dos electrones como máximo. Por ejemplo, consideremos nuestro átomo de magnesio, podemos ver que posee dos electrones en su última capa, que es la 3. Para conseguir tener ocho electrones necesita ganar seis, algo que no es nada fácil. Otra opción es perder los dos electrones que posee en la capa 3, de esta forma su última capa pasaría a ser la 2 y tendría ocho electrones. Esta es la explicación de por qué el magnesio tiene tendencia a perder dos electrones, quedándose por tanto con dos cargas positivas, lo que significa que su estado de oxidación sea +2. Debes notar que el estado de oxidación, o número de oxidación, es un número con signo, por lo que se escribe primero el signo y después el número, Siendo necesario escribir siempre el signo, incluso cuando es positivo. Lo mismo les ocurre a todos los elementos del grupo 2 y algo parecido les ocurre a todos los elementos del grupo 1 pero aquí considerando que solo tienen un electrón en su última capa. Si consideramos los halógenos, grupo 17, todos ellos poseen siete electrones en su última capa, por lo que su tendencia será la de ganar un electrón, justificando su estado de oxidación -1. Estudiando los elementos del grupo 16, vemos que poseen seis electrones en su última capa, por lo que su tendencia será a ganar dos electrones, justificándose así sus estados de oxidación de -2. La explicación del resto de estados de oxidación de los halógenos y anfígenos es materia para un curso de más nivel. Por ahora te has librado de ello, aunque no creas que es difícil de entender. Podrás ver los estados de oxidación de todos los elementos químicos, y más cosas, pinchando sobre cada elemento en este enlace. La tabla periódica (Autor: Damián Calvo) 20 3.4. Configuración electrónica y sistema periódico La configuración electrónica determina la forma que posee el sistema periódico. Como puedes comprobar, solo puede haber dos electrones en la primera capa electrónica de los átomos, por lo que si un átomo posee uno o dos electrones, los alojará en la primera capa. Esta es la razón de por qué solo hay dos elementos en el periodo 1: el hidrógeno: H y el helio: He. Si estudiamos la segunda capa, veremos que podrá tener un máximo de ocho electrones, dos en un orbital s y seis en orbitales p. Esta es la razón de por qué existen ocho elementos en el segundo periodo. Puedes preguntarte por qué el boro está en el grupo 13 y no en el 3. La razón es que los grupos 1 y 2 tienen su último electrón, llamado electrón diferenciador, en un orbital s, los grupos del 13 al 18 colocan su último electrón en orbitales p, mientras que los elementos situados en los grupos del 3 al 12 sitúan su último electrón en orbitales d. De esta forma se consigue que los elementos situados en un mismo grupo tengan propiedades semejantes, que es lo que se quiere con la estructura dada al sistema periódico. Por último, los elementos situados abajo y fuera de la estructura general del sistema periódico, los lantánidos y los actínidos, sitúan su último electrón en orbitales f. El orbital donde se sitúa el último electrón de un átomo le da nombre a los cuatro bloques del sistema periódico: Bloque s: Grupos 1 y 2, más el helio. Bloque p: Grupos del 13 al 18, excepto el helio. Bloque d: Grupos del 3 al 12. Elementos de transición. Bloque f: Lantánidos y actínidos. Por ahora no existen más bloques en la tabla periódica pero, si se siguen sintetizando elementos de forma artificial, se llegará a necesitar colocar electrones en orbitales g (aquellos en que el número cuántico secundario vale 4), por lo que aparecerá el bloque g, que tendrá un máximo de... exacto: 18 electrones. ¿Puedes explicar la razón? Seguro que sí. Nota: Si es la primea vez que lees este escrito, sigue ahora por el punto 6.1 y luego vuelve aquí. Para ello pincha aquí La tabla periódica (Autor: Damián Calvo) 21 3.5. Origen de los elementos químicos Dado que, como se comprobó cuando se descubrió la radiactividad, los átomos pueden generarse a partir de otros átomos, surge la pregunta sobre cual fue su primer origen. El modelo teórico actualmente admitido por la comunidad científica se basa en la Teoría del Big Bang. Según esta teoría, la formación de elementos se realiza en tres procesos, al que hay que añadir la generación a partir de rayos cósmicos, aunque esta generación de elementos ya no pertenece a la teoría del Big Bang Nucleosíntesis primigenia: Se forman básicamente núcleos de hidrógeno (75%) y helio (25%). Ocurrió al comienzo del big bang, después de la bariogénesis, desde el segundo 100 al 300, Formándose los átomos neutros en el año 380 000, (temperatura del universo sobre los 3000 K). Fusión nuclear al final del periodo de actividad de las estrellas. Se forman núcleos sucesivamente más pesados, hasta el hierro. Fusión nuclear en explosiones de supernova. Se forman los núcleos más pesados que el hierro. A partir de rayos cósmicos: Se forma principalmente 3He, Li, Be y B. El mecanismo se basa en la colisión de los rayos cósmicos con la materia que ocupa el espacio interestelar. Aquí tienes más información La tabla periódica (Autor: Damián Calvo) 22 3.6. Descubrimiento de los elementos químicos Aquí se incluyen los elementos naturales y los artificiales, sintetizados por el hombre, dado que, en caso de haberse formado en la naturaleza, su vida media es lo suficientemente baja como para que todos sus átomos se hayan desintegrado. 3.6.1. Elementos naturales Los elementos químicos han ido descubriéndose a lo largo de la historia, siendo los primeros los metales menos reductores como el oro, la plata y posteriormente el cobre y el mercurio. La evolución de la metalurgia permitió la obtención del hierro (edad del hierro, siglo XV a.c.). Los romanos también utilizaron el plomo para tuberías y recipientes, el azufre y conocían el carbono (negro de humo y diamante). En el siglo XVII se descubrieron elementos tales como fósforo (1669), arsénico, antimonio, bismuto y zinc. Los descubrimientos continuaron hasta el siglo XX, en el que se descubrieron los restantes elementos naturales y los isótopos por Soddy. 3.6.2. Elementos artificiales La aparición de los aceleradores de partículas permitió sintetizar elementos que no pueden ser encontrados en la naturaleza como el tecnecio, así como el lantánido que faltaba de su serie, el prometio. El descubrimiento del neutrón, y su uso como proyectil, permitió la síntesis del primer transuránido, el neptunio. Posteriormente, Seaborg sintetizó los siguientes transuránidos hasta Z=100: plutonio, americio, curio, berkelio, californio, einstenio y fermio, siéndolo a continuación el resto de actínidos mendelevio, nobelio y laurencio (Z=103). La síntesis de elementos nuevos no ha terminado, habiéndose añadido al inventario los siguientes elementos posteriores al laurencio: Rutherfordio, dubnio, seaborgio, bohrio, hassio, meitnerio, darmstadtio, roentgenio y copernicio, (Z=112). Habiéndose añadido últimamente el flevorio (Z=114) y el livermorio y (Z=116) Estando pendiente de recibir nombre propio los elementos a los que provisionalmente se les denomina como ununtrio, ununpentio, ununseptio y ununoctio. Mas información aquí y aquí La tabla periódica (Autor: Damián Calvo) 23 4. Evolución histórica de la clasificación periódica de los elementos Con el paso del tiempo, el número de elementos conocidos iba creciendo y los científicos empezaron a buscar patrones en sus propiedades y a desarrollar esquemas para su clasificación sistemática. 1. Tomando como base la cultura que ha determinado nuestro conocimiento actual, la primera clasificación que nos encontramos se la debemos a los antiguos griegos de los tiempos presocráticos (año 450 AC) quienes reconocían los cuatro elementos: Aire, Tierra, Fuego y Agua Aristóteles añadió un quinto elemento (año 350 AC), la quintaesencia. 2. En 1789, el francés Lavoisier, padre de la química, dividió los elementos naturales en dos grandes grupos: metales y no metales, según su aspecto y propiedades físicas. 3. En 1829, Döbereiner propuso la existencia de tríadas de elementos de forma que el central tenía propiedades promedio entre las de los extremos (la Ley de Tríadas), por ejemplo: Li Na K, Fe Co Ni y Cl Br I. Las tríadas hacían sospechar que existía una cierta regularidad entre los elementos químicos pero nada se sabía sobre la regla que dirigiría dicha regularidad. 4. En 1850, el químico francés Jean-Baptiste Dumas estableciendo cinco familias: H, C, N, O y F. 5. En 1862, Chancourtois dispuso los elementos según el orden creciente de sus pesos atómicos sobre una curva helicoidal en el espacio, tornillo telúrico, de manera que los puntos que se correspondían sobre las sucesivas vueltas de la hélice, diferían en 16 unidades de peso atómico. Los elementos análogos estaban situados en tales puntos, lo que sugería una repetición periódica de las propiedades. 6. En 1865, Newlands ordenó los elementos conocidos en orden creciente de pesos atómicos, observando que el octavo elemento se parecía al primero, el noveno al segundo, y así sucesivamente. Por el parecido con las notas musicales que se dividen en octavas, Newlands enunció su Ley de las octavas, por ejemplo: H, Li, Be, B, C, N, O. 7. En 1869, el químico alemán Lothar Meyer modificó la ordenación teniendo en cuenta también los volúmenes atómicos al percatarse de la existencia de una cierta periodicidad en el volumen atómico. La tabla periódica (Autor: Damián Calvo) 24 8. Fue el químico ruso Mendeléiev en 1869 quien desarrolló la ley periódica: “Las propiedades de los elementos químicos no son arbitrarias sino que varían con el peso atómico de una manera periódica”, siendo su tabla precursora de la actual. Dispuso los elementos en orden creciente de los pesos atómicos, pero dejando huecos para elementos aún no descubiertos, formando periodos largos para separar metales de no metales y predijo la existencia de elementos como el germanio, al que anticipó como ekasilicio. La ventaja de la tabla de Mendeleiev era que mostraba relaciones verticales, horizontales, y diagonales. 9. En 1898, Ramsey sugirió que el argón, descubierto por Rayleigh en 1895, se colocara en un nuevo grupo cero, debido a la valencia cero de estos elementos, a este grupo pertenecen los gases nobles. 10. En 1913, Moseley ordenó los elementos de la tabla periódica por su número atómico, evitándose así los problemas de falta de correlatividad que se presentaban al ordenar los elementos según su peso atómico. Quedaba claro que las propiedades de los elementos variaban periódicamente con su número atómico, no con su peso atómico, definiéndose elemento químico como la sustancia cuyos átomos tienen todos el mismo número de protones en el núcleo, su número atómico, y por tanto, el mismo número de electrones en la corteza, siendo esta una definición conceptual y no operacional de elemento. 11. En 1950, Glenn Seaborg, sintetizó los actínidos que faltaban y reconfiguró la tabla periódica poniendo su serie debajo de la serie de los lantánidos, dándole a la tabla periódica su estructura actual. 12. En 1988, la IUPAC aceptó la propuesta de Werner y Paneth de una numeración consecutiva para los grupos, desde el 1 (alcalinos) hasta el 18 (gases nobles). Puedes encontrar más información y curiosidades en este enlace. La tabla periódica (Autor: Damián Calvo) 25 5. Tabla Periódica La tabla periódica se escribió en base a la experiencia. Es el resultado del avance del saber humano a lo largo de la historia en la clasificación de los elementos químicos mediante la observación de sus propiedades. “La tabla periódica consiste en la ordenación de los elementos conocidos, según su número atómico creciente, en 7 filas (periodos) y 18 columnas (grupos), de forma que los elementos de una misma columna posean propiedades físicas y químicas correlacionadas”. Siendo posible que en un futuro se puedan sintetizar elementos pertenecientes a un octavo periodo. Su estructura actual (año 2015) es la siguiente: (Escribirla: G1, G2, Periodo 4, Grupos, La, Ac, Periodo 7.) Al desplazarnos de izquierda a derecha a través de un periodo, cada elemento tendrá su número atómico una unidad superior al precedente y, por tanto, poseerá un electrón más, llamado electrón diferenciador, que se situará en el orbital disponible de menor energía. 5.1. Descripción de los periodos La tabla periódica consta de 7 periodos. Todos los periodos comienzan con un metal alcalino y acaban con un gas noble, excepto el primero que comienza con el hidrógeno, que no puede ser clasificado como metal alcalino. El último periodo acaba con el elemento Uuo (Z=118) que presumiblemente será también gaseoso y no reactivo, pudiendo catalogarse como gas noble. El número del periodo al que pertenece cada elemento coincide con el número de la capa más alta que posea al menos un electrón, en el estado de mínima energía del átomo neutro, su estado fundamental. La tabla periódica (Autor: Damián Calvo) 26 5.2. Descripción de los grupos La tabla periódica consta de 18 grupos, en cada uno de ellos, los elementos que contiene poseen, salvo excepciones justificadas en los elementos de transición, la misma configuración electrónica externa, siendo esta la razón de la similitud de sus propiedades. 5.2.1. Elementos representativos Los elementos representativos poseen su electrón diferenciador en el orbital s ó p del último nivel. Grupo Nombre 1 Alcalinos 2 Alcalinotérreos 13 Térreos 14 Carbonoideos o carbonoides 15 Nitrogenoideos o pnictógenos 16 Anfígenos o calcógenos 17 Halógenos 18 Gases nobles 5.2.2. Elementos de transición Están situados en el centro de la tabla, comprenden los grupos 3 al 12 y cada grupo se denomina por el elemento de cabecera, p.ej. grupo del zinc (Zn, Cd, Hg y Cn). Los elementos de transición poseen su electrón diferenciador en el orbital d del nivel n-1. 5.2.3. Elementos de transición interna Constituyen las series de los lantánidos y los actínidos. Se sitúan fuera de la tabla para evitar su excesiva longitud. Los elementos de transición interna poseen su electrón diferenciador en el orbital f del nivel n-2. 5.2.4. El hidrógeno El hidrógeno se sitúa en el grupo 1 y periodo 1 pero no puede ser considerado un metal alcalino. Otra posibilidad sería situarle en el grupo 17, dentro de los halógenos, pero su tendencia a ceder su electrón le acerca más a los alcalinos que a los halógenos. Hay tablas periódicas que le sitúan en el centro superior, sin hacerle pertenecer a ningún grupo en concreto. La tabla periódica (Autor: Damián Calvo) 27 5.3. Bloques en la tabla periódica En la tabla periódica es posible diferenciar cuatro bloques atendiendo a la localización del electrón diferenciador de los elementos, situándose este electrón en el orbital que da nombre al bloque. Bloque Grupos / Elementos Descripción s 1 y 2 y el He Elementos representativos p 13 al 18 (excepto He) Elementos representativos d 3 al 12 Elementos de transición f Lantánidos y actínidos Elementos de transición interna 6. Relación de la periodicidad con la configuración electrónica Aunque, como se ha visto, la tabla periódica se desarrolló basándose en la experiencia, hemos de preguntarnos por qué existe la ley periódica, La justificación de las propiedades químicas de los elementos reside en su configuración electrónica externa puesto que en ella residen los electrones que utiliza el átomo para unirse químicamente formando compuestos, una distribución electrónica externa similar se manifestará en unas propiedades químicas similares. Debido a que una misma configuración electrónica externa puede presentarse independientemente de la capa que ocupe, los elementos presentarán la misma configuración electrónica externa a medida que aumente el número de orden que ocupe dicha capa. Por lo tanto, la razón de la periodicidad de la configuración electrónica externa para los elementos de la tabla periódica, será la explicación de la periodicidad de sus propiedades químicas, justificando la “Ley Periódica”, atisbada por Chancourtois, manifestada por Mendeleiev y establecida por Moseley. 6.1. Periodicidad en la configuración electrónica La configuración electrónica de un átomo viene determinada por las siguientes reglas: Principio de máxima estabilidad: Los electrones se dispondrán de tal forma que se minimice la energía del átomo. Principio de exclusión de Pauli: En un átomo dado no pueden existir electrones con los cuatro números cuánticos iguales. Principio de la máxima multiplicidad de Hund: Cuando hay orbitales de idéntica energía (degenerados), los electrones los ocuparán tendiendo al máximo desapareamiento posible. Principio Aufbau o de construcción progresiva, que se basa en las reglas debidas a Bohr, de orden físico y a Bury, de orden químico. La tabla periódica (Autor: Damián Calvo) 28 La aplicación de estas reglas se representa en el diagrama de Möeller, que ordena los orbitales en orden creciente de energía: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. Los electrones se dispondrán, en cada capa o nivel de número cuántico n, teniendo en cuenta la capacidad de los tipos de orbitales que posea según sus números cuánticos: (en el estado fundamental, los orbitales tipo g no se ocupan nunca). Nº cuántico Tipo de Nº cuántico Nº de Nº máximo l (l < n) orbital m (-l m +l) orbitales de electrones 0 s 0 1 2 1 p -1 0 1 3 6 2 d -2 -1 0 1 2 5 10 3 f -3 -2 -1 0 1 2 3 7 14 Aplicando estas reglas se observa que los átomos de un elemento poseen un electrón más que el que le precede. Cada periodo contiene los elementos que poseen algún electrón en el mismo número de capa externa, de forma que cuando al final del periodo se completa la capacidad de esta capa, el siguiente elemento iniciará un nuevo periodo en el que la capa externa estará en un nivel superior, repitiéndose las configuraciones electrónicas externas respecto de aquellas del periodo anterior, siendo esta la razón de la existencia de periodicidad. Siguiendo el diagrama de Möeller, podemos formar ahora los números cuánticos de cualquier electrón de forma más exacta que siguiendo las reglas de elección de los menores números cuánticos. Para ello debemos ir tomando los orbitales por el orden en que aparecen en el diagrama e ir asignando los números cuánticos correspondientes. Tomemos como caso un elemento con Z>18, por ejemplo el bromo: Br, cuyo número atómico es Z=35. El orden de los orbitales que deberemos seguir, en base al diagrama de Möeller es el siguiente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. Ahora asignemos los números cuánticos correspondientes a estos orbitales y por ese orden: (Revisa las tres reglas del punto 3.2.2, ellas son las que justifican el diagrama de Möeller) La tabla periódica (Autor: Damián Calvo) 29 Posición del electrón Orden Orbital Suborbital 1 1s 2 1s 3 2s 4 2s 5 2p 2px 6 2p 2py 7 2p 2pz 8 2p 2px 9 2p 2py 10 2p 2pz 11 3s 12 3s 13 3p 3px 14 3p 3py 15 3p 3pz 16 3p 3px 17 3p 3py 18 3p 3pz 19 4s 20 4s 21 3d 3d(m=-2) 22 3d 3d(m=-1) 23 3d 3d(m=0) 24 3d 3d(m=1) 25 3d 3d(m=2) 26 3d 3d(m=-2) 27 3d 3d(m=-1) 28 3d 3d(m=0) 29 3d 3d(m=1) 30 3d 3d(m=2) 31 4p 4px 32 4p 4py 33 4p 4pz 34 4p 4px 35 4p 4py n 1 1 2 2 2 2 2 2 2 2 3 3 3 3 3 3 3 3 4 4 3 3 3 3 3 3 3 3 3 3 4 4 4 4 4 Números cuánticos l m s 0 0 -1/2 0 0 1/2 0 0 -1/2 0 0 1/2 1 -1 -1/2 1 0 -1/2 1 1 -1/2 1 -1 1/2 1 0 1/2 1 1 1/2 0 0 -1/2 0 0 1/2 1 -1 -1/2 1 0 -1/2 1 1 -1/2 1 -1 1/2 1 0 1/2 1 1 1/2 0 0 -1/2 0 0 1/2 2 -2 -1/2 2 -1 -1/2 2 0 -1/2 2 1 -1/2 2 2 -1/2 2 -2 1/2 2 -1 1/2 2 0 1/2 2 1 1/2 2 2 1/2 1 -1 -1/2 1 0 -1/2 1 1 -1/2 1 -1 1/2 1 0 1/2 Completo 1,0,0,-1/2 1,0,0,1/2 2,0,0,-1/2 2,0,0,1/2 2,1,-1,-1/2 2,1,0, -1/2 2,1,1,-1/2 2,1,-1,1/2 2,1,0,1/2 2,1,1,1/2 3,0,0,-1/2 3,0,0,1/2 3,1,-1,-1/2 3,1,0,-1/2 3,1,1,-1/2 3,1,-1,1/2 3,1,0,1/2 3,1,1,1/2 4,0,0,-1/2 4,0,0,1/2 3,2,-2,-1/2 3,2,-1,-1/2 3,2,0,-1/2 3,2,1,-1/2 3,2,2,-1/2 3,2,-2,1/2 3,2,-1,1/2 3,2,0,1/2 3,2,1,1/2 3,2,2,1/2 4,1,-1,-1/2 4,1,0,-1/2 4,1,1,-1/2 4,1,-1,1/2 4,1,0,1/2 No se han escrito los nombres de los suborbitales tipo d porque no los vamos a tener en cuenta, basta con saber que hay cinco diferentes porque el número cuántico magnético m puede tomar cinco valores diferentes cuando el número cuántico secundario l vale 3 (orbitales d). Llegados a este punto, estoy seguro de que la formación de los números cuánticos ya no sea ningún problema para ti, como tampoco lo será la obtención de la configuración electrónica de cualquier elemento. Si llegaste aquí pinchando un enlace, vuelve donde estabas pinchando aquí. La tabla periódica (Autor: Damián Calvo) 30 6.2. Periodicidad en las propiedades químicas La tabla periódica coloca los elementos que repiten su configuración electrónica externa en la misma columna, explicitándose así dicha periodicidad y justificando la periodicidad de las propiedades químicas, por ejemplo: Elementos con su última capa completa: esto significa que su reactividad química será nula. Todos ellos situados en el grupo 18 perteneciente a los gases nobles. Elementos que les falta un electrón para completar su última capa. Todos ellos pertenecen al grupo 17 de los halógenos, excepto el H. Elementos con dos electrones en su última capa: todos ellos situados en el grupo 2 de los alcalinotérreos. Etc. 7. Propiedades periódicas Las propiedades de los elementos varían tanto al desplazarnos a través de un periodo como dentro de un grupo, pudiéndose analizar, entre otras, las siguientes propiedades. 7.1. Radio atómico / volumen atómico Desde el punto de vista de la mecánica cuántica, el radio atómico es un concepto de difícil interpretación. Tomando como radio atómico la mitad de la distancia entre dos átomos del mismo elemento en estado sólido, considerados como esferas rígidas, se observa lo siguiente: Periodos cortos, (1, 2 y 3), podemos observar que presenta una disminución al aumentar Z siendo mínimo en el grupo 17 y creciendo ligeramente en el 18. (He > H) Periodos largos, se aprecian dos mínimos, uno como en los periodos cortos hacia el final del bloque p y otro dentro del bloque d. Con las características particulares anteriores, la tendencia general es que, en la tabla periódica, el radio atómico crezca hacia la izquierda en los periodos y hacia abajo en los grupos. El volumen atómico es en todo similar al radio atómico. La tabla periódica (Autor: Damián Calvo) 31 7.2. Energía de ionización (o potencial de ionización) La energía de ionización se define como la mínima energía necesaria para arrancar un electrón a un átomo gaseoso en su estado fundamental, convirtiéndose en un ión positivo gaseoso. Si el electrón ha de salir de un átomo que ya ha perdido algún electrón, la energía sería para la segunda y sucesivas ionizaciones. Sus unidades son de energía Cuanto menos retenido esté el electrón que se va a arrancar menor energía de ionización, por tanto dependerá de la fuerza con la que el núcleo atraiga al electrón, mayor cuanto más cerca esté del núcleo y cuanto mayor sea su carga. En general, en la tabla periódica la energía de ionización aumenta hacia la derecha en los periodos (mayor carga nuclear) y hacia arriba en los grupos (menor distancia al núcleo). Presentándose un pequeño máximo local hacia el final del bloque d por llenarse los niveles ns y (n-1)d, lo que representa una estructura de especial estabilidad. 7.3. Afinidad electrónica (o electroafinidad) Se define como la energía desprendida cuando un átomo gaseoso en su estado fundamental capta un electrón y se convierte en un ión negativo gaseoso, siendo sus unidades de energía. Por criterios semejantes a la energía de ionización, la afinidad electrónica aumentará, hacia la derecha en los periodos y hacia arriba en los grupos. La afinidad electrónica puede ser primera o sucesivas. 7.4. Electronegatividad La electronegatividad no tiene unidades, se define como la tendencia de un átomo de una determinada especie química que forma parte una molécula a atraer hacia sí los electrones que le unen a otro átomo de otra especie química diferente. Esta propiedad está estrechamente relacionada tanto con la energía de ionización como con la afinidad electrónica, siendo tanto mayor cuanto mayor sean estas. En general, en la tabla periódica la electronegatividad aumenta al desplazarnos hacia la derecha en los periodos y hacia arriba en los grupos, Con un mínimo local al final del bloque d. La tabla periódica (Autor: Damián Calvo) 32 7.5. Carácter metálico / no metálico La electronegatividad puede utilizarse para separar los elementos entre metales, si su electronegatividad es menor que la del hidrógeno, y no metales si es mayor. En el límite existe una zona donde las electronegatividades de los elementos es similar a la del hidrógeno, constituyendo el conjunto de los semimetales. Por lo tanto, en la tabla periódica el carácter metálico aumenta hacia la izquierda en los periodos y hacia abajo en los grupos, variando al contrario el carácter no metálico. Los elementos de los bloques d y f no tienen su electrón diferenciador en la capa externa sino en la penúltima (n-1) y en la n-2, por lo que sus propiedades presentan diferencias menores, principalmente el bloque f. 7.6. Poder oxidante / reductor El poder oxidante puede definirse como la tendencia de un elemento a tomar electrones de otro. De lo dicho en cuanto a la electronegatividad, se deduce que, en la tabla periódica el poder oxidante aumenta hacia la derecha en los periodos y hacia arriba en los grupos. Exactamente lo contrario se puede decir respecto al poder reductor: aumenta hacia la izquierda en un periodo y hacia abajo en un grupo. La tabla periódica (Autor: Damián Calvo) 33 8. Configuración electrónica. Resumen Números cuánticos; n, l, m, s Número cuántico principal: n Indica la capa o nivel donde se sitúa el electrón. Su valor puede ir desde 1 hasta infinito: 1 Capa más Interna: K 2 Segunda capa: L 3 Tercera capa: M 4 Cuarta capa: N, etc. Número cuántico secundario: l Indica el tipo de orbital ocupado por el electrón. Su valor va desde 0 hasta n-1 l=0 orbital s (sharp) l=1 orbital p (principal) l=2 orbital d (difuso) l=3 orbital f (fundamental) Número cuántico magnético: m Define el tipo de suborbital. Su valor va desde -l hasta +l. Número cuántico de spín: s Determina el sentido de giro del electrón. Su valor puede ser -1/2 o +1/2, independientemente del valor del resto de números cuánticos. La tabla periódica (Autor: Damián Calvo) 34 9. Estructura electrónica. Resumen La estructura electrónica es la disposición de los electrones alrededor de un núcleo atómico. Los electrones se sitúan de forma que posean la menor energía posible, para lo que siguen el orden dado por el diagrama de Möeller: Como ya se mencionó antes, el diagrama de Möeller es una forma fácil de recordar el orden de energía de los orbitales atómicos sin necesidad de ir aplicando las tres reglas de formación vistas en el punto 3.2.2. Recuerda, eso de la suma de n + l, etc. La colocación de los electrones se asemeja a la caída de una serie de bolas en una caja. Primero se llenarán los huecos inferiores, después, las bolas que sigamos metiendo en la caja se situarán sobre las primeras, pero no podrán ocupar sus huecos porque están ocupados ya por esas primeras bolas. Si seguimos introduciendo bolas, las nuevas se situarán sobre las que ya están colocadas y así sucesivamente. De forma similar, los electrones de cada uno de los átomos de cualquier elemento van situándose en los orbitales disponibles, siguiendo el orden dado por el diagrama de Möeller, hasta conseguir que todos ellos estén alojados. Entonces, el número más alto de la capa que ocupe el último electrón nos dirá el periodo en el que se encuentra el elemento considerado. Por otro lado, el tipo de orbital que ocupe el último electrón nos dará el bloque al que pertenece el elemento. Y, por último, el número de electrones situados en el tipo de orbital que ocupe el último electrón nos dará el orden del elemento en dicho bloque. Obsérvese que el número del grupo se obtiene sumando los electrones situados en los orbitales s y p de la última capa y los electrones situados en los orbitales d de la penúltima capa, siendo necesario añadir 10 si no posee ningún electrón en orbitales d. La tabla periódica (Autor: Damián Calvo) 35 Ejemplos: 1.- 1s2 2s1 Elemento del periodo 2, bloque s y primer elemento del bloque s grupo 2: Li 2.- 1s2 2s2 2p3 Elemento del periodo 2, bloque p y tercer elemento del bloque p grupo 15: N 3.- 1s2 2s2 2p6 3s2 3p6 4s2 3d5 Elemento del periodo 4, bloque d y quinto elemento del bloque d grupo 7: Mn La tabla periódica (Autor: Damián Calvo) 36 10. Orbitales atómicos. Forma geométrica y nomenclatura Debes tener en cuenta que hablamos de orbitales p, donde cada uno de ellos recibe el nombre de suborbital p. Lo mismo sucede con os orbitales d y f. Aunque podemos decir que un electrón se encuentra en un orbital p, si queremos ser más explícitos deberemos decir en que suborbital está. Esto no sucede con el orbital s puesto que no tiene suborbitales diferentes. Recuerda que el tipo de orbital está determinado por el valor del número cuántico secundario l y el tipo de suborbital lo está por el valor del número cuántico magnético m. Orbitales p La tabla periódica (Autor: Damián Calvo) 37 Orbitales d Orbitales f La tabla periódica (Autor: Damián Calvo) 38 Diagrama de Möeller y orbitales atómicos Forma esquemática de los orbitales atómicos (Según el valor de l) La tabla periódica (Autor: Damián Calvo) 39








