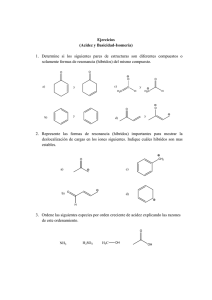
u Composición química de los seres vivos (I) 1unidad 1 - HIBIO-GEO
Anuncio

u1 Biologia 2 UD 01 26/1/09 08:17 Página 6 Composición química unidad 1 de los seres vivos (I) contenidos 1. Bioelementos y biomoléculas inorgánicas 2. Glúcidos 3. Lípidos Biologia 2 UD 01 26/1/09 08:17 Página 7 Composición química de los seres vivos (I) 7 1. Bioelementos y biomoléculas inorgánicas Los elementos químicos que forman parte de la materia viva son conocidos por el nombre de bioelementos o elementos biogénicos. Los bioelementos se combinan para formar moléculas llamadas biomoléculas. ! Dalton Un dalton equivale a un doceavo de la masa del isótopo más abundante del carbono. El valor en gramos de esta unidad es 1,6601 · 10–24 g. Símbolo: Da. Si estas biomoléculas se encuentran formando parte, además, de la materia inerte, reciben el nombre de biomoléculas inorgánicas, como son el agua, el carbonato cálcico, el oxígeno, etc. Pero muchas biomoléculas solo aparecen en los seres vivos, siendo entonces denominadas biomoléculas orgánicas, como la glucosa, la hemoglobina, el colesterol o el ácido desoxirribonucleico. Todos los compuestos orgánicos están formados por carbono e hidrógeno; la mayoría, además, contiene oxígeno o nitrógeno. En principio, las simples reglas del enlace covalente entre el carbono y otros elementos permiten un número infinitamente elevado de compuestos. Aunque el número de compuestos orgánicos diferentes de carbono de una célula es muy grande, solo representa una diminuta fracción de los que teóricamente son posibles. Las moléculas orgánicas pequeñas o monómeros, con un peso molecular que oscila entre 100 y 1.000 daltons, representan una décima parte de la materia orgánica celular. La mayoría se combina formando polímeros o macromoléculas con un peso molecular muy elevado. A grandes rasgos se puede decir que la materia viva está formada por moléculas inorgánicas (agua, sales minerales y gases) y moléculas orgánicas. Estas últimas se clasifican, por sus propiedades físicas y químicas, en cuatro grandes grupos: glúcidos, lípidos, prótidos y ácidos nucleicos. Además, desde un punto de vista funcional, se pueden diferenciar los biocatalizadores (enzimas y vitaminas). abundancia relativa porcentual 50 Organismos Corteza terrestre 40 30 20 10 0 H C O N Ca y Mg Na y K P Si Otros a Abundancia relativa de los elementos químicos encontrados en la corteza terrestre (el mundo inanimado), comparada con la encontrada en los tejidos blandos de los organismos vivos. La abundancia relativa se expresa como el porcentaje del número total de átomos. Así por ejemplo, aproximadamente el 50 % de los átomos son de hidrógeno. Y Biologia 2 UD 01 26/1/09 08:17 Página 8 Unidad 1 8 ! ¿Por qué no el silicio? El silicio es muy abundante en la corteza terrestre y tiene características similares al carbono; sin embargo, no se formaron a partir de él las molélulas orgánicas. Algunas de las razones son estas: el enlace Si-Si se rompe más fácilmente que el enlace C-C, por ello las grandes moléculas de Si son más inestables que las del C. El Si no puede formar dobles o triples enlaces, lo que limita el número de moléculas. Además, con el O2 forma SiO2, químicamente inerte e insoluble en agua, mientras que el CO2 es estable y fácilmente soluble en agua. Todos los seres vivos presentan los mismos componentes moleculares básicos, por lo que se puede concluir que todos proceden de un antepasado común. Posteriormente, a lo largo de la evolución, la identidad de una especie vendría determinada por la posesión de un conjunto peculiar o específico de proteínas formadas a partir de la información contenida en sus ácidos nucleicos. 1.1. Bioelementos Los elementos químicos de los seres vivos son cuantitativamente muy diferentes de los del entorno físico en que viven. Se han identificado alrededor de 70 bioelementos, aunque no todos están presentes en todos los seres vivos, ni aparecen en las mismas proporciones. Solamente 25 bioelementos son componentes esenciales de la materia viva. De acuerdo con su abundancia se dividen en primarios y secundarios. Bioelementos primarios Son el H, C, O, N, P y S. Constituyen más del 96 % de la materia viva. Sus propiedades físico-químicas los han convertido en los más adecuados para formar seres vivos. Los cuatro elementos más abundantes en la corteza terrestre son el oxígeno, el silicio, el aluminio y el hierro. En contraste, los cuatro elementos más abundantes en los organismos son el oxígeno, el carbono, el hidrógeno y el nitrógeno. • Cadenas C C C C C C C C representado también como • Estructuras ramificadas C C Además, el C puede efectuar enlaces covalentes con el O, H, N y S, con lo que se pueden introducir muchos grupos funcionales en la estructura de las moléculas orgánicas. Ningún otro elemento químico puede formar moléculas estables de tamaños y formas tan diferentes, ni con tal variedad de grupos funcionales; ello explica que, a pesar de su relativa escasez en la corteza terrestre, el carbono sea el elemento en el que se basa la química de los seres vivos. C C C C representado también como • Anillos C C C C C C C C Es particularmente significativa la capacidad del carbono para formar enlaces covalentes simples o dobles con otros átomos de carbono. Cada átomo puede establecer cuatro enlaces covalentes simples con otros cuatro átomos de carbono. De esta manera se consiguen esqueletos lineales o cíclicos muy polimorfos que permiten una ingente variedad de moléculas orgánicas distintas. C C representado también como a Esqueletos del carbono. El papel característico del carbono en la célula se debe a su capacidad de formar fuertes enlaces covalentes con otros átomos de carbono. Así, los átomos de carbono se pueden unir formando cadenas, estructuras ramificadas o anillos. El oxígeno y el hidrógeno abundan tanto en la litosfera como en la hidrosfera y en los seres vivos (biosfera). Ambos se combinan fácilmente con el carbono y participan en reacciones de oxidación-reducción, lo que permite intercambios energéticos fundamentales para la vida. El nitrógeno forma parte de moléculas fundamentales como las proteínas o los ácidos nucleicos, por lo que también está presente en todos los seres vivos. El fósforo forma parte de los ácidos nucleicos, de la «moneda energética» de la célula o ATP, de los fosfolípidos que constituyen las membranas celulares, de estructuras esqueléticas, coenzimas, etc. El azufre se encuentra en algunas proteínas, enzimas y vitaminas de gran importancia biológica. Y Biologia 2 UD 01 26/1/09 08:17 Página 9 Composición química de los seres vivos (I) 9 ! Bioelementos secundarios Constituyen aproximadamente el 4 % de la materia viva. Dentro de ellos cabe distinguir entre: • Indispensables: se presentan en todos los seres vivos: Ca, Na, K, Mg, Cl, Fe, Si, Cu, Mn, B, F y I. • Variables: solo aparecen en algunos: V, Pb, Ti, Br, Zn, Co, etc. Cuando un elemento se presenta en proporción inferior al 0,1 % se dice que es un oligoelemento (del griego oligos = escaso). Y en contra de lo que se puede pensar, dada su escasez, resultan imprescindibles, ya que su falta provoca enfermedades. Oligoelementos Algunos elementos, como el selenio y el aluminio, se encuentran en concentraciones infinitesimales dentro de los seres vivos. Experimentos con ratas han demostrado que estas no crecen normalmente si no reciben cantidades muy pequeñas de vanadio, selenio y flúor en la comida. Bastan 0,5 partes por millón de flúor en la comida para restaurar en el animal las condiciones normales de salud y crecimiento. Entre los bioelementos secundarios destacan: • Los iones de Na+, K+ y Cl– que mantienen el equilibrio osmótico y son fundamentales, por ejemplo, en la transmisión nerviosa. • El calcio forma parte de esqueletos y actúa en forma iónica en diversos procesos como la contracción muscular. • Elementos metálicos, como el Fe, Mg y Cu, intervienen en procesos de óxido-reducción cediendo o tomando electrones. El hierro se encuentra, por ejemplo, en la hemoglobina y en los citocromos; el magnesio, en la clorofila; el cobre, en la hemocianina (pigmento respiratorio de muchos invertebrados). • El yodo es imprescindible para sintetizar la hormona tiroidea de los vertebrados. • El cobalto forma parte de la vitamina B12 y de la nitrogenasa que utilizan algunas bacterias para fijar el nitrógeno atmosférico. 1.2. Los enlaces químicos y su importancia en Biología Cuando los átomos interactúan entre sí, constituyen moléculas. La fuerza con que los átomos se mantienen juntos se denomina enlace químico. Podemos clasificar los enlaces que encontramos en las biomoléculas según se indica en la tabla siguiente: CLASIFICACIÓN DE LOS ENLACES QUÍMICOS Enlaces covalentes Enlaces no covalentes Simples y dobles Iónico Polares y apolares Enlace de hidrógeno Enlaces de Van der Waals Interacciones hidrofóbicas Enlace covalente En este enlace los átomos comparten pares de electrones. Los elementos que forman este tipo de unión son muy electronegativos, tienen tendencia a ganar electrones para cubrir y estabilizar el nivel energético más externo. Y Biologia 2 UD 01 26/1/09 08:17 Página 10 Unidad 1 10 La capacidad del carbono para formar estos enlaces es determinante en los sistemas biológicos. El átomo de carbono tiene cuatro electrones en su capa externa. Puede compartir cada uno de ellos con otros átomos, formando enlaces covalentes con hasta cuatro átomos distintos. Estos enlaces covalentes pueden formarse con átomos diferentes (sobre todo hidrógeno, oxígeno y nitrógeno) o con otros carbonos. La facilidad para esto último hace posible la construcción de grandes moléculas, base estructural de los seres vivos, y de la actividad química de los procesos biológicos. Al formarse una molécula de hidrógeno (H2), cada átomo de hidrógeno comparte su único electrón con el otro. Resultando de esto, los dos átomos cubren su primer nivel de energía con dos electrones, situación esta muy estable. Este tipo de elace, donde los electrones se comparten, se llama enlace covalente. En las fórmulas estructurales se representa con un guión. a Esquema de la molécula de dióxido de carbono (CO2). El átomo de carbono en el centro de la molécula participa con dos enlaces covalentes dobles, uno con cada átomo de oxígeno. Cada enlace doble está formado por dos pares de electrones compartidos por los dos átomos que participan en el enlace. En las fórmulas estructurales, el enlace doble se representa por dos guiones paralelos: =. a Existen enlaces simples cuando se comparte un par de electrones, como ocurre entre los átomos de oxígeno e hidrógeno para formar la molécula de agua, y dobles si se comparten dos pares, como en el CO2. Los átomos de carbono pueden formar enlaces dobles entre sí y con átomos diferentes, por lo que la diversidad de moléculas a que dan lugar es muy grande. Los enlaces simples son flexibles y permiten la rotación de los átomos entre sí. Sin embargo, los dobles son relativamente rígidos, y su presencia aporta propiedades determinadas a una molécula. Por ejemplo, la manteca y el aceite son grasas de igual composición química, pero mientras en la manteca los ácidos grasos solo contienen enlaces simples, en el aceite algunos enlaces son dobles. La rigidez de estos últimos interfiere en la ordenación de las moléculas, y en consecuencia los aceites son líquidos a temperatura ambiente. Por el contrario, en la manteca el empaquetamiento de los ácidos grasos provoca el estado sólido a temperatura ambiente. Los enlaces covalentes cuyos electrones no se comparten por igual se denominan polares. Estos enlaces son comunes en el oxígeno, que atrae fuertemente a los electrones. Como veremos en el apartado correspondiente, el agua es una molécula polar con una región cargada positivamente y otra negativamente. La naturaleza polar del agua le confiere unas propiedades muy especiales de las que depende la vida. En moléculas perfectamente simétricas como el dióxido de carbono, la distribución de cargas se contrarresta y la molécula globalmente es apolar. Enlace iónico o electrostático Dibujo esquemático de una molécula de agua (H2O). Cada uno de los dos enlaces covalentes sencillos de esta molécula están formados por un electrón compartido del oxígeno y un electrón compartido del hidrógeno. a δ+ δ– las interacciones iónicas se producen entre grupos totalmente cargados (enlace iónico) o entre grupos parcialmente cargados. a Resulta de la atracción mutua de iones con cargas opuestas. En ausencia de agua, las fuerzas iónicas son muy intensas, pero en solución acuosa son bastante débiles. Estos enlaces resultan muy importantes en los sistemas biológicos. Por ejemplo, un enzima que se una a un sustrato cargado positivamente presentará en el centro activo un residuo cargado negativamente. Enlace de hidrógeno o puente de hidrógeno En este caso un átomo de hidrógeno es compartido por dos átomos, ambos electronegativos. Los enlaces de hidrógeno son más fuertes cuando los tres átomos se hallan en línea recta. Son más fuertes que los de Van der Waals, pero mucho más débiles que los covalentes. Ejemplos de la importancia de estos enlaces en los seres vivos los tenemos en las proteínas, cuyas estructuras, excepto la primaria, se estabilizan mediante los mismos. También vemos un ejemplo en la doble hélice del DNA, en la que se mantienen enlazadas las dos hebras antiparalelas. Y Biologia 2 UD 01 26/1/09 08:17 Página 11 Composición química de los seres vivos (I) Por otra parte, estos enlaces unen entre sí moléculas de agua por su carácter polar, como se verá más adelante. Estas atracciones intermoleculares dan como resultado unas excepcionales propiedades al agua de las que dependemos los seres vivos: su estado líquido, el calor específico y el de vaporización, la tensión superficial, la resistencia a cambios de temperatura y el punto de congelación, entre otras. 11 H H C H Las fuerzas de Van der Waals solo resultan significativas cuando numerosos átomos de una molécula pueden aproximarse a otros muchos átomos de la otra molécula. Esto ocurre cuando las formas de ambas se complementan. H C Son fuerzas atractivas inespecíficas que se establecen entre dos átomos cualesquiera que estén situados a una distancia mutua de 3 a 4 Amgstrons. Aunque son más débiles que las uniones electrostáticas o el enlace de hidrógeno, tienen gran importancia en Biología. H H Enlaces de Van der Waals La atracción de un par de átomos aumenta a medida que estos se acercan, hasta que están separados por la distancia de contacto de Van der Waals. A distancia menor, las fuerzas fuertemente repulsivas se hacen dominantes a causa de que las nubes electrónicas exteriores se solapan. C H H H H H C H a El agua une los grupos hidrofóbicos con objeto de minimizar los efectos destructores de estos grupos sobre la red de enlaces de hidrógeno del agua. A menudo se dice que los grupos hidrofóbicos que se mantienen unidos de esta manera están unidos por «puentes hidrofóbicos», a a pesar de que la atracción está generada en realidad por una repulsión de las moléculas de agua. Interacciones hidrofóbicas Se producen cuando las moléculas o grupos apolares tienden a agruparse en el seno del agua. En sentido figurado, el agua tiende a comprimir las moléculas apolares. Estas interacciones son la fuerza principal que dirige el plegamiento de las macromoléculas, la unión de los sustratos a los enzimas y la formación de las membranas celulares. 1.3. Biomoléculas inorgánicas Las biomoléculas son inorgánicas cuando aparecen también fuera de la materia viva, y se pueden clasificar en: agua, sales minerales y gases (oxígeno, nitrógeno, dióxido de carbono). El agua ! Contenido en agua de distintas especies y estructuras Algas: 98,0 % Espinacas: 93,0 % Medusas: 90,0 % Mejillón: 82,2 % Estrella de mar: 75,8 % La vida, tal como se conoce en la Tierra, se desarrolla siempre en medio acuoso. Incluso en los seres no acuáticos el medio interno es esencialmente hídrico. Recién nacido: 70,0 % Hombre adulto: 63,0 % La inmensa mayoría de las reacciones bioquímicas se desarrolla en el seno del agua y obedece las leyes físico-químicas de las disoluciones acuosas. Tejido nervioso: 85,0 % Hueso: 22,0 % Semillas: 20,0 % Dentina: 10,0 % El agua es la molécula más abundante en los seres vivos, y representa entre el 70 % y el 90 % del peso de la mayor parte de los organismos. El contenido de agua varía de una especie a otra; también es función de la edad del individuo (con la vejez disminuye el contenido hídrico) y del tipo de tejido. El papel primordial del agua en el metabolismo de los seres vivos se debe a sus excepcionales propiedades físicas y químicas, derivadas de su estructura molecular. Y Biologia 2 UD 01 26/1/09 08:17 Página 12 Unidad 1 12 a b c Hidrógeno Oxígeno Hidrógeno Oxígeno 104,5° 2δ –0,82 δ δ + 0,41 + 0,41 a a) Estructura de la molécula de agua; b) Modelo espacial compacto; c) Dipolo de una molécula de agua. El átomo de oxígeno, fuertemente electronegativo, comparte un par de electrones con cada átomo de hidrógeno y atrae a los electrones de este. Como resultado, la molécula presenta polaridad: cada átomo de hidrógeno posee una carga parcial positiva y el oxígeno posee carga parcial negativa. La molécula es un dipolo eléctrico. Este hecho permite la formación de puentes de hidrógeno que, aunque muy débiles, son de gran importancia en las reacciones químicas de los seres vivos. Cuando dos moléculas de agua se aproximan mucho, se establece una atracción electrostática entre la carga parcial negativa del átomo de O de una molécula y la carga parcial positiva de un átomo de H de la molécula adyacente. Esta unión electrostática se llama enlace o puente de hidrógeno. Comparado con un enlace covalente, el puente de hidrógeno es un enlace débil y tiene un tiempo de vida muy corto (de 10–8 a 10–10 s). Cada molécula de agua puede unirse a otras cuatro moléculas de agua vecinas, por lo que el agua líquida es como un mosaico de agrupamientos oscilantes de moléculas unidas por estos enlaces en continua reorganización. Enlace de hidrógeno δ 2δ δ δ 2δ δ 0,177 nm 0,099 nm 0,276 nm Hidrógeno Oxígeno Enlaces de hidrógeno de una molécula de agua, la cual puede participar en hasta cuatro enlaces de hidrógeno. El átomo de oxígeno de la molécula central de agua es un aceptor de enlaces de hidrógeno, mientras que los dos átomos de hidrógeno de dicha molécula son dadores de enlaces de hidrógeno. a Y Biologia 2 UD 01 26/1/09 08:17 Página 13 Composición química de los seres vivos (I) 13 AA Propiedades del agua Muchas de las propiedades del agua derivan de su estructura: • Su estado líquido, de 0 °C a 100 °C es una anomalía, si se compara el agua con otros hidruros semejantes como el NH3 y el SH2, y se debe al establecimiento de los puentes de hidrógeno. Moléculas anfipáticas: son moléculas que contienen una parte hidrofílica y otra hidrofóbica. • Elevado calor específico o capacidad calorífica. Esto hace que aumentos o descensos importantes de temperatura solo produzcan pequeñas variaciones de temperatura en el agua. De este modo el agua es un buen amortiguador frente a los cambios bruscos de temperatura, lo que es de vital importancia para los seres vivos. • Elevado calor de vaporización, mucho más alto que en otros líquidos. Esto permite a los organismos disminuir su temperatura mediante la evaporación superficial de agua en los pulmones o la piel. • Constante dieléctrica elevada. La constante dieléctrica del agua a 20 °C es 80, excepcionalmente alta comparada con otros disolventes. Esto se debe a su polaridad y capacidad para formar puentes de hidrógeno. De este modo el agua disuelve compuestos iónicos y moléculas polares, y dispersa moléculas anfipáticas. • Elevada fuerza de cohesión, lo que explica que el agua líquida se comprima poco y presente una alta tensión superficial. Esta, a su vez, facilita el fenómeno de la capilaridad, fundamental en el transporte de los líquidos circulatorios. ! La constante dieléctrica es una medida de la capacidad de las moléculas de un disolvente para mantener separados iones de carga opuesta que se atraen entre ellos. La constante dieléctrica elevada se debe a que el agua se opone a las atracciones electrostáticas entre iones (+) y (–), favoreciendo la disolución de redes cristalinas en agua mediante una solvatación iónica (rodear con dipolos de agua a los iones). • Menor densidad de su estado sólido. La máxima densidad del agua se da a 4 °C, pero el hielo es menos denso que el agua líquida a cero grados, por lo que el hielo flota en el agua líquida y esta se congela desde la superficie hacia el fondo. Por tanto, el hielo es un aislante excelente y permite el mantenimiento de la vida durante el invierno en los ecosistemas acuáticos. • Se puede disociar en iones H+ e iones OH– que participan en muchas reacciones químicas. Funciones del agua • Disolvente casi universal. Función realmente importante, ya que todas las reacciones químicas de las células tienen lugar en un medio acuoso. • Transporte. El agua transporta sustancias desde el exterior al interior del organismo y viceversa, así como en el propio organismo. • Estructural. El volumen y forma de las células que carecen de capas rígidas se mantienen gracias al contenido de agua. • Amortiguadora frente a grandes cambios de temperatura gracias a su calor específico. Interviene así en la regulación de la temperatura corporal. • Lubricante. Su reducida viscosidad amortigua el roce en articulaciones y entre órganos. • Vehículo de excreción. Los productos tóxicos son eliminados en medio acuoso, lo que rebaja su toxicidad. • Función de hidrólisis. Participa, a través de sus iones, en las reacciones de hidrólisis catalizadas por hidrolasas. ! El contenido acuoso del cuerpo humano se mantiene constante por el equilibrio entre ingresos y pérdidas. Los ingresos diarios en un hombre con dieta mixta, actividad física moderada y que habite en clima templado son de 2,6 litros. De ellos: 1,3 l de la bebida; 1 l de alimentos y 0,3 l de agua metabólica. Las pérdidas son otros 2,6 l, de los cuales: 1,4 l de la orina; 1 l de la evaporación por piel y pulmón y 0,2 l de pérdida fecal. Y Biologia 2 UD 01 26/1/09 08:17 Página 14 Unidad 1 14 Sales minerales Cuando se quema la materia orgánica, después de eliminar el agua, se obtiene un residuo formado por las sales minerales. La proporción de este contenido mineral varía mucho de unos organismos a otros y, dentro del mismo individuo, varía también con la edad y entre los distintos órganos. Las sales minerales aparecen en los seres vivos en diferentes formas: • Sólidas, cristalizadas, por tanto, no ionizadas. Así constituyen esqueletos como conchas, huesos, etc. • En estado iónico, disueltas en el medio celular o en líquidos extracelulares y circulantes. Entre ellas destacan: – Aniones: cloruro (Cl–), bicarbonato (HCO3–), sulfato (SO42–), nitrato (NO3–), fosfato (PO43 –). – Cationes: Na+, K+, Ca2+, Mg2+. Algunos cationes intervienen en procesos fisiológicos concretos, una alteración en su concentración puede provocar un mal funcionamiento celular. • Formando parte de moléculas orgánicas: por ejemplo, el ion fosfato en fosfoproteidos, fosfolípidos y ácidos nucleicos. Funciones de las sales minerales • Formar estructuras esqueléticas, tanto exoesqueletos como endoesqueletos. Por ejemplo: – CaCO3 en las conchas de moluscos, crustáceos y en foraminíferos (protozoos), – Ca3 (PO4)2 y CaCO3 en el esqueleto de los vertebrados. – SiO2 en diatomeas, radiolarios y gramíneas. • Regulación de fenómenos osmóticos. Las sales minerales en disolución son las principales causantes de uno de los fenómenos fisicoquímicos de mayor importancia biológica: la aparición de presiones osmóticas. Entendemos por ósmosis el paso de un disolvente a través de una membrana semipermeable que separa dos disoluciones de distinta concentración, lo que tiende a igualar ambas disoluciones. d Ósmosis. Si dos soluciones acuosas están separadas por una membrana que únicamente permite el paso de las moléculas de agua, esta pasará hacia la solución que contiene la mayor concentración de moléculas solubles, mediante un proceso denominado ósmosis. El movimiento del agua desde una solución hipotónica hacia una solución hipertónica puede generar un incremento de la presión hidrostática en el compartimento hipertónico. Las membranas celulares pueden considerarse semipermeables. Si comparamos dos disoluciones, estas pueden ser entre sí isotónicas, si poseen la misma concentración, o anisotónicas, si las concentraciones son diferentes: una es hipotónica (menos concentrada) y otra hipertónica. El agua pasará de los medios hipotónicos a los hipertónicos, ejerciendo una presión sobre la membrana llamada presión osmótica. Y Biologia 2 UD 01 26/1/09 08:17 Página 15 Composición química de los seres vivos (I) 15 El fenómeno de la ósmosis puede provocar intercambios de agua entre el interior y el exterior de la célula. Si el medio externo es hipertónico la célula pierde agua, se contrae, pero el resultado es distinto según se trate de células animales o vegetales. Las células animales se contraen; en las vegetales, al contraerse, se despega la membrana plasmática de la pared, lo que provoca la rotura de la célula o plasmólisis. Si, por el contrario, el medio externo es hipotónico, el agua entra en la célula, esta se hincha, y el resultado varía también con el tipo de célula. Las células animales estallan, mientras que las vegetales y bacterianas no se rompen, al estar rodeadas por una pared rígida, sino que presentan turgencia. De este modo, las sales disueltas son responsables de los intercambios hídricos de las células con el medio extracelular. a pared celular membrana En solución hipertónica En solución isotónica En solución hipotónica b En solución hipertónica En solución isotónica En solución hipotónica (hemólisis) c Fenómenos osmóticos: a) en células vegetales; b) en glóbulos rojos. • Regulación del equilibrio ácido-base. Muchas reacciones y procesos bioquímicos dependen de la concentración de iones hidrógeno H+. El agua, componente más abundante de las células y líquidos corporales, es neutra. Pero cuando el agua contiene sustancias disueltas se puede alterar el pH, tendiendo entonces hacia la acidez o basicidad. Casi todos los fenómenos vitales se desarrollan a un pH próximo al neutro, por lo que es fundamental para las células mantener el pH dentro de unos límites muy estrictos, ya que cualquier cambio brusco alteraría la estructura de muchas biomoléculas o impediría las reacciones químicas (por ejemplo, por pérdida del centro activo de las enzimas). conc. H+ pH 10–1 1 10–2 2 10–3 3 10–4 4 10–5 5 10–6 6 10–7 7 El fundamento es que, en presencia de la sal, el ácido casi no se disocia. 10–8 8 Los tampones más comunes en los seres vivos son el tampón fosfato con la sal de sodio, en los medios celulares, y el tampón bicarbonato en los medios intercelulares. HCO3– + H+ → H2CO3 → CO2 + H2O El pH de la sangre mantiene constante un valor de 7,4 gracias al sistema tampón carbonato. Si se liberan protones a la sangre (acidificación), el equilibrio se desplaza hacia la derecha y aumenta el CO2, que se expulsa por los pulmones. Si, por el contrario, aumenta el pH sanguíneo, el equilibrio se desplaza hacia la izquierda, y el CO2 se disuelve en la sangre para restaurar nuevamente el equilibrio. 10–9 9 10–10 10 10–11 11 10–12 12 10–13 13 10–14 14 Para el agua pura ALCALINO Para mitigar las variaciones de pH, los organismos han desarrollado los llamados sistemas tampón o amortiguadores de pH, formados por: un ácido débil (con poca tendencia a disociarse) y una sal de este ácido. ÁCIDO moles/litro [H+]=10–7 moles/litro a La acidez de una solución se define como la concentración de iones H+ que posee. Por comodidad, utilizamos la escala de pH en la que: pH = – log10 [H+] Y Biologia 2 UD 01 26/1/09 08:17 Página 16 Unidad 1 16 ! 1.4. Estados físicos de la materia de los seres vivos La hiperacidez del jugo gástrico, o hiperclorhidria, se debe a un aumento de la secreción de ácido clorhídrico por parte de las células de la mucosa gástrica. Puede aliviarse con la ingestión de alimentos y productos alcalinos o tomando bicarbonato sódico; pero el exceso de este puede intensificar la hiperclorhidria. ADSORCIÓN DIFUSIÓN Membrana dializadora DIÁLISIS Los fenómenos de adsorción, difusión y diálisis. a ACTIVIDADES PROPUESTAS 1. ¿Por qué el fósforo es un elemento imprescindible para los seres vivos? 2. Explica las diferencias entre enlaces iónicos, covalentes y covalentes polares. ¿Cuál es la causa de que los átomos tiendan a interactuar formando enlaces? 3. Comparada con otros hidruros, la temperatura de ebullición del agua debería ser de -80 ºC. Imagina qué ocurriría con el agua del planeta. ¿Podría entonces formar parte de los seres vivos? 4. ¿Sabrías explicar por qué los jamones se curan con sal? La materia constituyente de los organismos puede encontrarse en los tres estados físicos siguientes: sólido, gaseoso y líquido. • El estado sólido: de esta forma se presentan las sustancias que dan lugar a estructuras esqueléticas y de protección: huesos, conchas, pelo, plumas, depósitos de grasa, etc. Las sustancias sólidas pueden ser de dos tipos: – Inorgánicas: carbonato cálcico, fosfato cálcico, sílice, etc. – Orgánicas: la quitina del esqueleto de los artrópodos, queratina del pelo o las uñas, el sebo de los animales, la celulosa de la madera, etc. • El estado gaseoso: los gases que constituyen los seres vivos pueden intervenir en el metabolismo o ser inertes. Entre los primeros figura el oxígeno (O2) y el dióxido de carbono (CO2). Ambos intervienen en el catabolismo respiratorio aerobio. Entre los inertes, el nitrógeno (N2) se encuentra en el interior de algunas cianobacterias y cámaras de cefalópodos con función de flotación. • El estado líquido: está formado por dispersiones en las que el disolvente es el agua. Los solutos pueden ser de bajo peso molecular, como las sales minerales, o moléculas orgánicas pequeñas (glucosa, aminoácidos), o bien de peso molecular elevado (proteínas, polisacáridos). En el primer caso se trata de dispersiones moleculares o disoluciones, en el segundo de dispersiones coloidales. Las dispersiones coloidales pueden presentarse en forma fluida (sol) o con aspecto gelatinoso (gel). Las dispersiones son transparentes, aunque las coloidales, observadas al trasluz, tienen cierta turbidez. Todas las reacciones bioquímicas características de los procesos vitales tienen lugar en medio acuoso. Esto incluye los líquidos intracelulares, instersticiales y líquidos circulantes como el plasma sanguíneo y la linfa. Todos estos medios son dispersiones con gran uniformidad en su composición y propiedades, ya que las variaciones que surgen son compensadas por mecanismos de regulación. En ellas, las partículas dispersas pueden provocar varios fenómenos como son: la adsorción, la difusión, la diálisis y la ósmosis. – La adsorción es un proceso por el cual las partículas de un líquido o gas son atraídas hacia la superficie de un sólido o de una partícula coloidal en suspensión. – La difusión es el fenómeno por el cual las moléculas disueltas tienden a distribuirse uniformemente en el seno del agua. Se debe al constante movimiento de las partículas de un fluido. Puede realizarse a través de una membrana si esta es suficientemente permeable como para que la puedan atravesar las moléculas del soluto. De esta forma se realizan intercambios de gases y algunos nutrientes entre la célula y su medio. – La diálisis es un proceso mediante el cual se separan las partículas dispersas de elevado peso molecular de las de bajo peso molecular a través de una membrana semipermeable que solo deja pasar las partículas pequeñas. De este modo, en la filtración renal son eliminadas del plasma sanguíneo sales y moléculas orgánicas pequeñas, mientras que se retienen proteínas. – La ósmosis es el paso de disolvente a través de una membrana semipermeable entre dos disoluciones con distinta concentración. Como vimos anteriormente, los fenómenos osmóticos están provocados en los seres vivos, principalmente, por el contenido salino de las células y los medios extracelulares. Y Biologia 2 UD 01 26/1/09 08:17 Página 17 Composición química de los seres vivos (I) 17 2. Glúcidos AA Son biomoléculas orgánicas constituidas por C, H y O (a veces tienen N, S o P). Se llaman también hidratos de carbono por responder a la fórmula general Cn (H2O)n, aunque los átomos de carbono no van unidos a moléculas de agua. Glúcidos: el nombre de glúcidos procede del griego glycos: dulce, si bien, no todos los glúcidos tienen este sabor, como el almidón o la celulosa. Desde el punto de vista químico son polihidroxialdehídos o polihidroxicetonas, ya que los carbonos van unidos a radicales hidroxilo (–OH) y presentan siempre un grupo carbonilo (–C=O) que puede ser terminal (aldehído) o no (cetona). Realizan varias funciones en los seres vivos, muchos son una fuente de energía para las células (glucosa, almidón), y otros son estructurales, como la celulosa o la quitina. Se pueden clasificar atendiendo a diferentes criterios. En una clasificación sencilla se diferencian estos grupos: OSAS O MONOSACÁRIDOS Oligosacáridos HOLÓSIDOS Homopolisacáridos Polisacáridos ÓSIDOS Heteropolisacáridos Glucoproteidos HETERÓSIDOS Glucolípidos Las osas o monosacáridos son moléculas simples, no hidrolizables. Los ósidos están formados por la unión de osas. Son holósidos si solo contienen monosacáridos, y heterósidos si contienen, además, un componente no glucídico llamado grupo aglucón o aglicón. – MONOSACÁRIDOS: – OLIGOSACÁRIDOS (disacáridos): – POLISACÁRIDOS: a Esquema de los monosacáridos, oligosacáridos y polisacáridos. Y Biologia 2 UD 01 26/1/09 08:17 Página 18 Unidad 1 18 ! 2.1. Monosacáridos Grupos funcionales en los compuestos orgánicos: GRUPO MOLÉCULA • Hidróxilo Alcohol OH Cetona C O • Carbonilo Aldehído C O C • Carboxilo C O H O Ácido H Son glúcidos no hidrolizables, con un número de carbonos que varía de 3 a 12. Su denominación alude a este número y termina con el sufijo –osa: triosas (3C), tetrosas (4C), pentosas (5C), hexosas (6C) y heptosas (7C). Los monosacáridos con más de 7C son escasos e inestables. Son sólidos, blancos, cristalinos, dulces y solubles en agua. Desvían el plano de vibración de la luz polarizada cuando son atravesados por esta. Químicamente se caracterizan por poseer: • Un esqueleto carbonado con grupos alcohólicos o hidroxilos, • Un grupo aldehído (aldosas) o cetónico (cetosas). Este grupo aldehído o cetona es el responsable de la reducción del Cu2+, propiedad que se utiliza para su reconocimiento (prueba de Fehling). Los monosacáridos son importantes intermediarios en el metabolismo celular, o bien tienen función energética, o forman parte de macromoléculas importantes. • Amino NH2 Estructura e isomerías La estructura molecular de los azúcares más pequeños, como las triosas, puede escribirse mediante la forma de representación lineal o proyección de Fischer, como se aprecia en la figura inferior, en la que se ha dibujado también la estructura tridimensional. El carbono 2 del gliceraldehído es un carbono asimétrico. Todas las osas, excepto la dihidroxiacetona, tienen al menos un carbono asimétrico (unido a cuatro radicales distintos). Ello da lugar a la aparición de estereoisómeros o isómeros espaciales: los monosacáridos presentan estereoisomería. a H H C O C OH CH2OH D-Gliceraldehído b H O C HO C C H H CH2OH L-Gliceraldehído C H H O O OH OH CH2OH D-Gliceraldehído (una aldosa) C C H CH2OH L-Gliceraldehído (una aldosa) a a) Proyecciones de Fischer del gliceraldehído; b) Estructuras tridimensionales de los dos estereoisómeros del gliceraldehído. Puede observarse que son imágenes especulares el uno del otro y por tanto no son superponibles. Si el grupo OH va a la derecha del C asimétrico en la proyección de Fischer, el compuesto es un isómero D, si va situado a la izquierda es un isómero L. Al aumentar el número de carbonos asimétricos aumenta el número de estereoisómeros, que será 2n, siendo n el número de dichos carbonos. Cuando un monosacárido tiene varios estereoisómeros, todos aquellos que posean el OH del carbono más alejado del grupo carbonilo a la derecha son de la serie D, y los que lo posean a la izquierda son de la serie L. En la naturaleza la mayoría de los azúcares son de la forma D. Y Biologia 2 UD 01 26/1/09 08:17 Página 19 Composición química de los seres vivos (I) 19 Los monosacáridos tienen muchos isómeros que únicamente se diferencian en la orientación de sus grupos hidróxilo. Por ejemplo, la glucosa, la galactosa y la manosa son isómeros entre sí. CHO Si dos estereoisómeros son imágenes especulares uno del otro, se dice que son enantiómeros. Los enantiómeros corresponden a la misma sustancia, con las mismas propiedades, salvo la actividad óptica. HCOH HCOH Cuando dos monosacáridos se diferencian solo en la posición de un OH de un carbono se dice que son epímeros. Los epímeros son sustancias diferentes, con propiedades distintas. Otra isomería es la isomería óptica. Al tener uno o más carbonos asimétricos, los monosacáridos desvían el plano de vibración de la luz polarizada cuando esta atraviesa una disolución de los mismos. Si lo desvían hacia la derecha son dextrógiros, se les representa con el signo +. Si lo desvían hacia la izquierda son levógiros, se les representa con el signo –. La desviación se debe a la ausencia de planos de simetría en la molécula. El que los monosacáridos sean dextrógiros o levógiros es independiente de que pertenezcan a la serie D o L. Así, la D-glucosa es dextrógira, pero la D-fructosa es levógira. CHO HOCH HCOH CH2OH D-Eritrosa CH2 OH D-Treosa La D-eritrosa y la D-treosa son epímeros, ya que solo se diferencian en el –OH del carbono 2. a Estructura cíclica y formas anoméricas En la configuración abierta (proyección de Fischer), los azúcares presentan un número variable de grupos hidróxilo y un grupo aldehído o un grupo cetona. El grupo aldehído o cetona desempeña un papel especial. En primer lugar, puede reaccionar con un hidróxilo de la misma molécula, convirtiendo a esta en un anillo. En segundo lugar, una vez formado este anillo, este carbono puede unirse a uno de los carbonos con un grupo hidróxilo de otro azúcar, produciendo un disacárido, como veremos posteriormente. Cuando el grupo aldehído reacciona con un grupo hidróxilo se forma un hemiacetal, si es el grupo cetona el que reacciona con el hidróxilo se forma un hemicetal. En ambos casos son enlaces intramoleculares, ya que se dan entre átomos de la misma molécula. De este modo la molécula se cierra en forma de anillo que puede ser pentagonal o hexagonal. Los anillos pentagonales son furanósicos por su semejanza con el furano, los hexagonales son piranósicos por su semejanza con el pirano. ! El anillo piranósico no es plano, puede adoptar dos formas en el espacio: la forma cis o de nave y la forma trans o de silla de montar. O trans O cis CH2OH O 6 O H 5 O H H 4 1 OH OH 3 H Furano Pirano H OH 2 OH α-Glucopiranosa CH2OH 6 O 1 CH2OH 5 H 2 H 4 OH OH OH 3 H α-Fructofuranosa Anillos del furano y del pirano, de donde toman el nombre los monosacáridos ciclados, como la glucopiranosa y la fructofuranosa. a Y Biologia 2 UD 01 26/1/09 08:17 Página 20 Unidad 1 20 Así, hablaremos de la fructofuranosa cuando la fructosa está ciclada, y de la glucopiranosa en el mismo caso. Estas formas cíclicas reciben el nombre de fórmulas de Haworth. En estas representaciones, todos los átomos del polígono están en el mismo plano, y los grupos están situados hacia la parte superior o inferior del mismo. En las formas cíclicas aparece un nuevo carbono asimétrico, el que antes tenía el grupo aldehído o cetona. Este carbono se llama anomérico. Por ello surgen dos nuevos estereoisómeros o anómeros: anómeros α y β, según que el OH del carbono anomérico quede hacia abajo o arriba en la estructura cíclica, respectivamente. O H 1 2 1 3 C 4 5 H 6 D-Glucosa a 5 OH HOCH2 5 α H 6 6 5 c Paso de la forma abierta de la D-glucosa a la forma piranósica, según Haworth. H H 2 1α OH 3 H H 6 b H HO OH CH2OH 5 OH O OH CH2OH H 4 3 4 HOCH2 1 4 OH HO OH CH2OH 6 90° C 2 3 4 1 OH 1 OH HO OH H C 2 3 HO 4 1 OH 2 O H OH H C HO C O OH H OH H C C H OH C H α-D-Glucopiranosa β-D-Glucopiranosa e f d a Principales monosacáridos • Triosas. Destacan el D-gliceraldehído y la dihidroxiacetona. No se encuentran libres en grandes cantidades en la naturaleza pero son intermediarios en el metabolismo energético celular. • Pentosas. La D-ribosa forma parte del ácido ribonucleico, también del ATP y NAD. La 2-D-desoxirribosa forma parte del ácido desoxirribonucleico. La D-ribulosa tiene un papel fundamental en la fotosíntesis, ya que a ella se fija el CO2 atmosférico. • Hexosas. La D-Glucosa se encuentra libre en cantidades importantes en los seres vivos. Se presenta en las frutas y en la miel. Forma parte de polisacáridos como el almidón, o la celulosa, y también de disacáridos. La glucosa es el azúcar más extendido en la naturaleza y el que más utilizan las células como fuente de energía. La D-Fructosa es igualmente abundante y la encontramos en las frutas. La D-Galactosa forma parte de la lactosa, disacárido de la leche. H H O H O C C H C OH CH2OH D-Gliceraldehído a Triosas. HO C C CH2OH C L-Gliceraldehído O H C OH HO C H H C OH H C OH CH2OH Dihidroxiacetona CH2OH D-Eritrosa a Tetrosas. CH2OH C O H CH2OH H O CH2OH D-Treosa H C O C OH CH2OH D-Eritrulosa Y Biologia 2 UD 01 26/1/09 08:17 Página 21 Composición química de los seres vivos (I) H O H C C OH H C OH H C OH C C H C H HO C H C OH HO C H C OH H C OH C OH H C OH HO C H C OH H H CH2OH H OH H H O C H D-Desoxirribosa C H C CH2OH CH2OH C O HO C H D-Galactosa C OH OH HO C H H C OH OH H C OH H C OH CH2OH CH2OH CH2OH D-Xilosa D-Fructosa Pentosas. a Hexosas. O O CH2OH H CH2OH H C C C C OH H H H H H H C C C C OH OH OH H α -D-Ribofuranosa OH α -D-Desoxirribofuranosa Fórmulas cíclicas de las pentosas. CH2OH C H CH2OH HO C O H C OH H C C H OH α -D-Glucopiranosa a C H D-Ribulosa a CH2OH CH2OH D-Glucosa O O C H CH2OH D-Ribosa H H O O C H a 21 H OH C C OH H O H O H C OH H C C H OH α -D-Galactopiranosa OH CH2OH CH2OH C C H H OH C C OH H OH α -D-Fructofuranosa Fórmulas cíclicas de las hexosas. Y Biologia 2 UD 01 26/1/09 08:17 Página 22 Unidad 1 22 ! Consumo de glucosa por el cerebro El cerebro consume 140 gramos de glucosa por día. Si el nivel de glucosa desciende, como ocurre en un ayuno prolongado, utiliza como fuente de energía los cuerpos cetónicos procedentes de la oxidación de ácidos grasos en el hígado. 2.2. Oligosacáridos. El enlace O-glucosídico La unión de 2 a 9 monosacáridos por enlaces O-glucosídicos da lugar a oligosacáridos. El enlace O-glucosídico se forma cuando el grupo OH del carbono anomérico reacciona con un OH de otro monosacárido. En esta reacción se desprende una molécula de agua. Se forma así un disacárido. Por adición de nuevos monosacáridos se van formando oligosacáridos y polisacáridos. Si el primer monosacárido es α, el enlace es α-glucosídico. Por el contrario, si el primer monosacárido es β, el enlace es β-glucosídico. CH2OH CH2OH O O 1α + OH 4 H,OH HO α-D-Glucopiranosa D-Glucopiranosa CH2OH CH2OH O O 1α 4 H,OH O α-D-Glucopiranosil (1 → 4)-β-D-Glucopiranósido Maltosa: G(1α → 4)G a Formación del enlace O-glucosídico entre dos moléculas de glucopiranosa. Se libera una molécula de agua y se forma un disacárido, en este caso la maltosa. Disacáridos Dentro de los oligosacáridos destacan especialmente los disacáridos, que están constituidos por la unión de dos monosacáridos. Por su pequeño tamaño son dulces, solubles en agua y cristalizables. Pueden hidrolizarse por enzimas específicas o por ácidos en caliente. Los disacáridos son reductores cuando el carbono anomérico de alguno de sus componentes no está implicado en el enlace. La capacidad reductora de los glúcidos se debe a que el grupo aldehído o cetona puede oxidarse dando un ácido. Los principales disacáridos son: • Maltosa: G (1α→4α) G. Es un disacárido formado por dos moléculas de α-glucopiranosa unidas por un enlace O-glucosídico entre el C1 de la primera y el C4 de la segunda. Se obtiene por hidrólisis del almidón y del glucógeno. Es el azúcar de la malta, grano germinado de la cebada, que se utiliza en la elaboración de cerveza. Se hidroliza por medio de la maltasa, que produce dos moléculas de glucosa. • Isomaltosa: G (1α→6α) G. No se encuentra libre en la naturaleza, pero se obtiene por la hidrólisis de la amilopectina y del glucógeno. Está formada por dos moléculas de glucosa unidas mediante enlace α (1 → 6). Y Biologia 2 UD 01 26/1/09 08:17 Página 23 Composición química de los seres vivos (I) 23 • Celobiosa: G (1β→4β) G. Tampoco existe libre en la naturaleza. Aparece por hidrólisis de la celulosa. • Lactosa: Gal (1β→4α) G. Es el azúcar de la leche de los mamíferos, que es su única fuente natural. La leche de vaca contiene de un 4 a un 5 % de lactosa. Sirve de alimento a las crías de los mamíferos en las primeras etapas de su desarrollo. Se hidroliza por el enzima lactasa en el ser humano (por una β-galactosidasa en las bacterias) liberando sus componentes. • Sacarosa: G(1α→2β) F. Es el único disacárido no reductor, ya que los dos carbonos anoméricos están implicados en el enlace. Es el azúcar de mesa. Se encuentra en los frutos (dátiles, higos) y en el néctar de muchas flores. Industrialmente se obtiene de la caña de azúcar y de la remolacha azucarera. 6 CH2OH 6 CH2OH 5 O HO OH H H H H 1α 4 3 O O 5 H 1α H OH 4 OH 3 1 H O 2 H H OH H Celobiosa: β-D-Glucopiranosil (1 → 4)-β-D-Glucopiranosa 3 H OH 2 O OH H H 1 H OH H OH H H H 1 O 4 H OH H OH H Lactosa: β-D-Galactopiranosil (1 → 4)-α-D-Glucopiranosa La hidrólisis de la sacarosa a glucosa y fructosa está catalizada por el enzima sacarasa, llamado también invertasa porque la hidrólisis produce un cambio del poder rotatorio de dextrógiro a levógiro. ! CH2OH 6 1 OH H 1 OH OH O OH H H O H 4 6 CH2OH 4 5 O H 1 O H ! H OH H OH Isomaltosa: α-D-Glucopiranosil (1 → 6)-α-D-Glucopiranosa CH2OH H HO OH H 3 OH O H HO OH H H 4 2 H OH H Maltosa: α-D-Glucopiranosil (1 → 4)-α-D-Glucopiranosa CH2OH O H En el intestino delgado la lactosa es desdoblada en sus componentes por acción de la lactasa. A veces hay incapacidad de absorber la lactosa por falta de actividad de la lactasa, sobre todo en adultos americanos, árabes, filipinos, indios, japoneses y judíos. La capacidad del ser humano para digerir la lactosa durante su edad adulta parece haber aparecido a partir de la domesticación del ganado, hace unos 10.000 años. 6 CH2 5 H H 2 6 CH2OH ! H OH OH La maltasa, la lactasa y la sacarasa están localizadas en la superficie externa de las células epiteliales que revisten el intestino delgado. Estas células presentan microvellosidades que aumentan considerablemente su superficie para la digestión y absorción de los nutrientes. 6 CH2OH H 5 O 1 H H 1 4 HO OH 3 H 2 HOCH2 O O H 2 5 H 3 OH CH2OH 4 H OH OH H Sacarosa: α-D-Glucopiranosil (1→ 2)-β-D-Fructofuranósido a ! 6 Estructuras de los principales disacáridos. 2.3. Polisacáridos Están formados por la unión de muchos monosacáridos mediante enlaces O-glucosídicos. Pueden contener desde 10 a varios cientos o miles de monosacáridos. Tienen un peso molecular elevado, no cristalizan y no son dulces. Son insolubles en agua o forman dispersiones coloidales. No poseen poder reductor. La sacarina Sólido cristalino poco soluble en agua fría, es 500 veces más dulce que la sacarosa. Como puedes ver, su estructura no tiene relación con los glúcidos. O NH SO2 El tipo de enlace condiciona tanto la estructura como la función de los polisacáridos: los enlaces α-glicosídicos forman polímeros helicoidales abiertos que son moléculas de reserva energética, mientras que los enlaces β producen hebras casi rectas que constituyen fibrillas; estas moléculas son estructurales. Y Biologia 2 UD 01 26/1/09 08:17 Página 24 Unidad 1 24 glucógeno todos los demás enlaces son α (1→4) se producen enlaces α (1→6) en los puntos de ramificación Oligosacáridos y polisacáridos. Con unidades simples repetitivas se pueden formar grandes moléculas lineales y ramificadas. Las cadenas cortas reciben el nombre de oligosacáridos, mientras que las cadenas largas se denominan polisacáridos. El glucógeno, por ejemplo, es un polisacárido formado enteramente por unidades de glucosa unidas. a O O O O O O O • Homopolisacáridos: compuestos por un solo tipo de monosacáridos. O O O O O O O O O O O O O O O O O O O O O O O O • Heteropolisacáridos: compuestos por más de un tipo de monosacáridos. Homopolisacáridos O O Se diferencian dos grandes grupos: O O Arrollamiento helicoidal de la amilosa. a • Almidón: polisacárido de reserva de los vegetales y una de las fuentes más importantes de azúcares para los animales. Es un polímero de glucosa que está formado por dos tipos de moléculas: la amilosa y la amilopectina. La amilosa constituye un 30 % del almidón. Es un polímero de α–D-glucopiranosas unidas por enlaces α (1→4). De hecho, puede decirse que es un polímero de maltosa. Tiene estructura lineal y adopta una disposición helicoidal con 6 glucosas por vuelta. La amilopectina constituye un 70 % del almidón. Es un polímero muy ramificado. Las cadenas de glucosa están unidas por enlaces α (1→4), pero cada 25 o 30 unidades de glucosa aparece una ramificación con un enlace α (1→6). El almidón de los vegetales procede de la fotosíntesis. De esta forma las plantas almacenan glucosa sin que esta influya en la presión osmótica. El almidón se almacena en gránulos en los amiloplastos. Estos gránulos tienen capas concéntricas de amilosa en la parte interna y amilopectina en el exterior. Diversas estructuras vegetales contienen gran cantidad de almidón: semillas como de legumbres y cereales, base de la alimentación humana; tallos como los tubérculos (patata); y frutos como bellotas o castañas. La escisión por la α-amilasa produce maltosa libre ( ) Esquema de un fragmento de amilopectina. a En la digestión de esta macromolécula intervienen dos enzimas: la α-amilasa que rompe los enlaces (1→4) y la α–glucosidasa para las ramificaciones (1→6). Al final del proceso se libera únicamente glucosa. Y Biologia 2 UD 01 26/1/09 08:17 Página 25 Composición química de los seres vivos (I) 25 ! Más de la mitad de los carbohidratos ingeridos por el ser humano son almidón. Tanto la amilosa como la amilopectina son hidrolizadas rápidamente por el enzima α-amilasa, secretado por las glándulas salivales y el páncreas. Este enzima hidroliza los enlaces α (1,4) internos, originando maltosas y otros fragmentos cortos como la α-dextrina, que presenta enlaces α (1,4) y α (1,6). La hidrólisis se completa con los enzimas maltasa y α-dextrinasa. CH2OH O 5 1 4 1 O 2 3 CH2OH O O O Punto de ramificación enlace α (1 6) CH2OH 6 CH2 O 5 4 O La presencia de glucógeno incrementa la cantidad de glucosa asequible inmediatamente entre las comidas y durante la actividad muscular. La glucosa es el único combustible utilizado por el cerebro, excepto en ayunos prolongados. La cantidad de glucosa en los líquidos corporales de un ser humano de 70 kg tiene un contenido energético de tan solo 40 kcal, mientras que el total de glucógeno corporal tiene más de 600 kcal, aun después del ayuno de una noche. Los dos lugares principales de almacenamiento de glucógeno son el hígado y el músculo esquelético. La concentración de glucógeno hepático es superior a la del músculo, pero se acumula más en este último ya que el músculo esquelético tiene mayor masa. CH2OH O CH2OH Glucógeno O 1 O O O 2 3 Cadena principal α (1 a 4) Un fragmento de amilopectina con un punto de ramificación en posición a (1→6). ! • Glucógeno: polisacárido de reserva de los animales. Se localiza principalmente en el hígado (25 %) y en el músculo (70 %). Es muy similar a la amilopectina pero está más ramificado, con una ramificación cada 8 o 12 glucosas. Su disposición es helicoidal. Se requieren también dos enzimas para su hidrólisis. Fibra alimenticia Parece probado que la ingestión de fibras (celulosa, hemicelulosa, pectina y lignina) que no pueden ser digeridas, previene algunas enfermedades: estreñimiento, cáncer de colon y enfermedades cardiovasculares, entre otras. Los contenidos en fibras de algunos alimentos (expresado en gramos por 100 gramos de alimento) son: pan integral, 8,5; pan blanco, 2,7; arroz integral, 9,1; arroz blanco, 3,0; patatas, 3,5; lechuga, 1,5; judías blancas, 25,5; garbanzos, 15,0; almendras, 14,5; plátanos, 3,4; peras, 2,4; manzanas, 1,4. • Dextrano: es un polisacárido de reserva de las levaduras y bacterias. Solo contiene glucosa pero con enlaces α (1,6) casi exclusivamente. Según las especies, presenta distintos tipos de ramificaciones. • Celulosa: polisacárido estructural de los vegetales, en los que constituye la pared celular. Es el componente principal de la madera (papel), y el algodón es casi celulosa pura. Se calcula que el 50 % de la materia orgánica de la biosfera es celulosa. Cada año, en la Tierra, se sintetizan y degradan unos 1015 kg de celulosa. Los animales no pueden digerir la celulosa, a menos que tengan bacterias o protozoos simbiontes en su tubo digestivo, que con sus celulasas son capaces de hidrolizar el enlace β (1→4) y liberar glucosas. Dado que la especie humana carece de estos simbiontes, no podemos digerir la celulosa, con lo que esta pasa a aumentar el volumen de las heces fecales. • Quitina: polisacárido estructural de algunos animales y hongos. Forma el exoesqueleto en artrópodos y las paredes celulares en hongos. Es un polímero no ramificado de la N-acetilglucosamina con enlaces β (1→4). Foto Jacana. M.C. 177. Es un polímero lineal y no ramificado de celobiosa. Por tanto, contiene glucosas unidas por enlaces β (1→4). Este enlace le da una gran resistencia. Las cadenas de glucosas se unen entre sí por puentes de hidrógeno dando microfibrillas, estas se unen y dan fibrillas que, a su vez, producen fibras ya visibles. Las fibras son muy rígidas e insolubles en agua. En la pared celular se disponen de forma paralela dando lugar a capas. a Semilla de algodón. Y Biologia 2 UD 01 26/1/09 08:17 Página 26 Unidad 1 26 CH2OH O H H H NH H C Cadenas moleculares de celulosa CH3 Å OH 7 ,9 OH 10,3 Å OH H O 8,3 Å Disposición cristalina N-acetilglucosamina. La quitina es un polímero de esta molécula. a CH2OH CH2OH O H ! CH2OH O H H O H H O Una dieta equilibrada Es aquella que contiene todos los alimentos necesarios para conseguir un estado nutricional óptimo, proporcionando al individuo un estado de salud óptimo y aumentando su esperanza de vida. Esta dieta debe cumplir tres normas básicas: – Aportar una cantidad de energía suficiente para llevar a cabo los procesos metabólicos y de trabajo físico necesarios. – Ha de ser variada e incluir alimentos de todos los grupos para satisfacer las necesidades de todos los alimentos. – Las cantidades de los principios inmediatos deben estar equilibradas entre sí. Según los expertos de la OMS (Organización Mundial de la Salud), los glúcidos deben aportar entre el 55 % y el 60 % de la energía total, los lípidos un 30 % y las proteínas un 15 % de las calorías totales ingeridas. OH H H OH H CH2OH O H H O OH H H OH H H O OH H Celobiosa H OH H O OH H H OH H Fragmento de una cadena de celulosa, con la unidad que se repite (celobiosa) y unión de las cadenas. a Heteropolisacáridos Producen dos o más tipos distintos de monosacáridos al ser hidrolizados. Entre los de origen vegetal cabe destacar: • La pectina. Junto con la celulosa, está formando parte de la pared vegetal. Abunda en las manzanas, membrillos y ciruelas. Se utiliza como gelificante en la industria alimentaria, por ejemplo para las mermeladas. • La hemicelulosa. Se encuentra en las paredes celulares de las células vegetales. • El agar-agar. Presente en algas marinas. Se utiliza en microbiología como medio de cultivo y en la industria alimentaria como espesante. • Las gomas vegetales (arábiga, etc.). Son productos muy viscosos que cierran heridas en los vegetales. ! Los Heterósidos Compuestos glucídicos con un grupo aglucón, se clasifican en función de este grupo en glucolípidos y glucoproteidos. Estas moléculas se tratan en los apartados de lípidos y proteínas, respectivamente. Entre los heteropolisacáridos animales destacan: los glicosaminoglicanos, que forman parte de la sustancia intercelular del tejido conjuntivo, aportando viscosidad y elasticidad. Por ejemplo el ácido hialurónico, que se encuentra junto al colágeno en el tejido conjuntivo, también en el líquido sinovial de las articulaciones y en el humor vítreo del ojo. La heparina, sustancia anticoagulante que impide el paso de protrombina a trombina. Por último, la condroitina, que se encuentra en cartílagos, huesos, tejido conjuntivo y córnea. Y Biologia 2 UD 01 26/1/09 08:17 Página 27 Composición química de los seres vivos (I) 27 2.4. Funciones de los glúcidos • Estructural. Forman parte de diversas estructuras, ya sean moleculares, celulares u orgánicas. Por ejemplo, la ribosa y la desoxirribosa (en ácidos nucleicos), la celulosa, hemicelulosa y pectinas (en las paredes celulares), y la quitina (en el exoesqueleto de artrópodos). • Energética. Los azúcares constituyen una fuente primaria de energía química para las células. En una oxidación completa producen 410 kcal/100 g. El azúcar energético por excelencia es la glucosa. • De reserva energética. Los azúcares son incorporados a polisacáridos para el almacenamiento de energía. Es el caso de macromoléculas como el almidón en los vegetales y el glucógeno en los animales. • Marcadores de destino celular y lugares de reconocimiento celulares. Son transportadores de información biológica, como ácidos nucleicos y proteínas. Son sobre todo oligosacáridos asociados a proteínas. • Intermediarios metabólicos. Ejemplo: gliceraldehído. 2.5 Reconocimiento de glúcidos • Monosacáridos: reacción de Fehling. El grupo aldehído de las aldosas y el cetónico de las cetosas da a los monosacáridos su carácter reductor. Este grupo se oxida a ácido y reduce el sulfato de cobre (II), de color azul, a óxido de cobre (I) de color rojo-anaranjado. El reactivo de Fehling contiene la sal cúprica, de color azul, que en contacto con un monosacárido se reduce a óxido rojo-anaranjado. El reactivo de Fheling consiste en una mezcla de dos reactivos: el Fehling A (sulfato cúprico), de color azul, y el Fehling B (tartrato sódico-potásico), incoloro. Esta mezcla se prepara inmediatamente antes de su uso, ya que se estropea con el tiempo. – Reacción de Tollens. El fundamento de esta reacción es el mismo que en la anterior. Este reactivo contiene nitrato de plata con unas gotas de amoniaco. El monosacárido reduce la plata, y la plata libre forma un espejo sobre las paredes del tubo de ensayo. – Reactivo de Selivanoff. Contiene resorcina y ácido clorhídrico, y permite diferenciar las aldosas de las cetosas. Las cetosas, como la fructosa, presentan un anillo tipo furano que en medio ácido se deshidrata dando un compuesto llamado furfurol o un derivado del mismo, según el número de carbonos del monosacárido. Dichos compuestos reaccionan con la resorcina y forman un complejo de color rojo. • Disacáridos: con excepción de la sacarosa los principales disacáridos son reductores. La propiedad reductora de los mismos puede reconocerse con el reactivo de Fehling, que tomará color rojo-anaranjado. La sacarosa dará negativa la reacción de Fehling, ya que sus dos carbonos anoméricos están implicados en el enlace y no es reductora. • Polisacáridos: para la identificación de polisacáridos se utiliza la reacción del Lugol, que es una disolución de yodo y yoduro potásico. En presencia de Lugol los polisacáridos como el almidón toman color azul. La coloración producida se debe a que el yodo se introduce entre los espacios de la molécula de almidón. Por tanto no es una reacción química verdadera, la presencia del yodo en el interior de la molécula modifica sus propiedades físicas. ACTIVIDADES PROPUESTAS 5. ¿Por qué los monosacáridos presentan actividad óptica? 6. Diferencia entre las siguientes parejas de términos: hidrocarburo/glúcido; glucosa/fructosa; monómero/ polímero; glucógeno/almidón; celulosa/quitina; epímero/enantiómero; homopolisacárido/heteropolisacárido. 7. Indica si cada uno de los pares siguientes son entre sí anómeros, epímeros o parejas aldosa-cetosa: a) D-gliceraldehído y dihidroxiacetona b) D-glucosa y D-galactosa c) D-glucosa y D-fructosa d) α-D-glucosa y β-D-glucosa e) D-ribosa y D-ribulosa. Y Biologia 2 UD 01 26/1/09 08:17 Página 28 Unidad 1 28 AA Lípidos saponificables. Derivados por esterificación de ácidos orgánicos monocarboxílicos. Lípidos insaponificables. Derivados por aposición de varias unidades isoprénicas, o bien de naturaleza esteroidea. 3. Lípidos Los lípidos (del griego lypos, grasa) constituyen un grupo de biomoléculas estructuralmente muy heterogéneo, aunque con características comunes de solubilidad: son poco o nada solubles en agua, pero solubles en disolventes orgánicos (éter, benceno, cloroformo...), y de densidad: poseen baja densidad. La mayor parte de los lípidos constituye los aceites y grasas, que suelen ser productos de reserva y protección en el ser vivo, pero no se debe olvidar que algunos lípidos complejos forman parte de las membranas biológicas, y de este modo participan activamente en muchos aspectos de la fisiología celular. La citada heterogeneidad estructural de los lípidos dificulta su clasificación. Aunque rara vez se hallan en estado libre, los ácidos grasos forman parte de la mayoría de los lípidos. Por esta razón pueden utilizarse para clasificarlos. ÁCIDOS GRASOS Simples u hololípidos ACILGLICÉRIDOS CÉRIDOS LÍPIDOS SAPONIFICABLES Complejos o heterolípidos FOSFOGLICÉRIDOS ESFINGOLÍPIDOS ESTEROIDES LÍPIDOS NO SAPONIFICABLES ISOPRENOIDES O TERPENOS " LA DIETA DE LOS ESPAÑOLES La dieta de los españoles se aleja de las recomendaciones dadas por los expertos en nutrición: Ingerimos calorías y proteínas en exceso, así como alimentos de origen animal. Por el contrario, nuestro aporte de carbohidratos, especialmente almidón, y de fibra es insuficiente. Pero, sobre todo, la mayor diferencia afecta a las grasas, de las que consumimos casi el doble de la cantidad recomendada. Para prevenir enfermedades cardiovasculares las 2/3 partes del total de lípidos ingeridos deben contener ácidos grasos monoinsaturados y poliinsaturados, procedentes de aceites vegetales y de pescado, y 1/3 ácidos grasos saturados, de procedencia animal. Se recomienda reducir el consumo de colesterol hasta 300 mg/día. Y Biologia 2 UD 01 26/1/09 08:17 Página 29 Composición química de los seres vivos (I) 29 3.1. Ácidos grasos Los ácidos grasos son ácidos carboxílicos de cadena larga que forman parte de los lípidos saponificables por medio de enlaces éster. Son poco abundantes en estado libre y se obtienen por hidrólisis de los lípidos citados. Se conocen unos 100 ácidos grasos que poseen un número par de átomos de carbono. Los más abundantes son los de 16 y 18 carbonos. Los ácidos grasos son saturados cuando no poseen enlaces dobles; si en su cadena hay uno o más enlaces dobles son insaturados o poliinsaturados. El grado de insaturación y la longitud de la cadena hidrocarbonada determinan su punto de fusión. Los saturados son flexibles y sólidos a temperatura ambiente, mientras que los insaturados son rígidos a nivel del doble enlace y son líquidos aceitosos. –O O C Ácido esteárico –O COOH COOH CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH CH2 CH2 CH CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH3 CH2 CH2 O CH2 CH3 ácido esteárico (C18) C Ácido oleico COOH CH2 CH3 ácido palmítico (C16) Fórmulas desarrolladas de tres ácidos grasos frecuentes: palmítico, esteárico y oleico. a a Son ácidos grasos esenciales aquellos que no pueden ser sintetizados en el organismo, por lo que deben ser ingeridos con la dieta. Para la especie humana hay tres ácidos esenciales, todos ellos poliinsaturados: linoleico, linolénico y araquidónico. C Cola hidrofóbica a Disposición espacial de un ácido graso saturado (ácido esteárico) y uno insaturado (oleico). El doble enlace es rígido y provoca una alteración en la estructura de la cadena. Una característica importante de los ácidos grasos es su bipolaridad: son moléculas bipolares o anfipáticas (del griego amphi, doble), es decir, un extremo de la molécula, la cabeza, es polar o iónica y, por tanto, hidrófila. El otro extremo, la cola, es apolar o hidrófoba. En medio acuoso pueden formar monocapas, bicapas o micelas. O– O Cabeza hidrofílica Por ello, en los saturados el punto de fusión es más alto y aumenta con el número de carbonos, porque se forman enlaces de Van der Waals entre las cadenas hidrocarbonadas. En los insaturados es menor el número de interacciones de este tipo debido al codo en su cadena, por lo que su punto de fusión es más bajo. ácido oleico (C18) b a) Estructura del ácido graso donde se muestran la cabeza hidrófila y la cola hidrófoba. b) En agua pueden formar una película superficial (monocapa) o pequeñas esferas llamadas micelas. En cualquier caso las cabezas siempre toman contacto con el agua. a Y Biologia 2 UD 01 26/1/09 08:17 Página 30 Unidad 1 30 ÁCIDOS GRASOS MAS FRECUENTES, TANTO SATURADOS COM INSATURADOS SÍMBOLO NOMBRE SINTEMÁTICO ESTRUCTURA NOMBRE COMÚN PUNTO DE FUSIÓN (°C) Ácidos grasos saturados 12:0 CH3(CH2)10COOH n-Dodecanoico Ácido laúrico 44,2 14:0 CH3(CH2)12COOH n-Tetradecanoico Mirístico 53,9 16:0 CH3(CH2)14COOH n-Hexadecanoico Palmítico 63,1 18:0 CH3(CH2)16COOH n-Octodecanoico Esteárico 69,6 20:0 CH3(CH2)18COOH n-Eicosanoico Araquídico 76,5 24:0 CH3(CH2)22COOH n-Tetracosanoico Lignocérico 86,0 Ácidos grasos insaturados 16:1 CH3(CH2)5CH === CH(CH2)7COOH Palmitoleico –0,5 18:1 CH3(CH2)7CH === CH(CH2)7COOH Oleico 13,4 18:2 CH3(CH2)4CH === CHCH2CH === CH(CH2)7COOH Linoleico –5,0 18:3 CH3CH2CH === CHCH2CH === CHCH2CH === CH(CH2)7COOH Linolénico –11,0 20:4 CH3(CH2)4(CH === CHCH2)3CH == CH(CH2)3COOH Araquidónico –49,5 3.2. Acilglicéridos, grasas simples o grasas neutras ! El enranciamiento de los ácidos grasos se debe a un proceso de autooxidación en contacto con el aire. El O2 ataca el doble enlace y se forman compuestos que se polimerizan. En los tejidos de los seres vivos la vitamina E impide la autooxidación. Son lípidos simples formados por el glicerol esterificado por uno, dos o tres ácidos grasos: monoacilglicéridos, diacilglicéridos o triacilglicéridos respectivamente. Los más abundantes son los triacilglicéridos, en los cuales los ácidos grasos pueden ser iguales, si bien lo más frecuente es que sean diferentes. CH2OH CHOH + O HO O HO C (CH2) CH3 O CH2 O C (CH2) C (CH2) CH3 O CH O C (CH2) n n O CH2OH C (CH2)n CH3 HO Glicerol Ácidos grasos n n CH3 CH3 + 3H2O O CH2 O C (CH2)n CH3 Triacilglicérido Agua La esterificación del glicerol con ácidos grasos produce acilglicéridos, en este caso un triacilglicérido. Los ácidos grasos pueden ser iguales o no, y saturados o insaturados. a Si los ácidos grasos son insaturados la molécula resultante es líquida a temperatura ambiente y recibe el nombre de aceite. Si son saturados la molécula es sólida y son los sebos o mantecas. En plantas y animales poiquilotermos predominan los aceites, en los animales homeotermos hay sebos.Tanto unos como otros están formados por mezclas complejas de triacilglicéridos. Los triacilglicéridos pueden sufrir reacciones de saponificación. Consiste en una hidrólisis con álcalis (NaOH o KOH). Esta hidrólisis produce glicerol y jabón: sal sódica o potásica de los ácidos grasos.Todos los lípidos que contengan ácidos grasos son saponificables. Y Biologia 2 UD 01 26/1/09 08:17 Página 31 Composición química de los seres vivos (I) CH2 OOC (CH2) n CH CH3 CH2OH OOC (CH2)n CH3 + 3 NaOH CHOH + CH2 OOC (CH2)n CH3 Hidróxido sódico Triacilglicérido a CH2OH 31 O NaO O NaO O NaO Glicerol C (CH2) n CH3 C (CH2)n CH3 C (CH2)n CH3 Jabón La saponificación de las grasas produce jabones: sales sódicas o potásicas de los ácidos grasos. En los organismos la hidrólisis se lleva a cabo por enzimas específicas: las lipasas, y no se producen jabones, sino ácidos grasos y glicerina. En Alberts. Por cortesía de D. Friend. Los triacilglicéridos son relativamente insolubles en agua y no tienden a formar micelas, ya que son moléculas apolares. Los diacilglicéridos y monoacilglicéridos poseen polaridad a causa de los grupos hidróxilo libres y forman micelas. Funciones de los triacilglicéridos: • Reserva energética: en los animales forman depósitos sólidos que se acumulan principalmente bajo la piel (panículo adiposo) o rodeando los órganos. En los vegetales se almacenan los aceites en las semillas oleaginosas (nueces, almendras, soja, cacahuete, avellanas, pipas de girasol), o en frutos (aceituna). • Protección: frente al frío y traumatismos. En animales de zonas polares, el panículo adiposo es muy grueso y les ayuda a sobrevivir en esas condiciones extremas. La grasa es un buen aislante térmico. Igualmente sirve como capa amortiguadora de golpes. Fotografía al microscopio electrónico de una inclusión lipídica en el citoplasma que contiene triacilglicéridos, la principal forma de reserva de grasa. a 3.3. Céridos Las ceras son ésteres de un ácido graso de cadena larga con un monoalcohol de cadena larga. A temperatura ambiente son sólidas. Las ceras poseen sus dos extremos hidrófobos, por lo que su función en los seres vivos es impermeabilizante y protectora. En los animales se encuentran en la piel, recubriendo el pelo, las plumas, y el exoesqueleto de insectos. Una cera muy conocida es la cera de las abejas. En los vegetales forman películas que recubren hojas, flores y frutos. HIDRÓFOBO HIDRÓFOBO O Monoalcohol de cadena larga O O CH3 (CH2)28 CH2 O C C Enlace éster (CH2)14 ! Los detergentes son sustancias que, como los jabones, emulsionan la suciedad, pero no se obtienen de las grasas. El poder detergente de los jabones se debe a que forman micelas que engloban gotas de grasa, es decir, producen una emulsión. Ácido graso CH3 Estructura general de una cera y fórmula del palmitato de miricilo, componente principal de la cera de abeja. a Y Biologia 2 UD 01 26/1/09 08:17 Página 32 Unidad 1 32 3.4. Fosfoglicéridos a O Los fosfoglicéridos son los lípidos más abundantes en las membranas de la mayoría de las células. Están constituidos por el glicerol-3-fosfato esterificado en los carbonos 1 y 2 por ácidos grasos. grupo polar P O— O O CH CH2 O O C O CH2 CH2 b O CH O C HO P O OOC OOC CH2 Hidrófilo «colas» hidrofóbicas de ácido graso a) Estructura general de los fosfoglicéridos, donde el grupo polar está constituido por alcoholes. En los fosfoglicéridos, 2 de los grupos —OH del glicerol están unidos a ácidos grasos, mientras que el tercer grupo —OH está unido al ácido fosfórico. El fosfato está unido además a un pequeño grupo polar. b) Ácido fosfatídico. c OH Hidrófobo La molécula más sencilla es el ácido fosfatídico, cuyo grupo fosfato puede ser esterificado con alcoholes (frecuentemente aminados) como la etanolamina, serina y colina. Los fosfoglicéridos resultantes son la fosfatidiletanolamina, fosfatidilserina y fosfatidilcolina o lecitina, respectivamente. Hidrófoba CH2OH CH C O CH2OH NH2 N+ CH2 3 CH CH3 COO CH2 CH3 COO CH CH2 CH3 CH Colina Serina a CH2OH CH2 NH2 Etanolamina a Tres alcoholes aminados que aparecen en los fosfoglicéridos. O O P OH 3 OH Hidrófila Serina O CH2 CH COOH Fosfatidilserina. Los fosfoglicéridos son moléculas bipolares, con una cabeza polar o hidrófila (fosfato y alcohol) y una cola hidrófoba constituida por los ácidos grasos. Esta polaridad les confiere un papel trascendental en la formación de las membranas biológicas. Los ácidos grasos que contienen pueden ser saturados o insaturados. La longitud y grado de instauración de las cadenas de estos ácidos en los lípidos de membrana tienen un profundo efecto sobre la fluidez de la misma. Aire Cabeza polar Colas no polares Agua Agua Bipolaridad de los fosfoglicéridos y sistemas que forman en presencia de agua. NH2 d Micelas en el agua Y Biologia 2 UD 01 26/1/09 08:17 Página 33 Composición química de los seres vivos (I) 33 ! 3.5. Esfingolípidos Aunque los fosfoglicéridos son los lípidos más abundantes de las membranas celulares, en las membranas de animales y plantas se puede encontrar un segundo tipo de moléculas lipídicas: los esfingolípidos. Son particularmente abundantes en las células del tejido nervioso. El esqueleto de los esfingolípidos es la esfingosina, un alcohol aminado de cadena larga. La unión de la esfingosina con un ácido graso por un enlace amida origina una ceramida, precursor de todos los esfingolípidos. CH3 CH3 Ceramida, precursor de los esfingolípidos. (CH2)12 (CH2)n CH C CHOH NH CH Esfingosina CH2OH O d CH Ácido graso Lípidos de membrana La variedad de lípidos que constituyen las membranas celulares es extensa. Los tres tipos principales son los fosfolípidos (fosfoglicéridos y fosfoesfingolípidos), los glucolípidos y el colesterol. Todos ellos tienen en común una característica muy importante: son moléculas anfipáticas, es decir, contienen a la vez una parte hidrofílica y otra hidrofóbica. Su unidad hidrofílica, también llamada grupo o cabeza polar, se representa mediante un círculo, mientras que sus colas hidrocarbonadas son representadas mediante líneas rectas u onduladas. Existen varios tipos de esfingolípidos: esfingomielinas, cerebrósidos y gangliósidos, que se diferencian por los distintos grupos polares unidos a la ceramida. Todos ellos son moléculas bipolares o anfipáticas. Los cerebrósidos y gangliósidos se llaman también glucolípidos por llevar una parte glucídica en su molécula. Las esfingomielinas resultan de la esterificación de la ceramida por un grupo fosfato y el alcohol colina o etanolamina. Se encuentran en la mayoría de las membranas celulares animales y son los componentes mayoritarios de las vainas de mielina de las células nerviosas. CH3 (CH2)12 Ácido graso CH CH CHOH NH CH a Alcohol Aminado P CH2 Estructura general de una esfingomielina. Los cerebrósidos están formados por la ceramida unida a uno o varios azúcares, generalmente la galactosa o la glucosa. Abundan en las neuronas y en las vainas de mielina de sus axones. Los gangliósidos están formados por la ceramida unida a un oligosacárido a menudo ramificado. Aparecen en la parte externa de las membranas celulares, especialmente de las neuronas. Ácido Ácido graso graso Ácido Ácido graso graso Ácido Ácido graso graso Fosfolípidos Ácido graso Ácido graso Glucolípidos Esfingosina Glicerol Glicerol Triacilglicéridos b Esquemas donde se muestran las estructuras de los lípidos saponificables. P Alcohol Aminado Ácido Ácido graso graso Esfingosina P Alcohol Aminado Ácido Ácido graso graso Ceramida Fosfoglicéridos Azúcar Ceramida Esfingolípidos Y Biologia 2 UD 01 26/1/09 08:17 Página 34 Unidad 1 34 ! 3.6. Esteroides El colesterol que se absorbe a través del tubo digestivo se conoce como colesterol exógeno, el endógeno se sintetiza en las células. Una elevada concentración de colesterol en sangre (hipercolesterolemia) favorece su depósito en la pared de las arterias en forma de placas de ateroma, las cuales provocan arterosclerosis e hipertensión. Esto aumenta el riesgo de padecer infarto. Son lípidos insaponificables por no contener ácidos grasos. Derivan del esterano o ciclopentano-perhidrofenantreno. Todos ellos contienen esta estructura fundamental con diversos grupos de deshidrogenación y distintas cadenas laterales y grupos funcionales sustituyentes. Entre ellos destacan: • Hormonas suprarrenales: como la aldosterona, que aumenta la reabsorción del Na+, el Cl– y HCO3– en el riñón; y el cortisol, que regula la síntesis de glucógeno. • Hormonas sexuales: como la progesterona, hormona que prepara al organismo para la gestación, y la testosterona, responsable de los caracteres sexuales secundarios en los machos de los vertebrados. • Esteroles: poseen un grupo –OH en el carbono 3 y una cadena hidrocarbonada en el carbono 17. Son ejemplos de esteroles: – El colesterol, componente de las membranas celulares de los animales, modifica la fluidez de las mismas. El grupo hidróxilo en posición C3 es el único sustituyente polar, por lo que la molécula de colesterol es muy hidrófoba. Se sintetiza a partir del ácido acético y es precursor de otros esteroides como los ácidos biliares y las hormonas sexuales. La membrana plasmática de las células eucariotas es rica en colesterol, mientras que las membranas de sus orgánulos tienen mucha menor cantidad. El colesterol apareció en la biosfera después de que la atmósfera terrestre se hiciese aerobia. – Los ácidos biliares emulsionan las grasas, facilitando la acción de la lipasa pancreática y su absorción intestinal. – La vitamina D regula el metabolismo del Ca y del P. Puede obtenerse por irradiación ultravioleta del colesterol subcutáneo, por lo que comienza a considerarse como una hormona. – El estradiol es una hormona responsable de la aparición de los caracteres sexuales secundarios en las hembras de vertebrados. 18 11 19 2 3 1 A 4 10 5 9 12 C 13 17 D 14 16 15 8 B 7 6 Núcleo del ciclopentano-perhidrofenantreno. a No hay esteroles en las bacterias. Aldosterona O HC HO C CH3 D CH3 C Progesterona A 11 D 2 B O Fórmulas de varios esteroides. HC 24 CH2 23 CH2 22 CH2 HO 3 1 A 4 19 CH3 9 10 5 B 6 12 C HC 18 CH3 13 14 17 D 17 27 D A B O CH3 21 OH β-Estradiol 16 C 15 8 7 OH CH3 20 O 17 C Testosterona 26 B O a Colesterol O 25 C A CH2OH A HO B D Y Biologia 2 UD 01 26/1/09 08:17 Página 35 Composición química de los seres vivos (I) 35 3.7. Isoprenoides o terpenos CH2 Están formados por polimerización del isopreno. Son moléculas muy abundantes en los vegetales y se clasifican por el número de isoprenos que contienen: • Monoterpenos: formados por 2 isoprenos. Son los aceites esenciales de muchas plantas, a las que dan su olor y sabor característicos: mentol, geraniol, limoneno, pineno, alcanfor, etc. • Diterpenos: constan de 4 isoprenos. Es importante el fitol, por formar parte de la clorofila y ser precursor de la vitamina A. Son también diterpenos las vitaminas A, E y K. • Triterpenos: constituidos por 6 isoprenos, como el escualeno, precursor del colesterol. • Tetraterpenos: formados por 8 isoprenos. Son muy abundantes las xantofilas y los carotenos, pigmentos vegetales amarillos y anaranjados, respectivamente. Dan color a las flores, frutos, raíces como la zanahoria, etc. Desempeñan un papel clave en la fotosíntesis al absorber energía luminosa de longitudes de onda distintas a las que capta la clorofila. El caroteno es precursor de la vitamina A. • Politerpenos: constan de muchos isoprenos, como el caucho, que contiene varios miles. Se obtiene del árbol del caucho (Hevea brasiliensis) y se usa para fabricar objetos de goma (neumáticos, etc.). C CH3 CH3 C CH3 CH3 Fitol CH CH2 CH2 HC a CH2 CH2 CH CH2 a Isopreno (metil butadieno). ! Los carotenos y xantofilas en los animales se almacenan en el panículo adiposo, con lo que la piel queda coloreada. Por ello algunos se usan como cosmético bronceador de administración oral. CH3 CH2 CH2 CH2 CH CH3 CH2 CH2 CH2 C CH CH2OH C HC C CH3 CH2OH Geraniol, un monoterpeno lineal CH2 CH CH3 HC CH2 CH3 CH3 CH2 CH CH2 β-Caroteno (provitamina A) CH2OH C CH2 CH3 Limoneno, un monoterpeno cíclico Retinol (vitamina A1) Fórmulas de varios terpenos. 3.8. Eicosanoides El ácido araquidónico es el precursor más importante de varias clases de moléculas señal: prostaglandinas, prostaciclinas, tromboxanos y leucotrienos. Estas sustancias se denominan eicosanoides porque tienen 20 átomos de carbono (eikosi: veinte, en griego). Las prostaglandinas son ácidos grasos de 20 carbonos que contienen un anillo de 5 carbonos. Estos compuestos se descubrieron en la década de 1930 en las secreciones de la próstata, de ahí su nombre. Se fabrican cuando el ácido araquidónico de la membrana celular es procesado por enzimas a través de una serie de etapas. Estas moléculas y otros eicosanoides son hormonas locales, ya que son de vida breve. Alteran actividades de las células donde se sintetizan y de las adyacentes. Y Biologia 2 UD 01 30/1/09 09:46 Página 36 Unidad 1 36 a b Leucotrienos Fosfolípidos PLA2 OH O OH Protaglandina sintasa Prostaciclina sintasa Tromboxano sintasas Prostaciclina Tromboxanos Otras prostaglandinas COO– COO– Lipooxigenasas DG lipasa Diacilgliceroles Araquidonato Prostaglandina H2 (PGH2) OH Prostaglandina A2 Leucotrieno B4 –OOC O COO– O OH OH O OH Prostaciclina (PGI2) a a) El araquidonato es el principal precursor de las hormonas eicosanoides. b) Estructuras de varios eicosanoides. Tromboxano A2 (TXA2) Entre sus funciones reguladoras destacan: • Regulan el flujo sanguíneo a órganos particulares como el riñón. • Controlan la contracción del útero durante el parto y la menstruación. • Provocan inflamación como respuesta ante infecciones y heridas. • Protegen contra lesiones del estómago. • Controlan el transporte de iones a través de las membranas. • Modulan la transmisión sináptica e inducen el sueño. • Los tromboxanos son agentes que provocan la agregación plaquetaria. • Las prostaciclinas dilatan los vasos sanguíneos e inhiben la agregación plaquetaria. 3.9. Funciones de los lípidos Como se ha visto al tratar los diferentes grupos de lípidos, estos realizan varias funciones que resumimos a continuación: ACTIVIDADES PROPUESTAS 8. Define: ácido graso saturado, ácido graso esencial, anfipático, hidrófilo, hidrófobo y micela. 9. Los acilglicéridos son lípidos saponificables. ¿Qué significa esta característica? Escribe la reacción de saponificación de la tripalmitina con hidróxido sódico. 10. Haz esquemas para comparar las estructuras de los triacilglicéridos, fosfolípidos y glucolípidos. Señala en ellos los componentes y los tipos de enlaces que presentan. 11. ¿Es correcto afirmar que la bilis, por su contenido en ácidos biliares, digiere las grasas en el intestino delgado? Razona la respuesta. • Reserva energética. Proporcionan 940 kcal/100 g, más del doble que los glúcidos. Si se consumen más alimentos de los que se necesitan, el exceso, convertido en grasa, se acumula en las células adiposas. Esta función es llevada a cabo por los acilglicéridos. • Estructural. Forman las membranas celulares, como los fosfolípidos, esfingolípidos y colesterol. Estos lípidos reciben el nombre de lípidos de membrana. • Función dinámica. Es el caso de las hormonas y vitaminas citadas anteriormente. • Función transportadora: HDL y LDL (lipoproteínas). Transportan colesterol. • Función amortiguadora térmica y mecánica: grasas sólidas del panículo adiposo. 3.10. Reconocimiento de lípidos • Saponificación. Con excepción de los isoprenoides y terpenos, el resto de los lípidos contiene ácidos grasos. Por ello pueden saponificarse con OHNa o con OHK, dando jabón: sales sódicas o potásicas de los ácidos grasos. • Tinción con Sudán III. La presencia de lípidos en un material biológico puede ponerse de manifiesto utilizando el colorante Sudán III. Las grasas toman un color amarillo rojizo. Y Biologia 2 UD 01 26/1/09 08:17 Página 37 Composición química de los seres vivos (I) 37 EXPERIENCIAS Observación de gránulos de almidón en amiloplastos MATERIAL NECESARIO • Portaobjetos, cubreobjetos, bisturí y microscopio. PRODUCTOS QUÍMICOS Y MATERIAL BIOLÓGICO • Lugol y patatas. DESARROLLO • Raspar suavemente con el bisturí la superficie del corte de una patata. Colocar el raspado sobre un porta y añadir una gota de lugol. Colocar el cubre encima y observar al microscopio. Se apreciarán los granos de almidón de color azul intenso. • Raspar de nuevo la superficie del corte de la patata y colocar el raspado sobre otro porta. Añadir una gota de lugol diluido (5-8 gotas de agua y 1 gota de lugol), colocando luego el cubre. Observar al microscopio. Se apreciarán granos de almidón ovoides, de color azul, con capas concéntricas de crecimiento alrededor de un punto excéntrico (hilio). Saponificación del aceite de oliva Aceite MATERIAL Y PRODUCTOS QUÍMICOS NaOH • Tubos de ensayo, varilla de vidrio, baño maría, aceite de oliva y NaOH al 20 %. DESARROLLO • Poner en un tubo de ensayo 4 ml de aceite de oliva y 4 ml de NaOH al 20 %. Agitar para formar una emulsión. Poner el tubo al baño maría durante 30 minutos, agitando cada 5 minutos. • Pasado este tiempo se apreciarán tres fases: una inferior, acuosa, de álcali y glicerol; una intermedia, semisólida, de jabón (oleato sódico); y una superior, lipídica, de aceite inalterado. Aceite Jabón A C T I V I D A D E S 1. ¿Qué es un proceso de saponificación? Álcali y glicerol 2. Escribe la reacción de saponificación de un triacilglicérido líquido con NaOH. 3. ¿Se puede realizar la saponificación con cualquier lípido? Razona la respuesta. Y Biologia 2 UD 01 26/1/09 08:17 Página 38 Unidad 1 38 EXPERIENCIAS Reconocimiento de monosacáridos (glucosa y fructosa) MATERIAL • • • • Gradilla con tubos de ensayo. Varilla de vidrio. Pipetas. Baño maría. PRODUCTOS QUÍMICOS • • • • Glucosa sólida al 5 %. Fructosa sólida al 5 %. Reactivos de Fehling A y B. Reactivo de Selivanoff. DESARROLLO 1.1. Reconocimiento del carácter reductor. • En un tubo de ensayo, mezcla 5 mL del reactivo de Fehling A y 5 mL del reactivo de Fehling B. Agita hasta homogeneizar; esta mezcla es el reactivo de Fehling. • Prepara 3 tubos de ensayo, numéralos y actúa del siguiente modo: – Tubo 1: pon 1 mL de reactivo de Fehling y 1 mL de glucosa al 5 %. – Tubo 2: pon 1 mL de reactivo de Fehling y 1 mL de fructosa al 5 %. – Tubo 3 (tubo control): pon 1 mL de reactivo de Fehling y 1 mL de agua destilada. • Coloca los tubos al baño maría, observando los cambios de color. • Saca los tubos 1 y 2 cuando adquieran color rojo ladrillo por la aparición de óxido de cobre en el reactivo de Fehling. Esto demuestra el carácter reductor de los monosacáridos. 1.2. Diferenciación entre aldosas (glucosa) y cetosas (fructosa). • Prepara tres tubos de ensayo, numerados del 1 al 3, como sigue: – Tubo 1: pon 3 mL de reactivo de Selivanoff y 3 gotas de glucosa al 5 % – Tubo 2: pon 3 mL de reactivo de Selivanoff y 3 gotas de solución de fructosa al 5 % – Tubo 3: pon 3 mL de reactivo de Selivanoff. • Coloca los tubos al baño maría durante 3 a 5 minutos. • Saca los tubos y observa los cambios de color. • En el tubo 2 la mezcla presentará color rojo debido a la presencia del anillo furanósico de la fructosa. A C T I V I D A D E S 1. ¿Por qué los monosacáridos tienen carácter reductor? 2. ¿En qué se transforma el sulfato de cobre, presente en el reactivo de Fehling, por acción de los monosacáridos? 3. ¿Cuál es la diferencia entre una aldosa y una cetosa? Y Biologia 2 UD 01 26/1/09 08:17 Página 39 Composición química de los seres vivos (I) 39 Reconocimiento de disacárido (sacarosa) MATERIAL • • • • Gradilla con tubos de ensayo. Varilla de vidrio. Pipetas. Baño María. PRODUCTOS QUÍMICOS • • • • • Sacarosa sólida al 20 %. Reactivos de Fehling A y B. Reactivo de Selivanoff. Ácido clorhídrico. Hidróxido amónico al 40 % DESARROLLO • Pon en un tubo de ensayo 1 mL de solución de sacarosa al 20 % y 1 mL de reactivo de Fehling. • Coloca el tubo al baño maría durante 3 minutos. • Saca el tubo y anota el resultado. • Para hidrolizar la sacarosa se procede del siguiente modo: – Pon en un tubo de ensayo 2 mL de solución de sacarosa y añade 4 gotas de ácido clorhídrico concentrado. – Pon al baño maría durante 5 minutos. – Enfría el tubo y añade seis gotas de hidróxido amónico al 40 % para neutralizar. – Reparte el contenido del tubo en otros dos numerados: a) tubo 1: añade 1 mL de reactivo de Fehling. b) tubo 2: añade 4 mL de reactivo de Selivanoff. LA REACCIÓN DE FEHLING El licor de Fehling tiene en su composición sulfato de Cu disuelto: CuSO4 Cu+2 + (SO4)–2 Al añadir un monosacárido y calentar se observa la aparición de un precipitado rojo de óxido cuproso OCu2. Es decir, el cobre se reduce de Cu+2 a Cu+1. A C T I V I D A D E S Esto se debe a que todos los monosacáridos tienen un grupo cetónico o aldehído que se oxida y pasa a ácido. En el grupo cetónico, el C tiene el número de oxidación +2, y en el ácido +3. 1. ¿Por qué no cambia de color el tubo que contiene sacarosa con el reactivo de Luego se oxida de C+2 a C+3. – Pon ambos tubos al baño maría, deja calentar unos minutos y anota los resultados. Fehling? 2. ¿Cómo se ha producido la hidrólisis de la sacarosa? 3. ¿Cómo demuestras la presencia de los productos que resultan de la hidrólisis de la sacarosa? En el grupo aldehído, el número de oxidación del C es +1 y en el ácido +3. Es decir, se oxida de C+1 a C+3. Y Biologia 2 UD 01 26/1/09 08:17 Página 40 Unidad 1 40 ACTIVIDADES FINALES 1. Indica las principales propiedades del agua y relaciónalas con sus funciones biológicas. 2. Describe la estructura de la molécula de agua y explica el proceso de disolución de una sustancia soluble en agua, como por ejemplo el cloruro sódico o sal común. 3. Explica las funciones de las sales en los seres vivos. 4. En relación con las sales minerales en los organismos vivos: a) Explica en qué situación las células están turgentes. b) Explica en qué situación las células están plasmolizadas. c) Pon un ejemplo de una sal mineral disuelta y otra precipitada e indica la función de cada una de ellas. 5. Al añadir un ácido a una disolución de cloruro sódico se produce un gran descenso en el valor del pH. Sin embargo, si se añade la misma cantidad de ácido al plasma sanguíneo apenas cambia el pH. Propón una explicación para este hecho. 6. Para observar el proceso de ósmosis, tres muestras de sangre humana son sometidas a una prueba en el laboratorio. a) Si se añade agua destilada a una de las muestras, indica qué les sucede a los glóbulos rojos y por qué. b) Si se añade una solución saturada de sal a otra de las muestras, indica qué aspecto presentarán los glóbulos rojos al microscopio, cómo se denomina este fenómeno y explica cómo se produce. c) Si a la tercera muestra se le añade una solución isotónica, explica si se alteraría la forma y función del glóbulo rojo. 7. Define qué es un bioelemento. Cita cinco ejemplos e indica la importancia biológica de cada uno de ellos. 8. Explica muy brevemente qué es: a) un carbono asimétrico, b) una aldosa, c) el glucógeno, d) la celulosa. 9. Explica brevemente: a) ¿En qué se diferencian las aldosas y las cetosas? b) ¿Qué repercusión tiene la presencia de un carbono asimétrico? c) Cita el papel que te parezca más relevante de los desempeñados por los siguientes glúcidos: glucosa, ribosa, celulosa, almidón, glucógeno. 10. Explica la naturaleza química y las propiedades de los polisacáridos. Indica el tipo de enlace que los caracteriza. Menciona dos polisacáridos vegetales y señala su función. 11. En relación a las biomoléculas: a) Explica los siguientes términos: polisacáridos y lípidos saponificables. b) Indica un homopolisacárido y un heteropolisacárido, ambos con función estructural. c) En las células animales, cita un lípido saponificable con función estructural y otro con función energética. 12. Respecto al almidón y la celulosa, responde a las preguntas siguientes: a) Indica sus principales diferencias y semejanzas químicas y estructurales. b) ¿Qué funciones desempeñan en los seres vivos? 13. Los lípidos constituyen un grupo de biomoléculas estructural y funcionalmente muy heterogéneo. a) Describe la estructura general de dos tipos diferentes de lípidos. b) Indica cuatro funciones que desempeñan los lípidos en el organismo. 14. Los triacilglicéridos o grasas son utilizados en la alimentación humana: a) Explica su composición química. b) Explica la diferencia, desde el punto de vista químico, entre los aceites (grasas líquidas a temperatura ambiente) y los sebos (grasas sólidas a temperatura ambiente). c) Explica en qué consiste la saponificación. d) Menciona dos grupos de lípidos insaponificables. 15. Define qué son los esteroides. Cita tres ejemplos de moléculas esteroideas. Describe las funciones biológicas fundamentales de los esteroides. Y Biologia 2 UD 01 26/1/09 08:17 Página 41 Composición química de los seres vivos (I) 41 16. Escribe la fórmula general de los ácidos grasos y explica en qué consiste la esterificación. Expón qué significa que los ácidos grasos son moléculas antipáticas. Indique la diferencia química entre grasas saturadas e insaturadas. 17. Responde a las siguientes cuestiones: a) Concepto de lípido. b) ¿Qué tipo de lípidos conoces? c) Indica las principales funciones biológicas de los lípidos. d) Escribe la fórmula de uno de ellos, indicando de cuál se trata y su función principal. TEST DE EVALUACIÓN δ 1. En relación con la imagen adjunta, responde a las siguientes cuestiones: a) Identifica la sustancia representada y explica los criterios utilizados para identificarla. ¿Qué tipo de enlace se establece entre ambas moléculas? Explica una consecuencia biológica de la existencia de estos enlaces. b) Indica cinco funciones que realiza esa sustancia en los seres vivos. 2. Con respecto a la fórmula adjunta: 6CH O 1 4 OH 3 H a) b) c) d) δ 105° − H O 1 H HO CH2 H H OH δ+ δ+ δ+ 2OH 5 H δ + − 5 2 O H 3 2 OH OH OH 4 6CH 2OH H ¿De qué tipo de molécula se trata y cómo se denomina? ¿Cuáles son sus unidades estructurales? ¿Qué tipo de enlace los une y entre qué carbonos se establece? ¿Tiene carácter reductor? ¿Por qué? 3. En relación a los glúcidos: a) Indica cuáles de los siguientes compuestos son monosacáridos, disacáridos o polisacáridos: sacarosa, fructosa, almidón, lactosa, celulosa y glucógeno. b) Indica en qué tipo de organismos se encuentran los polisacáridos indicados en el apartado anterior. c) Indica cuál es la función principal de los polisacáridos indicados en el apartado a) de esta cuestión. d) Cita un monosacárido que conozcas y que no se encuentre en la relación incluida en el apartado a) de esta cuestión. 4. Dada la fórmula: a) ¿De qué tipo de molécula se trata? b) ¿Qué tipo de enlace es el que está señalado con una flecha? c) Indica las propiedades de solubilidad de dicha molécula. d) ¿Qué función realiza en los organismos vivos? O C O CH2 O CH O CH2 O C O C 5. Señala a qué grupo de lípidos pertenecen estas moléculas: • esfingomielina • fosfatidil colina • progesterona • vitamina D • xantofilas • aceite • manteca • caucho Y Biologia 2 UD 01 26/1/09 08:17 Página 42 Unidad 1 42 PANORAMA CIENTÍFICO La vitamina solar A principios del siglo XX, antes del descubrimiento de los antibióticos, la tuberculosis se trataba con baños de sol. El mismo tratamiento se había aplicado el siglo anterior durante una pandemia de raquitismo, enfermedad infantil caracterizada por deformidades esqueléticas debidas a un desarrollo óseo deficiente. El raquitismo aumentó en Europa durante los siglos XVIII y XIX, coincidiendo con la industrialización y la emigración del campo a las ciudades. Muy pronto se observó que afectaba menos a los niños que vivían en el campo, y que los niños de ciudad se curaban con baños de sol. En 1824 se descubrió que el aceite de hígado de bacalao era un remedio contra el raquitismo, pero hasta mucho más tarde no se vio la relación entre este aceite, rico en vitamina D, la luz solar y la cura del raquitismo. ¿Tomamos una dosis suficiente? En 1922 se descubrió la vitamina D, a la que se relacionó desde un principio con la osificación y regulación del calcio. Desde hace unos 25 años se sabe que es, además, un potente anticancerígeno y un regulador del sistema inmunitario. Además de la latitud hay otros factores que contribuyen a la carencia de vitamina D. Las personas de piel blanca producen vitamina a una velocidad seis veces superior que las de piel oscura, debido a que la melanina bloquea la penetración de la luz UVB. Los humanos obtenemos la vitamina D a través de los alimentos, pero también la sintetizamos en la piel expuesta a radiación ultravioleta B. Por ello no es estrictamente una vitamina; como se produce en un tejido y luego circula a través del cuerpo, afectando a otros tejidos, se considera una hormona. Acciones de la vitamina D • Se estima que esta vitamina regula unos 1000 genes, entre ellos los que controlan el metabolismo del calcio y los que participan en procesos de defensa celular. • Tiene efecto anticancerígeno. Su síntesis en células de la piel reduce el riesgo de la radiación UVB, que al dañar el ADN de las células dérmicas pueden transformarse en cancerígenas. • Activa el sistema inmunitario, ya que provoca en las células de este sistema la síntesis de sustancias que destruyen microorganismos. Esto demostraría por qué los pacientes tuberculosos se curaban con baños de sol. • Posee propiedades antiinflamatorias. La asociación entre el déficit de esta vitamina y el cáncer, trastornos inmunitarios y enfermedades infecciosas sugiere la necesidad de actualizar las recomendaciones de las dosis diarias. La penetración atmosférica de los rayos UVB es mayor en los trópicos que en las regiones templadas, que reciben cantidades suficientes de radiación solo en verano. Gran parte de la población que vive en estas regiones presenta niveles de vitamina D inferiores a los saludables, sobre todo en invierno. Los suplementos de vitamina D resolverían la carencia en estas zonas. Se ha observado una estrecha relación entre el aumento de latitud y el aumento de riesgo de varias enfermedades, sobre todo del sistema inmunitario, como la esclerosis múltiple, la diabetes infantil, la enfermedad de Crohn y otras. Cada vez hay mayor conciencia de que tomar el sol en exceso resulta dañino para la piel, esto contribuye a la carencia de esta vitamina. Los protectores solares reducen la síntesis en más de un 98 %. Basta una exposición solar que cause un ligero enrojecimiento de la piel para que esta sintetice niveles saludables de vitamina D. La recomendación diaria para adultos en EE.UU. y Europa varía entre 200 y 600 UI (unidades internacionales). En la actualidad, algunos investigadores consideran estas cantidades insuficientes. La ingesta de suplementos dietéticos puede provocar una sobredosis, aunque es poco probable. Nunca se ha observado un exceso de vitamina D por exposición solar. Una mujer adulta de piel blanca que tome el sol de verano en biquini genera 10.000 UI en unos 15 o 20 minutos. La exposición prolongada no aumenta la concentración, porque la luz UVB también degrada la vitamina. La carencia de vitamina D puede dar lugar a fragilidad ósea, mayor exposición a las infecciones y a las enfermedades del sistema inmunitario, y una mayor tendencia a desarrollar ciertos tumores. Sería necesario que los médicos recomendaran tomar el sol con moderación y que se indicara claramente la dosis diaria de esta vitamina en la dieta. A C T I V I D A D E S 1. ¿Qué propiedad de la vitamina D hace que se encuentre en el aceite de hígado de bacalao? 2. ¿A partir de qué molécula se sintetiza esta vitamina? 3. ¿Por qué la cantidad de vitamina D en sangre tiene relación con la latitud a la que vive la población? 3. ¿Cómo se explica la defensa que proporciona esta vitamina frente a las infecciones? Y Biologia 2 UD 01 26/1/09 08:17 Página 43 Composición química de los seres vivos (I) 43 EN RESUMEN LOS ORGANISMOS se caracterizan por su Metabolismo Reproducción Composición química Grado de organización constituida por Bioelementos por su abundancia son Bioelementos primarios Bioelementos secundarios que forman Biomoléculas Oligoelementos como son Inorgánicas Orgánicas como son como son Agua Sales minerales Glúcidos Lípidos con funciones con funciones con funciones con funciones Energética Estructural Transportadora Disolvente Termorreguladora Regular el pH Procesos osmóticos Reserva energética Comunicación intercelular Dinámica AMPLÍA CON… • Vinagre Arias, Francisco; Vinagre Arias, Antonia: Vida, muerte y azúcares. Editorial Filarias. • Moalen, Sharon; Prince, Jonathan: La ley del más débil. Editorial Ariel. • Riobo, Pilar: ¿Por qué no puedo adelgazar? Los aspectos psicológicos de la dieta inteligente. Editorial La esfera de los libros. • McCord, Wilson: Biología para principiantes. Editorial Era naciente. • http://www.usal.es/dbbm//modmol/ Temas de bioquímica y gráficos con modelos moleculares. • http://web.educastur.princast.es/proyectos • http://science.nhmccd.edu/biol/bio1int.htm Página que ofrece numerosos enlaces para ver animaciones de moléculas. Z