Cinética química Módulo 2: Factores que afectan la velocidad
Anuncio

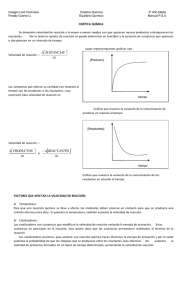
LICEO MANUEL BARROS BORGOÑO DEPARTAMENTO DE QUÍMICA Prof. Felipe Zamora Cinética química Módulo 2: Factores que afectan la velocidad Naturaleza de las sustancias reaccionantes Como regla general, la velocidad de una reacción: Entre iones en disolución es muy rápida En la que intervienen compuestos covalentes es muy variada De disoluciones homogéneas en las que intervienen líquidos y gases es as rápida que en las que intervienen sólidos. En las disoluciones heterogéneas aumenta al aumentar la superficie de contacto entre los reactantes o a mayor agitación. Concentración de los reactantes Las reacciones químicas que contienen sustancias en disolución se ven favorecidas con el aumento de concentración de al menos uno de los reactantes, provocando un incremento en la velocidad de la reacción. En caso de tener reacciones con sustancias gaseosas, se consigue el mismo efecto con un aumento de presión. La velocidad de una reacción aumenta si se eleva la concentración de uno de los reactivos, ya que el número de colisiones entre los átomos, moléculas o iones es más frecuente. Temperatura Al aumentar la temperatura de un sistema, las moléculas se desplazan con mayor rapidez provocando mayor cantidad de choques, lo que les permite alcanzar la energía necesaria para formar productos. La velocidad de una reacción endotérmica y exotérmica aumenta si elevamos la temperatura. Estado de división de los reactantes La velocidad de una reacción química aumenta cuando: Las sustancias con las que se trabaja son moléculas o iones que poseen mayor libertad de movimiento, por ejemplo, en reacciones gaseosas o en reacciones con sustancias disueltas. Las partículas reaccionantes, en estado sólido, se encuentran más divididas, de esta manera, la superficie de contacto entre las moléculas es mayor, facilitando la probabilidad de choques efectivos. LICEO MANUEL BARROS BORGOÑO DEPARTAMENTO DE QUÍMICA Prof. Felipe Zamora Catalizador Un catalizador es una sustancia que no forma parte de los reactantes ni de los productos, y su presencia, aun en cantidades muy pequeñas, acelera una reacción química. Al disminuir la energía de activación por presencia de un catalizador, la velocidad de reacción es mayor, esto es debido a que alteran el mecanismo de la reacción Un ejemplo de catalizador biológico son las enzimas, pues permiten que ocurran las reacciones al interior de las células en los organismos vivos Actividad 1. a. b. c. ¿Qué se entiende por?: Velocidad de reacción química Energía de activación Catalizador 2. a. b. c. ¿ Qué sucede con la velocidad? si: ¿Aumenta la concentración de un reactante? ¿Aumenta la temperatura? ¿Se muele un reactivo?