VELOCIDAD DE LAS REACCIONES QUÍMICAS
Anuncio

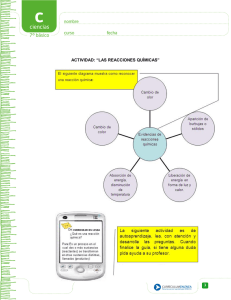
VELOCIDAD DE LAS REACCIONES QUÍMICAS Reacciones químicas Si una reacción es espontánea ¿A que velocidad ocurre? Velocidad de reacción Ejemplos de reacciones rápidas: • Sumergir sodio metálico en agua. • Calentar una cinta de magnesio. Sodio en agua Magnesio calentado Velocidad de reacción Ejemplos de reacciones lentas pueden ser: • Descomposición de una manzana. • Un clavo oxidado. Velocidad de reacción Ejemplo de una reacción muy lenta puede ser: • La formación de petróleo. http://www.educarchile.cl/Userfiles/P0001%5CFile%5Cquimica_teoria_colisiones.swf http://www.youtube.com/watch?v=RQIfEefAzg Factores que afectan la velocidad de reacción – La naturaleza de los reactantes. – La concentración de los reactantes. – La temperatura. – Superficie de contacto. – La presencia de catalizadores. La naturaleza de los reactantes • La velocidad de la reacción depende de qué elementos o sustancias estén involucrados ella. en La temperatura • La velocidad aumenta conforme aumenta la temperatura. • A mayor temperatura, hay más choques entre partículas, por lo tanto, aumenta la velocidad de reacción. • Un aumento de 10°C duplica la velocidad de reacción. La presencia de catalizadores E.A sin catalizador E.A con catalizador negativo E.A con catalizador positivo Complejo activado Energía de activación E.A Complejo activado Energía de activación E.A Productos E.A E.A Reactivos ∆H<0 ∆H>0 Productos Reactivos Transcurso de la reacción Reacción exotérmica Transcurso de la reacción Reacción endotérmica Superficie de contacto