CINÉTICA Y EQUILIBRIO QUÍMICO
Anuncio
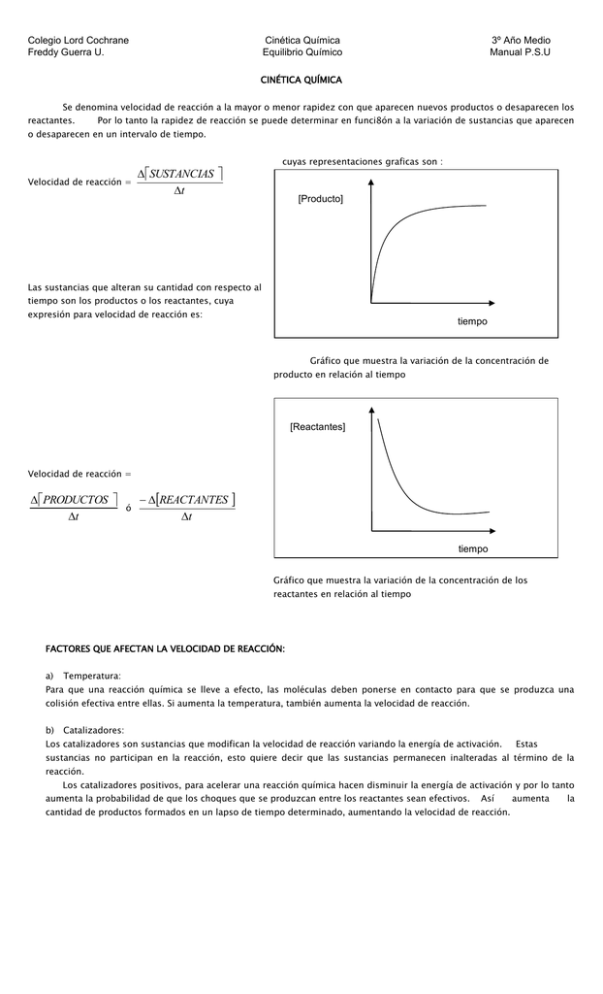
Colegio Lord Cochrane Freddy Guerra U. Cinética Química Equilibrio Químico 3º Año Medio Manual P.S.U CINÉTICA QUÍMICA Se denomina velocidad de reacción a la mayor o menor rapidez con que aparecen nuevos productos o desaparecen los reactantes. Por lo tanto la rapidez de reacción se puede determinar en funci8ón a la variación de sustancias que aparecen o desaparecen en un intervalo de tiempo. Velocidad de reacción = cuyas representaciones graficas son : SUSTANCIAS t [Producto] Las sustancias que alteran su cantidad con respecto al tiempo son los productos o los reactantes, cuya expresión para velocidad de reacción es: tiempo Gráfico que muestra la variación de la concentración de producto en relación al tiempo [Reactantes] Velocidad de reacción = PRODUCTOS t ó REACTANTES t tiempo Gráfico que muestra la variación de la concentración de los reactantes en relación al tiempo FACTORES QUE AFECTAN LA VELOCIDAD DE REACCIÓN: a) Temperatura: Para que una reacción química se lleve a efecto, las moléculas deben ponerse en contacto para que se produzca una colisión efectiva entre ellas. Si aumenta la temperatura, también aumenta la velocidad de reacción. b) Catalizadores: Los catalizadores son sustancias que modifican la velocidad de reacción variando la energía de activación. Estas sustancias no participan en la reacción, esto quiere decir que las sustancias permanecen inalteradas al término de la reacción. Los catalizadores positivos, para acelerar una reacción química hacen disminuir la energía de activación y por lo tanto aumenta la probabilidad de que los choques que se produzcan entre los reactantes sean efectivos. Así cantidad de productos formados en un lapso de tiempo determinado, aumentando la velocidad de reacción. aumenta la Colegio Lord Cochrane Freddy Guerra U. Cinética Química Equilibrio Químico 3º Año Medio Manual P.S.U COMPLEJO ACTIVADO E.A CON CATALIZADOR (+) ENERGIA DE ACTIVACION (E.A) REACTANTE PRODUCTO Relación entre la energía de activación y un catalizador positivo E.A CON CATALIZADOR (-) COMPLEJO ACTIVADO ENERGIA DE ACTIVACION (E.A) REACTANTE PRODUCTO Relación entre la energía de activación y un catalizador negativo En adelante cuando se mencione la acción de un catalizador, se entenderá que es positivo. La mayoría de las reacciones que ocurren en la atmósfera, océanos en nuestro organismo o en los procesos industriales son producidas por catalizadores. Los catalizadores pueden ser inorgánicos y orgánicos. Los de naturaleza inorgánica pueden ser H+, metales, óxidos. Dentro de estos son los que se utiliza dentro de la fabricación de los convertidores catalíticos, que se utilizan para disminuir los índices de contaminación de los motores de combustión interna que produce una gran cantidad de contaminantes como: el monóxido de carbono (CO (g)), restos de hidrocarburos (CXHY (g)) y óxidos de nitrógeno (NOX (g)). Los convertidores catalíticos desempeñan dos funciones: La primera es oxidar el CO y los hidrocarburos no quemados a agua y dióxido de carbono. CO ; CxHy (g) CO2 (g) (g) + H2O (g) Y por otra parte reducir los óxidos de nitrógeno a nitrógeno gaseoso. NOx (g) N2 (g) Estas dos funciones requieren catalizadores distintos, por lo que la fabricación de los convertidores catalíticos requiere tomar en cuenta estos dos procesos. Es por eso es que estos dispositivos generalmente utilizan radio o platino, u oxido de metales de transición y metales nobles. Por los elementos que se utilizan para su fabricación estos sistemas son incompatibles con algunos compuestos antidetonantes que se le agregan a los combustibles para mejorar el rendimiento de los motores. Colegio Lord Cochrane Freddy Guerra U. Cinética Química Equilibrio Químico Los compuestos como el tetraetil de plomo [Pb(C2H5)4], contaminan 3º Año Medio Manual P.S.U el catalizador, es decir, se adhieren a los sitios reactivos y bloquean su actividad, con lo que hace disminuir o desaparecer la acción catalítica. Esto se puede producir por el empleo de gasolina con plomo en automóviles que posee convertidores catalíticos. Los catalizadores de origen orgánico son más complejos y pertenecen al grupo de las enzimas. Estas sustancias son para que una gran cantidad de reacciones químicas que ocurren en los seres vivos se realicen a velocidades adecuadas. Casi todas las enzimas son moléculas grandes de proteínas cuya masa molecular varia desde alrededor de 10.000 hasta 1 millón de μ. Todas ellas son muy específicas en cuanto a reacciones que catalizan y algunas son totalmente específicas, pues funcionan para una sola sustancia en una sola reacción. Por ejemplo la descomposición de peroxido de hidrogeno (H2O2) es un proceso biológico muy importante. Ya que este compuesto es muy oxidante, puede ser fisiológicamente nocivo. Por esto que la enzima catalasa, transforma el H2O2 en agua (H2O) y oxígeno (O2). La mejor manera de interpretar una reacción enzimática es a través del modelo llave cerradura. Con este modelo, el sustrato se ajusta a una perfectamente al sitio activo de la enzima, de manera muy semejante a una llave que abre una cerradura, que se conoce como enzima sustrato. La reacción catalizada la podemos representar de la siguiente forma E + S E–S E + P Además del producto formado la enzima queda libre a fin de proseguir la reacción si es que existiera sustrato disponible para ello. La actividad enzimática puede detenerse si es que alguna sustancia química distinta al sustrato se une al sitio activo bloqueando su entrada. Estas sustancias conocidas como inhibidores de enzimas pueden ser algunos venenos del sistema nervioso y ciertos iones metálicos como el plomo (Pb) y el mercurio (Hg). c) Efecto de la Concentración: Una reacción química se podría representar como una colisión entre los reactantes para llegar a formar una cierta cantidad de producto y de energía. 1x1=1 1x2=2 2x3=6 PROBABILIDAD DE CHOQUES Esquema que muestraza relación entre la cantidad de reactantes y la probabilidad de choques que ocurren La ley de acción de las masas, enunciada por Gulberg y Waage, establece la relación que existe entre la velocidad de reacción y la concentración de los reactantes. La velocidad de reacción es directamente proporcional al producto de las concentraciones de los reactantes elevados a una potencia, cuyo exponente es numéricamente igual al coeficiente estequiométrico nA + m B V α [A]n × [B]m ; jC + kD V = K × [A]n × [B]m Por lo tanto, si aumenta la concentración de los reactantes, aumenta la posibilidad de colisiones, y por ende la velocidad de reacción. Colegio Lord Cochrane Freddy Guerra U. Cinética Química Equilibrio Químico 3º Año Medio Manual P.S.U ORDENES DE REACCIÓN Es importante hacer notar que el efecto de la concentración sobre la rapidez de reacción no es siempre predecible, pues no tiene que ver con la Estequiometría, sino con una determinación experimental. Los resultados obtenidos se pueden representar como la “ecuación de velocidad” o “Ley de velocidad”. Una ley de velocidad es una ecuación que expresa una velocidad instantánea en términos de la concentración de las sustancias que forman parte de la reacción. La expresión de la ley de velocidad se puede expresar como: Velocidad = K [reactantes]n Donde n es el orden de la reacción. Si al duplicar la concentración del reactivo, la rapidez se mantiene, se dice que la reacción es de orden cero. Pues la concentración de los reactantes no influye en la velocidad de reacción. V = K [A]0 V=K Si al duplicar la concentración de los reactantes, se duplica la rapidez, se dice que la reacción es de primer orden: V = K [A] Si al duplicar la concentración de un reactivo, la velocidad se hace cuatro veces mayor, se dice que la reacción es de segundo orden u orden 2: V = K [A] 2 El orden de la reacción no siempre toma valores enteros positivos, pues ser además fraccionarios o negativos. El orden de una reacción u orden global de la reacción es la de la suma de las potencias u ordenes que se eleva cada parte de la reacción. Por ejemplo, en una reacción A + B C + experimentalmente que los órdenes de reacción para A es 1 y para B es 2. D se encontró La expresión de la ley cinética de la reacción queda dada por: V = K [A] × [B]2 Por lo tanto el orden de la reacción es 1+2 = 3 Ejemplo 1 Para la reacción A + B [A] [B] C + D arrojo los siguientes datos experimentales: Rapidez inicial (mol/L s) Exp 1 0, 25 0, 40 1, 5 x 10-3 Exp 2 0, 50 0, 40 6, 0 x 10-3 Exp 3 0, 50 0, 80 2, 4 x 10-3 Con estos valores indique el orden de la reacción Si hacemos los análisis adecuados vemos que al duplicar la [A] la rapidez aumenta cuatro veces, siendo coherente con un segundo orden de reacción con respecto a A En cambio al duplicar la [B] solo se cuadruplica la rapidez, indicando que es una reacción de segundo orden con respecto a B. por lo tanto considerando la ecuación para la rapidez de la reacción: V = k [A]2 [B]2 La reacción es de CUARTO orden. Colegio Lord Cochrane Freddy Guerra U. Cinética Química Equilibrio Químico 3º Año Medio Manual P.S.U EQUILIBRIO QUIMICO Muchas reacciones químicas finalizan cuando las sustancias reaccionantes se agotan. A este tipo de reacción se les conoce como reacciones irreversibles. Sin embargo en la mayoría de los casos los reactantes se convierten en productos y los productos en reactantes. Cuando esto ocurre se dice que la reacción es reversible. La situación anterior se muestra en la siguiente ecuación aA+bBcC+dD Se produce un equilibrio químico cuando los reactantes se forman tan rápidamente como los productos, de modo que la composición de la mezcla permanece constante y no cambia con el tiempo. La expresión matemática que representa el equilibrio. V1 aA+bB cC+dD V2 V1 = K2 [A] [B] ; V2 = K2 [A] B] En el equilibrio químico se cumple que: La velocidad de paso de los reactantes es igual a la velocidad de paso de los productos a reactantes. Por lo tanto si V1=V2, V1 V1=V2 EQUILIBRIO V2 TIEMPO Gráfico que muestra la relación de velocidades en una reacción química Entonces: K1 [A]a[B]b = K2 [C]c[D]d Si ordenamos la ecuación: K1 Cc Dd K 2 A a Bb Keq Cc Dd Aa Bb Cuando se alcanza el equilibrio químico las proporciones entre los reactantes y los productos permanecen constantes. La expresión anterior corresponde a la llamada constante de equilibro, que es una medida cuantitativa del equilibrio química. La constante de equilibrio no depende de las proporciones en las cuales los reactantes se mezclan, ni de la presión. Además los catalizadores no afectan los valores de K. Las concentraciones de los reactantes o productos sólidos insolubles, convencionalmente se omiten de la ecuación de equilibrio por que sus concentraciones no varían. Si K < 1, se favorece el sentido de la reacción hacia la formación de reactantes Si K > 1, se favorece el sentido de la reacción hacia la formación de los productos Si K = 1, no se ve favorecido ninguno de los dos sentidos Colegio Lord Cochrane Freddy Guerra U. Cinética Química Equilibrio Químico Ejemplo: 3º Año Medio Manual P.S.U H2 (G) + I2 (G) 2 HI Keq (G) HI 2 H 2 I2 FACTORES QUE AFECTAN EL EQUILIBRIO QUIMICO Existen algunas condiciones y factores que pueden afectar el equilibrio y el sistema reacciona para eliminar la perturbación, esto se denomina PRINCIPIIO DE LE CHATELIER. a) Efectos de los cambios de temperatura: Cuando la temperatura de un sistema en equilibrio es aumentada el equilibrio se desplaza en la dirección que absorbe el calor. A + B C + D + ENERGIA Si la temperatura de un sistema disminuye el equilibrio se desplaza en la dirección que se libera calor b) Efectos de cambios en la presión: Cuando se aumenta la presión de un sistema en equilibrio, el equilibrio se desplaza en la dirección que se produzca el volumen menor. En el ejemplo siguiente todas las moléculas están en estado gaseoso CO (G) + 2 H2 (G) CH3OH 3 volumenes de gas (G) 1 volumen de gas En este caso al aumentar la presión el equilibrio se desplaza hacia la formación de productos c) Efecto de variación de concentración: En un aumento de cualquier componente de un sistema en equilibrio hará que este se desplace en la dirección que tienda a consumir parte de la sustancia agregada. d) Efecto de los catalizadores: Un catalizador acelera ambas reacciones directas e inversas por igual. El equilibrio se alcanza mas rápidamente, pero no se altera el equilibrio. CONSTANTE DE EQUILIBRIO EN LA FASE GASEOSA Para una reacción en fase gaseosa, la constante de equilibrio esta dada por: aA+bB Keq Entonces: Si PV = nRT y como n P V RT cC+dD p cC p d D p a A pb B n V c d pC p D RT RT Keq a p A pb B RT RT ; siendo Por lo tanto Keq = Kp (1/RT)Δn lo que generalizado da: R = Constante de Rydberg T = Temperatura en K (kelvin) Δn = Diferencia de coeficientes estequiométricos. concentración molar, entonces = Kp (1/RT)Δn Keq = Kp (RT) -Δn



