tutorial proteinas ciencias-2008
Anuncio

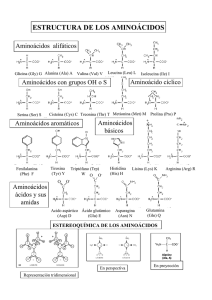
Bioquímica y Biología Molecular Bioquímica Ciencias- 2008 BIOQUIMICA TUTORIAL # 1 AGUA, BIOMOLECULAS Y PROTEÍNAS Jueves 27 de Marzo 2008 BUFFERS & AGUA Problemas 1. Cuál es el pH de una solución que tiene una concentración de protones de (a) 1.5 x 10-5 mol/L; (b) 6.5 x 10-10 mol/L; (c) 1.0 x 10-4 mol/L 2. En un laboratorio del hospital, se tomó una muestra de 10 ml del jugo gástrico de un paciente obtenido varias horas después de una comida. Este fue titulado con 7.2 ml de NaOH 0.1 N, hasta llegar a la neutralidad (pH 7.0). Ya que el estómago del paciente no contenía alimentos o bebidas, se asume que no habían buffers presentes. Cuál fue el pH del jugo gástrico? 3. La concentración de acetilcolina, un neurotransmisor, puede ser determinada a partir de los cambios de pH que ocurren durante su hidrólisis. Cuando se le incuba con pequeñas cantidades de la enzima acetilcolinesterasa, acetilcolina es convertida a colina y ácido acético, el cual se disocia a acetato y un ion hidrógeno de acuerdo a la siguiente reacción: O CH3 H2O CH3 C O CH2 +N CH3 CH3 CH3 OH CH2 CH2 +N CH3 + CH3 C O- + H+ CH3 O Acetilcolina Colina Acetato En un análisis típico, el pH de 15 ml de una solución que contiene una cantidad desconocida de acetil colina, fue de 7.65. Cuando fue incubada con acetilcolinesterasa el valor final del pH fue de 6.87. Asumiendo que no hay buffer en la mezcla de ensayo, determine el número de moles de acetilcolina en los 15 ml de la solución problema. 4. Determinar el peso en gramos que se requieren de: NaH2PO4.H2O; (PM = 138.01) y Na2HPO4 (PM = 141.98) para preparar 1 litro de una solución de buffer fosfato a pH 7.0 en donde la concentración total de fosfato sea 0.1M. El pK’ del fosfato es 6.86 a 25 °C AMINOACIDOS Y ENLACE PEPTIDICO 1. Punto isoeléctrico de aminoácidos, forma zwiteriónica y pK. Cómo se determina el pI de los a.a? a. Utilizando la ecuación de Henderson y Hasselbach, demuestre que en el punto isoeléctrico, un aminoácido como la glicina se encuentra en su forma zwitteriónica b. En qué forma se encuentra el ácido aspártico y la lisina a pH 1, 5, y 10. Cuál es la capacidad tamponante de estos aminoácidos en sistemas biológicos. 2. Calcular la carga neta de los siguientes tripéptidos a pH 4.0, 7,0 y 10.00 a) Asp-Glu-Ser b) Ala-Gly-Thr c) Gly-Lys-Val 3. Ud. tiene un péptido con la siguiente secuencia: Glu – His – Trp – Ser- Gly – Leu – Arg – Pro - Gly Cuál será su carga a pH 3, 8 y 11? 4. Cuál será el peso molecular aproximado de una proteína de 593 aminoácidos 1 Bioquímica y Biología Molecular Bioquímica Ciencias- 2008 PROTEINAS - ESTRUCTURA 1. El cabello crece a una velocidad de 15 a 20 cm por año. Todo este crecimiento está concentrado en la base de la fibra de cabello en donde α-queratina es sintetizada por las células epidermales y es ensamblada en una estructura tipo cuerda. El elemento fundamental de la α-queratina es el αhélice. Conociendo las dimensiones y el número de residuos que hay por vuelta de hélice, calcular el número de enlaces peptídicos que deben sintetizarse para dar cuenta del crecimiento observado por año. 2. Proteínas como la bacteriorodopsina, se encuentran en la membrana plasmática de las células. Estudios de difracción de rayos X has demostrado que la proteína consiste de 7 hélices alfa paralelas, cada una de las cuales atraviesa la membrana de la bacteria (espesor: 45 A). Calcule usted el número mínimo de aminoácidos que son necesarios para que cada segmento de hélice atraviese la membrana totalmente. Estimar la fracción de la proteína que se encuentra atravesando la membrana plasmática, considerando que la proteína pesa 26,000 daltons y que el peso promedio de un aminoácido es 110 3. Un glóbulo rojo tiene un volumen de 1.15 x 10-10 cm3. Una molécula de hemoglobina (considerarla como una esfera) tiene un diámetro de 65 Å. Si la célula estuviera completamente llena de moléculas de hemoglobina, cuántas moléculas podría contener? 4. En la secuencia de aminoácidos que se muestra debajo, dónde se puede predecir que ocurriría una vuelta beta? Dónde podría ocurrir la formación de un puente disulfuro 1 – 2 – 3 – 4 – 5 – 6 – 7 – 8 – 9 – 10 – 11 – 12 – 13 – 14 – 15 – 16 – 17 – 18 Ile – Ala – His – Thr – Tyr – Gly – Pro – Phe – Glu – Ala - Ala – Met – Cys – Lys – Trp – Glu – Ala – Gln – 19 – 20 – 21 – 22 – 23 – 24 – 25 – 26 – 27 – 28 Pro – Asp – Gly - Met – Glu – Cys – Ala – Phe – His – Arg PROTEINAS - ESTUDIO 1. Considerando el péptido de la pregunta anterior, qué fragmentos se producirán si es tratado de manera independiente, con tripsina, bromuro de cianógeno, o quimiotripsina? 2. Cuál es el orden de elución de las proteínas catalasa, α-quimotripsina, concanavalina B, lipasa y mioglobina de una columna de Sephadex G-50? 3. ¿En qué orden eluirán las proteínas fibrinógeno, hemoglobina, lisozima, pepsina y ribonucleasa A de una columna de intercambio iónico de CM-celulosa al aplicar un gradiente salino creciente a pH 7? 4. ¿Cuál sería la posición relativa de las proteínas insulina, citocromo c, histona mioglobina y ribonucleasa A luego de someterse a isoelectroenfoque? Esquematice la apariencia de la migración electroforética en gel bidimensional para citocromo c, mioglobina y ribonucleasa A. 5. ¿Cuál es la masa molecular de una proteína que tiene una movilidad electroforética relativa de 0.5 en un gel de SDS-poliacrilamida como el que se muestra en la figura? 6. Explique por qué la masa molecular del fibrinógeno se sobreestima en grado significativo cuando se la mide usando una columna calibrada de filtración en gel, pero se puede determinar con bastante precisión a partir de su movilidad electroforética en un gel de SDS-poliacrilamida. 7. Utilizando la información que se da a continuación, determine la secuencia de aminoácidos del opiáceo leucina encefalina. Explique cómo la secuencia propuesta es congruente con la información dada. 2 Bioquímica y Biología Molecular Bioquímica Ciencias- 2008 a) La hidrólisis completa con HCl 6 M a 110°C seguida del análisis de la composición de aminoácidos indicó la presencia de Gly, Leu, Phe y Tyr en una proporción molar de 2:1:1:1. b) El tratamiento del péptido con FDNB seguido por hidrólisis completa y cromatografía indicaron la presencia de un derivado de tirosina 2,4 dinitrofenil. No se encontró tirosina libre. c) La digestión completa del péptido con pepsina seguida por cromatografía dio como resultado un dipéptido constituido por Phe y Leu, y un tripéptido constituido por Tyr y Gly en una proporción de 1:2. 8. Un polipéptido se somete a las digestiones siguientes y da como resultado fragmentos polipeptídicos con las secuencias de aminoácidos que se indican. ¿Cuál es la secuencia de aminoácidos del polipéptido completo? I. Tratamiento con bromuro de cianógeno a) Asp-Ile-Lys-Gln-Met b) Lys c) Lys-Phe-Ala-Met d) Tyr-Arg-Gly-Met II. a) b) c) d) Tratamiento con tripsina Gln-Met-Lys Gly-Met-Asp-Ile-Lys Phe-Ala-Met-Lys Tyr-Arg 9. El tratamiento de un polipéptido con DTT da 2 polipéptidos que tienen las siguientes secuencias de aminoácidos: a) Ala-Phe-Cys-Met-Tyr-Cys-Leu-Trp-Cys-Asn b) Val-Cys-Trp-Val-Ile-Phe-Gly-Cys-Lys La hidrólisis catalizada por quimotripsina del polipéptido intacto da fragmentos polipeptídicos con las siguientes composiciones de aminoácidos: c) (Ala, Phe) d) (Asn, 2 Cys, Met, Tyr) e) (Cys, Gly, Lys) f) (2 Cys, Leu, 2 Trp, Val) g) (Ile, Phe, Val) Indique las posiciones de los puentes disulfuro en el polipéptido original. 3 Bioquímica y Biología Molecular Bioquímica Ciencias- 2008 4