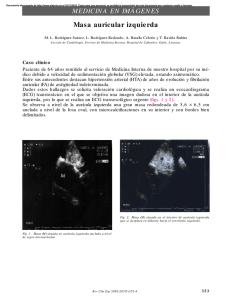
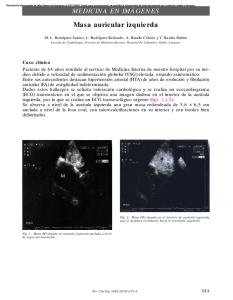
Limitaciones de la ecocardiografía transesofágica en la
Anuncio

(Rev. Esp. Anestesiol. Reanim. 2005; 52: 421-424) CASO CLÍNICO Limitaciones de la ecocardiografía transesofágica en la valoración de masas intracardiacas. A propósito de un caso L. Delange Segura* Servicio de Anestesiología y Reanimación. Sección de Anestesia Cardiovascular. Hospital Regional Universitario Carlos Haya. Málaga. Resumen Paciente varón de 72 años de edad, en tratamiento con warfarina por fibrilación auricular de 20 años de evolución, propuesto para resección de masa (3,5 x 4 cm) no pediculada en aurícula izquierda adherida a la pared posterior de la misma, y pequeña masa (1,5 x 2 cm) en aurícula derecha, diagnosticadas mediante ecocardiografía transtorácica y tomografía computarizada. En quirófano y tras la inducción anestésica se colocó sonda de ecografía transesofágica para realización de control intraoperatorio de ambas masas y resección de las mismas. Se confirmó gran masa en aurícula izquierda, dilatada por fibrilación auricular crónica, adherida a pared posterior, así como una masa de menor tamaño móvil en aurícula derecha, unida mediante un pedículo a la pared libre de la aurícula derecha o válvula tricúspide. Ante estos hallazgos, se plantea el diagnóstico diferencial fundamentalmente entre mixoma/trombo biauricular dadas las características de las masas visualizadas y los antecedentes del paciente. Tras la apertura de ambas aurículas, se confirma la presencia de trombo organizado en aurícula izquierda y gran trabécula hipertrófica en la porción trabeculada de la aurícula derecha responsable de la falsa imagen de masa obtenida en ecografía transesofágica. Palabras clave: Ecografia transesofágica. Mixoma. Trombosis intracardiaca. Introducción La ecocardiografía es el método de elección para el diagnóstico de masas intracardiacas, circunstancia que *Médico Adjunto. Correspondencia: L. Delange Segura Avda. de la Torre, 11 chalet nº 17, Rincón de la Victoria. 29738 Málaga E-mail: [email protected] Aceptado para su publicación en abril de 2005. 47 Limitations of transesophageal ultrasound in the assessment of intracardiac masses: a case report Summary A 72-year-old man who had been treated for 20 years with warfarin for auricular fibrillation was scheduled for resection of a sessile mass (3.5 x 4 cm) on the posterior wall of the left atrium and a smaller mass (1.5 x 2 cm) in the right atrium. The masses were diagnosed by transthoracic ultrasonography and computed tomography. After anesthetic induction, a tube was inserted for transesophageal ultrasound guidance during resection of the masses. During surgery, the presence of a large mass was confirmed on the posterior wall of the left atrium, which was enlarged due to chronic fibrillation. The smaller, mobile, pediculated mass attached to the right free wall of the atrium or to the tricuspid valve was also confirmed. Given these findings and the patient’s history, differential diagnosis with either biatrial myxoma or thrombus was considered. After opening both atria, an organized thrombus in the left atrium and a large hypertrophic trabecula in the trabeculated portion of the right atrium was found to be responsible for the misleading ultrasonographic image suggesting masses. Key words: Ultrasonography, transesophageal. Myxoma. Thrombosis, intracardiac. se ha visto potenciada por la aparición de la ecocardiografía transesofágica (ETE), que en general permite una mejor visualización de las estructuras que la ecografía transtorácica (ETT) tradicional, lo que puede resultar de gran ayuda en el diagnóstico diferencial de masas intracardiacas (tumores benignos y malignos, trombos, variantes de la normalidad, etc.)1. Los tumores cardiacos se clasifican en benignos y malignos, siendo los primeros el grupo más frecuente. En cuanto a los malignos, pueden ser primarios como el angiosarcoma y el rabdomiosarcoma (los más frecuentes entre los malignos) o metastásicos (sarcoma y melanoma en aurícula izquierda (AI) o hipernefroma, hepatocarcinoma o melanoma en aurícula derecha (AD)1,2. 421 Rev. Esp. Anestesiol. Reanim. Vol. 52, Núm. 7, 2005 Dentro de los tumores benignos intracardiacos el más frecuente es el mixoma, que supone aproximadamente el 30% de los mismos. La localización más frecuente del mixoma es la AI, y suele presentar un punto de anclaje generalmente pediculado en el septo interauricular. Se han descrito también en las demás cámaras cardiacas e incluso a nivel de las válvulas aurículo-ventriculares 3,4. En el 5% de los casos el mixoma puede ser múltiple, sobre todo en AI5-7, aunque en el caso de mixomas localizados en ambas aurículas, los casos descritos en la literatura corresponden a tumores localizados en AI y AD unidos entre sí a través de la fosa oval8. En cuanto a los trombos intracardiacos hay que diferenciar entre la AI y la AD. Los trombos que aparecen en la AD suelen ser trombos móviles en tránsito procedentes de territorios inferiores con un elevado riesgo de embolismo pulmonar y suelen tener una apariencia característica en palomita de maíz1, mientras que los trombos en AI suelen asociarse a fibrilación auricular y estenosis mitral y pueden estar unidos a la pared de la AI especialmente a la pared posterior o a la orejuela9. En ambas localizaciones se recomienda la exéresis quirúrgica de los mismos, dado el alto riesgo de embolismo pulmonar o sistémico. Además el diagnóstico diferencial entre tumores y trombosis intracardiacas es fundamental, ya que incluso en el caso de los tumores benignos como el mixoma se recomienda su extirpación quirúrgica ya que son potencialmente peligrosos por la posibilidad de aparición de arritmias, fenómenos embólicos, insuficiencia cardiaca, etc3. Sin embargo, cuando nos planteamos el diagnóstico diferencial de una masa intracardiaca, hay que tener en consideración otras estructuras además de trombos o tumores intracardiacos. Así, diversas estructuras cardiacas o extracardiacas se pueden interpretar de forma errónea como masas intracardiacas, entre las que se han descrito entre otras la hernia de hiato, la hipertrofia lipomatosa del septo interauricular, la calcificación del anillo mitral, tumores mediastínicos o hematomas1. Esta circunstancia debe ser tenida en cuenta y constituye el objetivo fundamental de la remisión para su publicación del siguiente caso clínico, donde una gran trabécula hipertrófica en AD fue malinterpretada por ETE como una falsa masa intracardiaca. Caso clínico Paciente varón de 72 años de edad con antecedentes personales de prostatismo, bronquitis crónica, hipertensión arterial y enfermedad reumática de larga evolución en tratamiento crónico con enalapril, digoxina y warfarina desde 422 hace 20 años por fibrilación auricular crónica. En el ETT presentaba estenosis mitral moderada, con un área de 1,2 cm2, así como engrosamiento de ambas valvas y el aparato subvalvular. La AI estaba dilatada y se observaba una gran masa en la misma de aproximadamente 4 cm de diámetro mayor. Así mismo, se apreciaba otra masa de menor tamaño en la AD, móvil y de características similares a la anterior, por lo que se planteó el diagnóstico diferencial entre trombosis y mixoma biauricular. Para la mejor definición de las masas se realizó también tomografía computarizada (TC) con contraste que confirmó la presencia de una masa de 3,5x4 cm de diámetro adherida a la pared posterior de la AI, aunque en la misma no se evidenció la presencia de masa en la AD. La coronariografía reveló ateroesclerosis coronaria difusa sin lesiones significativas y fracción de eyección conservada (65%). El paciente fue propuesto para recambio valvular mitral y exéresis quirúrgica de ambas masas dado el alto riesgo de complicaciones asociadas con las mismas. Tras la inducción anestésica, se colocó sonda para ETE multiplano con un ecógrafo Hewlett Packard Sonos 1000. En la exploración con ETE se apreció en la imagen de cuatro cámaras a 0º una masa en AI de unos 4 cm de diámetro mayor no móvil adherida a la pared posterior de la AI, la cual estaba dilatada y con importante ecocontraste espontáneo (característico de la fibrilación auricular). Además se evidenció una masa de menor tamaño móvil de aproximadamente 1,5 cm en AD situada en relación con la parte baja de la pared libre de la misma. La válvula mitral presentaba características reumáticas con apertura reducida (área de 1,2 cm2), engrosamiento de ambos velos valvulares y el aparato subvalvular y discreta calcificación (Figura 1). Sin embargo, cuando se procedió a explorar con más detenimiento la masa en AD, observamos también a 0º pero realizando pequeñas rotaciones laterales con la sonda de ETE, cómo esta masa móvil parecía estar unida mediante un pedículo a la pared libre de la AD o a la válvula tricúspide, ascendiendo y descendiendo dentro de la misma, por lo que se propuso como primer diagnóstico intraoperatorio probable para esta masa el de mixoma de AD pediculado en situación atípica (Figura 2). Con estos diagnósticos de presunción se inició la circulación extracorpórea (CEC), procediéndose tras el comienzo de la misma, en primer lugar a la apertura de la AI, confirmándose la presencia de una gran masa adherida a la pared posterior de la misma, dura y no friable, lo que apuntaba en primer lugar al diagnóstico de trombo intracavitario organizado, confirmado posteriormente por el análisis anatomopatológico. Así mismo se colocó prótesis metálica de 27 mm en posición mitral dada la imposibilidad de reparación de la válvula nativa. Posteriormente, se procedió a la apertura de la AD, sin que se observara masa alguna en la misma. En cambio sí se constató la presencia de una gran trabécula hipertrófica formando parte de la porción trabeculada de la cara lateral de la AD que la recorría desde su parte superior a la parte inferior como una variante de la normalidad, y que era la responsable de la imagen observada mediante ETE (Figura 3). 48 L. DELANGE SEGURA– Limitaciones de la ecocardiografía transesofágica en la valoración de masas intracardiacas. A propósito de un caso Fig. 1. Vista de cuatro cámaras a 0º. AI: aurícula izquierda; Tr: trombo; VM: válvula mitral; VI: ventrículo izquierdo; T: trabécula; AD: aurícula derecha. Tras la extirpación de la misma y el cierre de ambas cavidades se procedió a la desconexión de la CEC sin mayores incidentes, realizándose control ecocardiográfico postoperatorio que demostró la extirpación completa del trombo en AI y el correcto funcionamiento de la prótesis valvular. El paciente pasó a UCI, pasando a planta de hospitalización a los 3 días y siendo dado de alta a domicilio a los 8 días. Discusión La ecocardiografía es el método de elección para la Fig. 2. Vista de cuatro cámaras a 0º con ligera rotación de la sonda de ETE. AI: aurícula izquierda; Tr: trombo; VM: válvula mitral; VI: ventrículo izquierdo; T: trabécula; AD: aurícula derecha; VT: válvula tricúspide; VD: ventrículo derecho. Flecha negra: ecocontraste espontánea por FA crónica. Flecha blanca: falsa masa pediculada en contacto con pared libre de AD o VT. 49 Fig. 3. Aurícula derecha (AD) abierta con gran trabécula hipertrófica (T). detección, seguimiento y diagnóstico diferencial de masas intracardiacas. Además la introducción de la ETE ha supuesto una mejora sustancial en la detección de estas estructuras aumentando enormemente la sensibilidad y especificidad de la misma frente a la ETT tradicional, como lo demuestran multitud de estudios, que sitúan la sensibilidad de la ETE para el diagnóstico de trombos en AI y AD en un 100% frente a un 69% para la ETT. Los trombos no detectables por la ETT y sí por la ETE se situaban según estos estudios a nivel de la orejuela y la pared posterior de la AI, que corresponden a los territorios peor visualizados mediante la ETT9,10. Además, la ETE no sólo se ha mostrado superior en el diagnóstico de masas intracardiacas (sobre todo trombos) en relación con la ETT sino también frente a la tomografía axial y a la resonancia magnética, en el caso de trombos pequeños o situados en la orejuela de la AI, donde estas herramientas son menos útiles para el diagnóstico, y donde la ETE tiene una sensibilidad que se acerca al 100% dependiendo de los diferentes estudios9,10. Sin embargo, si bien es cierto que la ETE presenta una alta sensibilidad para la detección de masas intracardiacas, no siempre es capaz de hacer un diagnóstico diferencial entre las mismas. Así los trombos organizados con un tiempo de evolución prolongado, como era el caso del paciente que nos ocupa, pueden presentar áreas de calcificación con zonas de distinta ecogenicidad muy similares al patrón característico del mixoma, lo que puede dar lugar a confusiones en el diagnóstico diferencial. Sin embargo, sí existe una serie de características que nos pueden ayudar a diferenciar ambas entidades. Así el mixoma aparece sobre todo en la AI unido al tabique interauricular, y suele ser una masa móvil, en ocasiones pediculada que pue423 Rev. Esp. Anestesiol. Reanim. Vol. 52, Núm. 7, 2005 de incluso introducirse parcialmente en el VI a través de la válvula mitral, produciendo a veces síntomas de restricción en el llenado del VI. Por otro lado, los trombos aparecen sobre todo en la orejuela de la AI o bien adheridos a la pared posterior de la misma, en el seno de una AI dilatada, en la mayoría de las ocasiones con una fibrilación auricular de larga evolución o una estenosis mitral11-14. Al tratar las limitaciones de la ETE en la valoración de masas intracardiacas hay que tener en cuenta también la interpretación errónea de las imágenes obtenidas como falsas masas intracardiacas, situación que ha aumentado ostensiblemente desde la introducción de la ETE, ya que ésta proporciona una visualización más completa de las estructuras cardicas. Estas falsas imágenes pueden corresponder a estructuras tanto extra como intracardiacas, dentro de las cuales se podrían englobar las variantes de la normalidad, como sucede en el presente caso clínico. Entre las estructuras normales que frecuentemente se pueden interpretar de forma errónea como masas intracardiacas se han descrito sobre todo las hernias de hiato, una gran válvula de Eustaquio, la hipertrofia lipomatosa del septo interauricular, un anillo valvular tricúspide graso o la calcificación del anillo de la válvula mitral1. En el caso que nos ocupa, la presencia de una gran trabécula hipertrófica formando parte de la porción trabeculada de la pared libre de la AD como una variante de la normalidad fue erróneamente diagnosticada por ETT preoperatorio como una masa patológica, planteándose el diagnóstico diferencial entre trombosis/mixoma en AD, aunque decantándose más por el primero dados los antecedentes del paciente. En este caso, tampoco la ETE fue concluyente para realizar el diagnóstico diferencial entre ambas, sino que muy al contrario nos orientó hacia el otro diagnóstico posible, mixoma de AD con implantación pediculada atípica en pared libre auricular o más posiblemente en la válvula tricúspide. Tal vez, la ausencia en AD de una imagen de masa en el TAC con contraste nos debería haber alertado sobre la posibilidad de que se tratara de una falsa imagen ecocardiográfica pseudotumoral o trombótica. En cuanto a las implicaciones de la interpretación errónea de las imágenes obtenidas mediante ETT o ETE hay que señalar fundamentalmente las consecuencias derivadas para el paciente, que pueden llegar incluso a la realización de intervenciones quirúrgicas 424 innecesarias. En nuestro caso, la detección de una única masa aislada móvil en AD, independientemente de que se tratara de trombo o mixoma de AD, hubiera supuesto la realización de una intervención quirúrgica para la exéresis de la misma, dada la alta incidencia de complicaciones asociadas con las mismas. Si bien estas situaciones son difícilmente evitables, debemos intentar minimizarlas mediante el estudio exhaustivo tanto pre como intraoperatorio, sobre todo en el caso de aquellas masas sospechosas por lo poco habitual de su localización o la aparente discrepancia en cuanto a los síntomas asociados o los antecedentes previos del paciente. BIBLIOGRAFÍA 1. Oh JK, Seward JB, Tajik AJ. Tumores y masas cardiacas. En:, Marbán SL editores. Eco-manual. 2ª ed. en español. Filadelfia: Lippincott Williams & Wilkins; 2004. p. 205-214. 2. Tazelaar HD, Locke TJ, McGregor CGA. Pathology of surgically excised primary cardiac tumors. Mayo Clin Proc 1992;67(10):957-965. 3. Reynen K. Cardiac myxomas. N Engl J Med 1995;333(24):1610-1617. 4. Leibowitz G, Keller NM, Daniel WG, Freedberg RS, Tunick PA, Stottmeister C et al. Transesophageal versus transthoracic echocardiography in the evaluation of right atrial tumors. Heart J 1995;130(6):1224-1227. 5. O’Keefe PA, Jin XY, Jenkins M, Amadi AA, Bennett JG. Unidentified retained left atrial myxoma: intraoperative detection by transesophageal echocardiography. Eur J Cardiothorac Surg 1995;9(10):599-601. 6. Teoh KH, Mulji A, Tomlinson CW, Lobo FV. Right atrial myxoma originating from the Eustachian valve. Can J Cardiol 1993;9(5):441-443. 7. Kulshrestha P, Rousou JA, Tighe DA. Mitral valve myxoma: a case report and brief review of the literature. J Heart Valve Dis 1995; 4(2):196-198. 8. Peachell JL, Mullen JC, Bentley MJ, Taylor DA. Biatrial myxoma: a rare cardiac tumor. Ann Thorac Surg 1998;65(6):1768-1769. 9. Lin SL, Hsu TL, Liou JY, Chen CH, Chang MS, Chiang HT et al. Usefulness of transesophageal echocardiography for the detection of left atrial thrombi in patients with rheumatic heart disease. Echocardiography 1992;9(2):161-168. 10. Toyoda K, Yasaka M, Nagata S, Yamashita N, Imakita S, Yamaguchi S. Transesophageal echocardiography for detecting intracardiac thrombi in embolic stroke. Angiology 1993;44(5):376-383. 11. Granel B, Garcia E, Serratrice J, Christides C, Swiader L, Pache X et al. Asymptomatic intracardiac thrombi and primary antiphospholipid syndrome. Cardiology 1999;92(1):65-67. 12. Gertner E, Leatherman JW. Intracardiac mural thrombus mimicking atrial myxoma in the antiphospholipid syndrome. J Rheumatol 1992; 19(8):1293-1298. 13. Mahdhaoui A, Bouraoui H, Amine MM, Mokni M, Besma T, Hajri S et al. The transesophageal echocardiography diagnosis of left atrial myxoma simulating a left atrial thrombus in the setting of mitral stenosis. Echocardiography 2004;21(4):333-336. 14. Ouattara A, Boccara G, Chiche L, Coriat P. Intraoperative diagnosis of an unsuspected left atrial myxoma by transesophageal echocardiography. Anesth Analg 2002;94(6):1458-1459. 50