UNIDAD 2 1- Desarrolla el diagrama de orbitales moleculares para
Anuncio
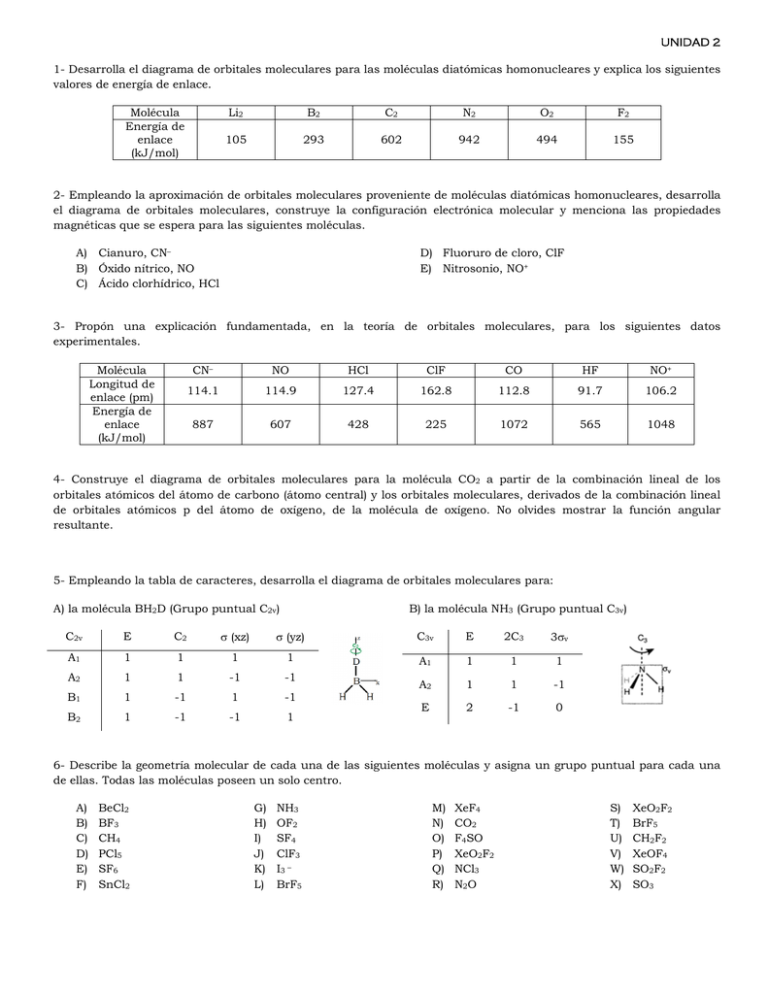
UNIDAD 2 1- Desarrolla el diagrama de orbitales moleculares para las moléculas diatómicas homonucleares y explica los siguientes valores de energía de enlace. Molécula Energía de enlace (kJ/mol) Li2 B2 C2 N2 O2 F2 105 293 602 942 494 155 2- Empleando la aproximación de orbitales moleculares proveniente de moléculas diatómicas homonucleares, desarrolla el diagrama de orbitales moleculares, construye la configuración electrónica molecular y menciona las propiedades magnéticas que se espera para las siguientes moléculas. A) Cianuro, CN– B) Óxido nítrico, NO C) Ácido clorhídrico, HCl D) Fluoruro de cloro, ClF E) Nitrosonio, NO+ 3- Propón una explicación fundamentada, en la teoría de orbitales moleculares, para los siguientes datos experimentales. Molécula Longitud de enlace (pm) Energía de enlace (kJ/mol) CN– NO HCl ClF CO HF NO+ 114.1 114.9 127.4 162.8 112.8 91.7 106.2 887 607 428 225 1072 565 1048 4- Construye el diagrama de orbitales moleculares para la molécula CO2 a partir de la combinación lineal de los orbitales atómicos del átomo de carbono (átomo central) y los orbitales moleculares, derivados de la combinación lineal de orbitales atómicos p del átomo de oxígeno, de la molécula de oxígeno. No olvides mostrar la función angular resultante. 5- Empleando la tabla de caracteres, desarrolla el diagrama de orbitales moleculares para: A) la molécula BH2D (Grupo puntual C2v) B) la molécula NH3 (Grupo puntual C3v) C2v E C2 (xz) (yz) C3v E 2C3 3v A1 1 1 1 1 A1 1 1 1 A2 1 1 -1 -1 A2 1 1 -1 B1 1 -1 1 -1 B2 1 -1 -1 1 E 2 -1 0 6- Describe la geometría molecular de cada una de las siguientes moléculas y asigna un grupo puntual para cada una de ellas. Todas las moléculas poseen un solo centro. A) B) C) D) E) F) BeCl2 BF3 CH4 PCl5 SF6 SnCl2 G) H) I) J) K) L) NH3 OF2 SF4 ClF3 I3 – BrF5 M) N) O) P) Q) R) XeF4 CO2 F4SO XeO2F2 NCl3 N2O S) T) U) V) W) X) XeO2F2 BrF5 CH2F2 XeOF4 SO2F2 SO3 7- Explica, utilizando la regla de Bent, el comportamiento del ángulo de enlace para las moléculas de fósforo, PX3. Molécula Ángulo de enlace (grados) PF3 PCl3 PBr3 PI3 97.8 100.3 101.5 102.0 8- Explica, utilizando la regla de Bent, el comportamiento en el ángulo de enlace de las moléculas. Molécula Ángulo de enlace (grados) NF3 PF3 AsF3 102.3 97.8 96.1 9- Utilizando los radios iónicos mostrados en la tabla, deduce qué tipo de red cristalina tendrán los siguientes compuestos iónicos. A) SrSe B) CsF C) SrBr2 D) ZnBr2 E) KI F) ZnSe G) MgSe H) SrI2 I) MgF2 Sr2+ (1.14 Ǻ) Cs+ (1.81 Ǻ) Mg2+ (0.80 Ǻ) Zn2+ (0.74 Ǻ) K+ (1.52 Ǻ) Se2– (1.86 Ǻ) F– (1.15 Ǻ) S2– (1.70 Ǻ) Br– (1.82 Ǻ) I– (2.06 Ǻ) 10- Clasifica los siguientes sólidos en iónico, covalente, metálico o molecular. A) B) C) D) E) F) P4 C (diamante) KBr TiCl4 I2 K G) H) I) J) K) L) IBr N2 H2O CO2 CaCO3 H6Si2O7 M) N) O) P) Q) R) H3P3O9 P4O10 C6H6 WC ICl SF6