tesis
Anuncio

INSTITUTO POLITECNICO NACIONAL
Escuela Superior de Ingeniería Química e Industrias Extractivas.
Posgrado en Metalurgia y Materiales
“ESTUDIO TERMODINÁMICO DE LIXIVIACIÓN DE UN
CONCENTRADO DE GALENA A ELEVADA PRESIÓN Y
TEMEPERATURA CON ÁCIDO NÍTRICO”
T
E
S
I
S
QUE
PARA OBTENER
EL
GRADO DE:
MAESTRO EN CIENCIAS CON ESPECIALIDAD EN
EN INGENIERIA METALURGICA Y MATERIALES
P
R
E
S
E
N
T
A :
Ing.
ROBERTO
ZÁRATE
GUTIÉRREZ
DIRECTOR DE TESIS:Dr. FRANCISCO JAVIER JUÁREZ ISLAS
CO-DIRECTOR DE TESIS:Dr. RODOLFO MORALES DAVILA
MÉXICO D.F.
FEBRERO 2007
I
RESUMEN
La mayoría de la producción mundial de plomo se origina del tratamiento en
el horno de soplo y sinterización de concentrado de Galena. El polvo rico en
plomo y emisiones de gases emanados de las plantas
persistente, y la dilución de gases de SO2
es un problema
del sinter son problemas de gran
dificultad y los procesos anticontaminantes son costosos. Hay algunas razones
para que el cambio de tecnología sea necesario. La primera es el crecimiento de
las restricciones sobre la descarga de los desechos gaseosos, sólidos y líquidos
de las plantas metalúrgicas. La segunda es necesario el uso de menas las cuales
no pueden ser tratadas por los procesos usados convencionalmente en el
presente. Por lo anterior se pretende obtener una vía alterna basado en las
soluciones de [HNO3, Ca(NO3)2] para la obtención del plomo metálico, así como
sus diferentes compuestos purificados de plomo como PbSO4 y PbO2.
La experimentación se efectuó en un reactor a presión (AUTOCLAVE) de 2
L de capacidad. Las variables de estudio son la temperatura (373.15 – 413.15 K),
velocidad de agitación (300 – 700 rpm), adición de agentes catalizadores, presión
de O2 (10 – 20 atm), concentración de ácido nítrico ([0.18M]-[2M]) y tiempo (4
horas).
Se estudio la parte Termodinámica construyendo los diagramas
estabilidad para los sistemas Pb(II)-HNO3, Ag(I)-HNO3. Por otro lado para la
lixiviación de galena y argentita con ácido nítrico, se parte de los diagramas E-pH
de los sistemas N-H2O, S-H2O, Pb-H2O, Pb-N-H2O, Pb-S-H2O y de ahí se partió
para construir los sistemas Pb-N-S-H2O y Ag-N-S-H2O. Las reacciones propuestas
para la lixiviación de Galena y Argentita con HNO3 son:
2PbS(S)+2NO3-+4H++O2(g) Æ Pb2++S(S)+PbSO4(S)+2NO(g)+2H2O(l)
ΔG413.15=-737.824 kJ mol-1
2Ag2S(S)+2NO3-+4H++5O2(g)+4eÆ2AgSO4-+Ag2SO4(S)+2NO(g)+2H2O(l)
ΔG413.15= -1,890.230 kJ mol-1
II
ABSTRACT
The majority of the world´s lead production originates from the sinter plantblast furnace treatment of Galena concentrate. The rich powder in lead and
emission of gases emanate from the plants is a persistent problem, and the gas
dilution of SO2 of the sinter they are problems of great difficulty and the processes
antipollutants are costly. There are some reasons in order that the change of
technology is necessary. The first one is the growth of the restrictions on the
unloading of the gaseous, solid and liquid tailing of the metallurgical plants. The
second one is necessary the use of ores which cannot be treated by the processes
used conventional in the present. For the previous thing one tries to obtain an
alternate route based on the solutions of [HNO3, Ca(NO3)2] for the obtaining of the
metallic lead, as well as it´s different compounds purified of lead as PbSO4 and
PbO2.
The experimentation was carried out in a reactor to (AUTOCLAVE) pressure
of 2 L of capacity. The variables of study were the temperature (373.15 - 413.15
K), agitation speed (300 - 700 rpm), agents' addition catalysts, pressure of O2 (10 20 atm), concentration of nitric acidic ([0.18M] - [2M]) and time (4 hours). It´s were
study the Thermodynamic part constructing the graphs stability for the systems
Pb(II)-HNO3, Ag(I)-HNO3. On the other hand for the leaching of Galena and
Argentita with nitric acidic, it were part of the graphs E-pH of the systems N-H2O,
S-H2O, Pb-H2O, Pb-N-H2O, Pb-S-H2O and of there it were to construct the systems
Pb-N-S-H2O and Ag-N-S-H2O. The reactions proposed for the leaching of Galena
and Argentita with HNO3 are:
2PbS(S)+2NO3-+4H++O2(g) Æ Pb2++S(S)+PbSO4(S)+2NO(g)+2H2O(l)
ΔG413.15=-737.824 kJ mol-1
2Ag2S(S)+2NO3-+4H++5O2(g)+4eÆ2AgSO4-+Ag2SO4(S)+2NO(g)+2H2O(l)
ΔG413.15= -1,890.230 kJ mol-1
III
INDICE
Pagina
RESUMEN
ABSTRACT
INDICE
LISTA DE TABLAS
LISTA DE FIGURAS
LISTA DE GRAFICAS
LISTA DE DIAGRAMAS
NOMECLATURA
I.
INTRODUCCIÓN
1.1
El plomo y sus aplicaciones.
1.2
Objetivos.
1.3
Justificación.
II.
ANTECEDENTES
2.1
I
II
III
IV
V
VI
VII
VIII
1
1
4
4
5
Proceso convencional para la obtención de plomo
a partir de galena
6
2.1.1 Diagrama de flujo del proceso convencional para la
obtención de plomo a partir de galena
6
2.1.2 Tostación de concentrados de plomo
6
2.1.3 Fusión de concentrados de plomo en horno de cuba
8
2.1.4 Productos del horno de cuba de plomo
9
2.1.5 Ablandamiento del bullión base
11
2.1.6 Desplatado del bullión base
11
2.2
Proceso Parkes para la obtención de plata de menas
de plomo
13
2.2.1 Cincado
13
2.2.2 Afino
14
2.2.3 Destilación
15
2.2.4 Copelación
15
2.2.5 Afino continuo del plomo
17
2.3
17
Proceso Jarosita
2.3.1 Desarrollo de los procesos de tratamiento de
residuos hidrometalúrgicos
20
2.3.2 Ventajas y desventajas del Proceso Jarosita
22
III.
HIDROMETALURGIA DEL PLOMO
24
3.1
Mineralogia
24
3.2
Hidrometalurgia del plomo con ácido clorhídrico y
III
INDICE
cloruro ferrico
27
3.3
Hidrometalurgia del plomo con nitratos
30
IV.
ESTUDIO TERMODINÁMICO
35
4.1
Construcción de diagramas de distribución de especies
35
4.2
Datos termodinámicos
37
4.3
Distribución de especies durante la lixiviación
39
4.4
Construcción de los diagramas pourbaix (E-pH) del
sistema Pb-N-S-H2O a diferentes temperaturas
4.4.1 Actividad de los iones hidrógeno
4.5
46
Estudió termodinámico de lixiviación de galena con
acido nítrico
4.6
44
51
Estudio Termodinámico de Lixiviación ácida con HNO3
a elevada presión y temperatura.
52
V.
DESARROLLO EXPERIMENTAL
60
5.1
Materiales y reactivos
60
5.1.1 Concentrado de plomo
60
5.1.2 Reactivos
60
5.2
Secuencia de la experimentación
61
5.3
Diagrama del proceso
62
5.4
Equipo
63
5.5
Establecimiento de las condiciones de experimentación
65
5.6
Metodología para la caracterización de las muestras
67
5.6.1 Espectrofotometría de absorción atómica
67
5.6.2 Difracción de rayos X
67
5.6.2 Microscopio Electrónico de Barrido (MEB)
68
VI.
RESULTADOS Y ANALISIS
69
6.1
Caracterización mineralogica
69
6.1.1 Análisis químico
69
6.1.2 Análisis granulométrico
70
6.2
Difracción de rayos X
71
6.3
Reconstrucción mineralógica
72
6.4
Pruebas de lixiviación
72
III
INDICE
6.5
Diseño factorial
73
6.5.1
Efecto del agente surfactante
74
6.5.2 Efecto de la concentración de ácido nítrico
76
6.5.3 Efecto de la temperatura
85
6.5.4 Efecto de la velocidad de agitación
87
6.5.5 Efecto del nitrato de calcio
90
CONCLUSIONES
93
BIBLIOGRAFÍA
95
APÉNDICE I
100
APÉNDICE II
112
APÉNDICE III
117
IV
LISTA DE TABLAS
PAGINA
Tabla 1.
Composición promedio de minerales Pb – Zn.
26
Tabla 2.
Composición típica de concentrados por flotación.
27
Tabla 3.
Energía libre estándar de Gibbs de formación de especies
en los sistemas Ag(I)-HNO3, Fe(III)-HNO3, Pb(II)-HNO3,
N(V)-HNO3, N(III)-HNO3 y S(V)-HNO3 a 298.15, 373.15 y
413.15 K y 1 atm.
Tabla 4.
37
Constantes de disociación para los sistemas Ag(I)-HNO3,
Fe(III)-HNO3, Pb(II)-HNO3, Cu(II)-HNO3 y Zn(II)-HNO3
a 298.15, 373.15 y 413.15 K y 1 atm.
Tabla 5.
Energía libre estándar de Gibbs de formación de especies
en el sistema Pb – N – S – H2O, a 413.15 K y 10 atm.
Tabla 6.
38
47
Líneas de equilibrio sistema Pb–N–S–H2O a 413.15 K y
10 atm.
49
Tabla 7.
Reactivos usados.
60
Tabla 8.
Equipos a usar.
64
Tabla 9.
Condiciones experimentales de los ocho
primeros experimentos.
66
Tabla 10.
Análisis químico del concentrado.
70
Tabla 11.
Análisis granulométrico del concentrado.
70
Tabla 12.
Análisis mineralógico del concentrado.
72
Tabla 13.
Condiciones de operación para observar el efecto de la
concentración de HNO3.
Tabla 14.
76
Valores de Energía libre de las especies presentes en los
sistemas S-H2O, N-H2O, Pb-H2O, Pb-N-H2O, Pb-S-H2O y
Pb-N-S-H2O a 413.15 K.
Tabla 15.
100
Valores de Energía libre de las especies presentes en los
sistemas Ag-H2O, Ag-N-H2O, Ag-S-H2O y Ag-N-S-H2O a
413.15 K.
Tabla 16.
104
Valores de Energía libre de las especies presentes
en los sistemas Ca-N-H2O y Ca-S-H2O a 413.15 K.
108
IV
LISTA DE TABLAS
Tabla 17.
Efecto de la velocidad sobre la disolución.
112
Tabla 18.
Efecto del agente surfactante sobre la disolución.
113
Tabla 19.
Efecto de la concentración de HNO3 a 373.15 K sobre
la disolución.
Tabla 20.
Efecto de la concentración de HNO3 a 413.15 K sobre
la disolución.
Tabla 21.
114
115
Efecto de la concentración del ión calcio a 413.15 K sobre
la disolución.
116
Tabla 22.
Equilibrio en el sistema Pb-H2O a 413.15 K y 10 atm.
117
Tabla 23.
Equilibrio en el sistema Ag-H2O a 413.15 K y 10 atm.
118
Tabla 24.
Equilibrio en el sistema Ag-S-H2O a 413.15 K y 10 atm.
118
Tabla 25.
Equilibrio en el sistema Pb-N-H2O a 413.15 K y 10 atm.
119
Tabla 26.
Equilibrio en el sistema Ag-N-H2O a 413.15 K y 10 atm.
121
Tabla 27.
Equilibrio en el sistema Pb-S-H2O a 413.15 K y 10 atm.
122
Tabla 28.
Equilibrio en el sistema Pb-N-S-H2O a 413.15 K y 10 atm.
123
Tabla 29.
Equilibrio en el sistema Ag-N-S-H2O a 413.15 K y 10 atm.
125
V
LISTA DE FIGURAS
PAGINA
Figura 1.
Figura 2.
Figura 14.
Figura 15.
Diagrama de flujo de una refinería de plomo.
Esquema para la obtención de plomo refinado y sus
impurezas.
Rueda de moldeo.
Horno de Destilación.
Horno de Copelación.
Cantidad de elemento precipitado por el efecto de la
temperatura para formarse como jarositas.
Región de estabilidad de la jarosita como una función
del pH y temperatura a partir de una solución de
0.5 M de Fe2(SO4)3.
Sistema Fe2(SO4)3-H2SO4-H2O con isotermas 110°C
y 200°C obtenido bibliográficamente.
Microfotografias de minerales obtenidos durante la
flotación de Zinc en una planta de Beneficio.
Microfotografias de minerales obtenidos durante la
flotación de Plomo-Cobre en una planta de Beneficio.
Diagrama simplificado de la producción de metales
desde minerales o concentrados por vía hidrometalúrgica.
Diagrama de flujo simplificado para el procesamiento
de plomo basado en la lixiviación con ácido nítrico.
Esta lixiviación opera a temperatura ambiente y en
tanques sin presión.
Diagrama principal en hidrometalurgia par el
procesamiento de concentrados de PbS.
Diagrama del proceso.
Reactor experimental de 2 L de capacidad (autoclave).
Figura 16.
Difractograma de la muestra inicial.
Figura 17.
Difractograma del Experimento con las sig.
Condiciones: 1.0 M HNO3, 5 ml. de Quebracho,
965 kPa, 500 rpm y 413.15 K.
Microfotografia del concentrado de plomo oxidado con
HNO3 y O2. (Condiciones: 1.0 M HNO3, 5 ml. de
Quebracho, 965 kPa, 500 rpm y 413.15 K).
Análisis químico del concentrado de plomo oxidado
con HNO3 y O2. Microscopio Electrónico de Barrido
con una micro prueba de EDS. (Condiciones: 1.0 M
HNO3, 5 ml. de Quebracho, 965 kPa, 500 rpm y 413.15 K).
Difractograma del Experimento con las sig.
Condiciones: 1.0 M HNO3, 5 ml. de Quebracho, 965 kPa,
500 rpm y 413.15 K.
Figura 3.
Figura 4.
Figura 5.
Figura 6.
Figura 7.
Figura 8.
Figura 9.
Figura 10.
Figura 11.
Figura 12.
Figura 13.
Figura 18.
Figura 19.
Figura 20.
7
12
14
15
16
18
21
22
25
26
28
32
34
62
64
71
81
82
82
92
VII
LISTA DE DIAGRAMAS
PAGINA
Diagrama 1. Distribución relativa de especies iónicas para el
sistema N(V)-HNO3 y N(III)-HNO3 a 413.15 K.
Diagrama 2.Distribución relativa de especies iónicas para el
sistema S(VI)-H2SO4 a 413.15 K.
Diagrama 3. Distribución relativa de especies iónicas para el
sistema Pb(II)-HNO3 a 413.15 K.
Diagrama 4. Distribución relativa de especies iónicas para el
sistema Ag(I)-HNO3 a 413.15 K.
Diagrama 5. Distribución relativa de especies iónicas para el
sistema Fe(III)-HNO3 a 413.15.15 K.
Diagrama 6. Distribución relativa de especies iónicas para el
sistema Ag(I)-SO4 a 413.15.15 K.
Diagrama 7. Distribución relativa de especies iónicas para el
sistema Ca(II)-SO4 a 413.15.15 K.
Diagrama 8. Distribución relativa de especies iónicas para el
sistema Fe(III)-SO4 a 413.15.15 K.
Diagrama 9. Distribución relativa de especies iónicas para el
sistema Pb(II)-SO4 a 413.15.15 K.
Diagrama 10.Diagramas de equilibrio para los sistemas
Pb-N-S-H2O y Ag-N-S-H2O a 413.15 K.
Actividad de [Pb]=0.21, [Ag]=1x10-4, [N]=1.0,
pO2=10 atm y [S]=0.21.
Diagrama 11.Diagramas de equilibrio y de especies para los
sistemas S-H2O y S(VI)-H2O a 413.15 K. Actividad
de pO2=10 atm y [S]=0.21.
Diagrama 12.Diagramas de especies para los sistemas
Pb(II)-SO4 y Ag(I)-SO4 a 413.15 K.
Diagrama 13.Diagrama de equilibrio para el sistema Ca-N-H2O
a 413.15 K. Actividad de [Ca]=0.5,
[N]=1.0 y pO2=10 atm.
Diagrama 14.Diagramas de equilibrio y de especies para los
sistemas Ca-S-H2O y Ca(II)-SO4 a 413.15 K.
Actividad de [Ca]=0.5, [S]=0.21 y pO2=10 atm.
Diagrama 15.Diagramas de equilibrio y de especies para los
sistemas N-H2O y N(V)-H2O a 413.15 K.
Actividad de [N]=1.0 y pO2=10 atm.
40
40
41
41
42
42
43
43
44
52
54
55
56
57
59
VIII
NOMECLATURA
a
A
atm
b
B
°C
cm
e
E
E°
F
g
∆G°
∆Gf°
H+
I
{i}
K
kg
Kn
kPa
ln
log
m
m
M
“M”
n
nm
pH
pNO3
ppm
R
rpm
T
μm
%
Coeficiente estequiometrico de A
Reactivos
Atmosferas
Coefciente estequiometrico de B
Productos
Grado Centrigado
Centimetro
Electrón
Voltaje
Potencial electroquimico de equilibrio estandar
Constante de Faraday
Gramo
Energía libre estandar
Energía libre de formación ( J mol-1)
Iones Hidrogeno
Esfuerzo ionico
Actividad trmidinamica de i
Grado Kelvin
Kilogramo
Constante de equilibrio
Kilopascales
Logaritmo natural
Logaritmo base 10
Metro
Coefciente estequiometrico de H+
Molaridad
Ión metalico
Número de electrones
nanometros
Potencial de Hidrogeno
Potencial de nitratos
Partes por millón
Constante universal de los gases (8.314 J mol-1)
Revoluciones por minuto
Temperatura estandar
micras
Por ciento
INTRODUCCIÓN
I.
INTRODUCCIÓN.
1.1
El plomo y sus aplicaciones.
Las tecnologías en uso para la extracción y reciclado de plomo datan del
siglo XIX y principios del siglo XX. Durante los años setentas la modernización
implicó la introducción de extensas unidades que mejoraron la labor, la
productividad energética y la construcción para disminuir las emisiones ( gas,
líquido y sólido) en respuesta a las rigurosas regulaciones ambientales.
Durante los años ochenta las industrias de plomo estuvieron en constante crisis
debido a la caída de los precios del metal y los grandes costos para
implementar medidas ambientales. Las industrias reorganizaron los procesos
y el reciclaje del metal como la chatarra de las baterías de plomo, escorias y
desperdicios metálicos para concentrar Plomo [11].
Es frecuentemente dicho que las reservas mundiales de menas de
algunos metales llegarán a agotarse. Cada afirmación en un caso particular
requiere una gran cantidad de hechos reales y una justificación técnica antes
de poder ser aceptado. En algunos casos el agotamiento de reservas es
igualado a la disminución de reservas de alta ley de minerales sulfúricos, las
cuales son tratadas en las plantas de fundición.
La mayoría de la producción mundial de plomo se origina del
tratamiento en el horno de soplo y sinterización de concentrados de sulfuro de
plomo donde la galena es el mineral de plomo predominante. Aunque existe
tecnología para la recuperación de plomo asociado a metales preciosos, hay
dificultades considerables con respecto a medio ambiente y regulación de
higiene en las plantas pirometalúrgicas. El polvo rico en plomo y emisiones de
gases emanados de las plantas es un problema persistente, y la dilución de
gases de SO2
del sinter son problemas de gran dificultad y los procesos
anticontaminantes son costosos [11]..
Se conoce con el nombre de tratamiento hidrometalurgico todo proceso
en el que el metal o metales beneficiables son disueltos con un disolvente
adecuado que de preferencia no ataque a la ganga o material residual.
1
INTRODUCCIÓN
A continuación, el metal puede recuperarse de la disolución en una
forma relativamente pura por cristalización, por un proceso combinado de
extracción por solventes y electrólisis o por precipitación.
Los tratamientos hidrometalúrgicos de concentrados de plomo son una
buena opción, por los problemas de fugas de SO2, higiene en la planta y
selectividad con respecto a otros metales. La mayoría de la actividad
hidrometalúrgica ha sido centrada en el sistema FeCl3 - HCl como agente
lixiviante, y en menor cantidad de trabajos ha sido usado el sistema HNO3 –
FeNO3 como agente lixiviante. Toda la lixiviación con nitratos ofrece opciones
y ventajas de los procesos en húmedo y minimiza la formación y producción de
azufre elemental para evitar emisiones de SO2.
El uso de un medio acuoso de nitrato para obtener plomo de minerales
sulfúricos no es una idea reciente. La reacción de Galena con ácido nítrico se
lleva a cabo muy rápidamente. La reacción produce azufre elemental en estado
sólido que es una gran ventaja en este proceso, comparado con los métodos
clásicos pirometalúrgicos donde se obtiene SO2 gaseoso.
Los
reactores
a
presión,
llamados
autoclaves,
están
ganando
gradualmente aceptación en las operaciones hidrometalúrgicas como es la
lixiviación de menas y concentrados de metales. El primer intento de estudio de
una reacción química bajo presión fue realizada en 1859 por el químico Ruso
N. Beketoff cuando estudiando en la Universidad de Sorbona en Paris, Beketoff
encontró que la Plata metálica puede ser precipitada desde una solución de
nitrato de Plata que fue calentada bajo presión de Hidrógeno [20].
La cinética de disolución de galena es de considerable interés ya que
no hay ningún proceso de lixiviación con ácido nítrico para concentrados de
plomo. La cinética define las condiciones para la completa y rápida disolución
de plomo e identifica oportunidades para la selectividad y remoción de plomo
asociado con impurezas metálicas.
2
INTRODUCCIÓN
Los diagramas de potencial - pH (Pourbaix) son gráficos teóricos que
representan equilibrios heterogéneos de hidrólisis de reacciones de oxidación
y reducción que ocurren en sistemas de soluciones acuosas en procesos
químicos. Estos diagramas se obtienen mediante un análisis conciso de datos
termodinámicos teóricos y experimentales, para con ello comprender las
condiciones bajo las cuales las especies son estables, y si se incrementa la
complejidad del sistema, él calculo y trazado de los datos puede volverse aun
más problemático [28].
La galena (PbS) es el único sulfuro de mineral de plomo de importancia
comercial. Los concentrados de galena son fácilmente procesados por métodos
pirometalurgicos, pero persisten problemas con la fuga de emisiones de SO2 en
algunas operaciones, y en todas las plantas son preocupantes los problemas
higiénicos causados por el Pb, Cd, Tl, etc. En suma, el costo económico de
remplazar el equipo obsoleto en las plantas de plomo es alto, por las normas
internacionales de ecología, la fundición esta en duda como un medio para
obtener plomo.
Los procesos hidrometalurgicos ofrecen muchas opciones para resolver
estos problemas y se han desarrollado numerosos estudios en la lixiviación y
electro-obtención de plomo. En este caso, grandes cantidades de minerales de
plomo han hallado respuesta al problema de contaminación, la atención es
ahora directamente a materiales en estado natural de minerales de sulfuros
complejos. Desafortunadamente la molienda de minerales de sulfuros
complejos esta limitada por problemas mineralógicos, donde, en minerales de
sulfuro complejos la galena es frecuentemente desplazada por la esfalerita o la
calcopirita de tamaños muy pequeños de algunas micras, que dificulta la
concentración por métodos convencionales de flotación [45].
Hay causas como los problemas ambientales relacionado a la obtención
del plomo por vía pirometalúrgica y la complejidad de los concentrados
asociados a la galena que hacen posible que el procesamiento de minerales
de plomo por vía hidrometalúrgica lleguen a ser desarrollados.
3
INTRODUCCIÓN
1.2
Objetivos:
Por lo anterior el presente trabajo tiene como finalidad:
(1) Estudiar la Termodinámica de lixiviación de un concentrado de plomo
variando presión y temperatura.
(2) Determinar las condiciones óptimas de disolución del concentrado de
plomo.
(3) Determinar la forma que se encuentra la plata y el hierro al final del
proceso.
1.3
Justificación.
La mayor parte de la producción mundial de plomo se origina del
tratamiento en el horno de soplo y sinterización de concentrado de Galena. El
polvo rico en plomo y emisiones de gases emanados de las plantas es un
problema persistente, y la dilución de gases de SO2 del sinter son problemas
de gran dificultad y los procesos anticontaminantes son costosos. Hay algunas
razones para que el cambio de tecnología sea necesario. La primera es el
crecimiento de las restricciones sobre la descarga de los desechos gaseosos,
sólidos y líquidos de las plantas metalúrgicas. La segunda es la necesidad del
uso de menas las cuales no pueden ser tratadas por los procesos usados
convencionalmente en el presente y tercero, es que estos nuevos procesos o el
cambio en los ya existentes pueden mejorarse bajo algunas (no todas)
circunstancias.
Por lo anterior se pretende obtener una vía alterna basado en las
soluciones de [HNO3 - Ca(NO3)2] para la obtención de plomo metálico, así
como sus diferentes compuestos purificados como el PbSO4 usados para la
producción de acumuladores, como químicos orgánicos e inorgánicos. Para lo
cual se trabajará en reactores (autoclave) a elevada presión y temperatura
durante un periodo de tiempo de 4 horas, donde el plomo queda en solución y
podría ser electro-depositado posteriormente, mientras que el sulfuro que
vienen en la galena y otros minerales tipo sulfuros se obtendrá en forma de
azufre.
4
ANTECEDENTES
II.
ANTECEDENTES
Todos los procesos para obtener metales, a partir de minerales
sulfurosos, se llevan a cabo por vía pirometalúrgica. Pero todos estos procesos
han presentado problemas ambientales, y en particular en el que se lleva a
cabo para la obtención de plomo asociado a metales preciosos, hay dificultades
considerables con respecto al medio ambiente y regulación de higiene, donde
el dióxido de azufre y el plomo, son generados como contaminantes, debido a
que sobrepasa los límites establecidos y se podrían disminuir con un mejor
control en su emisión. El proceso metalúrgico para la obtención de plomo a
partir de sulfuros se origina en el horno de cuba a partir de la sinterización de
concentrados de la galena, pues la galena está compuesta de sulfuro de plomo
y es el mineral de plomo predominante.
Hoy en día, se deben considerar nuevos procesos, así como también
mejorar los ya existentes, para la obtención de plomo, y todos los metales que
lo acompañan como plata, cobre, níquel, oro, hierro y zinc, con la finalidad de
incrementar la eficiencia de las etapas de purificación y concentración de iones
metálicos a partir de los licores obtenidos de los diferentes tipos de procesos
de lixiviación. Esta es la razón principal por la cual se han desarrollado
métodos hidrometalúrgicos para la obtención de plomo metálico. Por otra parte,
se debe considerar que los procesos anticontaminantes son costosos pero
pueden llegar a ser justificantes.
5
ANTECEDENTES
2.1
PROCESO CONVENCIONAL PARA LA OBTENCIÓN DE PLOMO A
PARTIR DE GALENA.
2.1.1 Diagrama de flujo del proceso convencional para la obtención de
plomo a partir de galena[6].
La figura 1 representa el diagrama de flujo del proceso pirometalúrgico
para la obtención de plomo refinado a partir de galena que se lleva a cabo en la
Compañía Metalúrgica Mexicana Peñoles, S. A. de C. V.
2.1.2 Tostación de concentrados de plomo
El sulfuro de plomo no se reduce por el carbono o por el óxido de
carbono, es por ello que los concentrados de galena deben tostarse antes de
proceder a su fusión, pues la presencia de demasiado azufre en la carga daría
por resultado que gran cantidad de plomo pase a la mata y dificulte la
recuperación subsecuente del metal. Más bien, lo que se busca es que gran
cantidad de cobre, pase en forma de mata para su posterior recuperación. Esta
cantidad de mata debe ser pequeña y se debe regular el contenido de azufre,
recurriendo a una tostación previa. También la temperatura debe regularse
cuidadosamente, ya que con esto, se evita que el contenido de azufre sea
mayor del 20 %.
6
ANTECEDENTES
Figura 1. Diagrama de flujo de una refinería de plomo (Cortesía de la
Compañía Metalúrgica Mexicana Peñoles, S. A. de C. V.).
Se debe considerar que la galena es frágil y se funde fácilmente;
entonces, para que sea eficaz el proceso de tostación, esta debe encontrarse
en forma de aglomerado para que tenga las propiedades de dureza, resistencia
y porosidad. Es por ello que debe tostarse con corriente forzada 1 de aire o
pasar por las máquinas de sinterización Dwight-Lloyd. En este proceso se debe
evitar la formación de mata. La temperatura debe controlarse porque la galena
puede formar sulfato de plomo, lo cual retrasa la tostación.
1
La tostación forzada es el método en el que se produce la oxidación por medio de combustión interna. Esta oxidación se propaga
dentro de la masa de las partículas del concentrado por corrientes de aire que pasan a través de las mismas.
7
ANTECEDENTES
Dentro de la carga de la máquina de sinterización se tiene el
concentrado, fundente y combustible dentro de un sinfín de paletas con fondo
perforado. A estas paletas se les el aire contenido en dirección descendente.
La cantidad de aire para la tostación debe regularse, porque de otra manera la
carga podría empaquetarse. En estas máquinas se sinteriza material cuyo
tamaño oscila entre las partículas de polvo y un diámetro de 1.25 cm como
máximo. La oxidación es tan intensa que el calor generado es suficiente para
iniciar la fusión de la carga
y aglomerar o sinterizar las partículas. Este
procesos se lleva a cabo en dos etapas: en la primera, se elimina una parte de
azufre, donde el producto sinterizado se tritura hasta un tamaño de 6 mm; y en
la segunda, se alimenta nuevamente el producto obtenido de la primera etapa,
para eliminar por completo el azufre que no se había eliminado en la primera.
En la superficie de la carga el coque y los sulfuros se inflaman y se
oxidan de acuerdo con las siguientes reacciones:
C + O2 = CO2
(1)
CO2 + C = 2 CO
(2)
2 PbS + 3O2 = 2 PbO + 2 SO2
(3)
2.1.3 Fusión de concentrados de plomo en horno de cuba
La mayor parte del plomo extraído en los yacimientos se reducen en el
horno de cuba. El concentrado de galena que llega a la fundición es compleja,
porque además de ganga, lleva consigo sulfuros de zinc, hierro, cobre,
antimonio y arsénico. Por lo que la carga de plomo debe pasar, previamente,
por los hornos de tostación Dwight-Lloyd para llevarse a cabo la aglomeración
con la finalidad de que no se forme una cantidad indebida de mata durante la
fundición en el horno de cuba.
En este paso el hierro, añadido en el horno como chatarra de hierro,
descompone el sulfuro, óxidos o silicatos de plomo, para liberarlo como plomo.
Los concentrados sulfurados que contiene alto porcentaje de sílice deben
tratarse por este proceso, mientras que las menas de plomo oxidadas pueden
fundirse directamente para dar un bullión impuro. Este método de fusión de los
8
ANTECEDENTES
concentrados de plomo se basa en la reducción de óxido de plomo por carbono
u óxido de carbono y en la reducción entre el sulfuro de plomo y el sulfato o el
óxido de plomo, para dar lugar, mediante una descomposición doble, a la
formación de plomo y anhídrido sulfuroso.
2 PbO + C = 2 Pb + CO2
(4)
PbS + 2 PbO = 3 Pb + SO2
(5)
PbS + PbSO4 = 2 Pb + 2 SO2
(6)
En este proceso se llevan a cabo las reacciones entre el óxido, el sulfato
y el sulfuro de plomo para liberar plomo, que puede perderse como
consecuencia de la oxidación. La proporción del óxido y del sulfato de plomo
formados dependerán de a temperatura alcanzada, de la admisión de aire y de
la naturaleza de los minerales asociados con la carga.
2.1.4
Productos del horno de cuba de plomo
Los productos obtenidos en el horno de cuba son:
¾ Bullion de plomo (o plomo blando). Este plomo es bastante puro
parea diversas aplicaciones comerciales sin que sea necesario a
someterlo a un nuevo afino. Casi todos los buliones deben ablandarse y
desplatarse antes de que tengan al pureza suficiente para emplearse en
la industria. Si tiene impurezas de hierro, cobre, arsénico o antimonio,
deben refinarse porque puede tener efectos perjudiciales. De igual
manera grandes cantidades de oro y plata, no deben encontrase en el
bulión, pues casi toda la plata se encuentra dentro del bulión y se
compensa el coste de su recuperación. El bulión residual que contiene
de 1.5 a 4 % de antimonio se vuelve a la cabeza del proceso para
tratarlo como material nuevo.
¾ Mata. Obtiene de un 40 al 100 % de cobre, además puede contener
grandes cantidades de oro y plata, por lo que se deben someter a un
nuevo tratamiento. Estas matas contienen hasta el 28 % de Pb. En
ocasiones estas matas se trituran, para después mezclarse con la carga
9
ANTECEDENTES
del horno de tostación para que se desulfuren antes de volverse al horno
de cuba para un nuevo tratamiento. En este paso una parte de hierro se
separa de la mata como escoria junto con el plomo y la otra parte se
volatiliza. El cobre, arsénico, oro y plata se recuperan como buliones de
cobre impuros.
¾ Escoria. Estas escorias no deben contener más del 0.7 % de plomo,
0.2 % de antimonio, 1 % de cobre y 15 gramos de plata por tonelada.
Las escorias pueden llegar a tener hasta un 30 % de óxido de zinc, pero
no es un problema, pero dificulta la recuperación de cobre o para el
ablandamiento de plomo, pues la desulfuración incompleta del cobre
hace que este metal pase a la escoria o al bulión. La escoria que no
contiene plata se vuelve al horno de cuba.
¾ Speiss. Cualquier cantidad de arsénico que no se elimine en el horno de
cuba da lugar a la formación de speiss dentro del horno. Este compuesto
es inmiscible con el cobre, el plomo, la mata y la escoria fundidos debido
al contenido de azufre. El níquel y cobalto se recupera a partir de este
sólido.
¾ Polvos volátiles. Estos polvos son muy finos y contienen gran cantidad
de plomo, sólo pueden recuperarse en una cámara de filtros de sacos,
sometiéndose a las siguientes operaciones: 1°. Humedecerse y volver a
alimentarse al mismo horno de cuba, en cuyo caso una parte se fundirá
y el resto se perderá en la atmósfera. 2°. Sintetizarse recurriendo al
encendido de la masa que se encuentra en las tolvas de acero de las
cámaras de filtros de sacos, bien formando parte de la carga de un
tostador Dwight-Lloyd. 3°. Briquetearse con el aglomerado adecuado.
¾ Gas 2 . Se deben tratar las partículas de azufre que son expulsados del
horno de cuba, para convertirlos en ácido sulfúrico o a azufre elemental
recurriendo a su reducción con coque o con gas natural.
2
8 – 16 % CO2 ; 0 – 1.5 % O2 ; 8 – 20 % CO; 0.1 – 0.8 % H2.
10
ANTECEDENTES
¾ Lobos de pared: Incrustaciones en la pared del horno con la siguiente
composición: 20% Zn, 3% Cu, 16% Fe, 17.9% S, 10.6% SiO2, 16.2% Pb.
¾ Lobos de solera: tiene la siguiente composición: 15.4% Zn, 20.8% Cu,
5.1% Fe, 13.1% S, 0.9% SiO2, 38.3 %Pb.
2.1.5 Ablandamiento del bullión base.
El bullión debe someterse a una operación de ablandamiento previo
antes de pasar por el Proceso Parkes para la recuperación de oro y plata. En
este proceso de ablandamiento consiste en separar una parte de las impurezas
como arsénico, antimonio y cobre, con objeto de acortar y abaratar el proceso,
pues ya que el cobre y antimonio, aumentan el consumo de zinc en el
desplatado. Durante el ablandamiento el bullión de plomo debe mantenerse a
una temperatura de 370 a 380 °C dentro de un horno con atmósfera oxidante y
durante un periodo de dos horas, que es suficiente para que se forme una
espuma (espuma de cobre) 3 que consta principalmente de cobre, azufre,
arsénico y plomo. Después del ablandamiento, la temperatura del baño se
eleva hasta el rojo (600 – 650 °C) durante doce horas inyectándose aire en el
horno para que imperen condiciones oxidantes. El plomo, arsénico, antimonio y
estaño se oxidan dando la formación de una escoria de litargirio. El antimonio
es difícil de separar por lo que se recomienda añadir más litargirio
bajo
agitación para acelerar el proceso. Una vez reblandecido el bullión, la escoria
se desnata y se envía para someterla a un nuevo tratamiento. Esta operación
tiene una duración de veinticuatro horas.
2.1.6 Desplatado del bullión base
El proceso de ablandamiento no da lugar a la obtención de plomo
comercial debido al hecho de que, además de cantidades considerables de
impurezas, todavía contiene cantidad de oro y plata que sería conveniente
recuperar. Este lingote puede refinarse por el Proceso Parkes que se detalla
en el Capítulo 2.2. La figura 2 muestra en forma más detallada el esquema
para la obtención de plomo refinado y sus impurezas a partir de galena.
3
PbO con 2 % Cu, 2 % Sb, y cantidad considerable de Au y Ag.
11
ANTECEDENTES
Concentrado de plomo
SO2
Tostación y sinterización
Fundente
Coque
Reducción
Plomo crudo
95-98%
Mata (FeS, PbS, Cu2S)
Espeis
(Fe3As2, FeSb, CoSb)
Escoria
Beneficio de Cu y Pb
Recuperación de
Zn y Pb
Beneficio de Co y Ni
Refinación
previa
Refinación
electrolítica
Eliminación de Cu, Ni, S
(materiales de retorno)
Refinación
térmica
(Oxidación)
Eliminación de Sn,
As, Sb, Zn
(grasa)
Recuperación
Pb 99.99%
Desplatado
Eliminación
de Bi
Ag, Au
Pb 99.97%
Figura 2. Esquema para la obtención de plomo refinado y sus
impurezas.
12
ANTECEDENTES
2.2
PROCESO PARKES PARA LA OBTENCIÓN DE PLATA DE MENAS DE
PLOMO[6].
Generalidades.
Este método de separar el oro y la plata del plomo se desarrolla de la siguiente
forma:
1. En una aleación que contiene plomo, zinc, oro y plata, el zinc primero se
combina con el oro y después con la plata, para formar compuestos
intermetálicos (Ag2Zn3) 4 .
2. Este compuesto es menos fusible que el plomo y tiene un menor peso
específico.
3. El compuesto es prácticamente insoluble en el plomo saturado con zinc.
2.2.1 Cincado
Este proceso se efectúa en calderas grandes, cada una de las cuales
tiene una capacidad de 100 toneladas; el plomo se funde rápida y fácilmente y
la temperatura de la masa fundida se controla cuidadosamente. Al bullión
fundido se añade zinc (en la cantidad calculada sobre la base del contenido en
metal precioso del bullión más aquellas necesarias para saturar el plomo con
zinc) 5 . Una parte de este zinc procede del material que aún no se ha saturado
con plata u oro en cincados anteriores, con objeto de mantener en un mínimo la
cantidad de metal de tipo pobre. La aleación se mantiene a una temperatura de
480 °C por espacio de varias horas, durante este tiempo,
y mientras está
sometida a la agitación, la aleación plomo-zinc-plata 6 se eleva a la superficie y
se separa. Cuando, finalmente, se añade una pequeña cantidad de zinc en
llantones el contenido de plata se reduce a unos 8 gramos por tonelada,
mientras que el plomo desplatado se bombea a la instalación de afino, que
constituye el siguiente paso del proceso.
4
El oro se combina preferentemente con el zinc, por lo que añadiendo una cantidad limitada de este metal, es posible obtener una
corteza de “oro” que contiene todo el oro y una pequeña cantidad de plata
5
Por ejemplo, un bullión que contiene 900 g por tonelada de plata necesitaría 1.35 % de su peso de zinc; y uno con 7.5 Kg de plata
por tonelada alrededor del 2.5 %.
6
Una de estas aleaciones típicas contiene 70 % de plomo, 1 % de cobre, 0.1 % de antimonio, 60 Kg de plata y 30 g de oro por
tonelada.
13
ANTECEDENTES
2.2.2 Afino.
El afino se suele llevar a cabo en un horno de reverbero, que quema
carbón y tiene una solera de 3.9 m de ancho, 8.5 m de largo y 75 cm de
profundidad, con una capacidad aproximada de 300 toneladas de plomo. Este
plomo se mantiene en el horno durante doce horas a 760 °C, mientras se pasa
aire o vapor a través del baño para agitarlo y oxidar el zinc y otras impurezas.
El zinc, el arsénico y el antimonio, junto con una gran cantidad de plomo,
forman óxidos, ascienden a la superficie en forma de espuma (cuyo peso es
aproximadamente del orden del 5 % del bullión cargado), que, después de
separarse, se devuelve al proceso. Al llegar a este punto, el plomo se
encuentra en un estado de pureza suficiente y / o bastante blando para
moldearlo. Esto se suele llevar a cabo en un tipo de máquina circular de
moldeo, mostrada en la figura 3.
Figura 3. Rueda de moldeo.
14
ANTECEDENTES
2.2.3 Destilación.
Las espumas finales de zinc procedentes del paso de desplatado se
tratan en una prensa potente para separar el plomo en exceso y, a
continuación, se llevan al horno de destilación. Este horno, mostrado en la
figura 4. consta de una retorta de grafito en forma de botella de 1 m de altura y
48 cm de diámetro que puede contener 550 Kg de aleación. Esta aleación se
carga en la retorta (puede emplearse para una 40 cargas) con una cantidad
pequeña de carbón vegetal finamente dividido y, a continuación, se adapta un
condensador en la boca (recubriendo la unión con masilla) y la temperatura se
eleva a unos 1200 °C: A esta temperatura el zinc se destila durante seis a ocho
horas, se recoge en el condensador , se vacía y, después de colocarlo en
forma de llantones, se vuelve a introducir en el proceso (se recupera del 60 al
80 % del zinc empleado en el desplatado). Cuando todo el zinc se ha destilado,
se desmonta el condensador y el plomo enriquecido (plomo que contiene 150
Kg de plata y 500 g de oro por tonelada) se moldea en barras para someterlo a
la copelación.
Figura 4. Horno de Destilación
2.2.4 Copelación.
Este paso, que implica la separación del plomo y la retención de la
mayor parte del oro y plata, se lleva a cabo en hornos de copelación, mostrado
en la Figura 5. Este consta de una solera de ceniza de huesos, cemento
Pórtland o piedra caliza o arcilla, montada en un carro. Esta solera tiene una
depresión en la que está
contenido el baño de plomo fundido y cuya
15
ANTECEDENTES
profundidad es del orden de 8 cm. Generalmente, se calienta en una quemador
de petróleo que se introduce por la puerta del horno. Se permite la libre
admisión del aire para que la superficie de la aleación esté recubierta por una
capa de litargirio. Las impurezas del tipo de cobre, hierro y zinc también se
oxidan y entran a formar parte de esta escoria de litargirio 7 , que cuando se
encuentra en cantidad suficiente, se retira con un rastrillo y se lleva a un
recipiente desde donde se devuelve al proceso para tratarla de nuevo. Si existe
telurio, éste es de difícil separación. Una parte del plomo y plata se volatizan y
escapan por la chimenea, mientras que otra la absorbe la copela 8 . A medida
que el plomo se va eliminando, se añade más plomo rico a la aleación hasta
que, después de varias horas de copelación, queda en la solera una aleación
que contiene 99.5 % de plata y oro. Esta se extrae con cuchara, se moldea en
barras, cada una de las cuales contiene unos 3 Kg de la mezcla de plata y oro 9
y se separan con el ácido nítrico o cloro o por métodos electrolíticos.
Figura 5. Horno de Copelación
7
70 %de plomo, 2.7 Kg de plata y 25 g de oro por tonelada.
Puede perderse el 5 % de plomo y el 1 % de plata.
9
99.4 % de plata y 0.3 % de oro.
8
16
ANTECEDENTES
2.2.5 Afino continuo de plomo.
Este proceso se ha desarrollado con mucho éxito en Port Piric, Australia.
Resumiendo, consiste en tratar el bullión en calderas especiales en las que las
espumas, compuesto plata-zinc y el plomo pueden separarse de forma
continua. La ventaja de este proceso son:
1. Reducción del costo de mano de obra al eliminar la remoción de
espuma, pues la espuma se separa como una escoria líquida.
2. La aleación plomo-zinc-plata formada, sólo contiene 12 % de plomo y
180 Kg de plata por tonelada, frente a 75-80 %de plomo y 90 Kg de plata
por tonelada en el proceso Parkes.
3. Como la cantidad de dicha aleación es menor, el costo y el tiempo
invertido en la destilación y en la copelación son menores.
4. El proceso discontinuo implica más mano de obra que no existen en el
proceso continuo.
5. El consumo de combustibles es menor, ya que se evita el calentamiento
y refrigeración repetidos del proceso discontinuo.
6. El espacio requerido es del orden de 1/3 del Proceso Parkes.
7. No es preciso predeterminar las adiciones de zinc, pues la capa de este
metal se enriquece gradualmente hasta que se separa de la caldera.
2.3
PROCESO JAROSITA
Los minerales naturales jarosíticos ricos en plomo y plata, han existido
desde el año 1200 a.C. en España. En los Estados de la República Mexicana
existen yacimientos de plumbojarosita y argentojarosita que se forman en
algunas minas de plomo y / o plata; además, los residuos que se generan en la
producción electrolítica de zinc de las compañías peñoles e IMMSA son de tipo
jarosíticos. La fórmula de la jarosita es la siguiente:
M Fe3 (SO4)2 (OH)6
(7)
17
ANTECEDENTES
Donde la letra “M” representa un ión metálico o no metálico, la cual
forma parte en la formación de la jarosita y es lo que hace la diferencia entre
ellas.
La FIGURA 6 muestra la precipitación de diferentes elementos en función de la
temperatura originando la formación de diferentes tipos de jarositas.
Figura 6. Cantidad de elemento precipitado por el efecto de la temperatura para
formarse como jarositas.
Las
impurezas
que
se
encuentran
presentes
en
la
galena,
particularmente la plata, pueden precipitar mediante el Proceso Jarosita. En
este trabajo, posiblemente se lleva a cabo la precipitación de jarosita de plata
debido a las condiciones en las que se llevó a cabo el proceso de lixiviación.
En los proceso de lixiviación, uno de los principales métodos más
comunes de purificación de solución es la precipitación química sin la
necesidad de adicionar un agente químico para provocar la reacción que lleve
consigo la precipitación; pues durante la lixiviación los iones metálicos son
18
ANTECEDENTES
absorbidos desde la solución para llevarse a cabo la precipitación. Si esos
iones son de plata metálica, una pérdida significante de producto es acarreado,
y esto debe evitarse. Además otra de las dificultades es la formación ocasional
de precipitados de óxidos mezclados con iones metálicos valuables, resultando
una inaceptable perdida de cantidad valuable de metal. En este caso, la plata
considerada como valor metálico se disuelve en el ácido, pero otra parte,
debido a sus propiedades químicas se precipita en forma de jarosita mediante
la siguiente reacción:
Ag+ + 3 Fe3+ + 2 SO42- + 6OH- → AgFe3 (SO4)2 (OH)6
(8)
El Proceso Jarosita[10] es ahora utilizado ampliamente en la industria
electrolítica del zinc para reducir y/ o eliminar el Fe presente en las soluciones
del zinc a fin de favorecer la recuperación de zinc y otros metales
(principalmente: plomo, plata, oro, cobre y cadmio). El zinc contenido en los
residuos de la planta de zinc está principalmente en la forma de ferrita de zinc
que se forma durante los procesos de tostación que convierten el sulfato de
zinc a óxido de zinc. Parte del zinc se combina con el hierro que está presente
como una impureza en los concentrados de sulfuro de zinc. Se determinó que
el 10 % del contenido de zinc reacciona con el hierro para formar ferrita de zinc.
El plomo en los residuos de la planta de zinc está presente como un sulfato
insoluble derivado de galena que también es una impureza común en
concentrados de sulfuros de zinc.
Con la llegada del Proceso Jarosita llegó a ser factible ajustar la
reducción de concentración para hierro en función del mineral valor. Ha sido
recordado, sin embargo, que los costos de recuperación de zinc a partir de
óxido de zinc son más bajos que los costos de recuperación de zinc (y otros
metales) a partir de los residuo ferrita de zinc.
19
ANTECEDENTES
2.3.1 Desarrollo
de
los
procesos
de
tratamiento
de
residuos
hidrometalúrgicos.
Desde los tiempos del comienzo de la producción de zinc electrolítico, la
atención ha sido concentradas sobre posibles métodos de recuperación de zinc
perdidos en ferrita de zinc. Se sabía desde entonces que la ferrita de zinc
podría ser disuelta en ácido sulfúrico si las condiciones del proceso fueran a
alta energía y a una temperatura de alrededor de 100 °C.
El problema surgió en el tratamiento para remover las grandes
cantidades de hierro disuelto desde la solución resultante del proceso
electrolítico del zinc[1,2,10,27].
En 1955 se llevó a cabo un proyecto sobre un programa de lixiviación de
ferrita de zinc y la hidrólisis de hierro a alta temperatura y presión del hierro
disuelto. Se investigó que una partir de la hidrólisis (precipitación) de hierro
disuelto podría ser realizado durante la lixiviación de ferrita de zinc a 100 °C y
se esperó que el uso de altas temperaturas incrementaría hasta el punto de tal
hidrólisis o precipitación de hierro en una forma que efectivamente podría ser
removida desde la solución.
Lo estudios clásicos de la fase de equilibrio[37] en el sistema Fe2O3SO3-H2O indicó que podría ser posible la precipitación de hierro desde la
solución a 200 °C en forma de Fe2O3 o hidroxisulfato Fe2O3 • 2SO3 • H2O o
como una mezcla de los dos componentes.
A temperaturas de aproximadamente 200 °C, la carfosiderita es
reemplazada por el hidroxisulfato como una fase sólida estable y la solubilidad
de hierro es incrementado. A más bajas concentraciones de sulfato ó ácido
sulfúrico, la goetita es reemplazada por la hematita como la fase sólida estable.
La hematita llega a ser estable a altas concentraciones de sulfato[43]. La
FIGURA 7 representa la zona de estabilidad de la formación de jarositas en
función de la temperatura y pH.
20
ANTECEDENTES
FIGURA 7. Región de estabilidad de la jarosita como una función del pH y
temperatura a partir de una solución de 0.5 M de Fe2(SO4)3[13].
Es evidente que una solución de sulfato Ferrico cuando se calentó a 200
°C se lleva a cabo la hidrólisis de acuerdo a las siguientes reacciones:
Fe2(SO4)3 + 2H2O = 2Fe(OH)(SO4) + H2SO4
(9)
Fe2(SO4)3 + 3H2O = Fe2O3 + 3H2SO4
(10)
La precipitación de hierro podría ser limitada por la concentración de
ácido sulfúrico que estaba presente inicialmente
o fue generado por las
reacciones a menos que un agente neutralizante estuviera presente o fuera
añadido.
21
ANTECEDENTES
La diferencia en solubilidad de ión ferrico de 100 °C y 200 °C se
muestra más claramente en la FIGURA 8 donde se muestran la proyección de
las dos isotermas sobre el plano Fe-SO4-H2O. La línea punteada representa las
mezclas de sulfato ferrico – agua, y su posición (en relación a las líneas
representando soluciones en equilibrio con carfosiderita o fibroferrita) indica
que algo de ácido sulfúrico es necesario para que se obtengan las soluciones
estables de sulfato ferrico hasta 100 °C.
FIGURA 8. Sistema Fe2(SO4)3-H2SO4-H2O con isotermas 110°C y 200°C
obtenido bibliográficamente.
2.3.2 Ventajas y desventajas del Proceso Jarosita.
¾ Las ventajas del proceso son:
1. Simple y rápido para integrarse a una planta ya existente.
2. El precipitado es rápidamente espesado y filtrado.
3. Hay bajas pérdidas de zinc en la precipitación de la jarosita.
4. Puede controlarse tanto el álcali como el sulfato en el circuito.
5. Permite altas recuperaciones de zinc, cadmio, cobre, etc., además es
relativamente selectivo para el hierro y produce un residuo donde es
posible la recuperación de oro, plata y plomo.
22
ANTECEDENTES
¾ Las desventajas del proceso son:
1.
Se debe controlar el pH.
2.
Es necesario usar un álcali.
3.
Alto volumen del residuo con un contenido de hierro relativamente
bajo.
4.
Origina residuos con sulfatos causando problemas ambientales.
23
HIDROMETALURGIA DEL PLOMO
III.
HIDROMETALURGIA DEL PLOMO.
3.1
Mineralogia.
En la mayor parte de los depósitos primarios,
los sulfuros como la
galena [PbS] y la esfalerita [ZnS] son los únicos minerales de plomo y zinc
existentes. Estos están comúnmente asociados y la esfalerita es predominante.
En pocos depósitos, la jamesonita [Pb4FeSb6S14] es un importante
constituyente de la mena, generalmente en sustitución de la galena.
Comúnmente los sulfuros asociados en los depósitos de plomo-zinc son la
pirita [FeS2], marcasita [FeS2] y calcopirita [CuFeS2]; y menos comunes son la
arsenopirita [FeAsS], tetrahedrita [(Cu,Fe,Ag)12Sb4S13], tenantita [(Cu,Fe,
Ag)12As4S13], enargita [Cu3AsS4], bornita [Cu5FeS4] y pirrotita [FeS]; la estibnita
[Sb2S3] es un constituyente ocasional. El cobre es un constituyente en menor
grado de las menas de plomo-zinc. La plata puede estar presente como
argentita [Ag2S], plata nativa o en otro tipo de minerales.
Los minerales mas comunes en la ganga incluyen carbonatos como la
calcita [CaCO3], dolomita [Ca,Mg(CO3)2], ankerita [Ca(Fe,Mg,Mn)(CO3)2] y
siderita; la rodocrosita [MnCO3] es menos comun. El cuarzo y el jasperoide
[SiO2], la aurita [CaF2] y barita [BaSO4] son comunes en la ganga. La rodonita
[MnSiO3] es menos común.
La variedad de la esfalerita [(Zn,Fe)S], conteniendo del 10 al 26%, es
común en muchos distritos mineros. Un porcentaje bajo de hierro en el
concentrado de zinc tiene efectos económicos adversos. El cadmio es común
en la esfalerita
como impureza en la retícula del cristal, variando desde
insignificante trazas hasta 1.7% en raras ocasiones
La mayor parte de la plata es un subproducto de menas de plomo o de
plomo-zinc. Es raro encontrarlo en menas de zinc. La plata esta retenida en la
retícula de la galena. La plata también esta presente como tetrahedrita o
tenantita. Otros minerales de plata en menas primarias de plomo y de plomo24
HIDROMETALURGIA DEL PLOMO
zinc, son la argentita [Ag2S] y la matildita [AgBiS2] que están como inclusiones
en la galena.
En la figura 9 y 10 se muestra como se encuentran asociados los
minerales de sulfuros como la Calacopirita (Cp), Esfalerita (Sp), Galena (Ga) y
Pirita (Py), así como otros minerales asociados como el Galio (Ga), Oro (Au) y
Telurio (Te) en una mena de sulfuros complejos.
Cp
Sp
Sp
Ga
Py
Sp
Py
Sp
Sp
0
microns
Py
50
Sp
Py
Ga
Sp
Cp
Te
Ga
Sp
Py
Py
0
Figura 9.
microns
Sp
50
Microfotografias de minerales obtenidos durante la flotación de
Zinc en una planta de Beneficio (Concentrados de Zn, Grupo Peñoles).
25
HIDROMETALURGIA DEL PLOMO
Figura 10.
Microfotografias de minerales obtenidos durante la flotación de
Plomo-Cobre en una planta de Beneficio (Concentrado de Plomo-Cobre, Grupo
Peñoles).
Una composición promedio de minerales Pb-Zn se muestra en la tabla 1.
Tabla 1. Composición promedio de minerales Pb - Zn [2].
% Pb
% Zn
%Cu
%Fe
%S
%SiO2
0.12
1.35
0.6
5
5
-
2.3
2.5
1
1.8
-
20
1.6
4
0.5
8.5
16
19
La liberación de minerales contenidos en menas, se realiza por molienda
y a continuación se hace la flotación para la separación de plomo-cobre del
zinc . La tabla 2 muestra la composición del concentrado, resultado de la
flotación.
26
HIDROMETALURGIA DEL PLOMO
Tabla 2. Composición típica de concentrados por flotación.
Producto
Cabeza
Concentrado
Plomo
Concentrado
Cobre
Concentrado
Zinc
Colas
Au(ppm) Ag(ppm)
2.21
256
19.33
3,322
Ensayes
Pb(%) Zn(%)
1.59
6.60
22.21
9.81
Cu(%)
0.48
3.96
Fe(%)
33.78
22.65
19.77
9,264
14.25
2.48
20.81
20.51
1.38
155
1.21
52.28
0.51
10.22
1.23
30
0.40
1.22
0.13
37.20
Los métodos hidrometalurgicos para recuperación de plomo de sus
concentrados están frecuentemente divididos en las siguientes etapas [45]:
•
Pre-tratamiento:
La
etapa
de
conversión
produce
compuestos
adecuados para la disolución.
•
Disolución: La disolución de concentrados o formación de compuestos
en la etapa de pretratamiento en solución.
•
Tratamiento de la solución: Remover impurezas y precipitación de
compuestos de plomo.
•
Recuperación: Etapa de producción de plomo metálico.
Sin embargo, en este trabajo, el proceso se lleva a cabo a partir del paso
N° 2, pues ya que el concentrado de galena pasa a la disolución (lixiviación) sin
ningún pre-tratamiento. La figura 11 es un diagrama esquemático de una planta
hidrometalúrgica.
3.2
Hidrometalurgia del plomo con ácido clorhídrico y cloruro ferrico.
Dutrizac [8] revisaron los estudios de disolución de minerales sulfurados
en soluciones iónicas férricas. Muchos de los trabajos ahí considerados, son
investigaciones realizadas en la antigua URSS, que acentuaron el desarrollo de
27
HIDROMETALURGIA DEL PLOMO
estos procesos. Estos autores y otros han reportado la estequiometría de la
reacción general para la galena en solución de cloruro férrico:
PbS + 2 FeCl3 Æ PbCl2 + 2 FeCl2 + S0
(11)
Figura 11. Diagrama simplificado de la producción de metales desde minerales
o concentrados por vía hidrometalúrgica.
Palmer[33] y Dutrizac[12] reportaron una cinética parabólica, para todas
las condiciones de temperatura (28 - 98°C) y concentración de cloruro Ferrico
investigadas, lo que sugiere una difusión externa del cloruro de plomo
producido entre las capas de azufre que se producen lo que limita la velocidad.
En estos estudios, el azufre producido en la reacción fue reportado sin
porosidad. Foerstenau [16], sin embargo, observó la cinética parabólica en el
modelo de nucleación decreciente con difusión por los poros, como el paso de
control de la velocidad. Morin y colaboradores [30] reportaron la disolución de
galena en solución de cloruro ferrico saturado con cloruro de sodio sigue el
modelo de núcleo decreciente y reacciona arriba de 99°C. Kim y colaboradores
28
HIDROMETALURGIA DEL PLOMO
[24] mostraron que la reacción de la galena con cloruro ferrico sigue el modelo
de núcleo decreciente y sugirieron que la reacción en la superficie del mineral
fue la que controlo la velocidad. Los mismos autores han examinado los
efectos del ión cloruro en la cinética de disolución, sugiriendo que una película
de cloruro de plomo se forma en la superficie de la galena por una reacción
estequiometrica entre el Cl- y PbS anterior a la formación del plomo disuelto:
PbS + 2 Cl- Æ PbCl2 + S0 + 2 e-
(12)
Esta película es disuelta de acuerdo a la reacción
PbCl2 + 2 Cl- Æ PbCl4-
(13)
La concentración del ión cloruro ( que determina la velocidad de
disolución del ión cloruro ) pudiera ser relacionada con la velocidad de la
reacción total. Palmer [33] ha sugerido que las reacciones electroquímicas y la
serie catódica de media celda son:
Fe3+ + e- Æ Fe2+
(14a)
FeCl2+ + e- Æ Fe2+ + Cl-
(14b)
FeCl2+ + e- Æ Fe2+ + 2 Cl-
(14c)
FeCl3 + e- Æ Fe2+ + 3 Cl-
(14d)
Que envuelven a varios cloro complejos del ión ferrico. Foerstenau [16],
explica que hay un control electroquímico. La reacción anódica envuelve la
oxidación de la galena a ión plomo y azufre elemental
PbS Æ Pb2+ + S0 + 2 e-
(15)
y la reacción catódica envuelve la reducción del ión ferrico a ión ferroso de
acuerdo a la reacción 4a; el mecanismo de reacción en la galena es un
intercambio de electrones. Aparentemente es una reacción química, pero en
realidad es una reacción electroquímica.
29
HIDROMETALURGIA DEL PLOMO
3.3
Hidrometalurgia del plomo con nitratos.
La lixiviación con ácido nítrico de concentrados y menas de sulfuro es un
método atractivo para la recuperación de metales básicos, debido a que el
HNO3 es un fuerte agente oxidante que puede ser fácilmente reciclado por
adición de oxigeno directamente en la lixiviación o usando una oxidación
externa de oxido nitroso.
Varios métodos basados en el ácido nítrico para el procesamiento de
concentrados y minerales sulfurosos para hierro y metales no ferrosos han sido
propuestos y examinados ( Bjorling y Kolta, 1964[4]; Prater y colaboradores,
1973[38]; Habashi, 1973[18,19], Bjorling y colaboradores, 1976[5]; Vizsolyi y
Peters, 1980[48]; Brennecke y colaboradores, 1981[7]; Fair y colaboradores,
1986[14]; Fuerstenau y colaboradores, 1987[17]; Van Weert y Shang, 1993[47];
Dropper y Shang, 1995[9]; Kholmogorov y colaboradores, 1998[23]; Novoselov
y Makotchenko, 1999[32]; Pashkov y colaboradores, 2002[34]) pero no aparece
operando en plantas comerciales en la actualidad. Una importante ventaja de la
lixiviación con ácido nítrico es la oxidación del azufre y sulfuros a sulfatos y
azufre elemental, en muchos casos en partes iguales. Esto tiene como
resultado un incremento en el consumo de ácido nítrico por la formación de
sulfatos, incrementando el costo del tratamiento de la solución y la
regeneración del ácido. Por ejemplo, un concentrado de plomo-zinc fue casi
completamente lixiviado con 2 M de HNO3 a 90°C, alrededor del 50% del plomo
fue encontrado en el residuo como PbSO4(S) (Kholmogorov y colaboradores,
1998[23]). La Hidrometalurgia del plomo es complicada por la baja solubilidad
de las sales del plomo y una importante ventaja de la electrolisis de nitratos en
que el nitrato de plomo es altamente soluble, es perdido en el caso de la
lixiviación convencional de plomo con ácido nítrico debido a la conversión de
PbS(S) a PbSO4(S).
La cinética y el mecanismo de disolución de sulfuros metálicos en ácido
nítrico así como la formación de azufre elemental y sulfatos es poco
comprendido. Se puede establecer que la producción de sulfatos aumenta con
el incremento de la concentración de ácido nítrico y el potencial de electrodo de
30
HIDROMETALURGIA DEL PLOMO
la pirita y otros minerales, mientras el azufre elemental es oxidado a sulfato
muy rápidamente ( Dropper y Shang, 1995[9]; Flatt y Woods, 2000[15]), sin
embargo, las conclusiones acerca del efecto de la temperatura sobre el
rendimiento de los sulfatos es contradictorio (Bjorling y Kolta, 1964[4]; Flatt y
Woods, 2000[15]). Se encontró que el hierro, cobre y los iones plata aceleran la
disolución de los sulfuros metálicos en soluciones de ácido nítrico ( Mulak,
1987[31]; Fuerstenau y colaboradores, 1987[17]), así como en otros medios de
oxidación.
El comportamiento del sulfuro de plomo (PbS) en soluciones de HNO3
ha recibido muy poca atención. Peters y Vizsolyi (1969) [36] propusierón que la
química de lixiviación de galena con ácido nítrico esta dada por:
3PbS + 8HNO3 Æ 3Pb(NO3)2 + 2NO(g) + 4H2O + S°
(16)
Con esta ecuación el plomo puede disolverse usando 1.23 gramos de
concentrado por cada gramo de HNO3 usado, ellos encontraron una disolución
del 82% de concentrado de plomo de Pine Point (78.2 % de Pb) en 2 horas y
un 91 % en 10 horas con una concentración inicial de ácido nítrico de 120 g l-1
(1.9 M) y una solución final con un pH de 2.4, conteniendo en el licor 120 g l-1de
Pb. Si esta lixiviación fuese usada para el proceso de obtención de plomo, se
necesitaría una etapa de purificación ( para remover el hierro y el zinc de la
solución, pero también para remover los nitritos (NO2-) residuales los cuales
pueden interferir en la electrorefinación). Esta purificación puede lograrse
adicionando PbO para neutralizar el ácido e hidrolizar el hierro, cobre y zinc; y
con PbO2 se reduce la oxidación de las formas del nitrógeno. Para la
producción final del plomo puede usarse la electrorefinación.
La electrorefinación del plomo desde soluciones de nitrato no es tan
directa como es la electrorefinación de cobre o del zinc de soluciones de
sulfatos. Hay dos complicaciones:
1. El plomo no solo se deposita sobre el cátodo como metal, también en el
ánodo como PbO2.
31
HIDROMETALURGIA DEL PLOMO
Pb2+ + H2O Æ PbO2 + 4H+ + 2e
(17)
2. El ácido nítrico reduce al cátodo y puede redisolver los depósitos de
plomo cuando los contenidos de ácido exceden los 10 g l-1 (0.18 M).
Tal procesamiento de plomo tiende a producir la mitad de plomo
metálico y la otra mitad de dióxido de plomo, el cual puede ser comercializado.
Los residuos de la lixiviación con ácido nítrico pueden contener azufre
elemental, sulfato de plomo, sulfato de zinc, metales preciosos e impurezas. Si
el proceso con ácido nítrico puede ser viable, el tratamiento de los residuos
puede llevarse a cabo. Un diagrama de flujo simplificado para un proceso con
ácido nítrico es mostrado en la figura 12.
Figura 12.
Diagrama de flujo simplificado para el procesamiento de plomo
basado en la lixiviación con ácido nítrico. Esta lixiviación opera a temperatura
ambiente y en tanques sin presión.
Fuerstenau y colaboradores (1987) [17] reportaron la cinética de
lixiviación de galena en soluciones de nitrato ferrico. Ellos encontraron que la
oxidación de galena produce azufre elemental y la velocidad es proporcional a
32
HIDROMETALURGIA DEL PLOMO
la raíz cuadrada de concentración de Fe3+, la adición de 1 M de nitrato de sodio
desacelera la reacción. La energía de activación fue de 47 kJ mol-1 y los
autores asumieron que la disolución procedió por un mecanismo electroquímico
con los iones férricos como oxidantes y la velocidad fue controlada por reacción
en la superficie.
Holmes y Crundwell (1995) [21] estudiarón la voltametria de la oxidación
electroquímica en electrodo de disco rotatorio de PbS con 0.6 M NaNO3 + 0.5
M H+ y llegarón a la conclusión que la corriente es controlada por la velocidad
de la reacción electroquímica. Mikhlin y colaboradores (2002) [29] compararón
la voltametria , el electrodo de disco rotatorio y datos en MEB para la oxidación
de PbS en soluciones de ácido nítrico y perclorhidrico y sugirieron que la
disolución anódica fue afectada por las alteraciones de la composición y
características semiconductoras de la reacción desordenada de la capa
superficial de la galena y la formación de azufre elemental y sulfato de plomo.
Pashkov y colaboradores (2002) [34] estudiaron la disolución de galena en
electrodo de disco rotatorio en soluciones de ácido nítrico y encontraron una
aparente energía de activación de 35 kJ mol-1 en 1 M HNO3 a o Volts y
sugireron que el proceso es controlado por reacción química o electroquímica.
A.G. Kholmogorov y col. [22]
estudiaron la disolución de concentrado
de sulfuro de plomo usando un sistema basado en nitratos [ PbS-HNO3Fe(NO3)3]. Como resultado las soluciones compuestas de [ Pb(NO3)2-HNO3H2O ] obtuvieron. La tecnología hidrometalúrgica para la síntesis de sales de
plomo con ácido nítrico y sulfato férrico en solución es mostrada en la figura 13.
33
HIDROMETALURGIA DEL PLOMO
PbS
Disolución de PbS en sales
Solución
Residuo insoluble
Precipitación de Pb
Recuperación de
(PbSO4, PbBr2, etc.)
PbSO4
S, Ag, Bi, etc.
Fe(NO3)2
K2CO3
Conversión a Fe(NO3)3
Carbonización
K2SO4
PbCO3
Disolución en disolvente
Orgánico e inorgánico
Solución de sales de plomo
Síntesis de sales de plomo
Figura 13.
Diagrama principal en hidrometalurgia par el procesamiento de
concentrados de PbS [23] .
34
ESTUDIO TERMODINAMICO
IV.
4.1
ESTUDIO TERMODINAMICO.
CONSTRUCCIÓN
DE
DIAGRAMAS
DE
DISTRIBUCIÓN
DE
ESPECIES.
La técnica usada para determinar los diagramas de distribución de
especies pueden ser ilustrados usando el sistema Plomo – Nitrato. Hay cinco
especies acuosas que pueden estar presentes en el sistema: Pb2+, PbNO3+,
Pb(NO3)2, Pb(NO3)3-, y Pb(NO3)42-.
En el sistema, la concentración total de especies de plomo esta dada
por:
{PbII} = {Pb2+} + {PbNO+} + {Pb(NO3)2} + {Pb(NO3)3-} + {Pb(NO3)42-}
(18)
Para cada especie, la reacción entre Pb y Nitrato puede escribirse:
Pb2+ + NO3- Æ PbNO3+
(19)
Pb2+ + 2NO3-Æ Pb(NO3)2-
(20)
Pb2+ + 3NO3-Æ Pb(NO3)3-
(21)
Pb2+ + 4NO3-Æ Pb(NO3)42-
(22)
Y para cada una de estas reacciones, la constante de equilibrio Kn
puede ser calculada de la energía libre estándar de la reacción usada:
∆G° = - RT ln (Kn)
(23)
En el equilibrio:
K2 =
{PbNO + }
{Pb 2 + }{NO3− }
(24)
35
ESTUDIO TERMODINAMICO
K3 =
{Pb( NO3 ) 2 }
{Pb 2 + }{NO3− }2
(25)
−
{PbNO3 )3 }
K4 =
{Pb 2 + }{NO3− }3
(26)
2−
{PbNO3 ) 4 }
K5 =
{Pb 2 + }{NO3− }4
(27)
Las cuales pueden reordenarse en la proporción de cada especie como
una función de la concentración de Pb2+ y NO3-:
{PbNO3+} = K2 {Pb2+} {NO3-}
2+
(28)
- 2
{Pb(NO3)2} = K3 {Pb } {NO3 }
(29)
{Pb(NO3)3-} = K4 {Pb2+} {NO3-}3
(30)
{Pb(NO3)42-} = K5 {Pb2+} {NO3-}4
(31)
Entonces, sustituyendo las ecuaciones (28) – (31) dentro de la ecuación
(18) da la concentración de plomo total en el sistema como función de {Pb2+} y
el pNO3:
{PbII} = {Pb2+} + K2{Pb2+}{NO3-} + K3{Pb2+}{NO3-}2 +
K4{Pb2+}{NO3-}3 +
K5{Pb2+}{NO3-}4
(32)
Factorizando y dividiendo por {Pb2+} da la fracción de iones en función
de la concentración de nitratos, por ejemplo pNO3:
{Pb 2 + }
1
=
−
− 2
−
−
II
{Pb }
(1 + K 2{NO3 } + K 3{NO3 } + K 4{NO3 }3 + K 5{NO3 }4
(33)
Sustituyendo este valor dentro de las ecuaciones (28) – (31) da la
fracción de las otras especies de plomo presentes en un amplio rango de
pNO3.
36
ESTUDIO TERMODINAMICO
4.2
DATOS TERMODINAMICOS.
Los datos termodinámicos usados son proporcionados por el programa
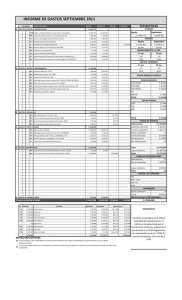
de computo Fact Sage, en diversos intervalos de temperatura. La Tabla 3
muestra los valores de la energía libre estándar de Gibbs de formación de
especies para los sistemas Ag(I)-HNO3, Fe(III)-HNO3, Pb(II)-HNO3.
La energía libre estándar de Gibbs de formación no esta tabulada para
todos los complejos de los sistemas arriba mencionados. La estabilidad de
estos fue deducida usando la constante de equilibrio presentada en la Tabla 4.
Tabla 3.
Energía libre estándar de Gibbs de formación de especies en los
sistemas
Ag(I)-HNO3, Fe(III)-HNO3, Pb(II)-HNO3, N(V)-HNO3, N(III)-HNO3 y
S(V)-HNO3 a 298.15, 373.15 y 413.15 K y 1 atm.
Especie
Estado
∆Gf° kJ/mol
298.15 K
373.15 K
413.15 K
H+
Acuoso
0
0
0
OH-
Acuoso
-226.744
-224.939
-223.265
H2O
Liquido
-306.686
-312.59
-316.223
H2
Gas
-38.930
-48.975
-54.519
O2
Gas
-61.132
-76.767
-85.296
Acuoso
83.731
77.921
74.622
Liquido
-157.790
-171.056
-178.949
Fe3+
Acuoso
45.649
69.137
81.586
FeNO32+
Acuoso
-121.754
-121.754
-121.754
Fe(NO3)3(S)*
Solidó
-707.495
-716.752
-721.690
Pb2+
Acuoso
-4.792
-5.245
-5.131
Acuoso
-257.879
-268.096
-272.525
Acuoso
-2.283
-0.751
-0.251
Ag+
AgNO3
*
PbNO3+
**
Pb(NO3)2**
Pb(NO3)3--
**
Acuoso
-759.287
-787.900
-800.594
Pb(NO3)42-
**
Acuoso
-1007.550
-1037.752
-1049.649
Acuoso
-251.188
-261.287
-266.118
NO3-
37
ESTUDIO TERMODINAMICO
HNO3
Líquido
-219.799
-23.428
-243.747
NO2-
Acuoso
-146.390
-155.904
-162.407
HNO2
Acuoso
-159.626
-168.983
-175.745
H2SO4
Liquido
-860.770
-873.788
-881.681
HSO4-
Acuoso
-929.613
-937.757
-944.625
SO42-
Acuoso
-914.844
-914.627
-913.453
Tabla 4.
Constantes de disociación para los sistemas Ag(I)-HNO3, Fe(III)-
HNO3, Pb(II)-HNO3, Cu(II)-HNO3 y Zn(II)-HNO3 a 298.15, 373.15 y 413.15 K y 1
atm. (I es el esfuerzo iónico de donde fueron adquiridos, todos de la referencia
[49]).
Constante de estabilidad
Reacción
Ag++NO3-ÆAgNO3
log k (298.15 K) log k (373.15 K) log k (413.15 K)
-0.2 (I=0)
Fe3++NO3-ÆFeNO32+
1.0 (I=0)
-0.62
-1.546
Pb2++NO3-ÆPbNO3+
0.33(I=1)
0.219
0.160
Pb2++2NO3-ÆPb(NO3)2
0.4(I=1)
0.105
0.032
Pb2++3NO3-ÆPb(NO3)3-
0.2(I=1)
-0.169
-0.366
Pb2++4NO3-ÆPb(NO3)42-
-0.3(I=1)
-1.776
-2.563
38
ESTUDIO TERMODINAMICO
4.3
DISTRIBUCIÒN DE ESPECIES DURANTE LA LIXIVIACIÒN.
En una solución de nitratos, el Ag(I), Fe(III) y Pb(II)
existen en varias
especies (Ag+, AgNO3, Fe3+, FeNO32+, Fe(NO3)3, Pb2+, PbNO3-, Pb(NO3)2,
Pb(NO3)3- y Pb(NO3)42-,).
En soluciones concentradas de ácido nítrico como solvente y sulfuros
minerales como solutos, la plata, el hierro y el plomo forman iones complejos
de acuerdo a las siguientes ecuaciones:
H+ + NO3-
Æ
HNO3
(34)
H+ + NO2-
Æ
HNO2
(35)
H+ + SO42-
Æ
HSO4-
(36)
2H+ + HSO4-
Æ
H2SO4
(37)
Ag+ + NO3-
Æ
AgNO3
(38)
Fe3+ + NO3-
Æ
FeNO32+
(39)
Æ
Fe(NO3)3
(40)
Pb2+ + NO3-
Æ
PbNO3-
(41)
PbNO3- + NO3-
Æ
Pb(NO3)2
(42)
Pb(NO3)2 + NO3-
Æ
Pb(NO3)3-
(43)
Pb(NO3)3- + NO3-
Æ
Pb(NO3)42-
(44)
3+
Fe
+ 3NO3
-
Como en otros sistemas de nitrato, la distribución de las especies
depende de la concentración de la solución. En el presente estudio, la
estabilidad para los sistemas Ag(I)-HNO3, Fe(III)-HNO3 y Pb(II)-HNO3 fueron
examinados. En una solución con estequiometrico de HNO3 y una
concentración de mineral del 2% en peso, Ag+, Fe3+ y Pb2+ y son las especies
predominantes. Los diagramas de estabilidad para estos sistemas a 413.15 K
se muestran en las diagramas 1 - 5. Por otra parte, al estar en solución de
ácido nítrico el azufre de los minerales producto de la lixiviación, produce iones
sulfatos que al estar en contacto con los iones metálicos producen una gran
cantidad de iones complejos. La estabilidad para los sistemas Ag(I)-SO4,
Ca(II)-SO4, Fe(III) -SO4 y Pb(II) -SO4 se muestran en los diagramas 6 – 9.
39
ESTUDIO TERMODINAMICO
1.0
Fracción de Especies
0.8
413.15 K
-
NO3
HNO3
0.6
-
NO2
HNO2
0.4
0.2
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 1. Distribución relativa de especies iónicas para el sistema N(V)HNO3 y N(III)-HNO3 a 413.15 K.
1.0
Fracción de Especies
0.8
413.15 K
0.6
-
SO4
-
HSO4
H2SO4(aq)
0.4
0.2
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 2. Distribución relativa de especies iónicas para el sistema S(VI)H2SO4 a 413.15 K.
40
ESTUDIO TERMODINAMICO
1.0
Fracción de Especies
0.8
413.15 K
2+
0.6
Pb
+
PbNO3
Pb(NO3)2(aq)
0.4
-
Pb(NO3)3
2-
Pb(NO3)4
0.2
0.0
-2
0
2
4
6
8
10
12
14
pNO3
Diagrama 3. Distribución relativa de especies iónicas para el sistema Pb(II)HNO3 a 413.15 K.
Fracción de Disolución
1.0
0.8
413.15 K
0.6
+
Ag
AgNO3(aq)
0.4
0.2
0.0
-2
0
2
4
6
pNO3
8
10
12
14
Diagrama 4. Distribución relativa de especies iónicas para el sistema Ag(I)HNO3 a 413.15 K.
41
ESTUDIO TERMODINAMICO
1.0
Fracción de Especies
0.8
413.15 K
3+
Fe
2+
FeNO3
0.6
0.4
0.2
0.0
-2
0
2
4
6
8
10
12
14
pNO3
Diagrama 5. Distribución relativa de especies iónicas para el sistema Fe(III)HNO3 a 413.15.15 K.
Fracción de Especies
-2
0
2
4
6
8
10
12
14
1.0
1.0
0.8
0.8
413.15 K
+
0.6
0.6
Ag
AgSO4
Ag2SO4(S)
0.4
0.4
0.2
0.2
0.0
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 6. Distribución relativa de especies iónicas para el sistema Ag(I)-SO4
a 413.15.15 K.
42
ESTUDIO TERMODINAMICO
Fracción de Especies
-2
0
2
4
6
8
10
12
14
1.0
1.0
0.8
0.8
413.15 K
2+
Ca
CaSO4(aq)
0.6
0.6
CaSO4(S)
0.4
0.4
0.2
0.2
0.0
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 7. Distribución relativa de especies iónicas para el sistema Ca(II)SO4 a 413.15.15 K.
Fracción de Especies
-2
0
2
4
6
8
10
12
14
1.0
1.0
0.8
0.8
413.15 K
3+
Fe
+
FeSO4
0.6
0.6
-
Fe(SO4)2
0.4
0.4
0.2
0.2
0.0
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 8. Distribución relativa de especies iónicas para el sistema Fe(III)SO4 a 413.15.15 K.
43
ESTUDIO TERMODINAMICO
-2
0
2
4
6
8
10
12
14
1.0
1.0
Fracción de Especies
0.8
0.8
413.15 K
2+
Pb
PbSO4(S)
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 9. Distribución relativa de especies iónicas para el sistema Pb(II)-SO4
a 413.15.15 K.
4.4
CONSTRUCCIÓN DE LOS DIAGRAMAS POURBAIX (E-pH) DEL
SISTEMA Pb-N-S-H2O A DIFERENTES TEMPERATURAS.
En la actualidad el rápido incremento en el uso de diagramas E-pH es
sorprendente, estos muestran la relación de estabilidad de los minerales. Los
diagramas E-pH son representaciones graficas de los dominios de estabilidad
de iones metálicos, óxidos, sulfuros y otras especies en solución. Estas líneas
muestran los límites entre dos dominios y expresan el valor del potencial de
equilibrio entre dos especies como una función del pH. Para realizar los
cálculos termodinámicos, tales como los potenciales estándar químicos se
utilizan la ecuación de Nernst.
Los diagramas E-pH proporcionan una
expresión grafica de la ley de Nernst. La ecuación de Nernst es de utilidad para
determinar el cambio de energía libre de una reacción [42].
44
ESTUDIO TERMODINAMICO
Estos diagramas dan el equilibrio de las reacciones ácido - bases
independientemente de los potenciales. Estos equilibrios se representan por
líneas verticales o diagonales, en específico para el pH. Los diagramas E-pH
organizan el tipo de información muy importante que son usados en la
disolución de minerales. Haciendo estos es posible predecir las posibles
reacciones que se llevaran a cabo en condiciones específicas de Potencial y
pH.
Los diagramas Potencial – pH son dibujados con el pH sobre el eje
horizontal y el voltaje sobre el eje vertical[42]. Considerando una reacción
generalizada envolviendo n electrones:
aA + mH+ + ne
=
bB + dH2O
(45)
El potencial electroquímico de equilibrio, E, para esta reacción esta dada
por la ecuación de Nerst:
E = E° +
2.303RT
{ A}a {H + }m
log
nF
{B}b {H 2O}d
Volts
(46)
Donde E°, R, T y F son el potencial electroquímico de equilibrio
estándar, la constante universal de los gases, temperatura absoluta y la
constante de Faraday. {i} denota la actividad termodinámica de i. Cuando
graficamos sobre un diagrama E-pH, la ecuación (46) genera una pendiente
2.303
RTm
V
con unidades
. La posición de cada línea depende de la
nF
pH
magnitud de {A} y {B}. Si estas son sólidos puros, la actividad es la unidad.
Para sustancias iónicas, acuosas o gaseosas, la actividad debe ser
especificada; generalmente estos valores son apropiados para una aplicación
especifica.
Las reacciones no necesariamente envuelven un cambio en el estado de
oxidación. Para la reacción general:
45
ESTUDIO TERMODINAMICO
aA + mH+
=
bB + dH2O
(47)
la energía libre de Gibbs de la reacción, determina la posición de
equilibrio:
∆G° = -RT ln
{B}b {H 2O}d
{ A}a {H + }m
(48)
Para una actividad especifica de A y B, la línea de equilibro depende de
un pH especifico:
ΔG°
{B}b {H 2O}d
pH = - log
a
{ A}
2.303RT
(49)
Este pH es independiente del potencial. Las especies A es la más básica
de los compuestos envueltos y predominan a valores de pH altos, a la inversa,
las especies B predominan a valores de pH bajos.
4.4.1 ACTIVIDAD DE LOS IONES HIDROGENO
En las soluciones acuosas siempre existe cierta cantidad de iones
hidrógeno la cual puede relacionarse con su actividad química. Debido a la
facilidad de la técnica experimental, la actividad de los iones hidrógeno ha sido
usada como una variable característica en las soluciones acuosas. Esta
actividad generalmente se expresa en forma logarítmica lo que da lugar al
término llamado pH:
pH = -log10 a H+
(50)
Muchas reacciones pueden expresarse en términos del parámetro pH,
no solamente soluciones ácidas sino también aquellas en la que intervienen
óxidos, hidróxidos, sales, carbonatos, silicatos, sulfuros y fosfuros. En nuestro
46
ESTUDIO TERMODINAMICO
caso, la disolución de la galena (PbS) en ácido sulfídrico se representa
mediante:
PbS(S) + 2H+ + 2e- → Pb(S) + H2S(g)
(51)
En condiciones de equilibrio, las únicas variables serán las actividades la
actividad del H+ [40]. La constante de equilibrio se escribe:
log10K = log10[ 1 / a2H+ ]
(52)
Acomodando y sustituyendo pH = -log10 aH+ se obtiene:
log10K = 2pH
(53)
La mayor parte de las veces, se dispone de diagramas E - pH a 298.15
K, pero no se tiene información termodinámica de compuestos y especies en
estado acuoso a temperaturas elevadas. Debido a esto se llevo a cabo la
construcción de estos diagramas de equilibrio a diferentes temperaturas. Los
datos termodinámicos a fueron tomados de un programa de computadora Fact
Sage a diferentes intervalos de temperatura. La Tabla 6 muestra los valores de
la energía libre estándar de Gibbs de formación de especies para el sistema
Pb – N – S – H2O a 413.15 K. La Tabla 7 muestra las líneas de equilibrio para
el sistema Pb – N – S – H2O a 413.15 K y 10 atm.
Tabla 5.
Energía libre estándar de Gibbs de formación de especies en el
sistema Pb – N – S – H2O, a 413.15 K y 10 atm.
Especies
Datos
∆G(kJ/mol) ∆G(Kcal/mol)
Pb, N , S gases:
1
N2(g)
FACT
-91.877
-21.959
2
H2S(g)
FACT
-119.323
-28.519
Pb, N , S liquidas:
3
HONO2(l)
FACT
-251.81
-60.184
4
H2SO4(H2O)(l)
FACT
-1237.343
-295.732
47
ESTUDIO TERMODINAMICO
Pb, N , S especies acuosas :
5
N2(aq)
FACT
-64.092
-15.318
6
NH3(aq)
FACT
-132.95
-31.776
7
NH4+
FACT
-186.758
-44.636
8
ONO-
FACT
-166.269
-39.739
9
NO3-
FACT
-272.764
-65.192
10
HONO(aq)
FACT
-179.999
-43.021
11
S2-
FACT
40
9.56
12
HS-
FACT
-42.117
-10.066
13
H2S(aq)
FACT
-97.766
-23.367
14
SO2(aq)
FACT
-401.735
-96.017
15
SO42-
FACT
-910.539
-217.624
16
S2O82-
FACT
-1468.455
-350.969
17
HSO4-
FACT
-956.13
-228.521
18
H2S2O4(aq)
FACT
-616.722
-147.4
19
Pb2+
FACT
-4.395
-1.05
Pb, N , S sólidos:
20
S(s)
FACT
-16.206
-3.873
21
S(s2)
FACT
-16.327
-3.902
22
Pb(s)
FACT
-31.84
-7.61
23
PbO(s)
FACT
-252.887
-60.441
24
PbO(s2)
FACT
-252.625
-60.379
25
PbO2(s)
FACT
-311.259
-74.393
26
Pb(OH)2(s)
FACT
-452.2
-108.078
27
PbS(s)
FACT
-143.718
-34.349
28
PbSO4(s)
FACT
-994.961
-237.801
29
PbSO4(s2)
FACT
-990.131
-236.647
30
PbOPbSO4(s)
FACT
-1276.001
-304.972
Otros gases:
31
H2(g)
FACT
-63.044
-15.068
32
O2(g)
FACT
-98.307
-23.496
Otros líquidos:
48
ESTUDIO TERMODINAMICO
33
H2O(l)
FACT
-322.229
-77.015
Otras especies acuosas:
Tabla 6.
34
H+
FACT
0
0
35
OH-
FACT
-219.826
-52.54
36
e-(aq)
ELEM
-31.295
-7.48
Líneas de equilibrio sistema Pb–N–S–H2O a 413.15 K y 10 atm.
Número
1
Reacción
PbO2+S2O82-+2H++2eÆPbO2+2HSO4-+2NO3-
Línea de equilibrio
2.01-0.0825pH−
{HSO4 }2
0.0206log
2−
{S 2O8 }
2
PbO2+S2O82-+NO3-+2eÆPbO2+2SO42-+NO3-
{SO4 }2
2.01-0.041log
2−
{S 2O8 }
3
PbO2+SO42-+NO3-+H+ÆPbO2+HSO4-+NO3-
pH=3.94
4
2PbO2+HSO4-+NO3-+3H+ÆPbO2+HSO4-+NO3-
1.758-0.163pH-
2−
−
0.041log {HSO4 }
5
6
7
2PbO2+SO42-+NO3-+4H++2eÆPbO2+PbSO4
1.5964-0.164pH-
+NO3-+2H2O
0.041log {SO4 }
PbSO4+PbO2+NO3-+4H++2eÆPbSO4+Pb2+
1.4398-0.123pH-
+NO3-+2H2O
0.041log {Pb 2+ }
2PbSO4+PbO2+NO3-
1.2253-0.0819pH
2−
+2H++2eÆPbO.PbSO4+PbSO4+NO3-+H2O
8
PbO.PbSO4+PbSO4+NO3-
pH=2.6188-0.5log {Pb 2+ }
+2H+Æ2PbSO4+Pb2++NO3-+H2O
9
PbSO4+Pb2++2NO3-+12H++10eÆPbSO4+Pb2+
+N2+6H2O
10
PbO.PbSO4+PbSO4+2NO3-+12H++10eÆ
PbO.PbSO4+PbSO4+N2+6H2O
11
PbO.PbSO4+PbSO4+N2+2H+Æ
1.2159-0.0984pH0.0082log
pN 2
−
{NO3 }2
1.2159-0.0984pH0.0082log
pN 2
−
{NO3 }2
pH=2.6188-0.5log {Pb 2+ }
2PbSO4+Pb2++ N2+H2O
12
PbSO4+Pb2++N2+8H++6eÆ2Pb2++S+N2+4H2O
0.2432-0.1093pH-
49
ESTUDIO TERMODINAMICO
0.0137log {Pb 2+ }
13
PbSO4+Pb2++N2+8H++8eÆPbS+Pb2++N2+
0.2652-0.082pH
4H2O
14
PbO.PbSO4+PbSO4+N2+8H++8eÆ
0.2652-0.082pH
PbO.PbSO4+PbS+N2+4H2O
15
Pb2++S+N2+8H++6eÆPb2++S+2NH4+
0.2124-0.1093pH+
0.014log
{NH 4 }2
pN 2
16
2Pb2++S+N2+2eÆPbS+Pb2++N2
0.3311+0.0409log{Pb2+}
17
Pb2++S+NH4++2H++2eÆPb2++H2S+NH4+
0.1976-0.082pH
18
2Pb2++S+NH4++2eÆPbS+Pb2++NH4+
0.3311+0.0409log {Pb 2+ }
19
PbS+Pb2++N2+8H++6eÆPbS+Pb2++2NH4+
0.2124-0.1093pH+
{NH 4 }2
0.014log
pN 2
20
PbS+Pb2++N2+2eÆPbS+Pb+N2
21
PbO.PbSO4+PbS+N2+10H++8eÆ 2PbS+Pb2+ 0.3188-0.1025pH
22
-0.1665+0.041 {Pb 2+ }
+N2+5H2O
+0.041 {Pb 2+ }
PbS+Pb2++NH4++2H+Æ2Pb2++H2S+NH4+
pH=-1.62860.5log
{Pb 2+ }2
pH 2 S
23
Pb2++H2S+NH4++2eÆPb+H2S+NH4+
-0.1665+0.041 {Pb 2+ }
24
PbS+Pb2++NH4++2eÆPbS+Pb+NH4+
-0.1665+0.041 {Pb 2+ }
25
PbS+Pb+N2+8H++6eÆPbS+Pb+2NH4+
0.2019-0.1093pH+
0.014log
26
PbS+Pb+NH4++2H++2eÆ2Pb+H2S+NH4+
{NH 4 }2
pN 2
-0.3-0.082pH0.041log pH 2 S
27
O2+4H++4eÆ2H2O
1.13610.082pH+0.025log pO2
28
2H++2eÆH2
0.0011-0.082pH0.041log pH 2
50
ESTUDIO TERMODINAMICO
4.5
Estudio termodinámico de lixiviación de galena con acido nítrico.
La Lixiviación con ácido nítrico de concentrados y minerales sulfurosos
es un método atractivo para la recuperación de metales básicos, debido a que
el HNO3 es un fuerte agente lixiviante y este puede ser fácilmente reciclado por
la adición de oxigeno directamente en la mezcla de lixiviación o usando una
oxidación externa de Oxido Nitroso (NO). Varios métodos basados en el ácido
nítrico para el procesamiento de concentrados y minerales de metales noferrosos han sido propuestos y examinados, pero no aparecen operando en las
plantas comerciales en el presente. Un importante defecto de la lixiviación de
ácido nítrico es la oxidación del azufre contenido en la galena a azufre
elemental y sulfato, en muchos de los casos en partes iguales. Esto resulta en
un incremento del consumo de ácido nítrico y la necesidad de usar el sulfato,
aumentando el costo del tratamiento de la solución y la regeneración del ácido.
La Hidrometalurgia del Plomo es complicada por la baja solubilidad de la
mayoría de las sales de plomo, una gran ventaja de los electrolitos de los
nitratos como el nitrato de plomo que es altamente soluble, la pierde cuando se
encuentran presentes los iones sulfatos en el caso de la lixiviación
convencional de plomo con ácido nítrico debido a la conversión de PbS(S) a
PbSO4(S).
51
ESTUDIO TERMODINAMICO
4.6
Estudio Termodinámico de Lixiviación ácida con HNO3 a elevada
presión y temperatura.
Para el análisis termodinámico de la lixiviación a presión, se parte de los
diagramas E-pH para los sistemas Pb-N-S-H2O y Ag-N-S-H2O a 413.15 K en
un intervalo de pH de -2 a 4 y un voltaje de -2 a 2 V que están representados
en el Diagrama 10.
-2
-1
2.0
0
1
2
413.15 K
1.5
E (volts)
4
+HSO +NO
PbO
4
3
2(S)
Pb SO
2+
4(s) +Pb +NO 3
2+
PbSO
+Pb +N
4(s)
2(g)
0.5
(6)
(5)
2+
+
Pb +H2S(g)+NH4
3
(s)
(3) PbO.PbSO4(s)+PbSO4(S)+N2(g)
PbO.PbSO
+N
+PbS
(4)
4(s)
(S)
2(g)
(5) Pb2++S(S)+N2(g)
+
(6) Pb2++S(S)+NH4
-1.5
1.0
(3)
0.5
0.0
(4)
+
PbS +Pb +NH
(s)
(s)
4
(1) PbO2 +SO42-+NO
3
(s)
(2) PbO.PbSO4 +PbSO4(S)+NO -
-1.0
1.5
(2)
PbS
2+
(s) +Pb +N
2(g)
2+
+
PbS(s)+Pb +NH4
-
-0.5
2.0
(1)
PbO
2(S) +PbSO
4 +NO3
1.0
0.0
3
2PbO
+S O +NO3
2(S) 2 8
-0.5
-1.0
+
Pb(s)+H2S(g)+NH4
-1.5
-2.0
-2.0
-2
-1
0
1
2
3
2
3
4
pH
-2
-1
0
2.0
1
-
-
-
E(Volts)
1.0
-
Ag2SO4(S)+AgSO4 +N2(g)
-
AgSO4 +Ag(S)+N2(g)
0.5
Ag S +H S
2 (S)
2 (g) +NH
0.0
(2)
Ag(S)+HSO4 +N2(g)
0.0
+
4
-0.5
0.5
-
(1)
(3)
2.0
1.5
-
AgSO4 +Ag2O3(S)+NO3
-
Ag2SO4(S)+AgSO4 +NO3
1.0
-
Ag2O3(S)+S2O8 +NO3
Ag2O3(S)+HSO4 +NO3
1.5
4
2-
-
(4)
-0.5
413.15 K
-
-1.0
-1.5
(1) Ag2S(S)+HSO4 +N2(g)
(2) Ag2S(S)+S(S)+N2(g)
+
(3) Ag2S(S)+S(S)+NH4
(4) Ag2S(S)+H2S(g)+N2(g)
-1.0
+
Ag(S)+H2S(g)+NH4
-1.5
-2.0
-2.0
-2
-1
0
1
2
3
4
pH
Diagrama 10.Diagramas de equilibrio para los sistemas Pb-N-S-H2O y Ag-N-SH2O a 413.15 K. Actividad de [Pb]=0.21, [Ag]=1x10-4, [N]=1.0, pO2=10 atm y
[S]=0.21.
52
ESTUDIO TERMODINAMICO
Las reacciones propuestas para la lixiviación de Galena y Argentita con
HNO3 son:
2PbS(S)+2NO3-+4H++O2(g) Æ Pb2++S(S)+PbSO4(S)+2NO(g)+2H2O(l)
(54)
-1
ΔG413.15=-737.824 kJ mol
2Ag2S(S)+2NO3-+4H++5O2(g)+4eÆ2AgSO4-+Ag2SO4(S)+2NO(g)+2H2O(l)
(55)
ΔG413.15= -1,890.230 kJ mol-1
De acuerdo a los ΔG de las reacciónes y al diagrama E-pH, se tiene que
la disolución de la Galena es posible llevarse a cabo desde un intervalo de pH
de -2 a 3 y un voltaje de .0.2 a 1.7 V donde se desarrollara el trabajo, con la
formación de Pb2+, PbSO4(S) y S(S) para la zona de estabilidad del agua en la
zona de oxidación ácida de los diagramas.
Para la Argentita la reacción es posible de acuerdo a su ΔG y al
diagrama E-pH 10, se observa que la lixiviación sucede dentro de un intervalo
de pH de -2 a 2 y un voltaje de 0.2 a 1.9 V con la formación de AgSO4-,
Ag2SO4(S) y S(S).
Podemos ver que durante los intervalos de trabajo, estamos produciendo
iones sulfato que reaccionan con los iones metálicos formando PbSO4(S) y
Ag2SO4(S). Lo cual se comprueba de acuerdo al Diagrama de Pourbaix (11)
para el sistema S-H2O y el diagrama de complejación del sistema S(VI)- H2O,
se están produciendo iones HSO4- en la región ácida de lixiviación que con la
presencia de O2 gaseoso reacciona formando iones sulfatos de acuerdo:
HSO4-+1/2O2(g)+2eÆ2SO42-+H2O(l)
(56)
ΔG413.15= -156,923 kJ mol-1
El ión sulfato al estar en contacto con los iones Pb2+ y Ag+ producidos en
la lixiviación, reaccionaran formando PbSO4(S) y Ag2SO4(S) de acuerdo a las
siguientes reacciones:
53
ESTUDIO TERMODINAMICO
Pb2+ + SO42- ÆPbSO4(S)
(57)
ΔG413.15= -64.924 kJ mol-1
2Ag+ + SO42- ÆAg2SO4(S)
(58)
-1
ΔG413.15= -93.431 kJ mol
-2
0
2
4
6
2.0
8
10
12
2-
2.0
413.15 K
S2O8
1.5
14
1.5
O2
1.0
1.0
-
HSO4
E (Volts)
0.5
0.5
S(l)
0.0
-0.5
H2O
2-
SO4
0.0
-0.5
H2S(g)
-1.0
H2
H2S(aq)
-1.0
log pH2S=0
-
HS
2-
S
-1.5
-1.5
-2.0
-2.0
-2
0
2
4
6
8
10
12
14
pH
1.0
Fracción de Especies de S
0.8
413.15 K
0.6
-
SO4
-
HSO4
H2SO4(aq)
0.4
0.2
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 11. Diagramas de equilibrio y de especies para los sistemas S-H2O y
S(VI)-H2O a 413.15 K. Actividad de pO2=10 atm y [S]=0.21.
54
ESTUDIO TERMODINAMICO
Como se puede observar en los diagramas de complejación para los
sistemas Pb(II)-SO4 y Ag(I)-SO4 del Diagrama 12, en donde las especies
predominantes son el PbSO4(S) y el Ag2SO4(S).
Fracción de Especies de Pb
-2
0
2
4
6
8
10
12
14
1.0
1.0
0.8
0.8
413.15 K
0.6
0.6
2+
Pb
PbSO4(S)
0.4
0.4
0.2
0.2
0.0
0.0
-2
0
2
4
6
8
10
12
14
8
10
12
14
pH
Fracción de Especies de Ag
-2
0
2
4
6
1.0
1.0
0.8
0.8
413.15 K
+
0.6
0.6
Ag
AgSO4
Ag2SO4(S)
0.4
0.4
0.2
0.2
0.0
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 12.Diagramas de especies para los sistemas Pb(II)-SO4 y Ag(I)-SO4
a 413.15 K.
55
ESTUDIO TERMODINAMICO
Por lo anterior y debido a que la termodinámica predice la precipitación
del Pb y Ag en forma de PbSO4(S) y el Ag2SO4(S) y no puede alcanzarse la
disolución del concentrado de Plomo al 100%, se adiciona al sistema Nitrato de
Calcio para ver el efecto que tiene en la lixiviación.
Diagrama 13 muestra el diagrama de Pourbaix para el sistema Ca-NH2O y a 413.15 K, donde se observa que el ión calcio se encuentra dentro de
un intervalo de pH de -2 a 7 y un voltaje de -1 a 2 V. De la Diagrama 13
muestra el diagrama de Pourbaix para el sistema Ca-S-H2O a 413.15 K, se
observar que el ión calcio puede precipitarse desde un intervalo de pH -2 a 7
un voltaje de
-1 a 2 V en forma de CaSO4(S) y la Diagrama 14 muestra el
diagrama de complejación para el sistema Ca(II)-SO4 a 413.15 K donde se
observa que desde un intervalo de pH de -2 a 4 el CaSO4(S) es la sustancia
predominante. Por lo anterior el ión calcio en presencia del ión sulfato se
precipitara formando sulfato de calcio de acuerdo a:
Ca2+ + SO42- ÆCaSO4(S)
(59)
ΔG413.15= -45.662 kJ mol-1
-2
0
2
4
6
8
10
12
14
2.0
16
413.15 K
1.5
2+
-
1.5
-
Ca +NO3
CaO2(S)+NO3
1.0
E (Volts)
2.0
1.0
0.5
0.5
2+
Ca +N2(g)
-
0.0
-0.5
2+
+
Ca +NH4
Ca(OH)2(S)+NO3
0.0
Ca(OH)2(S)+N2(g)
-0.5
2+
-1.0
-1.0
Ca +NH3(aq)
-1.5
Ca(OH)2(S)+NH3(aq)
+
CaH2(S)+NH4
-2.0
-2
0
2
4
-1.5
CaH2(S)+NH3(aq)
6
8
10
-2.0
12
14
16
pH
Diagrama 13.Diagrama de equilibrio para el sistema Ca-N-H2O a 413.15 K.
Actividad de [Ca]=0.5, [N]=1.0 y pO2=10 atm.
56
ESTUDIO TERMODINAMICO
-2
0
2
4
6
8
2.0
12
14
2-
-
2.0
1.5
2+
1.0
16
413.15 K
CaO2(S)+S2O8
-
CaO2(S)+HSO4
Ca +HSO4
1.5
2-
CaO2(S)+SO4
CaO2(S)+CaSO4(S)
Ca(OH)2(S)+CaSO4(S)
2+
Ca +CaSO4(S)
0.5
2+
Ca +S(S)
0.0
-0.5
2+
-
Ca +H2S(g)
Ca +HS
E (Volts)
10
2+
-1.0
1.0
0.5
0.0
2-
Ca(OH)2(S)+SO4
-0.5
-1.0
-
Ca(OH)2(S)+HS
2-
-1.5
Ca(OH)2(S)+S
CaH2(S)+H2S(g)
-
CaH2(S)+HS
-2.0
-2
0
2
4
6
8
-1.5
2-
CaH2(S)+S
10
-2.0
12
14
16
pH
Fracción de Especies de Ca
-2
0
2
4
6
8
10
12
14
1.0
1.0
0.8
0.8
413.15 K
2+
0.6
0.6
Ca
CaSO4(aq)
CaSO4(S)
0.4
0.4
0.2
0.2
0.0
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 14. Diagramas de equilibrio y de especies para los sistemas Ca-SH2O y Ca(II)-SO4 a 413.15 K. Actividad de [Ca]=0.5, [S]=0.21 y pO2=10 atm.
Por lo anterior al adicionar iones Ca2+ al sistema, habrá una competencia
con los iones Pb2+ y Ag+ para combinarse con los iones SO42- producidos
durante la lixiviación.
57
ESTUDIO TERMODINAMICO
De acuerdo al diagrama de Pourbaix para el sistema N-H2O a 413.15 K
del Diagrama 15, el ión nitrato es producido debido a la disolución del ácido
nítrico de acuerdo:
HNO3(l) Æ H+ +NO3-
(60)
-1
ΔG413.15= -212.58 kJ mol
El diagrama de distribución de especies del Diagrama 15 para el sistema
N(V)-H2O puede verse que la especie predominante es el ión nitrato en todos
los intervalos de pH.
El oxido nitroso es producido de acuerdo:
NO3- + 4 H+ Æ NO(g) + 2 H2O
(61)
ΔG413.15= -369.022 kJ mol-1
El oxido nitroso es liberado durante la lixiviación de los sulfuros
metálicos y en presencia de oxigeno y agua es convertido nuevamente a
HNO3(l) de acuerdo:
2 NO(g) + 3/2 O2(g) + H2O(l) Æ HNO3(l)
(62)
ΔG413.15= -40.909 kJ mol-1
La formación de azufre elemental de acuerdo al diagrama de Pourbaix
del sistema S-H2O a 413.15 K del Diagrama 13, se produce por la formación
del ión HSO4- durante la lixiviación ácida de acuerdo a:
HSO4-+ 7 H+ +6eÆS(l) + 4H2O(l)
(63)
-1
ΔG413.15= -171.102 kJ mol
De acuerdo a los Diagramas de Pourbaix y de distribución de especies
se explica la factibilidad del proceso de lixiviación ácida de concentrados de
Plomo a elevada temperatura y condiciones oxidantes.
58
ESTUDIO TERMODINAMICO
-2
0
2
4
6
8
10
12
14
2.0
2.0
1.5
1.0
E (Volts)
1.5
-
NO3
NO
N2O
N2
413.15 K
1.0
HNO2
0.5
0.5
0.0
0.0
-
NO2
NH3(aq)
-1.0
-0.5
log pNH3=0
-0.5
+
NH4
-1.5
-1.0
NH3(g)
-1.5
-2.0
-2.0
-2
0
2
4
6
8
10
12
14
pH
Fracción de Especies de N(V)
1.0
0.8
413.15 K
-
NO3
0.6
HNO3
-
NO2
0.4
HNO2
0.2
0.0
-2
0
2
4
6
8
10
12
14
pH
Diagrama 15. Diagramas de equilibrio y de especies para los sistemas N-H2O y
N(V)-H2O a 413.15 K. Actividad de [N]=1.0 y pO2=10 atm.
59
DESARROLLO EXPERIMENTAL
V.
DESARROLLO EXPERIMENTAL.
5.1
MATERIALES Y REACTIVOS.
Los materiales que se utilizaron para realizar la experimentación son:
5.1.1 CONCENTRADO DE PLOMO
El concentrado de plomo fue proporcionado por la Compañía Metalúrgica
Mexicana Peñoles S.A. y C.V., de Torreón Coahuila.
5.1.2 REACTIVOS
La Tabla 7 muestra los reactivos que se usaron durante la experimentación con su
respectivo porcentaje de pureza.
Tabla 7. Reactivos usados.
RECTIVOS
Agua Desionizada
PUREZA (%)
-
Ácido Nítrico (HNO3)
69.1
Nitrato de Calcio (Ca(NO3)2)
99.9
Quebracho
Oxigeno
99.9
60
DESARROLLO EXPERIMENTAL
5.2
SECUENCIA DE LA EXPERIMENTACIÓN.
La experimentación se efectuó de acuerdo al siguiente procedimiento:
1. La muestra mineral se llevo a análisis químico en el espectrofotómetro de
absorción atómica.
2. La solución lixiviante se preparo agregando ácido nítrico en agua destilada,
si es al 100% del estequiometrico se adiciona 16.6 ml de HNO3 para
preparar 1.5 litros de pulpa.
3. Se pesa 30.48 gramos de mineral que corresponde al 2 % de pulpa y este
se encapsula en vidrio de boro silicato.
4. La solución lixiviante y el mineral encapsulado se agregan al reactor, el
mineral encapsulado se coloca al lado de la propela del reactor.
5. Se enciende el equipo y se establecen las condiciones de experimentación.
6. Al llegar a la temperatura deseada, se enciende el motor del tacómetro para
que la propela rompa la cápsula de vidrio y a partir de este momento es el
tiempo cero de la experimentación.
7. Cada 30 minutos se tomaran muestras de 5 ml. Hasta completar las 4 horas
de experimentación. Las muestras se diluyen en agua destilada 1/1000 en
volumen, para su posterior análisis en espectrofotómetro de absorción
atómica.
8. La solución se filtra y se seca para su posterior análisis en Difracción de
RX y MEB.
61
DESARROLLO EXPERIMENTAL
5.3
DIAGRAMA DEL PROCESO.
La figura 14 representa en forma esquemática el proceso de lixiviación a alta
presión.
AGUA
DESTILADA
CONCENTRADO DE
GALENA
ÁCIDO NÍTRICO
TE
REACTOR
AUTOCLAVE
OXÍGENO
SURFACTANTE
MUESTRA
DILUCIÓN
FILTRACIÓN
ANALIZAR EN EL
ESPECTROFOTÓMETRO DE
ABSORCIÓN ATÓMICA
PRODUCTO
SÓLIDO
ANALIZAR EN EL
ESPECTROFOTÓMETRO DE
A.A. E INFRARROJO Y
DIFRACTÓMETRO DE RAYOS
X Y MEB
PRODUCTO
LÍQUIDO
ANALIZAR EN EL
ESPECTROFOTÓMETRO DE
ABSORCIÓN ATÓMICA
Figura 14. Diagrama del proceso.
62
DESARROLLO EXPERIMENTAL
5.4
EQUIPO.
1. El equipo a emplear en la caracterización mineralogica del concentrado
será un microscopio estereográfico y difractómetro de RX. Para el análisis
químico una muestra de concentrado previamente a homogenizar es
disuelta y analizada en el espectrofotómetro de absorción atómica.
2. Para las pruebas de lixiviación el equipo a emplear, es un reactor a presión
(AUTOCLAVE) de titanio grado 4, de 2 litros de capacidad, marca Parr.
El reactor se muestra en la Figura 15.
El reactor es calentado externamente por medio de resistencias eléctricas
que están conectados a un controlador de temperatura, que por medio de
un termopar registran la temperatura y permiten el control con una variación
de ± 2 °C. El reactor cuenta con un controlador de la velocidad de agitación.
Además cuenta con un sistema de válvulas en la parte superior, por donde
se introducen los gases (Oxigeno), se purga el reactor y tiene una válvula
de seguridad; cuenta con un tubo muestreador y un termopozo donde se
coloca el termopar, así como un sistema de enfriamiento en la parte
superior. La presión del sistema es registrada en un manómetro colocado
en la parte superior del reactor. La inyección de Oxigeno se realiza a través
de un regulador conectado entre un tanque de Oxigeno y el Autoclave.
3. La Tabla 8 muestra el equipo a usar para la caracterización del mineral y el
producto resultante.
63
DESARROLLO EXPERIMENTAL
Tabla 8. Equipos a usar.
EQUIPO
FUNCIÓN
Reactor autoclave de 2 L (FIGURA 19 Y 20 )
Análisis químico
Equipo de Espectrofotometría de Absorción
Atómica
Equipo de Espectrofotometría de Infrarrojo
Caracterización
Caracterización
Equipo de Difracción de Rayos X
Caracterización
Equipo de Microscopio Electrónico de Barrido
Caracterización
1.
VÁLVULA DE INTRODUCCIÓN DE GASES
2.
VÁLVULA DE MUESTREO
3.
VÁLVULA DE SEGURIDAD MANÓMETRO
4.
MANÓMETRO
5.
VÁLVULA DE PURGA
6.
SISTEMA DE ENFRIAMIENTO
7.
TERMOPOZO
8.
AGITADOR
9.
PROPELA
10.
TUBO MUESTREADOR
Figura 15. Reactor experimental de 2 L de capacidad (autoclave).
64
DESARROLLO EXPERIMENTAL
5.5
ESTABLECIMIENTO DE LAS CONDICIONES DE EXPERIMENTACIÓN.
Existen distintas variables que afectan al proceso de Lixiviación de Galena y
Argentita con HNO3 como son Temperatura, Velocidad de Agitación, Presión de
Oxigeno, Volumen del Surfactante, Tamaño de Partícula y Volumen de Ácido
Nítrico, entre otras, pero en nuestro caso solo contemplaremos tres, las cuales
son:
1. Temperatura: El intervalo de trabajo es de 100 a 140°C, debido que a
119°C es el punto de fusión del azufre elemental y se puede observar el
efecto de la formación de este durante la lixiviación.
2. Presión de Oxigeno: Las condiciones de trabajo serán de 413.57 kPa a 965
kPa (5 – 10 atm) para saber las mejores condiciones de disolución de
mineral con este agente oxidante.
3. Velocidad de agitación: Se trabajará en el intervalo de 300 a 700 rpm y se
tomara como base para la experimentación las pruebas a 500 rpm.
4. Concentración de HNO3: La concentración de ácido se maneja de acuerdo
a la cantidad estequiometrica de HNO3 requerida en la lixiviación y se
desarrollan las pruebas en relación al % de exceso del estequiometrico, en
un intervalo de 0.18 M (Estequiometrico) a 2.0 M.
5. Surfactante: Por disponibilidad
el reactivo surfactante empleado es el
Quebracho se realizán las pruebas de 3 a 7
ml. Para encontrar las
condiciones optimas de disolución.
65
DESARROLLO EXPERIMENTAL
Sobre la base de un diseño factorial, se establecerán las condiciones
experimentales y las repeticiones, ya que el diseño pide que se tome un nivel alto
y un nivel bajo para cada condición de experimentación y así como una serie de
repeticiones que este en función del numero de variables a trabajar, en este caso
se realizaran tres repeticiones. Para lo cual se realizaran 8 experimentos
los
cuales tendrán las siguientes condiciones:
Tabla 9.
Condiciones experimentales de los ocho primeros experimentos.
EXPERIMENTO TEMPERATURA(°C)
ρO2
VELOCIDAD DE AGITACIÓN
(kPa)
(rpm)
1
120
413.57
300
2
120
413.57
700
3
140
413.57
300
4
140
413.57
700
5
120
965
300
6
120
965
700
7
140
965
300
8
140
965
700
66
DESARROLLO EXPERIMENTAL
5.6
METODOLOGÍA PARA LA CARACTERIZACIÓN DE LAS MUESTRAS.
5.6.1 ESPECTROFOTOMETRÍA DE ABSORCIÓN ATÓMICA.
Las muestras que se analizaran en el Espectrofotómetro de Absorción
Atómica Modelo 2380 Perkin-Elmer provienen de las que se obtuvieron cada
media hora durante la lixiviación, las cuales se diluyeron a 10 % y al 0.1 % las que
se lixiviaron ácido nítrico. También los residuos sólidos de los experimentos con
las mayores condiciones de operación se caracterizaran con este equipo; esto
para obtener un balance metalúrgico del proceso. Los resultados obtenidos en
este análisis, permitirán saber si el plomo y plata se disuelven en la solución ácida
durante el proceso.
5.6.2 DIFRACCIÓN DE RAYOS X.
Este tipo de caracterización por Difractómetro de Rayos-X Modelo Siemens
D5000
permite obtener información, mediante el análisis cualitativo de las
muestras que se analizan en este equipo. Los resultados se registran mediante
una gráfica y se interpretan por picos que surgen de la línea de la gráfica y que
son característicos de cada uno de los compuestos que se encuentran presentes
en la muestra analizada. Estos resultados corresponden a sólo dos de los
experimentos que se llevaron a cabo con ácido nítrico; además el de la muestra
inicial. Estos se seleccionaron de acuerdo a las mayores condiciones de
experimentación.
67
DESARROLLO EXPERIMENTAL
5.6.3 MICROSCOPIO ELECTRÓNICO DE BARRIDO (MEB).
La caracterización por el MEB 6300
proporciona información tanto por
análisis cuantitativo y análisis cualitativo. La razón principal de su desarrollo:
mejorar la resolución obtenible por microscopia óptica (0.5 μm). Un haz fino
(aprox. 1 nm a 1μm) de electrones es barrido sobre la superficie de la muestra en
sincronía con el haz de un tubo de rayos catódicos (pantalla del MEB). Un detector
mide la intensidad de la señal de respuesta producida por la muestra, y esta
intensidad es usada para controlar la brillantez en pantalla del MEB. La imágenes
producidas en el MEB son, regularmente, fácilmente interpretables para el
observador.
68
RESULTADOS Y ANALISIS
VI.
RESULTADOS Y ANALISIS.
El elemento más importante en este trabajo es sin duda el plomo porque
representa el mayor contenido, en cuanto elemento, en la galena y debe ser
primordial su obtención, pues de él depende que el proceso sea, o no, viable.
Además, los valores de plata que forman parte del concentrado de galena son de
gran importancia.
La caracterización de las muestras líquidas de cada experimento se llevará
en el Espectrofotómetro de Absorción Atómica. Los productos finales sólidos
obtenidos se caracterizarán en el Espectrofotómetro de Absorción Atómica, para
obtener un balance metalúrgico del proceso, y por Difractómetro de Rayos-X y
Microscopio Electrónico de Barrido (MEB)
cuyos resultados
proporcionan un
análisis cualitativo y cuantitativo de los compuestos formados, durante la lixiviación
de galena, en especial de plomo y plata.
El análisis químico de las muestras líquidas de cada uno de los
experimentos que se obtuvieron cada media hora durante la lixiviación se realizó
en el Espectrofotómetro de Absorción Atómica, cuyos resultados proporciona un
análisis cuantitativo, en concentración en partes por millón, de la disolución de
plomo durante la lixiviación de galena a elevada presión y temperatura.
6.1
CARACTERIZACIÓN MINERALOGICA.
6.1.1 ANÁLISIS QUÍMICO
El concentrado se disuelve y analiza con el espectofotometro de absorción
atómica obteniendose los resultados que se muestra en la Tabla 10.
69
RESULTADOS Y ANALISIS
Tabla 10. Análisis químico del concentrado.
ESPECIE MASA (%)
Pb
70.0
Fe TOTAL
4.2
Cu
3.0
Zn
3.8
Ag
0.08
Au
0.002
S
16.7
SiO2
0.6
CaO
0.65
Fe2+
1.9
6.1.2 ANÁLISIS GRANULOMÉTRICO.
La disociación de los elementos del mineral durante la lixiviación depende,
principalmente, del contacto de la superficie de las partículas con el reactante; por
ello, es necesario saber el tamaño de grano del mineral. Pues mientras más
pequeño sea, más contacto tendrán las partículas con el reactante y así, la
velocidad de disociación será mayor. La Tabla 11 muestra el análisis
granulométrico del concentrado.
Tabla 11. Análisis granulométrico del concentrado.
+ 100 #
3.51 %
-100#, +150#
12.23 %
-150#
84.26 %
70
RESULTADOS Y ANALISIS
6.2
DIFRACCIÓN DE RAYOS X.
El patrón de difracción muestra que se caracterizaron por difracción de
Rayos X corresponden a la muestra del concentrado de plomo inicial muestran
sólo los picos de las especies que se consideran de importancia para este trabajo.
Las especies caracterizadas en el figura 16 son PbS y ZnS. Estos
compuestos forman parte del concentrado de
galena, el hierro y el cobre no
difractan debido a que el equipo de difracción utilizado usa lámpara de Cobre y
esta presenta problemas de fluorescencia. La plata y el oro al estar presentes en
cantidades por debajo del 0.2 % no son detectados por el equipo.
3500
♦
♣ ZnS
Galena (PbS)
Intensidad (u.a.)
80
2500
60
40
20
0
20
2000
30
40
50
60
70
80
90
100
2 θ ( Cu α, Grados)
100
80
1500
Intensidad (u.a.)
Intensidad (u. a.)
♦ PbS
100
3000
1000
ESFALERITA (ZnS)
60
40
20
♦
0
20
♦
500
0
20
40
40
50
60
70
80
90
100
2 θ ( Cu α, Grados)
♣
♥
♣
30
♦
♦
♣
60
♦
80
♦
100
2 θ (Grados)
Figura 16. Difractograma de la muestra inicial.
71
RESULTADOS Y ANALISIS
6.3
RECONSTRUCCION MINERALÓGICA
El análisis mineralógico del concentrado de galena, en base al análisis químico y
al barrido de difracción de RX se muestra en la Tabla 12.
Tabla 12. Análisis mineralógico del concentrado
6.4
MINERAL
FORMULA
CONTENIDO (%)
GALENA
PbS
80.937
PIRITA
FeS2
7.938
CALCOPIRITA
CuFeS2
3.875
ESFALERITA
ZnS
3.425
ARGENTITA
Ag2S
0.140
ELECTRUM
Au, Ag
0.002
CUARZO
SiO2
1.00
CALCITA
CaCO3
2.804
PRUEBAS DE LIXIVIACIÓN.
Las pruebas se realizan a diferentes condiciones de experimentación, se
toman muestras de solución a diferentes intervalos de tiempo en las que se
analiza el Plomo, Plata, Hierro, Cobre y Zinc por medio de espectofotometria de
absorción atómica y se calcula la fracción disuelta de estos elementos con
respecto al total de muestra inicial.
A continuación se muestra los resultados obtenidos se muestran los
resultados por medio de las graficas de % de Disolución vs Tiempo dependiendo
de la variable de estudio.
72
RESULTADOS Y ANALISIS
6.5
DISEÑO FACTORIAL
100
300 rpm, 393.15 K, 413.57 kPa, 5 ml Queb.
300 rpm, 393.15 K, 965 kPa, 5 ml Queb.
700 rpm, 393.15 K, 413.57 kPa, 5 ml Queb.
700 rpm, 393.15 K, 965 kPa, 5 ml Queb.
% de Disolución de Pb
80
60
40
20
0
0
30
60
90
120
150
180
Tiempo (Minutos)
Grafica 1. Efecto de la Velocidad de agitación en la disolución de plomo a
393.15K.
100
300 rpm, 413.15 K, 413.57 kPa, 5 ml Queb.
300 rpm, 413.15 K, 965 kPa, 5 ml Queb.
700 rpm, 413.15 K, 413.57 kPa, 5 ml Queb.
700 rpm, 413.15 K, 965 kPa, 5 ml Queb.
% de Disolución de Pb
80
60
40
20
0
0
30
60
90
120
150
180
Tiempo (Minutos)
Grafica 2. Efecto de la Velocidad de agitación en la disolución de plomo a
413.15K.
73
RESULTADOS Y ANALISIS
La grafica 1 y 2 muestra los resultados del diseño factorial, estas graficas
muestra que la velocidad de disolución es rápida durante los primeros 30 minutos
para después mantenerse constante, puede observarse que a mayor presión
aumenta la disolución del concentrado esto es debido a que aumentando la
presión de oxigeno este se
difunde en mayor proporción en el mineral
aumentando la velocidad de disolución, a menor velocidad de agitación la
disolución aumenta debido a que a mayores velocidades el agente lixiviante no
tiene un contacto eficiente con el concentrado
y a mayor temperatura se puede
observar que aumenta la disolución de plomo en 10 %.
De acuerdo a la experimentación anterior se planteo mantener las
siguientes condiciones 965 kPa (10 atm) y 413.15 K y observar el efecto de las
siguientes variables.
6.5.1 EFECTO DEL AGENTE SURFACTANTE
El efecto del agente surfactante se observa por medio de la adición de
Quebracho, como reactivo en la Lixiviación, el diagrama 22 muestra los resultados
de la pruebas realizadas con 3, 5 y 7 ml de Quebracho a las siguientes
condiciones: Concentración estequiometrica de HNO3,
Temperatura 413.15 K,
Velocidad de Agitación 500 rpm, Presión de O2 965 kPa y tiempo de
experimentación 180 minutos.
74
RESULTADOS Y ANALISIS
100
413.15 K, 965 kPa, 500 rpm, 3 ml. Quebracho
413.15 K, 965 kPa, 500 rpm, 5 ml. Quebracho
413.15 K, 965 kPa, 500 rpm, 7 ml. Quebracho
% de disolución de Pb
80
60
40
20
0
0
30
60
90
120
150
180
Tiempo (minutos)
Grafica 3. Efecto del surfactante en la disolución de plomo.
La grafica 3 muestra el efecto de la adición del agente surfactante donde se
observa que hay una mayor disolución de plomo con 5 ml de Quebracho, ya que
se obtiene el 50 % de disolución a 120 minutos. En el caso de la prueba realizada
con 3 ml de Quebracho solo se alcanza una lixiviación del 40 % a un tiempo de
120 minutos, lo mismo ocurrió en la prueba efectuada con 7 ml de Quebracho, en
donde se alcanza 42 % de lixiviación a 180 minutos. En base a estas pruebas se
muestra que la prueba realizada con 5 ml de agente surfactante se realizo una
lixiviación mayor del 10 % en comparación con las otras pruebas. De acuerdo a
estos resultados se determino trabajar el resto de la investigación manteniendo la
cantidad de Quebracho en 5 ml.
75
RESULTADOS Y ANALISIS
6.5.2 EFECTO DE LA CONCENTRACCIÓN DE ÁCIDO NITRICO
Para observar el efecto de la concentración de HNO3 en la lixiviación del
concentrado de Plomo, se realizan dos series de pruebas, las condiciones de
estas de estas se muestran en la Tabla 13.
Se trabajo a 373.15 K para observa el comportamiento del azufre por
debajo de su punto de fusión que es de 392.15 K.
Tabla 13.
Condiciones
de
operación
para
observar
el
efecto
de
la
concentración de HNO3.
CONDICIONES
SERIE 1
SERIE 2
Temperatura
373.15 K
413.15 K
Presión
965 kPa
965 kPa
Agitación
500 rpm
500 rpm
Surfactante
5 ml.
5 ml.
Concentración de HNO3
0.18, 0.75, 1 y 2 M
0.18, 0.75, 1 y 2 M
Las graficas 4, 5 y 6 muestran los resultados para la serie 1 para el Plomo,
Plata y Hierro respectivamente.
100
0.18 M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 373.15 K
0.75 M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 373.15 K
1.00 M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 373.15 K
90
% de Disolución de Pb
80
70
60
50
40
30
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (MInutos)
Grafica 4. Efecto de la concentración de HNO3 en la disolución de plomo para la
serie 1.
76
RESULTADOS Y ANALISIS
La grafica 4 muestra la disolución de plomo, donde se observa que con una
concentración de 1.0 M de HNO3 se logra una conversión de cerca del 70 %
durante los primeros 30 minutos, con 0.75 M de HNO3 la lixiviación de plomo
alcanzo el 70 % a los 120 minutos para después mantenerse constante y con 0.1
M de HNO3 se obtiene el 35 % de disolución a los 90 minutos. En esta grafica se
puede ver el efecto de la conversión de los sulfuros minerales, que se convierten
en iones sulfatos y precipitan al plomo en solución de acuerdo al diagrama (10) de
Pourbaix del sistema Pb-N-S-H2O y al diagrama de distribución de especies 12,
por lo que solo se logra una conversión del 70 %.
Lo anterior muestra que a condiciones estequiometricas la disolución es
mínima por la competición entre los iones nitratos y los iones que se forman
durante el proceso como es SO42- formando compuestos insolubles como el
PbSO4(S).
Al incrementar la concentración de HNO3 se observa que se incrementa la
cantidad de Pb2+, obteniéndose un máximo a una concentración de 1 M HNO3
donde se observa una serie de escalones debido al incremento y disminución del
SO42- formado, de tal forma que el Pb2+ en solución esta en función tanto de la
velocidad de disolución como de precipitación en forma de PbSO4(S).
77
RESULTADOS Y ANALISIS
100
0.18 M HNO3, 10 atm, 5 ml. Quebracho, 500 rpm, 100°C
0.75 M HNO3, 10 atm, 5 ml. Quebracho, 500 rpm, 100°C
90
1.00 M HNO3, 10 atm, 5 ml. Quebracho, 500 rpm, 100°C
% de Disolución Ag
80
70
60
50
40
30
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 5. Efecto de la concentración de HNO3 en la disolución de plata para la
serie 1.
La grafica 5 muestra el efecto del HNO3 en la lixiviación de plata, donde se
ve un efecto marcado, ya que con 1.0 M de HNO3 se alcanza 90 % de disolución
de plata a los 210 minutos donde se observa un ligero descenso en la disolución a
los 60 y 120 minutos por la formación de plata y precipitación de acuerdo al
diagrama de Pourbaix 10, con 0.75 M de HNO3 solo se logra el 20 % de disolución
de plata a los 20 minutos, en el caso de 0.18 M de HNO3 no se alcanza el 10 % de
lixiviación.
De igual forma que para el plomo, en este caso también se forma Ag2SO4(S),
lo cual no beneficia el proceso.
78
RESULTADOS Y ANALISIS
100
0.18 M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 373.15 K
0.75 M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 373.15 K
90
1.00 M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 373.15 K
% de Disolución Fe
80
70
60
50
40
30
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 6. Efecto de la concentración de HNO3 en la disolución de plata para la
serie 1.
La grafica 6 muestra el efecto del HNO3 en la disolución del hierro con 1.0
M de HNO3 donde se alcanza el 85 % de lixiviación a los 240 minutos, con 0.75 M
de HNO3 el 60 % a los 180 minutos, después se observa un ligero descenso en la
lixiviación posiblemente por la precipitación de hierro en forma de jarositas de
acuerdo a lo que nos indica la figura 7 y con 0.18 M de HNO3 se logra un 25 % de
lixiviación a los 240 minutos, debido a que no se logra una buena lixiviación tanto
de la pirita como la calcopirita.
79
RESULTADOS Y ANALISIS
100
0.18M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
90
0.75M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
1.00M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
80
% de Disolución Pb
2.00M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
70
60
50
40
30
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 7. Efecto de la concentración de HNO3 en la disolución de plomo para la
serie 2.
La grafica 7 muestra la lixiviación de plomo, donde se muestra que con 1.0
M de HNO3 hay un 65 % de lixiviación a los 120 minutos para después tener un
ligero descenso, esto se debe a que el azufre de los sulfuros metálicos se
transforma a azufre elemental y al ión sulfato, este ión al estar en contacto con el
plomo en solución reacciona y se precipita como PbSO4(S). Esto se confirma con el
análisis termodinámico y al barrido de RX del producto sólidos que se presentan
en la Figura 17. Cabe mencionar que los resultados que se muestran sólo
corresponden a los picos de las especies que se consideran de importancia para
este trabajo, en la cual aparecen especies como el PbSO4(S), PbO(S) y la jarosita
de plomo, además apareció gran cantidad S° que quedo aglomerado en una sola
pastilla en los residuos y no se caracterizo por RX.
80
RESULTADOS Y ANALISIS
700
♥
1.0 M HNO3,500 rpm,965 kPa, 5 ml. Queb., 413.15 K
Intensidad (u.a)
600
♦ PbSO4(S)
500
♥ PbO
♣ Pb0.5Fe3(SO4)2(OH)6
400
300
♦
♦
♦
200
♦
♦
100
♦♣
♥
♣♦
♣
♣
♣
0
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95 100
2 θ (Grados)
Figura 17. Difractograma de los residuos de la lixiviación del concentrado de
plomo con las siguientes condiciones: 1.0 M HNO3, 5 ml. de Quebracho, 965 kPa,
500 rpm y 413.15 K. (Condiciones de barrido 2° / min.).
Los residuos de lixiviación de esta muestra se observaron en el Microscopio
Electrónico de Barrido, la figura 18 muestra las partículas de Sulfato de Plomo,
Oxido de Plomo y Jarositas de Plomo encontradas de acuerdo a la microanálisis
realizado por EDS en la figura 19, cabe resaltar que se realizo un microanálisis
global y otro puntual.
81
RESULTADOS Y ANALISIS
Figura 18. Microfotografia del concentrado de plomo oxidado con HNO3 y O2.
(Condiciones: 1.0 M HNO3, 5 ml. de Quebracho, 965 kPa, 500 rpm y 413.15 K).
Figura 19. Análisis químico del concentrado de plomo oxidado con HNO3 y O2.
Microscopio Electrónico de Barrido con una micro prueba de EDS. (Condiciones:
1.0 M HNO3, 5 ml. de Quebracho, 965 kPa, 500 rpm y 413.15 K).
De acuerdo a lo anterior se concluye que la lixiviación a temperaturas
mayores de 120°C no favorece el proceso ya que existen varios compuestos
insolubles que se forman como son la jarosita, el PbSO4(S) y el PbO(S) donde la
temperatura favorece su formación.
82
RESULTADOS Y ANALISIS
100
% de Dsisolución de Ag
80
60
40
0.18M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
0.75M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
1.00M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
20
2.00M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 8. Efecto de la concentración de HNO3 en la disolución de plata para la
serie 2.
En la grafica 8 se observa el efecto del HNO3 en la disolución de plata,
donde se ve que con 1 M de HNO3 se logra una lixiviación del 100 % a los 210
minutos, esto se logra porque aunque no se disuelva al 100 % el plomo debido a
la precipitación de PbSO4(S) , la argentita que se encuentra en la matrix de la
galena se libera para reaccionar con el ácido nítrico y el oxigeno, con 0.75 M
HNO3 hay una lixiviación del 85 % a los 240 minutos donde se nota la
precipitación de la plata a partir de los 90 minutos razón por la cual no se efectúa
una disolución total, con 2 M de HNO3 hay 78 % de disolución para después tener
un fuerte descenso en la disolución por la rápida formación de iones sulfatos
producto de la disolución
del sulfuro de plata y precipitación de acuerdo al
diagrama (10) de pourbaix del sistema Ag-N-S-H2O y con 0.18 M de HNO3 solo se
logra un 12 % de disolución debido a que ha estas condiciones la poca cantidad
de ácido inhibe una rápida velocidad de disolución.
83
RESULTADOS Y ANALISIS
De
acuerdo
a
lo
anterior
no
se
recomienda
trabajar
a
concentraciones mayores de 1 M ya que a concentraciones mayores la disolución
es muy rápida pero a su vez la precipitación de la plata a medida que se va
formando los iones sulfatos. Considerando que los procesos en autoclaves se
efectúa en 90 minutos aproximadamente, se determina trabajar con una
concentración 1 M que concuerda con el de disolución de plomo.
100
90
% de Disolución Fe
80
70
60
0.18M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
50
0.75M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
1.00M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
40
2.00M HNO3, 965 kPa, 5 ml. Quebracho, 500 rpm, 413.15 K
30
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 9. Efecto de la concentración de HNO3 en la disolución de hierro para la
serie 2.
La grafica 9 muestra el efecto de la concentración de HNO3 para el hierro,
donde se muestra que con 1.0 y 2.0 M HNO3 hay una disolución del 100 % a los
30 y 90 minutos respectivamente, con 0.75 y 0.18 M de HNO3 recuperación
alcanza el 72 y 22 % respectivamente.
84
RESULTADOS Y ANALISIS
Lo anterior muestra que la disolución de hierro es muy rápida por las
condiciones oxidantes del sistema, por lo que no es recomendado trabajar con
altas concentraciones de HNO3 ya que al formase el ion sulfato se transforma a
Fe(SO4)2- el cual favorece la formación de jarositas que pueden ser de plomo y
plata.
6.5.3 EFECTO DE LA TEMPERATURA
El efecto de la temperatura en la lixiviación del concentrado de plomo se
observa en las graficas 10, 11 y 12 para el plomo, la plata y el hierro
respectivamente, donde se grafica el % de disolución contra Tiempo de las
pruebas realizadas a temperaturas de 373.15 y 413.15 K a las siguientes
condiciones, Presión 965 kPa, Concentración de HNO3 de 1 M, Velocidad de
agitación de 500 rpm,
Volumen de agente surfactante 5 ml. El tiempo de
Experimentación fue de 240 minutos.
% de Disolución de Pb
100
80
60
40
1 M HNO3, 500 rpm, 965 kPa, 373.15 K
1 M HNO3, 500 rpm, 965 kPa, 413.15 K
20
0
0
30
60
90
120
150
Tiempo (minutos)
180
210
240
Grafica 10. Efecto de la Temperatura en la disolución de plomo.
85
RESULTADOS Y ANALISIS
% de Disolución de Ag
100
80
60
40
1 M HNO3, 500 rpm, 965 kPa, 373.15 K
1 M HNO3, 500 rpm, 965 kPa, 413.15 K
20
0
0
30
60
90
120
150
Tiempo (minutos)
180
210
240
Grafica 11. Efecto de la Temperatura en la disolución de plata.
% de Disolución de Fe
100
80
60
40
1 M HNO3, 500 rpm, 965 kPa, 373.15 K
1 M HNO3, 500 rpm, 965 kPa, 413.15 K
20
0
0
30
60
90
120
150
Tiempo (minutos)
180
210
240
Grafica 12. Efecto de la Temperatura en la disolución de hierro.
86
RESULTADOS Y ANALISIS
La temperatura no tiene un efecto favorable en la lixiviación del plomo como
lo indica la grafica 10, esto se debe a que la velocidad de formación de sulfatos se
incrementa con la temperatura, para posteriormente precipitarse como sulfato de
plomo, oxido de plomo y / o jarositas de plomo de acuerdo al barrido de RX
realizado a los residuos de lixiviación de la figura 18 y al microanálisis por EDS
realizado que se observa en la figura 20.
En el caso de la plata tiene efecto favorable en la disolución ya que alcanza
a disolverse totalmente, esto se debe a que la plata en forma de argentita se
encuentra dentro de la estructura cristalina de la galena, primero empieza la
reacción de la galena con el HNO3 y el O2, para posteriormente reaccionar con la
argentita disolver a la plata dentro de la solución., como se muestra en la grafica
11.
Para el hierro se tiene un efecto favorable, ya que se realizo una total lixiviación
del hierro a estas condiciones como lo indica la grafica 12.
6.5.4 EFECTO DE LA VELOCIDAD DE AGITACIÓN
El efecto de la velocidad de agitación en la lixiviación del concentrado de
plomo se observa en las graficas 13, 14 y 15 para el plomo, la plata y el hierro
respectivamente, donde se grafica el % de disolución contra Tiempo de las
pruebas realizadas a variando la velocidad de agitación de 300, 500 y 700 rpm, a
las siguientes condiciones, Presión 965 kPa, Concentración de HNO3 de 1 M,
temperaturas de 413.15 K, Volumen de agente Surfactante 5 ml. El tiempo de
Experimentación fue de 240 minutos.
87
RESULTADOS Y ANALISIS
100
90
% de Disolución de Pb
80
70
60
50
40
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 300 rpm
30
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 500 rpm
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 700 rpm
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 13. Efecto de la velocidad de agitación en la disolución de plomo.
100
90
80
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 300 rpm
% de Disolución Ag
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 500 rpm
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 700 rpm
70
60
50
40
30
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 14. Efecto de la velocidad de agitación en la disolución de plata.
88
RESULTADOS Y ANALISIS
100
90
% de Disolución Fe
80
70
60
50
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 300 rpm
40
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 500 rpm
1M HNO3, 5 ml. Quebracho, 965 kPa, 413.15 K, 700 rpm
30
20
10
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 15 . Efecto de la velocidad de agitación en la disolución de hierro.
Para el plomo se observa que no hay un fuerte efecto sobre la disolución,
debido a que para los tres casos hay una lixiviación cercana al 60 % como se
observa en la grafica 13.
En el caso de la plata la grafica 14 muestra que a 500 rpm se logra una
completa lixiviación de plata en la solución, esto es debido a que con esta
velocidad no permite que las partículas de azufre y el sulfato de plomo que se van
formando cubran a las partículas de argentita que todavía no reacciona con los
agentes lixiviantes.
Para el hierro la velocidad de agitación optima es a 500 rpm donde se logra
una total disolución de las especies minerales que contienen al hierro, como se
muestra en la grafica 15.
89
RESULTADOS Y ANALISIS
6.5.5 EFECTO DEL NITRATO DE CALCIO.
Después de observar el efecto de las variables de operación como son la
temperatura , presión y agitación se determino que la precipitación de los
diferentes compuestos de plomo juega un papel importante, por lo cual se ataco
este problema con la adición de otros reactivos que redujeran la formación de
estos compuestos insolubles, determinando que la adición de nitrato de calcio
podría beneficiar el proceso.
100
% de Disolución de Pb
80
60
40
1 M HNO3, 500 rpm, 965 kPa, 5 ml. Quebracho, 413.15 K
2+
0.2 M Ca ,1 M NO3 , 500 rpm, 965 kPa, 5 ml. Quebracho, 413.15 K
20
0
0
30
60
90
120
150
180
210
240
Tiempo (Minutos)
Grafica 16. Efecto del ión calcio en la disolución del plomo.
90
RESULTADOS Y ANALISIS
Para observar el efecto del nitrato de calcio en la lixiviación del concentrado
de plomo, la grafica 16 muestra el efecto del ión calcio en la disolución del plomo,
se muestra que se alcanza una lixiviación del plomo del 100 % a los 180 minutos
esto se debe por la competencia entre el ión calcio y el ión plomo por el ión sulfato
que se va formando durante la lixiviación, el ión calcio al reaccionar con el ión
sulfato se precipita como sulfato de calcio de acuerdo al diagramas de equilibrio y
de especies 14 para los sistemas Ca-S-H2O y Ca(II)-SO4 , esta es la razón de una
completa disolución de la galena. El producto sólido obtenido en los residuos en el
experimento con las siguientes condiciones: 0.2 M Ca2+, 1.0 M NO3-, 5 ml. de
Quebracho, 965 kPa, 500 rpm y 413.15 K se le hizo un barrido en RX que se
muestra figura 20. Cabe mencionar que los resultados que se muestran sólo
corresponden a los picos de las especies que se consideran de importancia para
este trabajo.
En la figura 20 se presentan el difractograma, en la cual aparecen especies
como el PbO(S), la jarosita de plomo, Yeso (CaSO4.2H2O(S)) y Anhidrita (CaSO4(S)) ,
donde podemos ver que el sulfato de calcio es producto de la precipitación del ión
sulfato que reacciona con el ión calcio, además apareció gran cantidad S° que
quedo aglomerado en una sola pastilla en los residuos y no se caracterizo por RX.
91
RESULTADOS Y ANALISIS
350
2+
-
0.2 Ca ,1 M NO3 , 140°C, 500 rpm, 140 psi
+
♠ CaSO4(S)
Intensidad (U.A.)
300
♥ CaSO4.2H2O
♥
250
♣ Pb0.5Fe3(SO4)2(OH)6
+ PbO
♥
200
♦
150
♥
♦
♠
100
+
♣
50
♠
+
♠♥
♣
♣
♠
0
20
25
30
35
40
45
50
55
60
65
70
75
80
2 θ (Grados)
Figura 20. Difractograma del Experimento con las sig. Condiciones: 0.2 M Ca2+,
1.0 M NO3-, 5 ml. de Quebracho, 965 kPa, 500 rpm y 413.15 K.
De acuerdo a lo anterior se observa que se evita la formación de PbSO4(S)
con la adición con la adición de Nitrato de Calcio, no se evita la formación de las
jarositas y el oxido de plomo.
92
CONCLUSIONES
CONCLUSIONES
•
Se desarrollaron los diagramas de Pourbaix para los sistemas Pb-N-SH2O y Ag-N-S-H2O a 413.15 K y [Ag]=1x10-4, [Ca]=0.5, [N]=1.0,
[Pb]=0.21, [S]=0.21 y pO2=965 kPa
y apoyados en el estudio
termodinámico realizado se establece que la reacción de lixiviación
ácida del concentrado de plomo con HNO3 y presión de O2 es factible en
un intervalo de pH de -2 a 3 para el plomo y la plata, para la plata el
intervalo de pH es de -2 a 3 y un voltaje de 0.75 a 1.9 Volts. En estos
intervalos de pH y voltaje el plomo producido por la reacción se
encontrara en forma de Pb2+ y PbSO4(S); la plata estará en forma de
AgSO4- y Ag2SO4(S). El ácido nítrico usado en la lixiviación se
transformara en NO(g). El azufre contenido en el concentrado de plomo
reaccionara formando S° y SO42-..
•
La
concentración
de
HNO3
favorece
la
disolución,
donde
la
concentración de ácido fue variada (0.18-2.0) M, obteniéndose un 60 %
más de recuperación a concentración de altas HNO3 en el caso del
plomo. Para la plata y el hierro la disolución fue del 100 % con altas
concentración es de HNO3.
•
La presión de Oxigeno favorece la formación SO2-2, debido a la reacción
del oxigeno con el HSO4- producido durante la experimentación.
•
Se determina que un incremento de temperatura favorece la
precipitación de PbSO4(S) y aumenta la disolución del hierro y plata.
•
La velocidad de agitación tiene un papel importante ya que no afecta la
velocidad de disolución de plomo, pero afecta la disolución de plata y
hierro, encontrándose que 500 rpm era la mejor condición de
experimentación.
93
CONCLUSIONES
•
Las mejores condiciones de lixiviación del concentrado de plomo son:
0.2 M Ca2+, 1.0 M NO3-, 500 rpm, 5 ml. de Quebracho, 413.15 K y 965
kPa de Oxigeno, obteniéndose un 100 % de disolución de plomo, plata y
hierro en solución.
•
La adición de ión calcio al sistema favorece la reacción química con el
SO42- formando CaSO4(S), favoreciendo el que Pb2+ permanezca en
solución obteniéndose una disolución del 100 %.
94
BIBLIOGRAFIA
BIBLIOGRAFIA
1) Acharya S, J., “Iron rejection through jarosite precipitation durin acid
pressure leaching of zinc leach residue”, Hidrometallurgy 31, (1992)
101-110.
2) Arslan C. and Arslan F., “Termochemical Review of Jarosite and
Goethite Stability Regions at 25 and 95°C. Turkish J. Eng. Env. Sci.
27, (2003) 45-52.
3) Baláz, P., “Influence of solid state propperties on ferric chloride
leaching of mechanically activated galena”. Hydrometallurgy, 40
(1996) 359 -368.
4) Bjorling, G., Kolta, G. A., 1964. Oxidizing leach of sulphide
concentrates and other materials catalyzed by nitric acid. VII Int.
Mineral Processing Congr., Part III. Gordon and Breach Sci. Publ.,
New Cork, pp. 127-138.
5) Bjorling, G., Falda, I., Toromanov, I., 1976. A nitric acidic route in
combination with solvent extraction for hydrometallurgical treatment
of chalcopyrite. In : Yannapoulus, T. C., Agarwal, T.C. (Eds.), AIME
Extractive Metallurgy of Copper, Las Vegas, NV, Feb. 22-26, 1976,
pp. 726-737.
6) Bray J. L., Metalurgia Extractiva de los metales no ferrosos,
Ediciones Interciencia. Pp 405-409, España 1968.
7) Brennecke, H.M., Bergmann, O., Ellefson, R.R., Davies, D.S.,
Lauders, R.E., Spitz, R.A., 1981. Nitric–sulfuric leach process for
recovery of copper from concentrate. Mining Eng. 33, 1259-1266.
8) Criss C.M., Cobble J.W., “The Termodynamic Propierties of High
Temperature Aqueous Solutions”. (1964) J.A.C.S., 86, 5390.
9) Droppert, D.J., Shang, Y., 1995. The leaching behavior of
nickeliferous
pyrrhotite
concentrate
in
hot
nitric
acid.
Hydrometallurgy 39, 1969-1982.
95
BIBLIOGRAFIA
10) Dutrizac, J.E., “The Physical Chemestry of Iron Precipitation in the
Zinc Industry”, Lead-Zinc-Tin '80, Eds. J. M. Cigan, T. S. Mackey and
T.J O'Keefe, AIME, New York, 532-564, 1980.
11) Dutrizac, J.E., “The Leaching of Sulphide Minerals in Chloride Media”.
Hydrometallurgy 29, (1992) 1 -45.
12) Dutrizac, J. E. and Chen, T.T., The Effect of the Elemental Sulphur
Reaction Product on the Leaching of Galena in Ferric Chloride Media.
Metal. Trans. , 21B (1990): 935 - 943.
13) Dutrizac, J.E. and Monhemius, A.J., Iron control in processes
development at Sherrit Gordon Mines, The Metallurgical society of
CIM/Ellis Horwood Limited, Series in Industrial Metals, 1986 pp. 131151.
14) Fair, K.J., Schneider, J.C., Van Weert, G., 1986. Prochem´s NITROX
process. CIM Bull. 79, 84-85.
15) Flatt, J. R., Woods, R., 2000. Oxidation of pyrite in nitric acidic
solutions: relation to treatment of refractory gold ores. In: Woods, R.,
Doyle, F. (Eds.), Electrochemestry in Mineral and Metal Processing
V. The Electrochem. Soc., Pennington, NJ, pp. 152-163.
16) Fuersteneu, M.C., Chen, C.C., Han K.N. and Palmer, B.R., “Kinetic
of Galena Dissolution in Ferric Chloride Solutions”, Metallurgical
Transactions B, Volume 17B, (1986) 415 - 423.
17) Fuerstenau M.C., Nebo C.O., Elango B.V., Han K.N., "The Kinetics of
Leaching Galena with Ferric Nitrate, Metallurgical Transactions B,
Volume 18B, (1987) 25-29.
18) Habashi F., 1973 a. Action of nitric acid on chalcopyrite. Trans. Soc.
Min. AIME 254, 224-228.
19) Habashi F., 1973 b. Treatment of low-grade nickel-copper sulphide
concentrate by nitric acid. Trans. Soc. Min. AIME 254, 228-230.
20) Habashi F., A short history of hydrometallurgy, Hydrometallurgy 79,
(2005) 15-22.
96
BIBLIOGRAFIA
21) Holmes, P.R., Crundwell, F.K., 1995. Kinetic aspects of galvanic
interaction between minerals during dissolution. Hydrometallurgy 39,
353-375.
22) Kholmogorov A. G., Kononova O. N., Processing mineral materials in
Siberia:
ores
of
molybdenum,
tungsten,
lead
and
gold,
Hydrometallugy 76, (2005) 37 – 54.
23) Kholmogorov, A.G., Mikhlina, E.V. Effect of nitric acid concentration
and process temperature on breakdown of lead concentrates. Journal
Prikladnoy Khimii 71, (1998) 353-356 (in Russian).
24) Kim S. H. Henein H. And Warren G. W. An investigation of the
thermodynamics and kinetics of the ferric chloride brine leaching of
galena concentrate. Metall. Trans., 17B, 1986, 29-39.
25) Mangano P., Adams, P.W., Matthew, I.G., Hydrometallurgical
recovery of metals and elemental sulfur from metal sulfides.(1986)
Australian Patent No. 596,716.
26) Margulis, E.V., Basic leaching of lead during complex processing of
lead-zinc fumes. Tsvetnye Metally 3 (1989), 41-45 (in Russian).
27) Mervyn G. Kershaw and Ralph W. Pickering, The Jarosite Process Phase Equilibria, Electrolytic Zinc Company of Australasia Limited
Melbuorne, Victoria, Australia.
28) Metals Handbook, Corrosion, 9 Edition, Volume 8, ASM, 1989, pp.
18-28.
29) Mikhlin, Yu., Kuklinskiy, A.V. Mikhlina, E.V., Kargin, V.F., Asanov,
I.P.,
2002. Electrochemical behaviour of lead sulfide in nitric and
perchloric
acid
solutions:
voltammetric,
SEM,
and
XPS
characterization and application of the disordered semiconductor
concept. In press.
30) Morin D. Gaunand A and Renon H. Representation of the kinetics of
leachingof galena by ferric chloride in concentrated sodium chloride
solutions by a modified mixed kinetics model. Metall. Trans., 16B,
1985, 31-9.
97
BIBLIOGRAFIA
31) Mulak, W., 1987. The catalytic action of cupric and ferric ions in nitric
acid leaching of Ni3S2. Hydrometallurgy 17, 201-214.
32) Novoselov, R.I., Makotchenko, E.V., 1999. Oxygen as an ecologically
compatible agent for oxidation of non-ferrous and noble metals and
sulfide minerals. Chem. Sustainable Dev. 7, 321-330.
33) Palmer B. Kinetics of dissolution of galena with ferric chloride. Metall.
Trans., 12B, (1981) 595 – 601.
34) Pashkov G. L., Mikhlina E. V., Kholmogorov A. G., Mikhlin Y. L.,
2002. “Effect of potential and ferric ions on lead sulfide dissolution in
acid nitric”, Hydrometallurgy 63, (2002) 171 – 179.
35) Peters E., “Hydrometallurgical process innovation”, Hydrometallurgy
29, (1992) 431-459.
36) Peters, E., Vizsolyi, A., 1971. A new hydrometallurgy process for lead
recovery. 100th AIME Annu. Meet. (New York).
37) Posnjak E. and Merwin H. E., The System, Fe2O3-SO3-H2O, Journal
American Chemical Society, 44 (2), (1922) 1965-1994.
38) Prater, J.D., Queneau, P.B., Hudson, T.J, 1973. Nitric acid route to
processing copper concentrates. Trans. Soc. Min. Eng. AIME 254,
117-122.
39) Rath, P.C., Paramguru, R.K. and Jena, P.K., “Kinetics of Dissolution
of Sulphide Minerals in Ferric Chloride Solution. 1: Disolution of
Galena, Sphalerite and Chalcopyrite”. Trans. Inst. Min. Metall., 97
(1988): C150 - C158.
40) Romero, J.A., Apuntes de Termodinámica Metalurgia y Materiales,
ESIQIE, (2004), pp. 324 - 327.
41) Rosenqvist Terkel, Fundamentos de Metalurgia Extractiva, Ed.
Limusa, pp. 469 – 471, México, 1984.
42) S. Aksu and F. M. Doyle., “Electrochemestry of Copper in Aqueous
Glycine Solutions”, J. Electrochem. Soc. 148, B51 (2001).
43) Sasaki K. and Konno H., “Morphology of Jarosite-Group compounds
precipitated from biologically and chemically oxidized Fe ions. The
Canadian Mineralogist 38, (2000) 45-56.
98
BIBLIOGRAFIA
44) Smith R. M., 1976. Critical Stability Constans Inorganic Complexes,
Volume 4. College of New York, Pag. 51, New York.
45) Subagja, R. and Fuwa A., “New Hydrometallurgical Process
Development for Lead Recovery From Their Minerals”. The Mining
and Metallurgical Institute of Japan, Volume 5, No 2, (1988). pp. 1 –
23.
46) Szczygiel Zbigniew, Metalurgia no ferrosa, Ed. Limusa, pp. 195-397,
México, 1984.
47) Van Weert. , Shang, Y., 1993. Iron control in nitrate hydrometallurgy
by autoclaving hydrolysis of iron (III) nitrate. Hydrometallurgy 33, 273290.
48) Vizsolyi, A., Peters, E., 1980. Nitric acid leaching molybdenite
concentrates. Hydrometallurgy 6, 103-119.
49) Welham, N.J., Malatt, K.A. and Vukcevic S., “The effect of solution on
iron-sulphur-arsenic-chloride systems at 298 K”, Hydrometallurgy
57(2000) 209-223.
99
APENDICE I
Tabla 14.
Valores de Energía libre de las especies presentes en los sistemas
S-H2O, N-H2O, Pb-H2O, Pb-N-H2O, Pb-S-H2O y Pb-N-S-H2O a
413.15 K.
Número
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
Especie
Pb, N , S gases:
N(g)
N2(g)
N3(g)
NH(g)
NH2(g)
NH3(g)
HNNH(g)
N2H4(g)
NO(g)
N2O(g)
NO2(g)
NO3(g)
N2O3(g)
N2O4(g)
N2O5(g)
HNO(g)
N2H5OH(g)
HONO(g)
HONO(g)
HONO2(g)
S(g)
S2(g)
S3(g)
S4(g)
S5(g)
S6(g)
S7(g)
S8(g)
HS(g)
H2S(g)
H2S2(g)
NS(g)
SO(g)
Referencia
ΔG(kJ)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
408.981
-79.694
319.861
301.144
109.304
-126.223
121.943
-4.312
2.672
-9.576
-66.783
-34.191
-45.934
-118.241
-133.84
7.734
-315.713
-180.677
-182.719
-245.451
207.222
33.724
29.18
16.084
-19.936
-46.604
-57.432
-80.495
57.912
-106.151
-95.359
171.25
-87.25
ΔG(Kcal)
97.749
-19.047
76.449
71.975
26.124
-30.168
29.145
-1.031
0.639
-2.289
-15.961
-8.172
-10.979
-28.26
-31.989
1.848
-75.457
-43.183
-43.671
-58.664
49.527
8.06
6.974
3.844
-4.765
-11.139
-13.726
-19.239
13.841
-25.371
-22.791
40.93
-20.853
100
APENDICE I
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
SO2(g)
FACT
SO3(g)
FACT
SSO(g)
FACT
O2S(OH)2(g)
FACT
Pb(g)
FACT
Pb2(g)
FACT
PbH(g)
FACT
PbO(g)
FACT
PbS(g)
FACT
Pb, N , S liquidos:
N2H4(l)
FACT
HN3(l)
FACT
N2O4(l)
FACT
(NH4)2O(l)
FACT
HONO2(l)
FACT
S(l)
FACT
H2S2(l)
FACT
SO3(l)
FACT
O2S(OH)2(l)
FACT
H2SO4(H2O)(l)
FACT
H2SO4(H2O)2(l)
FACT
H2SO4(H2O)3(l)
FACT
H2SO4(H2O)4(l)
FACT
H2SO4(H2O)6(l)
FACT
(H2SO4)2(H2O)13(l) FACT
Pb(l)
FACT
PbO(l)
FACT
PbS(l)
FACT
Pb, N , S especies acuosas:
N2(aq)
FACT
N3[-]
FACT
NH3(aq)
FACT
NH4[+]
FACT
N2H4(aq)
FACT
N2H5[+]
FACT
HN3(aq)
FACT
ONO[-]
FACT
N2O2[2-]
FACT
NO3[-]
FACT
HONO(aq)
FACT
S[2-]
FACT
-400.159
-502.857
-167.656
-860.293
122.379
215.705
144.439
-51.754
27.268
-95.64
-120.186
-40.071
-205.615
29.249
51.555
34.522
-12.37
6.517
-1.602
-0.383
205.929
49.218
-108.941
-26.038
-546.117 -130.525
-239.866
-57.329
-13.874
-3.316
-102.859
-24.584
-489.746 -117.052
-881.681 -210.727
-1219.339 -291.429
-1546.683 -369.666
-1869.602 -446.846
-2190.271 -523.487
-2987.488 -714.027
-5974.845 -1428.022
-25.879
-6.185
-230.947
-55.198
-126.702
-30.283
-53.835
233.173
-126.272
-179.771
-22.735
-69.575
200.861
-160.335
-18.017
-266.118
-173.543
39.51
-12.867
55.73
-30.18
-42.966
-5.434
-16.629
48.007
-38.321
-4.306
-63.604
-41.478
9.443
101
APENDICE I
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
S2[2-]
FACT
S3[2-]
FACT
S4[2-]
FACT
S5[2-]
FACT
HS[-]
FACT
H2S(aq)
FACT
SO2(aq)
FACT
SO3[2-]
FACT
SO4[2-]
FACT
S2O3[2-]
FACT
S2O4[2-]
FACT
S2O5[2-]
FACT
S2O6[2-]
FACT
S2O8[2-]
FACT
S3O6[2-]
FACT
S4O6[2-]
FACT
S5O6[2-]
FACT
HSO3[-]
FACT
HSO4[-]
FACT
HS2O4[-]
FACT
H2S2O4(aq)
FACT
Pb[2+]
FACT
PbOH[+]
FACT
HPbO2[-]
FACT
Pb3(OH)4[2+]
FACT
Pb4(OH)4[4+]
FACT
Pb6(OH)8[4+]
FACT
Pb, N , S solidos:
NH4N3(s)
FACT
N2O4(s)
FACT
N2O5(s)
FACT
NH4NO3(s)
FACT
S(s)
FACT
S(s2)
FACT
NH4HS(s)
FACT
SO3(s)
FACT
(NH4)2(SO4)(s)
FACT
(NH4)2SO4(NH3)3(s) FACT
Pb(s)
FACT
PbO(s)
FACT
PbO(s2)
FACT
18.733
-0.892
-19.248
-35.726
-41.2
-89.785
-390.742
-614.144
-913.453
-668.3
-789.881
-1012.702
-1220.79
-1446.329
-1225.468
-1300.458
-1246.315
-683.788
-944.625
-614.63
-616.722
-5.131
-226.354
-338.486
-1131.681
-1155.356
-2285.804
4.477
-0.213
-4.6
-8.539
-9.847
-21.459
-93.389
-146.784
-218.32
-159.728
-188.786
-242.042
-291.776
-345.681
-292.894
-310.817
-297.876
-163.429
-225.771
-146.9
-147.4
-1.226
-54.1
-80.9
-270.478
-276.137
-546.32
68.979
-99.82
-119.564
-430.732
-13.709
-13.759
-199.171
-484.227
-1275.136
-1589.87
-27.303
-247.745
-247.372
16.486
-23.858
-28.576
-102.947
-3.276
-3.288
-47.603
-115.733
-304.765
-379.988
-6.525
-59.213
-59.123
102
APENDICE I
113
114
115
116
117
118
119
120
121
122
123
124
125
126
127
128
129
130
131
132
133
134
135
136
137
138
139
140
141
142
143
144
145
146
147
PbO2(s)
Pb3O4(s)
Pb(OH)2(s)
(PbO)3(H2O)(s)
Pb(N3)2(PbO)(s)
PbS(s)
Pb2S2(s)
O3PbS(s)
PbSO4(s)
PbSO4(s2)
PbOPbSO4(s)
(PbO)2(PbSO4)(s)
(PbO)3(PbSO4)(s)
(PbO)4(PbSO4)(s)
PbSO4(NH3)2(s)
PbSO4(NH3)4(s)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
Otros gases:
H(g)
FACT
H2(g)
FACT
O(g)
FACT
O2(g)
FACT
O3(g)
FACT
OH(g)
FACT
H2O(g)
FACT
HOO(g)
FACT
HOOH(g)
FACT
Otros líquidos:
H2O(l)
FACT
HOOH(l)
FACT
Otras especies acuosas:
H[+]
FACT
H2(aq)
FACT
O2(aq)
FACT
OH[-]
FACT
HO2[-]
FACT
HOOH(aq)
FACT
e[-](aq)
ELEM
Otros sólidos:
H2O(s)
FACT
-305.394
-809.464
-452.2
-799.5
333.046
-137.047
-70.564
-730.557
-983.508
-979.967
-1259.928
-1516.451
-1772.295
-2002.175
-1184.397
-1409.184
-72.991
-193.467
-108.078
-191.085
79.6
-32.755
-16.865
-174.607
-235.064
-234.218
-301.13
-362.441
-423.589
-478.531
-283.078
-336.803
170.238
-54.519
182.247
-85.296
43.196
-37.457
-320.474
-93.224
-233.214
40.688
-13.03
43.558
-20.386
10.324
-8.952
-76.595
-22.281
-55.739
-316.223
-234.356
-75.579
-56.013
0
-31.292
-61.513
-223.265
-163.262
-248.398
-27.154
0
-7.479
-14.702
-53.362
-39.021
-59.369
-6.49
-311.93
-74.553
103
APENDICE I
Tabla 15.
Valores de Energía libre de las especies presentes en los sistemas
Ag-H2O, Ag-N-H2O, Ag-S-H2O y Ag-N-S-H2O a 413.15 K.
Número Especies
Ag, N , S gases:
1
N(g)
2
N2(g)
3
N3(g)
4
NH(g)
5
NH2(g)
6
NH3(g)
7
HNNH(g)
8
N2H4(g)
9
NO(g)
10
N2O(g)
11
NO2(g)
12
NO3(g)
13
N2O3(g)
14
N2O4(g)
15
N2O5(g)
16
HNO(g)
17
N2H5OH(g)
18
HONO(g)
19
HONO(g)
20
HONO2(g)
21
S(g)
22
S2(g)
23
S3(g)
24
S4(g)
25
S5(g)
26
S6(g)
27
S7(g)
28
S8(g)
29
HS(g)
30
H2S(g)
31
H2S2(g)
32
NS(g)
33
SO(g)
34
SO2(g)
35
SO3(g)
Referencia ΔG(KJ)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
408.981
-79.694
319.861
301.144
109.304
-126.223
121.943
-4.312
2.672
-9.576
-66.783
-34.191
-45.934
-118.241
-133.84
7.734
-315.713
-180.677
-182.719
-245.451
207.222
33.724
29.18
16.084
-19.936
-46.604
-57.432
-80.495
57.912
-106.151
-95.359
171.25
-87.25
-400.159
-502.857
ΔG(Kcal)
97.749
-19.047
76.449
71.975
26.124
-30.168
29.145
-1.031
0.639
-2.289
-15.961
-8.172
-10.979
-28.26
-31.989
1.848
-75.457
-43.183
-43.671
-58.664
49.527
8.06
6.974
3.844
-4.765
-11.139
-13.726
-19.239
13.841
-25.371
-22.791
40.93
-20.853
-95.64
-120.186
104
APENDICE I
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
SSO(g)
FACT
-167.656
-40.071
O2S(OH)2(g)
FACT
-860.293 -205.615
Ag(g)
FACT
212.3
50.741
Ag2(g)
FACT
303.07
72.435
AgS(g)
FACT
284.644
68.032
Ag, N , S liquidos:
N2H4(l)
FACT
-1.602
-0.383
HN3(l)
FACT
205.929
49.218
N2O4(l)
FACT
-108.941
-26.038
(NH4)2O(l)
FACT
-546.117 -130.525
HONO2(l)
FACT
-239.866
-57.329
S(l)
FACT
-13.874
-3.316
H2S2(l)
FACT
-102.859
-24.584
SO3(l)
FACT
-489.746 -117.052
O2S(OH)2(l)
FACT
-881.681 -210.727
H2SO4(H2O)(l)
FACT
-1219.339 -291.429
H2SO4(H2O)2(l)
FACT
-1546.683 -369.666
H2SO4(H2O)3(l)
FACT
-1869.602 -446.846
H2SO4(H2O)4(l)
FACT
-2190.271 -523.487
H2SO4(H2O)6(l)
FACT
-2987.488 -714.027
(H2SO4)2(H2O)13(l) FACT
-5974.845 -1428.022
Ag(l)
FACT
-12.178
-2.911
AgNO3(l)
FACT
-178.948
-42.77
Ag2S(l)
FACT
-89.994
-21.509
Ag2SO4(l)
FACT
-788.963 -188.567
Ag, N , S especies acuosas:
N2(aq)
FACT
-53.835
-12.867
N3[-]
FACT
233.173
55.73
NH3(aq)
FACT
-126.272
-30.18
NH4[+]
FACT
-179.771
-42.966
N2H4(aq)
FACT
-22.735
-5.434
N2H5[+]
FACT
-69.575
-16.629
HN3(aq)
FACT
200.861
48.007
ONO[-]
FACT
-160.335
-38.321
N2O2[2-]
FACT
-18.017
-4.306
NO3[-]
FACT
-266.118
-63.604
HONO(aq)
FACT
-173.543
-41.478
S[2-]
FACT
39.51
9.443
S2[2-]
FACT
18.733
4.477
S3[2-]
FACT
-0.892
-0.213
S4[2-]
FACT
-19.248
-4.6
105
APENDICE I
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
S5[2-]
FACT
HS[-]
FACT
H2S(aq)
FACT
SO2(aq)
FACT
SO3[2-]
FACT
SO4[2-]
FACT
S2O3[2-]
FACT
S2O4[2-]
FACT
S2O5[2-]
FACT
S2O6[2-]
FACT
S2O8[2-]
FACT
S3O6[2-]
FACT
S4O6[2-]
FACT
S5O6[2-]
FACT
HSO3[-]
FACT
HSO4[-]
FACT
HS2O4[-]
FACT
H2S2O4(aq)
FACT
Ag[+]
FACT
Ag(NH3)[+]
FACT
Ag(NH3)2[+]
FACT
AgOH(aq)
FACT
Ag(OH)2[-]
FACT
AgNO3(aq)
FACT
Ag(NO2)2[-]
FACT
AgSO3[-]
FACT
AgSO4[-]
FACT
Ag(S2O3)2[3-]
FACT
Ag2SO3(aq)
FACT
Ag, N , S solidos:
NH4N3(s)
FACT
N2O4(s)
FACT
N2O5(s)
FACT
NH4NO3(s)
FACT
S(s)
FACT
S(s2)
FACT
NH4HS(s)
FACT
SO3(s)
FACT
(NH4)2(SO4)(s)
FACT
(NH4)2SO4(NH3)3(s) FACT
Ag(s)
FACT
-35.726
-41.2
-89.785
-390.742
-614.144
-913.453
-668.3
-789.881
-1012.702
-1220.79
-1446.329
-1225.468
-1300.458
-1246.315
-683.788
-944.625
-614.63
-616.722
74.622
31.631
-211.452
-92
-260.245
-32.49
-10.042
-440.157
-857.179
-1396.204
-381.1
-8.539
-9.847
-21.459
-93.389
-146.784
-218.32
-159.728
-188.786
-242.042
-291.776
-345.681
-292.894
-310.817
-297.876
-163.429
-225.771
-146.9
-147.4
17.835
7.56
-50.538
-21.989
-62.2
-7.765
-2.4
-105.2
-204.871
-333.701
-91.085
68.979
-99.82
-119.564
-430.732
-13.709
-13.759
-199.171
-484.227
-1275.136
-1589.87
-18.137
16.486
-23.858
-28.576
-102.947
-3.276
-3.288
-47.603
-115.733
-304.765
-379.988
-4.335
106
APENDICE I
115
116
117
118
119
120
121
122
123
124
125
126
127
128
129
130
131
132
133
134
135
136
137
138
139
140
141
142
143
144
145
146
AgN3(s)
Ag2O(s)
Ag2O2(s)
Ag2O3(s)
AgNO2(s)
AgNO3(s)
AgNO3(s2)
Ag2S(s)
Ag2S(s2)
Ag2S(s3)
Ag2SO3(s)
Ag2SO4(s)
Ag2SO4(s2)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
Otros gases:
H(g)
FACT
H2(g)
FACT
O(g)
FACT
O2(g)
FACT
O3(g)
FACT
OH(g)
FACT
H2O(g)
FACT
HOO(g)
FACT
HOOH(g)
FACT
Otros liquidos:
H2O(l)
FACT
HOOH(l)
FACT
Otras especies acuosas:
H[+]
FACT
H2(aq)
FACT
O2(aq)
FACT
OH[-]
FACT
HO2[-]
FACT
HOOH(aq)
FACT
e[-](aq)
ELEM
Otros solidos:
H2O(s)
FACT
264.082
-82.214
-74.406
-9.706
-99.613
-180.732
-180.617
-92.632
-92.319
-91.965
-558.425
-801.366
-794.897
63.117
-19.65
-17.783
-2.32
-23.808
-43.196
-43.169
-22.14
-22.065
-21.98
-133.467
-191.531
-189.985
170.238
-54.519
182.247
-85.296
43.196
-37.457
-320.474
-93.224
-233.214
40.688
-13.03
43.558
-20.386
10.324
-8.952
-76.595
-22.281
-55.739
-316.223
-234.356
-75.579
-56.013
0
-31.292
-61.513
-223.265
-163.262
-248.398
-27.154
0
-7.479
-14.702
-53.362
-39.021
-59.369
-6.49
-311.93
-74.553
107
APENDICE I
Tabla 16.
Valores de Energía libre de las especies presentes en los sistemas
Ca-N-H2O y Ca-S-H2O a 413.15 K.
Número
ΔG(kJ)
Especies
ΔG(kcal)
Referencia
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
Ca, N , S gases:
N(g)
N2(g)
N3(g)
NH(g)
NH2(g)
NH3(g)
HNNH(g)
N2H4(g)
NO(g)
N2O(g)
NO2(g)
NO3(g)
N2O3(g)
N2O4(g)
N2O5(g)
HNO(g)
N2H5OH(g)
HONO(g)
HONO(g)
HONO2(g)
S(g)
S2(g)
S3(g)
S4(g)
S5(g)
S6(g)
S7(g)
S8(g)
HS(g)
H2S(g)
H2S2(g)
NS(g)
SO(g)
SO2(g)
SO3(g)
SSO(g)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
408.981
-79.694
319.861
301.144
109.304
-126.223
121.943
-4.312
2.672
-9.576
-66.783
-34.191
-45.934
-118.241
-133.84
7.734
-315.713
-180.677
-182.719
-245.451
207.222
33.724
29.18
16.084
-19.936
-46.604
-57.432
-80.495
57.912
-106.151
-95.359
171.25
-87.25
-400.159
-502.857
-167.656
97.749
-19.047
76.449
71.975
26.124
-30.168
29.145
-1.031
0.639
-2.289
-15.961
-8.172
-10.979
-28.26
-31.989
1.848
-75.457
-43.183
-43.671
-58.664
49.527
8.06
6.974
3.844
-4.765
-11.139
-13.726
-19.239
13.841
-25.371
-22.791
40.93
-20.853
-95.64
-120.186
-40.071
108
APENDICE I
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
O2S(OH)2(g)
Ca(g)
Ca2(g)
CaH(g)
CaO(g)
CaOH(g)
Ca(OH)2(g)
CaS(g)
Ca, N , S líquidos:
N2H4(l)
HN3(l)
N2O4(l)
(NH4)2O(l)
HONO2(l)
S(l)
H2S2(l)
SO3(l)
O2S(OH)2(l)
H2SO4(H2O)(l)
H2SO4(H2O)2(l)
H2SO4(H2O)3(l)
H2SO4(H2O)4(l)
H2SO4(H2O)6(l)
(H2SO4)2(H2O)13(l)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
-860.293
113.443
234.738
144.959
-50.903
-292.028
-730.225
26.85
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
-1.602
205.929
-108.941
-546.117
-239.866
-13.874
-102.859
-489.746
-881.681
-1219.339
-1546.683
-1869.602
-2190.271
-2987.488
-5974.845
Ca(l)
FACT
CaO(l)
FACT
CaSO4(l)
FACT
Ca, N , S especies acuosas:
N2(aq)
FACT
N3[-]
FACT
NH3(aq)
FACT
NH4[+]
FACT
N2H4(aq)
FACT
N2H5[+]
FACT
HN3(aq)
FACT
ONO[-]
FACT
N2O2[2-]
FACT
NO3[-]
FACT
HONO(aq)
FACT
S[2-]
FACT
S2[2-]
FACT
S3[2-]
FACT
S4[2-]
FACT
-53.835
233.173
-126.272
-179.771
-22.735
-69.575
200.861
-160.335
-18.017
-266.118
-173.543
39.51
18.733
-0.892
-19.248
-205.615
27.114
56.104
34.646
-12.166
-69.796
-174.528
6.417
-0.383
49.218
-26.038
-130.525
-57.329
-3.316
-24.584
-117.052
-210.727
-291.429
-369.666
-446.846
-523.487
-714.027
1428.022
-11.708
-2.798
-583.601 -139.484
-1461.586 -349.327
-12.867
55.73
-30.18
-42.966
-5.434
-16.629
48.007
-38.321
-4.306
-63.604
-41.478
9.443
4.477
-0.213
-4.6
109
APENDICE I
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
116
117
118
119
120
S5[2-]
HS[-]
H2S(aq)
SO2(aq)
SO3[2-]
SO4[2-]
S2O3[2-]
S2O4[2-]
S2O5[2-]
S2O6[2-]
S2O8[2-]
S3O6[2-]
S4O6[2-]
S5O6[2-]
HSO3[-]
HSO4[-]
HS2O4[-]
H2S2O4(aq)
Ca[2+]
CaOH[+]
CaSO4(aq)
Ca, N , S sólidos:
NH4N3(s)
N2O4(s)
N2O5(s)
NH4NO3(s)
S(s)
S(s2)
NH4HS(s)
SO3(s)
(NH4)2(SO4)(s)
(NH4)2SO4(NH3)3(s)
Ca(s)
Ca(s2)
CaH2(s)
Ca3N2(s)
CaO(s)
CaO2(s)
Ca(OH)2(s)
Ca(NO3)2(s)
Ca(NO3)2(H2O)2(s)
Ca(NO3)2(H2O)3(s)
Ca(NO3)2(H2O)4(s)
CaS(s)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
-35.726
-41.2
-89.785
-390.742
-614.144
-913.453
-668.3
-789.881
-1012.702
-1220.79
-1446.329
-1225.468
-1300.458
-1246.315
-683.788
-944.625
-614.63
-616.722
-520.509
-718.393
-1438.443
-8.539
-9.847
-21.459
-93.389
-146.784
-218.32
-159.728
-188.786
-242.042
-291.776
-345.681
-292.894
-310.817
-297.876
-163.429
-225.771
-146.9
-147.4
-124.405
-171.7
-343.796
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
FACT
68.979
-99.82
-119.564
-430.732
-13.709
-13.759
-199.171
-484.227
-1275.136
-1589.87
-17.7
-17.267
-204.223
-486.291
-651.554
-695.191
-1022.361
-1019.763
-1656.656
-1975.31
-2293.587
-497.546
16.486
-23.858
-28.576
-102.947
-3.276
-3.288
-47.603
-115.733
-304.765
-379.988
-4.23
-4.127
-48.811
-116.226
-155.725
-166.155
-244.35
-243.729
-395.95
-472.111
-548.18
-118.916
110
APENDICE I
121
122
123
124
125
126
127
128
129
130
131
132
133
134
135
136
137
138
139
140
141
142
143
144
145
146
CaSO3(s)
CaSO4(s)
CaSO4(s2)
CaSO3(H2O)2(s)
CaSO4(H2O)2(s)
(CaSO4)2(H2O)(s)
(CaSO4)2(H2O)(s2)
FACT
FACT
FACT
FACT
FACT
FACT
FACT
Otros gases:
H(g)
FACT
H2(g)
FACT
O(g)
FACT
O2(g)
FACT
O3(g)
FACT
OH(g)
FACT
H2O(g)
FACT
HOO(g)
FACT
HOOH(g)
FACT
Otros líquidos:
H2O(l)
FACT
HOOH(l)
FACT
Otras especies acuosas:
H[+]
FACT
H2(aq)
FACT
O2(aq)
FACT
OH[-]
FACT
HO2[-]
FACT
HOOH(aq)
FACT
e[-](aq)
ELEM
Otros sólidos:
H2O(s)
FACT
-1215.196
-1479.624
-1474.938
-1832.27
-2106.747
-3266.247
-3265.187
-290.439
-353.639
-352.519
-437.923
-503.525
-780.652
-780.398
170.238
-54.519
182.247
-85.296
43.196
-37.457
-320.474
-93.224
-233.214
40.688
-13.03
43.558
-20.386
10.324
-8.952
-76.595
-22.281
-55.739
-316.223
-234.356
-75.579
-56.013
0
-31.292
-61.513
-223.265
-163.262
-248.398
-27.154
0
-7.479
-14.702
-53.362
-39.021
-59.369
-6.49
-311.93
-74.553
111
APENDICE II
Tabla 17.
Efecto de la velocidad sobre la disolución.
CONDICIONES 413.15 K, 965 kPa, 300 rpm, 5 ml Queb, 1M HNO3
TIEMPO
[Pb %]
[Ag %]
[Fe%]
[Cu%]
[Zn%]
0
3.99
42.67
5
54.72
5.52
44.72
10
51.73
7.06
59.92
20
59.01
9.52
84.18
30
60.68
13.81
84.76
60
60.06
13.51
92.07
90
61.12
11.97
83.01
120
59.01
13.51
89.15
150
57.78
15.96
87.69
180
58.40
24.86
88.27
92.32
79.47
210
63.40
22.41
85.35
89.29
90.24
240
60.94
31.92
94.70
90.19
74.95
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
413.15, 965 kPa, 500 rpm, 5 ml Queb, 1M HNO3
[Pb %]
49.72
48.58
45.86
51.91
47.88
44.90
60.15
64.71
58.31
60.85
40.60
49.72
[Ag %]
7.98
35.91
19.34
45.73
45.43
48.50
79.19
88.70
79.50
71.21
168.51
51.87
[Fe%]
18.12
56.70
70.15
87.98
90.32
96.75
107.85
105.22
99.96
103.47
104.05
108.15
[Cu%]
[Zn%]
90.43
90.84
92.07
88.30
90.45
92.61
CONDICIONES 413.15 K, 965 kPa, 700 rpm, 5 ml Queb, 1M HNO3
TIEMPO
[Pb %]
[Ag %]
[Fe%]
[Cu%]
[Zn%]
0
43.05
10.44
33.32
5
58.40
15.04
65.47
10
58.75
20.87
68.69
20
68.83
17.19
70.44
30
58.84
11.97
73.95
60
106.98
24.55
80.96
90
53.14
23.33
62.55
120
54.45
24.86
79.50
150
81.46
29.16
74.82
180
57.43
41.13
78.62
73.21
63.10
210
71.55
43.59
79.79
71.45
59.44
240
53.84
53.71
82.13
73.41
57.07
112
APENDICE II
Tabla 18.
Efecto del agente surfactante sobre la disolución.
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
[Pb %]
7.54
29.37
28.59
33.76
34.90
39.28
34.81
40.51
38.76
39.28
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
[Pb %]
3.60
29.11
28.32
44.02
33.32
37.62
36.83
49.37
37.09
36.92
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
[Pb %]
60.06
11.49
16.31
28.32
24.11
39.81
32.88
33.85
34.46
44.02
415.15 K, 965 kPa, 500 rpm, 3 ml Queb.
[Ag %]
1.23
2.46
2.15
2.76
3.07
2.76
2.15
3.38
2.76
2.15
[Fe%]
5.26
36.24
28.06
11.11
11.69
7.60
4.09
4.09
4.68
4.09
[Cu%]
[Zn%]
59.62
48.46
140°C, 140 psi, 500 rpm, 5 ml Queb., 0.18M HNO3
[Ag %]
0.61
0.61
0.00
0.61
1.23
1.84
2.46
3.68
0.92
1.53
[Fe%]
4.97
5.26
5.55
2.05
4.97
2.34
2.92
3.80
5.55
6.43
[Cu%]
[Zn%]
54.38
46.09
[Cu%]
[Zn%]
13.38
37.69
140°C, 140 psi, 500 rpm, 7 ml Queb.
[Ag %]
2.15
3.68
2.46
2.46
5.22
6.14
4.30
3.07
0.61
1.53
[Fe%]
2.63
11.98
17.54
12.86
7.60
2.92
5.55
5.26
4.09
4.97
113
APENDICE II
Tabla 19.
Efecto de la concentración de
HNO3
a 373.15 K sobre la
disolución.
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
373.15 K, 965 kPa, 500 rpm, 5 ml Queb, 0.18M HNO3
[Pb %]
[Ag %]
[Fe%]
[Cu%]
4.38
2.15
5.85
8.33
3.99
8.48
10.70
2.15
7.60
14.21
2.15
11.69
14.82
2.15
10.52
22.27
2.46
16.37
32.09
3.38
18.41
27.01
3.07
19.29
29.46
3.38
21.34
25.95
7.06
19.00
0.05
46.03
3.68
24.84
0.05
31.30
2.15
27.77
0.05
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
373.15 K, 965 kPa, 500 rpm, 5 ml Queb, 0.75M
HNO3
[Pb %]
[Ag %]
[Fe%]
[Cu%]
18.76
6.14
15.49
24.03
8
17.54
37.35
14.43
19.88
53.49
7.67
28.94
61.64
6.75
38.87
64.36
10.13
38.58
66.55
15.96
50.86
68.48
20.26
60.50
65.24
14.12
59.33
64.80
17.50
63.43
64.24
66.82
18.72
61.09
65.06
61.99
17.50
54.95
63.84
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
373.15 K, 965 kPa, 500 rpm, 5 ml Queb, 1M HNO3
[Pb %]
[Ag %]
[Fe%]
[Cu%]
63.92
6.14
10.52
55.59
5.22
21.04
66.20
14.73
31.27
67.00
31.61
40.34
67.25
59.85
54.95
68.48
54.94
69.86
80.93
70.60
74.24
67.08
58.93
75.99
65.76
73.05
79.50
65.15
74.89
77.75
76.93
68.31
88.40
74.24
78.57
68.92
85.02
84.18
79.79
[Zn%]
34.46
34.46
38.77
[Zn%]
75.38
79.69
75.38
[Zn%]
88.30
100
99.07
114
APENDICE II
Tabla 20.
Efecto de la concentración de
HNO3
a 413.15 K sobre la
disolución.
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
140°C, 140 psi, 500 rpm, 5 ml Queb., 0.18M HNO3
[Pb %]
3.60
29.11
28.32
44.02
33.32
37.62
36.83
49.37
37.09
36.92
[Ag %]
0.61
0.61
0.00
0.61
1.23
1.84
2.46
3.68
0.92
1.53
[Fe%]
4.97
5.26
5.55
2.05
4.97
2.34
2.92
3.80
5.55
6.43
[Cu%]
[Zn%]
54.38
46.09
140°C, 140 psi, 500 rpm, 5 ml Queb, 0.75M HNO3
[Pb %]
13.59
32.88
41.74
47.26
51.21
55.15
47.79
43.05
44.11
37.53
44.37
43.23
[Ag %]
7.98
11.05
15.65
30.39
43.28
61.39
53.41
57.09
45.12
60.16
78.27
89.01
[Fe%]
16.95
34.78
54.36
61.67
62.84
70.15
73.36
61.38
63.13
64.30
69.56
63.13
[Cu%]
[Zn%]
77.75
83.48
78.57
92.61
94.76
90.45
140°C, 140 psi, 500 rpm, 5 ml Queb, 1M HNO3
[Pb %]
49.72
48.58
45.86
51.91
47.88
44.90
60.15
64.71
58.31
60.85
40.60
49.72
[Ag %]
7.98
35.91
19.34
45.73
45.43
48.50
79.19
88.70
79.50
71.21
100.0
51.87
[Fe%]
18.12
56.70
70.15
87.98
90.32
96.75
100.0
100.0
99.96
103.47
100.0
100.0
[Cu%]
[Zn%]
90.43
90.84
92.07
88.30
90.45
92.61
115
APENDICE II
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
Tabla 21.
140°C, 140 psi, 500 rpm, 5 ml Queb, 2M HNO3
[Pb %]
24.64
48.93
47.26
45.86
46.91
48.75
47.00
47.79
45.68
49.19
43.40
41.91
[Ag %]
10.13
34.68
76.73
37.75
54.33
63.23
59.55
39.29
57.09
56.48
44.51
62.62
[Fe%]
24.26
92.95
90.32
100.0
100.0
100.0
100.0
100.0
100.0
100.0
100.0
100.0
[Cu%]
[Zn%]
90.84
88.80
91.25
94.76
100.0
86.15
Efecto de la concentración del ión calcio a 413.15 K sobre la
disolución.
CONDICIONES
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
140°C, 140psi, 500 rpm, 5 ml Queb, 1M NO3-, 0.2M Ca2+
[Pb %]
[Ag %]
[Fe%]
[Cu%]
39.20
5.83
30.69
38.23
18.72
42.09
42.00
21.49
59.92
69.97
31.31
65.76
51.47
54.63
76.29
49.45
20.87
81.26
51.47
48.50
77.46
67.34
92.08
77.75
100.0
31.61
72.49
100.0
44.51
78.92
95.75
100.0
42.05
75.12
97.39
99.00
90.24
83.30
95.92
CONDICIONES
140°C, 140psi, 500 rpm, S/Quebracho, 1M NO3-, 0.5M
Ca2+
[Pb %]
[Ag %]
85.23
3.53
59.45
4.60
58.00
4.14
48.58
5.22
84.53
3.53
49.10
3.99
66.99
3.99
69.97
4.45
53.31
4.45
39.98
5.06
70.85
4.30
346.36
5.83
TIEMPO
0
5
10
20
30
60
90
120
150
180
210
240
[Zn%]
51.69
100.0
75.38
116
APENDICE III
Tabla 22. Equilibrio en el sistema Pb-H2O a 413.15 K y 10 atm.
Numero
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
117
Reacción
PbO2(S)+4H++2eÆPb2++2H2O
4PbO2(S)+12H++8eÆPb4(OH)44++4H2O
3PbO2(S)+4H++4eÆPb3O4(S)+2H2O
4Pb3O4(S)+20H++8eÆ3Pb4(OH)44++4H2O
2Pb3O4(S)+8H++4eÆPb6(OH)84+
Pb3O4(S)+2H++2eÆ3PbO(S)+H2O
6PbO(S)+4H++2H2OÆ Pb6(OH)84+
2Pb6(OH)84++4H+Æ3Pb4(OH)44++4H2O
Pb4(OH)44++4H+Æ4Pb2++4H2O
Pb2++2eÆPb(S)
Pb4(OH)44++4H++8eÆ4Pb(S)+4H2O
Pb6(OH)84++8H++12eÆ6Pb(S)+8H2O
4PbO(S)+2H++2eÆPb(S)+H2O
O2(g)+4H++4eÆ2H2O
2H++2eÆH2(g)
Línea de equilibrio
E=1.4398-0.041log{Pb2+}-0.1640pH
E=1.2714-0.102log{ Pb4(OH)44+}-0.1229pH
E=1.0806-0.0819pH
E=1.6528-0.0102log{ Pb4(OH)44+}3-0.2049pH
E=1.4463-0.021log{ Pb6(OH)84+}-0.1639pH
E=1.014-0.0819pH
pH=5.27-0.25log{ Pb6(OH)84+}
4+
{Pb4 (OH ) 4 }3
pH=5.04-0.25log
4+
{Pb6 (OH ) 8 }2
pH=4.11-0.25log
{Pb 2 + }4
4+
{Pb4 (OH ) 4 }
E=-0.1665-0.041log{Pb2+}
E=0.0019+0.21log{ Pb4(OH)44+}-0.0409pH
E=0.0708-0.0068log{ Pb6(OH)84+}-0.0547pH
E=0.2149-0.0819pH
E=1.1361+0.02logpO2-0.082pH
E=0.0011-0.041logpH2-0.082pH
APENDICE III
Tabla 23. Equilibrio en el sistema Ag-H2O a 413.15 K y 10 atm.
Numero
1
2
3
4
5
6
7
8
9
Reacción
Ag2O3(S)+6H++4eÆ2Ag++3H2O
Ag2O3(S)+2H++2eÆAg2O2(S)+H2O
Ag2O2(S)+4H++2eÆ2Ag++2H2O
Ag2O2(S)+4H++2eÆAg2O(S)+H2O
Ag2O(S)+2H+Æ2Ag++H2O
Ag+ +eÆAg(S)
Ag2O(S)+2H++2eÆ2Ag(S)+H2O
O2(g)+4H++4eÆ2H2O
2H++2eÆH2(g)
Línea de equilibrio
E=1.7646-0.0204log{Ag+}2 -0.1229pH
E=1.6924-0.0819pH
E=1.8368-0.0409log{Ag+}2-0.1639pH
E=1.3976-0.0819pH
pH=5.36-0.5log{Ag+}2
E=0.6798-0.0819log{Ag+}
E=1.1191-0.0819pH
E=1.1361+0.02logpO2-0.082pH
E=0.0011-0.041logpH2-0.082pH
Tabla 24. Equilibrio en el sistema Ag-S-H2O a 413.15 K y 10 atm.
Numero Reacción
1
Ag2O3(S)+S2O82-+2H++2e Æ Ag2O3(S)+2HSO4-
118
2
3
4
5
Ag2O3(S)+HSO4-+6H++4e Æ 2Ag2O3(S)+HSO4-+3H2O
Ag++HSO4-+e Æ Ag(S)+HSO43Ag(S)+HSO4-+7H++6e Æ Ag(S)+Ag2S(S)+4H2O
Ag(S)+Ag2S(S)+2H++2e Æ 3Ag(S)+H2S(g)
6
7
O2(g)+4H++4eÆ2H2O
2H++2eÆH2(g)
Línea de equilibrio
−
{HSO4 }2
E=2.001-0.041log
-0.0819pH
2−
{S 2 O8 }
E=1.7646-0.0205log{Ag+}2-0.1229pH
E=0.9313+0.0819log{Ag+}
E=0.3691+0.0068log{HSO4-}-0.0956pH
E=-0.0234-0.0409pH2S
-0.0819pH
E=1.1361+0.02logpO2-0.082pH
E=0.0011-0.041logpH2-0.082pH
APENDICE III
Tabla 25. Equilibrio en el sistema Pb-N-H2O a 413.15 K y 10 atm.
Numero Reacción
1
PbO2(S)+NO3-+4H++2eÆPb2++ NO3-+2H2O
2
3
4
5
PbO2(S)+2NO3-+12H++10eÆPbO2(S)+N2(g)+6H2O
3PbO2(S)+NO3-+4H++4eÆPb3O4(S)+NO3- +2H2O
Pb2++2NO3-+ 12H++10eÆPb2+ +N2(g) +6H2O
2Pb3O4(S)+2NO3+12H++10eÆPb3O4(S)+N2(g)+6H2O
6
7
8
9
10
11
12
Pb3O4(S)+NO3-+2H++12eÆ3PbO(S)+NO3-+H2O
PbO(S)+N2(g)+ +4H++12eÆPb2++N2(g)+2H2O
4PbO2(S)+N2(g)+12H++8eÆPb4(OH)44++N2(g)+4H2O
4Pb3O4(S)+N2(g)+20H++8eÆ3Pb4(OH)44++N2(g)+4H2O
Pb3O4(S)+N2(g)+ +8H++4eÆPb6(OH)84++N2(g)
Pb3O4(S)+N2(g)+2H++12eÆ3PbO(S)+N2(g)+H2O
PbO(S)+2NO3-+12H++10eÆPbO(S)+N2(g)+6H2O
13
Pb4(OH)44++N2(g)+ +4H+Æ4Pb2++N2(g)+4H2O
14
15
119
2Pb6(OH)84++N2(g)+4H+Æ3Pb4(OH)44++N2(g)+4H2O
6PbO(S)+N2(g)+4H++2H2OÆPb6(OH)84++N2(g)
Línea de equilibrio
E=1.2159-0.0082log
E=1.2159-0.0082log
pN 2
−
{NO3 }2
pN 2
−
{NO3 }2
-0.1640pH
-0.0984pH
E=1.0806-0.0819pH
E=1.2159-0.0082log
E=1.2159-0.0082log
pN 2
−
{NO3 }2
pN 2
−
{NO3 }2
-0.0984pH
-0.0984pH
E=1.014-0.0819pH
E=1.4398-0.041log{Pb2+}-0.1640pH
E=1.2714-0.0102log{ Pb4(OH)44+}-0.1229pH
E=1.6528-0.0102log{ Pb4(OH)44+}3-0.2049pH
E=1.4493-0.021log{ Pb6(OH)84+}-0.1639pH
E=1.014-0.0819pH
pN 2
E=1.2159-0.0089log
-0.0984pH
−
{NO3 }2
pH=4.11-0.25log
{Pb 2 + }4
4+
{Pb4 (OH ) 4 }
4+
pH=5.04-0.25log
{Pb4 (OH ) 4 }3
4+
{Pb6 (OH ) 8 }2
pH=5.27-0.25{Pb6(OH)84+}
APENDICE III
16
Pb2++N2(g)+8H++6eÆPb2++2NH4+
17
PbS(S)+N2(g)+8H++6eÆPb(S)+2NH4+
{NH 4 }2
E=0.2019-0.0137log
-0.1093pH
pN 2
18
PbS(S)+N2(g)+6H++6eÆPbS(S)+2NH3(aq)
{NH 3 }2
E=-0.017-0.0137log
-0.082pH
pN 2
19
PbS(S)+NH3(aq) +H+ÆPb(S)+NH4+
20
21
22
23
24
25
26
120
Pb2++NH4++2eÆPb(S)+NH4+
Pb2++N2(g)+2eÆPb(S)+N2(g)
Pb4(OH)44++N2(g)+4H++8eÆ4Pb(S)
+N2(g)+4H2O
Pb6(OH)84++N2(g)+8H++12eÆ6Pb(S)+N2(g)+8H2O
PbO(S)+N2(g)+2H++2eÆPb(S)+N2(g)+H2O
O2(g)+4H++4eÆ2H2O
2H++2eÆH2(g)
+
E=0.2019-0.0137log
{NH 4 }2
-0.1093pH
pN 2
+
+
+
pH=6.77-log
{NH 4 }
+
{NH 3 }
E=-0.1665-0.041log{Pb2+}
E=-0.1665-0.041log{Pb2+}
E=0.0019+0.021log{Pb4(OH)44+}-0.0409pH
E=0.0708-0.068log{Pb6(OH)84+}-0.0547pH
E=0.2149-0.0819pH
E=1.1361+0.0205logpO2-0.082pH
E=0.0011-0.041logpH2-0.082pH
APENDICE III
Tabla 26. Equilibrio en el sistema Ag-N-H2O a 413.15 K y 10 atm.
Numero
1
2
3
4
5
6
Reacción
Ag2O3(S)+NO3-+6H++4eÆ2Ag++NO3-+3H2O
Ag2O3(S)+NO3-+2H++2eÆAg2O2(S)+NO3-+H2O
Ag2O2(S)+NO3-+4H++2eÆ2Ag++NO3-+2H2O
Ag2O2(S)+NO3-+2H++2eÆAg2O(S)+NO3-+H2O
Ag2O(S)+2H++2eÆ2Ag++NO3-+H2O
Ag++2NO3-+2H++2eÆAg++N2(g)+6H2O
7
8
9
Ag2O(S)+NO3-+2H++2eÆ2Ag(S)+NO3-+H2O
Ag++N2(g)+eÆ Ag(S)+N2(g)
Ag(S)+2NO3-+12H++10eÆAg(S)+N2(g)+6H2O
10
Ag(S)+N2(g)+8H++6eÆAg(S)+2NH4+
11
Ag(S)+N2(g)+6H++6eÆAg(S)+NH3(aq)
Línea de equilibrio
E=1.7646-0.0204log{Ag+}2 -0.1229pH
E=1.6924-0.0819pH
E=1.8368-0.0409log{Ag+}2 -0.1639pH
E=1.3976-0.0819pH
pH=5.36-0.5log{Ag+}2
pN 2
E=1.2159-0.0082log
-0.0984pH
−
{NO3 }2
E=1.1191-0.0819pH
E=6798-0.0819log{ Ag+}
pN 2
E=1.2159-0.0082log
-0.0984pH
−
{NO3 }2
+
E=0.2019-0.0137log
{NH 4 }2
-0.1093pH
pN 2
E=-0.0171-0.0137log
12
13
14
121
Ag(S)+NH3(aq)+H+ÆAg(S)
+NH4+
O2(g)+4H++4eÆ2H2O
2H++2eÆH2(g)
{NH 3( aq ) }2
pN 2
pH=6.77
E=1.1361+0.02logpO2-0.082pH
E=0.0011-0.041logpH2-0.082pH
-0.082pH
APENDICE III
Tabla 27. Equilibrio en el sistema Pb-S-H2O a 413.15 K y 10 atm.
Numero Reacción
1
PbO2(S)+S2O82-+2H++12eÆPbO2(S)+ 2HSO42
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
122
Línea de equilibrio
−
{HSO4 }2
E=2.001-0.041log
-0.0819pH
2−
{S 2 O8 }
2PbO2(S)+HSO4+3H++2eÆPbO2(S)+PbSO4(S)+2H2O
E=1.6147+0.041log{HSO4-}-0.1229pH
PbO2(S)+PbSO4(S)+4H++2eÆPb2++ PbSO4(S)+2H2O
E=1.4398-0.041log{Pb-+}-0.1639pH
2PbO2(S)+PbSO4(S)+4H++eÆPbO2(S)+PbO.PbSO4(S)+2H2O
E=1.2821-0.0819pH
+
2+
PbO2(S)+PbO.PbSO4(S)+4H +2eÆPb +PbO.PbSO4(S)+2H2O E=1.4398-0.041log{Pb2+}-0.1639pH
Pb2++PbO.PbSO4(S)+2H+Æ2Pb2++PbSO4(S)+H2O
pH=2.84-0.5log{Pb2+}
2+
+
2+
Pb +PbSO4(S)+8H +6eÆ2Pb +S(S)+4H2O
E=0.2372-0.0136log{Pb2+}-0.1093pH
2Pb2++PbSO4(S)+8H++10eÆPb2++PbS(S)+4H2O
E=0.1469+0.0081log{Pb2+}-0.0655pH
2+
+
2+
Pb +PbO.PbSO4(S)+10H +6eÆ3Pb +PbS(S)+3H2O
E=0.5278-0.0136log{Pb2+}2-0.1366pH
Pb2++S(S)+2H++2eÆPb2++H2S(g)
E=0.1414-0.0409logpH2S-0.0819pH
2+
2+
2Pb +S(S)+2eÆPb +PbS(S)
E=0.3308+0.0409log{Pb2+}
2+
+
2+
Pb +PbS(S)+2H Æ2Pb +H2S(g)
pH=-2.31-0.5log{Pb2+}-0.5logpH2S
Pb2++H2S(g)+2eÆ2PbS(S)+H2S(g)
E=0.1665+0.0409log{Pb2+}
2+
Pb +PbS(S)+2eÆPb(S)+PbS(S)
E=-0.1665+0.0409log{Pb2+}
Pb(S)+PbS(S)+2H++2eÆ2Pb(S)+H2S(g)
E=-0.3559-0.0409logpH2S-0.0819pH
+
O2(g)+4H +4eÆ2H2O
E=1.1361+0.0205logpO2-0.082pH
2H++2eÆH2(g)
E=0.0011-0.041logpH2-0.082pH
APENDICE III
Tabla 28. Equilibrio en el sistema Pb-N-S-H2O a 413.15 K y 10 atm.
Número
Reacción
2+
1
PbO2(S)+NO3 +S2O8 +2H +2eÆPbO2(S)+2HSO4-+NO32
PbO2(S)+S2O82-+NO3-+2eÆPbO2(S)+2SO42-+NO3-
2−
E=2.01-0.041log
{SO4 }2
2−
{S 2O8 }
3
4
PbO2(S)+SO42-+NO3-+H+ÆPbO2(S)+HSO4-+NO32PbO2(S)+HSO4-+NO3-+3H+ÆPbO2(S)+HSO4-+NO3-
pH=3.94
−
E=1.758-0.163pH-0.041log {HSO4 }
5
2PbO2(S)+SO42-+NO3-+4H++2eÆPbO2(S)+PbSO4(S)+NO3+2H2O
E=1.5964-0.164pH-0.041log {SO4 }
6
PbSO4(S)+PbO2(S)+NO3-+4H++2eÆPbSO4(S)+Pb2+ +NO3-+2H2O
7
8
2PbSO4(S)+PbO2(S)+NO3-+2H++2eÆPbO.PbSO4(S)+PbSO4(S)+NO3-+H2O
PbO.PbSO4(S)+PbSO4(S)+NO3+2H+Æ2PbSO4(S)+Pb2++NO3-+H2O
E=1.4398-0.123pH-0.041log {Pb 2+ }
E=1.2253-0.0819pH
pH=2.6188-0.5log {Pb 2+ }
9
PbSO4(S)+Pb2++2NO3-+12H++10eÆPbSO4(S)+Pb2+ +N2(g)+6H2O
10
PbO.PbSO4(S)+PbSO4(S)+2NO3+12H++10eÆPbO.PbSO4(S)+PbSO4(S)+N2(g)+6H2O
11
PbO.PbSO4(S)+PbSO4(S)+N2(g)+2H+Æ 2PbSO4(S)+Pb2++ N2(g)+H2O
12
PbSO4(S)+Pb2++N2(g)+8H++6eÆ
2Pb2++S(S)+N2(g)+4H2O
13
14
15
PbSO4(S)+Pb2++N2(g)+8H++8eÆPbS(S)+Pb2++N2(g)+4H2O
PbO.PbSO4(S)+PbSO4(S)+N2(g)+8H++8eÆ PbO.PbSO4(S)+PbS(S)+N2(g)+4H2O
Pb2++S(S)+N2(g)+8H++6eÆPb2++S(S)+2NH4+
16
2Pb2++S(S)+N2(g)+2eÆPbS(S)+Pb2++N2(g)
123
Línea de equilibrio
−
{HSO4 }2
E=2.01-0.0825pH-0.0206log
2−
{S2O8 }
2−
E=1.2159-0.0984pH-0.0082log
pN 2
−
{NO3 }2
E=1.2159-0.0984pH-0.0082log
pN 2
−
{NO3 }2
pH=2.6188-0.5log {Pb 2+ }
E=0.2432-0.1093pH
-0.0137log {Pb 2+ }
E=0.2652-0.082pH
E=0.2652-0.082pH
+
E=0.2124-0.1093pH-0.014log
E=0.3311+0.0409log{Pb2+}
{NH 4 }2
pN 2
APENDICE III
17
18
Pb2++S(S)+NH4++2H++2eÆPb2++H2S(g)+NH4+
2Pb2++S(S)+NH4++2eÆPbS(S)+Pb2++NH4+
E=0.1976-0.082pH
E=0.3311+0.0409log {Pb 2+ }
19
PbS(S)+Pb2++N2(g)+8H++6eÆPbS(S)+Pb2++2NH4+
{NH 4 }2
E=0.2124-0.1093pH-0.014log
pN 2
20
E=-0.1665+0.041 {Pb 2+ }
21
PbS(S)+Pb2++N2(g)+2eÆPbS(S)
+Pb(S)+N2(g)
PbO.PbSO4(S)+PbS(S)+N2(g)+10H++8eÆ 2PbS(S)+Pb2+ +N2(g)+5H2O
22
PbS(S)+Pb2++NH4++2H+Æ2Pb2++H2S(g)+NH4+
23
Pb2++H2S(g)+NH4++2eÆPb(S)+H2S(g)+NH4+
E=-0.1665+0.041 {Pb 2+ }
24
E=-0.1665+0.041 {Pb 2+ }
25
PbS(S)+Pb2++NH4++2eÆPbS(S)
+Pb(S)+NH4+
PbS(S)+Pb(S)+N2(g)+8H++6eÆPbS(S)+Pb(S)+2NH4+
26
27
28
PbS(S)+Pb(S)+NH4++2H++2eÆ2Pb(S)+H2S(g)+NH4+
O2(g)+4H++4eÆ2H2O
2H++2eÆH2(g)
E=-0.3-0.082pH-0.041log pH 2 S
E=1.1361-0.082pH+0.025log pO2
E=0.0011-0.082pH-0.041log pH 2
124
+
E=0.3188-0.1025pH +0.041 {Pb 2+ }
pH=-1.6286-0.5log
{Pb 2+ }2
pH 2 S
+
E=0.2019-0.1093pH-0.014log
{NH 4 }2
pN 2
APENDICE III
Tabla 29. Equilibrio en el sistema Ag-N-S-H2O a 413.15 K y 10 atm.
Número
1
Reacción
Ag2O3(S)+ NO3-+S2O82-+2H++2eÆAg2O3(S)+2HSO4-+2NO3-
2
2Ag2O3(S)+2HSO4-+NO3-+2eÆAgSO4-+Ag2O3(S)+NO3-+3H2O
3
1
1
Ag2O3(S)+NO3-+3H+ +2eÆAg2SO4(S)+AgSO4-+NO3-+ H2O
2
2
+
Ag2SO4(S)+AgSO4 +2NO3 +12H +10eÆAg2SO4(S)+AgSO4 +N2(g)+2H2O
4
2AgSO4-+
5
6
Ag2SO4(S)+AgSO4-+N2(g)+eÆ2AgSO4-+Ag(S)+N2(g)
AgSO4-+ Ag(S)+N2(g)+H++eÆAg(S)+HSO4-+N2(g)
7
8
9
2Ag(S)+2HSO4-+N2(g)+7H++6eÆAg2S(S)+HSO4-+N2(g)+4H2O
2Ag2S(S)+HSO4-+N2(g)+7H++6eÆAg2S(S)+S(S)+N2(g)+4H2O
Ag2S(S)+S(S)+N2(g)+8H++6eÆAg2S(S)+S(S)+2NH4+
10
11
12
Ag2S(S)+S(S)+N2(g)+2H++2eÆAg2S(S)+H2S(g)+N2(g)
Ag2S(S)+S(S)+NH4++2H++2eÆAg2S(S)+H2S(g)+NH4+
Ag2S(S)+H2S()+N2(g)+8H++6eÆAg2S(S)+H2S(g)+2NH4+
13
27
28
Ag2S(S)+H2S()+NH4++2H++2eÆ2Ag(S)+2H2S(g)+NH4+
O2(g)+4H++4eÆ2H2O
2H++2eÆH2(g)
125
Línea de equilibrio
−
{HSO4 }2
E=2.001-0.0819pH-0.041log
2−
{S2O8 }
E=1.6981-0.0204log{AgSO4-}2
+0.0204log{HSO4-}2-0.0819
E=1.8620+0.0409log{AgSO4-}-0.1229pH
pN 2
0.0984pH
−
{NO3 }2
E=0.4849-0.0819log{AgSO4-}
E=0.8128+0.0819log{AgSO4-}
-0.0819log{HSO4-}-0.0819pH
0.3691+0.0136log{HSO4-}-0.0819pH
E=0.2954+0.0136log{HSO4-}-0.0956pH
+
{NH 4 }
E=0.2019-0.0136log
-0.1093pH
pN 2
E=0.1976-0.0409logpH2S-0.0819pH
E=0.1976-0.0409logpH2S-0.0819pH
+
{NH 4 }
E=0.2019-0.0136log
-0.1093pH
pN 2
E=-0.0234-0.0409pH2S-0.0819pH
1.1361-0.082pH+0.025log pO2
0.0011-0.082pH-0.041log pH 2
E=1.2159 -0.0082log