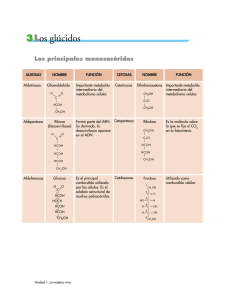
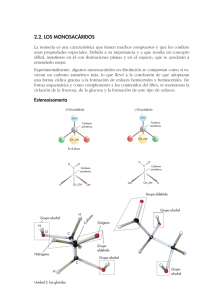
Carbohidratos Funciones Carbohidratos clasificación
Anuncio

Funciones Carbohidratos Dra. Edith Ponce A. Carbohidratos Edulcorantes Agentes funcionales Geles Emulsiones Incrementar viscosidad Crioprotectores Abatir aw Reserva de energía Intermediarios de metabolismo Estructura Defensa clasificación Monosacáridos Oligosacáridos C6H12O6 (C6H10O5)n si, N(2,12) Polisacáridos (C6H10O5)n Biosas Triosas Tetraosas Pentosas Hexosas Disacáridos Trisacaridos Tetrasacaridos Reserva Estructurales gomas Monosacáridos Monosacáridos Poli- hidroxialdehídos o aldosas Polihidroxicetonas o cetosas Azucares simples Cristalizables Solubles en agua Poco solubles en etanol Amplio espectro de dulzura Mutarrotación Desvían la luz polarizada 1 Aldosas y cetosas Gliceraldehído Aldotriosa Dihidroxiacetona Cetotriosa 2 Estructura Pentosas (C5) Hexosas (C6): Aldosas Aldosas: ribosa, arabinosa, xilosa, lixosa Cetosa: ribulosa, xilulosa Aldosas: glucosa, manosa, galactosa Cetosa: fructosa, sorbosa Cetosas Nombre Fuente Hexosas galactosa hexulosa D-fructosa Miel, frutas D-Psicosa Residuos de malazas glucosa Leche, oligo- y polisacáridos Plantas y animales manosa Polisacáridos heptulosa D-mano-2-hetulosa aguacate L-ramnosa Gomas vegetales, glucosidos octulosa D-glicero-D-manosa-Doctulosa Aguacate nonulosa D-eritro-L-gluco-2-nonulosa aguacate 3 Carbonos asimétricos 1 2 3 4 5 6 CHO HCOH 2N = 24 = 16 estereoisómeros HCOH HCOH HCOH H2COH Enantiómeros D y L Configuración del penúltimo átomo de carbono en relación con la del último D-gliceraldehído L-gliceraldehído hemiacetales H R C OR’ + HO R’ O R CH OH C1 hemiacetálico se vuelve asimétrico :. dos esterioisómeros α y β 4 mutarrotación CHO OH HC HO CH HCOH HCOH HOCH HCOH HOCH HOCH HCOH O HCOH HC O HCOH HCOH HC CH2OH CH2OH CH2OH D-α-glucosa D-glucosa D-β-glucosa +112.2° +53° +18.7° t Rotación específica [α]λ Rotación óptica Dextrógira: Rotación óptica a la derecha (+) Levógira: Rotación óptica a la izquierda (- ) t [α]λ = 100 a l c Nombre t l = longitud del polarímtero c = gramos de azúcar en 100 ml de sol. α = ángulo de rotación Nombre t [α]λ [α]λ D(+)glucosa Lα(+) arabinosa +55.4 Dα(+) manosa +29.3 D(-)fructosa Dβ(-) fructosa -133.5 Dβ(-) manosa -17 Dα(+) galactosa +150.7 (+) Maltotriosa +160 Dβ(+) galactosa +52.7 (+) Lactosa +53.6 Poder edulcorante % nombre sacarosa 100 βD-manosa D-fructosa 135 Lactosa D-galactosa 63 xilitol D-glucosa Azúcar invertido 40 127 aspartamo % 150 amargo 130 39 102 10000 poder edulcorante nombre Poder edulcorante D-glucosa D-galactosa maltosa D-fructosa 110 90 70 50 30 10 30 50 temperatura (°C) 5 Conformación La conformación 4C1 es más estable por la posición axial de grupos La conformación 1C4 es menos estable por la posición ecuatorial Fructosa levulosa o azúcar de las frutas y miel. • C6H12O6 Hidrólisis de sacarosa, e inulina cristaliza con dificultad Temperatura de fusión 102 -104 ºC Glucosa HOCH2 O HO HO OH CH2OH •Dextrosa •C6H12O6 •Miel, jugo de numerosas frutas, sangre. •hidrólisis ácida o enzimática de: sacarosa, maltosa, almidón, celulosa, glucógeno. HO •cristaliza en tres formas diferentes y c/u gira el plano de polarización de la luz en distinto grado. CH2OH O OH OH OH 6 Galactosa •C6H12O6 •hidrólisis ácida o enzimática de: lactosa, gomas HO CH2OH O H OH Oligosacáridos OH OH Oligosacáridos Condensación de 2 a 10 monosacáridos mediante un enlace glucosídico Uno de los azucares pierde un –OH unido al carbono anomérico y adquiere el sufijo (- sil) Enlace glucosídico Si uno de los C con la función carbonílica se encuentra libre se denominan azúcares reductores ya que pueden reducir iónes metálicos Maltosa Isomaltosa 4−β−D-Glucopiranosil-α-D-glucopiranosa • 2 unidades Glucosa CH2OH •Enlace α(1,4) O •Reductor •Isomeros α y β OH •hidrolizados de almidón de maiz, cebada OH O •Fermentable, soluble en agua •No cristaliza OH •Elaboración de bebidas fermentadas •Fácil digestión •Elaboración de alimentos infantiles CH2OH O 4−β−D-Glucopiranosil-α-Dglucopiranosa CH2OH O OH OH OH OH • 2 unidades Glucosa •Enlace α(1,6) •Reductor •Isomeros α y β •Cebada, hidrolizados de maíz, almidón •Fermentable, soluble en agua •No cristaliza •Elaboración de bebidas fermentadas HO O OH CH2 O OH HO OH OH 7 Celobiosa Gentobiosa β-D-glucopiranosil-α-D-glucopiranosido 4-β-D-glucopiranosil-Dglucopiranosa CH2OH CH2OH O OH O Glucosa β(1,4) Unidad de la celulosa reductor OH OH O OH 2 unidades de glucosa β(1,6) Reductor presente en amigdalina (glucósido cianogénico presente en almendras) CH2OH O O CH2 OH HO Trehalosa OH OH OH OH O OH OH HO Lactosa 1−α-D-glucopiranosil-α-D-glucopiranosido 4-β-D-galactopiranosil-Dglucopiranosa Galactosa y glucosa Enlace β(1,4) Reductor Isomeros α y β Leche de mamíferos poco soluble 2 unidades de glucosa α(1,1) Carece de grupos aldehído y cetona libres No Reductor hemolinfa de insectos Hongos y levaduras Lactosa CH2OH OH OOH OH O OH Lactosa OH HO Lactasa (β-galactosidasa) OH CH2OH O OH O OH O OH OH OH lactulosa CH2OH O CH2OH OH CH2OH O H OH CH2OH O + OH HO OH galactosa + OH OH OH glucosa OHCH2 4 - -α -D galactopiranosilO OH -D fructofuranosa HO CH2OH CH2OH β(1,4) HO O O Galactosa y fructosa H OH Reductor OH Por epimerización de OH glucosa a fructosa al calentar leche 8 Sacarosa CAÑA TRITURADO β-D-fructofuranosil-α-D-glucopiranosido α-D-glucopiranosil- β-D-fructofuranosido BAGAZO JUGO Proceso de obtención DE AZÚCAR Clarificar Glucosa y fructosa (1,2) Carece de grupos aldehído y cetona libres No sufre mutarrotación No Reductor Elevada solubilidad Fácilmente cristalizable Remolacha, caña de azúcar Granos y frutas Evaporar Centrifugar MELAZAS AZÚCAR EN BRUTO AZUCAR REFINADA Azúcar invertido Galactosacaridos Sacarosa en solución CH2OH O OH [α]λ OH HOCH2 O OH HO t OH OH t [α]λ -20 HO HO CH2OH OH HO CH2 O CH2OH Rafinosa O CH2OH O H OH HO O HO OH HO O OH α(1,6) O α(1,6) O CH2 CH2OH Estaquiosa OH OH H Reacciones de carbohidratos HOCH2 O OH OH HO Gal- glu - fru Gal- gal- glu - fru Gal- gal- gal- glu - fru [α]λ -92 OH O Rafinosa Estaquiosa Verbascosa t [α]λ +52.5 α(1,6) Flatulencia Leguminosas: soya, frijoles, garbanzo, cacahuates, chíncharos Mezcla de glucosa y fructosa CH2OH O OH H CH2OH OH Calor/ácido o invertasa +66 HO O HO t HOCH2 O CH2 O OH HOCH2 O O HO OH HO OH CH2OH 9 Reacciones químicas condiciones reacción HC=O isómeros Enolización/hidrólisis Enoles, Diacetilo, acetoína, ácidos Álcalis (1N) Enolización/ Oxidación Ácidos débiles Enolización (lenta) Isómeros Ácidos fuertes Deshidratación/ ciclización Ácidos glucónicos OHCH OHCH Álcali 1N HCOH HCOH HCOH HCOH CH2OH O=CH HOC HOC OHCH OHCH OHCH HCOH HCOH HCOH HCOH HCOH HCOH HCOH HCOH HCOH CH2OH trans-enol enediol CH2OH CH2OH D-Fructosa 32% cis-enol enediol Poder reductor (Fehling reduccion del CuSO4) Enoles Cu+ + Cu2+ enolización enedioles o reductonas Óxido-reducción Cu+ + azúcares ácidos + H2O oxidación Cu2O (rojo) Ac. D-glucorónico Iones que pueden reducir: Ag +, Hg 2+ , Cu 2+ , Bi 3+ , Fe(CN) métodos de Benedict, Somogyi, Hagendorn-Jensen, etc Deshidratación y ciclización (ácidos) HC=O HCOH HC=O = HC=O HCOH = HCOH H2O CH HCOH HCOH HCOH HCOH 1,2-enol CH2OH CH2OH 3-desoxiosulosa = HCOH CH HCOH 6- Reacciones de oscurecimiento Mecanismo HC=O HC=O -H O 2 reacomodo CH2 CH ciclización HCOH CH2OH D-manosa 3% CH2OH D-glucosa OHCH CH2OH Arreglo de Lobry De Bruyn y Alberda Van Eckenstein Azúcar + álcali reductor HCOH HOCH HCOH D-glucosa 65% hidroximetilfurfural furfural HC=O COOH HCOH OHCH OHCH HOCH2 HCOH CH2OH Oxidación a ácidos glucónicos HC=O HOCH HCOH = Álcalis (0.5N) productos = álcalis (0.05N) enolización Enolización (álcalis débiles 0.05N) HC CH HOCH2C O2 Caramelización No Sustrato Temp. pH óptimo elevada azúcares Sí Alc/ac productos caramelo CCHO O Maillard No Az. reductor + amino No ligeramentea melanoidinas lcalino Oxidación Ac. ascórbico Sí Ac. ascórbico No Ligeramente ácido No Polifenoloxidasa (PPO) sí Comp. fenólicos No Ligeramente alcalino melaninas CH2OH hidroximetil furfufural HMF 10 Oscurecimiento enzimático Caramelización OH Reacciones: O PPO / O2 OH Ocurre a Temp. superiores al punto de fusión pH ácidos/alcalinos Se acelera con ácidos carboxílicos y sales •Sistema enzimático polifenol oxidasa •pH óptimo 7 •Sensibles a tratamiento térmico •Agentes reductores: ácido cítrico, SO2 polimerización (catecolasa) (cresolasa) MELANINAS O Fenoles Deshidratación Polimerización Otras derivados furfural melanoidinas aldehídos, cetonas, pirazinas, etc Quinonas Caramelo Caramelización: fragmentación melanoidinas Mezcla compleja compuestos en forma coloidal. Temperatura superior al punto de fusión Líquido o sólido café oscuro sabor a azúcar quemada/ amargo Soluble en agua SACAROSA (C6H12O6) Azucares O Acidos sacaricos C2H5 O Etil-maltol maltol (C24H36O18) (C36H50O25) CARAMELINA (C125H188O80) HUMINA H3C N CH3 N CH3 N H3C CH3 N N CH2CH3 N CH3 2,3,5-trimetilpirazina 2,5-dimetilpirazina 2-etil5(6)dimetilpirazina Adición de ácidos CARAMELENO OH O CARAMELANA CH3 Furanos, furanonas,lactonas Pironas, aldehídos, cetonas Ácidos, ésteres, pirazinas CH3 OH ISOSACAROSANA Hidrólisis Deshidratación dimerización O Furfural Sulfúrico Acético Cítrico Fosfórico Favorecen formación de furanos baja intensidad de sabor 11 Alcalis Hidroxido Hidroxido Hidroxido Hidroxido Amoniaco y SO2 de de de de sodio potasio amonio calcio Caramelo tipo I absorbancia de caramelo al 0.1% (w/v) en agua, celda de 1-cm a 610 nm base al contenido de sólidos Sulfatado En presencia de ácidos o bases y SO2 Usos Extractos vegetales Aderezos coñac Simple o cáustico sin aditivos Estable en solución alcohólica al 75% Usos Tequila, Ron Etc. Caramelo tipo III (Ammoniacal) Caramelo tipo II Bebidas de cola favorece enolización y fragmentación Sabor intenso Color suave Color Favorecen la producción de pigmentos obscuros de elevado peso molecular Usos En presencia de ácidos o bases y sales de Amonio Color oscuro e intenso Estable en soluciones salinas al 20% Estable a pH 3 Usos Cerveza Salsas y aderezos Productos horneados 12 Clase IV Sulfato - amonio En presencia de ácidos o bases, SO2 y sales de amonio Color oscuro e intenso Estable en soluciones salinas al 20% Estable a pH menor a 2 Usos Bebidas de cola saborizantes Reacción de Maillard:etapas A. Condensación azúcar reductor y grupo amino B. Reordenamiento de los productos de condensación C. Deshidratación de los productos reordenados D. Fisión y Degradación E. Polimerización a melanoidinas Melanoidinas Pigmentos complejos de alto peso molecular Color amarillo al café oscuro Sabor amargo Reacción de Maillard: factores pH alcalino Ea= 30 kcal/mol Q10 = 2 a 3 Aw 0.6 - 0.9 Tipo de aminoácido Tipo de azúcar Reacción de Maillard:inhibición Acido sulfuroso Bloquea grupos carbonilo en degradación de Strecker R - CH=O + H2SO3 HO - C -H OSO2H R Efecto antioxidante Lisina> arginina> histidina> triptofano Aldosas>cetosas: Xilosa>galactosa>glucosa>fructosa>lactosa>maltosa Cu2+ / Fe3+, O2 y radiaciones catalizan formación de melanoidinas Reacción de Maillard:inhibición Refrigeración Acidificación Emplear azúcar no reductor: sacarosa Fermentación de azúcar 13 Reacción de Maillard: efectos Reduce la calidad nutricional Aminoácidos esenciales “lisina” Reduce solubilidad y digestibilidad de proteínas Oscurecimiento y sabores desagradables 14