Gammaglobulina Humana Antitetánica Pasteurizada Grifols® 250 U.I.
Anuncio

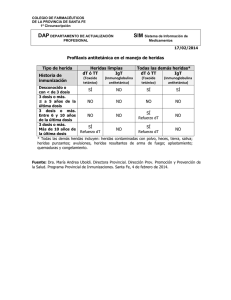
Gammaglobulina Humana Antitetánica Pasteurizada Grifols® 250 U.I. INMUNOGLOBULINA HUMANA ANTITETÁNICA Solución inyectable en jeringa precargada Composición - Principio activo: Inmunoglobulina humana antitetánica (Proteínas humanas (Proporción inmunoglobulina humana - Excipientes: Glicina, Cloruro sódico Agua para inyección c.s.p. 250 U.I. 250 U.I. 160 mg) ≥ 95% Ig) 1 ml Forma farmacéutica y contenido del envase Solución inyectable en jeringa precargada conteniendo 250 U.I. de inmunoglobulina humana antitetánica. Actividad Gammaglobulina Humana Antitetánica Pasteurizada Grifols® es una solución inyectable de inmunoglobulina humana antitetánica que contiene anticuerpos frente a la toxina tetánica y que ha sido sometida a un proceso de pasteurización. Se prepara a partir de una mezcla de plasma de donantes que contiene anticuerpos específicos frente a la toxina de Clostridium tetani. Titular y fabricante Instituto Grifols, S.A. Can Guasch, 2 - Parets del Vallès 08150 Barcelona - ESPAÑA Indicaciones - Profilaxis en personas con heridas recientes que puedan estar contaminadas con esporas tetánicas y que no hayan sido vacunadas durante los 10 últimos años o cuya vacunación haya sido incompleta o se desconozca. - Tratamiento del tétanos manifestado clínicamente. Contraindicaciones El riesgo de la enfermedad del tétanos una vez aparece es tal, que la administración del fármaco prima sobre cualquier contraindicación que éste pudiera tener. (Ver apartado correspondiente a Precauciones). Precauciones No administrar por vía intravascular (posibilidad de shock). Debe administrarse por vía intramuscular, teniendo la precaución de aspirar antes de inyectar para asegurarse de que la aguja no está en un vaso sanguíneo. Son raras las reacciones alérgicas reales tras la inyección intramuscular de inmunoglobulina antitetánica. En caso de shock, deben seguirse las pautas de tratamiento del mismo. Podría aparecer intolerancia a las inmunoglobulinas en aquellos casos excepcionales en que el paciente con deficiencia de IgA tiene anticuerpos contra ésta. Los pacientes deben estar en observación al menos durante 20 minutos después de la administración del producto. Cuando se administran medicamentos derivados de sangre o plasma humanos, no se puede excluir totalmente la aparición de enfermedades debidas a la transmisión de agentes infecciosos. Esto también se refiere a la posible transmisión de patógenos de naturaleza desconocida. Sin embargo, el riesgo de transmisión de agentes infecciosos se reduce por: - La selección de los donantes mediante un reconocimiento médico y el despistaje de AgHBs y anticuerpos frente a VIH y VHC en las donaciones individuales y en las mezclas de plasma. - El análisis de material genómico del VHC en las mezclas de plasma. - Los procedimientos de inactivación/eliminación incluidos en el proceso de producción que han sido validados utilizando virus modelo. Estos procedimientos se consideran efectivos para VIH, VHC, VHA y VHB. Los procedimientos de inactivación/eliminación pueden tener un valor limitado para virus no envueltos tales como parvovirus B19 y otros agentes infecciosos transmisibles. Interacciones e incompatibilidades Vacunas con virus vivos atenuados La administración de inmunoglobulinas puede disminuir durante un periodo de como mínimo 6 semanas hasta 3 meses la eficacia de vacunas con virus vivos atenuados tales como: sarampión, rubéola, paperas, varicela. Interferencias con pruebas serológicas Tras la inyección de inmunoglobulina pueden aparecer falsos resultados positivos en pruebas serológicas, debido al incremento transitorio de varios anticuerpos transmitidos pasivamente a la sangre del paciente. Incompatibilidades Gammaglobulina Humana Antitetánica Pasteurizada Grifols® no debe mezclarse con otros medicamentos. Advertencias Embarazo y lactancia No se ha demostrado la inocuidad de este producto para su uso durante el embarazo con ensayos clínicos controlados por lo que debe administrarse con precaución en mujeres embarazadas y en periodo de lactancia. La experiencia clínica con inmunoglobulinas, particularmente en la administración de inmunoglobulina anti-D, indica que no deben esperarse efectos perjudiciales durante el embarazo, en el feto ni en el recién nacido. Efectos sobre la capacidad de conducción No existe ningún indicio de que la inmunoglobulina humana antitetánica pueda afectar a la capacidad de conducir vehículos o utilizar maquinaria. Posología Inyección intramuscular lenta. En caso de que existan trastornos de la coagulación en los que la inyección intramuscular esté contraindicada, puede administrarse la inmunoglobulina humana antitetánica por vía subcutánea. Seguidamente deberá hacerse una presión manual cuidadosamente con una compresa en el lugar de la inyección. Si se precisan dosis elevadas (≥ 5 ml), se aconseja su administración repartida en dosis fraccionadas y en diferentes regiones anatómicas. Para administrar la vacuna y la inmunoglobulina antitetánicas deben utilizarse distintas jeringas, agujas y lugares de inyección. Aparte de la limpieza o desbridamiento de la herida y de administrar la inyección i.m. de inmunoglobulina humana antitetánica, debe iniciarse simultáneamente la inmunización activa con la vacuna antitetánica administrándose ésta en una zona del cuerpo distinta a la de la inmunoglobulina de acuerdo con las siguientes instrucciones: - Heridas menores y limpias En personas que se sabe han completado su ciclo primario de vacunación antitetánica y que han recibido la última dosis de refuerzo en los últimos 10 años, no está recomendado revacunar ni tampoco la utilización de inmunoglobulina antitetánica. En personas que no han completado su ciclo primario de vacunación antitetánica, en las que se desconoce o es incierto su estado de inmunización, y cuando han transcurrido más de 10 años desde su último refuerzo, se recomienda una dosis de vacuna. No es necesario administrar inmunoglobulina antitetánica. - Heridas mayores o sucias En personas que hayan completado su ciclo de vacunación primaria antitetánica y hayan recibido además su última dosis de refuerzo en los últimos 5 años, no es necesario revacunar; pero si han transcurrido más de 5 años desde su último refuerzo, es necesario administrar una dosis de vacuna. En ambos casos no es necesario administrar inmunoglobulina antitetánica. En personas que no han completado su ciclo primario de vacunación antitetánica, y en las que se desconoce o es incierto su estado de inmunización, además de la dosis de vacuna, se administrará inmunoglobulina antitetánica. La vacuna antitetánica que se utilice puede contener únicamente toxoide tetánico, o toxoide tetánico más toxoide diftérico (vacuna dT adultos). Esta última no debe administrarse en caso de heridas en individuos inmunodeprimidos. Es recomendable que el médico determine si una herida menor es susceptible de estar contaminada, basándose en la probabilidad de que el Clostridium tetani estuviera presente en el objeto causante de la lesión. Niños y adultos deben recibir la misma dosis. - Profilaxis del tétanos Se administrarán 250 U.I. por vía intramuscular. Cuando se trate de heridas anfractuosas (sucias, penetrantes, con destrucción de tejido), o infectadas, si han pasado más de 24 horas desde la producción de la herida, o en adultos cuyo peso sea superior a lo normal, podrá duplicarse la dosis (500 U.I.). - Tratamiento del tétanos manifestado clínicamente Diversos estudios sugieren la utilidad de la administración de inmunoglobulina humana antitetánica en el tratamiento del tétanos manifestado clínicamente utilizando dosis únicas de 3000 a 6000 U.I. por vía intramuscular en combinación con otras terapias clínicas apropiadas. Instrucciones para la correcta administración del preparado Los productos en solución deben someterse a inspección visual de partículas y de coloración antes de su administración. No deberán utilizarse las soluciones que estén turbias o presenten sedimentos. Debe llevarse a temperatura ambiente o temperatura corporal antes de su uso. Sobredosis No se conocen las consecuencias de una sobredosificación. Reacciones adversas Puede observarse dolor local y aumento de la sensibilidad en el lugar de la inyección; esto se puede prevenir, repartiendo las dosis elevadas en varias inyecciones aplicadas en diferentes regiones anatómicas. Ocasionalmente puede aparecer fiebre, reacciones cutáneas y escalofríos. En raras ocasiones se han descrito: náuseas, vómitos, hipotensión, taquicardia y reacciones alérgicas o anafilácticas, incluido el shock. Cuando se administran medicamentos derivados de sangre o plasma humanos, no se puede excluir totalmente la aparición de enfermedades debidas a la transmisión de agentes infecciosos (ver apartado correspondiente a Precauciones). Si se observa cualquier otra reacción adversa, no descrita anteriormente, consulte a su médico o farmacéutico. Conservación Conservar entre 2 y 8 ºC. Caducidad Este medicamento no se debe utilizar después de la fecha de caducidad indicada en el envase. Manténgase fuera del alcance y la vista de los niños Instituto Grifols, S.A. Can Guasch, 2 - Parets del Vallès 08150 Barcelona - ESPAÑA 3020078