La estereoquímica es el estudio de las moléculas en tres
Anuncio

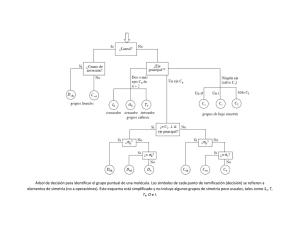
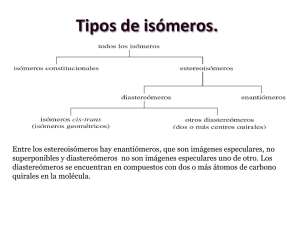
TEMA 2 ESTEREOQUÍMICA La estereoquímica es el estudio de las moléculas en tres dimensiones. Quiralidad vs Aquiralidad Imagen especular original Molécula original Molécula quiral: La molécula rotada no puede superponerse a su imagen especular. Imagen especular original Molécula aquiral: La molécula rotada se superpone a su imagen especular. Molécula original Quiralidad (del griego Cheir que significa mano) es la propiedad que tienen ciertos objetos de poder existir bajo dos formas que son imágenes especulares una de otra y que no se pueden superponer. Enantiomeros - Diasteroisómeros Los Carbonos que tienen unidos 4 grupos diferentes, se llaman Carbonos Quirales o Asimétricos. ENANTIÓMEROS: Son estereoisómeros que son imágenes especulares entre sí, no superponibles. Los enantiómeros tienen igual Propiedades Químicas, pero difieren en la Actividad Optica. 3 Pruebas de Quiralidad: Planos de Simetría Plano de Simetría Aquiral No hay Plano de Simetría Quiral Pruebas de Quiralidad: Planos de Simetría El cis-1,2-diclorociclopentano tiene un plano de simetría especular. Un plano de simetría divide la molécula en dos imágenes especulares internas Cualquier compuesto con un plano de simetría especular interno no puede ser quiral. Pruebas de Quiralidad: Planos de Simetría El trans-1,2-diclorociclopentano no tiene plano de simetría especular. Por lo que estos dos compuestos son quirales Configuración Absoluta Configuración del estereocentro: R/S Cahn, Ingold y Prelog establecieron el sistema de nomenclatura R/S para nombrar la configuración absoluta de un centro quiral. En sentido de las agujas del reloj En sentido contrario a las agujas del reloj Se deja el grupo de prioridad menor (4) hacia atrás y se observa el sentido de giro para ir desde el grupo de más prioridad (1) hacia el de menor (3) de los tres que quedan. Si el sentido es el de las agujas del reloj, la configuración es R (rectus). Al contrario es S (sinister). Resumen de las reglas de prelación El número atómico de los átomos directamente unidos al estereocentro determina su orden de prioridad. El átomo de mayor numero atómico tiene la mayor prioridad. Si uno de ellos es un hidrógeno, éste será el de prioridad menor. Si hay dos átomos iguales unidos al estereocentro, se observa en la posición siguiente qué atomo tiene el número atómico mayor. En caso de nueva coincidencia se sigue a la siguiente posición, y así sucesivamente. Si alguno de los átomos unidos al estereocentro participa en un enlace doble o triple, se supone que aquél está unido por enlaces sencillos a un numero respectivamente doble o triple de átomos. Mezclas Racémicas Se denomina mezcla racémica o racemato, cuando un par de enantiómeros están en una proporción del 50% de cada uno. Esta mezcla no produce desviación de la luz polarizada, es decir, no tiene actividad óptica. Una mezcla racémica se simboliza escribiendo (±) o (d,l) antes del nombre del compuesto. Por ejemplo, el 2-butanol racémico se simboliza por (±)-2-butanol o «(d,l)-2-butanol Moléculas quirales sin estereocentro o centros quirales Bifenilos El bifenilo tetrasustituido no puede transformarse en su conformación simétrica porque los átomos de yodo y de bromo son demasiado voluminosos. La molécula está «bloqueada» en una de las dos conformaciones alternadas quirales, enantioméricas Moléculas quirales sin estereocentro o centros quirales Alenos • 2,3-pentadieno, el átomo de carbono central de un aleno tiene hibridación sp y es lineal, mientras que los átomos de carbono de los extremos tienen hibridación sp2 y son trigonales. Los alenos son quirales cuando cada uno de los átomos de carbono tienen al final dos sustituyentes diferentes Moléculas quirales sin estereocentro o centros quirales Alenos Bifenilos Binaftilos No hay plano de simetría. La molécula y su imagen especular no son superponibles Ejercicios Asigne la configuración absoluta R o S para cada uno de los siguientes compuestos: Ejercicios Asigne la configuración absoluta R o S para cada uno de los siguientes compuestos: R Menor prioridad Mayor prioridad R PROYECCIÓN DE FISCHER PROYECCIÓN DE FISCHER orientar Construir proyección Fischer Asignar prioridad Determinar configuración Si el último grupo en prioridad está en la horizontal y la unión 1→ 2→ 3 va en sentido R la configuración del estereocentro es opuesta, o sea, S Si el último grupo en prioridad está en la horizontal y la unión 1→ 2→ 3 va en sentido S la configuración del estereocentro es opuesta, o sea, R. La rotación de una proyección de Fischer afecta a la configuración del estereocentro representado: El giro de 180º conserva la configuración atras Este giro de 180° en el plano en una proyección de Fischer equivale a un número par de intercambios de grupos La rotación de una proyección de Fischer afecta a la configuración del estereocentro representado: El giro de 90º invierte la configuración Un giro de 90° equivale a un número impar de intercambios (un total de tres interconversiones) Moléculas con más de un centro quiral. Si una molécula tiene un único carbono quiral, sólo puede existir un par de enantiómeros. Si tiene dos carbonos quirales tiene un máximo de cuatro estereoisómeros (dos pares de enantiómeros). En general, una molécula con n carbonos quirales tiene un número máximo de 2n estereoisómeros posibles. Por ejemplo, el 3-bromo-2-butanol tiene dos carbonos quirales, por lo tanto, se esperaría 4 estereoisómeros. CH3 OH *CH *CH Br CH3 Cuantos estereoisómeros son posibles? Acido dihidroxibutanoico Acido (2R, 3R)-dihidroxibutanoico Proyección de Fischer Cuando Hay dos sustiyentes iguales en la molecula de dos Estereocentros: Diasteroisómero Eritro, los sustituyentes están a un mismo en la Proyc. Fischer. Diasteroisómero Treo, los sustituyentes están de lados opuestos la Proyc. Fischer. 2R, 3R 2S, 3S 2R, 3S 2S, 3R Eritro Treo H HO CH3 H3C OH C C C C Br CH3 H H3C Br (2R, 3S) (2S, 3R) H H H HO H Br H CH3 H3C OH C C C C CH3 (2S, 3S) H3C H Br (2R, 3R) Flechas horizontales: enantiómeros Flechas verticales y oblicuas: diastereoisómeros 3-bromo-2-butanol Moléculas con más de un centro quiral Moléculas con más de un centro quiral. 1-bromo-2-chlorocyclopropane Enantiómeros Diasteroisómeros Tipos de isómeros. Entre los estereoisómeros hay enantiómeros, que son imágenes especulares, no superponibles y diastereómeros no son imágenes especulares uno de otro. Los diastereómeros se encuentran en compuestos con dos o más átomos de carbono quirales en la molécula. Compuestos meso. El 2,3-dibromobutano, ejemplo de un compuesto que tiene cuatro permutaciones de las configuraciones (R) y (S) en C2 y C3 se representan a continuación. D,l-Treo Eritro -Meso Moléculas disimétricas. los términos eritro y treo se utilizan con moléculas disimétricas, cuyos extremos son diferentes Los términos meso y (+), (-), o (d),(l) se suelen utilizar con moléculas que poseen extremos iguales. LA FORMA MESO ¿Por qué en el caso del ácido tartárico (ácido 2,3-dihidroxibutanodioico), con dos estereocentros, sólo se producen tres estereoisómeros? (+)-tartaric acid: [α]D = +12º m.p. 170 ºC (–)-tartaric acid: [α]D = –12º m.p. 170 ºC meso-tartaric acid: [α]D = 0º m.p. 140 ºC Compuestos meso. (+)-tartaric acid: [α]D = +12º m.p. 170 ºC (–)-tartaric acid: [α]D = –12º m.p. 170 ºC meso-tartaric acid: [α]D = 0º m.p. 140 ºC •Una forma meso es un compuesto que contiene dos o más estereocentros y es superponible con su imagen especular. •Los compuesto meso contienen un plano de simetría que divide la molécula en dos, de tal forma que una mitad es la imagen especular de la otra Compuestos meso.