Síntesis Orgánica - Departamento de Química Orgánica
Anuncio
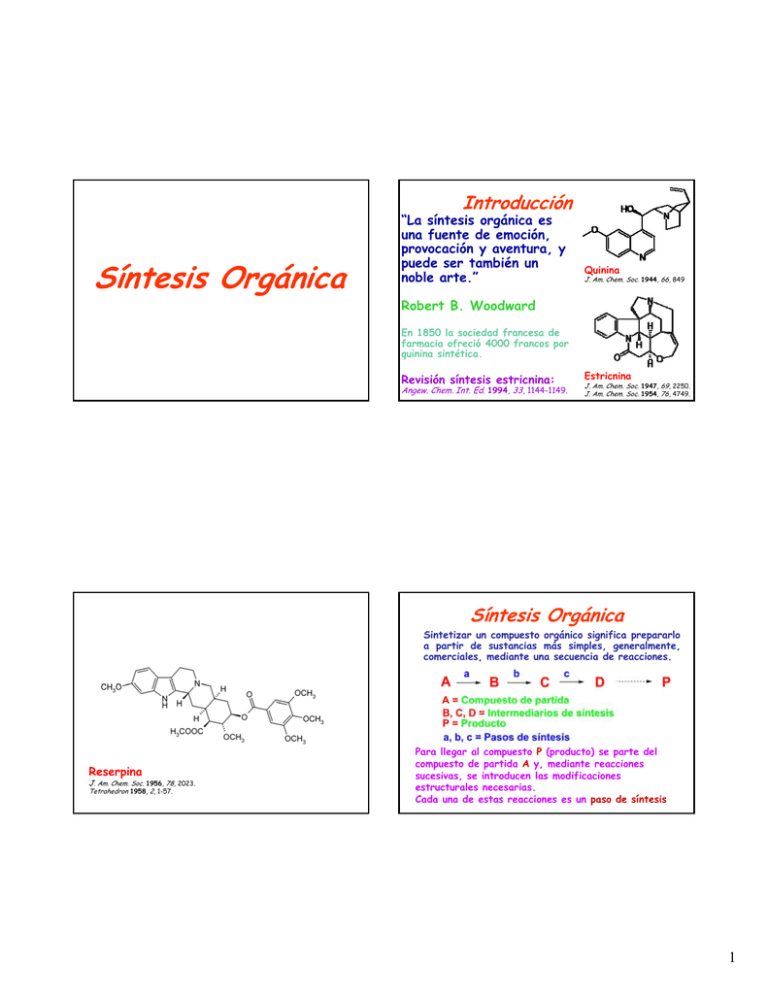
Introducción Síntesis Orgánica g “La síntesis orgánica es una fuente de emoción, provocación y aventura, y puede ser también un noble arte.” Quinina J. Am. Chem. Soc. 1944, 66, 849 Robert B. Woodward En 1850 la sociedad francesa de farmacia ofreció 4000 francos por quinina sintética. Revisión síntesis estricnina: Angew. Chem. Int. Ed. 1994, 33, 1144-1149. Estricnina J. Am. Chem. Soc. 1947, 69, 2250. J. Am. Chem. Soc. 1954, 76, 4749. Síntesis Orgánica Sintetizar un compuesto orgánico significa prepararlo a partir de sustancias más simples, generalmente, comerciales, mediante una secuencia de reacciones. Reserpina J. Am. Chem. Soc. 1956, 78, 2023. Tetrahedron 1958, 2, 1-57. Para llegar al compuesto P (producto) se parte del compuesto de partida A y, mediante reacciones sucesivas, se introducen las modificaciones estructurales necesarias. Cada una de estas reacciones es un paso de síntesis 1 Síntesis Orgánica Sintetizar un compuesto orgánico significa prepararlo a partir de sustancias más simples, generalmente, comerciales, mediante una secuencia de reacciones. Síntesis Orgánica Se requiere la mayor EFICIENCIA de la síntesis que se puede enunciar en el siguiente axioma: “Obtener el PRODUCTO con el menor número de pasos y con los máximos rendimientos posibles”. Aunque la Síntesis Orgánica es una actividad racional, racional no se encuentra totalmente sistematizada. P se puede obtener a partir de A por diversos caminos, e incluso, a partir de compuestos distintos de A. La síntesis de A a D tiene tres pasos. En general, cuanto más compleja es la molécula, un mayor número de pasos se requiere. Síntesis Orgánica Se deben analizar los caminos sintéticos probables, es decir, existe un proceso mental exploratorio de prueba y error para predecir d i cuall será á la l mejor j estrategia. Esto se denomina: DISEÑO DE LA SÍNTESIS Objetivos de la Síntesis Orgánica 1. Obtener cantidades del producto en condiciones económicamente ventajosas (industrias farmacéutica, química, agroquímica, veterinaria, etc.), es decir, productos de alto valor agregado “fine chemicals”. 2. Obtener moléculas no naturales como un desafío nt ctua c como m cu cubano an o tw twistano. tan . intelectual 3. Modificar sustancias naturales con actividad biológica relevante. 4. Prueba definitiva y rigurosa para confirmar una estructura 2 Síntesis Lineal o Convergente 1. Secuencia lineal: Un paso después otro. En este caso, el rendimiento disminuye rápidamente con el número de pasos. A → B → C → D → → P 2 Secuencia convergente: Cada 2. C d intermediario d se obtiene por combinación de dos precursores, por lo tanto, los intermediarios más valiosos se obtienen hacia el final de la síntesis. Los rendimientos son mayores que en la lineal. Síntesis Lineal o Convergente Una síntesis lineal de un polipéptido de 64 pasos (90% de rendimiento para cada uno) da un rendimiento total de 0,13%. Una síntesis convergente de igual número de pasos da un rendimiento total del 53%. Síntesis Lineal o Convergente Si se comparan 4 pasos de síntesis lineal versus convergente cada paso con 90% de rendimiento. Síntesis Total y Parcial Esta clasificación se basa fundamentalmente en el compuesto utilizado como material de partida para la síntesis. SINTESIS TOTAL: El blanco molecular “target” se sintetiza a partir de compuestos básicos, generalmente comerciales o muy fáciles de preparar. N E PARCIAL L ((Semisíntesis): m nt ) Se ut utilizan zan c como m SINTESIS compuestos de partida moléculas con esqueletos preformados. Por ejemplo, colesterol para sintetizar hormonas esteroidales o corticoides. 3 Síntesis Total y Parcial Un ejemplo interesante es la semisíntesis de taxol, un agente antitumoral, a partir de 10desacetilbaccatina III. Estrategia Sintética (a) En sentido directo (FORWARD). (b) Análisis retrosintético. (c) Estrategias quirales. (a) En sentido directo Se utiliza comúnmente cuando se estudia la molécula y, de acuerdo a su estructura, se elige g el blanco y compuesto de partida e imagina la ruta más directa. Plan de Síntesis Un químico orgánico de síntesis debe estar familiarizado con la literatura. Cuantas más reacciones conozca, mayor posibilidad tendrá de poder ejecutar un paso de síntesis. Se tendrán en cuenta algunos principios básicos: 1. La posibilidad de realizar cada paso de síntesis d b ser elevada. debe l d L Las reacciones i competitiva titi s deben d b ser eliminadas. 2. Para cada paso deben existir caminos alternativos, de modo que si fracasan, se puede escoger otro. 3. Debe existir una máxima correlación entre las operaciones sintéticas de modo que cada una de ellas posibilite, ayude o simplifique, de alguna manera, los pasos siguientes. Análisis retrosíntético (b) Análisis retrosintético retro en latín: hacia atrás. Es un método que consiste en transformar la estructura de una molécula objeto de síntesis (Molécula blanco) en una secuencia de estructuras progresivamente más simples p mediante una ruta q que conduce a compuestos p de partida sencillos. 4 Análisis retrosíntético Análisis retrosíntético La molécula blanco se degrada gradualmente rompiendo enlaces (retroanálisis) para dar estructuras más simples (sintón o bloque de construcción). Esta operación se llama desconexión de enlace y debe realizarse de acuerdo a ciertas reglas. La transformación de una molécula blanco en su precursor sintético se consigue aplicando el retroanálisis que, en general, es la inversa de la reacción de síntesis. La aplicación L li ió de d una desconexión d ió debe d b ser lógica ló i d d desde el punto de vista químico. En muchos casos, aunque no siempre, representa la inversa de la reacción de formación del enlace. O O + Cada estructura derivada por aplicación de un retroanálisis áli i se convierte i t en una nueva molécula lé l blanco, bl d de modo que puede continuarse el análisis. En el ejemplo anterior vemos que ⇒ indica el sentido de la dirección retrosintética. Se suele usar el mismo nombre para el retroanálisis que para la reacción de síntesis. Por ejemplo, en el esquema es una retro Diels-Alder Análisis retrosíntético Para poder aplicar un retroanálisis debe estar presente en la MOLECULA BLANCO una estructura básica que posibilite la transformación. Esta estructura básica se llama ll retrón. t ó Retrones provenientes de reacciones clásicas El retrón de la retro Diels-Alder es un anillo de 6 miembros con un enlace π. 5 Retrones provenientes de reacciones clásicas En el análisis retrosintético se rompen enlaces C-C estratégicos en los puntos cuya formación parece posible (cercanos a grupos funcionales). Se indica con la doble flecha ⇒. También se llama desconexión estratégica. str té ic Las desconexiones estratégicas deben producir la máxima simplificación en la estructura, pues al igual que en la síntesis, hay muchas rutas posibles. También en el análisis retrosintético puede haber varias desconexiones posibles. Ö Ö Retrones provenientes de reacciones clásicas Las estrategias a y bb son mejores que a pues producen fragmentos de tamaño semejante. Los precursores de la síntesis se llaman sintones. Estrategias Quirales Síntesis Asimétrica Síntesis Asimétrica Síntesis enantioselectiva o enantioespecífica. Definición: la síntesis asimétrica produce sustancias ópticamente activas a partir de sustancias aquirales por mediación de materiales ópticamente activos. La síntesis asimétrica utiliza compuestos de partida no quirales y catalizadores o auxiliares quirales para pero en forma realizar reacciones clásicas p asimétrica. Mediante estas estrategias se consigue construir el blanco molecular con su configuración correcta para cada uno de los estereocentros. Para evitar esto se debe emplear una estrategia quiral 6 Síntesis Asimétrica Síntesis Asimétrica Para obtener asimetría se requiere la intervención de una herramienta quiral, más comunmente, un auxiliar quiral o un catalizador quiral. quiral reacciona q químicamente con el El auxiliar q sustrato aquiral y se elimina luego de inducir asimentría. Un ejemplo muy interesante es el uso del auxiliar de Evans Síntesis Asimétrica Los catalizadores quirales se usan muy ampliamente en reducciones, alquilaciones, reacciones de DielsAlder. Ejemplo: reducción de acetofenona. Exceso Enantiomérico • ¿Qué es el exceso enantiomérico? iniciación iniciación 7 Selectividad en Síntesis En moléculas complejas, hay casos donde un mismo grupo presente en las mismas presenta reactividad diferenciada frente a un dado reactivo, o bien que la reacción produce preferencialmente un estereoisómero entre todos los posibles. En estos casos, se dice que existe selectividad. selectividad Un reactivo es selectivo cuando puede discriminar entre los mismos grupos funcionales (GF) o semejantes que conduce preferentemente a un dado isómero o estereoisómero entre todos los posibles. Selectividad en Síntesis La quimioselectividad abarca dos casos principales: (a) Reactividad de 2 GFs distintos. (b) Reactividad de 2 GFs idénticos. La discriminación entre grupos distintos es más simple p q que cuando los GFs son idénticos o muy semejantes. Ejemplos: GFs distintos aunque semejantes Selectividad en Síntesis Tipos de selectividad: (a) Reactividad química Quimioselectividad (b) Orientación Regioselectividad (c) Estereoquímica Estereoselectividad Estereoselectividad: comprende enantioselectividad. diatereo y Quimioselectividad: Es la capacidad de discriminar los distintos sitios de una molécula que, obviamente, posee más de un sitio reactivo o grupo funcional capaz de reaccionar con el reactivo empleado. Selectividad en Síntesis Quimioselectividad Ejemplos: GFs idénticos 8 Selectividad en Síntesis Regioselectividad Se refiere a la formación preferencial de un isómero estructural sobre otros. La regioselectividad determina la orientación del ataque. Selectividad en Síntesis Regioselectividad Cuando hay más de un sitio reactivo de un grupo funcional y el reactivo se puede aproximar para dar más de un producto preponderante (isómeros entre sí) la reacción es regioselectiva. Selectividad en Síntesis Regioselectividad Para conseguir regioselectividad, en algunos casos, se pueden introducir una modificación transitoria Sintesis enantioselectiva o enantioesespecífica Históricamente, esta idea tuvo su origen en la estrategio del quirón de Hanessian. El concepto de quirón reemplaza al de sintón que podría considerarse como un sintón enantioméricamente puro. La estrategia del quirón difiere conceptualmente de la del sintón, en que estos se forman sin tener en cuenta la estereoquímica. En la estrategia del quirón, las desconexiones en la molécula blanco se realizan localizando segmentos que contienen un determinado número de estereocentros. 9 Sintesis enantioselectiva o enantioesespecífica Sintesis enantioselectiva o enantioesespecífica Los quirones se forman retrosintéticamente con la menor perturbación posible de los estereocentros de la molécula blanco. Supongamos el mismo sistema β-hidroxicarbonílico anterior: El esqueleto carbonado del molde quiral es una réplica de un segmento de la molécula blanco de la molécula blanco y su quiralidad natural se relaciona con la estereoquímica de la misma. Siempre que sea posible, Si ibl ell quirón i ó posee ell nivel de funcionalización y similitud estereoquímica con la “molécula blanco”. Esta estrategia permite sintetizar moléculas quirales basándose en el concepto de molde quiral. Los quirones son sintones o precursores sintéticos enantioméricamente puros. Sintesis enantioselectiva o enantioesespecífica Los siguientes productos naturales se han sintetizado empleando los moldes quirales que se indican. 10