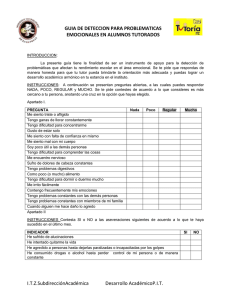
Serie 1.
Anuncio
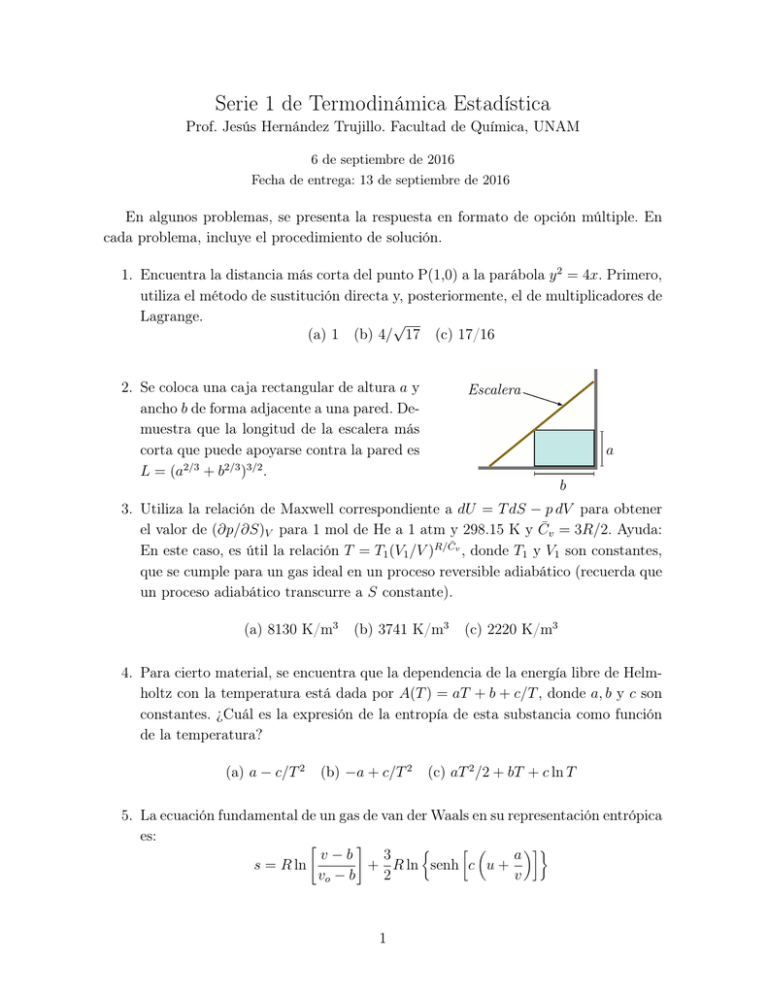
Serie 1 de Termodinámica Estadística Prof. Jesús Hernández Trujillo. Facultad de Química, UNAM 6 de septiembre de 2016 Fecha de entrega: 13 de septiembre de 2016 En algunos problemas, se presenta la respuesta en formato de opción múltiple. En cada problema, incluye el procedimiento de solución. 1. Encuentra la distancia más corta del punto P(1,0) a la parábola y 2 = 4x. Primero, utiliza el método de sustitución directa y, posteriormente, el de multiplicadores de Lagrange. √ (a) 1 (b) 4/ 17 (c) 17/16 2. Se coloca una caja rectangular de altura a y ancho b de forma adjacente a una pared. Demuestra que la longitud de la escalera más corta que puede apoyarse contra la pared es L = (a2/3 + b2/3 )3/2 . Escalera a b 3. Utiliza la relación de Maxwell correspondiente a dU = T dS − p dV para obtener el valor de (∂p/∂S)V para 1 mol de He a 1 atm y 298.15 K y C̄v = 3R/2. Ayuda: En este caso, es útil la relación T = T1 (V1 /V )R/C̄v , donde T1 y V1 son constantes, que se cumple para un gas ideal en un proceso reversible adiabático (recuerda que un proceso adiabático transcurre a S constante). (a) 8130 K/m3 (b) 3741 K/m3 (c) 2220 K/m3 4. Para cierto material, se encuentra que la dependencia de la energía libre de Helmholtz con la temperatura está dada por A(T ) = aT + b + c/T , donde a, b y c son constantes. ¿Cuál es la expresión de la entropía de esta substancia como función de la temperatura? (a) a − c/T 2 (b) −a + c/T 2 (c) aT 2 /2 + bT + c ln T 5. La ecuación fundamental de un gas de van der Waals en su representación entrópica es: " # v−b 3 a s = R ln + R ln senh c u + vo − b 2 v 1 donde s, u y v son la entropía, la energía interna y el volumen molar, respectivamente. Además, R, a, b, c y v0 son constantes. Obtén las ecuaciones de estado para demostrar que p= a RT − 2 v−b v 6. Considera la siguiente ecuación fundamental U (S, V, N ) = k S 3 /(N V ), donde k es una constante. Mediante la transformada de Legendre, encuentra la expresión de la energía libre de Gibbs, G = G(T, p, N ). q (a) − N 2 pT 3 /(9k) (b) −2N pT 3 /(3) (c) −N T 3 /(27kp) 7. La nitrogenasa es una enzima que convierte N2 en NH3 que contiene un cúmulo Fe4 S4 formando un cubo de arista a = 3 Å. Utiliza el modelo de una partícula en una caja de potencial infinito cúbica y calcula Fe S la longitud de onda de la radiación electromaga S Fe nética para llevar a cabo la transición electróS Fe nica de más baja energía. Supón que el número total de electrones de valencia es 20. Fe S (a) 294 nm (b) 155 nm (c) 437 nm 8. Las siguientes líneas (en cm−1 ) del espectro vibración-rotación corresponden a la banda fundamental de la molécula de HCl. 2821.43 2843.56 2865.09 2906.25 2925.78 2944.89 Calcula la longitud de enlace y la constante de fuerza de la molécula. (a) 0.13 nm, 0.048 N/m (b) 1.29 nm, 27 N/m 2 (c) 1.30 Å, 477 N/m