Vasculopatía livedoide: significado actual
Anuncio

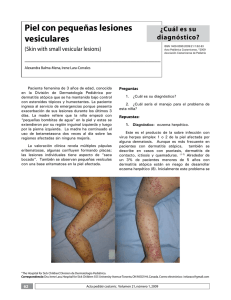
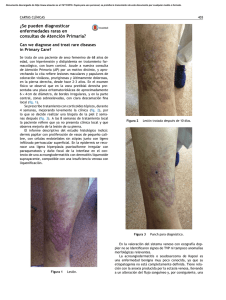
Dermatología Rev Mex 2008;52(4):175-81 Caso clínico Vasculopatía livedoide: significado actual. Comunicación de dos casos ED Poletti,* NR Muñoz Sandoval,** JL Moreno González,*** A Santacruz Torres**** Resumen La vasculopatía livedoide es una alteración idiopática oclusiva no inflamatoria de los vasos sanguíneos dérmicos. Se distingue por lesiones bilaterales en las piernas, particularmente en el tobillo y el pie, concomitante con cicatrices atróficas blancas y edema; produce úlceras y dolor crónico. Su cuadro clínico es característico, pero debe realizarse una evaluación que descarte enfermedad vascular periférica. Es importante buscar padecimientos asociados o detectar alguna alteración protrombótica o de la coagulación. Se reportan dos casos de vasculopatía livedoide tratados satisfactoriamente con clopidogrel. Palabras clave: vasculopatía livedoide, úlcera, trombosis, atrofia blanca, daño endotelial. Abstract The livedoid vasculopathy is an occlusive, non inflammatory disease, which causes a chronic painful, and severely scarred leg ulcer. The clinical presentation is distinctive and an initial evaluation should be a high priority to discard peripheral vascular disease. Focus should be put on associated systemic diseases, and particular attention to look for prothrombotic or coagulation disorders. We report two cases of livedoid vasculopathy in which treatment with clopidogrel was effective. Key words: livedoid vasculopathy, leg ulcer, thrombosis, atrophie blanche, endothelial damage. D iversas alteraciones de los vasos cutáneos se reflejan a través de diferentes manifestaciones clínicas al momento de la exploración física; por lo tanto, son de valor diagnóstico para los angiólogos, internistas, médicos familiares y dermatólogos. Una de éstas son las úlceras en las extremidades inferiores, que hacen sospechar vasculopatía livedoide (del latín lividus: lívido, amoratado, azulado plomizo).1 La vasculopatía livedoide se considera una alteración idiopática oclusiva no inflamatoria de los vasos sanguíneos dérmicos. Este padecimiento se distingue por lesiones bilaterales en las piernas, particularmente en el tobillo y el pie, concomitante con cicatrices atróficas blancas y edema; afecta principalmente a las mujeres. Esta alteración ha sido mal clasificada dentro del grupo de las vasculitis, pero * Internista-Dermatólogo. Profesor de dermatología clínica de la Universidad Autónoma de Aguascalientes. ** Médica asistente, Clínica en Derma Norte de Aguascalientes. *** Dermatólogo. Profesor interconsultante del departamento de dermatología del Hospital Universitario Dr. Eleuterio González; práctica clínica privada en Monterrey, NL. **** Cirujano angiólogo. Decano del Centro Biomédico de la Uni versidad Autónoma de Aguascalientes. Dermatología Rev Mex Volumen 52, Núm. 4, julio-agosto, 2008 hasta el momento el principal mecanismo fisiopatológico es la trombosis intraluminal en las vénulas.2 CASOS Clínicos Caso 1 Mujer de 56 años de edad con úlceras dolorosas recurrentes y bilaterales en los tobillos y la cara tibial media anterior de siete años de evolución, con recaídas en los meses de verano. Antecedentes de importancia: tabaquismo durante 20 años y terapia hormonal combinada durante ocho (anticonceptivo); recientemente le detectaron hiperglucemia de 146 mg/100 mL y hemoglobina A1c glucosilada de 7.2. Al momento de su consulta se aplicaba curaciones tópicas con ketanserina en gel, con lo que percibió disminución parcial Correspondencia: Dr. Edgar David Poletti. Sierra Tepoztlán 407, Residencial Bosques del Prado, CP 20127, Aguascalientes, Ags. México. E-mail: [email protected] Recibido: mayo, 2008. Aceptado: junio, 2008. Este artículo de debe citarse como: Poletti ED, Muñoz SNR, Moreno GJL, Santacruz TA. Vasculopatía livedoide: significado actual. Comunicación de dos casos. Dermatol Rev Mex 2008;52(4):175-81. 175 Poletti ED y col. del tamaño de las úlceras, pero no del dolor. En la exploración física se observó un biotipo endomórfico, tensión arterial de 145/95 mmHg, pulso de 78 latidos por minuto, índice de masa corporal de 34, sin datos de insuficiencia venosa. Tenía múltiples úlceras en las piernas, desde 8 mm hasta 1.4 cm de diámetro, de bordes indurados, tono eritematovioláceo intenso, distribución “estelar”, centro excavado y cicatrices cóncavas, atróficas (4 a 8 mm), marginales, color rosado-blanquecino (figuras 1 y 2). Figura 2. Misma paciente, lesiones semejantes en la extremidad inferior contralateral. clopidogrel por vía oral (75 mg), dos veces al día, durante las primeras tres semanas y después, una vez al día. Se obtuvieron resultados favorables y el dolor disminuyó desde la tercera semana de tratamiento. Figura 1. Intensa vasculopatía livedoide, activa y pasada con úlcera tegumentaria de bordes eritematovioláceos, distribución “estelar” con cicatriz marginal, dolor a la palpación y cicatrices previas de característico color blanconacarado. Los exámenes de laboratorio incluyeron: determinación de plaquetas, tiempo de protrombina, tiempo de tromboplastina, anticuerpos anticardiolipina, anti-ADN nativo, C3, C4, CH50, anticuerpos antinucleares y perfil lipídico. No hubo hallazgos de relevancia. Con el diagnóstico de vasculopatía livedoide se inició tratamiento con 176 Caso 2 Mujer de 47 años de edad, multípara y en actual tratamiento por síndrome climatérico. Acudió a consulta con úlceras dolorosas en la cara interna del tercio inferior de la pierna, extendida hacia la prominencia calcánea, que fue injertada en una ocasión con resultados fallidos. Las úlceras eran coalescentes, de 1 hasta 2.5 cm, cribiformes, fondo limpio, borde indurado con telangiectasias, hiperpigmentación violácea intensa, marginal y dolorosas a la palpación. El contorno de las úlceras mostraba petequias palpables y trasudación (figura 3). La pierna contralateral, Dermatología Rev Mex Volumen 52, Núm. 4, julio-agosto, 2008 Vasculopatía livedoide: significado actual DISCUSIÓN La paciente del primer caso recibió 75 mg de clopidogrel, por vía oral, dos veces al día en las primeras tres semanas y posteriormente, una vez al día, con lo que obtuvo resultados satisfactorios (disminuyó el dolor desde la tercera semana de tratamiento). La paciente del segundo caso también recibió clopidogrel, pero en diferente dosis (150 mg/día en los primeros 15 días y después disminuyó a 75 mg/día durante tres meses más), propilenglicol en gel al 40% para desbridamiento, con oclusión, vendaje compresivo y, ulteriormente, apósitos de espuma de poliuretano cada 72 horas. La paciente mejoró desde la segunda semana; después de la cuarta, la contracción de la herida y reepitelización formaron una cicatriz blanquecina-nacarada y brillante (figura 4). Figura 3. Las úlceras son coalescentes, dolorosas, cribiformes, de fondo limpio, borde esclerótico, con pigmentación purpúrea intensa y petequias (pretratamiento). en sus tercios medio e inferior, mostraba una extensa placa esclerosa de forma triangular, con longitud máxima de 12 cm, borde ocre y diversas exulceraciones en su interior (la mayor medía 3 cm y las menores, de 6 a 9 mm). Negó eritema facial, oligoartralgias o fiebre. Se obtuvo una biopsia cutánea porque se sospechó vasculitis o pioderma gangrenoso. Los datos más relevantes fueron trombosis intraluminal, depósito de fibrina en los vasos de la dermis papilar profunda y reticular, sin daño inflamatorio en la pared de los vasos o fragmentación nuclear de células polimorfonucleares. El estudio Doppler a color de ambas extremidades, exámenes básicos de coagulación, determinación de anticuerpos antinucleares, anti Sm, factor reumatoide, anti-ADN nativo, C3, C4, CH 50, anticuerpos anticardiolipina, antifosfolipídicos y antinucleares resultaron sin alteraciones. Dermatología Rev Mex Volumen 52, Núm. 4, julio-agosto, 2008 Figura 4. Reacción favorable después de cuatro semanas de iniciar el tratamiento con apósitos hidrocoloides, vendaje oclusivo y clopidogrel sistémico (característica cicatriz blanquecina-nacarada residual). El seguimiento clínico y de laboratorio de ambos casos no detectó ningún padecimiento conectivo vascular ni alteraciones en la coagulación. Sólo en una de las pacientes se obtuvo una biopsia para estudiar lo atípico del cuadro. 177 Poletti ED y col. En ambos casos coincidió el diagnóstico de vasculopatía livedoide, aunque ha sido esporádico a través del tiempo. Este padecimiento es una vasculopatía oclusiva no inflamatoria de los vasos pequeños que corresponde, particularmente, a daño vascular hialinizante y segmentario. Tiene múltiples denominaciones: livedo vasculitis, vasculitis livedoide, atrofia blanca en placa de Millian, vasculitis de atrofia blanca, capilaritis alba, livedo reticularis con ulceraciones de verano o invierno, vasculitis hialinizante segmentaria, vasculopatía livedoide y úlceras purpúreas dolorosas con patrón reticulado de las extremidades inferiores (PURPLE).3 Afecta a pacientes de entre 15 y 50 años de edad (promedio de 32 años), principalmente mujeres (3:1) y su prevalencia se estima en 2% de la población general.4,5 En los niños suele ser muy rara; no hay datos que indiquen su distribución geográfica o racial en particular.6 Sospecha clínica El diagnóstico de vasculopatía livedoide se basa en: búsqueda intencionada de enfermedad vascular perifé- Figura 5. Piel atrófica, hiperpigmentada y cicatricial, datos clínicos de alta sospecha para diagnosticar vasculopatía livedoide crónica. 178 rica, alteraciones del tejido conjuntivo y antecedentes personales o familiares de alteraciones en la coagulación. El primer indicio exploratorio fue observar la piel de las piernas con lesiones purpúreas que alternaban con “islotes” blanquecinos de la piel por debajo de las rodillas.7,8 La prevalencia de venas varicosas en estas pacientes varió de 20 a 75%. Las úlceras cutáneas recurrentes se localizaban entre las rodillas y los tobillos, con preferencia hacia los maléolos, cuya exacerbación fue en los meses de verano.9,10 Las lesiones desaparecen ad integrum, pero reaparecen después de algunos meses, de manera episódica y, frecuentemente, dejan una cicatriz excavada, blanquecina y retráctil; en ocasiones, los episodios son tan cortos que pasan inadvertidos por el paciente, hasta que aparece la cicatriz atrófica, similar a la de las pacientes de este estudio.11,12 Durante su evolución se forman pápulas y placas “eritematovinosas” y purpúreas, dolorosas a la palpación, con vesículas de contenido hemorrágico, úlceras de 4 a 6 mm que cicatrizan con bordes “estrellados” y centro atrófico, telangiectasias punteadas y esfacelo.13 Posteriormente, se percibe una cicatriz marginal poco retráctil, inflexible, con telangiectasias periféricas que resultan en fibroesclerosis verdadera e induración de la piel afectada (figura 5).14 De acuerdo con su curso natural y morfología clínica, algunos autores señalan que la lesión puede subdividirse Figura 6. Clara insuficiencia venosa y atrofia blanca que sugieren episodios repetidos de vasculopatía livedoide. Dermatología Rev Mex Volumen 52, Núm. 4, julio-agosto, 2008 Vasculopatía livedoide: significado actual en atrófica o ulcerosa. Esta última tarda varios meses en cicatrizar y su mayor estigma comprende zonas pequeñas e irregulares de piel atrófica blanco-nacarada (figura 6).2,9 Dichas cicatrices no son patognomónicas de la vasculopatía livedoide, pues también se observan en las dermatitis por venoestasis o en algunos padecimientos del tejido conectivo vascular (lupus eritematoso y dermatomiositis).14,15 En otros casos puede acompañarse de púrpura pigmentosa crónica (20%), particularmente en la primeras etapas de la enfermedad.9 El diagnóstico diferencial se realiza con liquen escleroso y atrófico, papulosis atrófica maligna de Degós, síndrome de “pseudo-Kaposi” y formación de cicatrices postraumáticas.11 Asociaciones comórbidas Las alteraciones relacionadas con vasculopatía livedoide son: enfermedad vascular periférica, lupus eritematoso generalizado y pacientes con amplio antecedente de traumatismos en los miembros inferiores. Un estudio reportó este cuadro en una mujer joven con lupus eritematoso, que además tuvo elevada incidencia de nefritis, anticuerpos anticardiolipina positivos y mayor susceptibilidad de lesiones del sistema nervioso central (síndrome de Sneddon con livedo racemosa y anticuerpos anticardiolipina, asociado con trombosis cerebral o demencia progresiva).16 Predisposición genética procoagulante Los portadores heterocigotos del factor V de Leiden o con mutaciones genéticas en la producción de protrombina tienen riesgo elevado de padecer vasculopatía si consumen ciertos fármacos (estrógenos).17 Los pacientes con hiperhomocisteinemia (con o sin criofibrinogenemia) y tendencia trombopática pueden tener deficiencia en ácido fólico, cianocobalamina o pirodoxina y alteraciones genéticas que cursan con disminución de metileno-dehidrofolato-reductasa que produzcan infartos y trombosis inexplicables.18 El primer desafío clínico es plantear si estos pacientes corresponderán al grupo “idiopático” o, después del escrutinio clínico y de laboratorio suficientes, clasificarlos en alteración vascular secundaria. Un estado procoagulante se origina por cualquiera de las siguientes alteraciones: síndrome de anticuerpos anticardiolipina, crioglobulinemia o enfermedad de aglutininas por frío, síndrome de Sjögren, esclerodermia sistémica, poliarteritis nodosa, policitemia vera, disproteinemias, enfermedad de cadenas pesadas gamma, leucemia mielógena crónica, linfoma, talasemia Dermatología Rev Mex Volumen 52, Núm. 4, julio-agosto, 2008 menor, trombocitosis menor, trombocitosis esencial y deficiencias de glutatión reductasa.5,8,9,14 Fisiopatología Se piensa que la vasculopatía livedoide se origina por múltiples alteraciones en la cascada de coagulación, a partir de un defecto en la fibrinólisis. Los pacientes con mayor afección son aquéllos con predisposición genética (factor II mutante y factor V Leiden), alteraciones en la respuesta a la instauración de un coágulo (modificaciones del acoplamiento trombina-trombomodulina) concomitante con lesión endotelial ulcerativa y estado pretrombótico previo (deficiencia de las proteínas C o S para activar los factores Va y VII a), o con defectos en la producción del activador de plasminógeno (cuadro 1).19,20 Entre otras se incluyen: incrementos en la agregación plaquetaria, formación de fibrina y sus dímeros, autoanticuerpos circulantes o crioglobulinas y disminución en la cantidad de trombomodulina endotelial.3,12 Papi y su grupo señalan elevadas concentraciones de p-selectina o fibrinopéptido A, en células endoteliales activadas (su interacción produce anormalidades en la adhesión plaquetaria o alteraciones del sistema degradador endógeno fibrinolítico).21 Aún con diversas teorías, como la adhesión de células blancas, alteraciones del endotelio, formación de autoanticuerpos, incrementos en formaciones locales de fibrina o alteración en los factores de procoagulación, se interpreta como un fenómeno trombo-oclusivo (como ocurre en los pacientes son síndrome de Sjögren).20,22 Exámenes de acuerdo con la sospecha clínica Los estudios de laboratorio comprenden: determinación de plaquetas, tiempo de protrombina, tiempo de tromboCuadro 1. Alteraciones fisiopatológicas en la vasculopatía livedoide Incremento Fibrinopéptido A Actividad plaquetaria Homocisteína Formación de dímeros de fibrina Deficiencia Proteína C Proteína S Liberación del activador tisular de plasminógeno Mutación heterocigótica del factor V de Leiden (resistencia a la inactividad de la proteína C) Modificado de la referencia 12. 179 Poletti ED y col. plastina, homocisteína sérica, anticuerpos antinucleares, velocidad de sedimentación globular, factor reumatoide, concentraciones del complemento (C4), crioglobulinas, crioaglutininas, globulinas, electroforesis sérica y urinaria de proteínas.4,8,15 También puede ser útil evaluar la actividad biológica y antígenos de proteína C y S, antitrombina III, factor V de Leiden, anticuerpos anticardiolipina, anticoagulante lúpico, viscosidad sanguínea y complejos antígeno-anticuerpo circulantes.13,23 Los estudios complementarios que requerirá el angiólogo son: estudio del flujo vascular con pletismografía, detección de flujo doppler, ultrasonido en tiempo real, arteriografía, venograma y oximetría transcutánea.9,15,20 Histopatología En la mayoría de los pacientes debe realizarse una biopsia cutánea; sin embargo, muchas úlceras de la piel se “amplían” después de la incisión (evento denominado patergia como el que sucede en el pioderma gangrenoso). Su importancia radica en descartar alteraciones inflamatorias de la pared vascular.2,7 Los hallazgos más frecuentes son los vasos de la dermis superficial con capilares dilatados y asas tortuosas. La dermis suele ser gruesa y esclerótica, y con aplanamiento de las papilas. A detalle, los vasos están ocluidos con material fibrinoide rosado en la dermis papilar y reticular, con afección de la pared venular, depósito de fibrina y trombos intraluminales (estos cambios pueden observarse mediante la tinción vascular con fibrinógeno marcado).2,24 El infiltrado inflamatorio es escaso; en la fase temprana depende de los neutrófilos y en la tardía de los linfocitos. Como datos secundarios se describen atrofia epidérmica con aplanamiento de los procesos interpapilares y depósitos dermoepidérmicos de pigmento melánico.2,5,7 El estudio de inmunofluorescencia directa resulta positivo hasta en 80% de los casos; en éstos se detecta depósito vascular de conjugados múltiples (inmunoglobulinas y complemento), pero inespecíficos y diversos, por lo que no es útil para establecer el diagnóstico.24 Tratamiento El tratamiento prescrito en esta vasculopatía es variado; su carácter recurrente hace que el clínico actualice continuamente las medidas de mayor utilidad y que estimulen los siguientes efectos: 1) Inhibición de la síntesis de prostaglandinas (modular la agregación plaquetaria): aspirina, dipiri- 180 damol o tienopiridinas (clopidogrel, indobufeno o hidrocloruro de ticlopidina, asociados o no con ácido acetilsalicílico), agentes inhibidores de la agregación plaquetaria (inducida por la acción de adenilciclasa y que funcionen en los receptores de nucleótidos de membrana plaquetaria denominados “P2” [P2X,P2Y, P2Y1]).25,26 2) Efecto hemorreológico: disminución de la viscosidad sanguínea, mayor flexibilidad eritrocitaria e incremento del flujo circulatorio con pentoxifilina o blufomedil.27 3) Lisis de trombos: minidosis subcutáneas de heparina o enoxiparina; warfarina o acenocumarina, antagonistas de la vitamina K (fluindiona).18,28,29 4) Optimización de agentes con probada fibrinólisis o potenciadores sinérgicos de la conversión de plasminógeno en plasmina: fenformina-etilestrenol, danazol, estreptoquinasa-uroquinasa tópicas en gel.5,15 5) Vasodilatación con prevención del estasis o formación de bloques de fibrina: nifedipina, ácido nicotínico o cilostazol.10,15 6) Modulación de la respuesta linfocitaria local: fotoquimioterapia sistémica con PUVA (8-metoxipsoraleno oral), activado con luz ultravioleta A (320 a 400 nm).30 7) De rescate (formas graves o recalcitrantes): inmunoglobulina intravenosa, en bolos para pulsoterapia, iloprost IV, activador del plasminógeno tisular (tPA) y oxígeno hiperbárico.10,31-34 En la mayoría de los pacientes deberá considerarse la sobreinfección de la zona ulcerada (realizar cultivos ante la sospecha) y disminución del dolor (parches de lidocaína).10 La compresión y oclusión reducen el tiempo de cicatrización y disminuyen el dolor.9,11 Temporalmente y con alguna ulceración importante, son efectivos los recubrimientos hidrocoloides con poliuretano o polisobutileno más carboximetilcelulosa-pectina.10 Coincidimos con los autores que la alteración más común de vasculopatía livedoide es claramente resistente al tratamiento. Referencias 1. 2. Jenette JC, Falk R, Andrassy K, Bacon Pa, et al. Nomenclature of systemic vasculitides. Proposal of an international consensus conference. Arthritis Rheum 1994;37:187-92. Smoller BR, Horn TD. Dermatopathology in systemic disease. Dermatología Rev Mex Volumen 52, Núm. 4, julio-agosto, 2008 Vasculopatía livedoide: significado actual 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 1st ed. New York: Oxford University Press, 2001;pp:11-16. Jorizzo JL. Livedoid vasculopathy: what is it? Arch Dermatol 1998;134(4):491-3. Shornick JK, Nicholes BK, Bergstresser PR, Gilliam JN. Idiopathic atrophie blanche. J Am Acad Dermatol 1983;8:792-8. Maessen-Visch MB, Koedam MI, Hamulayak K, Neumann HA. Atrophie banche. Int J Dermatol 199;38:161-72. Suárez SM, Paller AS. Atrophie blanche with onset in childhood. J Pediatr 1993;123:753-5. Guerrero-Gutierrez E, Soto-Ortiz JA. Úlcera dolorosa sobre placas atróficas en las piernas. Casos para diagnóstico. Revista Piel 2000;2:234-5. Elisaf M, Nikou-Stefansky S, Drosos AA, Moutsopoulos HM. Atrophie blanche. Clinical diagnosis and treatment. Ann Med Interne (Paris) 1991;142:415-8. Sumpio BE. Foot ulcers. N Engl J Med 2000;343:787-93. Lebowl MG, Heymann WR, Berth-Jonez J, Coulson I. Treatment of skin disease, comprehensive therapeutic strategies. 2nd ed. Philadelphia: Mosby Elsevier, 2006;pp:178-9. Miller OF, Phillips TJ. Leg ulcers. J Am Acad Dermatol 2000;43(1 Part 1):91-95. Wolf K, Goldsmith LA, Katz SI, Gilchrest,BA, et al. Fitzpatrick’s Dermatology in general medicine. 7th ed. New York: McGraw Hill, 2008;pp:1606-16. Bolognia JL, Jorizzo JL, Rapini RP. Dermatology. 2nd ed. London: Mosby-Elsevier, 2008;pp:347-67. Callen JP, Jorizzo JL, Bolognia JL, Piette WW, Zone JJ. Dermatological signs of internal medicine. 3rd ed. Philadelphia: Saunders, 2003;pp:25-29. Bryant C. Atrophie blanche: a review from the perspective of a 31 patient cohort. Dermatol Ther 2001;14:111-6. Grattan CE, Burton JL, Boon AP. Sneddon’s syndrome (livedo reticularis and cerebral thrombosis) with livedo vasculitis and anticardiolipin antibodies. Br J Dermatol 1999;140:131-5. Maessen-Visch MB, Hamulyak K, Tazelaar DJ, Crombag NH, Neumann HA. The prevalence of factor V Leiden mutation in patients with leg ulcers and venous insufficiency. Arch Dermatol 1999;135:41-44. Browning CE, Callen JP. Warfarin therapy for livedoid vasculopathy associated with cryofibrinogenemia and hyperhomocysteinemia. Arch Dermatol 2006;142:75-78. Davis MDP, Wysokinski WE. Ulcerations caused by livedoid vasculopathy associated with a prothrombotic state: response to warfarin. J Am Acad Dermatol 2008;58:512-5. Dermatología Rev Mex Volumen 52, Núm. 4, julio-agosto, 2008 20. McCalmont CS, McCalmont TH, Jorizzo JL, White WL, et al. Livedo vasculitis: vasculitis or thrombotic vasculopathy? Clin Exp Dermatol 1992;17:4-8. 21. Papi M, Didona BD, Pita O. Livedo vasculopathy vs small vessel cutaneous vasculitis. Cytokine ans platelet P-selectin studies. Arch Dermatol 1998;134:447-52. 22. Cardoso R, Gonçalo M, Tellechea O, Maia R, et al. Livedoid vasculopathy and hypercoagulability in a patient with primary Sjögren’s syndrome. Int J Dermatol 2007;46:431-4. 23. Acland KM, Darvay A, Wakelin SH, Russell-Jones R. Livedoid vasculitis: a manifestation of the antiphospholipid syndrome? Br J Dermatol 1999;140:131-5. 24. Otoyama K, Katayama I, Kondo S, Nishioka K, Nishiyama S. A case of Sneddon’s syndrome with positive ANA and anticardiolipin antibodies: primary anti-phospholipid syndrome? J Dermatol 1990;17:489-92. 25. Schroeter AL, Diaz-Perez JL, Winkelmann RK, Jordan RE. Livedo vasculitis (the vasculitis of atrophie blanche): immunohistopathologic study. Arch Dermatol 1975;111:188-93. 26. Kern AB. Atrophie blanche: report of two patients treated with aspirin and dipyridamole. J Am Acad Dermatol 1982;6:104853. 27. Drucker CR, Duncan WC. Antiplatelet therapy in atrophie blanche and livedo vasculitis. J Am Acad Dermatol 1982;7:35963. 28. Sauer GC. Pentoxifylinne (Trental) therapy for the vasculitis of atrophie blanche. Arch Dermatol 1986;122:380-1. 29. Hairston BR, Davis MD, Gibson LE, Drage LA. Treatment of livedoid vasculopathy with low-molecular-weight heparin: report of 2 cases. Arch Dermatol 2003;139:987-90. 30. Lee JH, Choi HJ, Kim SM. Livedoid vasculitis responding to PUVA therapy. Int J Dermatol 2001;40:153-7. 31. Kreuter A, Gambichler T, Breuckmann F, Bechara FG, et al. Pulsed intravenous immunoglobulin therapy in livedoid vasculitis: an open trial evaluating 9 consecutive patients. J Am Acad Dermatol 2004;51:574-9. 32. Jolles S, Hughes J, Whittaker S. Dermatogical uses of high-dose intravenous immunoglobulin. Arch Dermatol 1998;134:80-86. 33. Amita H, Levy Y , Shoenfeld Y. Use of intravenous immunoglobulin in livedo vasculitis. Clin Exp Rheumatology 2000;18:404-6. 34. Dahl MV, Bridges AG. Intravenous immune globulin: fighting antibodies with antibodies. J Am Acad Dermatol 2001;45:77583. 181