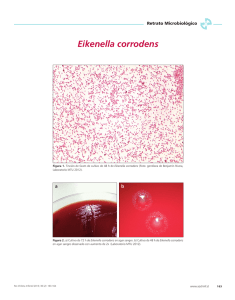
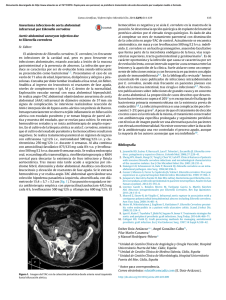
Bacteriemia por Eikenella corrodens secundaria
Anuncio

BACTERIEMIA POR EIKENELLA CORRODENS SECUNDARIA A INFECCIÓN PERIODONTAL EN UN PACIENTE NEUTROPÉNICO. CASO 518 Varón de 44 años natural de Mali que acude al Servicio de Urgencias por fiebre de seis horas de evolución y malestar general. Como antecedentes de interés cabe destacar enfermedad de GravesBasedow en tratamiento con carbimazol 30 mg/día desde hacía 6 semanas y la extracción del tercer molar inferior cuatro días antes. En la exploración física se objetiva temperatura de 39,5ºC, TA de 122/71 y FC de 137 lpm. Se palpa bocio grado Ia. En la boca se observan caries en varias piezas dentarias y enrojecimiento en la zona de extracción dentaria. En la analítica se observan 500 leucocitos/mm3 (0% neutrófilos) con el resto de series normal y PCR de 321 mg/L, sin otros datos de interés. Se toman muestra de orina, esputo y hemocultivos para estudio microbiológico y se comienza con tratamiento antibiótico de amplio espectro (amikacina 20 mg/kg/día y cefepima 2 g/8 horas). En el estudio de médula ósea practicado al día siguiente se detecta hipercelularidad con parada madurativa en serie mieloide sin otros datos de interés, de probable etiología farmacológica, motivo por el que se suspende carbimazol y comienza tratamiento con G-CSF 5 µg/kg/día. Los tres días primeros del ingreso el paciente tuvo dos picos de fiebre de 39ºC, por lo que al cuarto día se cambió el tratamiento antibiótico previo por meropenem 1 g/8 horas y se añadió fluconazol 400 mg/día, al tiempo que se realizó ecocardiograma transesofágico que descartó la presencia de endocarditis. Al quinto día desapareció la fiebre, coincidiendo con la recuperación parcial de la cifra de neutrófilos a 1.800/mm3, y al séptimo día se dio de alta por evolución favorable y resolución del cuadro. A las 18 horas de incubación se detecta en los hemocultivos (frascos aerobio y anaerobio) el crecimiento de un bacilo gramnegativo que se subcultiva posteriormente en diferentes medios sólidos en aerobiosis, anaerobiosis y en atmósfera enriquecida en CO2. A las 48 horas crecen en agar Columbia con sangre, Agar Brucella y en agar chocolate (pero no en agar McConkey) unas colonias de color amarillo pálido, incrustadas en el agar y con olor a hipoclorito. Son oxidasa positiva, catalasa negativa, ureasa e indol negativas, reducen los nitratos a nitritos y no fermentan los hidratos de carbono. En el estudio de sensibilidad que se realizó paralelamente por el método de Kirby-Bauer con placas de Mueller-Hinton con 5% de sangre y por tiras de E-test®, la cepa aislada resultó sensible a todos los antibióticos probados (ampicilina, amoxicilina-ácido clavulánico, azitromicina, levofloxacino, ciprofloxacino, cefotaxima, cefuroxima, imipenem, cotrimoxazol y tetraciclinas), salvo a gentamicina y amikacina con CMI de 16 y 32 mg/L, respectivamente. Su identidad fue confirmada por amplificación y secuenciación del gen 16s ARN. ¿Qué microorganismo es el responsable de la infección? ¿Cuáles son las características microbiológicas y la sensibilidad antimicrobiana? Eikenella corrodens es una bacteria oportunista y pertenece al grupo HACEK. Fue identificada por primera vez en 1948 por Henriksen como un microorganismo gramnegativo anaerobio facultativo con la peculiaridad de crear una depresión en el medio de cultivo, por lo que lo denominó bacilo corrosivo. Posteriormente, esta bacteria fue reclasificada en el género Eikenella. Es un bacilo gramnegativo anaerobio facultativo que puede adoptar un aspecto pleomorfo o cocobacilar, inmóvil, no forma esporas, no tiene cápsula y su crecimiento se ve favorecido en medios con hemina e incubación en CO2 al 5-10%. Crece en forma de colonias puntiformes, pequeñas y grisáceas (las más antiguas pueden adoptar un color amarillo pálido) que huelen a lejía. En ocasiones, pueden mostrar una discoloración ligeramente verdosa en agar sangre y hasta en un 50% de los casos producen depresiones muy características en el agar. Son oxidasa positiva, catalasa negativa salvo excepciones que son débilmente positivas, lisina descarboxilasa y ornitina descarboxilasa positivas, ureasa, gelatinasa, indol y esculina negativas, no fermentan los hidratos de carbono y reducen nitratos a nitritos. Aunque se han descrito cepas productoras de beta-lactamasas mediadas por transposón, la mayor parte de las cepas son sensibles a ampicilina, ureidopenicilinas, cefalosporinas de segunda y tercera generación, carbapenemas, tetraciclinas y fluoroquinolonas. Por el contrario, presentan sensibilidad variable frente a aminoglucósidos, tigeciclina, telitromicina y azitromicina; y son resistentes a cefazolina, metronidazol y clindamicina. ¿Cuál es el hábitat de esta bacteria y qué tipo de infecciones causa? ¿Cuáles son sus mecanismos de patogenicidad? Esta bacteria forma parte de la flora endógena de la boca, vías respiratorias superiores, tracto gastrointestinal y genitourinario. Las infecciones más frecuente en la que se ve involucrada son las de cabeza y cuello, seguidas de las del aparato respiratorio, heridas por mordedura humana, infecciones ginecológicas asociadas a dispositivos intrauterinos y endocarditis en pacientes con valvulopatías y ADVP. Es muy típico el aislamiento de esta bacteria en las infecciones por mordedura humana, sobre todo, en las lesiones de puño cerrado, y en infecciones de personas que se muerden los dedos o las uñas, y que por proximidad al hueso, puede desencadenar osteomielitis y/o artritis. Se ha aislado en ulceración genital tras mordedura humana en pene y en absceso vulvar de una paciente diabética tras prácticas de sexo oral. E. corrodens es una bacteria oportunista y la infección que causa se caracteriza por ser de evolución lenta, con un intervalo que suele ser superior a una semana entre el momento de la lesión y la aparición de las manifestaciones clínicas de la enfermedad. La supuración que causa este tipo de infección suele ser fétida y simula un proceso anaerobio. Suele aislarse como un componente de infecciones mixtas, generalmente junto a estreptococos, y con frecuencia en pacientes con algún grado de inmunodeficiencia. Entre los componentes de la superficie de E. corrodens que se pueden considerar como factores de virulencia se encuentran los lipopolisacáridos, exopolisacáridos, proteínas de membrana externa, limo, adhesinas y pilis. De hecho, parece que podrían estar relacionados los componentes de la superficie celular con el diferente grado de virulencia de las cepas. ¿Es frecuente la infección invasiva por corrodens? ¿Hay muchas bacteriemias descritas? ¿Cuál fue el foco de infección en nuestro paciente? Tras la revisión de la literatura médica (Medline 1985-2011) son escasos los trabajos que documentan bacteriemias por esta especie, y una proporción importante de ellos corresponden a pacientes ADVP y/o con valvulopatías diagnosticados de endocarditis. Está descrito un caso de infección intratorácica con pericarditis, mediastinitis, neumonía y pleuritis, y otro paciente oncológico con abdomen agudo en el que se aisló E. corrodens junto a un estreptococo del grupo C. Por otro lado, en una revisión realizada de 43 casos de infecciones invasivas por E. corrodens, se detectan 8 bacteriemias (5 polimicrobianas), de las cuales 4 fueron secundarias al drenaje de abscesos abdominopélvicos, 1 por absceso cerebral, 1 por tiroiditis supurada y 2 por endocarditis. Por lo tanto, la proporción de casos descritos de infección invasiva que desarrollan bacteriemia no superan el 20%. En nuestro paciente el factor determinante de la bacteriemia fue la manipulación dental favorecida por la situación de inmunosupresión transitoria en la que se encontraba en ese momento el paciente debido al carbimazol. Se ha descrito por métodos de biología molecular el hallazgo de E. corrodens y otros bacterias saprofitas de la boca en el torrente sanguíneo hasta en un 50% de pacientes después de un episodio de manipulación dental. Este hallazgo puede no tener ninguna transcendencia en pacientes sanos con un sistema inmune indemne; sin embargo, puede ser el origen de una grave infección en pacientes inmunodeprimidos como el que se presenta. ¿Cuáles son los principales microorganismos causantes de bacteriemia en pacientes neutropénicos? ¿Cuál es el tratamiento empírico en los pacientes con neutropenia febril? Las alteraciones cuantitativas o cualitativas de los fagocitos (segmentados, cayados y monocitos), predisponen primariamente a la infección bacteriana y fúngica y no incrementan, en general, la incidencia de infecciones virales o parasitarias. En las últimas décadas se han producido cambios significativos en cuanto a los tipos de bacterias que producen infección con mayor frecuencia, siendo los grampositivos (estafilococos coagulasa negativa, enterococos, estreptococos y S. aureus) los microorganismos aislados con mayor frecuencia en estados de neutropenia y fiebre, representando un 60-80% de las bacteriemias documentadas microbiológicamente. Este hecho parece explicarlo el aumento de prevalencia en el uso de catéteres centrales. La mayoría de estos gérmenes grampositivos no suelen causar infecciones que constituyan un compromiso vital inmediato para el paciente. Sin embargo, a pesar de la menor incidencia, las infecciones por bacterias gramnegativas (especialmente P. aeruginosa y E. coli), dan lugar a procesos más graves asociados a mayores tasas de mortalidad, motivo que justifica la utilización de protocolos de tratamiento antibiótico empírico con cobertura de amplio espectro para bacterias gramnegativas de instauración precoz. Aunque en la mayoría de los episodios de fiebre asociada a neutropenia no se logra identificar el agente causal, se cree que la flora endógena del paciente es la causa en un porcentaje muy elevado de casos. La pauta empírica inicial debe tener un espectro muy amplio por la posible participación de bacterias grampositivas y gramnegativas, de forma que la combinación más adecuada y más ampliamente aceptada consta de un beta-lactámico de espectro amplio con actividad antipseudomonas tipo ceftazidima/cefepima con un aminoglucósido tipo amikacina/gentamicina. La adición de vancomicina o teicoplanina para cubrir los estafilococos está indicada en pacientes con catéteres venosos permanentes si se sospecha infección asociada. La monoterapia con carbapenemas, cefalosporinas de tercera (ceftazidima) o cuarta generación constituye otra posibilidad terapéutica inicial. En los pacientes neutropénicos, la infección por hongos se ve favorecida por otros factores, tales como la presencia de úlceras mucosas, tratamiento antibiótico, corticoterapia y nutrición parenteral. Por ello, aunque su implicación en el primer episodio febril de un paciente neutropénico suele ser excepcional, sí es habitual su participación en infecciones secundarias en el seno del tratamiento antibiótico empírico. El tratamiento antifúngico durante la neutropenia, sobre todo cuando es severa y de larga duración, suele administrarse de forma empírica, siguiendo al tratamiento antibacteriano cuando este no es eficaz una vez transcurridos 4-7 días, o cuando aparece un segundo pico febril no atribuible a sobreinfección bacteriana, siendo la anfotericina B el tratamiento empírico de elección. ¿Cuál es el fármaco responsable de la agranulocitosis? ¿Cuál es la incidencia de esta reacción adversa y cuál es el mecanismo por el que se produce? Las tionamidas son un grupo de fármacos antitiroideos en los que se da con más frecuencia este tipo de reacción idiosincrásica, junto con clozapina, sulfasalazina, metimazol y ticlopidina. El fármaco responsable es el carbimazol y se da reacción cruzada con el resto de antitiroideos pertenecientes al grupo de las tionamidas, siendo necesaria su retirada sin poder ser sustituido por otro del grupo. La prevalencia de agranulocitosis durante la terapia con tionamidas se sitúa en el 0,2-0,5%, generalmente está descrita con más frecuencia en los dos primeros meses de tratamiento, y se observa una asociación mayor en las personas de más de 40 años, con dosis mayores de 40 mg diarios, terapia previa con tionamidas y sexo femenino. La destrucción de los granulocitos por un mecanismo de tipo autoinmune se da en días o semanas de tratamiento, los síntomas son agudos y explosivos y la recuperación es rápida. Por ello, el beneficio de la utilización de G-FSC no es tan claro como en las otras causas de neutropenia por toxicidad directa sobre la médula como ocurre con los citostáticos. Bibliografía Sheng WS, Hsueh PR, Hung CC, et al. Clinical features of patients with invasive Eikenella corrodens infections and microbiological characteristics of the causative isolates. Eur J Clin Microbiol Infect Dis 2001; 20: 231-6. Cercenado E, Cercenado S, Bouza E. In vitro activies of tigecycline (GAR-936) and 12 other antimicrobial agents against 90 Eikenella corrodens clinical isolates. Antimicrob Agents Chemother 2003; 47: 2644-5. Caso descrito y discutido por: Sonia Junquera Bañares Servicio de Microbiología Hospital Santos Reyes Aranda de Duero. Burgos Correo electrónico: [email protected] Palabras Clave: Bacteriemia, Eikenella corrodens. Neumonía por Pasteurella multocida.