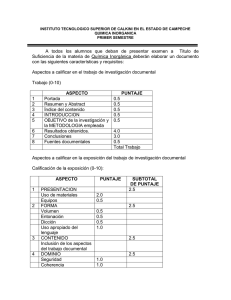
Contenidos teóricos: Contenidos prácticos:
Anuncio

QUÍMICA (1º Biología, grupo 16). PROGRAMA. Curso 2008/09 Carácter: Troncal Créditos: 6 (4 teóricos + 2 prácticos) Páginas web: asignatura http://www.uam.es/quimicabiologos grupo 16 http://www.uam.es/quimica/aimp/luis/Docencia/QB Profesor: Luis Seijo http://www.uam.es/luis.seijo Contenidos teóricos: 1. Introducción Reacciones y ecuaciones. Ajuste de reacciones redox. Cálculos estequiométricos. Reactivo limitante. Rendimiento de las reacciones. Composición de las disoluciones: formas de expresión. Diluciones. 2. Termoquímica. Objetivos. Principios y conceptos básicos. Primer principio. Entalpía. Calores de reacción. Ley de Hess. Segundo principio: Entropía. Energía libre. Espontaneidad de las reacciones químicas. 3. Cinética Química. Velocidad de reacción. Concepto y medida. Leyes de velocidad. Orden de reacción. Relaciones concentración-tiempo. Cinética de primer orden. Vida media. Mecanismos de reacción. Molecularidad. Energía de activación. Catálisis. 4. Equilibrio químico. Concepto. Sistemas gaseosos. Concentraciones de equilibrio. Ley de acción de masas. Relación entre equilibrio y energía libre. Equilibrios heterogéneos. Aplicaciones de la constante de equilibrio. Cociente de reacción. Cambio de condiciones y equilibrio: Principio de Le Chatelier. Equilibrios de solubilidad: Ks. 5. Equilibrios ácido-base. Equilibrios en disolución. Producto iónico del agua. Disoluciones neutras, ácidas y básicas. Concepto de pH. Modelos ácido-base. Ácidos y bases fuertes y débiles: Ka y Kb. Grado de ionización. Ácidos polipróticos. Indicadores. Propiedades ácido-base de las sales: hidrólisis. Reacciones ácidobase. Valoraciones. Efecto del ión común: disoluciones amortiguadoras. Características. Cálculos prácticos. Capacidad amortiguadora. Cálculos de variaciones de pH. 6. Reacciones de oxidación-reducción. Conceptos básicos. Electroquímica. Serie electromotriz: semirreacciones y potenciales de electrodo. Aplicaciones. Reacciones espontáneas: pilas. Fuerza electromotriz y energía libre. Efecto de la concentración sobre el voltaje: Ecuación de Nernst. Contenidos prácticos: 1. 2. 3. 4. 5. 6. 7. 8. Normas generales de comportamiento y seguridad en el laboratorio. Preparación de disoluciones. Determinación de la estequiometría de una reacción de precipitación. Cinética química. Estudio cuantitativo de la velocidad de una reacción química y los factores que la modifican. Equilibrio químico. Perturbaciones del estado de equilibrio de diferentes reacciones mediante adición/sustracción de reactivos y cambios de temperatura. Normalización de disoluciones. Determinación del índice de acidez de un vinagre mediante una valoración ácido-base. Disoluciones reguladoras: preparación y estudio de sus propiedades. Determinación potenciométrica de la Ka del ácido acético. QUÍMICA (1º Biología, grupo 16). PROGRAMA. Curso 2008/09 Fechas de prácticas: Noviembre – Diciembre de 2008 Laboratorio: Facultad de Ciencias, módulo C-VII, 1ª planta. Los alumnos asistirán al laboratorio en grupos de unos 40 estudiantes. Se publicarán listados con los alumnos que componen cada grupo de prácticas. Habrá 10 turnos de prácticas semanales, 5 de tarde, de 14:30 a 18:30 h y 5 de mañana, de 9:30 a 13:30. Cada estudiante debe asistir al laboratorio a cuatro sesiones (una sesión por semana, el día que corresponda). Requisitos recomendados Formulación química. Conocimientos de química de nivel preuniversitario BIBLIOGRAFIA - AMERICAN CHEMICAL SOCIETY. 2005. Química. Un proyecto de la ACS. Ed. Reverté. Barcelona. - CHANG, R. 2007. Química. 9ª edición. McGraw-Hill. - MASTERTON, W.L., HURLEY, C.N. 2003. Química: Principios y Reacciones. 4ª edición. Thomson Editores. Madrid. - PETRUCCI, R.H., HAWOOD, W.S. 2003. Química general. 8ª edición. Prentice Hall. - REBOIRAS, M.D. 2006. Química. La ciencia básica. Thomson Eds. Madrid. - REBOIRAS, M.D. 2007. Química. La ciencia básica. Problemas resueltos. Thomson Eds. Madrid. Criterios de evaluación Para superar las prácticas será necesario: - asistir al laboratorio - entregar, de forma adecuada, los resultados obtenidos y las cuestiones propuestas - examen teórico sobre las prácticas realizadas La calificación de las prácticas de laboratorio será la media aritmética entre la calificación de las cuestiones propuestas y la del examen. Es necesario obtener una calificación mínima de 4 puntos para que participe en la calificación final de la asignatura. La evaluación de los contenidos teóricos se realizará mediante un examen escrito que incluirá cuestiones y problemas y que tendrá lugar en las siguientes fechas (aprobadas en Junta de Facultad): lunes 2 de febrero (mañana) de 2009 y viernes 4 de septiembre (mañana) de 2009. También habrá dos exámenes parciales de carácter voluntario, no eliminatorios; cada uno de ellos contribuirá con un 25% a la nota global de teoría si su calificación fuese superior a la del examen final y no se tendrá en cuenta si fuese inferior. Calificación final de la asignatura: 80% de teoría y 20% de las prácticas