Implementación del Programa Regional de
Anuncio

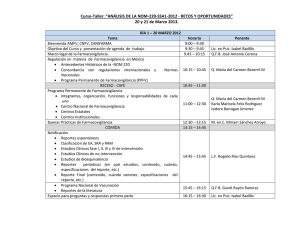
Implementación del Programa Regional de Farmacovigilancia en Centroamérica y República Dominicana La Habana, junio 2016 Dr. Ramón Palop Baixauli Premisas para la Implementación del Programa Regional de Farmacovigilancia en Centroamérica y República • Las Autoridades Reguladoras Nacionales de Referencia regional (ARNr) de la región enfrentan grandes desafíos para ejercer su función reguladora con eficiencia y aspiran a desarrollar un nivel mayor de desempeño. • La SE-COMISCA que articula y conduce las acciones políticas y estratégicas que se consideran prioritarias en el Sector Salud, es el espacio favorable para generar y articular procesos que contribuyan al desarrollo un marco regulatorio, fortaleciendo el trabajo conjunto entre las ARNr • Facilitar la cooperación horizontal entre países de la región y, otros sistemas de integración, organismos y agencias de cooperación. 1. Resultados esperados del Programa Subregional de Farmacovigilancia. 2. Logros y Proyecciones Planteamiento de la Acción Regional en Salud, centrada en medicamentos: Desarrollo de Marcos Normativos armonizados Mecanismos de Contención de costos Fortalecimiento de los mecanismos de vigilancia Evolución y Resultados del PSFV (Periodo 2008-2016) 1.- Resultados esperados del PSFV periodo 2014 - 2016 Resultados Esperados 1: • El Sistema Regional de Farmacovigilancia dispone de una normativa que permita el desarrollo de las actividades de evaluación de la seguridad de los medicamentos Acciones: Creación del Sistema Subregional de Farmacovigilancia (SSFV). Establecimiento de requerimientos mínimos de organización y funcionamiento de los CNFV Oficialización del Sistema de Información Creación del sistema de comunicación y difusión del SSFV Entre otras…. • Resultado esperados 2: Los Centros Nacionales de Farmacovigilancia (CNFV) disponen de procesos y procedimientos armonizados para la evaluación de la seguridad de los medicamentos. Que incluye el desarrollo del Sistema Único de Información de Farmacovigilancia para CA y RD: • Plan de transferencia tecnológica de FACEDRA en tres países de la región a partir del año 2017. • Desarrollo del Catalogo de Medicamentos para CA y RD, como una aplicación informática con perspectiva regional que reúne los datos de autorización de comercialización de los medicamentos registrados en las Autoridades Reguladoras Nacionales (ARN) de la región, siguiendo sus propios procedimientos de Registro 2. Logros alcanzados del periodo 2015 - 2016: 1. Formulación de la propuesta de Reglamento Técnico Centroamericano (RTCA) de Farmacovigilancia para Centroamérica que define entre otros aspectos: • Criterio armonizados de funcionamiento de los CNFV • Mecanismos consensuados de trabajo • Manejo e intercambio de información entre los CNFV – PSFV – UPPSALA • Definición de un Sistema Único de Información de Farmacovigilancia que incluye FACEDRA. • Trabajo colaborativo para el desarrollo de competencia técnicas Actualmente en proceso de validación en Consejo de Ministros de Economía (COMIECO) 2: Implementación del Sistema de Farmacovigilancia del PSFV. Generación de 3. Definición del Catálogo de Medicamentos para CA y RD Alertas Regionales de Catalogo de Medicamentos de CA y RD (CMC) El Catalogo posibilitara la implementación de un Sistema Regional de información de Medicamentos a través del levantamiento de la información electrónica unívoca de cada uno de los medicamentos registrados en los países de la Región. Mapeo Fármaco FACEDRA FACEDRA Sistema De Intercambio De Datos De RAM En Centroamérica 10 Flujo de Información TAC FACEDRA Envío UMC Profesional Ciudadano sanitario Flujo de información OMS 11 Procesamiento de los datos PRE-FACEDRA FACEDRA DMC Validación Proyecciones 1.- Aprobación por COMIECO del Reglamento de Farnmacovigilancia . 2.- Creación del Diccionario de Medicamentos Centroamericano 3.- Desarrollo de FACEDRA incorporación de los diccionarios médicos (MEDRA y el Catalogo de Medicamentos de Centroamérica). 4. – Implantación del piloto de FACEDRA en tres países de Centroamérica. 2º SEM 2016 1 2º SEM 2016 2 1º SEM 2017 3 2º SEM 2017 4 Gracias…. Oportunidades en el desarrollo de los Sistemas de Regulación de Medicamentos en Centroamérica y República Dominicana. • Contar con una Red de Autoridades Reguladoras que permitan un espacio de análisis y generación de propuestas técnicas y de incidencia política. • Desarrollo de recurso humano, técnico y tecnológico que fortalezcan los sistemas de regulación de medicamentos y otras tecnologías sanitarias en los países de Centroamérica y República Dominicana. • Gestión del conocimiento que favorezca la cooperación horizontal y el intercambio de buenas prácticas regulatorias. Alcance de la RED: • Establecer procesos participativos y de cooperación activa entre las ARN de la Región, que fomenten la convergencia y la armonización regulatoria. • Definir estrategias y mecanismos de armonización regulatoria, que fomente su divulgación, adopción e implementación por las ARN. • Impulsar el fortalecimiento de las competencias en buenas prácticas regulatorias. • Promover el intercambio de experiencias y conocimientos regulatorios entre las ARN de la Red y con ARN de referencia.