Aminas
Anuncio

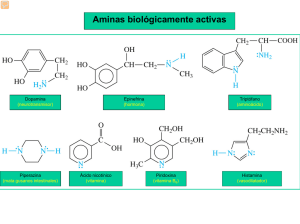
QUÍMICA ORGÁNICA III Aminas L. Wade, Jr. Química Orgánica 5ª Edición. Pearson Educación, S.A., Madrid, 2004. ¿Qué son las aminas? Son derivados orgánicos del amoniaco con uno o más compuestos alquilo o arilo enlazados al átomo de nitrógeno Funciones de las aminas 1) 2) 3) 4) Bioregulación Neurotransmisión Defensa contra depredadores Drogas y medicamentos Efectos al medio ambiente, alimentos, salud ? Ejemplos de aminas biológicamente activas Alcaloides Se clasifican según el número de radicales alquilo o arilo unidos al átomos de nitrógeno Propiedades físicas de las aminas ¿Quién es el donador? Quién es el aceptor? Las aminas son bases ligeramente fuertes, sus soluciones acuosas son básicas. Una amina puede abstraer un protón del agua, dando lugar a un ión amonio y a un ión hidróxido La constante de basicidad esta dada por la ecuación y el pkb La basicidad es una propiedad de las aminas que se puede utilizar para su purificación. ¿Cuál es el pKb? Solubilidad de las aminas. Solubilidad de las aminas y las sales de amonio La mayoría de las aminas, que contienen más de seis átomos de carbono, son relativamente insolubles en agua. En presencia de ácido diluido (en disolución acuosa), estas aminas forman las sales de amonio correspondientes, por lo que se disuelven en agua. La formación de una sal soluble es una de las características de las pruebas para el grupo funcional amina. Una amina puede convertirse en sal de amonio mediante un tratamiento con ácido. La sal de amonio es soluble en agua. Al tratar la sal de amonio con soluciones básicas la volverá a convertir en la amina. Cocaína. La cocaína generalmente se consume en forma de clorhidrato. Cuando el clorhidrato de cocaína se trata con hidróxido de sodio y se extrae con éter se vuelve a transformar en la base volátil, utilizada para fumar. La cocaína se encuentra normalmente como una sal de clorhidrato porque es sólida y se puede manejar fácilmente. Al neutralizar el clorhidrato de cocaína se convierte en una base libre que es más volátil. Clasificación Nomenclatura Aminas primarias Nombre IUPAC CH3-CH(CH3)-CH2-NH2 Nombre común metilamina etilamina n-butilamina Isobutilamina CH3-C(CH3)2NH2 terbutilamina CH3CH(CH3)NH2 Isopropilamina 2-metil-2propanamina 2-propanamina CH3NH2 CH3-CH2-NH2 CH3-CH2-CH2-CH2-NH2 metanamina etanamina 1-butanamina 3-butanamina Aminas secundarias CH3-NH-CH3 (CH3-CH2)2-NH2 CH3-CH2-NH-CH3 CH3-CH2-CH2-NH-CH2-CH2-CH3 CH3-CH2-NH-CH2-CH2-CH3 Nombre Nombre IUPAC común dimetilamina N-metilmetanamina dietilamina N-etiletanamina metil etilamina N-metiletanamina dipropilamina N-propilpropanamina etil propilamina N-etil propanamina Aminas terciarias CH3-CH2-NH-CH3 Nombre común trimetilamina trietilamina metil etilamina CH3-CH2-CH2-N-(CH3)2 dimetilpropilamina (CH3)3-N (CH3-CH2)3-N Nombre IUPAC N,N-dimetilmetanamina N,N-dietiletanamina N-metiletanamina N,N-dimetilpropanamina Bases Nitrogenadas Purinas Adenina (A) Pirimidinas Citosina (C) ADN Guanina (G) Timina (T) ARN Uracilo (U) Características estructurales El amoniaco tiene una estructura tetraédrica algo distorsionada, con una de las posiciones del tetraedro ocupada por un par de electrones no enlazantes. Esta geometría es debida a la hibridación sp3 del nitrógeno, de forma que el par de electrones solitario hace que el ángulo H-N-H se comprima desde 109,5º (ángulo de la estructura tetraédrica perfecta) hasta 107º. Estabilización por el grupo alquilo de las aminas. Los grupos alquilo son donantes de electrones. Como la metilamina tiene un grupo metilo, éste ayuda a estabilizar la carga positiva del nitrógeno. Esta estabilización disminuye la energía potencial del catión metilamonio, haciendo que la metilamina sea una base más fuerte que el amoniaco. Las alquilaminas sencillas tienden a ser bases más fuertes que el amoniaco. Sales de amonio La protonación de una amina da lugar a una sal de amina. La sal de amina está formada por dos tipos de iones: el catión amonio y el anión derivado del ácido. Las sales de aminas sencillas se nombran como sales de amonio sustituidas. Las sales de aminas complejas utilizan los nombres de la amina y del ácido que dan lugar a la sal. Obtención de aminas 1.Por alquilación de amoniaco o de otras aminas 2.Por reducción de otros derivados que contengan nitrógeno 3.Por aminación reductiva b) La naturaleza de la amina obtenida depende de los sustituyentes de la amida Mecanismo de la reducción de amidas Etapa 1: El H nucleofílico del hidruro se adiciona al carbono electrofílico del grupo carbonilo. Los electrones del grupo C=O se desplazan hacia el O electronegativo creando un complejo metal alcóxido Etapa 2: El intermedio tetraédrico colapsa y desplaza el oxígeno como parte de un grupo metal alcóxido saliente. Esto produce un ión imonio altamente reactivo Etapa 3: El H nucleofílico del hidruro se adiciona (reducción rápida) al C electrofílico del sistema iminio. Los electrones π electrons de C=N se desplazan al N catiónico neutralizando la carga y creando la amina Reducción de nitrilos Aldehido ¿Qué tipo de amina se forma?