Sesión 22 TEMA: AMINAS I. Objetivos: Después de finalizar el
Anuncio

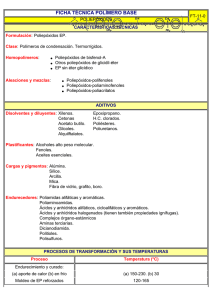
Sesión 22 TEMA: AMINAS I. Objetivos: Después de finalizar el estudio de este capítulo Ud. debería ser capaz de: 1) Escribir la fórmula estructural y el nombre de aminas primarias, secundarias y terciarias. 2) Distinguir entre aminas primarias, secundarias y terciarias.. 3) Conocer las principales formas de obtención de aminas. 4) Conocer las principales reacciones en que pueden intervenir las aminas. 5) Conocer las principales drogas relacionadas con las aminas. II. TEMAS. Las aminas son compuestos que se consideran derivados del amoníaco, al reemplazar sus hidrógenos por radicales alquilo. Como el amoníaco tiene tres hidrógenos, habrá tres clases de aminas: si se remplaza un solo hidrógeno, la amina es primaria, si se reemplazan dos, la amina es secundaria y si se reemplazan tres, la amina es terciaria. R−NH2 amina primaria R’ | R-NH amina secundaria R’’ | R-N-R’ amina terciaria Nomenclatura: El método más extendido para nombrar las aminas es el radicofuncional que consiste en tomar como base el radical más complejo y añadirle el sufijo -amina. Los otros radicales se nombran como sustituyentes sobre el nitrógeno. Cuando la función amina no es principal se utiliza el prefijo -amino . El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Clasificación: Monoaminas: son las aminas que derivan de una sola molécula de amoníaco. Ejs.: metil amina: CH3-NH-CH 3 dimetilamina; CH 3-NH 2 NH 2 fenilamina o anilina; CH 3 CH 3 CH 3 difenilamina; Ar trimetilamina; N Ar Ar N trifenilamina; Diaminas: son las que derivan de dos moléculas de amoníaco. Ejs.: H 2N-CH 2-CH 2-NH2 etilendiamina; H 2N-CH 2-CH2-CH2-CH2-NH 2 1,4-diaminobutano o putrescina; H 2N-CH 2-CH 2-CH2-CH2-CH2-NH 2 1,5-diaminopentano o cadaverina; NH2 Metafenilendiamina o p-diaminobenceno Síntesis NH 2 • Reducción de nitrilos (o cianuros). • Reducción de nitroderivados H2/cat. R-NO2 • R-NH2 Reacción de derivados monohalogenados con amoniaco C2H5-I + NH3 [C2H5-NH3]+I- El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. El exceso de amonia co lib era la amina [C2H5-NH3]+I- + NH3 C2H5-NH2 + NH4+I- La etila mina reacciona con una nueva molécula de io duro de etilo C2H5 C2H5-NH2 + C2H5-I H2N C2H5 + I- La amina secundaria es liberada por el amonia co [(C2H5)2NH2]+I- + NH3 (C2H5)2NH2 + NH4+I- La reacción continúa en la misma forma para formar la amina terciaria (C2H5)2NH2 + C2H5-I [(C2H5)3NH]+I- + NH3 [(C2H5)3NH]+I- + NH4+I(C2H5)3N + NH4+I- Propiedades físicas: Las aminas alifáticas, en lo s primeros términos son gaseosas de olor amonia cal y solu ble s en agua, de tres a once átomos de carbón, son líquid os a temperatura ambiente, excepto la trimetilamina, y las restantes son sólidas, disminuyendo su solubilidad en agua y su olo r desagradable. Las aminas primarias y secundarias (pueden formar puentes de Hid rógeno) tienen puntos de ebullición más altos que las terciarias de igual peso molecular. Las aminas son compuestos eminentemente básicos. Propiedades químicas: 1. Basicidad. Las aminas, al igual que el amoníaco, tienen propiedades básicas, debido al par de electrones no compartidos del átomo de nitrógeno, las que se manifiestan en su reacción con los ácidos para formar sales sustituidas de amonio cuaternario [R-NH 3]+OH - ion alquilamonio R-NH2 + H 2O [R-NH2-R’]+OH - ion dialquilamonio R-NH-R’ + H 2O [CH 3-CH2-NH3]+ Cl- cloruro de etilamonio CH 3-CH 2-NH 2 + HCl 2. Con los haluros, reemplazan al halógeno, en procesos de alquilación o acilación, si se trata de haluros de alquilo o de acilo. 3. En las aminas aromáticas el grupo amino se oxida al respectivo grupo nitro. El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. 4. Las aminas primarias con ácido nitroso producen el alcohol correspondiente y nitrógeno R-NH2 + HO-NO R-OH + N 2 + H 2O 5. Enlace peptídico. Las aminas pueden reaccionar con los ácidos carboxílicos para formar la amida correspondiente. Este enlace, cuando se produce entre aminoácidos se llama enlace peptídico, y es fundamental para la estructura de las proteinas. R’-C-NH-R + H 2O R-NH2 + R’-C-OH || || O O R-NH-R’ + R’’-C-OH R’’-C-N-R’ + H2O || || | O O R Las aminas terciarias no reaccionan con los ácidos carboxílicos. Principales Aminas: a) METILAMINA, CH3-NH2, gas in colo ro de olor desagradable, semejante al amoniaco, es una base mucho mas fuerte que el amoníaco (Kb = 4,4 x 10 -4), arde en presencia de aire producie ndo dió xido de carbono, nitrógeno y agua. Muy soluble en agua (1 l de agua disuelve 1000 l de metilamina a temperatura ambiente, caso similar al del amoníaco). b) FENILAMINA O ANILINA, C6H5-NH2, esta amina primaria aromática no existe en la naturale za, se obtiene generalmente por reducción del nitrobenceno con hid rógeno, en solució n ácid a. C6 H5 NO2 3H2 C6 H5 NH2 + 2 H2O La anilin a es un líquid o aceitoso, incolo ro de olo r característico. Su punto de ebullición es de 184ºC. Es insoluble en agua y soluble en disolventes orgánicos, sus vapores son venenosos y se oxid a con facilidad. Al igual que las aminas primaria s alifáticas, con el ácid o nitroso produce nitrógeno y fenol. La anilina tiene múltiples aplicaciones como colorante y como materia prima en la industria de colorantes, también se utiliza en la fabricación de medicamentos y resinas sintéticas. Con el ácid o sulfúrico concentrado, y en caliente, la anilin a se transforma en ácid o sulfanílico, compuesto de mucha utilidad en la industria de colo rantes. NH2 NH2 180º C + HO-HSO3 + H2O SO3H Acido Sulfanílico ALCALOIDES: Son productos alcalinos, que contienen átomos de nitrógeno en su molécula. Se producen en ciertos vegetales. En la actualidad algunos de ellos se han sintetizado. Tienen una acción fisiológica marcada sobre el hombre y los animales. Algunos se usan en medicina como analgésicos, como sedantes y para el tratamiento de algunas enfermedades. En casi todos los países, su uso está controlado por leyes. Según sus efectos, los alcaloides pueden ser estupefacientes, sedantes, hipnóticos, estimulantes, alucinógenos etc. Los alcaloides junto con el tabaco, el alcohol y los medicamentos entran el grupo de sustancias que comúnmente se llaman "drogas". Droga (según la O.M.S) es una sustancia que introducida en el organismo vivo, modifica una o varias de sus funciones. Ejemplo de alcaloides: Opio, Morfina, Codeína, Heroína, Opiáceos sintéticos, Hachís, (marihuana), El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. cocaína, nicotina, LSD, etc. Morfina, extraida del opio (izq.) y codein a, derivado de la morfina (der.) heroína (derivado de la morfina) cocaina (prin cipio activo de la hoja de coca) tetrahidrocannabinol (prin cipio activo de la marihuana) LSD (ácido lisérgico) III. Actividad previa. Syllabus sesión 20 IV. Metodología de la sesión. Clase expositiva, de debate y con eje rcicio s prácticos El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. V. Lectura post-sesión. Por defin ir Cuestionario. 1. Distinga entre aminas primaria s, secundarias, terciarias y sales de alq uila monio . 2. Escriba la fórmula molecular y la fórmula estructural para 3. 4. a. N-metilpropilamina b. N,N-dimetil-N’,N’-dietil-1,3-propanodiamina c. Ácido 2-aminopropanoico d. Ácido p-aminobenzoico e. trimetilamina f. difenilamina g. p-dia minobenceno h. 1,4-dia minobutano Escriba ecuaciones para la s siguie ntes reaccio nes: a. Acetonitrilo y AlLiH4 en ambiente ácido. b. Nitrofenol y Fe, HCl y calor c. Dietilamina y ioduro de etilo. d. 1-propilamina y HCl. e. 1-Br-butano y amoniaco f. cloruro de acetilo y trimetilamina g. anilin a y permanganato de potasio . h. Fenila mina y ácido nitroso i. Dietilamina y ácid o propanoico j. Anilina y ácid o sulfúrico a 180ºC ¿Qué se entiende por alcaloid es? El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento.