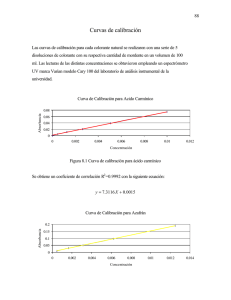
PRACTICA No.2: Ley de Beer‐Lambert II1. Curvas de Calibración y Método Estadístico de Mínimos Cuadrados. Palabras Clave: Curva de Calibración, Blanco Analítico, Método de Mínimos Cuadrados, Coeficiente de Correlación Lineal. Introducción: La gran mayoría de métodos instrumentales requieren una calibración, proceso que relaciona la señal analítica medida con la concentración del analito. Los tres métodos más frecuentemente utilizados son: la realización y el uso de una curva de calibración, el método de la adición estándar y el del patrón interno1. Para realizar el Método de la Curva de Calibración se procede a realizar una serie de soluciones de concentración conocida de analito, los cuales se introducen en el instrumento y se registra la señal instrumental. Normalmente esta señal se corrige por medio de la señal de un Blanco Analítico en el que se establece el cero de absorbancia, este blanco contiene todos los componentes de la matriz del análisis (Ejemplo: agua destilada, agua/etanol) a excepción del analito que se desea medir. El blanco es preparado en el instante en que se preparan las demás muestras a determinarse ya debe imitar las condiciones de análisis a las que se cometen éstas últimas. Fundamento: La absorción de la luz por una solución diluida, viene dada por la ley de Beer, que relaciona la concentración de la fase absorbente con la radiación. La relación entre la absorción de la luz y el camino recorrido por ésta (o sea, el espesor de la cubeta, viene dado por las leyes de Lambert. La fusión de estas leyes empíricas nos da la absorbancia total por un cuerpo, cuando interacciona con un haz monocromado. Mediante un método que obedezca la ley de Beer‐Lambert se puede realizar un análisis cualitativo de cualquier especie en solución, conociendo por supuesto la longitud de onda de máxima absorbancia del analito, esto por medio de la determinación de la absorbancia en función de soluciones de concentración conocida a través de la elaboración de una curva de calibración que las relacione de manera proporcional y linealmente, para lo que se requiere de un método estadístico. El método estadístico clásico y que se adecua a las características para la realización de dicha actividad es el de los Mínimos Cuadrados en los que se grafica la ordenada (la variable independiente) con los datos de la respuesta del aparato y la abscisa (variable dependiente) en donde se coloca la concentración o el tanto por ciento del analito, lo más habitual (y deseable) es que la gráfica se aproxime a una línea recta, sin embargo puede darse el caso de que los valores no coincidan en una recta debido a errores aleatorios del proceso de medida, el método de los mínimos cuadrados nos sirve para intentar ajustar la “mejor” línea recta que conecte los puntos. La ecuación canónica de la recta se expresa matemáticamente como: Y = mx + b y en el método de mínimos cuadrados estos valores se obtienen realizando las siguientes operaciones manuales: m = y, b = 1
Elaborada por Jorge Reyes y William Quiroa.
Donde n, indica el número de datos y ∑ las sumatorias correspondientes de los términos tabulados. Esto se simplifica con el uso de calculadoras científicas en cuyas opciones estadísticas se encuentra por lo regular la opción de calculo de regresión lineal, al igual que en programas de ordenador como Exel y otras hojas electrónicas. La viabilidad del método de curva de calibración queda establecida por el valor del cuadrado del Coeficiente de Correlación Lineal (r2), que debe ser superior a 0.998, para realizar un estudio cualitativo adecuado. Objetivos 1. Elaborar una curva de calibración para relacionar la señal analítica medida con la concentración del analito. 2. Conocer la importancia de la elaboración de un blanco para la realización de un análisis espectrofotométrico. 3. Aplicar métodos estadísticos esenciales e inherentes a los métodos instrumentales. Procedimiento: • Elaboración de una Curva de Calibración. Preparación de Soluciones de Trabajo. 1. Transvasar los 100 mL de solución coloreada de la práctica 1 (o lo que queda de las mismas) y transvasar cuantitativamente a un balón aforado de 250 mL, asignar un valor nominal de concentración arbitrario a cada una (por ejemplo: 0.05 N). [Solución Madre] 2. De esta solución madre tomar 4 alícuotas de 1, 2, 3, 5, 10 respectivamente y diluirlas en balones de 100 mL (o del volumen que asigne el instructor) con agua destilada. [Soluciones Estándar] 3. Determinar las concentraciones de estos estándares mediante la ecuación C1V1 = C2V2. Proceso de Calibración. 1. Ejecutar la calibración del Spectronic 20 empleando el procedimiento descrito en la sección de Técnicas Complementarias. Resultados. 1. Graficar respuesta del aparato (Absorbancia promedio) en eje Y, contra unidades de concentración del colorante en el eje X. 2. Ingresar los valores a una calculadora de calculo de regresión lineal para determinar la pendiente m y el intercepto en eje x: b según la ecuación canónica de la recta: y = mx + b. Recuerde borrar las lecturas estadísticas de cálculos pasados de la memoria de su calculadora antes de ingresar nuevos datos. 3. Calcular el cuadrado del coeficiente de regresión lineal [r2], el valor deberá estar comprendido entre 0.990 a 0.999. El valor no puede ser mayor a 1. Recordar que esto indica que la señal o respuesta del instrumento puede asociarse de un 99 a 100% con la concentración del analito. Análisis de Resultados. ¿La Ley de Beer‐Lambert se demuestra con el experimento que se realizó?, ¿Se logró determinar la concentración de la muestra desconocida por medio del método?, ¿Según el coeficiente de correlación determinado para el análisis cree que es confiable el valor de concentración de muestra desconocida, y si no se cree así por que razón existe cierto error? ¿Por qué es importante la ley de Beer? Los métodos instrumentales incluyen procesos estadísticos, ¿A la hora de medir el valor de la absorbancia de los estándares y la muestra desconocida cree que es suficiente llevar a cabo solo una vez la medición….? ¿Podría medirse 2 o tres veces y realizar un promedio de absorbancia para incrementar la reproducibilidad o confiabilidad del método? Cuestionario. 1. ¿Si en lugar del color asignado en el laboratorio se hubiese tenido que trabajar con una solución de otro color como un color secundario como el violeta, sería necesario hacer un barrido para determinar el máximo de absorbancia? 2. ¿Si la solución stock fuese incolora cree que se puede llevar a cabo una determinación en el Spectronic 20? 3. ¿Si la solución stock estuviera coloreada pero al mismo tiempo extremadamente turbia como afectaría esto el análisis? 4. ¿Qué es un cromóforo y como se aplica en análisis cuantitativos por la técnica espectrofotométrica? Bibliografía. 1. Skoog, D. A., Holler, F.J. & T. A. Nieman (2001) Principios de Análisis Instrumental. 5ta Edición, Editorial McGraw‐Hill, México. 1028 pp. 2. American Public Health (APH) et. al. Métodos Estándar para el Exámen de Aguas y Aguas de Desecho, Incluyendo Sedimentos Bentables y Lodos. (1963) 11 Ed. Trad. I.Q.Pedro Caballero. Editorial Interamericana S. A. México, 609 pp. Internet: Para más información puede visitar: 1. Beer’s Law. Autor: Sheffield Hallam University. Última Actualización: Desconocida. [http://teaching.shu.ac.uk/hwb/chemistry/tutorials/molspec/beers1.htm] 2. Beer‐Labmbert Calculator. Autor: Chang Bioscience. Última Actualización: 2004. [http://www.changbioscience.com/calculator/BeerLambert.html] TM
3. Use of the Spectronic 20 at a Fixed Wavelegth. Autor: Departament of Chemistry of University of Wisconsin‐Madison. Última actualización: 1997. [http://inst.sfcc.edu/chemscape/catofp/measurea/concentr/spec20/spec20b.htm] Estándar Concentración Medida de %T 1 2 3 4 5 %T Promedio Absorbancia Absorbancia Promedio