resumen
Anuncio

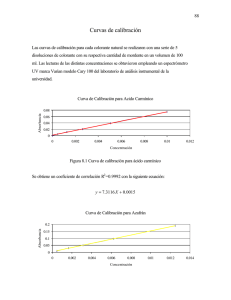
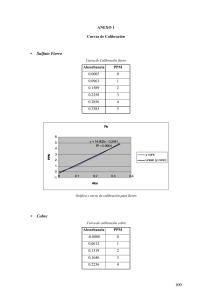
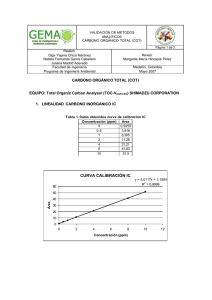
RESUMEN En diversos lugares del mundo es frecuente caracterizar grande zonas territoriales en que las aguas subterráneas pueden aparecer con cantidades relativamente elevadas de arsénico. Estas que generalmente son explotadas para satisfacer las necesidades de consumo humano, presentan el enorme riesgo que, al ser ingeridas en forma continua y por largos periodos, resulte altamene tóxico para la salud. Según investigaciones los estados con mayor afectación son Aguascalientes, Chihuahua, Durango, Coahuila y San Luis Potosí. El consumo de alimentos y agua es la principal fuente de exposición al arsénico, elemento que causa efectos adversos a la salud, la Organización Mundial de Salud (OMS, 1996) y la Agencia de Protección al Ambiente en Estados Unidos (EPA, 1998) clasifican al As inorgánico como un agente carcinógeno al ser humano. Por ello, el proyecto sobre el cual se basa este estudio tuvo como finalidad estudiar un proceso de remoción, utilizando como adsorbente un recurso mineralógico natural de la región (zeolita), en columna. Se realizo un trabajo de experimentación en un rango de pH de entre 4 y 10, manejando 9 lotes de pH/ prueba. Al analizar estos datos el % de adsorción tiende a aumentar conforme baja el pH. Los porcentajes de remoción obtenidos con los materiales seleccionados, estuvieron por arriba del 80%. 1. INTRODUCCIÓN El agua como fuente vital para todo ser vivo ha encontrado una problemática severa en su calidad a causa de la sobreexplotación de los mantos acuíferos. A causa de la alteración física y psicológica que provoca esta intoxicación, se han realizados diversos estudios para determinar la presencia (cuantitativa) y disminución del arsénico en el agua por medio de diversos procesos Fisicoquímicos. 1.1 Situación Actual. En las zonas áridas y semiáridas de México, la principal fuente de agua para diferentes usos, entre ellos el de consumo humáno, proviene de los mantos acuíferos. La extracción inmoderada de este recurso origina que se encuentren algunos metales, debido a la disolución de los minerales que están presentes en la conformación geológica. Algunos de ellos a las concentraciones presentes, llegan a ocasionar problemas de toxicidad a los seres vivos, por lo que es de importancia su remoción a través de procesos fisicoquímicos principalmente. La alúmina activada y el hidróxido férrico granular son ejemplos de adsorbentes comerciales utilizados ampliamente en los procesos de remoción. Su utilización en países en desarrollo afecta a la economía regional, debido a los altos costos que implica. Por ello se han estado desarrollando estudios de investigación para encontrar materiales que puedan ofrecerse como sustitutos de estos y otros productos comerciales. Estudios geológicos y mineralógicos realizados en Durango han detectado la presencia de minerales arcillosos con características adsorbentes, como es el caso de las zeolitas. Las zeolitas son en la actualidad materiales de enorme interés científico y tecnológico basados en aluminofosfatos y silicoaluminofosfatos que a escala industrial se utilizan en multitud de procesos como catalizadores, adsorbentes y agentes de intercambio iónico, presentando una alternativa viable a los procesos que requieren de materiales de mesoporosidad uniforme, basados en yacimientos regionales. 1.2 Arsénico El arsénico es un metaloide tóxico, pertenece al grupo 5A y tiene estados de oxidación –3, +3 y +5. El As se presenta en forma natural en rocas sedimentarias y rocas volcánicas, y en aguas geotermales. El As se presenta en la naturaleza con mayor frecuencia como sulfuro de arsénico y arsenopirita, que se encuentran como impurezas en los depósitos mineros, o como arsenato y arsenito en las aguas superficiales y subterráneas. Es usado comercialmente e industrialmente como un agente en la manufactura de transistores, láser y semiconductores, como también en la fabricación de vidrio, pigmentos, textiles, papeles, adhesivos de metal, preservantes de alimentos y madera, municiones, procesos de bronceado, plaguicidas y productos farmacéuticos. La ingestión de agua con altas concentraciones de As incrementa el riesgo de cáncer de piel y tumores en la vejiga, riñones y pulmones (Chiow y col., 1995), decoloración de la piel (Mandal y col., 1996), nausea, diarrea, decremento en la producción de células sanguíneas (Resuke y col., 1991), ritmo anormal del corazón, daño de venas y adormecimiento de las palmas de las manos y plantas de los pies (Donofrio y col., 1987). Investigaciones recientes han relacionado la exposición a As con el desarrollo de diabetes mellitus (Rahman y col., 1995). MATERIALES Y METODOS Selección del material Este punto consistió en realizar una prospección mineralógica en el Estado de Durango, a través de información geográfica y trabajo de campo, misma que se realizó por personal de investigación en el área de Geología del CIIDIR, previa a este estudio. El mineral con el cual se trabajo fue identificado previamente como zeolita el cual extraído del yacimiento localizado entre el Km. 44 - 45 de la carretera DurangoTopia, proporcionado por investigadores del CIIDIR-IPN Durango, del área de Materiales. Caracterización del mineral Para poder identificar la composición del mineral, se determinó la caracterización, misma que comprendió las siguientes actividades: Pretratamiento Consistió en el secado (a 25 ºC), una vez secado, el mineral es triturado y molido hasta que pase la malla 100, para su posterior análisis. Se pesan con precisión en la balanza analítica 20 g de cada zeolita tamizada, se guardan en bolsas y se etiquetan para poder ser identificadas. Tratamiento Químico Se realizó por el método de digestión húmeda. Consistió de la digestión de muestras con agua regia (HCl:HNO3), llevándose a digestión completa, en una parrilla de calentamiento, a temperatura controlada para evitar proyecciones de muestra. El material de laboratorio utilizado durante los análisis fue: pipetas, picetas, buretas, matraces, vasos, embudos y recipientes para guardar las muestras de agua, entre otros. Antes de utilizar cualquier material de laboratorio se lavó perfectamente, esto para poder eliminar todo residuo adherido a las paredes. Este material se lavó con agua, jabón líquido, ácido clorhídrico al 5% y agua desionizada. Digestión de muestras para la determinación de metales pesados • Se pesaron con precisión 0.5 g de cada zeolita con tamaño de partícula de 40 +20 mallas (por duplicado), cada muestra se depositó en un vaso de precipitados de 250 ml. • Se agregaron 3 ml de ácido nítrico (HNO3) y 9 ml de ácido clorhídrico (HCL) a cada vaso de precipitados, con pipetas serológicas de 5 y 10 ml. • Los vasos se taparon con vidrios de reloj. Se calentaron casi a sequedad aproximadamente a un volumen de 2 ml evitando que se proyectara la muestra. • Una vez que alcanzaron este volumen se volvió a agregar la misma cantidad de HNO3 y HCL, prolongando la digestión, evaporando casi a sequedad (aprox. 2 ml). Generalmente fue cuando adquirieron una apariencia cristalina. • Se agregaron 10 ml de HCL y 10 ml de agua desionizada. Se evaporaron hasta un volumen de 10 ml para redisolver precipitados que se formaron. • Una vez que se obtuvieron aproximadamente 10 ml de las muestras, se retiraron de la parrilla y se dejaron enfriar un poco. Se filtraron a través de papel filtro whatman No. 41 y se aforaron a 100 ml con agua desionizada. Las muestras se vaciaron en frascos de polietileno (previamente etiquetados) ambientados previamente con la misma muestra. • Las muestras estaban listas para su análisis. El contenido de metales se realizó por absorción atómica, por la técnica de flama para: Fe, Mg y Mn (debido a las características mineralógicas de las muestras), con la finalidad de conocer la presencia de estos elementos, que pueden aumentar las características de adsorción al mineral. Se incluyeron también el análisis de los elementos a remover, para observar si el material contenía de antemano presencia de ellos. El equipo utilizado para la medición de las concentraciones fue un espectrofotómetro de absorción atómica (EAA), marca Perkin Elmer modelo 2280. En la Tabla 1 se especifican las condiciones espectrales de cada elemento analizado. Tabla 1. Condiciones de Calibración para el EAA. Elemento Flama Longitud de Apertura del onda (nm) monocromador Mg 285.2 0.7 Aire-acetileno Mn 279.5 0.2 Aire-acetileno Fe 248.3 0.2 Aire-acetileno Fuente Lámpara de cátodo hueco. Lámpara de cátodo hueco. Lámpara de cátodo hueco. Determinación de Silice El procedimiento que se llevo a cabo para determinar la cantidad de sílice por fusión con hidróxido de sodio. El contenido de Sílice se calcula por diferencia de peso de la muestra original y las cenizas mediante la ecuación siguiente : ⎛ W − SiO 2 − mg ⎞ ⎟⎟ * (100 ) %SiO 2 = ⎜⎜ W muetra mg − − ⎠ ⎝ Donde el peso de la muestra se determino mediante la siguiente ecuación: ( 1) W muestra = ( W del crisol de porcelana a WCTE con muestra) - W del crisol de porcelana a WCTE (2) Determinación de Aluminio El contenido de aluminio se determina por diferencia de los porcentajes de óxidos calculados : % Al 2 O 3 = 100 − (∑ de − los% − de − Si + Mg + Ca + Mn + K + Na + Fe ) (3) PRUEBAS DE ADSORCIÒN Las pruebas de adsorciòn consistieron en realizar pruebas Batch con de relación de hidromódulo de las muestras de 1:25 (Adsorbente: Solución) Estas pruebas consistieron en la determinación de: a) Efecto del pH b) Estudio de la Cinética de Remoción c) Isotermas de Adsorción EFECTO DEL PH. El termino de pH optimo se puede definir como el punto de la escala del pH donde se realiza la mayor adsorción del material a remover sobre el adsorberte. El experimento se realizó determinando los siguientes parámetros: • Variable experimental (independiente): Ph • Variable de respuesta: Concentración y % de remoción. • Número de repeticiones: 3 • Número total de muestras: 27 • Concentración inicial: 100 ppm. • Temperatura: Ambiente (21 - 25 °C). CINÉTICA DE REMOCIÓN. Parámetros experimentales: • Variable de de respuesta: Concentración y % de remoción. • Número de pruebas: 3 • Número total de muestras: 30 y 1 para el control de pH • Concentración inicial: 100 ppm. • Temperatura: Ambiente (21 - 25 °C). • pH de remoción: 7 (±0.05). ISOTERMAS DE ADSORCIÓN Parámetros Experimentales • Variable dependiente: % de remoción. • Número de lotes: 9 • Número de pruebas: 3 • Numero total de muestras:27 • Concentraciones muestras iniciales: 1, 5, 10, 15, 20, 30, 50,75 y 100 ppm. • Hidromódulo: 1:25 (2g : 50ml) • Temperatura: Ambiente (21 - 25 °C). • Tiempo de contacto total: 48 horas. • pH de remoción: el determinado por la prueba de pH (7.0). Para obtener las concentraciónes problema de arsénico, se realizaron diluciones de estándar primario (1000 ppm) . RESULTADOS Caracterización de los materiales De acuerdo a la Ley de Beer y Lambert, la relación entre la absorbancia y la concentración se comporta de manera lineal, por lo que a partir de las lecturas de absorbancia, se puede calcular la concentración del elemento en la muestra, con la siguiente ecuación. y = a + bx Donde: y = absorbancia a = la ordenada al origen b = la pendiente x = la concentración De donde: x= (y − a) (Ec. 2) b Una vez calculada la ecuación de la línea recta, se procede a calcular la concentración del elemento en la matriz en la que está comprendido, mediante las Ecuaciones 3 y 4 (Perkin-Elmer): Para muestras sólidas se emplea la Ec. 3: μg g Donde: = (C )(V )( f .d .) W (Ec. 3) C = concentración “x” calculada en la Ec. 2 V = Volumen de aforación f.d = (Volumen de la muestra diluida en ml) / (Volumen de la alícuota diluida en ml) W = peso de la muestra Para muestras líquidas se hace uso de la Ec. 4: mg L = [C ∗ f .d ] (Ec. 4) Donde: C = concentración “x” calculada en la Ec. 2 f.d = (Volumen de la muestra diluida en ml) / (Volumen de la alícuota diluida en ml) 9.1.1 Fierro (Fe) Se prepararon los estándares de Fe. Los valores obtenidos para la elaboración de la curva de calibración, se enlistan en la Tabla 3. Tabla 3. Datos para la curva de calibración de Fe. Estándar de concentración Absorbancia (nm) (ppm) 1 0.01 2 0.02 3 0.03 4 0.036 5 0.045 6 0.053 La curva de calibración para Fe se muestra en la Figura 1. Absorbancia (nm) 0,06 0,05 0,04 0,03 0,02 y = 0.0085x + 0.0027 R2 = 0.9955 0,01 0 0 1 2 3 4 5 6 Conce ntración de Fe (ppm) Figura 1. Curva de calibración para Fe. La Tabla 4 resume los resultados del análisis de las muestras de Fe. 7 Tabla 4. Resultados de análisis de Fe. Zeolita Absorbancia (nm) X (mg/L) W (g) µg/g ZEO 1 0.09 10.2706 0.5025 2043.898 ZEO 2 0.056 6.2706 0.5023 1248.375 ZEO 3 0.042 4.6235 0.503 919.1907 ZEO 4 0.052 5.8 0.5003 1159.304 ZEO 5 0.04 4.3882 0.5036 871.3732 9.1.2 Magnesio (Mg) Se prepararon los estándares de Mg. Los valores obtenidos para la elaboración de la curva de calibración, se enlistan en la Tabla 5. Tabla 5. Datos para la curva de calibración de Mg. Estándar de concentración (ppm) Absorbancia (nm) 0.1 0.077 0.2 0.14 0.3 0.2 0.5 0.37 La curva de calibración para Mg se muestra en la Figura 2. Absorbancia (nm) 0,4 0,3 0,2 y = 0.7346x - 0.0053 R2 = 0.9922 0,1 0 0 0,1 0,2 0,3 0,4 0,5 0,6 Conce ntración de Mg (ppm) Figura 2. Curva de calibración para Mg. La Tabla 6 resume los resultados del análisis de las muestras de Mg. Tabla 6. Resultados de análisis de Mg. Zeolita Absorbancia (nm) X (mg/L) W (g) µg/g ZEO 1 0.088 0.1270 0.5025 25.2752 ZEO 2 0.126 0.1787 0.5023 35.5837 ZEO 3 0.113 0.1610 0.503 35.0159 ZEO 4 0.12 0.1706 0.5003 34.0933 ZEO 5 0.074 0.1079 0.5036 21.4356 9.1.3 Manganeso (Mn) Se prepararon los estándares de Mn. Los valores obtenidos para la elaboración de la curva de calibración, se enlistan en la Tabla 7. Tabla 7. Datos para la curva de calibración de Mn. Estándar de concentración (ppm) Absorbancia (nm) 0.5 0.034 1 0.063 2 0.138 3 0.188 4 0.258 La curva de calibración para Mn se muestra la Figura 3. Absorbancia (nm) 0,3 0,2 0,1 y = 0.0636x + 0.0028 R2 = 0.9963 0 0 1 2 3 4 Conce ntración de Mn (ppm) Fig. 3 Curva de calibración para Mn. La tabla 8 muestra los resultados del análisis de las muestras de Mn. 5 Tabla 8. Resultados de análisis de Mn. Absorbancia Zeolita (nm) X (mg/L) W (g) µg/g ZEO 1 0.221 3.4308 0.5025 682.7498 ZEO 2 0.123 1.8899 0.5023 376.2566 ZEO 3 0.078 1.1824 0.503 235.0676 ZEO 4 0.104 1.5912 0.5003 318.0482 ZEO 5 0.089 1.3553 0.5036 269.1314 9.2 Pruebas de Adsorción en columna 9.2.1Arsénico (As) Se prepararon los estándares de As. Los valores obtenidos para la elaboración de la curva de calibración, se enlistan en la Tabla 9. Tabla 9. Datos para la curva de calibración de As. Estándar de concentración (ppb) Absorbancia (nm) 20 0.014 40 0.017 60 0.028 80 0.034 100 0.039 La curva de calibración para As se muestra en la Figura 4. Absorbancia (nm) 0,05 0,04 0,03 0,02 y = 0.0003x + 0.0082 R2 = 0.9946 0,01 0 0 20 40 60 80 100 120 Concentración de As (ppb) Fig. 4 Curva de calibración para As. Tabla 10. Resultados de remoción de As. Zeolita μg/L % Remoción MZ 1 19.23 80.77 MZ 2 14.57 85.43 Figura . Curva de Calibración EFECTO DEL pH Tabla 3. Datos de la grafica para el % de Adsorción en la prueba 1 pH 4.02 5.02 6.01 6.48 7.00 7.51 8.00 9.00 10.01 % Adsorción 86.964 83.107 82.294 81.685 81.888 78.437 79.452 80.264 79.452 Efecto del pH (Prueba 1) 82.5 %Adsorbancia 82.0 81.5 81.0 80.5 80.0 79.5 79.0 78.5 78.0 6.0 6.5 7.0 7.5 8.0 pH Figura . Grafica Efecto del pH sobre el % de adsorbancia. 8.5 Prueba # 2 Tabla . Datos de experimentación de la segunda prueba realizada para la obtención del % de adsorción a pH diferidos. pH 4.02 5.02 6.01 6.48 7.00 7.51 8.00 9.00 10.01 Abs 0.200 0.188 0.190 0.180 0.177 0.166 0.174 0.172 0.167 Conc. CC 0.336 0.397 0.387 0.438 0.453 0.509 0.468 0.478 0.504 mg/L F13.442 15.878 15.472 17.503 18.112 20.345 18.721 19.127 20.142 % Adsorción 86.558 84.122 84.528 82.497 81.888 79.655 81.279 80.873 79.858 Tabla. Datos de la grafica para el % de Adsorción en la prueba 2 pH 4.02 5.02 6.01 6.48 7.00 7.51 8.00 9.00 10.01 % Adsorción 86.558 84.122 84.528 82.497 81.888 79.655 81.279 80.873 79.858 Efecto del Ph (Prueba 2) 83.0 % Adsorbancia 82.5 82.0 81.5 81.0 80.5 80.0 79.5 79.0 6.0 6.5 7.0 7.5 8.0 8.5 pH Figura . Grafica Efecto del pH sobre el % de adsorbancia IMPACTO Actualmente el problema de contaminación del agua por la presencia de metales pesados y arsénico en países en vías de desarrollo no se ha solucionado, ya que los procesos convencionales para la remoción de estos contaminantes involucran tecnologías y materiales sumamente caros. Este estudio presenta la alternativa de utilizar para la remoción de arsénico un material regional que actualmente no se le ha encontrado un aprovechamiento integral, como es el caso de las zeolitas.