Propiedades coligativas
Anuncio

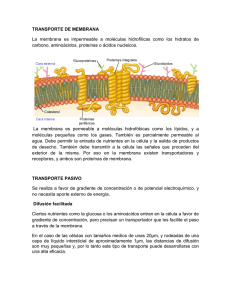
Liceo Polivalente “Juan Antonio Ríos“ Quinta Normal GUIA DE APRENDIZAJE Nº 7 2º MEDIO PROPIEDADES COLIGATIVAS Unidad temática: Propiedades Coligativas Objetivo General: Formación y desarrollo del interés y capacidad de conocer la realidad y utilizar el conocimiento y la información. Contenidos: Conceptos generales de las propiedades coligativas. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha: Instrucciones: A continuación encontrarás una serie de actividades que deberás desarrollar a fin de prepararte para rendir Examen Final. PROPIEDADES COLIGATIVAS Los líquidos tienen propiedades físicas características como: densidad, ebullición, congelación y evaporación, viscosidad, capacidad de conducir corriente, etc. Para estas propiedades cada líquido presenta valores característicos constantes. Cuando un soluto y un disolvente dan origen a una disolución, la presencia del soluto determina la modificación de estas propiedades con relación a las propiedades del solvente puro. Propiedades de las disoluciones: 1. Propiedades constitutivas: aquellas que dependan de la naturaleza de las partículas disueltas. Ej. viscosidad, densidad, conductividad eléctrica, etc. 2. Propiedades coligativas: dependen del número de partículas disueltas en una cantidad fija de disolvente y no de la naturaleza de estas partículas. Ej. Descenso de la presión de vapor, aumento del punto de ebullición, disminución del punto de congelación, presión osmótica. Utilidades de las propiedades coligativas: a. separar los componentes de una solución por destilación fraccionada. b. formular y crear mezclas frigoríficas y anticongelantes. c. determinar masas molares de solutos desconocidos. d. formular sueros fisiológicos para animales. e. formular caldos de cultivos para microorganismos. f. formular soluciones de nutrientes especiales para regadíos de vegetales. Las disoluciones deben ser relativamente diluidas (menores a 0,2 M), en donde las fuerzas de atracción intermolecular entre soluto y solvente serán mínimas. PRESIÓN DE VAPOR Evaporación es la tendencia de las partículas de la superficie del liquido, a salir de la fase liquida en forma de vapor. Es importante saber que no todas las partículas de liquido tienen la misma energía cinética (no todas se mueven a la misma velocidad). Las partículas con mayor energía en la superficie pueden escaparse a la fase gaseosa. Las moléculas de la fase gaseosa que chocan contra la fase liquida ejercen una fuerza contra la superficie del líquido, a la que se le denomina presión de vapor, cuando ambas fases están en equilibrio dinámico. Esta presión de vapor depende de la temperatura y de la naturaleza del líquido. Conclusiones: 1. Para un mismo líquido, la presión de vapor aumenta a medida que aumenta la temperatura 2. Líquidos diferentes a la misma temperatura presentan presiones de vapor diferentes. El efecto de la presión se observa muy bien al destapar una bebida gaseosa . Estando la botella cerrada no se aprecian las burbujas, pero después de abrirla aparecen las burbujas por todo el líquido lo que indica que el gas no pude permanecer disuelto en esas condiciones y escapa a la atmósfera. PROPIEDAD COLIGATIVA 1: DESCENSO DE LA PRESIÓN DE VAPOR Los líquidos no volátiles presentan una gran interacción entre soluto y solvente, por lo tanto su presión de vapor es pequeña, mientras que los líquidos volátiles tienen interacciones moleculares más débiles, lo que aumenta la presión de vapor. Si el soluto que se agrega es no volátil, se producirá un descenso de la presión de vapor, ya que este reduce la capacidad del disolvente a pasar de la fase líquida a la fase vapor. El grado en que un soluto no volátil disminuye la presión de vapor es proporcional a su concentración. Ejemplo La mayoría de los pegamentos de contacto son productos que pueden ser tóxicos por inhalación. La toxicidad se debe a los solventes que contienen. Estas sustancias evitan que el pegamento se seque en el interior del recipiente pero, cuando el pegamento se extiende sobre la superficie a pegar , el disolvente se evapora rápidamente dejando una capa de pegamento seco. Por lo tanto esta sustancia tiene una alta presión de vapor. PROPIEDAD COLIGATIVA 2: AUMENTO PUNTO DE EBULLICIÓN Un disolvente tiene menor numero de partículas que se convierten en gas por la acción de las moléculas del soluto en la superficie. Esto provoca el descenso del punto de ebullición, pues la presión de vapor se igualará a la presión atmosférica a mayor temperatura. Ejemplo El punto de ebullición del agua temperatura a la cual se la presión de vapor se iguala a la presión atmosférica. PROPIEDAD COLIGATIVA 3: DESCENSO PUNTO DE CONGELACIÓN En una solución, la solidificación del solvente se producirá cuando éste rompa sus interacciones con el soluto y se enlace nuevamente como si estuviera puro. Para ello la temperatura debe bajar más que el punto en el cual el disolvente se congelaría puro, por lo tanto, el punto de congelación es siempre más bajo que el disolvente puro y directamente proporcional a la concentración del soluto. Ejemplo El anticongelante en los vehículos este es, el etilenglicol (CH2OHCH2OH) que disminuye el punto de congelación del agua en el radiador del automóvil y también eleva el punto de ebullición. PROPIEDAD COLIGATIVA 4: PRESIÓN OSMÓTICA Al poner en contacto dos disoluciones de diferente concentración a través de una membrana semipermeable se producirá el paso del disolvente desde la disolución más diluida hacia la más concentrada, fenómeno conocido como ósmosis. La Presión osmótica es aquella que establece un equilibrio dinámico entre el paso del disolvente desde la disolución diluida hacia la mas concentrada y viceversa. Ejemplos 1. Entre las aplicaciones que involucran fenómenos relacionados con las propiedades coligativas, como la presión osmótica, ,en la deshidratación de alimentos. 2. la adición de azúcar a las mermeladas también tiene relación directa con fenómenos osmóticos que provocan la deshidratación de microorganismos y hongos que de otro modo producirían su descomposición. En general, el uso de sal y azúcar para la conservación de alimentos se basa en los efectos osmóticos sobre microorganismos, larvas de insectos, etc. Evaluación 1.- ¿Explica brevemente que son las propiedades coligativas? 2.- ¿Qué relación tiene las propiedades coligativas con el uso que se da a determinadas soluciones, como por ejemplo el líquido anticongelante de los automóviles? 3.- ¿Qué importancia tiene la presión osmótica en la conservación de los alimentos?