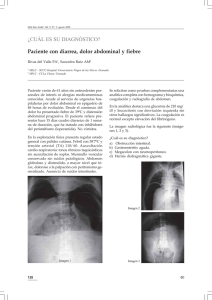
ACOMODACIÓN ABDOMINAL
Anuncio

ACOMODACIÓN ABDOMINAL: Fisiopatología de la Distensión Abdominal. TESIS DOCTORAL presentada por Albert Villoria Ferrer para optar al grado de Doctor en Medicina. Programa de Doctorado en Medicina Barcelona, Abril de 2011 Departamento de Medicina Universitat Autònoma de Barcelona Tesis Doctoral dirigida por Fernando Azpiroz y Juan-R Malagelada Universitat Autònoma de Barcelona FERNANDO AZPIROZ VIDAUR, Profesor titular del Departamento de Medicina de la Universitat Autònoma de Barcelona HAGO CONSTAR Que la memoria titulada “Acomodación abdominal: Fisiopatología de la distensión abdominal” presentada por ALBERT VILLORIA FERRER para optar al grado de Doctor se ha realizado bajo mi dirección, y al considerarla concluida, autorizo su presentación para ser juzgada por el Tribunal correspondiente. Y para que conste a los efectos firmo la presente. Barcelona, enero de 2011 Dr. Fernando Azpiroz Vidaur Dr.Juan-R Malagelada Benaprés Director de la tesis Co-director de la tesis A mis padres Rafael y Montserrat. A mi esposa Pilar, y a mis tres hijos Nicolás, Cristina y Carlota, por su cariño, comprensión y constante apoyo durante la realización de este proyecto. Agradecimientos En primer lugar quiero expresar mi gratitud al Doctor Fernando Azpiroz Vidaur, codirector de la presente tesis y Jefe de la Unidad de Pruebas Funcionales Digestivas del Hospital Vall d’Hebrón, por haberme transmitido su pasión por la investigación clínica. Su implicación en el proyecto, plena dedicación y espíritu crítico han sido esenciales para completar los trabajos que forman esta tesis. Al profesor Juan-Ramón Malagelada Benaprés, codirector de la presente tesis, por haberme dado la oportunidad de trabajar en un ambiente de excelencia científica y por su valiosa aportación en los diferentes estudios. También querría agradecer la inestimable ayuda de Alfredo Soldevilla, Profesor del Departamento de Física de la Universidad Politécnica de Catalunya, por ayudarme a entender el apasionante mundo de la electromiografía. Sin su colaboración desinteresada, no se habría podido desarrollar la tecnología implementada en los estudios que conforman esta tesis. Gracias a todos los coautores de los trabajos que componen esta tesis, y en especial al Doctor Fabrizio Tremolaterra que fue el precursor de los estudios, ya que sin su colaboración no habría sido posible el desarrollo y publicación de los trabajos de esta tesis. Deseo dejar constancia de mi gratitud, a las enfermeras de la Unidad de Pruebas Funcionales Digestivas del Hospital Vall d’Hebrón, Anna Aparici, Maite Casaus y Purificación Rodriguez, por su generosa ayuda y comprensión durante realización de los estudios. A mis compañeras de la Unidad de Pruebas Funcionales Digestivas del Hospital Vall d’Hebrón, Doctora Fosca de Iorio y Maria Maluenda, por su paciencia e inestimable ayuda y amistad en los momentos más difíciles. A mis compañeros de residencia del Servicio de Digestivo del Hospital Vall d’Hebrón, y en especial a la Doctora Carmen Alonso, Doctora Beatriz Lobo y Doctora Carolina Malagelada por su amistad, su apoyo y los buenos momentos compartidos. A mis compañeros del Servicio de Digestivo del Hospital de Sabadell y en especial al Doctor Rafael Campo y al Doctor Xavier Calvet, por haberme animado a finalizar los trabajos que conforman esta tesis. ÍNDICE Índice 1. INTRODUCCIÓN 1.1.EPIDEMIOLOGÍA 3 1.2. PRESENTACIÓN CLÍNICA 4 1.2.1 Condiciones clínicas asociadas a distensión abdominal 5 1.2.1.1 Estreñimiento 6 1.2.1.2 Diarrea 6 1.2.1.3 Síndrome de intestino irritable 7 1.2.1.4 Dispepsia 7 1.2.1.5 Desordenes alimentarios y obesidad 8 1.3 FISIOPATOLOGÍA DE LA DISTENSIÓN 9 1.3.1. Distensión abdominal objetiva 10 1.3.2. Alteración muscular de las paredes abdominales 12 1.3.3. Alteración de la percepción abdominal 13 1.3.4. Contenido intraabdominal 15 1.4. GAS INTESTINAL y DISTENSIÓN ABDOMINAL 16 1.4.1. Fisiología del gas intestinal 16 1.4.2. Producción de gas intestinal 21 1.4.3. Volumen de gas intraluminal 23 1.4.4. Alteración del manejo de gas intestinal 24 1.4.5. Mecanismos de alteración del gas intestinal 27 1.4.6. Control reflejo del tránsito intestinal de gas 28 1.4.7. Área del intestino responsable de la distensión abdominal 29 1.4.8. Es el gas el elemento responsable de la distensión? 31 Índice 1.5. ANATOMÍA DEL DIAFRAGMA 33 1.5.1. Anatomía descriptiva 33 1.5.2. Histología 35 1.5.2.1 Fibras musculares 35 1.5.2.2. Receptores propioceptivos 36 1.5.3. Anatomía Funcional 37 1.5.3.1. Actividad muscular 37 1.5.3.2. Mecánica muscular 38 1.6. ANATOMÍA DE LA PARED MUSCULAR ANTERIOR 1.6.1. Anatomía descriptiva 40 40 1.6.1.1 Recto anterior 40 1.6.1.2 Oblicuo externo 40 1.6.1.3 Oblicuo interno 42 1.6.1.4 Transverso del abdomen 43 1.6.2. Anatomía funcional 44 1.6.2.1 Recto anterior 44 1.6.2.2 Oblicuo externo 44 1.6.2.3 Oblicuo interno 44 1.6.2.4 Transverso del abdomen 45 1.6.3. Histología 45 1.7. ELECTROMIOGRAFÍA 47 1.7.1 Definición 47 1.7.2. Electromiografía de superficie abdominal 47 1.7.3. Electromiografía de superficie diafragmática 49 Índice 1.8 HIPÓTESIS 2. OBJETIVOS 53 55 3. PUBLICACIONES - Publicación 1 57 Impaired Viscerosomatic Reflexes and Abdominal-Wall Dystony Associated With Bloating. Publicado en Gastroenterology 2006; 130: 1062–1068. - Publicación 2 59 Abdominal Accommodation: A Coordinated Adaptation of the Abdominal Walls to Its Content. Publicado en Am J Gastroenterol 2008; 103: 2807–2815. - Publicación 3 61 Abdomino-phrenic dyssynergia in patients with abdominal bloating and distensión. Am J Gastroenterol 2010. En Prensa. 4. DISCUSIÓN. 64 5. CONCULSIONES 72 6. BIBLIOGRAFÍA 74 Índice 1.INTRODUCCIÓN Introducción La distensión abdominal es un término que puede englobar dos significados diferentes, en función de si es una percepción únicamente subjetiva o si se acompaña de un incremento objetivo del perímetro abdominal. Aunque son entidades parecidas, no comparten los mismos mecanismos fisiopatológicos y es por ello que se estudian de modo separado. Esta tesis esta centrada fundamentalmente sobre la distensión abdominal objetiva. En la actual clasificación de los trastornos funcionales digestivos (clasificación de Roma III), la distensión abdominal forma parte de los dos trastornos más importantes, la dispepsia funcional (DF) y el síndrome de intestino irritable (SII). Por el contrario, existe un subgrupo de pacientes que no cumplen los criterios diagnósticos de las patologías anteriormente descritas y solo manifiestan distensión abdominal, por lo que se clasifican de forma independiente como pacientes con distensión abdominal funcional 1. En los últimos años varios estudios clínicos han descrito la distensión abdominal como un problema clínico importante y con importantes repercusiones económicas derivadas de un aumento en el número de consultas y exploraciones médicas 2-4 .A pesar de ello la distensión abdominal ha sido una patología escasamente estudiada por la comunidad científica y por tanto, ni su fisiopatología ni un tratamiento eficaz, han quedado suficientemente definidos hasta la fecha. -2- Introducción 1.1. EPIDEMIOLOGÍA Varios estudios clínicos han demostrado que la distensión abdominal es un problema con una alta prevalencia en nuestro medio, tanto en sujetos de la población general, como en pacientes afectos de trastornos funcionales digestivos. Estudios poblacionales han descrito que la distensión abdominal se presenta entre un 16 a un 30% de la población 5, 6 . En un estudio norte-Americano realizado en el estado de Minnesota, el 16% de la población adulta a la que se consultó mediante una encuesta por correo, refirió presentar distensión abdominal durante el mes previo a la misma. Asimismo, en más del 65% de los participantes, la distensión había sido moderada o severa y característicamente con una frecuencia superior entre mujeres y hombres (19% vs. 10%) 7. Este dato confirma otros estudios en los que se describe que la distensión abdominal tiene una prevalencia superior en las mujeres (2:1) respecto de los hombres 8-10. La distensión abdominal es uno de los síntomas más frecuentes (>90%) molestos 12, 13 9, 11 y más referidos por los pacientes con SII. Aproximadamente un 75% de los pacientes atendidos en un centro de referencia en Estados Unidos describieron la distensión abdominal como el síntoma más severo respecto al resto de síntomas, mientras que el dolor abdominal solo fue descrito en un 25% de los pacientes como el síntoma más severo. Cabe destacar que aquellos pacientes afectos de SII con predominio de estreñimiento, presentan más frecuentemente distensión abdominal acompañada de incremento en el perímetro abdominal, mientras que aquellos con predominio de diarrea, refieren manifestar predominantemente solo sensación subjetiva de distensión 9, 13, 14 . Finalmente, la distensión abdominal no solo se ha descrito por los pacientes como uno de los síntomas más molestos sino como un síntoma -3- Introducción persistente a lo largo del día 15 . Es por ello que, si añadimos que este síntoma modifica hábitos de vida de los pacientes que lo padecen (por ejemplo, necesidad de vestir ropa ancha que se amolde a cambios en el perímetro abdominal, disminución de la actividad física o en los hábitos dietéticos) no es de extrañar que varios estudios valoren la distensión abdominal como un factor influyente en la disminución de su calidad de vida 5, 16. 1.2. PRESENTACIÓN CLÍNICA. La distensión abdominal presenta unas características clínicas fácilmente reconocibles, pero debido a la escasez de estudios sistemáticos, los datos disponibles hasta la actualidad se basan exclusivamente en la impresión subjetiva. La distensión abdominal presenta varias características fundamentales: a) Relación con la ingesta Una gran parte de los pacientes con distensión abdominal, alrededor del 82%, describen que esta se desarrolla o empeora en el período post-prandial inmediato 17, incluso muchos de ellos no pueden terminar la comida a causa de la distensión. Este efecto suele ser más relevante tras la ingesta de una comida copiosa y con alto contenido en grasa, pero en ocasiones la ingesta de pequeñas cantidades de alimento o incluso agua han desencadenando los síntomas. Finalmente, alimentos con alto contenido en fibra o suplementados con fibra, también se han descrito como factores que pueden empeorar la distensión abdominal 18. -4- Introducción b) Variación circadiana Es una característica típica de la distensión abdominal 9, 17, 19 . En la mayoría de pacientes la distensión abdominal se desarrolla progresivamente durante el día y tiende a disminuir o desaparecer tras el descanso nocturno. Este tipo de patrón debe tener una base fisiológica, ya que gracias a la medición continua del perímetro abdominal mediante la pletismografía de inductancia en sujetos sanos, se ha observado de forma objetiva un incremento de la cintura durante el día con una reducción tras el descanso nocturno 19, 20. c) Localización La distensión se puede localizar en la parte alta (asociada más frecuentemente con síntomas dispépticos) o en la parte baja del abdomen (como parte del SII), aunque existe un gran solapamiento entre ambas, presentando distensión de todo el abdomen. La distensión abdominal suele ser más prominente en bipedestación que en supino, empeora con el estrés y mejora tras la relajación. d) Ciclo menstrual Aunque la mujeres sanas refieren presentar distensión abdominal durante el período menstrual, en el caso de las pacientes con SII este síntoma se encuentra muy pronunciado 9, 21 . Este hecho sugirió la posibilidad de relacionar la distensión abdominal con factores neurohormonales, aunque no se han encontrado diferencias en la frecuencia de distensión entre mujeres pre y post-menopáusicas, ni se han descrito diferencias entre ambas fases del ciclo menstrual 9. 1.2.1. Condiciones clínicas asociadas a distensión abdominal La distensión abdominal tiene varias formas de presentación, siendo en algunas entidades clínicas el síntoma predominante. -5- Introducción 1.2.1.1 Estreñimiento Una considerable proporción de pacientes con distensión abdominal presentan asociada una alteración del hábito intestinal. La incidencia de distensión abdominal en pacientes con estreñimiento es muy alta, siendo en algunos estudios de hasta el 80% 22 . Experimentalmente, cuando se indujo estreñimiento farmacológico con loperamida en 12 sujetos sanos, presentaron un aumento en la sensación de distensión abdominal, llegando al mismo nivel que los pacientes estreñidos 23 . Además, el efecto laxante en 24 pacientes con estreñimiento alivió sustancialmente la prevalencia y la severidad de su distensión 23 . A diferencia de estos pacientes con estreñimiento sintomático, en el caso de los pacientes con encopresis, la retención fecal es bien tolerada incluso durante períodos de tiempo prolongados sin ningún síntoma. Es plausible que los pacientes con estreñimiento y síntomas abdominales significativos incluida la distensión abdominal, tienen un SII con poca tolerancia a la sobrecarga. La mayoría de estos pacientes con SII con predomino de estreñimiento y sensación subjetiva de distensión también presentan distensión abdominal objetiva 9, 19. 1.2.1.2 Diarrea En algunos pacientes, la distensión abdominal se encuentra asociada a heces blandas, aumento de la frecuencia deposicional o urgencia. Este subgrupo correspondería al SII con predominio de diarrea y en aproximadamente 1/3 de ellos la distensión no esta asociada con un verdadero incremento del perímetro abdominal 9 . La distensión abdominal es una característica clínica muy común en otras alteraciones orgánicas como la diarrea infecciosa o la diarrea malabsortiva. Por ello, -6- Introducción la pérdida de peso o la presencia de déficits nutricionales deben alertar al médico de la presencia de una posible malabsorción o maldigestión. 1.2.1.3 Síndrome de intestino irritable Una serie de estudios en los últimos años ha desvelado la importancia de la distensión abdominal en el espectro clínico del SII 9, 12, 22. La distensión abdominal es el síntoma más frecuentemente descrito en los pacientes con SII (76%) y además un 60% de ellos declaran que es el síntoma más molesto 12 . La distensión abdominal produce una disminución de calidad de vida que es incluso mayor que la producida por el dolor abdominal 24, 25 . Desde una perspectiva diferente, se podría afirmar que los pacientes con distensión abdominal pueden cumplir criterios de SII. Por tanto este síntoma formaría parte del SII, que por definición se ha de acompañar de alteración del hábito deposicional. 1.2.1.4 Dispepsia Funcional La distensión abdominal es un síntoma que se encuentra integrado entre los síntomas de la dispepsia funcional y además, una gran proporción de pacientes con dispepsia (54-57%) describen la distensión como un síntoma frecuente. Un estudio describió la presencia de distensión abdominal objetiva en un 36% de pacientes dispépticos en comparación con un 7% de sujetos sanos 11. La localización de la distensión en la dispepsia suele ser en la parte alta del abdomen, pero debido al frecuente solapamiento de esta entidad con el SII también puede describirse de una forma más difusa. Es característico que la distensión en la dispepsia se precipita con las comidas 26 y es por ello que en algunas ocasiones los pacientes restringen la ingesta para evitar la distensión. En cualquier caso, no queda -7- Introducción claro si este grupo de pacientes constituye un grupo diferenciado o si solo utilizan el término distensión abdominal para describir una sensación imprecisa de tensión, presión, pesadez abdominal o cualquier término parecido. 1.2.1.5 Desordenes alimentarios y obesidad La distensión abdominal es un síntoma frecuente de los trastornos alimentarios, como la anorexia nerviosa 27 o la bulimia 28, 29 , habiéndose descrito una relación con el índice de masa corporal (IMC) y la obesidad 30, 31. Aunque los sujetos sanos pueden presentar distensión abdominal ocasionalmente tras una trasgresión dietética o en asociación con la ingesta de alimentos fermentables, esta tiende a ser de corta duración. La distensión secundaria a un motivo conocido raramente es una causa de queja por el paciente, ya que el individuo entiende que ésta viene dada por el exceso de comida y tendrá una resolución espontánea. -8- Introducción 1.3. FISIOPATOLOGÍA DE LA DISTENSIÓN. Los factores relacionados con la fisiopatología de la distensión abdominal son: sensación subjetiva, cambios objetivos en el perímetro abdominal, volumen de la cavidad intraabdominal y la actividad muscular de las paredes abdominales, pudiendo jugar un papel independiente o estar interrelacionados entre ellos. La sensación subjetiva de distensión abdominal se puede producir por cualquiera de los otros 3 factores o por una alteración en la percepción. La distensión abdominal objetiva, ya sea acompañada o no de sensación de distensión, puede deberse a cambios en la actividad de la pared abdominal debido a una redistribución del contenido intrabdominal o a un aumento real del volumen abdominal. El contenido intrabdominal puede aumentar por un aumento del volumen intestinal (por ejemplo, por contenido líquido/sólido o gas) o por un aumento del volumen extraluminal (incremento del líquido tisular, edema o congestión vascular). Los cambios de actividad muscular en la pared abdominal pueden incrementar la tensión muscular abdominal y ser interpretado subjetivamente como sensación de distensión, pero también pueden producir una distensión abdominal objetiva al producirse una redistribución del contenido intraabdominal, incluso en ausencia de cambios de volumen. Al probablemente igual que representa muchos una otros condición síntomas, la heterogénea, distensión producida abdominal por una combinación de mecanismos fisiopatológicos que difieren entre diferentes pacientes. Revisaremos la fisiopatología de la distensión analizando su relación con: 1) la distensión abdominal objetiva, 2) alteración muscular de las paredes abdominales, 3) -9- Introducción alteración en la percepción y finalmente, 4) el contenido intraabdominal. Este último ha sido el más estudiado, particularmente el papel del gas intestinal. 1.3.1. Distensión abdominal objetiva. Muchos pacientes declaran que de forma episódica presentan distensión del abdomen, pudiendo ser objetivada por otras personas. A pesar de ello, el médico no ha tenido forma de confirmarlo fehacientemente. Experimentalmente se ha demostrado que una cinta métrica adherida a un cinturón colocado en el abdomen, es capaz de medir incluso pequeños cambios de perímetro abdominal tras la infusión de gas intestinal 32-34 . Sin embargo, la colocación de dicha cinta requiere la inmovilización del paciente durante todo el procedimiento y cada individuo sirve como su propio control. Medidas realizadas en el contexto de estudios clínicos de investigación no han dado lugar a resultados uniformes. En un estudio multicéntrico que evaluó pacientes con trastornos funcionales digestivos (SII y DF), no fueron capaces de detectar diferencias de perímetro abdominal entre aquellos pacientes que referían presentar distensión abdominal objetiva y aquellos que no 35 . El equipo del Dr. Whorwell demostró que la utilización de una cinta métrica en mujeres con SII detectaba incrementos significativos del perímetro abdominal a lo largo del día con respecto de un grupo de sujetos sanos. Además, demostró un aumento en la distancia antero-posterior del abdomen, medidos por tomografía computerizada, en estos mismos sujetos con distensión abdominal 17 . Otro estudio, describió que en los pacientes con distensión abdominal, los episodios de distensión abdominal se acompañaban exclusivamente de un aumento del perímetro abdominal y no de otros factores (por ejemplo, el peso corporal). Sin embargo, en este estudio, las medidas fueron realizadas por los propios pacientes y por ello la variabilidad de las - 10 - Introducción diferencias descritas fue muy grande (cambios de 5,3±3,0 cm de perímetro y 1,0±0,9 kg de peso) 36. Recientemente, se ha desarrollado un mecanismo automático para medir ambulatoriamente cambios del perímetro abdominal durante 24 horas - la pletismografía de inductancia 20 . La inductancia es una propiedad de un circuito eléctrico y se define como la oposición de un elemento conductor (una bobina) a cambios en la corriente que circula a través de ella. Basada en esta propiedad, la pletismografía de inductancia consiste en un aparato de medida constituido por una banda de tela elástica (aproximadamente de 8.5 cm de ancho) que incorpora un cable formando una espiral que permite su expansión. Al producirse la expansión de la banda, se modifica la geometría de la bobina, lo que comporta un cambio en el valor del área y así, un cambio en el valor de la inductancia. Considerando fijos el resto de parámetros de la inductancia, la variación de ésta, es proporcional a la variación del área. Utilizando esta técnica, se ha demostrado que las variaciones clínicas en el perímetro abdominal son objetivas y significativamente mayores en pacientes con SII y distensión abdominal, que en los sujetos sanos 19 . Sin embargo la relación entre la distensión abdominal y la sensación de distensión fue variable, reflejando solo una buena correlación de la distensión abdominal en los pacientes con SII de predominio estreñimiento y no en los de predominio de diarrea 19 . Finalmente, existe una serie de pacientes con criterios de SII y sensación de distensión continua, que presentan un abdomen prominente y globuloso. En este sentido, un estudio prospectivo describió que los pacientes con distensión abdominal tenían predisposición a presentar recientemente una mayor ganancia ponderal que los sujetos sanos, a pesar de presentar valores similares de edad y IMC (índice de masa corporal) entre ambos grupos 36 . Por tanto, se especuló que la grasa en el - 11 - Introducción abdomen podía favorecer la sensación o la toma de conciencia de la distensión como síntoma. 1.3.2. Alteración de la actividad muscular de las paredes abdominales. La configuración del abdomen viene determinada por la disposición de las paredes de la cavidad abdominal. Existen dos paredes con escasa movilidad, que se corresponden a nivel posterior, con la columna vertebral y a nivel inferior con la pelvis. Por el contrario, existen dos paredes móviles, a nivel craneal, el diafragma y a nivel anterior, la musculatura antero-lateral del abdomen. Una alteración de la configuración de las paredes abdominales puede producir distensión abdominal objetiva incluso sin incrementos del volumen intraabdominal. Además, las paredes musculares pueden enviar señales que induzcan sensación subjetiva de distensión abdominal, incluso en ausencia de distensión abdominal y esto podría explicar aquellos casos de distensión abdominal imaginaria. En un artículo clásico de Alvarez y colaboradores 37, se describe detalladamente una serie de pacientes en los que la protusión abdominal se debe en su opinión, a una alteración de la actividad muscular de la pared abdominal. Esta hipótesis podría sustentarse por el hecho de que habitualmente la distensión abdominal tiene un inicio rápido 17, 37 y puede resolverse instantáneamente mientras el paciente se relaja, se le administra anestesia 37 o se le induce hipnosis. Además la distensión abdominal puede afectar selectivamente a una parte del abdomen, superior o inferior, y la rápida resolución de esta no se ve acompañada de una evacuación de gas 37 . En un estudio realizado por Maxton y colaboradores 17 , se evaluó la posición del diafragma o la influencia de la lordosis lumbar en la distensión abdominal - 12 - Introducción mediante tomografía axial computerizada (TAC) abdominal y no se obtuvieron resultados concluyentes. Sullivan y colaboradores 36 , describieron que los pacientes con distensión abdominal presentan debilidad de la musculatura de la pared anterior del abdomen, medido mediante la capacidad de realizar flexiones, respecto de los sujetos sanos. Bajo dicha premisa, McManis y colaboradores 38 , estudiaron la actividad muscular, registrada mediante electromiografía de superficie, entre sujetos afectos de SII con distensión abdominal y sujetos sanos. Los pacientes y los sujetos sanos incrementaron la actividad muscular de la pared abdominal inferior de igual manera, al pasar de la posición de supino a bipedestación, demostrando la ausencia de debilidad muscular en los pacientes con distensión 38. 1.3.3. Alteración en la percepción abdominal. La percepción anormal, ya sea relacionada por una interpretación cognitiva, por sensaciones provenientes de la pared abdominal o por sensibilidad visceral, probablemente representa un factor clave en la sensación de distensión abdominal. Algunos pacientes con un abdomen normal o simplemente con exceso de grasa, pueden creer incluso hasta la obsesión, que su abdomen esta distendido. Un ejemplo de ello viene reflejado en un artículo de Suarez y colaboradores 39, en el que demostraron que los pacientes que se creían gravemente intolerantes a la lactosa y manifestaban distensión abdominal con la toma de cantidades pequeñas de ésta, cuando se estudiaron de forma ciega, no mostraron síntomas al consumir leche, tuviera o no lactosa. Por tanto, la evidencia experimental demostró que los síntomas habituales relacionados con la toma de leche en estos pacientes tenía un origen imaginario. - 13 - Introducción En otras ocasiones la alteración de la percepción se puede deber a una hipersensibilidad verdadera por una distorsión en la modulación de las señales sensoriales 40 . Un ejemplo de ello sería la hipersensibilidad de la pared abdominal como el que vemos en traumatismos de la pared abdominal, heridas o cicatrices, que pueden ser percibidas por el paciente como sensación de tensión abdominal e interpretadas como distensión. Este sería el mismo mecanismo de sensación de distensión que se produce en el postoperatorio de una laparotomía. Finalmente, la sensación de distensión también puede provenir de las vísceras. De hecho, la hiperalgesia visceral ha sido extensamente caracterizada en los pacientes con trastornos funcionales digestivos, ya sea DF o SII 40 . En estos pacientes, los estímulos normalmente no percibidos, pueden inducir síntomas abdominales y específicamente distensión abdominal. En el laboratorio, la distensión intestinal experimental, reproduce los síntomas habituales dependiendo del área del intestino estimulada, y en una proporción de pacientes, induce sensación de distensión. El área del intestino afectada por la disfunción sensorial esta en relación con el subtipo de síndrome clínico 41 . Por ejemplo, el área con hipersensibilidad a la distensión en los pacientes con SII es el intestino delgado y el colon 42 , mientras que el área más predominantemente afecta en la dispepsia funcional es el estómago. Recientemente se ha descrito que pacientes con dispepsia funcional y molestias de tipo pesadez post-prandial, la distensión fúndica reproduce mejor sus síntomas habituales que la distensión antral 26 . Por el contrario, en los pacientes dispépticos con dolor de tipo ulceroso en ayunas, la distensión antral es la que reproduce mejor los síntomas de estos pacientes 26. En los pacientes con trastornos funcionales digestivos, la alteración de la sensibilidad se combina con una alteración de la motilidad intestinal, y ambas - 14 - Introducción interaccionan para producir los síntomas 40 . Este paradigma es igualmente aplicable para los pacientes con distensión abdominal. Básicamente, el acúmulo de contenido intestinal puede producir distensión focal en un área hipersensible e inducir los síntomas. De hecho, alteraciones motoras mínimas, que no comprometen la normal función del intestino, pueden ser solo clínicamente relevantes y producir síntomas, en presencia de una alteración de la percepción intestinal. 1.3.4. Contenido intraabdominal. La distensión abdominal puede deberse a un aumento del contenido intraluminal o del contenido libre intraperitoneal (como la ascitis). De todos los elementos de la cavidad abdominal, el gas intestinal parece ser el más versátil. Dadas las rápidas fluctuaciones de la distensión, que generalmente refieren los pacientes, el gas es el candidato más probable explicar la distensión, mientras que otros elementos potenciales han sido menos estudiados. - 15 - Introducción 1.4. GAS INTESTINAL Y DISTENSION ABDOMINAL Varios estudios en diferentes poblaciones y utilizando diferente metodología han demostrado que, a pesar de la gran capacidad del tracto gastrointestinal, el volumen total de gas no supera los 100-300 mililitros (ml) 43-45 . Esta cifra relativamente constante de gas intestinal es sorprendente, teniendo en cuenta los diversos y complicados procesos de entradas y salidas de gas intestinal. 1.4.1 Fisiología del gas intestinal. El gas en el intestino puede provenir de diferentes fuentes: del aire ingerido, de las reacciones químicas, de la difusión de gas desde el torrente sanguíneo o de la fermentación bacteriana. De la misma manera, la salida de gas se puede producir por: la emisión de eructos, la absorción intestinal, el consumo bacteriano en el colon o la evacuación anal. (Fig.1) La deglución introduce de forma fisiológica una pequeña cantidad de aire en el estómago, que si es excesiva, puede ser eliminada del estómago mediante la emisión de eructos, por absorción a la sangre o por vaciado al intestino. Las reacciones químicas producidas por la neutralización de los ácidos y álcalis en el intestino proximal producen una enorme cantidad de dióxido de carbono 46 que es absorbido en el intestino delgado. Las bacterias colónicas juegan un papel clave en el metabolismo del gas, tanto en la producción, como en el consumo de gas intraluminal y por ello su actividad constituye un factor determinante del gas eliminado. El efecto de la flora colónica sobre el metabolismo del gas depende del balance existente entre los microorganismos productores y consumidores, siendo esta relación variable entre cada individuo 47. - 16 - Introducción Deglución de aire Eructos ESTÓMAGO Difusión de gas Liberación de CO2 desde / hacia la INTESTINO DELGADO Reacciones químicas sangre Consumo Metabolismo bacteriano COLON Producción Evacuación Figura 1. Fisiología del gas intestinal La composición de la flora colónica se adquiere en etapas precoces de la vida, aunque también se halla influenciada por el tipo de alimentación 48, 49 . La población occidental, de forma mayoritaria (90%), presenta bacterias productoras de hidrógeno, siendo éstas las responsables de la fermentación de los substratos no digeribles, concretamente los carbohidratos, y dando lugar a la liberación de hidrógeno y dióxido de carbono 50-53 . El hidrógeno, el dióxido de carbono y el oxígeno (este último utilizado por las bacterias aerobias), son consumidos en grandes cantidades por las bacterias colónicas y así se ve reducida su concentración a nivel intraluminal. Muchos - 17 - pacientes presentan bacterias Introducción productoras de sulfatos distribuidas por todo el colon 53 . Estas bacterias consumen gran cantidad de hidrógeno, liberando pequeñas cantidades de gases sulfurosos que son los responsables del característico mal olor de los gases evacuados. Un 30% de los individuos presentan asimismo un grupo de bacterias productoras de metano en el colon izquierdo, que consumen una gran cantidad de hidrógeno y liberan metano 52-56 . Debido a la competencia por el consumo de hidrógeno entre ambas poblaciones bacterianas, en este subgrupo de individuos las bacterias productoras de sulfatos se encuentran circunscritas al colon derecho. La tendencia de los gases intraluminales es al equilibrio con los gases venosos y esto depende de 3 factores principales: la presión parcial de cada gas en ambos lados de la barrera hemato-intestinal, la capacidad de difusión y el tiempo de exposición del gas a la superficie de difusión (determinado por la velocidad del tránsito de gas) 47, 57. Así, los gases con alta capacidad de difusión presentes en el intestino, como el dióxido de carbono producido por las reacciones químicas o el oxígeno proveniente de la deglución, son absorbidos rápidamente. Parte de los gases producidos por las bacterias del colon difunden a la sangre y se eliminan por los pulmones 58 , (este es el principio básico utilizado en las pruebas de aliento) mientras que el resto de gases son eliminados por el ano. De esta manera, la composición del gas intraluminal varia enormemente a lo largo de todo el intestino y la composición de los gases evacuados, refleja el balance de los múltiples procesos que han tenido lugar en el interior del intestino 53. Durante condiciones normales, el nitrógeno es el componente predominante del gas eliminado, mientras que el oxigeno, aún siendo el segundo componente más importante, presenta una concentración pequeña (< 10%). Sin embargo, si se realiza una ingesta de comida rica en carbohidratos altamente - 18 - Introducción fermentables, las concentraciones pueden variar con predominio del hidrógeno, el dióxido de carbono y el metano (en sujetos con flora productora de metano). La presencia de otros componentes gaseosos es mínima 47. Es importante tener en cuenta que la velocidad del tránsito de gas determina la exposición de los gases intraluminales a la difusión, así como al consumo bacteriano y por ende puede influir no solo en el volumen de gas en el intestino, sino también en su composición 59 . El tránsito y la tolerancia de gas se han medido mediante una prueba de tránsito de gas intestinal (Fig.2). Infusión de gas yeyunal Cinta métrica Evacuación de gas rectal Figura 2. Prueba experimental de tránsito de gas. Esta prueba consiste en la infusión de una mezcla de gases, con la misma proporción que en sangre venosa, en el yeyuno proximal, mientras se cuantifica la evacuación de gas anal. En un estudio inicial, se comprobó que la mayoría de los sujetos sanos eran capaces de propulsar y evacuar todo el gas que se les infundía (independientemente de la velocidad de infusión) (Fig.3) sin desarrollar síntomas - 19 - 32 . Introducción Se concluyó que, el tránsito de gas es un mecanismo regulado, capaz de adaptarse a diferentes sobrecargas de volumen. Estudios con manometría intestinal demostraron que la infusión de gas no producía alteraciones en la motilidad del intestino delgado 60 . Recientemente se ha sugerido que la infusión de gas induce cambios de tono intestinal; una contracción de la zona proximal a la infusión acompañada de una relajación en el área distal 61 . Por tanto, el desplazamiento de grandes masas de gas en el intestino se produce por cambios en el tono y capacitancia del intestino 62. Gas evacuado, ml Período de infusión, min Figura 3. Capacidad de evacuación de diferentes flujos de gas infundido en sujetos sanos. ◊,1 mL/min; ∆, 4 mL/min; О, 12 mL/min; □, 30 mL/min. Reproducido con permiso del editor. - 20 - Introducción 1.4.2 Producción de gas intestinal Como se ha descrito previamente, la producción de gas se halla determinada fundamentalmente por 2 factores: la cantidad de alimento fermentable que no se ha absorbido en el intestino delgado y llega al colon, y por la composición de la flora colónica. Por tanto, la distensión abdominal puede ser una característica clínica de los procesos de malabsorción, en donde la fermentación y producción de gas se produce por la llegada de alimento al colon. En determinadas circunstancias, como en el caso del sobrecrecimiento bacteriano, esta fermentación tiene lugar en el intestino delgado. Tanto en la malabsorción intestinal como en el sobrecrecimiento bacteriano, la distensión y otros síntomas relacionados con el gas constituyen una pequeña parte de la clínica de estos pacientes y por tanto su relevancia es menor. El reto en la práctica clínica son aquellos pacientes que presentan síntomas aparentemente relacionados con el gas y donde las pruebas diagnósticos son normales, como por ejemplo los pacientes con trastornos funcionales digestivos 6. Parece dudoso que la malabsorción de una cierta parte de nutrientes juegue un papel en la distensión funcional. Algunos estudios sugieren que los pacientes con SII tienen menor capacidad de absorción de ciertos alimentos sido corroborado por otros estudios 66, 67 63-65 , aunque esto no ha . Además se ha descrito que los pacientes con malabsorción comprobada de lactosa, son capaces de tolerar 250 ml de leche sin presentar síntomas. Esto es debido a la capacidad del colon de manejar cierta concentración de substratos no absorbidos, ya sea por fermentación y absorción de ácidos grasos de cadena corta o por absorción y consumo de los gases producidos 39 . Debido a que la definición de malabsorción es ambigua, algunos investigadores han explorado la eficacia de las dietas de exclusión en los pacientes afectos de distensión abdominal. Con estas dietas, los resultados obtenidos son poco - 21 - Introducción convincentes 68 y el efecto beneficioso de excluir alimentos no solo puede ser debido a una disminución de la fermentación, sino que también pueden estar implicados otros mecanismos relacionados como las reacciones alérgicas o atópicas. En una serie de estudios realizados en los años setenta, Levitt y colaboradores midieron la producción de gas intestinal utilizando la técnica del lavado 44 y demostraron que la producción de gas durante el período de ayunas fue similar en los pacientes con SII y en los sujetos sanos 69 . Posteriormente, en un único estudio publicado en forma de resumen, se demostró que la producción de gas post-prandial no presentaba diferencias entre los pacientes y los sujetos sanos 70. La evaluación de la producción de gas intestinal mediante las pruebas de aliento ha dado lugar a resultados discordantes. En un estudio 71, se midió la producción diurna de hidrógeno durante siete días en pacientes con SII y distensión abdominal y en un grupo de controles sanos. La concentración de hidrógeno exhalado fue similar en ambos grupos. A pesar de ello, los pacientes presentaron cifras de distensión más altas que los sujetos sanos y además no se observó correlación entre la sensación de distensión abdominal y las concentraciones de hidrógeno. Por el contrario, en otro estudio se midió la expulsión total de gas (exhalado y evacuado por el ano) mediante calorimetría indirecta y se observó que siguiendo una dieta estándar, los pacientes excretaban más hidrógeno que los sujetos sanos, sugiriendo que los pacientes presentaban una flora productora de gas hiperactiva 58 . Sin embargo, debido a que algunos sujetos producen hidrógeno y metano, al medir el volumen total excretado (hidrógeno y metano) no se encontraron diferencias entre ambos grupos. Finalmente, Pimentel y colaboradores 72 , realizaron un estudio en el que describieron que la proporción de pacientes con SII que presentaban pruebas de aliento con lactulosa alteradas era mayor que en controles sanos y ello lo - 22 - Introducción atribuyeron a la presencia de sobrecrecimiento bacteriano. En ese mismo estudio, la administración de neomicina oral produjo una normalización de las pruebas de aliento y una reducción de los síntomas en los pacientes con SII 72 . Esta interpretación ha sido cuestionada en la literatura científica, ya que la reproducibilidad de las pruebas de aliento con lactulosa para el diagnóstico del sobrecrecimiento es dudosa 73, 74 , la respuesta sintomática al tratamiento con antibiótico fue relativamente pobre y la respuesta en el grupo placebo fue más baja de lo habitual en otros estudios 75. Tanto la malabsorción, una flora colónica hiperactiva o un sobrecrecimiento bacteriano, producirán un aumento de la evacuación de gas anal, pero no necesariamente distensión, ya que los sujetos sanos tienen la capacidad de propulsar y evacuar grandes cantidades de gas sin desarrollar síntomas ni distensión 32, 39 . Por tanto deben existir otros mecanismos responsables de la producción de la distensión. 1.4.3. Volumen de gas intraluminal. En sus estudios iniciales Lasser y colaboradores 69, 70 , demostraron mediante la técnica de lavado que la cantidad y tipo de gas presente en la luz del tubo digestivo era similar en los pacientes con SII y en los sujetos sanos. Utilizando una técnica similar en nuestro laboratorio, no hemos encontrado diferencias en el volumen de gas intestinal entre pacientes con distensión abdominal y sujetos sanos 32, 45 . Utilizando una metodología distinta (mediante radiografías del abdomen), pero con el mismo propósito, dos estudios diferentes 76, 77 concluyeron que la cantidad de gas abdominal era mayor en pacientes con SII que en sujetos sanos (un 54% y un 118%, - 23 - Introducción respectivamente) pero no hallaron una correlación significativa entre el volumen de gas y los síntomas descritos. En un estudio multicéntrico utilizando radiografías de abdomen realizadas entre 1 y 2 horas tras el desayuno o la comida, se encontró que el área total de gas (aprox 28%) en pacientes con SII y distensión abdominal era mayor que en pacientes sin distensión. Sin embargo, la correlación entre el contenido del gas abdominal y la intensidad de la distensión fue pobre 35 . Debido a que el volumen de gas intraluminal en los pacientes con SII medido por diferentes estudios es de solo 100 a 300 ml 33, 45, 69, 70 las variaciones porcentuales descritas en los 3 estudios se corresponden con diferencias relativamente pequeñas en volumen absoluto. Utilizando una sofisticada técnica de medición volumétrica del gas intestinal mediante tomografía axial computerizada (TAC) abdominal no se han observado diferencias clínicamente significativas en el volumen de gas entre sujetos sanos y pacientes con distensión 78 . En un estudio subsiguiente comparando pacientes en condiciones basales y durante episodios de máxima distensión, se detectó un aumento relativamente pequeño pero significativo de la cantidad de gas en las imágenes obtenidas durante la distensión 79 . Estos datos sugieren que la distensión abdominal puede no deberse directamente a un aumento del gas intestinal pero si a otros factores, como la incapacidad de manejo del gas, su distribución en el intestino o a reacciones anormales a una cantidad de gas que puede ser normal. 1.4.4. Alteración del manejo de gas intestinal. No se han podido detectar anormalidades que expliquen la distensión abdominal en estudios convencionales de motilidad intestinal, sin embargo estudios de tolerancia y tránsito de gas han demostrado que los pacientes con distensión - 24 - Introducción abdominal presentan una alteración en el manejo de sobrecargas de gas intestinal 33, 34, 45, 69 . Por tanto, los estudios de gas intestinal podrían revelar trastornos en la propulsión intestinal, que juntamente con alteraciones sensitivas, probablemente podrían ser la base para el desarrollo de la distensión abdominal. Solo una pequeña proporción de sujetos sanos (15%) presentan una alteración del manejo del gas intestinal, con un incremento en la percepción de síntomas abdominales debidos al gas intestinal 32. Si a esta pequeña porción de sujetos sanos se les somete a una sobrecarga de gas intestinal, experimentaran síntomas abdominales 32 . Además, si se induce experimentalmente la producción de gas mediante la infusión de almidón en el colon, una pequeña parte de los sujetos sanos también presentan síntomas 80 . Por ello, se puede sugerir que algunas personas tienen tendencia a la distensión, pero este síntoma solo se produce bajo circunstancias muy concretas. Lasser y colaboradores 69 mediante su técnica de lavado intestinal de gas, describieron que los pacientes con distensión abdominal y síntomas relacionados, no toleraban el procedimiento y que en algunos de ellos el gas infundido refluía al estómago, siendo esto interpretado como un indicador de trastorno motor. En nuestro laboratorio demostramos que los pacientes con distensión abdominal que cumplían criterios de Roma II, tanto para SII como para distensión abdominal funcional, presentaban una alteración del manejo del gas intestinal al someterlos a la prueba de tránsito de gas 33, 34, 45. Estos pacientes retuvieron gas y/o experimentaron síntomas abdominales en respuesta a una sobrecarga de gas intestinal bien tolerada por la mayoría de los sujetos sanos. Además, la prueba de gas reprodujo sus síntomas habituales, desarrollaron distensión abdominal objetiva y se observó una - 25 - Introducción correlación significativa entre el volumen de gas retenido y la distensión objetiva. (Fig 4 y 5) Síntomas abdominales, escala Gas retenido, ml Figura 4. Relación entre volumen de gas retenido y síntomas abdominales en respuesta a la sobrecarga de gas en pacientes con SII y sujetos sanos (datos individuales). Reproducido con permiso del editor. Perímetro abdominal, mm Gas retenido, ml Figura 5. Relación entre volumen de gas retenido y distensión abdominal en respuesta a una sobrecarga de gas intestinal pacientes con SII y sujetos sanos (datos individuales). Reproducido con permiso del editor. - 26 - Introducción 1.4.5. Mecanismos de alteración del gas intestinal. El mecanismo por el cual estos pacientes presentan retención de gas intestinal no queda bien aclarado. Experimentalmente, se ha demostrado que dos mecanismos pueden ser responsables de la retención de gas en sujetos sanos: 1) un aumento de la resistencia al flujo de gas (obstrucción al flujo de salida) y 2) una alteración en la propulsión intestinal (inducida farmacológicamente mediante inhibición motora por glucagón) 81 . Utilizando la prueba de gas desarrollada en nuestro laboratorio, observamos que la retención de gas producida por alteración en la propulsión, induce distensión abdominal objetiva, pero que es bien tolerada. Sin embargo, cuando la retención de gas se produce por una resistencia aumentada al flujo, los síntomas abdominales son más intensos que en el modelo de inhibición motora. Por tanto, mientras que la distensión abdominal depende del volumen de gas retenido, la molestia abdominal depende de un aumento de la resistencia más que a una alteración de la propulsión intestinal. De este modo, pequeñas cantidades de gas impulsadas contra resistencia, pueden incrementar la tensión de la pared intestinal e inducir síntomas. Además si varios acúmulos de gas quedan atrapados a diferentes niveles, la percepción aumentara por un fenómeno de sumación espacial 82 . En sujetos sanos se ha observado que la contracción voluntaria anal puede producir retención de gas 81 . En nuestro laboratorio demostramos que los pacientes con distensión abdominal, al someterse a una prueba de tránsito de gas, presentaron niveles de retención similares, independientemente de si el gas era recogido por cánula rectal interna (de forma que se anula la potencial retención anal) o por cánula externa 45 . A pesar de ello, en la práctica clínica hay pacientes en donde el ano - 27 - Introducción participa en la retención, ya sea por alteración de la relajación anal o por inhibición voluntaria de los gases rectales. 1.4.6. Control reflejo del tránsito intestinal de gas. Los datos existentes en la actualidad sugieren que la retención de gas en pacientes con distensión abdominal se debe a una alteración refleja del tránsito. De hecho, el tránsito de gas se encuentra regulado por reflejos víscero-viscerales a lo largo de todo el intestino 61, 83. La presencia de lípidos intraduodenales induce de forma dosis dependiente un retraso, en el tránsito y retención de gas 34 . Sin embargo, la infusión directa de lípidos a nivel ileal produce un mayor enlentecimiento del tránsito que los lípidos duodenales, fenómeno denominado paro ileal 83 . Otros reflejos producen una aceleración del tránsito intestinal. Por ejemplo, la distensión gástrica se acompaña de una inmediata evacuación de gas colónico y acelera la evacuación de gas exógeno, lo que constituye el reflejo gastro-cólico 84 . Sin embargo este reflejo forma parte de un fenómeno general, ya que la distensión a diferentes niveles del intestino, duodeno o recto, produce el mismo efecto estimulatorio 61, 84 . Es interesante recalcar que la distensión intestinal tiene la capacidad de antagonizar el efecto inhibitorio de los lípidos sobre el tránsito de gas 61, 84. En sujetos sanos, el aclaramiento de gas intestinal se ha demostrado superior en bipedestación que en supino 86 85 y durante la realización de ejercicio físico moderado , poniendo de relieve que los reflejos somato-viscerales también participan en la regulación del tránsito de gas. En situaciones fisiológicas diferentes tipos de reflejos están interaccionando para que se produzca un efecto. La prueba de tránsito de gas con infusión de lípidos - 28 - Introducción intraluminales permite una distinción clara entre pacientes con SII o distensión funcional y sujetos sanos. Los pacientes retienen volúmenes mayores de gas y/o presentan síntomas abdominales, indicando que la propulsión del gas es ineficaz y/o sintomática 34. 1.4.7 Área del intestino responsable de la distensión abdominal En los sujetos sanos la tolerancia del gas depende del lugar de acumulación. Por ejemplo, se ha demostrado que en el modelo de retención de gas por obstrucción del flujo de salida, la retención de gas yeyunal, produce más síntomas intestinales que la retención a nivel colónico, a pesar de producir la misma distensión abdominal 87 . Al marcar el gas con Xenón 133, observamos que la infusión de gas yeyunal produce retención fundamentalmente a nivel del intestino delgado y del colon proximal, mientras que la infusión rectal produce una retención en todo el colon pero mayoritariamente en colon distal 87 . Estos datos nos permiten concluir que los síntomas relacionados con el gas son dependientes del área estimulada, mientras que la distensión abdominal depende del volumen de gas retenido en el intestino. El marcaje del gas con Xenón 133 también se ha utilizado para investigar el tránsito segmentario de gas intestinal. En sujetos sanos, el tránsito de gas por todo el intestino es rápido, siendo similar en el intestino delgado que en el colon. Por tanto, a diferencia de los líquidos o los sólidos, la velocidad de tránsito del gas es homogénea a lo largo de todo el intestino. Los pacientes afectos de distensión abdominal, a diferencia de los sujetos sanos, tienen una aclaramiento de gas intestinal ineficaz, debido a una propulsión del intestino delgado alterada, mientras que el tránsito colónico es normal. Estos datos - 29 - Introducción fueron confirmados posteriormente al infundir gas mediante una sonda intestinal a diferentes niveles del intestino y medir las respuestas generadas, comprobándose que si la infusión es a nivel yeyunal se retiene gas, mientras que si es a nivel ileal o colónico, el tránsito de gas es normal 88 . Por consiguiente la zona ileocecal no es la responsable de la retención de gas y en conjunto los datos muestran al intestino delgado y no al colon como responsable de la generación de los síntomas intestinales en los pacientes con distensión abdominal. A partir de la neutralización del ácido gástrico se produce una gran cantidad de dióxido de carbono en el intestino delgado, que difunde fácilmente al torrente sanguíneo 46, 47. A pesar de ello, el gas remanente puede ser suficiente para producir síntomas en un intestino con un defecto para la propulsión. Al mismo tiempo parece razonable contemplar otras posibilidades, por ejemplo, la distensión post-prandial en los pacientes dispépticos puede provenir del estómago 26, 89 . Normalmente la comida se acomoda mayoritariamente en el estómago proximal, en parte debido a que el llenado antral induce un reflejo relajatorio del fundus. Además, cuando el estómago inicia el vaciado, los nutrientes intestinales inducen un reflejo entero-fúndico relajatorio, que contribuye al proceso de acomodación del fundus. Los pacientes dispépticos presentan una alteración de los reflejos relajatorios entero-fúndicos y antro-fúndicos y ello puede dar lugar a un defecto de acomodación, con un desplazamiento distal del contenido intragástrico y una sobrecarga antral 26 . Estos pacientes se caracterizan por presentar una percepción gástrica antral aumentada. La disfunción motora que da lugar a sobredistensión de un antro hipersensible, puede explicar la génesis de la percepción de distensión abdominal en pacientes dispépticos independientemente del tránsito de gas en el intestino. - 30 - Introducción 1.4.8 Es el gas el elemento responsable de la distensión? Los estudios de tránsito de gas han demostrado que los pacientes con distensión abdominal funcional (de origen no aclarado) presentan una alteración motora en la propulsión intestinal de gas asociada a una mayor sensibilidad, lo que parece jugar un papel en la fisiopatología de los síntomas abdominales. Sin embargo el desencadenante de la distensión puede ser otro elemento intestinal diferente del gas. La distensión abdominal se puede producir sin que exista un incremento de gas intestinal. Levitt y colaboradores 90 estudiaron la disparidad existente entre la distensión abdominal y la flatulencia en respuesta a una sobrecarga oral de lactulosa o de dos tipos de fibra (psyllium o metilcelulosa) en sujetos sanos. La lactulosa, que es un azúcar no absorbible por el intestino delgado, al llegar al colon es fermentada por las bacterias, produciendo hidrógeno e induciendo flatulencia, una sensación de gas rectal y distensión. Es interesante que, tanto en la fibra fermentable (psyllium) como la no fermentable (metilcelulosa), producen un incremento de hidrógeno medido por la prueba de aliento exhalado y sensación de distensión abdominal, pero sin acompañarse de flatulencia o sensación de gas rectal. Los autores concluyeron que la distensión abdominal asociada a una sobrecarga experimental de fibra presumiblemente se debe al incremento de la masa intraluminal. El aumento del fluido intestinal puede ser una causa importante de distensión abdominal en algunas circunstancias, por ejemplo en el caso de diarrea aguda y en algunos casos de distensión post-prandial. Sin embrago, los datos del tránsito de quimo en el intestino delgado de pacientes con distensión abdominal son inconsistentes, mostrando tanto aceleración 18 como retraso 91 del mismo. Se han descrito hipótesis en las que se define al íleo terminal y la unión íleo-cólica como - 31 - Introducción zonas del intestino que juegan un papel relevante en la regulación del tránsito de quimo, sin embargo estudios de tránsito ileo-cecal han dado lugar a resultados contradictorios 92, 93 , incluso cuando la llegada de quimo al ciego se encuentra temporalmente relacionada con los síntomas 91 . La distensión abdominal podría derivar de una expansión extraluminal de agua en la cavidad abdominal. La ingurgitación vascular y el edema visceral, bajo influencias neurohormonales, podría ser el origen de algunos tipos de distensión menstrual, pero esta posibilidad no ha sido explorada y queda como una base teórica. - 32 - Introducción 1.5. ANATOMIA DEL DIAFRAGMA 1.5.1 Anatomía descriptiva. El diafragma es una estructura músculo-aponeurótica (Fig. 6) caracterizada por separar dos cavidades (la abdominal y la torácica) y formar 2 hiatos (el hiato esofágico y el hiato aórtico). El hiato esofágico se sitúa ventralmente para dar lugar al paso del esófago y nervio vago, y el hiato aórtico dorsalmente para el paso de la arteria aorta y conducto torácico. En el diafragma se pueden diferenciar tres estructuras anatómicas con características morfológicas y funcionales específicas que se definen como: diafragma costal, diafragma crural y la cúpula diafragmática 94. Esternón Proceso xifoideo Tendón central del diafragma Vena cava inferior Esófago (hiato esofágico) Impresión hepática Cartílagos costales Impresión gástrica Pilar diafragmático Aorta abdominal (Hiato aórtico) Cuadratus Lumborum 12º Costilla Músculo Psoas Figura 6. Anatomía del diafragma (vertiente abdominal). Reproducido con permiso del editor. - 33 - Introducción La cúpula diafragmática es una estructura tendinosa en donde se insertan las fibras musculares de la porción costal y crural y representa el 20% del total del diafragma 95. El diafragma crural se sitúa en la parte posterior: se origina en la cúpula diafragmática y se dirige caudalmente para insertarse en la cara antero lateral de las tres primeras vértebras lumbares y representa el 35% del total de la superficie muscular diafragmática. Estudios anatómicos han demostrado la existencia de 2 patrones diferentes de organización del diafragma crural. El patrón más frecuente es el tipo I (85% de la población), formado por 2 pilares diafragmáticos. El pilar derecho (D) presenta dos ramas que ascienden desde los cuerpos vertebrales hasta la cúpula diafragmática y forman el hiato esofágico, mientras que el pilar izquierdo (Izq) consta de una única rama. El patrón tipo II es menos frecuente (15% de la población) y característicamente ambos pilares presentan dos ramas, siendo las ramas internas las que forman el hiato esofágico 96 (Fig.7). Izq D D Tipo I Izq Tipo II Figura 7. Patrones anatómicos del diafragma crural - 34 - Introducción El diafragma costal se origina en la cúpula diafragmática y distribuye sus fibras en sentido cráneo caudal, insertándose en el apéndice xifoides (fibras esternales) y en la porción interna de las últimas 6 costillas inferiores (fibras costales) 97 . Las fibras musculares que se encuentran íntimamente adheridas a la parrilla costal forman la denominada zona de aposición, que constituye aproximadamente 45% del total de la superficie muscular diafragmática 95, 98. El aporte sanguíneo del diafragma proviene de las arterias intercostales, arterias frénicas (superiores e inferiores) y de la arteria mamaria interna. Estas arterias se anastomosan entre ellas con el fin de asegurar un buen flujo sanguíneo 99. La inervación motora del diafragma se produce mediante el nervio frénico izquierdo y derecho, originándose a partir de las raíces nerviosas medulares C3-C5. 1.5.2 Histología 1.5.2.1 Fibras musculares De acuerdo con sus propiedades metabólicas y funcionales, las fibras musculares se pueden dividir en tres tipos diferentes (tipo I, IIa y IIb) (Tabla.1). La distribución de estas fibras en cada músculo esquelético dependerá de su función motora y de la demanda que se ejerza sobre éste. Específicamente en el diafragma, la proporción de cada tipo de fibras puede cambiar en función de factores como la edad, el estado nutricional o alteraciones en la fisiología normal del sistema respiratorio 97 (sobrecarga crónica sobre el diafragma). Durante la respiración pausada, la mayor parte del esfuerzo respiratorio lo realiza el diafragma sin intervención de la musculatura accesoria, activándose ésta última - 35 - Introducción cuando se requiera un esfuerzo adicional. Por lo tanto, dado que el diafragma presenta una actividad rítmica y continua durante toda la vida, dispone de una proporción alta de fibras resistentes a la fatiga. Tabla.1 Clasificación de las diferentes fibras del músculo esquelético humano. Fibra Muscular Tipo I Tipo IIa Tipo IIb - Metabolismo: Oxidativo lento Oxidativo rápido Glucolítico rápido - Resistencia a la fatiga: Lenta Rápida Rápida Isoformas Miosina I o lento IIa IIb Velocidad de acortamiento Lento Rápido Muy rápido Actividad ATPasa Baja Alta Muy alta Lento Rápido Muy rápido Oxidativo Oxidativo glucolítico Glucolítico - Propiedades: Captación Ca2++ en RS Metabolismo RS: retículo sarcoplasmático Se ha estimado que la proporción de fibras del diafragma en los sujetos sanos es de aproximadamente un 55% de tipo I, 21% de tipo IIa y 24% de tipo IIb 100 y que característicamente no hay diferencias entre la proporción de dichas fibras entre el diafragma costal y el crural 101. 1.5.2.2 Receptores propioceptivos La función de la fibra muscular esta controlada de forma permanente, tanto a nivel periférico (por receptores sensoriales del propio músculo) como a nivel central (mediante eferencias del SNC). - 36 - Introducción En la musculatura esquelética se pueden diferenciar 2 tipos de receptores propioceptivos: los husos musculares y los receptores tendinosos de Golgi. Los husos musculares son receptores sensoriales constituidos por fibras musculares especializadas inmersas en el vientre muscular y dispuestas en paralelo a las fibras musculares esqueléticas, cuya función principal es dar información sobre la longitud (extensión) del músculo. La estimulación de dichos receptores se transmite mediante una fibra neural aferente (tipo Ia) hacia la medula espinal en donde se produce una sinapsis directa con una motoneurona alfa (reflejo monosináptico) que será la que en último término estimulará al músculo para producir la contracción. El órgano tendinoso de Golgi es un receptor sensorial encapsulado, localizado a nivel del tendón muscular y en serie con las fibras musculares. Debido a su disposición anatómica, cuando el músculo se contrae, el órgano de Golgi se estira informando de la tensión muscular ejercida. Cuando se excede de un cierto nivel de tensión, se transmite una señal a la medula espinal mediante fibras nerviosas aferentes (tipo Ib) que sinaptan con una interneurona inhibidora cuya función es inhibir a la motoneurona alfa. De esta manera, este receptor proporciona un mecanismo de defensa que evitaría los excesos de tensión muscular. 1.5.3 Anatomía Funcional 1.5.3.1 Actividad muscular El diafragma es un músculo que se contrae rítmicamente en contra de fuerzas elásticas y resistivas (pared torácica, pulmones y vías aéreas) 102. La contracción del diafragma deforma la pared torácica y produce la inspiración, mientras que en la - 37 - Introducción espiración, se relaja y vuelve a la posición inicial. La contracción diafragmática es unitaria, pero cada porción del músculo tiene particularidades funcionales generadas por sus inserciones anatómicas. Por ejemplo, cuando se contrae la porción costal del diafragma, la zona de aposición disminuye y ello provoca un acortamiento axial, que es el responsable del desplazamiento caudal del diafragma. Al mismo tiempo y debido a la inserción de las fibras musculares sobre la porción interna de las costillas, se produce una fuerza centrípeta que tiende a desplazar las costillas hacia fuera. El diafragma crural ejerce exclusivamente una fuerza craneo-caudal de la cúpula diafragmática produciendo un desplazamiento caudal de las vísceras abdominales y por tanto un aumento de la presión intraabdominal. Es por ello que la función diafragmática no es exclusivamente respiratoria, sino que interviene en actividades que requieran un aumento de la presión abdominal, como puede ser el vómito o la defecación. Cualquiera de estas acciones necesita de una contracción muscular coordinada entre el diafragma y la pared anterior del abdomen (fundamentalmente músculos oblicuo interno y transverso del abdomen) para generar aumento de presión intraabdominal. La contracción diafragmática se ha observado también en el control postural del tronco, tales como levantamiento de pesos o incluso tan pequeños como movimientos de extremidades superiores 103 . Debido a su estructura anatómica y su actividad contráctil, el diafragma crural participa en la formación del esfínter esofágico inferior en su porción externa 96. 1.5.3.2 Mecánica muscular La mecánica muscular del diafragma depende de dos variables fundamentales, la posición del tronco y la carga que se ejerce sobre el diafragma. En la posición de bipedestación, el diafragma se encuentra en una posición inferior de la - 38 - Introducción caja torácica; para compensar la fuerza que ejerce la gravedad, se produce una activación tónica de la musculatura abdominal, específicamente del músculo oblicuo interno y probablemente también del músculo transverso del abdomen 104 . Dicha actividad tónica de la musculatura abdominal consigue que el diafragma adopte una longitud de reposo óptima, que le permite realizar una contracción eficaz 105, 106. Este fenómeno se ha verificado en pacientes tetrapléjicos, ya que en ausencia de una contracción abdominal, no se puede compensar la caída diafragmática y por tanto, la capacidad de contracción diafragmática y el volumen corriente respiratorio disminuyen. En éstos pacientes, la colocación de una faja abdominal produce un aumento de presión abdominal (efecto que realiza normalmente el tono de la musculatura abdominal), forzando al diafragma a adoptar una relación tensiónlongitud de reposo óptima y con ello, mejorar significativamente su capacidad contráctil. La actividad muscular que se produce con el cambio de postura es controvertida. Existe un estudio 107 en el que se describe la actividad muscular del diafragma con los cambios posturales. Al pasar de bipedestación a la posición de supino, todo el contenido abdominal se desplaza en dirección craneal y este desplazamiento de las vísceras abdominales produce un estiramiento del diafragma. Dicho estiramiento muscular provoca la activación de los husos musculares, que a su vez, producen una contracción muscular compensatoria del diafragma 107 . Este aumento de actividad muscular diafragmática evitará de este modo un desplazamiento craneal y una disminución de la capacidad residual funcional. En contraposición, otros autores 108, 109 no abogan por esta teoría, rechazando la presencia de husos musculares en el interior de diafragma y negando la existencia un aumento de la actividad electromiográfica con el cambio de postura. - 39 - Introducción 1.6. ANATOMIA DE LA PARED MUSCULAR ANTERIOR 1.6.1 Anatomía descriptiva La pared anterior del abdomen se encuentra compuesta por una serie de músculos planos con simetría lateral: recto anterior, oblicuos interno y externo y transverso. 1.6.1.1 Recto anterior El recto anterior del abdomen es un músculo que se extiende a lo largo de toda la porción anterior del abdomen y esta separado uno de otro por la línea media. Este músculo esta formado por cuatro vientres musculares separados por tres intersecciones tendinosas transversales. Las fibras musculares se originan en los cartílagos costales de la 5ª, 6ª y 7ª costilla, así como de la apófisis xifoides del esternón, para dirigirse caudalmente e insertarse a nivel de la cresta y sínfisis del pubis 110. La inervación del músculo recto anterior proviene de las ramas anteriores de los seis últimos nervios torácicos, alcanzando al músculo a través del oblicuo interno y transverso del abdomen 110, 111. 1.6.1.2. Oblicuo Externo (OE) Es el músculo más superficial de la pared antero-lateral del abdomen. Anatómicamente se pueden diferenciar en 2 porciones: anterior y lateral. Las fibras anteriores se originan de las superficies externas de la 5ª a la 8ª costilla, formando interdigitaciones con el músculo serrato mayor, para dirigirse caudal y medialmente e insertarse en la aponeurosis anterior que termina en la línea media. Las fibras - 40 - Introducción laterales se originan en la superficie externa de la 9ª costilla con interdigitaciones del serrato anterior y superficie externa de la 10ª a la 12ª costilla con interdigitaciones del dorsal ancho todas ellas dirigiéndose caudalmente para insertarse a nivel de la espina ilíaca antero-superior y en la mitad anterior de la cresta ilíaca.(Fig. 8) La inervación de dicho músculo se produce por las ramas anteriores de los últimos seis nervios torácicos y de los nervios ilio-hipogástricos e ilio-inguinales (provenientes de la unión entre la rama anterior del primer nervio lumbar, el X intercostal y el segundo lumbar) 110. Figura. 8. Músculo Oblicuo Externo del abdomen. Imagen reproducida de www.abdominales.info. - 41 - Introducción 1.6.1.3. Oblicuo Interno (OI) Este músculo se encuentra subyacente al oblicuo externo y forma parte, al igual que este último, de la pared antero-lateral del abdomen. Tiene 3 tipos de fibras: antero-inferiores, superiores y externas. Las fibras antero-inferiores se originan de los dos tercios externos del ligamento inguinal y una porción corta de la cresta ilíaca, para dirigirse transversalmente e insertarse en la cresta del pubis, la línea pectínea y por medio de una aponeurosis en la línea media. Las fibras superiores se originan del tercio anterior de la línea intermedia de la cresta ilíaca para dirigirse craneal y medialmente e insertarse mediante una aponeurosis en la línea alba. Finalmente las fibras externas se originan de la línea media de la cresta ilíaca y fascia toracolumbar para dirigirse cranealmente e insertarse en los bordes inferiores de la 10ª a 12ª costillas (Fig.9). La inervación de dicho músculo se produce por las ramas anteriores de los últimos seis nervios torácicos y de los nervios ilio-hipogástricos e ilio-inguinales 110. Figura. 9. Músculo Oblicuo Interno del abdomen. Imagen reproducida de www.abdominales.info. - 42 - Introducción 1.6.1.4. Transverso del Abdomen Este es el músculo más profundo del abdomen y se origina desde las superficies internas de las seis costillas inferiores con interdigitaciones con el diafragma, fascia toracolumbar, tres cuartos anteriores del labio interno de la cresta ilíaca y tercio externo del ligamento inguinal para dirigirse transversalmente e insertarse mediante una ancha aponeurosis en la cresta pubiana, pectínea y línea alba (Fig.10). La inervación del transverso abdominal proviene de las ramas anteriores de los últimos seis nervios torácicos y de los nervios ilio-hipogástricos e ilio-inguinales 110. Figura. 10. Músculo Transverso del abdomen. Imagen reproducida de www.abdominales.info. - 43 - Introducción 1.6.2 Anatomía Funcional 1.6.2.1 Recto anterior La función de este músculo es principalmente flexora del tronco y de la columna vertebral. Cuando se fija la inserción pélvica y se contrae el músculo, se produce una aproximación del tórax a la pelvis, mientras que con el tórax fijo será la pelvis la que se aproximara a éste. 1.6.2.2. Oblicuo Externo La acción del oblicuo externo dependerá de la activación de sus fibras musculares anteriores o laterales, bilateral o de forma unilateral. La activación bilateral de las fibras anteriores produce una flexión de la columna vertebral, sostenimiento de las vísceras abdominales y contribuye a la espiración forzada. Con la activación unilateral de las fibras anteriores del oblicuo externo y las fibras contralaterales del oblicuo interno, se producirá la rotación hacia el lado opuesto del tronco. La activación bilateral las fibras laterales produce una flexión de la columna vertebral fundamentalmente sobre la columna lumbar y la activación unilateral produce la flexión lateral de la columna vertebral aproximando lateralmente el tórax y la cresta iliaca 112. 1.6.2.3. Oblicuo Interno Al igual que el oblicuo externo, la acción de este músculo dependerá de la activación selectiva de sus fibras. Las fibras antero-inferiores, al igual que el músculo transverso del abdomen, tienen como misión principal el sostenimiento de las - 44 - Introducción vísceras abdominales. Las fibras superiores, cuando se activan bilateralmente, flexionan la columna vertebral, sostienen y comprimen las vísceras abdominales y actúan como musculatura respiratoria (fundamentalmente espiratoria). Finalmente, las fibras externas del oblicuo externo junto con las fibras externas del oblicuo interno producen una flexión ipsilateral del tronco 112. 1.6.2.4. Transverso del Abdomen La particular disposición de este músculo es la responsable de su acción de compresión y sostenimiento de las vísceras abdominales, la participación en movimientos respiratorios y la estabilización de la columna dorsal 112. 1.6.3. Histología A pesar de una actividad funcional diferenciada entre los diversos músculos de la pared antero-lateral del abdomen, no se han encontrado diferencias en la composición histoquímica de sus fibras musculares, ni en la distribución por sexos 113, 114 . Las fibras tipo I representan aproximadamente un 55-58%, las fibras tipo IIa entre un 15-23% y finalmente entre un 21-28% para la fibras tipo IIb. La elevada proporción de fibras tipo I con actividad resistente a la fatiga ponen en evidencia la función postural de dichos músculos. Los músculos que presentan mayoritariamente una actividad tónica en bipedestación son, el oblicuo interno y el transverso del abdomen. Con el cambio de la posición supina a la bipedestación, el contenido abdominal recae sobre la pared anterior y produce un estiramiento que estimula las fibras intrafusales de los husos musculares. Esta activación desencadena un reflejo monosináptico o reflejo miotático que activa la motoneurona alfa del asta anterior medular que induce una contracción compensatoria de la musculatura anterior. Este - 45 - Introducción tipo de actividad muscular se ha demostrado mediante electromiografía de superficie. 104, 115. - 46 - Introducción 1.7. EVALUACIÓN DE LA ACTIVIDAD MUSCULAR: ELECTROMIOGRAFÍA La actividad de músculos planos (como por ejemplo los músculos de la pared antero-lateral del abdomen) es difícil de valorar por métodos mecánicos, sin embargo se pueden estudiar de forma fiable mediante electromiografía. 1.7.1. Definición La electromiografía (EMG) es una técnica que permite detectar la actividad eléctrica mediante la grabación de las diferencias de potencial expresadas en la superficie muscular como resultado de la actividad eléctrica generada por este a partir de su contracción. 1.7.2. Electromiografía de superficie abdominal. La musculatura antero-lateral del abdomen esta formada por varias capas en profundidad, pero debido a su particular posición anatómica, es posible un estudio selectivo de los 4 músculos más superficiales; oblicuos (interno y externo) y rectos (superior e inferior). En un estudio minucioso realizado por Ng y colaboradores 116 se determinó la posición más adecuada para la colocación de los electrodos abdominales y de esta manera obtener una metodología estandarizada para el estudio selectivo de la actividad contráctil de los diferentes músculos que conforman la pared antero-lateral del abdomen. Los electrodos de registro en la EMG abdominal de superficie, pueden estar realizados por diferentes materiales, siendo los más comúnmente utilizados los de plata (Ag/AgCl), ya sea por su buena transmisión de señal con bajo ruido, como por - 47 - Introducción ser ampliamente disponibles y económicos. Dichos electrodos se colocan en contacto con la piel previa utilización de geles abrasivos que reducen la impedancia electrodo-piel. La impedancia cutánea se puede definir como la resistencia al paso de una corriente eléctrica por la piel. Una baja impedancia proporciona registros electromiográficos estables y bajos niveles de ruido. La distancia interelectrodo, cuando se utiliza un registro electromiográfico bipolar, no esta estandarizada y cada laboratorio utiliza diferentes posiciones. En el caso de los músculos de gran tamaño se ha demostrado que no existen diferencias significativas en la actividad muscular registrada con diferentes distancias interelectrodo 117 y únicamente se ha recomendado que dichos electrodos estén fijos en la piel para evitar movimientos o cambios en su disposición que puedan artefactuar la señal. En la electromiografía de superficie abdominal, el electrocardiograma (ECG) no presenta una gran influencia y no comporta problemas para el análisis, ya sea porque la distancia del electrodo al corazón es grande o porque la gran amplitud de la señal EMG enmascara la interferencia del ECG. La fuerza de un músculo viene determinada por 2 mecanismos fundamentales, el reclutamiento de unidades motoras y el aumento de actividad de dichas unidades. Debido a que la amplitud de la señal electromiográfica depende de ambos mecanismos, se acepta que la amplitud de la señal es un buen parámetro para estimar la fuerza de contracción muscular. La amplitud de la señal obtenida mediante electromiografía se pude estimar mediante el RMS (Root Mean Square) o AVR (Average Rectified Value), siendo el primero el más ampliamente utilizado. Se define RMS como la raíz cuadrada de la media del cuadrado de los valores instantáneos alcanzados durante un período (Fig.11), y se expresa en microvoltios (µV). Por lo tanto se puede estimar un aumento en la actividad contráctil del músculo - 48 - Introducción cuando se produce un incremento de los valores de RMS respecto de sus valores iniciales. Figura 11. Fórmula para el cálculo del Root mean Square (RMS) √1/n ∑ e n RMS= 2 i i=n 1.7.3. Electromiografía diafragmática. Desde hace tres décadas, diferentes investigadores han utilizado la electromiografía transesofágica como un buen método de medición de la actividad diafragmática 118 . Actualmente con los nuevos sistemas de registro, procesamiento y filtraje de la señal, se pueden obtener unas mediciones con una alta calidad de la señal. Se han descrito 3 métodos para el estudio de la actividad eléctrica del diafragma: a) mediante electrodos de aguja, b) mediante electrodos de superficie o c) mediante catéter transesofágico. Se han utilizado electrodos de aguja en estudios de fisiología diafragmática en humanos 119, 120 , a pesar de ello, son poco prácticos para estudios clínicos, fundamentalmente por su invasividad y por el riesgo de presentar complicaciones (p.ej, neumotórax). Los estudios que han utilizado electrodos de superficie en la caja torácica permiten un análisis no invasivo de la actividad electromiográfica pero no están exentos de desventajas. La medición en superficie se contamina fácilmente con la actividad - 49 - Introducción eléctrica de músculos vecinos, fenómeno denominado ‘cross-talk’, generalmente de los músculos intercostales y de la pared anterior del abdomen. Asimismo, se han descrito múltiples posiciones para la configuración de los electrodos de superficie torácica, 121-123 pero no hay ningún método estándar para dicha colocación. Finalmente, al colocarse los electrodos en la superficie, el registro electromiográfico puede afectarse por la capa de grasa subcutánea, reduciendo significativamente la señal registrada en algunos pacientes. En contraposición a todo lo anterior, el registro de la actividad eléctrica diafragmática mediante la utilización de electrodos transesofágicos se encuentra menos afectada por los fenómenos de ‘cross-talk’ y por el posicionamiento de los electrodos 124 y es por ello que la mayoría de los laboratorios se han decantado por esta técnica. El diafragma se divide en dos porciones, crural y costal, y aunque se puedan diferenciar anatómicamente y funcionalmente, se ha demostrado que la medición de la actividad muscular de la porción crural, se puede correlacionar con la actividad global del músculo 125-127 . Ello permite a la EMG transesofágica, que registra la actividad crural, inferir la actividad global diafragmática. La EMG diafragmática transesofágica consiste en la medición de la actividad muscular diafragmática circunferenciales en mediante número, una tamaño sonda y oral distancias provista de interelectrodo electrodos variables dependiendo de los diferentes laboratorios. La sonda oral se sitúa a nivel de la unión gastroesofágica, generalmente mediante control fluoroscópico, siendo en esta posición donde se obtiene una mejor captación de la señal electromiográfica. A pesar de ser la técnica más apropiada para el estudio del diafragma, no esta exenta de focos de interferencia. Uno de los más problemáticos son los referentes al peristaltismo esofágico o a los movimientos de los electrodos, aunque estos son - 50 - Introducción minimizados mediante la utilización de filtros de paso alto, generalmente fijados a 20-30 Hz. Otro foco de interferencia es la actividad eléctrica del corazón (que se visualiza como el ECG). Su rango de frecuencias se encuentra dentro del rango del diafragma, por lo que es difícil de eliminar mediante filtros especiales. De este modo, se han ideado diferentes metodologías para la sustracción del ECG con una mínima alteración de la señal electromiográfica original 128, 129 . En la electromiografía diafragmática, al igual que la abdominal, se utiliza el RMS como una medida de la amplitud de la señal y consecuentemente, de la contracción muscular del diafragma. - 51 - Hipótesis 2. HIPÓTESIS 52 Hipótesis 1) Las paredes musculares de la cavidad abdominal, pared anterior y diafragma, se adaptan activamente a su contenido, mediante un proceso coordinado de acomodación abdominal. 2) Esta actividad de acomodación del contenido depende de la posición del cuerpo y contrarresta fuerzas gravitatorias. 3) Los pacientes con distensión abdominal tienen una alteración del proceso de acomodación abdominal normal. . - 53 - Hipótesis 3. OBJETIVOS 54 Objetivos 1) Determinar si la actividad de la musculatura anterior del abdomen en respuesta a los cambios posturales esta afectada en pacientes con distensión abdominal. 2) Determinar los cambios del perímetro abdominal en respuesta a un aumento del volumen intraabdominal en pacientes con distensión abdominal en relación con sujetos sanos. 3) Comparar la actividad de la musculatura abdominal anterior en respuesta a un aumento del volumen intraabdominal, en sujetos sanos y en pacientes con distensión abdominal. 4) Determinar si existe una coordinación en la respuesta de la musculatura abdominal anterior y del diafragma a un aumento del volumen intraabdominal en sujetos sanos. 5) Determinar si esta respuesta abdomino-frénica esta alterada en pacientes con distensión abdominal. - 55 - Publicaciones Objetivos 4. PUBLICACIONES 56 Publicaciones Objetivos 4.1.Publicación 1 Autores: Fabrizio Tremolaterra, Albert Villoria, Fernando Azpiroz, Jordi Serra, Santiago Aguadé y Juan-R. Malagelada. Título: Alteración de los reflejos viscero-somáticos y distonía de la musculatura abdominal asociada con la distensión abdominal. Revista: Gastroenterology 2006; 130: 1062–1068. Factor impacto: 12,46 Antecedentes y objetivos. La distensión abdominal es un síntoma muy frecuente en los pacientes con síndrome de intestino irritable (SII), pero no se conoce su mecanismo subyacente. Nuestro objetivo fue determinar si la pared abdominal juega un papel en la adaptación a un incremento de volumen intra-abdominal. Métodos. En 12 pacientes aquejados de distensión abdominal (8 con síndrome de intestino irritable y 4 con distensión funcional) y en 12 controles sanos, se probó el efecto de una sobrecarga de gas en el colon (infusión de gas rectal durante 1 hora a 24 ml/min) sobre la percepción (medida por una escala de 0-6), la distensión abdominal y la actividad muscular abdominal. Se realizó una electromiografía mediante electrodos bipolares de superficie, situados bilateralmente, en la parte superior e inferior del recto abdominal y los oblicuos externo e interno, con los participantes sentados en una silla ergonómica y el tronco erguido. Resultados. En controles sanos, la sobrecarga de gas en el colon produjo síntomas subjetivos (puntuación, 3,0±0,3), distensión abdominal objetiva (incremento de perímetro abdominal, 6,0±1,0 mm) y aumento de la actividad de los músculos abdominales (actividad oblicuo externo, 11±3 %, p<0.05 vs basal). Tras la administración del mismo volumen de gas en colon, los pacientes desarrollaron - 57 - Publicaciones Objetivos significativamente más síntomas (puntuación 4,5±0,4) y distensión abdominal (11,0±1,0 mm, p<0.05 vs sujetos sanos, para ambos). Las respuestas observadas se asociaron con una falta de actividad tónica contráctil de la pared abdominal (cambio en la actividad del oblicuo externo de -1±4 %; p no significativa vs. basal) con una relajación paradójica del músculo oblicuo interno (reducción de la actividad de 26±7 %; p<0.01 vs basal). Conclusión. En pacientes con distensión abdominal la percepción y distensión desarrolladas en respuesta a incrementos de volumen intrabdominal son exageradas y asociadas con una distonía de la pared abdominal. - 58 - GASTROENTEROLOGY 2006;130:1062–1068 Impaired Viscerosomatic Reflexes and Abdominal-Wall Dystony Associated With Bloating FABRIZIO TREMOLATERRA,* ALBERT VILLORIA,* FERNANDO AZPIROZ,* JORDI SERRA,* SANTIAGO AGUADÉ,‡ and JUAN–R. MALAGELADA* *Digestive System Research Unit, ‡Department of Nuclear Medicine, University Hospital Vall d’Hebron, Autonomous University of Barcelona, Barcelona, Spain Background & Aims: Abdominal bloating is a frequent complaint in irritable bowel syndrome (IBS), but its underlying mechanism remains uncertain. Our aim was to determine whether the abdominal wall, specifically its adaptation to intra-abdominal volumes, plays a role. Methods: In 12 patients complaining of abdominal bloating (8 IBS and 4 functional bloating) and in 12 healthy controls, the effect of colonic gas load (24 mL/ min rectal gas infusion for 1 hour) on perception (measured by a 0 – 6 scale), abdominal girth, and muscular activity was tested. With the participants sitting on an ergonomic chair and the trunk erect, multichannel electromyography was measured via bipolar surface electrodes located over the upper and lower rectus abdominis, and the external and internal oblique bilaterally. Results: In healthy controls, colonic gas loads produced subjective symptoms (score, 3.0 ⴞ 0.3), objective abdominal distention (girth increment, 6 ⴞ 1 mm), and increased the activity of the abdominal muscles (external oblique activity, 11% ⴞ 3% in; P < .05 vs basal). At the same infused gas volumes, the patients developed significantly more symptoms (score, 4.5 ⴞ 0.4) and abdominal distention (11 ⴞ 1 mm; P < .05 vs healthy for both). These abnormal responses were associated with failed tonic contraction of the abdominal wall (external oblique activity change, ⴚ1% ⴞ 4%; P value not significant vs basal) and paradoxic relaxation of the internal oblique (activity reduction, 26% ⴞ 7%; P < .01 vs basal). Conclusions: In patients with bloating, abdominal perception and distention in response to intra-abdominal volume increments are exaggerated markedly and associated with muscular dystony of the abdominal wall. atients with irritable bowel syndrome (IBS) frequently report a sensation of bloating associated with other abdominal symptoms and believe that at times their girth becomes abnormally enlarged. Intestinal hypersensitivity and impaired handling of gut contents have been proposed as mechanisms of their subjective symptoms, but the reason for actual abdominal distention is more uncertain.1 Several studies have shown that patients complaining of bloating have impaired clearance and tolerance of intestinal gas.2– 6 Furthermore, some studies reported increased abdominal gas in IBS: the gas surface in plain abdominal radiographs was 28%– 118% larger in IBS patients than in controls.7–9 Considering that the normal volume of intestinal gas is about 200 mL,2,4,6,10,11 the extra volume in patients could elicit discomfort, but hardly would account for objective abdominal distention. Other studies failed to show increased volumes of intestinal gas in these patients.2,4,6,10,12 In this context, we developed an alternative hypothesis that would explain the mechanism of abdominal distention in the absence of a net increment in intra-abdominal volume. We postulated that distention represents an abnormal response of the abdominal wall to its content with intra-abdominal redistribution and anterior displacement. Hence, we designed an experimental study with 2 aims: (1) to determine whether patients complaining of bloating develop abnormal abdominal distention in response to a standard volume load, and (2) to show a potential mechanism for this abnormal response, specifically, abnormal activity of the abdominal muscles. To these aims, we used a previously validated experimental model of intestinal gas retention13 to compare girth and electromyographic responses of the abdominal muscles in patients with bloating and healthy controls. In this article the term bloating is used for the patient’s belief that abdominal girth has increased, and abdominal distention is used to describe an actual change in girth. P Abbreviations used in this paper: EMG, electromyography; IBS, irritable bowel syndrome. © 2006 by the American Gastroenterological Association Institute 0016-5085/06/$32.00 doi:10.1053/j.gastro.2005.12.036 April 2006 BLOATING AND ABDOMINAL–WALL DYSTONY 1063 The appropriate location of the electrodes was checked by recording EMG responses to maximal voluntary abdominal contractions (global activation of all muscular components; Figure 2), responses to sit-ups (preferential activation of upper and lower rectus abdominis), and responses to rotation of the trunk at both sides in the erect position (activation of ipsilateral internal and contralateral external oblique). Colonic Gas Load Figure 1. Abdominal EMG recording. The EMG activities of various components of the abdominal wall were measured by means of bipolar surface electrodes at both sides of the abdomen. Materials and Methods Participants Sixteen patients predominantly complaining of abdominal bloating (12 women, 4 men; age range, 18 –74 years) and 24 healthy individuals without gastrointestinal complaints (9 women, 7 men; age range, 21– 40 years) were studied; of these 40 participants, 12 patients and 12 healthy controls participated in the main study, and the other 16 participated in ancillary studies (see Experimental Design section). On a scale from 0 (none) to 4 (incapacitating), the mean score of bloating in patients was 2.7 ⫾ 0.1. By using Rome II criteria, 10 patients were classified as IBS and 6 were classified as functional bloating.14 The study protocol had been approved by the Institutional Review Board of the University Hospital Vall d’Hebron, and all participants gave written informed consent to participate in the study. Colonic gaseous filling was performed by a 60-minute continuous gas infusion at 24 mL/min (1440 mL final volume) via a balloon catheter (Foley catheter 20 F; Bard, Barcelona, Spain) introduced into the rectum and hermetically connected to a modified volumetric pump (Asid Bonz PP 50-300; Lubratronics, Unterschleissheim, Germany). To prevent rectal gas leaks, the intrarectal balloon was inflated with 5 mL of water. The gas mixture infused (88% nitrogen, 6.5% carbon dioxide, and 5.5% oxygen, bubbled into water for saturation) mimicked the partial pressures of venous blood gases to minimize diffusion across the intestinal-blood barrier.17,18 Measurement of Abdominal Girth Changes At the beginning of the experiments, a nonstretch belt was placed over the umbilicus. The overlapping ends of the belt were adjusted carefully by means of 2 elastic bands so that the belt constantly adapted to the abdominal wall. Girth measurements during the study were performed directly by means of a metric tape fixed to the belt. All measurements were performed while participants were breathing quietly and Abdominal Electromyography Electromyographic (EMG) activity was recorded at 8 different sites corresponding to the upper rectus, external oblique, lower rectus, and internal oblique at both sides of the abdomen (Figure 1).15 At each site, EMG activity was recorded by means of bipolar Ag-AgCl surface electrodes with a diameter of 1 cm (Kendall Arbo Kiddy H207PG/F; Tyco Healthcare, Barcelona, Spain) placed 4 cm apart. An abrasive paste (Everi; Spes Medica, Battipaglia, Italy) was used to reduce skin impedance. The electrodes were connected to an EMG recording system (Electromyographic System ASE 16; Prima Biomedical & Sport, Mareno di Piave, Italy). EMG activity was recorded at 1024 Hz, amplified 20,000 times, and filtered with a high-pass filter at 30 Hz and a low-pass filter at 500 Hz.16 Figure 2. Example of abdominal EMG activity. A voluntary abdominal contraction induced a marked increment in the activity of all muscular components of the abdominal wall. 1064 TREMOLATERRA ET AL were referenced to the midpoint of respiratory displacements and by averaging inspiratory and respiratory determinations over 3 consecutive respiratory excursions. Measurements were taken at 10-minute intervals without manipulation of the belt-tape assembly. Previous studies have validated the reproducibility of the measurements19 and the sensitivity of this method to detect consistently the small variations in girth induced by various experimental conditions.2–5,13 Perception Measurements Conscious perception was measured at 10-minute intervals by means of 4 graphic rating scales, each graded from 0 (no perception) to 6 (painful sensation), specifically for scoring 4 possible abdominal sensations: (1) pressure/bloating, (2) borborigmi/colicky sensation, (3) stingy sensation, and (4) other type of sensation (to be specified), respectively. The questionnaire included an additional scale to score rectal perception, and the one presented to patients also had a tick box (yes/no) to signal the replicability of customary symptoms. The location of the perceived sensations was marked on an abdominal diagram divided into 9 regions corresponding to the epigastrium, periumbilical area, hypogastrium, both hypochondria, flanks, and iliac fossae. Participants were instructed to report the sensations perceived over the preceding 10minute period in the scales.2,3,20 –22 Procedure Participants (both patients and healthy controls) were instructed to eat a low-flatulogenic diet for the 2 preceding days. After an 8-hour fast the rectal catheter and the abdominal EMG surface electrodes were positioned (Figure 1). First, postural changes of the abdominal muscles were studied by comparing the EMG activity recorded for 20-second periods in duplicate at 2-minute intervals in supine rest and in the erect position with the participants relaxed and sitting on an ergonomic chair. Thereafter, the responses to colonic gas loads were studied with the participants sitting on the ergonomic chair with the trunk erect, EMG activity was continuously recorded, first, during a 30-minute basal period, and subsequently, during 60-minute colonic gas filling. Ancillary studies. Studies without colonic gas load. To rule out potential time effects of prolonged erect position on abdominal-wall activity, abdominal EMG activity was recorded continuously for 90 minutes with the participants sitting on the ergonomic chair without colonic gas infusion. Scintigraphic study. To map the intraluminal distribution of the colonic gas load, the gas infused was labeled with 2 mL 133Xe (74 MBq). During the 60-minute gas-infusion period, anterior and posterior abdominal scans were obtained simultaneously at 60-second intervals using a dual-head, large field of view gamma camera with high-energy collimators (Helix; General Electric-Elscint, Haifa, Israel). Experimental Design Twelve patients (9 women, 3 men) and 12 healthy controls (8 women, 4 men) participated in the main studies GASTROENTEROLOGY Vol. 130, No. 4 (postural activity and responses to gut distention). Eight additional healthy controls (4 women, 4 men) were studied without colonic gas infusion. Another 4 patients (3 women, 1 man) and 4 healthy controls (1 woman, 3 men) participated in the ancillary scintigraphic study. Data Analysis Girth changes were referred to girth measurements at the start of the basal period. The intensity of abdominal perception was measured by the scores rated in the scales at each time interval during the study (using the highest score when more than 1 sensation was rated simultaneously). In each participant we also counted the number of times each abdominal sensation was scored to calculate the frequency of each specific sensation. EMG activity was measured at 10-minute intervals as the average root mean square voltage23 recorded at each specific muscle over 2-minute periods and was expressed as the percent change from basal activity. Scintigraphic images were analyzed by a region-of-interest program.22 In each study, 5 regions of interest were defined as the largest region excluding areas of overlap that encompassed, respectively, the small bowel, cecum, hepatic flexure, splenic flexure, and rectosigma. Depth corrections were performed by calculating the geometric mean of anterior and posterior scans. The activity measured in each region was divided by its surface for normalization. The activity in each region was expressed as the percent of total activity (sum in all 5 regions). Statistical Analysis In each group of participants we calculated the mean values (⫾SE) of the parameters measured. The Kolmogorov– Smirnov test was used to check the normality of data distribution. Comparisons of parametric, normally distributed data were performed by the Student t test, paired tests for intragroup comparisons, and unpaired tests for intergroup comparisons; otherwise the Wilcoxon signed-rank test was used for paired data and the Mann–Whitney U test was used for unpaired data. The Bonferroni correction was applied for multiple comparisons (right vs left). Correlations of various parameters were performed by linear regression analysis. The location of sensations over the abdomen and symptom distribution were compared by the 2 test. Differences in regional radioactivity distribution in the scintigraphic images were compared by the Wilcoxon signed-rank test. Results No differences in body weight or height were found between patients and healthy controls, and abdominal circumference before the start of the study was similar in both groups (843 ⫾ 43 mm vs 795 ⫾ 20 mm, respectively; P value not significant). Because no lateral predominance in abdominal EMG activity was observed, the right and left activity recorded at each muscular site was averaged and pooled data are reported. During vol- April 2006 Figure 3. Postural adaptation. The erect position increased the basal activity of the internal oblique to a similar level in patients and healthy controls. □, Patients; ●, healthy controls; *, P ⬍ .05 vs supine. untary abdominal contractions the EMG activity increased to a level somewhat lower in patients than in healthy controls, but this difference was statistically significant only for the internal oblique during ipsilateral rotation of the trunk (55 ⫾ 10 v vs 97 ⫾ 17 v in healthy controls; P ⬍ .05). Postural Activity In the supine position, no differences in basal activity were observed between patients and healthy controls (Figure 3). The activity of the internal oblique significantly increased when the participant adopted the erect position, and this increment was similar in patients and healthy controls (Figure 3). Responses to Gut Distention Abdominal distention and symptoms. Compared with healthy controls, standard colonic loads in patients produced significantly more perception (score, 4.5 ⫾ 0.4 vs 3.0 ⫾ 0.3; P ⬍ .05) and objective abdominal distention (11 ⫾ 1 mm vs 6 ⫾ 1 mm; P ⬍ BLOATING AND ABDOMINAL–WALL DYSTONY 1065 .05). In 53% ⫾ 6% of the occasions during colonic gas infusion the participants reported more than 1 sensation perceived simultaneously; pressure/bloating, borborigmi/colicky sensation, and stingy sensation were reported similarly by patients in 89% ⫾ 5%, 54% ⫾ 7%, and 20% ⫾ 8% of the occasions, respectively, and by healthy controls in 90% ⫾ 4%, 54% ⫾ 12%, and 20% ⫾ 8%, respectively. Symptoms were localized in the abdominal midline over the hypogastrium, periumbilical region, and the epigastrium both in patients (75% ⫾ 8%, 67% ⫾ 10%, and 41% ⫾ 8%, respectively) and controls (60% ⫾ 10%, 62% ⫾ 10%, and 28% ⫾ 11%, respectively). The extension of the referral area was larger in patients than in healthy controls, but the differences did not reach statistical significance (74% ⫾ 7% and 53% ⫾ 2% of symptoms were referred over more than 2 areas, respectively). In 81% ⫾ 10% of the occasions, sensations were recognized by the patients as their customary complaints. Muscular activity of the abdominal wall. In healthy controls the colonic gas load was associated with a significant increment in EMG activity of all abdominal muscles but the internal oblique (Figure 4). These EMG changes were not attributable to time effects of prolonged erect position because no significant increment was observed in the studies without gas infusion (3% ⫾ 4% activity change in the superior rectus, ⫺4% ⫾ 10% in the inferior rectus, 19% ⫾ 23% in the external oblique, and ⫺27% ⫾ 9% in the internal oblique). The response to colonic gas load was impaired markedly in patients who failed to develop significant increments in the lower rectus and external oblique and who furthermore showed a significant inhibition of the internal oblique during colonic gas infusion (Figure 4). Patients were older than healthy controls, but age did not explain the differences found because the muscular responses in the younger half of the patients (ⱕ45 y) were not significantly different than in the older half (⬎45 y). In patients, the degree of inhibition of the internal oblique correlated with the increment of abdominal girth (Figure 5), but not with the increment in perception score (r ⫽ 0.002; P ⫽ .9). Colonic gas distribution. The intracolonic gas distribution through the rectosigma, splenic flexure, hepatic flexure, and cecum was similar in patients (45% ⫾ 11%, 18% ⫾ 3%, 24% ⫾ 8%, and 13% ⫾ 8%, respectively) and healthy controls (50% ⫾ 8%, 17% ⫾ 2%, 19% ⫾ 7%, and 14% ⫾ 7%, respectively; P value was not significant vs patients), without detectable gas reflux into the small bowel. 1066 TREMOLATERRA ET AL GASTROENTEROLOGY Vol. 130, No. 4 gated the response of the abdominal muscles to intraabdominal volume increments. First, we were able to show that healthy controls adapt to intra-abdominal volume loads by increasing the muscular activity of the abdominal wall. The EMG response detected probably reflects a tone increment in the abdominal muscles that control expansion. This adaptive response likely is mediated by viscerosomatic reflexes, which have been characterized in experimental animal models.24 Interestingly, we found that patients complaining of bloating show impaired abdominal contraction in response to colonic gas loads and even a paradoxic relaxation of the internal oblique. Our data further show that the decrease in activity of the internal oblique correlated with increments in girth, suggesting that the faulty response would favor an exaggerated protrusion of the anterior abdominal wall in response to standard volume loads. Previous studies have suggested that patients with abdominal distention may have weak abdominal mus- Figure 4. Responses of abdominal muscles to standard intra-abdominal volume load. In healthy controls the volume load induced significant contraction of all abdominal muscles, except the internal oblique. Patients showed an abnormal adaptive response with impaired contraction of the lower rectus and external oblique, and paradoxic relaxation of the internal oblique. □, Patients; , healthy controls; *, P ⬍ .05 vs basal. Discussion We have shown that the activity of the abdominal musculature adapted to intra-abdominal content, that this modulatory mechanism fails in patients complaining of bloating, and that the faulty muscular response is associated with exaggerated abdominal distention in response to intra-abdominal volume loads. These data provide experimental evidence in support of the patients’ claims by showing that they are prone to abdominal distention caused by abdominal-wall dystony. We used an experimental model that incorporates a standard intra-abdominal volume load to determine whether the girth increment was similar in patients and healthy controls. Interestingly, the same volume load produced significantly more abdominal distention in patients with bloating. In the short term, the configuration of the anterior abdominal wall is determined by the balance between intra-abdominal forces and the activity of the various muscular components of the wall.1 Hence, further testing our working hypothesis, we also investi- Figure 5. Relationship between relaxation of the internal oblique and abdominal distention in response to colonic gas load. April 2006 cles.25 A later study using an EMG recording of the abdominal wall26 showed no differences in basal activity either in the erect or supine positions between bloating patients and healthy controls,26 and the present study confirms these data. We have shown that the adaptation of the abdominal wall to posture is similar in patients and controls, and this change primarily affects the internal oblique, whose function is to counterbalance gravitational forces and provide support for abdominal contents.27 However, when a much more potent contraction of the internal oblique is elicited by ipsilateral rotation of the trunk, EMG activity is lower in patients than in healthy controls. The significance of these data cannot be ascertained because the maneuvers to activate abdominal muscles cannot be standardized reliably. Patients not only showed a faulty adaptation of the abdominal wall and excessive abdominal distention in response to the intra-abdominal volume load, but also reported significantly more abdominal complaints. Of note, the perceived sensations replicated their customary symptoms, and most patients described them as abdominal fullness/bloating. The question is: where do these sensations originate from? The distribution of the gaseous load in the colon was similar in patients and controls. Abdominal perception did not correlate with changes in abdominal-wall activity. Hence, increased perception probably was related to the gut hypersensitivity that is characteristic of IBS.21 However, we cannot rule out that in cases of pronounced distention, the abdominal wall may contribute to the bloating sensation. The changes in girth induced by the colonic gas load in patients (⯝1 cm) were similar to those previously observed under other experimental conditions2–5,28 but were relatively small, equivalent to a clinically mild or even subclinical episode of abdominal distention. Indeed, the severity of clinical bloating is variable, and our patients were not at the top of the scale (they scored their customary bloating as 2.7 on a scale of 0 – 4). The precise circumstances that trigger the clinically severe episodes of visible distention have not been well characterized29 and have not been reproduced experimentally in the laboratory to date. Several abnormalities have been detected that may play a role in the development of abdominal distention. Gas transit studies have shown nicely that patients complaining of bloating have impaired clearance and reduced tolerance of intraluminal gas loads.2,3 This dysfunction predominantly affects the small bowel,5 and is related to abnormal reflex control of gas propulsion.3 Impaired handling of gut contents may result in segmental pooling and focal gut distention, which may induce abnormal viscerosomatic reflexes, leading to abdominal distention. BLOATING AND ABDOMINAL–WALL DYSTONY 1067 On the other hand, subjective symptoms in these patients may originate from the intraluminal stimulus in a hypersensitive gut and/or from the distended abdominal wall itself, as discussed earlier. Conscious sensations arising from the gut also could induce abdominal distention via abnormal behavioral responses. Gas was used in the present and in previous studies to investigate the pathophysiology of abdominal bloating and distention, but this does not imply that gas is the offending element; indeed, other intraluminal components, including chyme and endogenous secretions, also may induce abnormal responses and symptoms. Abdominal bloating probably represents a heterogeneous condition produced by a combination of pathophysiologic mechanisms that may differ among individual patients. The present data add a new perspective to this puzzle by showing that abnormal viscerosomatic responses are an important component of the disease mechanism of distention. References 1. Azpiroz F, Malagelada J-R. Abdominal bloating. Gastroenterology 2005;129:1060 –1078. 2. Caldarella MP, Serra J, Azpiroz F, Malagelada J-R. Prokinetic effects of neostigmine in patients with intestinal gas retention. Gastroenterology 2002;122:1748 –1755. 3. Serra J, Salvioli B, Azpiroz F, Malagelada J-R. Lipid-induced intestinal gas retention in the irritable bowel syndrome. Gastroenterology 2002;123:700 –706. 4. Serra J, Azpiroz F, Malagelada J-R. Impaired transit and tolerance of intestinal gas in the irritable bowel syndrome. Gut 2001;48: 14 –19. 5. Salvioli B, Serra J, Azpiroz F, Lorenzo C, Aguade S, Castell J, Malagelada J-R. Origin of gas retention and symptoms in patients with bloating. Gastroenterology 2005;128:574 –579. 6. Lasser RB, Bond JH, Levitt MD. The role of intestinal gas in functional abdominal pain. N Engl J Med 1975;293:524 –526. 7. Poynard T, Hernandez M, Xu P, Couturier D, Frexinos J, Bommelaer G, Benand-Agostini H, Chaput JC, Rheims N. Visible abdominal distention and gas surface: description of an automatic method of evaluation and application to patients with irritable bowel syndrome and dyspepsia. Eur J Gastroenterol Hepatol 1992;4:831– 836. 8. Chami TN, Schuster MM, Bohlman ME, Pulliam TJ, Kamal N, Whitehead WE. A simple radiologic method to estimate the quantity of bowel gas. Am J Gastroenterol 1991;86:599 – 602. 9. Koide A, Yamaguchi T, Odaka T, Koyama H, Tsuyuguchi T, Kitahara H, Ohto M, Saisho H. Quantitative analysis of bowel gas using plain abdominal radiograph in patients with irritable bowel syndrome. Am J Gastroenterol 2000;95:1735–1741. 10. Lasser RB, Levitt MD, Bond JH. Studies of intestinal gas after ingestion of a standard meal. Gastroenterology 1976;70:A906. 11. Accarino AM, Quiroga S, Azpiroz F, Perez F, Alvarez-Castells A, Malagelada JR. Changes in intestinal gas during early digestion evidenced by a new CT analysis program. Gastroenterology 2005;128:A672. 12. Maxton DG, Martin DF, Whorwell P, Godfrey M. Abdominal distention in female patients with irritable bowel syndrome: exploration of possible mechanisms. Gut 1991;32:662– 664. 1068 TREMOLATERRA ET AL 13. Harder H, Serra J, Azpiroz F, Passos MC, Aguadé S, Malagelada J-R. Intestinal gas distribution determines abdominal symptoms. Gut 2003;52:1708 –1713. 14. Thompson WG, Longstreth G, Drossman DA, Heaton K, Irvine EJ, Muller-Lissner SC. Functional bowel disorders and D. Functional abdominal pain. In: Drossman DA, Corazziari E, Talley NJ, Thompson WG, Whitehead WE, eds. The functional gastrointestinal disorders. 2nd ed. McLean, VA: Degnon Associates, 2000:351– 432. 15. Ng JK, Kippers V, Richardson CA. Muscle fibre orientation of abdominal muscles and suggested surface EMG electrode positions. Electromyogr Clin Neurophysiol 1998;38:51–58. 16. Redfern MS, Hughes RE, Chaffin DB. High-pass filtering to remove electrocardiographic interference from torso EMG recordings. Clin Biomed 1993;8:44 – 48. 17. Foster RE. Physiological basis of gas exchange in the gut. Ann N Y Acad Sci 1968;150:4 –12. 18. Pogrund RS, Steggerda FR. Influence of gaseous transfer between the colon and blood stream on percentage gas compositions of intestinal flatus in man. Am J Physiol 1948;153:475– 482. 19. Serra J, Azpiroz F, Malagelada J-R. Intestinal gas dynamics and tolerance in humans. Gastroenterology 1998;115:542–550. 20. Gracely R. Studies of pain in normal man. In: Wall PMR, ed. Textbook of pain. Edinburgh: Churchill Livingstone, 1994:315– 336. 21. Azpiroz F. Gastrointestinal perception: pathophysiological implications. Neurogastroenterol Motil 2002;14:229 –239. 22. Harder H, Serra J, Azpiroz F, Malagelada J-R. Reflex control of intestinal gas dynamics and tolerance in humans. Am J Physiol 2004;286:G89 –G94. 23. Hägg GM, Melin B, Kadefors R. Applications in ergonomics. In: Merletti RPP, ed. Electromyography, physiology, engineering, and noninvasive applications. Hoboken, NJ: John Wiley & Sons, Inc, 2004:343–363. GASTROENTEROLOGY Vol. 130, No. 4 24. Martinez V, Thakur S, Mogil J. Differential effects of chemical and mechanical colonic irritation on behavioral pain response to intraperitoneal acetic acid in mice. Pain 1999;81:179 –186. 25. Sullivan SN. A prospective study of unexplained visible abdominal bloating. N Z Med J 1994;1:428 – 430. 26. McManis PG, Newall D, Talley NJ. Abdominal wall muscle activity in irritable bowel syndrome with bloating. Am J Gastroenterol 2001;96:1139 –1142. 27. De Troyer A. Mechanical role of the abdominal muscles in relation to posture. Respir Physiol 1983;53:341–353. 28. Passos MC, Tremolaterra F, Serra J, Azpiroz F, Malagelada J-R. Impaired reflex control of intestinal gas transit in patients with abdominal bloating. Gut 2005;54:344 –348. 29. Alvarez W. Hysterical type of nongaseous abdominal bloating. Arch Intern Med 1949;84:217–245. Received May 19, 2005. Accepted December 14, 2005. Address requests for reprints to: Fernando Azpiroz, MD, Digestive System Research Unit, Hospital General Vall d’Hebron, 08035 Barcelona, Spain. e-mail: [email protected]; fax: (34) 93-48944-56. Present affiliation of F.T.: Gastroenterology Department, Azienda Ospedaliera Policlinico, Universita Federico II, Naples, Italy. Supported in part by the Spanish Ministry of Education (Dirección General de Enseñanza Superior del Ministerio de Educación y Cultura, BFI 2002-03413), Instituto de Salud Carlos III (grants 02/3036 and CO3/02), Generalitat de Catalunya (Direcció General de Recerca 1998SGR-00113), and National Institutes of Health (grant DK 57064). Also supported by a scholarship from the Spanish Ministry of Health (ISC III 02/3036 to J.S.) and by a scholarship from the Spanish Ministry of Health (Ayuda para contratos post Formación Sanitaria Especializada, ISC III 300051 to A.V.). The authors thank Anna Aparici and Maite Casaus for technical support, and Gloria Santaliestra for secretarial assistance. Publicaciones Objetivos 4.2 Publicación 2 Autores: Albert Villoria, Fernando Azpiroz, Alfredo Soldevilla, Frederic Perez, y Juan-R. Malagelada. Título: Acomodación abdominal: adaptación coordinada de las paredes abdominales a su contenido. Revista: Am J Gastroenterol 2008; 103: 2807–2815. Factor Impacto: 6,44 Antecedentes y objetivos. Tal y como hemos demostrado en estudios previos, la infusión de gas en el colon produce un incremento del perímetro abdominal y modifica la actividad muscular de la pared anterior del abdomen. En base a esto, nuestra hipótesis fue que la acomodación abdominal a una carga de volumen, es un proceso activo relacionado con una actividad coordinada de la pared anterior del abdomen y del diafragma. Métodos. Para incrementar el volumen intraabdominal en sujetos sanos, se infundió gas en el colon durante 1 hora (1440 ml). Durante la infusión, se midió el perímetro abdominal (mediante una cinta métrica), la actividad electromiográfica (EMG) de la pared anterior del abdomen a través de electrodos de superficie bipolares y la actividad muscular del diafragma mediante una sonda esofágica que incorporaba 6 electrodos anulares. Tras la realización de estudios de viabilidad (n=12), se midió la actividad postural (n=6) y las respuestas a la sobrecarga de gas en el colon, tanto en sujetos en bipedestación (n=8) como en supino (n=8). Finalmente se realizó un análisis morfovolumétrico mediante tomografía axial computerizada (n=8). Resultados. Los sujetos en bipedestación presentaron un aumento de la actividad tónica muscular de la pared anterior abdominal y una disminución de la actividad - 59 - Publicaciones Objetivos diafragmática con respecto a los sujetos en supino. La infusión de gas en los sujetos en bipedestación indujo una relajación diafragmática (21±3 %; p<0.05) y una contracción de la pared anterior (16±4 % incremento de EMG; p<0.05). Por el contrario en los sujetos en supino, se indujo una contracción de la actividad del diafragma (16±6 %; p<0.05) mientras que la pared anterior, debido a su ausencia de actividad tónica, no mostró cambios significativos (3±2 %; p no significativa). La infusión de gas se asoció con un aumento del perímetro abdominal (7,3±1.0 mm en los sujetos en bipedestación y 8,6±1,4 mm en los sujetos en supino) y un ascenso del diafragma (17,3±5,2 mm en supino; p<0,05). Conclusión. El grado de distensión abdominal producido por el incremento de volumen intrabadominal viene determinado por una respuesta muscular abdominofrénica dependiente de la postura corporal. - 60 - American Journal of Gastroenterology C 2008 by Am. Coll. of Gastroenterology Published by Blackwell Publishing ISSN 0002-9270 doi: 10.1111/j.1572-0241.2008.02141.x ORIGINAL CONTRIBUTIONS Functional GI Abdominal Accommodation: A Coordinated Adaptation of the Abdominal Wall to Its Content Albert Villoria, M.D.,1 Fernando Azpiroz, M.D.,1 Alfredo Soldevilla, E.Eng.,2 Frederic Perez, Ph.D.,1 and Juan-Ramon Malagelada, M.D.1 1 Digestive System Research Unit, University Hospital Vall d’Hebron; Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (Ciberehd); Department of Medicine, Autonomous University of Barcelona, Barcelona, Spain; and 2 Department of Physics, Polytechnic University of Catalonia, Barcelona, Spain BACKGROUND: AND AIM: We previously showed that colonic gas infusion increases the girth and modifies the muscular activity of the anterior abdominal wall. We hypothesized that abdominal accommodation to volume loads is an active process instrumented by the coordinated activity of the anterior wall and the diaphragm. METHODS: To increase intraabdominal volume in healthy subjects, a gas was infused into the colon (1.44 L in 1 h) while measuring girth (by tape measure) and electromyography (EMG) activity of the anterior wall (via four pairs of surface electrodes) and the diaphragm (via six ring electrodes over an esophageal tube in the hiatus). After preliminary feasibility studies (N = 12), postural activity (N = 6) and responses to colonic gas loads, both with the trunk erect (N = 8) and in supine position (N = 8), were studied. A morphometric analysis was performed by computed tomography, image analysis (N = 8). RESULTS: In the erect position, anterior wall tone was higher and diaphragmatic tone was lower than in the supine position. With the trunk erect, gas infusion induced diaphragmatic relaxation (by 21 ± 3%; P < 0.05) and anterior wall contraction (16 ± 4% EMG increment; P < 0.05). By contrast, in the supine position, it induced diaphragmatic contraction (15 ± 6%, P < 0.05), while the anterior wall, in the absence of postural tone, showed no change (3 ± 2%, NS). Gas infusion was associated with girth increase (7.3 ± 1.0 mm with the trunk erect and 8.6 ± 1.4 mm in the supine position) and diaphragmatic ascent (17.6 ± 5.2 mm; P < 0.05). CONCLUSION: The degree of abdominal distension produced by intraabdominal volume increments results from posture-related abdomino-phrenic muscular responses. (Am J Gastroenterol 2008;103:2807–2815) INTRODUCTION In clinical practice, many patients complain of abdominal distension; however, despite its clinical significance, the mechanisms leading to distension are poorly understood (1, 2). The intraabdominal volume changes in physiologic conditions and in various disease states, so that the abdomen behaves as an adaptable reservoir. However, the relationship between the abdominal walls and its content, whether passive viscoelastic adaptation or active neuromuscular accommodation, has not been systematically studied. We recently showed that, in healthy subjects with the trunk erect, an increment in intraabdominal volume, using an experimental model of colonic gas infusion, increases girth and induces muscular contraction of the anterior abdominal wall (3). In patients complaining of abdominal dis- tension, this contraction is impaired, and with the same volume load, the girth increase is significantly larger (3). These preliminary data suggest that the muscular activity of the anterior abdominal wall in response to intraabdominal volume increments controls girth: wall contraction prevents excessive distension. However, from a mechanical viewpoint, the gas infused must occupy space somewhere; therefore, if in healthy subjects the anterior wall expands only to a limited extent, where is the rest of the volume load accommodated? As opposed to the posterior and pelvic abdominal structures, the diaphragm is a muscular wall that has been primarily related to the control of chest/lung volumes and respiration, but that may also participate in the regulation of abdominal capacity and the accommodation of intraabdominal volume loads. Hence, we developed an original hypothesis that envisions abdominal accommodation to volume loads as an active 2807 2808 Villoria et al. process instrumented by the coordinated activity of the two major muscular components of the abdominal cavity: the anterior wall and the diaphragm. This hypothesis was tested by a carefully designed series of studies with specific aims, as follows. In a first set of feasibility studies, we determined whether the diaphragm participates actively in the accommodation process. In a second series of studies using simultaneous electromyography (EMG) measurements, we correlated the responses of the anterior abdominal wall and the diaphragm to colonic gas loads under different conditions. In a third set of experiments, the morphometric response of the abdominal walls to colonic gas loads was measured using an original computed tomography (CT) image analysis program recently developed in our laboratory (4). MATERIAL AND METHODS Participants Forty-two healthy subjects with the following characteristics were studied: 17 women, 25 men; age (median [range]) 25 (20–37) yr; height 172 (155–190) cm; weight 68 (47–85) kg; body mass index 24 (18–27) kg/m2 in men and 20 (18–23) kg/m2 in women; and girth 82 (71–96) cm. The participants were recruited by public advertising among university students. They had no known disease, were not taking any medication, and had normal bowel habit. Before entry into the study, the absence of gastrointestinal symptoms was verified using a standardized abdominal symptoms questionnaire, as conducted previously by us (3–7). The study protocol was approved by the institutional review board of the University Hospital Vall d’Hebron, and all subjects gave their written informed consent to participate in the study. EMG of the Abdominal Walls The muscular activity of the abdominal walls, both of the diaphragm and of the anterior wall, was recorded by EMG (Electromyographic System ASE 16; PRIMA Biomedical & Sport, Mareno di Piave, Italy) at 1,024 Hz, amplified 20,000 times, and filtered with a high-pass filter at 30 Hz and a lowpass filter at 500 Hz (8). Diaphragmatic EMG activity was measured via intraesophageal electrodes mounted over a probe. The probe consisted of a polyvinyl tube (5 mm outside diameter, 3 mm inside diameter) with six ring electrodes, 5-mm wide, at 15-mm intervals. The electrodes were made using a pen dispenser for drawing highly conductive silver traces (Conductive Pen; Chemtronics, Leeds, United Kingdom). The electrodes were connected by insulated copper wires (200 µm in diameter) running through the lumen of the tube to external plugs. After oral intubation, the radio-opaque electrodes were positioned across the diaphragmatic hiatus under fluoroscopic control with the subjects in the same position as in the subsequent study (see below). Except in the first set of feasibility studies (see Experimental Design), bipolar EMG activity was recorded from contiguous electrodes. The position Figure 1. Example of diaphragmatic EMG activity. Inspiratory contractions and marked EMG increment during a Valsalva maneuver are best recorded in channel 4, fluoroscopically located at the diaphragmatic hiatus. of the electrodes was rechecked (and adjusted if necessary) by recording the responses to a Valsalva maneuver (Fig. 1). Cardiac activity was superimposed on the diaphragmatic EMG signal: to prevent electrocardiographic artifacts, 0.2-s intervals were removed from the diaphragmatic EMG signal around each QRS peak using a specifically developed digital filter. The activity of the anterior abdominal wall at the right side was recorded from bipolar electrodes (Kendall Arbo Kiddy H207PG/F; Tyco Healthcare, Barcelona, Spain) at four different sites: the upper rectus, external oblique, lower rectus, and internal oblique of the abdomen (3, 9). The appropriate location of the anterior wall electrodes was checked by recording EMG responses to sit-ups (preferential activation of upper and lower rectus) and responses to rotation of the trunk (activation of ipsilateral internal and contralateral external oblique). Colonic Gas Load A gas mixture (88% nitrogen, 6.5% carbon dioxide, and 5.5% oxygen) mimicking the partial pressures of venous blood gases (10, 11) was infused into the colon at 24 mL/min for 60 min (final volume 1,440 mL) via a rectal catheter (Foley catheter, 20-F; Bard, Barcelona, Spain), as described previously (3, 12) Girth Measurement The method was previously described in detail (3). Briefly, a nonstretch belt (48-mm wide) was placed over the umbilicus and fixed to the skin on the back to prevent slipping. Abdominal Accommodation The overlapping ends of the belt were adjusted carefully by two elastic bands so that the belt constantly adapted to the abdominal wall. Girth measurements during the study were taken directly with a metric tape measure fixed to the belt. The measurements were taken at 10-min intervals without manipulation of the belt-tape assembly. Previous studies validated the reproducibility of the measurements and the sensitivity of this method to consistently detect the small variations in girth induced by various experimental conditions (3, 5, 6, 12–14). Perception Measurement Abdominal perception was measured by graphic rating scales graded from 0 (no perception) to 6 (painful sensation). Independent scales were used for scoring: (a) pressure/bloating, (b) cramp/rumbling sensation, (c) puncture/stinging sensation, and (d) other type of sensation (to be specified). The location of the sensations (epigastrium, periumbilical area, hypogastrium, both hypochondria, flanks, and iliac fossae) was marked on an abdominal diagram. During the study, the participants, previously instructed, were asked to score the sensations perceived during the preceding 10-min period (one or more sensations simultaneously) on the scales. This method has been extensively used and previously validated in detail (3, 7, 12, 13, 15). Procedure To prevent excessive colonic fermentation and gas formation, the participants were instructed to follow a diet excluding legumes, vegetables, garlic, onions, nuts, cereals, whole-meal bread, and fizzy drinks during the 2 days prior to the study. The night before the study, they were permitted a light dinner. Meat, fish, eggs, rice, pasta, and/or white bread were allowed, whereas dairy products, salad, fruit, and alcoholic beverages were prohibited (3, 7). The participants were instructed to fast for 8 h before the study. After the preparatory procedures, a 10-min equilibration period was allowed. Perception, girth, and EMG activity were measured during a 20-min basal period and during a 60-min colonic gas filling. The studies were performed with the participants lying supine on a hospital bed or sitting with the trunk erect on an ergonomic chair (3, 16, 17). The back of the chair was adjusted to the lumbar area to fix the curvature of the spine. Valsalva maneuvers were performed at the beginning of each experiment. Experimental Design FEASIBILITY STUDIES. In a first set of studies, the diaphragmatic response to colonic gas infusion was assessed in a group of subjects (N = 8; 2 women and 6 men) sitting with the trunk erect on the ergonomic chair. In these studies, 15 bipolar combinations were recorded from the six intraluminal electrodes to determine the effect of interelectrode distance and position on diaphragmatic EMG recording. Fluoroscopic imaging of the upper abdomen (BV25; Philips, Eindhoven, The Netherlands) was performed before and after colonic gas infusion in the same position (trunk erect) as during the 2809 experiment, and paper prints were obtained for a later morphometric analysis (see Data Analysis). In four additional healthy subjects (2 women and 2 men), the diaphragmatic EMG activity was measured following the same protocol, but without colonic gas infusion, to rule out potential time effects of a prolonged erect position. RESPONSES TO COLONIC GAS LOADS. In a second set of studies, combined recordings of the anterior wall and the diaphragm in response to colonic gas load were taken in the supine position (N = 8; 1 woman and 7 men) and with the trunk erect (N = 8; 4 women and 4 men); each subject was studied in only one position. POSTURAL ACTIVITY. The effect of posture and gravity on the abdominal walls was evaluated in an additional group of subjects (N = 6; 4 women and 2 men) by recording the anterior wall and diaphragmatic EMG activity with the trunk erect and in the supine position. ABDOMINAL IMAGING. In a separate study set (N = 8; 4 women and 4 men), the morphometric response of the abdominal walls to colonic gas infusion was investigated. CT scans were obtained in the supine position before and after colonic gas infusion of the same volume load as in the main experiments. Abdominal CT scans were obtained with a helical multislice CT scanner (Mx8000; Philips Medical Systems, Best, The Netherlands) with the following specifications: exposure of 120 kV and 50 mAs, 2.5-mm section thickness, reconstruction at 1.6-mm intervals, 1.5 pitch ratio, and 512 × 512 acquisition matrix (4). Data Analysis LOCATION OF THE DIAPHRAGMATIC HIATUS. To detect putative displacements of the diaphragmatic hiatus over the recording electrodes during the study, EMG recording of tidal respiration was measured at each recording lead (root mean square voltage averaged over a 30-s period) at the beginning and end of each experiment (3, 18). RESPONSES TO COLONIC GAS LOAD. The changes in the girth were referenced to girth measurements at the start of the basal period. The intensity of abdominal perception was measured by the scores rated on the scales at each time interval during the study (using the highest score when more than one sensation was simultaneously rated). The EMG activity was measured at 10-min intervals as the root mean square voltage (3, 18) averaged over 1-min periods. The diaphragmatic activity was measured at each recording lead, and the activity recorded by the best two channels was averaged. POSTURAL ACTIVITY. In each position (trunk erect and supine), the diaphragmatic and the anterior wall EMG activity were measured as the root mean square voltage averaged over 30-s periods. 2810 Villoria et al. MORPHOMETRIC ANALYSIS. In the fluoroscopic images taken before and after colonic gas infusion (see feasibility studies), the position of the diaphragm was determined by measuring the distance in the vertical axis from the left diaphragmatic dome to an external radio-opaque marker fixed on the skin over T10 . In each subject, the length measurements were referenced to the mean value of the vertebral bodies depicted in the fluoroscopic print, as we did previously (16). Abdominal CT image analysis was performed using a software program developed in our laboratory (4). In each scan, the abdominal girth and the position of the diaphragmatic domes were measured. The girth was measured by averaging the perimeter of the abdominal surface measured in 10 axial slices 4 mm apart, starting tangentially to the iliac crest in the cephalic direction. At each site, the girth was measured as the length of a polyline (series of connected segments) following the body contour. The position of the diaphragm was measured as the distance (in the vertical axis) between the left diaphragmatic dome and the line connecting the ileac crests. These measurements were expressed as an absolute value (in cm) and were also referenced to the mean value of the three contiguous vertebral bodies, following the same method as for the fluoroscopic measurements. Lumbar lordosis was measured in the sagittal plane as the angle between lines perpendicular to the cranial end-plate of L1 and the caudal end-plate of L5 (4, 19). Statistical Analysis The sample size was calculated based on previous data (3), anticipating a 20% EMG activity change, with a power of 80% and a significance level of 5% (2-sided). In each subject, the parameters measured during the last 20 min of the colonic gas infusion were averaged, and the grand mean values in the group of subjects (± standard error [SE]) were calculated. The Kolmogorov-Smirnov test was used to check the normality of data distribution. Intragroup comparisons were made by a paired analysis, for example, postural activity, and intergroup comparisons by an unpaired analysis, for example, responses to colonic gas loads with the trunk erect versus the supine position. Parametric normally distributed data were compared by Student’s t-test for paired or unpaired data; otherwise, the Wilcoxon signed-rank test was used for paired data, and the Mann-Whitney U-test for unpaired data. Correlations of paired parameters were performed by a linear regression analysis. A univariate linear regression analysis was used to predict gender effects on abdominal and diaphragmatic EMG activity. The location of sensations over the abdomen and the symptom distribution were compared by the χ 2 test. A P value < 0.05 was considered significant for all statistical analyses. RESULTS Reliability of Diaphragmatic EMG Recording Recordings from multiple bipolar combinations indicated that an interelectrode distance of 1 cm (contiguous electrodes) Figure 2. Diaphragmatic EMG recording of a Valsalva maneuver. The activity at the best recording lead (∗; N = 16 in upright position) and at the adjacent ones was averaged (± SE). Note declining activity in cranial and caudal direction. provided the best EMG recordings of respiratory activity and of the responses to Valsalva maneuver and colonic gas infusion. The response to gas infusion recorded with 2.5-cm, 4-cm, 5.5-cm, and 7-cm interelectrode distances was 9%, 19%, 42%, and 74%, respectively, lower than that recorded with 1-cm interelectrode distance. EMG activity recorded at contiguous leads showed that both tidal respiration and the response to a Valsalva maneuver were best detected at one channel (strongest signal); in each subject, we determined the channel that best recorded the diaphragmatic signal: in the leads located cranially and caudally to this site, the recording signal became weaker (Fig. 2). The location of the strongest signal (best recording site) was the same for tidal respiration and the Valsalva maneuver, and did not change from the beginning to the end of the experiment (Fig. 3). With the trunk erect, colonic gas infusion was associated with inhibition of the diaphragmatic activity. Significant inhibition was already achieved with 480 mL (20-min infusion) and increased up to 21 ± 3% (mean during the last 20-min infusion period; N = 16; see below). The diaphragmatic response to colonic gas infusion was best recorded at the same site as the Valsalva maneuver and respiration (Fig. 3), and this response was also progressively blurred both in cranial and caudal directions (the response to gas infusion recorded in 1 cm oral and 1 cm caudal directions was 59% and 62%, respectively, lower than that at the best recording site). The diaphragmatic response to colonic gas loads was similar, regardless of whether diaphragmatic activity was recorded alone in the feasibility studies (8.5 ± 0.8 µV vs 10.6 ± 1.0 µV basal; P < 0.01; N = 8) or concomitantly with anterior wall recording in the studies measuring the response to colonic gas load with the trunk erect (8.4 ± 0.3 µV vs 11.1 ± 0.8 µV basal; P < 0.01; N = 8). These EMG changes were not attributable to the time effects of a prolonged erect position as no significant increase was observed in the studies without colonic gas infusion (9.5 ± 0.4 µV Abdominal Accommodation Figure 3. Best diaphragmatic EMG recording site. Individual location of the strongest diaphragmatic EMG signal (N = 16 in upright position) in response to: Valsalva maneuver (A), respiration at the beginning (B), and end of the experiment (C), and location of the most pronounced inhibition induced by colonic gas infusion (D). Note minimal displacement of the diaphragmatic hiatus. at the beginning and 9.7 ± 0.3 µV at the end of the study; N = 4). Postural Activity In the erect position, anterior wall tone was higher and diaphragmatic tone was lower than in the supine position (Table 1). Indeed, in the erect position, the internal oblique of the anterior abdominal wall showed prominent antigravitational activity compared with the supine position. Similar, but markedly smaller, differences were observed in the upper rectus, lower rectus, and external oblique. By contrast, the diaphragm exerted antigravitational activity in the supine position, and the diaphragmatic EMG activity was significantly higher than in the erect position. Colonic Gas Load Tolerance The colonic gas load was well tolerated by all subjects except three in the feasibility studies who requested discontinuation after 50 min of gas infusion. In the remaining experiments, all subjects completed the procedure. Colonic gas infusion inTable 1. Postural Activity of the Anterior Abdominal Wall and the Diaphragm EMG Activity, µV Upper rectus Lower rectus External oblique Internal oblique Diaphragm Supine 10.3 ± 1.5 3.5 ± 0.6 8.6 ± 0.9 4.1 ± 0.5 12.0 ± 1.7 Upright Difference 12.2 ± 1.8 1.8 ± 0.6 4.7 ± 1.0 1.2 ± 1.0 10.4 ± 1.1 1.8 ± 0.7 16.7 ± 3.2 12.6 ± 3.2 10.2 ± 1.1 −1.8 ± 0.7 P Value 0.035 0.293 0.058 0.010 0.045 Paired data (mean ± SE) in 6 subjects. Note contraction (EMG increase) of the anterior abdominal wall, particularly the internal oblique, and relaxation of the diaphragm (EMG decrease) in upright versus supine position. 2811 duced abdominal sensations that were described (pooled data; N = 24) as pressure/bloating (60 ± 5%), cramp/rumbling sensation (32 ± 5%), and puncture/stinging sensation (8 ± 3%). Perception was already significant with 480 mL of gas infused (20 min), and the intensity increased during the infusion period (Figs. 4 and 5). The sensations were referred predominantly to the abdominal midline over the hypogastrium (83 ± 6%), the periumbilical region (89 ± 5%), and the epigastrium (64 ± 7%). The type and referral pattern of the sensations did not differ in the two postures tested. By the end of the infusion period (average of the last 20 min), abdominal perception in the feasibility study involving only diaphragmatic EMG recording (3.1 ± 0.5 score; N = 8) was similar to the study groups involving both diaphragmatic and anterior wall recording either with the trunk erect (2.8 ± 0.4 score; N = 8) or in the supine position (3.5 ± 0.4 score; N = 8). Colonic gas administration produced an increase in girth that was already significant with 240 mL (10-min infusion). During abdominal accommodation of the gas load, girth increased progressively (Figs. 4 and 5). The magnitude of the increment (average of the last 20 min of infusion vs basal) was similar in the erect position (8.5 ± 0.8 mm in the feasibility study with diaphragmatic recording alone, and 7.3 ± 1.0 mm in the experiment with combined anterior wall and diaphragmatic EMG recording; N = 8 each) and in the supine position (8.6 ± 1.4 mm; N = 8). Abdomino-Phrenic Response to the Gas Load With the Trunk Erect (N = 8) During colonic gas infusion, the diaphragm relaxed, while the activity of the anterior abdominal wall increased (Fig. 4). Specifically, the gas load was associated with an EMG increment in the upper rectus (by 12 ± 4%; P < 0.01), lower rectus (by 22 ± 6%; P < 0.01), and external oblique (by 15 ± 3%; P < 0.01), whereas no significant change was detected in the internal oblique (–0.4 ± 0.7% change; P = 0.26), which was already contracted due to its postural activity. The global increase in the anterior wall in response to colonic gas infusion (excluding the internal oblique) was already significant with the 240 mL gas infusion (10 min) and increased up to 16 ± 4% (mean of the last 20 min infusion period). The changes in the EMG activity occurred progressively during the infusion period, and the diaphragmatic inhibition correlated with the anterior wall contraction (R = 0.89; P < 0.01). Abdomino-Phrenic Response to the Gas Load in the Supine Position (N = 8) In contrast to the erect position, the activity of the diaphragm in the supine position progressively increased in response to colonic gas infusion (by 15 ± 6%; P < 0.05) (Fig. 5). In the supine position, the basal activity of the anterior abdominal wall was low (no antigravitational activity), and no relaxation in response to colonic gas was detected (3 ± 2% global change, 4 ± 3% upper rectus, 6 ± 4% lower rectus, 2 ± 3% external oblique, and –6 ± 7% internal oblique; NS for all). 2812 Villoria et al. Figure 4. Responses to colonic gas infusion in erect position (N = 8). Intraabdominal volume increment induced diaphragmatic relaxation, anterior wall contraction, abdominal distension, and perception of abdominal sensations (see text). Global activity of the anterior abdominal wall was calculated by averaging the activity recorded in the upper rectus, lower rectus, and external oblique. Perception intensity was measured as the score of the predominant sensation (see text). ∗ P < 0.05. Figure 5. Responses to colonic gas infusion in the supine position (N = 8). In contrast to the erect position, the diaphragm contracted without changes in anterior wall activity. In the supine position, abdominal distension and perception of abdominal sensations were similar to the erect position. Global activity of the anterior abdominal wall was calculated by averaging the activity recorded in the upper rectus, lower rectus, and external oblique. Perception intensity was measured as the score of the predominant sensation (see text). ∗ P < 0.05. Abdominal Accommodation 2813 Effect of Gender and Size No gender differences in the abdominal EMG activity, diaphragmatic EMG activity, or abdominal girth increase in response to the colonic gas load were observed. The correlation between the resting abdominal girth and the girth increase produced by the colonic gas load was low (R = 0.36; P = 0.09). DISCUSSION Figure 6. Abdominal CT imaging before and after colonic gas infusion. Note abdominal gas increment associated with cranial displacement of the diaphragm. Abdominal Accommodation: Morphometric Data The fluoroscopic paper prints showed a significant cranial displacement of the diaphragm in response to the colonic gas load in the erect position that corresponded to 0.5 ± 0.2 mean vertebral height (P < 0.05 vs basal; N = 8). CT imaging analysis showed that gas infusion in the supine position produced 17.5 ± 5.2-mm cranial displacement of the diaphragm (corresponding to 0.6 ± 0.2 mean vertebral height) associated with 11.6 ± 4.3-mm girth increase (P < 0.05 for both; N = 8) (Fig. 6); no changes in lumbar lordosis were detected. Hence, accommodation of the gas load involved adaptation both of the anterior wall and the diaphragm (Fig. 7). Figure 7. Summary of results. The colonic gas load displaced both the anterior wall (girth increment) and the diaphragm (cranial displacement). This effect was similar in the erect and supine positions, independently of gravitational influences, owing to posturespecific abdomino-phrenic responses: in the erect position, adaptive diaphragmatic relaxation (yellow arrow) and compensatory anterior wall contraction (red arrow); in the supine position, compensatory diaphragmatic contraction (red arrow) without change in anterior wall activity due to the lack of basal tone (passive adaptation). Our data indicate that abdominal accommodation to volume loads involves a metered displacement of the anterior abdominal wall and diaphragm, which results from the changes in the activity of both muscular structures. The degree of muscular responses depends on the specific antigravitational role of the anterior wall and diaphragm, which varies according to posture. The muscles in the abdominal walls exhibit postural activity. In particular, in the upright position, the internal oblique exerts antigravitational activity, that is, contracts to counteract gravitational forces and support abdominal contents. In this position, the diaphragmatic domes are located at the top of the abdominal cavity without gravitational load. With the trunk erect, an extra volume load was associated with inhibition of the diaphragmatic activity and muscular activation of the anterior wall. The changes in electromyographic activity conceivably reflect the variations in muscle tone. Specifically, a reduced diaphragmatic activity reflects an adaptive relaxation, which allows cranial expansion of the abdominal cavity, as shown by the displacement of the diaphragmatic domes detected by fluoroscopy and CT imaging. This was not the only mechanism of volume accommodation as, during colonic gas infusion, the anterior wall displaced ventrally and the girth increased. However, this was associated with an increased activity of the anterior abdominal muscles, which probably reflects a compensatory contraction to counterbalance the extra load and control girth increment, thereby preventing excessive abdominal distension. Conceivably, the key to abdominal accommodation is the coordination of these metered muscular responses: in the upright position, a considerable volume load produced a relatively small increase in girth, as the muscles in the anterior abdominal wall contracted and the diaphragm relaxed. The importance of abdomino-phrenic coordination became apparent when responses to volume loads in the erect position were compared with those when supine. We acknowledge that ideally these comparisons should have been based on paired data from repeat studies; however, to reduce discomfort, each subject was studied in only one position. In the supine position, the anterior abdominal wall is at the top without detectable basal activity, while the diaphragm exerts antigravitational contraction to support the weight of the viscera. Responses to volume loads in this situation are analogous to those in the erect position: the muscle with antigravitational activity, in this case the diaphragm, contracts to 2814 Villoria et al. limit cranial expansion, while the anterior abdominal wall has a permissive role in accommodation and remains inactive. As a result of this posture-dependent coordination, girth increment, and hence, intraabdominal distribution of the volume load in the supine position are similar to the trunk erect. Colonic gas loads elicited volume-related responses of the abdominal walls; however, the trigger zone of this accommodation remains uncertain. We previously showed that in healthy subjects, gas loads are better tolerated in the large bowel than in the poorly compliant small bowel (12). Despite the greater stimulation of gut receptors in the latter, the girth increase was similar in both conditions, suggesting that in healthy subjects, the trigger for the adaptive response may lie in the abdominal walls rather than in the gut (12). The volume-related muscular responses could be mediated by reflex mechanisms; however, colonic gas infusion also produced volume-related conscious sensation, and hence, a cortical link and a behavioral component may also be involved in the viscerosomatic response. We used an experimental model, which produced relatively large and rapid changes in intraabdominal volume, specifically designed to mimic the clinical conditions of bloating. These patients frequently report a rapid onset of visible abdominal distension (20–22). Using CT-based volumetric analysis, we recently showed that in some of these patients, particularly those with intestinal dysmotility, bloating is associated with a marked increment in intraabdominal volume (1.4 ± 0.4 L) and high amounts of intestinal gas (1.1 ± 0.5 L) located mainly in the colon (23). Gas overload was used as a challenge test as it is better tolerated than liquids and permits a wider load range to be tested. Of note, the responses rapidly became apparent and significant with relatively low volume loads comparable with that of bladder or rectal content. Hence, it seems likely that the abdominal accommodation phenomena described here are a common physiological event. Furthermore, considerable increments in intraabdominal volume may occur after ingestion of large-volume meals, which also involve a series of postprandial phenomena such as gas production by duodenal acid-alkaline reactions and colonic fermentation, particularly prominent in subjects with highly flatulogenic flora, gastrointestinal secretions, increased visceral blood supply, and urine formation, all adding up to a total intraabdominal volume conceivably larger than the gas load tested (24). Reliable electromyographic recording of the diaphragmatic activity proved to be a challenging task that involved original technical developments and a long series of preliminary studies testing different arrays of electrodes. The final probe with multiple ring electrodes permitted serial bipolar recordings over a 7.5-cm segment located across the diaphragmatic hiatus. With this array, we observed that the position of the crura diaphragmatica did not change with respect to the electrodes during the experiment and was not affected either by the depth of breathing or by the abdominal volume load: the change induced by a Valsalva maneuver (forced diaphragmatic contraction) was best detected at the same site as tidal respiration and as the response to colonic gas infusion. These data indicate that significant movement of the diaphragmatic domes is associated with a relatively small displacement of the diaphragmatic hiatus not detectable with the interelectrode distance of our probe. We have put forward an original concept and produced experimental evidence in support of a mechanistic model that may help to explain the origin of distension. In fact, abdominal girth may not only depend on the intraabdominal volume, but also depend on the muscular activity of the anterior abdominal wall and the diaphragm. ACKNOWLEDGMENTS Supported in part by the Spanish Ministry of Education (Dirección General de Investigación, SAF 2006–03907) and European Community (project OASIS, QLRT-2001–00218). Ciberehd is funded by the Instituto de Salud Carlos III. Dr. Villoria was supported by a scholarship from the Spanish Ministry of Health (Ayuda para contratos post Formación Sanitaria Especializada, ISC III 03/00051). The authors thank Prof. R. Merletti and Dr. A. Bottin for help in setting up the electromyography system; Maite Casaus and Anna Aparici for technical support; Christine O’Hara for the English editing of the manuscript; and Gloria Santaliestra for secretarial assistance. STUDY HIGHLIGHTS What Is Current Knowledge r r The anterior abdominal wall adapts to intraabdominal volume increments. Abnormal adaptation results in excessive abdominal distension. What Is New Here r r r The diaphragm also participates in abdominal accommodation to volume loads. The accommodation involves a metered displacement and changes in muscular activity of both the anterior wall and the diaphragm. The degree of abdomino-phrenic muscular responses varies according to posture and their specific antigravitational role. Reprint requests and correspondence: Fernando Azpiroz, M.D., Digestive System Research Unit, Hospital General Vall d’Hebron, Autonomous University of Barcelona, 08035 Barcelona, Spain. Received April 25, 2008; accepted July 8, 2008. REFERENCES 1. Azpiroz F, Malagelada J-R. Abdominal bloating. Gastroenterology 2005;129:1060–78. Abdominal Accommodation 2. Houghton LA, Whorwell PJ. Towards a better understanding of abdominal bloating and distension in functional gastrointestinal disorders. Neurogastroenterol Motil 2005;17:500– 11. 3. Tremolaterra F, Villoria A, Azpiroz F, et al. Impaired viscerosomatic reflexes and abdominal wall dystony associated with bloating. Gastroenterology 2006;130:1062–8. 4. Perez F, Accarino A, Azpiroz F, et al. Gas distribution within the human gut: effect of meals. Am J Gastroenterol 2007;102:842–9. 5. Passos MC, Tremolaterra F, Serra J, et al. Impaired reflex control of intestinal gas transit in patients with abdominal bloating. Gut 2005;54:344–8. 6. Hernando-Harder AC, Serra J, Azpiroz F, et al. Sites of symptomatic gas retention during intestinal lipid perfusion in healthy subjects. Gut 2004;53:661–5. 7. Salvioli B, Serra J, Azpiroz F, et al. Impaired small bowel gas propulsion in patients with bloating during intestinal lipid infusion. Am J Gastroenterol 2006;101:1853–7. 8. Merletti R, Hermens HJ. Detection and conditioning of the surface EMG signal. In: Merletti RPP, ed. Electromyography, physiology, engineering, and noninvasive applications. Hoboke, NJ: John Wiley & Sons, 2004:107–31. 9. Ng JK, Kippers V, Richardson CA. Muscle fibre orientation of abdominal muscles and suggested surface EMG electrode positions. Electromyogr Clin Neurophysiol 1998;38: 51–8. 10. Foster RE. Physiological basis of gas exchange in the gut. Ann N Y Acad Sci 1968;150:4–12. 11. Pogrund RS, Steggerda FR. Influence of gaseous transfer between the colon and blood stream on percentage gas compositions of intestinal flatus in man. Am J Physiol 1948;153:475–82. 12. Harder H, Serra J, Azpiroz F, et al. Intestinal gas distribution determines abdominal symptoms. Gut 2003;52:1708–13. 13. Salvioli B, Serra J, Azpiroz F, et al. Origin of gas retention and symptoms in patients with bloating. Gastroenterology 2005;128:574–9. 14. Caldarella MP, Serra J, Azpiroz F, et al. Prokinetic effects of neostigmine in patients with intestinal gas retention. Gastroenterology 2002;122:1748–55. 15. Harder H, Serra J, Azpiroz F, et al. Reflex control of intestinal gas dynamics and tolerance in humans. Am J Physiol 2004;286:G89–94. 16. Caldarella M, Azpiroz F, Malagelada J.-R. Antro-fundic dysfunctions in functional dyspepsia. Gastroenterology 2003;124:1220–9. 2815 17. Distrutti E, Azpiroz F, Soldevilla A, et al. Gastric wall tension determines perception of gastric distension. Gastroenterology 1999;116:1035–42. 18. Beck J, Sinderby C, Lindstrom L, et al. Effects of lung volume on diaphragm EMG signal strength during voluntary contractions. J Appl Physiol 1998;85:1123–34. 19. Polly DW Jr, Kilkelly FX, McHale KA, et al. Measurement of lumbar lordosis. Evaluation of intraobserver, interobserver, and technique variability. Spine 1996;21:1530–5. 20. Maxton DG, Whorwell PJ. Abdominal distension in irritable bowel syndrome: The patient’s perception. Eur J Gastroenterol Hepatol 1992;4:241–3. 21. Alvarez W. Hysterical type of nongaseous abdominal bloating. Arch Intern Med 1949;84:217–45. 22. Chang L, Lee OY, Naliboff B, et al. Sensation of bloating and visible abdominal distension in patients with irritable bowel syndrome. Am J Gastroenterol 2001;96:3341–7. 23. Perez F, Accarino A, Azpiroz F, et al. Abdominal bloating: Distinctive features of organic versus functional disorders. Gut 2007;56:A39. 24. Oghe H, Levitt MD. Intestinal gas. In:Friedman LS, Brandt LJ, eds. Sleisenger and Fordtran gastrointestinal and liver diseases. Philadelphia, PA: Saunders, 2006:187–97. CONFLICT OF INTEREST Guarantor of the article: Fernando Azpiroz, M.D. Specific author contributions: Albert Villoria: study management, conduction of experiments, and data analysis; Fernando Azpiroz: study design, data interpretation, and manuscript preparation; Alfredo Soldevilla: adaptation of the EMG system; Frederic Perez: CT-based morphovolumetric analysis; and Juan-Ramon Malagelada: study design, data interpretation, and manuscript revision. Financial support: Supported in part by the Spanish Ministry of Education (Dirección General de Investigación, SAF 2006–03907) and European Community (project OASIS, QLRT-2001–00218). Ciberehd is funded by the Instituto de Salud Carlos III. Dr. Villoria was supported by a scholarship from the Spanish Ministry of Health (Ayuda para contratos post-Formación Sanitaria Especializada, ISC III 03/00051). Potential competing interests: None. Publicaciones Objetivos 4.3 Publicación 3 Autores: Albert Villoria, Fernando Azpiroz, Emanuel Burri, Daniel Cisternas, Alfredo Soldevilla y Juan-R. Malagelada. Título: Disinergia abdomino-frénica en pacientes con distensión abdominal. Revista: Am J Gastroenterol 2010, en prensa. Antecedentes y objetivos. Se ha demostrado que el abdomen tiene capacidad para acomodar incrementos de volumen intraabdominal. Los pacientes que refieren distensión abdominal tienen una acomodación anormal de la pared anterior del abdomen (contracción deficiente y protusión excesiva) al someterles a una sobrecarga de gas en colon. Sin embargo, estudios mediante técnicas de imagen han demostrado en pacientes con trastornos funcionales intestinales un descenso significativo del diafragma durante los episodios de distensión espontánea. El objetivo del presente estudio fue establecer el papel del diafragma en la distensión abdominal. Métodos. En 20 pacientes afectos de distensión abdominal (15 con síndrome intestino irritable tipo estreñimiento y 5 con distensión funcional) y 15 sujetos sanos, se aumentó el volumen de la cavidad abdominal mediante una sobrecarga de gas en el colon (24 ml / minuto de infusión de gas rectal durante 1 h) y se midió el perímetro abdominal (con una cinta métrica) y la actividad electromiográfica de los músculos anteriores del abdomen (mediante 4 pares de electrodos de superficie) y del diafragma (mediante 6 electrodos anulares montados sobre una sonda localizada en el hiato esofágico). - 61 - Publicaciones Objetivos Resultados. En sujetos sanos la sobrecarga de gas en el colon produjo un aumento en el perímetro abdominal (un 7,8±0,8 mm), una relajación del diafragma (disminución de la actividad muscular en un 16±3 %) y un aumento del tono de la pared anterior del abdomen (11±3 %). Con el mismo volumen de gas, los pacientes desarrollaron una distensión abdominal significativamente mayor (incremento del perímetro de 10,6±0,7 mm, p<0,05 vs sanos), y esto se asoció con una contracción paradójica del diafragma (aumento de la actividad del 35±11 %, p <0,05 vs sanos) y una relajación del músculo oblicuo interno (un 29±7 %, p<0,05 vs sanos). Conclusión. En este modelo experimental de provocación, la distensión abdominal en pacientes esta relacionada con una contracción paradójica del diafragma asociada a la relajación de la pared anterior. - 62 - ABDOMINO-PHRENIC DYSSYNERGIA IN PATIENTS WITH ABDOMINAL BLOATING AND DISTENSION Short title: Abdomino-phrenic dyssynergia Albert Villoria, M.D. 1, Fernando Azpiroz, M.D. 1, Emanuel Burri 1,3, M.D., Daniel Cisternas, M.D. 1,4, Alfredo Soldevilla, E.Eng. 2, and Juan-R. Malagelada, M.D. 1 1. Digestive System Research Unit, University Hospital Vall d'Hebron; Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (Ciberehd); Department of Medicine, Autonomous University of Barcelona, Barcelona, Spain. 2. Department of Physics, Polytechnic University of Catalonia, Barcelona, Spain. 3. Division of Gastroenterology and Hepatology, University Hospital, Basel, Switzerland. 4. Departamento de Gastroenterología. Facultad de Medicina. Pontificia Universidad Católica de Chile, Santiago, Chile. Acknowledgments Supported in part by the Spanish Ministry of Education (Dirección General de Investigación, SAF 2009-07416), and Fundació La Marató TV3 (MARATV3_072010. Ciberehd is funded by the Instituto de Salud Carlos III. Dr. Villoria was supported by a scholarship from the Spanish Ministry of Health (Ayuda para contratos post Formación Sanitaria Especializada, ISC III 03/00051). Dr. Burri was supported by grants from the Freiwillige Akademische Gesellschaft (Basel, Switzerland) and the Gottfried und Julia Bangerter-Rhyner-Stiftung (Bern,.Switzerland). Dr Cisternas was supported by grants from Comisión Nacional de Investigación Científica y Tecnológica-Gobierno de Chile and from Pontificia Universidad Católica de Chile. The authors thank Prof. R Merletti and Dr. A Bottin for help in setting up the electromyography system; Maite Casaus and Anna Aparici for technical support; Christine O’Hara for English editing of the manuscript; and Gloria Santaliestra for secretarial assistance. Abbreviations: EMG, electromyography; IBS, irritable bowel syndrome Word count: 2299 Corresponding author: Fernando Azpiroz, M.D. Digestive System Research Unit Hospital General Vall d'Hebron 08035-Barcelona, Spain Phone: (34) 93 274 62 22 Fax: (34) 93 489 44 56 E-mail: azpiroz.fernando@gmail,com Villoria 2 ABSTRACT BACKGROUND & AIM. It has been shown that he abdomen normally accommodates intraabdominal volume increments, modelled by colonic gas infusion. Patients complaining of abdominal distension have an abnormal accommodation of the anterior abdominal wall to colonic gas loads (defective contraction and excessive protrusion). However, abdominal imaging demonstrated significant diaphragmatic descent during spontaneous episodes of bloating in patients with functional gut disorders. Our aim was to establish the role of the diaphragm in abdominal distension. METHODS. In 20 patients complaining of abdominal bloating (15 IBS-C and 5 functional bloating) and 15 healthy subjects, the volume of the abdominal cavity was increased by a colonic gas load (24 ml/min rectal gas infusion for 1 h), while abdominal girth (by a tape measure), and electromyographic activity of the anterior abdominal muscles (via 4 pairs of surface electrodes) and of the diaphragm (via 6 ring electrodes over a probe positioned at the esophageal hiatus) were measured. RESULTS. In healthy subjects, the colonic gas load increased girth (by 7.8±0.8 mm), relaxed the diaphragm (activity decreased by 16±3 %) and increased anterior wall tone (by 11±3 %). With the same gas load, patients developed significantly more abdominal distension (10.6±0.7 mm girth increment), and this was associated with paradoxical contraction of the diaphragm (activity increased by 35±11 %) and relaxation of the internal oblique (by 29±7 %; p<0.05 vs health for all). CONCLUSION. In this experimental provocation model, abnormal accommodation of the diaphragm is involved in abdominal distension, although a causal relationship in clinical bloating cannot be demonstrated. Villoria 3 Key words: abdominal distension, abdominal bloating, intestinal gas, abdominal volume, viscero-somatic reflexes, intestinal distension, visceral perception, diaphragm, abdominal muscles, electromyography, irritable bowel syndrome, functional bloating. Villoria 4 Abdominal bloating: definition Abdominal bloating has been reported as one of the most cumbersome complaints in various functional gut disorders, but despite its clinical relevance, its pathophysiology and management are still poorly defined (1;2). To complicate matters, the term bloating is unprecise. When defined as subjective sensation of abdominal distension, bloating is associated with a real girth increment (3). However, the term bloating has been also defined as “sensation of increased abdominal pressure” (1), and using this definition the relation of bloating to distension is weaker, particularly in patients with diarrhea-predominant IBS or in those with visceral hypersensitivity (4;5). In this report the term bloating is used as the sensation of abdominal distension. Abdominal accommodation: a new physiological concept The volume of the abdominal cavity exhibits physiological variations, and a recent study demonstrated that the abdominal wall actively adapt to its content (6): an increase in intra-abdominal volume, modelled by colonic gas infusion, modified the muscular activity the anterior abdominal wall and the diaphragm resulting in a metered girth increment, regardless of body posture. The volume-response relation is not influenced by the gas infusion rate. In the upright position, the internal oblique exerts anti-gravitational activity, i.e. it contracts to counteract gravitational forces and support abdominal contents (6;7). In this position, colonic gas infusion is associated with a contraction of anterior wall muscles that are not already contracted due to postural activity, i.e. all but the internal oblique. This muscular response of the anterior abdominal wall to Villoria 5 the extra load probably reflects a compensatory contraction to control girth increment and prevent excessive abdominal distension. In the upright position, the diaphragmatic domes are located at the top of the abdominal cavity without gravitational load, and in healthy subjects an intraabdominal volume increment is associated with diaphragmatic activity inhibition (6). Abdominal CT imaging showed that diaphragmatic activity inhibition reflects an adaptive relaxation, which allows cranial expansion of the abdominal cavity to accommodate the extra volume load (6). While the domes move, the diaphragmatic pillars and the hiatus, where the electromyographic activity is measured, are fixed without detectable displacement over a series of contiguous electrodes at 15 mm intervals (see Figure 1) (6). These data on abdomino-phrenic coordination during abdominal accommodation suggested the possibility that abdominal distension might be related to abnormal activity of the abdominal wall. Abnormal accommodation in patients with bloating Using the same experimental model, it was shown that patients complaining of abdominal distension develop a paradoxical relaxation of the anterior wall in response to colonic gas infusion, and with the same volume loads, their girth increase was significantly larger than in healthy subjects (7). These data suggested that abdominal distension is related to abnormal control of the anterior abdominal wall. Patients with functional bloating characteristically report that the bloating sensation fluctuates. Using an original technique for morpho-volumetric analysis of the abdomen (8) a recent study compared abdominal CT scans taken during basal Villoria 6 conditions with absent or mild bloating sensation and during an episode of spontaneous bloating (3). As compared to basal, anterior wall protrusion during bloating was associated with significant diaphragmatic descent (3), but it remains uncertain whether the diaphragmatic descent is just an epiphenomenon following anterior wall relaxation and caudoventral displacement of contents or whether the diaphragm actively contracts, pushing intraabdominal contents against the anterior wall. This issue is highly relevant, because if diaphragmatic contraction were implicated, it would establish a role for chest activity in the pathogenesis of distension in patients with functional bloating. Does the diaphragm play a role in abdominal distension ? To determine the functional role of the diaphragm in abdominal distension we designed a study comparing the responses to a provocation model of abdominal distension in a group of healthy subjects and a group of patients with functional gut disorders complaining of abdominal distension. Study methods and design Participants. The study was conducted in a new set of 15 healthy subjects and 20 consecutive patients primarily complaining of abdominal bloating, defined as the subjective sensation of abdominal distension [2.4±0.2 score (mean±SE) on a 0-4 scale], that were classified as IBS with constipation (n=15) or functional bloating (n=5), according to the Rome III criteria (Table 1). Sample size was calculated based on previous data on the diaphragmatic response to colonic gas infusion (6), anticipating a 15% difference between groups (patients versus healthy subjects) with 80 % power and a significance level of 5 % (two-sided). The study protocol Villoria 7 was approved by the Institutional Review Board of the University Hospital Vall d’Hebron, and all subjects gave their written informed consent to participate in the study. Provocation stimulus and measurements. Abdominal distension was induced by the same provocative stimulus-response test used in previous studies and that has been described in detail (6). In brief, the volume of the abdominal cavity was increased by a colonic gas load (24 ml/min rectal gas infusion for 1 h), while abdominal sensations (by 0-6 perception scales), abdominal girth (by a tape measure), and electromyographic activity of the anterior abdominal muscles (via 4 pairs of surface electrodes) and of the diaphragm (via 6 ring electrodes over a probe positioned at the esophageal hiatus) were measured (Figure 1). Experimental procedure and design. As previously described, participants were instructed to follow a low flatulogenic diet during the 2 days prior to the study and fasted for 8 hours before the study (6;7;9). To note, the subjects were studied sitting on an ergonomic chair with the trunk erect. The back of the chair was adjusted to the lumbar area to fix the curvature of the spine. After 10 min equilibration, the measurements were performed during a 20-min basal period and, subsequently, during 60 min of colonic gas filling (Figure 1). Valsalva maneuvers were performed at the beginning of each experiment. Data analysis. Results were analyzed as previously described (6). Previous data showed that colonic gas infusion induces different responses in anterior abdominal muscle activity in healthy subjects and in patients with bloating: in the former, the upper rectus, lower rectus and external oblique contract without changes in the internal oblique which is already contracted in the erect position due to its anti- Villoria 8 gravitational activity; by contrast the patients exhibit no significant contraction, but paradoxical relaxation of the internal oblique muscle (6;7). Hence, in the present study the response of the anterior wall to the gas load was evaluated by two parameters: activity of the internal oblique and average response of the upper rectus, lower rectus and external oblique muscles. Owing to technical problems, the recordings of the diaphragm in two patients and one healthy subject were not valid for analysis; the anterior wall recordings were not valid in six patients and in one healthy subject. Results are presented as mean (or grand mean) values (±SE). The relation between paired parameters during colonic gas infusion was evaluated by linear regression measuring the slope in each subject, and then comparing the slopes between patients and healthy subjects. Results Basal measurements No differences were detected between patients and healthy subjects in basal girth (Table 1) or in diaphragmatic and anterior wall responses to the Valsalva maneuver. Perception and abdominal distension in response to gas load Twenty-seven subjects tolerated the 60-min gas infusion test and completed the procedure; 1 healthy subject and 5 patients requested discontinuation of the study after 50 min of gas infusion and 2 patients after 40 min. In healthy subjects, colonic gas infusion induced conscious perception and the intensity of the sensation increased during the infusion period (Figure 2). Villoria 9 Colonic gas infusion also produced a progressive increase in abdominal girth (Figure 2). In patients colonic loads produced significantly more perception and greater abdominal distension than healthy subjects: the differences from the basal level (average in the last 20 min of infusion minus basal) were 4.4±0.2 vs 3.2±0.3 perception score (p=0.003) and 10.6±0.7 mm vs 7.8±0.8 mm girth increment (p=0.02) (Figure 2). The relation between gas volume load and perception (measured by the slope of linear regression) was different in patients than in healthy subjects (2.6±0.2 vs 1.8±0.2 slope respectively; p=0.016). A similar differences was observed for the relation between gas load and girth increment (7.7±0.5 vs 5.4±0.7 slope respectively; p=0.008). On 92±6 % of occasions, sensations were recognized by the patients as their ussual complaints. Abdomino-phrenic response to the gas load Overall response can be summarized as follows: in healthy subjects, the diaphragm relaxed during colonic gas infusion, while activity of the anterior abdominal wall increased; by contrast, patients exhibited a paradoxical abdominophrenic response with diaphragmatic contraction and anterior wall relaxation (Figure 3). The precise responses of the diaphragm and anterior wall are described below. Responses of the diaphragm. In healthy subjects, colonic gas infusion with the trunk erect was associated with inhibition of diaphragmatic activity (Figures 3 and 4). In contrast, colonic gas infusion in patients was associated with progressive contraction of the diaphragm (Figures 3 and 4). The diaphragmatic Villoria 10 response (change in EMG activity) was related to the change in girth; however, the relation (measured by the slope of linear regression) was different in patients than in healthy subjects (4.4±1.8 vs -2.4±0.8 slope respectively; p=0.003). Responses of the anterior abdominal wall. In healthy subjects, the colonic gas load was associated with a global EMG increment in the upper rectus, lower rectus and external oblique, whereas no significant change was detected in the internal oblique (Figures 3 and 4), which was already contracted due to its postural activity. Changes in abdominal EMG activity occurred progressively during the infusion period. The anterior wall contraction correlated with the diaphragmatic inhibition (r=0.55; p=0.03). In patients, the anterior wall response was markedly impaired, and developed significant inhibition of the internal oblique, without a significant contractile response in the rest of the anterior wall muscles (Figures 3 and 4). The degree of inhibition of the internal oblique muscle in patients correlated with the diaphragmatic contraction (r=0.51; p=0.07) and with the increment in abdominal girth (r=0.52; p=0.05). Effect of size, gender and age No significant correlation between the resting abdominal girth and the girth increase produced by the colonic gas load was found either in patients (r=0.35; p=0.17) or in healthy subjects (r=0.37; p=0.23). Size, gender or age could not explain the differences found between patients and healthy subjects. Comment These results suggest that abnormal diaphragmatic activity has a key role in the genesis of abdominal distension in patients with functional gut disorders. Villoria 11 Indeed, in contrast to healthy subjects, patients who complain of abdominal bloating exhibited distorted accommodation to volume loads: the diaphragm showed a paradoxical contraction, while the anterior wall muscles failed to contract, and even the internal oblique, which was already contracted, relaxed. In contrast to the normal synergy of the anterior wall and the diaphragm in healthy subjects (6), the response in patients can be described as abdomino-phrenic dyssynergia, However, these data on its own do not clarify whether the paradoxical contraction of the diaphragm or the faulty contraction of the anterior wall were the primers to distension. Overall interpretation The morpho-volumetric changes previously demonstrated by CT imaging during bloating versus basal conditions (diaphragmatic descent and anterior wall protrusion) (3) are in accordance with the functional data of the present study in a different set of patients (diaphragmatic contraction and anterior wall relaxation), and moreover, help to interpret the role of the diaphragm in abdominal distension. Abdominal imaging was performed in supine position, in which abdominal wall mechanics and postural activity differ from when the trunk is erect as in the present study (6). Indeed, in the supine position, the anterior abdominal wall is at the top without detectable basal activity, while the diaphragm exerts antigravitational contraction to support the weight of the viscera (6). In healthy subjects, an increase in intra-abdominal contents in this position induces a compensatory contraction of the diaphragm that controls cranial expansion, while the anterior abdominal wall plays a permissive role and remains inactive (6). Since the anterior abdominal wall exerts no basal activity in supine position, it could not Villoria 12 possibly relax, leaving the contraction of the diaphragm as the driving force for the caudoventral abdominal displacement and excessive anterior wall protrusion detected in patients during bloating (3). Hence, a possible interpretation of these data considered altogether is that the anterior wall protrusion during bloating is produced by an abnormal contraction of the diaphragm. Previous validation studies in healthy subjects have shown that the diaphragmatic inhibition during colonic gas infusion is associated with diaphragmatic ascent measured by CT imaging (6), but we do not have direct proof that the paradoxical contraction of the diaphragm in patients results in reduced cranial expansion. Interestingly, the increment in girth experimentally provoked in the present study was similar to that measured by CT during episodes of spontaneous bloating (14±2 mm increment from basal conditions) (3). Abnormal abdomino-phrenic adaptation to intraabdominal content in patients with bloating may be a behavioural response, analogous to aerophagia or rumination. The faulty response may be triggered by uncomfortable abdominal sensations. Indeed, it has been consistently shown that patients with bloating have impaired transit of intestinal gas (9-11). Given the characteristic intestinal hypersensitivity in these patients (12-14), even modest retention may induce symptoms and distension. Indeed, the amount of intestinal gas measured during spontaneous bloating was relatively small (3). Conceivably, other factors such as meals, fatigue or stress, either independently or in conjunction, may also contribute to trigger the abnormal response in real-life distension (1;2). Villoria 13 Conclusion and potential implication The data presented above, considered altogether, indicate that abdominal distension in patients complaining of bloating is associated with abnormal activity of the diaphragm. This concept opens a new treatment strategy for this difficult condition. In analogy to abdomino-perineal dyssynergia in patients with functional outlet obstruction (15), correction of the inappropriate diaphragmatic contraction by bio-feedback treatment (16) may prevent the unpleasant anterior abdominal protrusion that most bloaters focus on, as their central clinical symptom. Villoria 14 CONFLICT OF INTEREST A. Guarantor of the paper: Fernando Azpiroz B. Authors’ contribution to the paper: • Albert Villoria: study management, conduction of experiments, and data analysis • Fernando Azpiroz: study design, data interpretation, and manuscript preparation • Emanuel Burri: conduction of experiments • Daniel Cisternas: conduction of experiments • Alfredo Soldevilla: development of recording system • Juan-R Malagelada: study design, data interpretation, and manuscript revision C. Financial Support: supported in part by the Spanish Ministry of Education (Dirección General de Investigación, SAF 2009-07416), and Fundació La Marató TV3 (MARATV3_072010. Ciberehd is funded by the Instituto de Salud Carlos III. Dr. Villoria was supported by a scholarship from the Spanish Ministry of Health (Ayuda para contratos post Formación Sanitaria Especializada, ISC III 03/00051). Dr. Burri was supported by grants from the Freiwillige Akademische Gesellschaft (Basel, Switzerland) and the Gottfried und Julia Bangerter-Rhyner-Stiftung (Bern,.Switzerland). Dr Cisternas was supported by grants from Comisión Nacional de Investigación Científica y Tecnológica-Gobierno de Chile and from Pontificia Universidad Católica de Chile. D. Competing Interest: none Villoria 15 REFERENCES (1) Agrawal A, Whorwell PJ. Review article: abdominal bloating and distension in functional gastrointestinal disorders--epidemiology and exploration of possible mechanisms. Aliment Pharmacol Ther 2008;27(1):2-10. (2) Azpiroz F, Malagelada J-R. Abdominal bloating. Gastroenterology 2005;129:1060-78. (3) Accarino A, Perez F, Azpiroz F et al. Abdominal distension results from caudo-ventral redistribution of contents. Gastroenterology 2009;136:154451. (4) Houghton LA, Lea R, Agrawal A et al. Relationship of abdominal bloating to distension in irritable bowel syndrome and effect of bowel habit. Gastroenterology 2006;131:1003-10. (5) Agrawal A, Houghton LA, Lea R et al. Bloating and distention in irritable bowel syndrome: the role of visceral sensation. Gastroenterology 2008;134(7):1882-9. (6) Villoria A, Azpiroz F, Soldevilla A et al. Abdominal accommodation: a coordinated adaptation of the abdominal walls to its content. Am J Gastroenterol 2008;103:2807-15. (7) Tremolaterra F, Villoria A, Azpiroz F et al. Impaired viscerosomatic reflexes and abdominal wall dystony associated with bloating. Gastroenterology 2006;130:1062-8. (8) Perez F, Accarino A, Azpiroz F et al. Gas distribution within the human gut: effect of meals. Am J Gastroenterol 2007;102:842-9. Villoria 16 (9) Hernando-Harder AC, Serra J, Azpiroz F et al. Colonic responses to gas loads in subgroups of patients with abdominal bloating. Am J Gastroenterol 2010;105(4):876-82. (10) Serra J, Villoria A, Azpiroz F et al. Impaired intestinal gas propulsion in manometrically proven dysmotility and in irritable bowel syndrome. Neurogastroenterol Mot 2010;22:401-6. (11) Salvioli B, Serra J, Azpiroz F et al. Origin of gas retention and symptoms in patients with bloating. Gastroenterology 2005;128:574-9. (12) Distrutti E AFMJR. Perception of rectal distension depends on wall tension, but not on expansion. Gastroenterology 1996;110:A657. (13) Kellow JE, Azpiroz F, Delvaux M et al. Applied neurogastroenterology: physiology/motility sensation. principles of Gastroenterology 2006;130:1412-20. (14) Azpiroz F, Bouin M, Camilleri M et al. Mechanisms of hypersensitivity in IBS and functional disorders. Neurogastroenterol Mot 2007;19:62-88. (15) Azpiroz F, Enck P, Whitehead WE. Anorectal functional testing. Review of a collective experience. Am J Gastroenterol 2002;97:232-40. (16) Burri E, Azpiroz F, Hernandez C et al. Biofeedback treatment of abdominal distention: a proof-of-concept (Abstract). Gut 2010;in press. Villoria TABLE 1. Demographic data patients healthy subjects 19/1 7/8 age, years * 45 (25-64) 24 (22-35) height, cm * 160 (151-172) 173 (157-190) weight, Kg * 57 (50-90) 66 (53-85) 23 (18.5-33.0) 22 (18.3-29.3) 87 (73-122) 85 (75-100) sex, M/F body mass index, Kgm2 * girth, cm * * Data are median (range) 17 Villoria 18 FIGURE LEGENDS Figure 1. Experimental procedure. The volume of the abdominal cavity was increased by a colonic gas load, while measuring the responses of the anterior wall and the diaphragm by electromyography. Figure 2. Abdominal perception and distension in response to the intracolonic gas load. Both responses were significantly larger in patients than in healthy subjects. Data are mean±SE of values averaged over 20 min periods; * p<0.05 vs health comparing data averaged over the last 20 min in each study. Arrows signal when changes became significant versus basal (p<0.05 vs basal). Figure 3. Electromyographic activity of the abdominal walls during colonic gas infusion. In healthy subjects, the activity of the diaphragm decreased, and the activity of the anterior muscles (upper rectus, lower rectus and external oblique) increased, without changes in the internal oblique. By contrast, patients exhibited a progressive activation of the diaphragm and inhibition of the internal oblique. Data are mean±SE of values averaged over 20 min periods; * p<0.05 vs health comparing data averaged over the last 20 min in each study. Arrows signal when changes became significant versus basal (p<0.05 vs basal). Villoria Figure 4. 19 Distorted abdominal accommodation in patients with bloating. Note paradoxical contraction of the diaphragm, relaxation of the internal oblique and impaired contraction of the other anterior muscles (upper rectus, lower rectus and external oblique). Data are mean±SE of delta values (average of last 20 min minus basal in each study). Figure 1 EMG Basal Gas infusion (24 ml/h) 60 min Figure 2 6 perception, score * 0 girth increment, mm 14 * 0 basal 20 40 infusion period, min patients health 60 Figure 3 20 * Diaphragm µV 8 12 Anterior muscles (UR, LR, EO) µV * 6 14 Internal oblique µV * 5 basal 20 40 60 gas infusion, min patients health Figure 4 Diaphragm Anterior muscles (UR, LR, EO) * EMG change, % 50 Internal oblique * * * - 50 p < 0.001 patients p = 0.04 health p = 0.09 * p <0.05 vs. basal Discusión 5. DISCUSIÓN 63 Discusión La distensión abdominal es una alteración clínica frecuente en la población general y en especial en los pacientes afectos de trastornos funcionales digestivos donde se manifiesta de una manera más intensa uno de los síntomas más molestos significativa de la calidad de vida 5, 16 12 9, 11 . En estos pacientes, se ha descrito como y es por ello que condiciona una alteración y una gran demanda asistencial. A pesar de su importancia clínica, no se conocen los mecanismos fisiopatológicos responsables de la distensión abdominal. El problema se complica porque la propia definición de distensión abdominal es confusa, ya que engloba a dos grupos de pacientes, aquellos con sensación de distensión acompañada de un incremento real del perímetro abdominal y aquellos con sensación de distensión pero sin un aumento objetivo del perímetro abdominal. Los pacientes que refieren exclusivamente sensación de presión o hinchazón sin objetivarse distensión abdominal, presentan con más frecuencia intestino irritable tipo diarrea o hipersensibilidad visceral. Por el contrario, aquellos pacientes en los que se demuestra una distensión real, presentan una tendencia a referir síntomas compatibles con intestino irritable con predominio de estreñimiento19. Los pacientes estudiados en esta tesis pertenecen a este último grupo, en el que su distensión abdominal se acompaña de un incremento evidente y de forma progresiva del perímetro abdominal. Acomodación abdominal: un nuevo concepto fisiológico. El volumen de la cavidad abdominal presenta variaciones fisiológicas en repuesta a la ingesta de alimentos, el llenado vesical o la evacuación rectal. Nuestros datos indican que cuando se realiza un incremento del volumen abdominal de forma experimental en sujetos sanos mediante la infusión de gas en el intestino, las - 64 - Discusión paredes abdominales responden de forma coordinada con cambios en la actividad muscular que modulan el grado de aumento del perímetro abdominal, de forma que el aumento de cintura es independiente de la posición del sujeto y no esta influenciada por la tasa de infusión de gas. Inicialmente estudiamos los cambios que se producen en las paredes musculares con el cambio de postura. El paso de supino a bipedestación en todos los sujetos estudiados (sanos y pacientes), provocó una gran activación del músculo oblicuo interno, mientras que el resto de músculos de la pared abdominal anterior permanecieron sin variaciones significativas. Esta activación del músculo oblicuo interno con el cambio de postura demuestra su importancia en contrarrestar la fuerza de la gravedad y sostener las vísceras abdominales. Una vez conocida la actividad postural de la musculatura abdominal, valoramos la respuesta de los diferentes músculos de la pared anterior del abdomen, mediante una prueba provocativa, en la que infundimos un volumen de gas en el colon. El incremento del volumen abdominal en sujetos sanos con el tronco en posición erecta, se acompañó de un incremento significativo de la actividad muscular en todos los músculos de la pared anterior del abdomen excepto el oblicuo interno, que en esta posición ya esta normalmente contraído debido a su actividad postural. Esta respuesta muscular de la pared anterior del abdomen al incremento de volumen intrabdominal, refleja una contracción muscular compensatoria que controla el incremento del perímetro abdominal y previene una distensión excesiva. El diafragma tiene una gran importancia en la conformación de la cavidad abdominal, ya que junto con la pared anterior del abdomen son las dos estructuras móviles de la cavidad abdominal. En bipedestación, el diafragma se encuentra en la parte superior de la cavidad abdominal y no recibe influencias gravitacionales. En - 65 - Discusión sujetos sanos la infusión de gas en cólon indujo una disminución progresiva de la actividad muscular diafragmática. Esta inhibición de la actividad muscular, se asoció con un desplazamiento craneal del diafragma que objetivamos tanto mediante estudio fluoroscópico como por tomografía abdominal computerizada. De esta manera, la inhibición diafragmática, refleja una relajación adaptativa que permite una expansión craneal de la cavidad abdominal para acomodar el volumen extra de gas. Es importante destacar que, a pesar de observar un desplazamiento craneal de la cúpula del diafragma, esta no se acompaña de un movimiento en el hiato esofágico ni en los pilares del diafragma crural. Esto es importante para poder valorar con fiabilidad los cambios observados en la actividad eléctrica diafragmática. Cuando se realizó el mismo estudio con los sujetos en supino, la pared anterior del abdomen se encontraba en la parte superior de la cavidad abdominal sin presentar actividad basal, mientras que el diafragma presentó un aumento de actividad, para contrarrestar las fuerzas gravitatorias y contener el paquete abdominal. La respuesta a la infusión de gas intestinal fue análoga a la que se produjo con el tronco erecto, el músculo con actividad antigravitatoria, en este caso el diafragma, se contrajo para limitar la expansión craneal del abdomen, mientras que la pared anterior del abdomen ejerció un papel permisivo en la acomodación abdominal sin aumentar su actividad eléctrica. Estos datos sobre coordinación abdomino-frénica en la acomodación abdominal abren la posibilidad que la distensión abdominal esté relacionada con una alteración en la actividad de la musculatura de las paredes abdominales. - 66 - Discusión Acomodación anormal en pacientes con distensión abdominal Utilizando el mismo modelo experimental que en sujetos sanos, observamos como los pacientes con distensión abdominal presentaron una relajación paradójica del músculo oblicuo interno durante la infusión de gas en el intestino, acompañada de un incremento del perímetro abdominal significativamente mayor que en sujetos sanos. Estos datos sugieren que la distensión abdominal se relaciona con una alteración muscular de la pared anterior del abdomen. Recientemente se ha publicado un estudio 79 en el que se realizó una medición del volumen de gas intestinal utilizando una técnica original de análisis morfovolumétrico de la cavidad abdominal mediante tomografía axial computerizada. Se estudió a pacientes afectos de distensión abdominal en dos situaciones distintas: en condiciones basales sin distensión o con distensión mínima, y durante un episodio de distensión severa. En comparación con la situación basal, cuando el paciente presentó sensación de distensión, ésta se acompañó de una protusión de la pared anterior del abdomen asociada a un descenso del diafragma. Sin embargo, en este estudio no quedó claro si el descenso del diafragma es un epifenómeno producido por la relajación de la pared anterior del abdomen y por el desplazamiento caudoventral del contenido abdominal o si, por el contrario, el descenso del diafragma es consecuencia de una contracción activa que desplaza el contenido abdominal y favorece la distensión abdominal. Este hecho es de gran importancia, ya que una activación del diafragma implicaría la participación del tórax en el mecanismo que genera la distensión abdominal. - 67 - Discusión Papel del diafragma en la distensión abdominal Para determinar el papel del diafragma en la distensión abdominal, se compararon las respuestas en un modelo provocativo en sujetos sanos y en pacientes con distensión. A diferencia de los sujetos sanos, los pacientes presentaron una alteración de la acomodación: el diafragma presentó una contracción paradójica, mientras que la musculatura anterior del abdomen no se contrajo, e incluso el músculo oblicuo interno, que estaba previamente contraído, presentó una relajación progresiva. Por lo tanto, contrariamente a la acomodación normal de los sujetos sanos, los pacientes presentaron una disinergia abdomino-frénica. Sin embargo, estos datos por si solos no son suficientes para determinar si la contracción del diafragma o la relajación de la musculatura abdominal, son los causantes primarios de la distensión. Es interesante observar como los datos de nuestro estudio mediante electromiografía abdominal y diafragmática, son concordantes con los reflejados en el estudio del análisis morfo-volumétrico mediante tomografía axial computarizada en pacientes con distensión abdominal 79 . Además este estudio ayuda a interpretar mejor el papel que ejercen las paredes abdominales en la distensión abdominal. Por los condicionantes técnicos, las imágenes abdominales tomadas mediante la tomografía axial computarizada en los sujetos sanos y en los pacientes, se realizaron en supino. En esta posición, la pared anterior del abdomen se encuentra en la parte superior de la cavidad abdominal sin mostrar actividad eléctrica, mientras que el diafragma, por su posición, se contrae para contrarrestar las fuerzas gravitatorias y sostener las vísceras abdominales. En sujetos sanos estudiados en supino, el aumento del volumen intrabdominal mediante la infusión de gas, se acompañó de un incremento progresivo de la actividad eléctrica del diafragma - 68 - Discusión (contracción) mientras que la pared anterior del abdomen tuvo un papel permisivo y permaneció inactiva. Como la pared anterior del abdomen en supino no presenta actividad, no puede relajarse y por lo tanto la contracción del diafragma sería la fuerza que produce el desplazamiento caudo-ventral y la excesiva protusión abdominal que presentan los pacientes con distensión abdominal. La disinergia abdomino-frénica que observamos tras el aumento del volumen intrabdominal en los pacientes con distensión abdominal puede ser producida por una respuesta conductual, equiparable a la rumiación o a la aerofagia. Esta respuesta alterada puede ser desencadenada por una sensación de molestia abdominal. Estudios independientes han demostrado que este tipo de pacientes con distensión abdominal presentan una alteración del transito intestinal de gas 45 , que puede condicionar un cierto grado de retención de gas. También se ha demostrado que estos pacientes presentan una hipersensibilidad visceral, de forma que una distensión focal, incluso leve, producida por pequeñas acumulaciones de contenido intestinal, puede inducir una sensación de molestia abdominal y desencadenar la distensión. En nuestros trabajos hemos estudiado el gas como elemento desencadenante, pero posiblemente otros factores como la alimentación, la fatiga o el estrés, ya sea independientemente o en conjunto, también puede contribuir a desencadenar la respuesta anormal y distensión abdominal en la vida real. Considerados en conjunto, los trabajos de esta tesis indican que el incremento del perímetro abdominal en los pacientes afectos de distensión abdominal se asocia con una actividad anormal del diafragma y la pared anterior del abdomen. En analogía con la disinergia abdomino-perineal observada en pacientes con estreñimiento por - 69 - Discusión obstrucción funcional durante la maniobra defecatoria, la corrección de la contracción del diafragma mediante bio-feedback, podría ser una posibilidad terapéutica para corregir la distensión abdominal. - 70 - Conclusiones Objetivos 6. CONCLUSIONES 71 Conclusiones 1) La actividad de la musculatura anterior del abdomen en respuesta a los cambios posturales, es similar en sujetos sanos y en pacientes con distensión abdominal. 2) Los pacientes que manifiestan distensión abdominal presentan un aumento excesivo del perímetro abdominal tras una sobrecarga de volumen intestinal. 3) El aumento del perímetro abdominal en pacientes con síndrome de intestino irritable que manifiestan distensión abdominal, se debe a una respuesta anormal de la musculatura de la pared anterior del abdomen, en concreto una relajación paradójica del músculo oblicuo interno. 4) El aumento del volumen intraabdominal induce una respuesta coordinada de las paredes abdominales (diafragma y pared abdominal anterior). 5) Esta respuesta tiene una función antigravitatoria y depende de la posición del cuerpo: en bipedestación se produce una contracción de la pared anterior y relajación diafragmática; mientras que en supino se produce una relajación de la pared anterior y contracción diafragmática. 6) El aumento del perímetro abdominal en pacientes con síndrome de intestino irritable que manifiestan distensión abdominal, se debe a una respuesta anormal de la musculatura de las paredes abdominales, contracción del diafragma y relajación del músculo oblicuo interno, que describimos como disinergia abdomino-frénica. - 72 - Bibliografía 7. BIBLIOGRAFÍA Bibliografía 1. Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology 2006; 130:1480-1491. 2. Longstreth GF, Wilson A, Knight K, Wong J, Chiou CF, Barghout V, Frech F, Ofman JJ. Irritable bowel syndrome, health care use, and costs: a U.S. managed care perspective. Am J Gastroenterol 2003; 98:600-607. 3. Dapoigny M, Bellanger J, Bonaz B, Bruley d, V, Bueno L, Coffin B, Ducrotte P, Flourie B, Lemann M, Lepicard A, Reigneau O. Irritable bowel syndrome in France: a common, debilitating and costly disorder. Eur J Gastroenterol Hepatol 2004; 16:995-1001. 4. Ringel Y, Williams RE, Kalilani L, Cook SF. Prevalence, characteristics, and impact of bloating symptoms in patients with irritable bowel syndrome. Clin Gastroenterol Hepatol 2009; 7:68-72. 5. Tuteja AK, Talley NJ, Joos SK, Tolman KG, Hickam DH. Abdominal bloating in employed adults: prevalence, risk factors, and association with other bowel disorders. Am J Gastroenterol 2008; 103:1241-1248. 6. Thompson WG, Longstreth G, Drossman DA, Heaton K, Irvine EJ, MullerLissner SC. Functional bowel disorders in functional abdominal pain. In: Drossman DA, Talley NJ, Corazziari E, ThompsonWG, and Whitehead WE, eds. The functional gastrointestinal disorders. 2nd ed, McLean, VA: ed. Degnon Associates, 2000:351-432. - 74 - Bibliografía 7. Sandler RS, Stewart WF, Liberman JN, Ricci JA, Zorich NL. Abdominal pain, bloating, and diarrhea in the United States: prevalence and impact. Dig Dis Sci 2000; 45:1166-1171. 8. Thompson WG. Gender differences in irritable bowel symptoms. Eur J Gastroenterol Hepatol 1997; 9:299-302. 9. Chang L, Lee OY, Naliboff B, Schmulson M, Mayer EA. Sensation of bloating and visible abdominal distension in patients with irritable bowel syndrome. Am J Gastroenterol 2001; 96:3341-3347. 10. Jiang X, Locke GR, III, Choung RS, Zinsmeister AR, Schleck CD, Talley NJ. Prevalence and risk factors for abdominal bloating and visible distention: a population-based study. Gut 2008; 57:756-763. 11. Talley NJ, Phillips SF, Melton J, III, Wiltgen C, Zinsmeister AR. A patient questionnaire to identify bowel disease. Ann Intern Med 1989; 111:671-674. 12. Lembo T, Naliboff B, Munakata J, Fullerton S, Saba L, Tung S, Schmulson M, Mayer EA. Symptoms and visceral perception in patients with painpredominant irritable bowel syndrome. Am J Gastroenterol 1999; 94:13201326. 13. Schmulson M, Lee OY, Chang L, Naliboff B, Mayer EA. Symptom differences in moderate to severe IBS patients based on predominant bowel habit. Am J Gastroenterol 1999; 94: 2929-2935. 14. Talley NJ, Dennis EH, Schettler-Duncan VA, Lacy BE, Olden KW, Crowell MD. Overlapping upper and lower gastrointestinal symptoms in irritable bowel - 75 - Bibliografía syndrome patients with constipation or diarrhea. Am J Gastroenterol 2003; 98: 2454-2459. 15. Hahn BA, Saunders WB, Maier WC. Differences between individuals with selfreported irritable bowel syndrome (IBS) and IBS-like symptoms. Dig Dis Sci 1997; 42: 2585-2590. 16. Cain KC, Headstrom P, Jarrett ME, Motzer SA, Park H, Burr RL, Surawicz CM, Heitkemper MM. Abdominal pain impacts quality of life in women with irritable bowel syndrome. Am J Gastroenterol 2006; 101:124-132. 17. Maxton DG, Martin DF, Whorwell PJ, Godfrey M. Abdominal distension in female patients with irritable bowel syndrome: exploration of possible mechanisms. Gut 1991; 32:662-664. 18. Hebden JM, Blackshaw E, D'Amato M, Perkins AC, Spiller RC. Abnormalities of GI transit in bloated irritable bowel syndrome: effect of bran on transit and symptoms. Am J Gastroenterol 2002; 97:2315-2320. 19. Houghton LA, Lea R, Agrawal A, Reilly B, Whorwell PJ. Relationship of abdominal bloating to distention in irritable bowel syndrome and effect of bowel habit. Gastroenterology 2006; 131:1003-1010. 20. Lewis MJ, Reilly B, Houghton LA, Whorwell PJ. Ambulatory abdominal inductance plethysmography: towards objective assessment of abdominal distension in irritable bowel syndrome. Gut 2001; 48:216-220. - 76 - Bibliografía 21. Heitkemper MM, Cain KC, Jarrett ME, Burr RL, Crowell MD, Woods NF. Relationship of bloating to other GI and menstrual symptoms in women with irritable bowel syndrome. Dig Dis Sci 2004; 49:88-95. 22. Mertz H, Naliboff B, Mayer EA. Symptoms and physiology in severe chronic constipation. Am J Gastroenterol 1999; 94:131-138. 23. Marcus SN, Heaton KW. Irritable bowel-type symptoms in spontaneous and induced constipation. Gut 1987; 28:156-159. 24. Sach J, Bolus R, FitzGerald L, Naliboff BD, Chang L, Mayer EA. Is there a difference between abdominal pain and discomfort in moderate to severe IBS patients? Am J Gastroenterol 2002; 97:3131-3138. 25. Wiklund IK, Fullerton S, Hawkey CJ, Jones RH, Longstreth GF, Mayer EA, Peacock RA, Wilson IK, Naesdal J. An irritable bowel syndrome-specific symptom questionnaire: development and validation. Scand J Gastroenterol 2003; 38:947-954. 26. Caldarella MP, Azpiroz F, Malagelada JR. Antro-fundic dysfunctions in functional dyspepsia. Gastroenterology 2003; 124:1220-1229. 27. Waldholtz BD, Andersen AE. Gastrointestinal symptoms in anorexia nervosa. A prospective study. Gastroenterology 1990; 98:1415-1419. 28. Chami TN, Andersen AE, Crowell MD, Schuster MM, Whitehead WE. Gastrointestinal symptoms in bulimia nervosa: effects of treatment. Am J Gastroenterol 1995; 90:88-92. - 77 - Bibliografía 29. Crowell MD, Cheskin LJ, Musial F. Prevalence of gastrointestinal symptoms in obese and normal weight binge eaters. Am J Gastroenterol 1994; 89:387-391. 30. Talley NJ, Quan C, Jones MP, Horowitz M. Association of upper and lower gastrointestinal tract symptoms with body mass index in an Australian cohort. Neurogastroenterol Motil 2004; 16:413-419. 31. Delgado-Aros S, Locke GR, III, Camilleri M, Talley NJ, Fett S, Zinsmeister AR, Melton LJ, III. Obesity is associated with increased risk of gastrointestinal symptoms: a population-based study. Am J Gastroenterol 2004; 99:18011806. 32. Serra J, Azpiroz F, Malagelada JR. Intestinal gas dynamics and tolerance in humans. Gastroenterology 1998; 115:542-550. 33. Caldarella MP, Serra J, Azpiroz F, Malagelada JR. Prokinetic effects in patients with intestinal gas retention. Gastroenterology 2002; 122:1748-1755. 34. Serra J, Salvioli B, Azpiroz F, Malagelada JR. Lipid-induced intestinal gas retention in irritable bowel syndrome. Gastroenterology 2002; 123:700-706. 35. Poynard T, Hernandez M, Xu P, Couturier P, Frexinos J, Bommelaer G, Benan-Agostini H, Chaput JC. Visible abdominal distention and gas surface: description of an automatic method of evaluation and application to patients with irritable bowel syndrome and dyspepsia. Eur J Gastroenterol Hepatol 1992; 4:831-836. 36. Sullivan SN. A prospective study of unexplained visible abdominal bloating. N Z Med J 1994; 107:428-430. - 78 - Bibliografía 37. Alvarez WC. Hysterical type of nongaseous abdominal bloating. Arch Intern Med (Chic) 1949; 84:217-245. 38. McManis PG, Newall D, Talley NJ. Abdominal wall muscle activity in irritable bowel syndrome with bloating. Am J Gastroenterol 2001; 96:1139-1142. 39. Suarez FL, Savaiano DA, Levitt MD. A comparison of symptoms after the consumption of milk or lactose-hydrolyzed milk by people with self-reported severe lactose intolerance. N Engl J Med 1995; 333:1-4. 40. Azpiroz F. Gastrointestinal perception: pathophysiological implications. Neurogastroenterol Motil 2002; 14:229-239. 41. Bouin M, Lupien F, Riberdy M, Boivin M, Plourde V, Poitras P. Intolerance to visceral distension in functional dyspepsia or irritable bowel syndrome: an organ specific defect or a pan intestinal dysregulation? Neurogastroenterol Motil 2004; 16:311-314. 42. Accarino AM, Azpiroz mechanosensitive F, intestinal Malagelada afferents JR. in Selective irritable dysfunction bowel of syndrome. Gastroenterology 1995; 108:636-643. 43. Bedell GN, Marshall R, Dubois AB, Harris JH. Measurement of the volume of gas in the gastrointestinal tract; values in normal subjects and ambulatory patients. J Clin Invest 1956; 35:336-345. 44. Levitt MD. Volume and composition of human intestinal gas determined by means of an intestinal washout technic. N Engl J Med 1971; 284:1394-1398. - 79 - Bibliografía 45. Serra J, Azpiroz F, Malagelada JR. Impaired transit and tolerance of intestinal gas in the irritable bowel syndrome. Gut 2001; 48:14-19. 46. Fordtran JS, Morawski SG, Santa Ana CA, Rector FC, Jr. Gas production after reaction of sodium bicarbonate and hydrochloric acid. Gastroenterology 1984; 87:1014-1021. 47. Suarez FL, Levitt MD. Intestinal gas. In: Feldman M, FriedmanLS, and Sleisenger MH, eds. Gastrointestinal and liver diseases: pathophysiology/diagnosis/management. Philadelphia: Saunders, 2002:155163. 48. Scheppach W, Fabian C, Ahrens F, Spengler M, Kasper H. Effect of starch malabsorption on colonic function and metabolism in humans. Gastroenterology 1988; 95:1549-1555. 49. Stephen AM, Cummings JH. Mechanism of action of dietary fibre in the human colon. Nature 1980; 284:283-284. 50. Levitt MD, Bond JH, Jr. Volume, composition, and source of intestinal gas. Gastroenterology 1970; 59:921-929. 51. Levitt MD. Intestinal gas production--recent advances in flatology. N Engl J Med 1980; 302:1474-1475. 52. Strocchi A, Levitt MD. Factors affecting hydrogen production and consumption by human fecal flora. The critical roles of hydrogen tension and methanogenesis. J Clin Invest 1992; 89:1304-1311. - 80 - Bibliografía 53. Suarez F, Furne J, Springfield J, Levitt M. Insights into human colonic physiology obtained from the study of flatus composition. Am J Physiol 1997; 272:G1028-G1033. 54. Flourie B, Pellier P, Florent C, Marteau P, Pochart P, Rambaud JC. Site and substrates for methane production in human colon. Am J Physiol 1991; 260:G752-G757. 55. Strocchi A, Furne J, Ellis C, Levitt MD. Methanogens outcompete sulphate reducing bacteria for H2 in the human colon. Gut 1994; 35:1098-1101. 56. Kajs TM, Fitzgerald JA, Buckner RY, Coyle GA, Stinson BS, Morel JG, Levitt MD. Influence of a methanogenic flora on the breath H2 and symptom response to ingestion of sorbitol or oat fiber. Am J Gastroenterol 1997; 92:8994. 57. Pogrund RS, Steggerda FR. Influence of gaseous transfer between the colon and blood stream on percentage gas compositions of intestinal flatus in man. Am J Physiol 1948; 153:475-482. 58. King TS, Elia M, Hunter JO. Abnormal colonic fermentation in irritable bowel syndrome. Lancet 1998; 352:1187-1189. 59. El OL, Flourie B, Bruley d, V, Barry JL, Cloarec D, Bornet F, Galmiche JP. Relations between transit time, fermentation products, and hydrogen consuming flora in healthy humans. Gut 1996; 38:870-877. 60. Galati JS, McKee DP, Quigley EM. Response to intraluminal gas in irritable bowel syndrome. Motility versus perception. Dig Dis Sci 1995; 40:1381-1387. - 81 - Bibliografía 61. Harder H, Serra J, Azpiroz F, Malagelada JR. Reflex control of intestinal gas dynamics and tolerance in humans. Am J Physiol Gastrointest Liver Physiol 2004; 286:G89-G94. 62. Tremolaterra F, Villoria A, Serra J, Azpiroz F, Malagelada JR. Intestinal tone and gas motion. Neurogastroenterol Motil 2006; 18:905-910. 63. Rumessen JJ, Gudmand-Hoyer E. Functional bowel disease: malabsorption and abdominal distress after ingestion of fructose, sorbitol, and fructosesorbitol mixtures. Gastroenterology 1988; 95:694-700. 64. Fernandez-Banares F, Rosinach M, Esteve M, Forne M, Espinos JC, Maria VJ. Sugar malabsorption in functional abdominal bloating: a pilot study on the long-term effect of dietary treatment. Clin Nutr 2006; 25:824-831. 65. Symons P, Jones MP, Kellow JE. Symptom provocation in irritable bowel syndrome. Effects of differing doses of fructose-sorbitol. Scand J Gastroenterol 1992; 27:940-944. 66. Nelis GF, Vermeeren MA, Jansen W. Role of fructose-sorbitol malabsorption in the irritable bowel syndrome. Gastroenterology 1990; 99:1016-1020. 67. Afdhal NH, Piggott C, Long AA, O'Donoghue DP. Carbohydrate handling by colonic flora--is it pathogenic in the irritable bowel syndrome? Ir J Med Sci 1986; 155:197-201. 68. McKee AM, Prior A, Whorwell PJ. Exclusion diets in irritable bowel syndrome: are they worthwhile? J Clin Gastroenterol 1987; 9:526-528. - 82 - Bibliografía 69. Lasser RB, Bond JH, Levitt MD. The role of intestinal gas in functional abdominal pain. N Engl J Med 1975; 293:524-526. 70. Lasser RB, Levitt MD, Bond JH. Studies of intestinal gas after ingestion of a standard meal. 70 ed. 1976. 71. Haderstorfer B, Psycholgin D, Whitehead WE, Schuster MM. Intestinal gas production from bacterial fermentation of undigested carbohydrate in irritable bowel syndrome. Am J Gastroenterol 1989; 84:375-378. 72. Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. a doubleblind, randomized, placebo-controlled study. Am J Gastroenterol 2003; 98:412-419. 73. Ford AC, Spiegel BM, Talley NJ, Moayyedi P. Small intestinal bacterial overgrowth in irritable bowel syndrome: systematic review and meta-analysis. Clin Gastroenterol Hepatol 2009; 7:1279-1286. 74. Bratten JR, Spanier J, Jones MP. Lactulose breath testing does not discriminate patients with irritable bowel syndrome from healthy controls. Am J Gastroenterol 2008; 103:958-963. 75. Hasler WL. Lactulose breath testing, bacterial overgrowth, and IBS: just a lot of hot air? Gastroenterology 2003; 125:1898-1900. 76. Chami TN, Schuster MM, Bohlman ME, Pulliam TJ, Kamal N, Whitehead WE. A simple radiologic method to estimate the quantity of bowel gas. Am J Gastroenterol 1991; 86:599-602. - 83 - Bibliografía 77. Koide A, Yamaguchi T, Odaka T, Koyama H, Tsuyuguchi T, Kitahara H, Ohto M, Saisho H. Quantitative analysis of bowel gas using plain abdominal radiograph in patients with irritable bowel syndrome. Am J Gastroenterol 2000; 95:1735-1741. 78. Accarino A, Perez F, Azpiroz F, Quiroga S, Malagelada JR. Intestinal gas and bloating: effect of prokinetic stimulation. Am J Gastroenterol 2008; 103:20362042. 79. Accarino A, Perez F, Azpiroz F, Quiroga S, Malagelada JR. Abdominal distension results from caudo-ventral redistribution of contents. Gastroenterology 2009; 136:1544-1551. 80. Flourie B, Florent C, Jouany JP, Thivend P, Etanchaud F, Rambaud JC. Colonic metabolism of wheat starch in healthy humans. Effects on fecal outputs and clinical symptoms. Gastroenterology 1986; 90:111-119. 81. Serra J, Azpiroz F, Malagelada JR. Mechanisms of intestinal gas retention in humans: impaired propulsion versus obstructed evacuation. Am J Physiol Gastrointest Liver Physiol 2001; 281:G138-G143. 82. Serra J, Azpiroz F, Malagelada JR. Modulation of gut perception in humans by spatial summation phenomena. J Physiol 1998;506 ( Pt 2):579-587. 83. Hernando-Harder AC, Serra J, Azpiroz F, Malagelada JR. Sites of symptomatic gas retention during intestinal lipid perfusion in healthy subjects. Gut 2004; 53:661-665. - 84 - Bibliografía 84. Serra J, Azpiroz F, Malagelada JR. Gastric distension and duodenal lipid infusion modulate intestinal gas transit and tolerance in humans. Am J Gastroenterol 2002; 97:2225-2230. 85. Dainese R, Serra J, Azpiroz F, Malagelada JR. Influence of body posture on intestinal transit of gas. Gut 2003; 52:971-974. 86. Dainese R, Serra J, Azpiroz F, Malagelada JR. Effects of physical activity on intestinal gas transit and evacuation in healthy subjects. Am J Med 2004; 116:536-539. 87. Harder H, Serra J, Azpiroz F, Passos MC, Aguade S, Malagelada JR. Intestinal gas distribution determines abdominal symptoms. Gut 2003; 52:1708-1713. 88. Salvioli B, Serra J, Azpiroz F, Lorenzo C, Aguade S, Castell J, Malagelada JR. Origin of gas retention and symptoms in patients with bloating. Gastroenterology 2005; 128:574-579. 89. Coffin B, Azpiroz F, Guarner F, Malagelada JR. Selective gastric hypersensitivity and reflex hyporeactivity in functional dyspepsia. Gastroenterology 1994; 107:1345-1351. 90. Levitt MD, Furne J, Olsson S. The relation of passage of gas an abdominal bloating to colonic gas production. Ann Intern Med 1996; 124:422-424. 91. Cann PA, Read NW, Brown C, Hobson N, Holdsworth CD. Irritable bowel syndrome: relationship of disorders in the transit of a single solid meal to symptom patterns. Gut 1983; 24:405-411. - 85 - Bibliografía 92. Trotman IF, Price CC. Bloated irritable bowel syndrome defined by dynamic 99mTc bran scan. Lancet 1986; 2:364-366. 93. Hutchinson R, Notghi A, Smith NB, Harding LK, Kumar D. Scintigraphic measurement of ileocaecal transit in irritable bowel syndrome and chronic idiopathic constipation. Gut 1995; 36:585-589. 94. De Troyer A., Sampson M, Sigrist S. The diaphragm: two muscles. Science 1981; 213:237-238. 95. Paiva M, Verbanck S, Estenne M, Poncelet B, Segebarth C, Macklem PT. Mechanical implications of in vivo human diaphragm shape. J Appl Physiol 1992; 72:1407-1412. 96. Costa MM, Pires-Neto MA. Anatomical investigation of the esophageal and aortic hiatuses: physiologic, clinical and surgical considerations. Anat Sci Int 2004; 79:21-31. 97. Orozco-Levi M, Gea J. The diaphragm. Arch Bronconeumol 1997; 33:399-411. 98. De Troyer A., Estenne M. Functional anatomy of the respiratory muscles. Clin Chest Med 1988; 9:175-193. 99. Comtois A, Gorczyca W, Grassino A. Anatomy of the diaphragmatic circulation. J Appl Physiol 1987;62:238-244. 100. Polla B, D'Antona G, Bottinelli R, Reggiani C. Respiratory muscle fibres: specialisation and plasticity. Thorax 2004; 59:808-817. - 86 - Bibliografía 101. Sanchez J, Medrano G, Debesse B, Riquet M, Derenne JP. Muscle fibre types in costal and crural diaphragm in normal men and in patients with moderate chronic respiratory disease. Bull Eur Physiopathol Respir 1985; 21:351-356. 102. Rochester DF. The diaphragm: contractile properties and fatigue. J Clin Invest 1985; 75:1397-1402. 103. Hodges PW, Gandevia SC. Activation of the human diaphragm during a repetitive postural task. J Physiol 2000;522 Pt 1:165-175. 104. DeTroyer A. Mechanical role of the abdominal muscles in relation to posture. Respir Physiol 1983; 53:341-353. 105. Abe T, Yamada T, Tomita T, Easton PA. Posture effects on timing of abdominal muscle activity during stimulated ventilation. J Appl Physiol 1999; 86:1994-2000. 106. Butler JE, McKenzie DK, Gandevia SC. Discharge frequencies of single motor units in human diaphragm and parasternal muscles in lying and standing. J Appl Physiol 2001; 90:147-154. 107. Muller N, Volgyesi G, Becker L, Bryan MH, Bryan AC. Diaphragmatic muscle tone. J Appl Physiol 1979; 47:279-284. 108. Druz WS, Sharp JT. Activity of respiratory muscles in upright and recumbent humans. J Appl Physiol 1981; 51:1552-1561. - 87 - Bibliografía 109. Xie AL, Takasaki Y, Popkin J, Orr D, Bradley TD. Chemical and postural influence on scalene and diaphragmatic activation in humans. J Appl Physiol 1991; 70:658-664. 110. Caix P. Anatomy of the abdominal wall. Ann Chir Plast Esthet 1999; 44:289311. 111. Hammond DC, Larson DL, Severinac RN, Marcias M. Rectus abdominis muscle innervation: implications for TRAM flap elevation. Plast Reconstr Surg 1995; 96:105-110. 112. Henry Otis Kendall, Florence Peterson Kendall, Gladys Elizabeth Wadsworth. Musculos del tronco. Músculos: Pruebas y funciones. 2ª ed. Editorial Jims, 1974:187-194. 113. Caix M, Outrequin G, Descottes B, Kalfon M, Pouget X. The muscles of the abdominal wall: a new functional approach with anatomoclinical deductions. Anat Clin 1984; 6:101-108. 114. Haggmark T, Thorstensson A. Fibre types in human abdominal muscles. Acta Physiol Scand 1979; 107:319-325. 115. Floyd WF, Silver PH. Electromyographic study of patterns of activity of the anterior abdominal wall muscles in man. J Anat 1950; 84:132-145. 116. Ng JK, Kippers V, Richardson CA. Muscle fibre orientation of abdominal muscles and suggested surface EMG electrode positions. Electromyogr Clin Neurophysiol 1998; 38:51-58. - 88 - Bibliografía 117. Zedka M, Kumar S, Narayan Y. Comparison of surface EMG signals between electrode types, interelectrode distances and electrode orientations in isometric exercise of the erector spinae muscle. Electromyogr Clin Neurophysiol 1997; 37:439-447. 118. Petit JM, Milic-Emili G, Delhez L. Role of the diaphragm in breathing in conscious normal man: an electromyographic study. J Appl Physiol 1960; 15:1101-1106. 119. Podnar S, Resman-Gaspersic A. Quantitative motor unit potential analysis in the diaphragm: a normative study. 37 ed. 2008:518.-521. 120. Gorman RB, McKenzie DK, Butler JE, Tolman JF, Gandevia SC. Diaphragm length and neural drive after lung volume reduction surgery. Am J Respir Crit Care Med 2005; 172:1259-1266. 121. Similowski T, Catala M, Rancurel G, Derenne JP. Impairment of central motor conduction to the diaphragm in stroke. Am J Respir Crit Care Med 1996; 154:436-441. 122. Sharshar T, Hopkinson NS, Ross ET, Jonville S, Dayer MJ, Nickol AH, Lofaso F, Moxham J, Polkey MI. Motor control of the costal and crural diaphragm-insights from transcranial magnetic stimulation in man. Respir Physiol Neurobiol 2005; 146:5-19. 123. Glerant JC, Mustfa N, Man WD, Luo YM, Rafferty G, Polkey MI, Moxham J. Diaphragm electromyograms recorded from multiple surface electrodes following magnetic stimulation. Eur Respir J 2006; 27:334-342. - 89 - Bibliografía 124. Beck J, Sinderby C, Weinberg J, Grassino A. Effects of muscle-to-electrode distance on the human diaphragm electromyogram. J Appl Physiol 1995; 79:975-985. 125. Sinderby C, Lindstrom L, Grassino AE. Automatic assessment of electromyogram quality. J Appl Physiol 1995; 79:1803-1815. 126. Sinderby CA, Beck JC, Lindstrom LH, Grassino AE. Enhancement of signal quality in esophageal recordings of diaphragm EMG. J Appl Physiol 1997; 82:1370-1377. 127. Beck J, Sinderby C, Lindstrom L, Grassino A. Effects of lung volume on diaphragm EMG signal strength during voluntary contractions. J Appl Physiol 1998; 85:1123-1134. 128. Sinderby C, Beck J, Spahija J, Weinberg J, Grassino A. Voluntary activation of the human diaphragm in health and disease. J Appl Physiol 1998; 85:21462158. 129. Bartolo A, Roberts C, Dzwonczyk RR, Goldman E. Analysis of diaphragm EMG signals: comparison of gating vs. subtraction for removal of ECG contamination. J Appl Physiol 1996; 80:1898-1902. - 90 -