“Conductividad electrolítica : una demostración sencilla y segura” 1
Anuncio

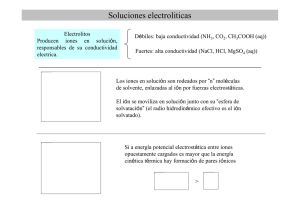
TÍTULO: “Conductividad electrolítica : una demostración sencilla y segura” AUTORAS: 1. Pamela Grajales Rodríguez 2. María José Porras Salgado PROFESO(ES) ASESORAS • • Guadalupe Machín Ramírez Olivia Salazar Elizalde ESCUELA: Colegio Marymount ÁREA EN QUE PARTICIPA: Ciencias Biológicas, Químicas y Ambientales. Secundaria. Experimental. MARCO TEÓRICO Algunas sustancias, como los ácidos y bases, tienen una característica especial: cuando se disuelven en agua, conducen la electricidad (no así en estado “puro”) Svante Arrhenius ( 1859-1927) propuso una explicación para este fenómeno: los ácidos y bases al disolverse en agua se disocian ( “separan”) y generan dos o más iones con carga eléctrica. A estas sustancias les llamó electrolitos. Desde el punto de vista químico, la mayoría de los electrolitos presentan enlaces iónicos ( o covalentes polares); mientras que las sustancias con enlaces covalentes moleculares no conducen la electricidad, por eso se les llama no electrolitos. Así, un electrolito o electrólito es cualquier sustancia que contiene iones libres, los que se comportan como un medio conductor eléctrico[1]. Algunas características de los electrolitos son: [1] • En estado sólido no conducen la electricidad, ya que las fuerzas de atracción entre los iones que forman el cristal, no les permite moverse con facilidad, como cuando se encuentran disueltos. • En disolución los iones se encuentran libres para moverse en el disolvente, por eso cuando se hace pasar una corriente eléctrica, la migración de los iones cierra el circuito y permite la conducción. • En la conducción iónica: los cationes se mueven en sentido contrario a los aniones. Algunas aplicaciones de la electrólisis son: [2] • La electrólisis de una solución salina permite producir hipoclorito (cloro): este método se emplea para conseguir una cloración ecológica del agua en las piscinas. • La electrometalurgia es un proceso para separar el metal puro de compuestos usando la electrólisis. Por ejemplo, el hidróxido de sodio es separado en sodio puro, oxígeno puro y agua. PROPÓSITO “ Armar un dispositivo (circuito eléctrico) que permita observar la conductividad eléctrica de los electrolitos de manera segura”. OBJETIVOS • Diseñar y armar un dispositivo (circuito eléctrico), que funcione con pilas, de manera que los experimentos que se realicen con este dispositivo no sean riesgosos, como cuando se emplea corriente eléctrica alterna ( toma de corriente). • Que el dispositivo permita observar la conductividad eléctrica de diferentes electrolitos. • Demostrar que una solución electrolítica funciona como conductor de electrones, permitiendo que se cierre un circuito eléctrico y como evidencia se prenda un foco. METODOLOGÍA MATERIAL: Una pila, frascos de vidrio , agua , 20 centímetros de cable duplex (dos colores: rojo y negro), 20 centímetros de cable blanco, foco pequeño, soquet, soldadura y cautín, pedazo de metal, papel aluminio , agua para beber, navaja de precisión , naranja , clips, clavos , agitador , cinta de aislar, vasos de precipitados , sales de diferentes tipos, y tijeras, agua, jugo de naranja y otros. DESARROLLO EXPERIMENTAL: Armado del dispositivo: 1.- Circuito eléctrico: montar el dispositivo de la figura: fijando en una base (1) un soquet (2) para el foco (3), y dos laminillas para la pila(4). Conectar los cables (5). Es necesario soldar para que quede fijo. 3 1 2 5 4 2. Para verificar que el dispositivo funcione, hacer que se toquen ambos cables (electrodos). El foco debe encender. Probando la conductividad: 1. Utilizando el dispositivo elaborado anteriormente, probar con diferentes disoluciones, colocando en un vaso de precipitados 25 ml de disolución, e introducir los electrodos, cuidando que no se toquen. 2. Para las pruebas emplear disoluciones de sales (electrolitos) y otras sustancias como jugo de naranja, agua mineral, bebidas deportivas que contenga electrolitos o una solución con azúcar. Si el foco enciende la sustancia se considera un electrolito, si no enciende es un “no electrolito”. TABLA DE RESULTADOS: SUSTANCIA FÓRMULA ¿ENCIENDE EL FOCO? ¿ES UN ELECTROLITO? RESULTADOS: El proyecto se encuentra en desarrollo. Esperamos que el dispositivo funcione de manera adecuada para poderlo utilizar en las prácticas de Ciencias en el colegio. BIBLIOGRAFÍA: [1] http://es.wikipedia.org/wiki/Electr%C3%B3lisis. Marzo, 2011. [2] http://enciclopedia.us.es/index.php/Electr%C3%B3lisis. Marzo, 2011. CONSULTA: • V. Talanquer, G. Irazoque. Ciencias 3 (Química) . Ed. Castillo. México 2008. pp. 120 -123.