Descargar Artículo Acidosis in Feedlot Cattle
Anuncio

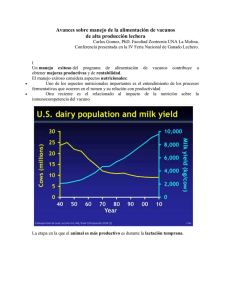
0749‐0720/07/$ ‐ ver materia _ 2007 Elsevier Inc. todos los derechos reservados. doi:10.1016/j.cvfa.2007.04.002 vetfood.theclinics.com Acidosis en ganado bovino en corral de engorda T.G. Nagaraja, DVM, MS, PhDa, *, Kelly F. Lechtenberg, DVM, PhDb ∗ a Departamento de diagnóstico en medicina/pato biología, Colegio de Medicina Veterinaria, 305 Coles Hall, Kansas State University, Manhattan, KS 66506‐5606, EUA b Midwest Veterinary Services, Incorporated, Oakland, NE 68405, EUA La mortalidad y la morbilidad asociadas a las alteraciones digestivas en el ganado bovino en corral de engorda se encuentran en el segundo lugar en importancia y son sobrepasadas solamente por las enfermedades respiratorias. Entre los desórdenes digestivos del ganado bovino en corral de engorda, la acidosis es una de las más comunes y se ha reconocido su importarcia desde que el uso de granos en el alimento se volvió una práctica ampliamente utilizada. La acidosis en la engorda es el resultado del consumo de carbohidratos fermentables en cantidades suficientes como para causar una acumulación de ácidos orgánicos en el rumen, con una reducción concurrente en el pH [1]. Los ácidos orgánicos son productos de la fermentación microbiana de la materia alimenticia. En una situación normal con un consumo normal, los ácidos orgánicos no se acumulan en el rumen porque la absorción ruminal se mantiene al mismo ritmo al que se van produciendo. En esas situaciones, la fermentación ruminal es estable y el pH ruminal puede variar desde 5.6 hasta 6.5, con un pH promedio típico de alrededor de 5.8 a 6.2; el pH puede ocasionalmente caer por debajo de 5.6 por un breve periodo de tiempo durante el ciclo normal de alimentación. La fluctuación ocurre debido a que el pH ruminal se encuentra influenciado por el consumo de granos, por la capacidad inherente del animal a proporcionar amortiguadores y por la proporción de uso y absorción de esos ácidos. No es infrecuente que se de una reducción del pH ruminal después de la alimentación en más de una unidad de pH, un aumento mayor a 10 veces en la concentración de iones hidrógenos. En la Figura 1 se presenta un ejemplo de un patrón diurno de pH ruminal que se monitoreó de forma continua a lo largo de un periodo de 2 días en un novillo alimentado con 92.5% de concentrado de una dieta con base en grano de maíz agregado al alimento una vez al día [1,2]. En ganado bovino de engorda al que se alimenta con dietas altas en concentrados, se minimiza la habilidad del animal para amortiguar el rumen debido a la limitada masticación y a la poca rumia, y por lo tanto, a una insuficiente secreción de saliva [3]. Además, si se encuentra dañada la capacidad de absorción de la pared ruminal debido a que tiene papilas ruminales anormales o presenta rumenitis, se encuentra afectada la habilidad del animal para mantener un pH ruminal estable. Para la función normal y estable del rumen el pH ruminal es un factor crítico, ya que tiene un profundo impacto sobre la población microbiana, sobre los productos de la fermentación y sobre las funciones fisiológicas del rumen, principalmente sobre la función de absorción y de motilidad. Por lo tanto, la acumulación no‐fisiológica de los ácidos orgánicos y la subsiguiente reducción de pH por debajo de lo normal (<5.6) llevan a tener un impacto significativo sobre: la actividad microbiana, la función del rumen y sobre la productividad y la salud de los animales. Britton y Stock [4] fueron los primeros en reconocer que la “acidosis no es una enfermedad, sino más bien un continuo en grado de acidez ruminal”, y para sintetizar, se categorizan como aguda o subaguda, esta clasificación se basa en el pH ruminal, en el tipo de ácido que es el responsable del bajo pH y si existe evidencia de signos clínicos (Cuadro 1). ∗ Correspondencia dirigida a:. Dirección de e‐mail: [email protected]‐state.edu (T.G. Nagaraja). pH ruminal Dieta con base 92.5% de maíz enrolado agregado al alimento una vez por día. Rango de pH = 4.9 a 6.3 Horas Fig. 1. pH ruminal a lo largo de de un periodo de 2 días de un novillo adaptado a una dieta con 92.5% de concentrado con base en maíz rolado agregado al alimento una vez al día a las 0 horas y a las 24 horas (flechas). Se monitoreó el pH ruminal con un electrodo de pH suspendido sumergible que fue enchufado a una cánula ruminal. Se registró la lectura de pH cada minuto. (Datos de Nagaraja TG, Titgemeyer EC. Acidosis in beef cattle. J Dairy Sci 2007;90(ESuppl. 0):E17–E38; y Cooper RJ, Klopfenstein TJ, Stock RA, et al. Observations on acidosis through continual feed intake and ruminal pH monitoring. En: Nebraska Beef Report. Lincoln (NE): University of Nebraska; 1998. p. 75–7.) Cuadro 1 Comparación de acidosis aguda y subaguda en ganado bovino. Punto Acidosis aguda a Acidosis subaguda b Presente Ausente Mortalidad Si No Cambios ruminales Productos de la fermentación pH ruminal <5.0 5.0 ‐ 5.5 Ácidos orgánicos totales Aumentada Aumentado Ácido láctico Alto (50 ‐ 120 mmol) Normal (0 ‐ 5 mmol) AGVs Altos al inicio y a continuación por debajo de lo normal (< 100 mmol) Alto (150 ‐ 225 mmol) Streptococcus bovis Aumento inicial Sin cambios Lactobacillus sp. Aumento Aumento Productoras de ácido láctico Aumento Aumento Que utilizan ácido láctico Disminución Aumento Protozoarios ciliados Ausentes o reducidos Ausentes o reducidos Etanol Aumentada No se determinó Aminas aumentada No se determinó Endotoxinas Aumentada Aumentada Cambios sanguíneos pH Disminuida (<7.350) Normal a ligeramente disminuida Signos clínicos Microbios Productos microbianos “tóxicos” Ácido láctico Aumentada, particularmente D(‐) Normal Bicarbonato Reducción marcada (<20 meq/l) Normal a reducida de forma transitoria Status de base Déficit de base Exceso de base Volumen de paquete celular Aumentada (>40%) Normal (30%–35%) Endotoxinas Si Si Mediadores de la inflamación Si Si Rumenitis Si Si Laminitis Si Si Polioencefalomalacia Si Si Secuelas Abscesos en hígado si Si a Cambios en las variables de respuesta se encuentran en relación al animales adaptado a forraje b Cambios en las variables de respuesta se encuentran en relación al animal adaptado al grano. De Nagaraja TG, Titgemeyer EC. Acidosis in beef cattle. J Dairy Sci 2007;90(ESuppl. 0): E17–38; con permiso. Microbiología ruminal y acidosis Los microbios ruminales responden a una disponibilidad en aumento de sustratos fermentables, como lo son los almidones y los azúcares, aumentando así su tasa de crecimiento y las actividades de fermentación. Esta situación lleva a una producción en aumento de productos de la fermentación, particularmente de ácidos grasos volátiles (AGVs). Cambios bacterianos Los cambios bacterianos asociados con la acidosis ruminal incluyen principalmente cambios en las poblaciones de bacterias fermentadoras de almidones y azucares solubles (bacterias amilolíticas, fermentadoras de maltosa y de glucosa) y bacterias fermentadoras de ácido láctico. La proporción de bacterias amilolíticas en el rumen puede llegar a ser tan alta como en un 90% a un 95% del total de bacterias que se cultivan en animales alimentados con granos [5]. Las bacterias ruminales que rápidamente fermentan almidones y azúcares y contribuyen a una rápida acumulación de ácido láctico DL y de AGVs incluyen: Selenomonas ruminantium, Streptococcus bovis y Lactobacillus sp. El S. ruminantium es un organismo dominante (22%–51% del total de las bacterias cultivables) en el rumen de los animales adaptados a una dieta alta en granos [6]. El S. bovis es anaerobio facultativo y su conteo en animales alimentados con forrajes no es alto (10 –10 /g), pero su número puede alcanzar 10 /g del contenido ruminal si existe un exceso de carbohidratos fermentables. Aunque muchas bacterias ruminales pueden utilizar el almidón, el éxito relativo del S. bovis es el resultado de su rápida tasa de crecimiento (con un tiempo de duplicación tan bajo como de 12 minutos) y por la rápida degradación del almidón en los granos de cereal que realiza [7]. El crecimiento explosivo del S. bovis en respuesta a la disponibilidad de carbohidratos fermentable se observa solamente en situaciones donde el animal no está adaptado al grano o durante el periodo de la dieta escalonada o set‐up. De forma paradójica, una vez que el ganado se adaptó a la dieta con granos, el número de S. bovis declina 10,000 veces y son similares a los del ganado que se alimenta de forraje; esta declinación no se encuentra enteramente relacionada con el pH ruminal [8]. Aunque se considera que el S. bovis es de alguna manera tolerante al ácido [9], no es tan tolerante como los Lactobacilli y su tasa de crecimiento se reduce si el pH es menor a 6.0 [8,10]. La producción de ácido láctico por el S. bovis causa que el pH ruminal decline, lo cual inhibe las tasas de crecimiento de la mayoría de las bacterias ruminales y que los Lactobacilli tolerantes al ácido se conviertan en los predominantes. El papel del S. bovis es iniciar la cadena de eventos que eventualmente llevarán a la acidosis ruminal. Por lo tanto, el S. bovis se considera el principal agente etiológico de la acidosis aguda, y las estrategias de intervención, como el uso de antibióticos y vacunas, frecuentemente tienen como blanco el control del crecimiento del S. bovis en el rumen [11,12]. Los Lactobacilli ruminales son más resistentes a un pH bajo en comparación con el S. bovis, lo cual explica porque se vuelven dominantes en un rumen ácido (pH <5.6). El aumento significativo en la población de Lactobacilli ruminal es una característica común de la acidosis aguda y subaguda [12–14]. El rumen tiene Lactobacilli homofermentadores (isómeros L‐ y D‐) y heterofermentadores (lactato y acetato o etanol), y debido a las numerosas especies que existen, los aislamientos del rumen no se identifican normalmente a nivel de especie, sino más bien frecuentemente se describen como “Lactobacillus sp.” Dos especies predominantes de Lactobacilli 4 11 7 que se han identificado y caracterizado bien, particularmente en animales adaptados a granos, incluyen el Lactobacillus ruminis y el Lactobacillus vitulinus [15,16]. La primera especie produce principalmente ácido láctico L (+) y la última produce solamente el isómero D. El lactato es un producto intermedio de la fermentación y se metaboliza aun más a AGVs (Fig. 2). La adaptación del rumen a una dieta alta en granos incluye principalmente el aumento en estas poblaciones de bacterias capaces de utilizar el ácido láctico [17,18]. Las especies bacterianas que fermentan ácido láctico incluyen Anaerovibrio lipolytica, Fusobacterium necrophorum, Megasphaera elsdenii, Peptostreptococcus asaccharolyticus, S. ruminantium subsp lactilytica, Propionibacterium acnes y Veillonella parvula. De estas, el M. elsdenii y el S. ruminantium subsp lactilytica son los organismos fermentadores de lactato predominantes en animales que se alimentan con granos [18,19]. El M. elsdenii, un cocus grande Gram negativo, es probablemente el organismo ruminal más importante con respecto a la fermentación de ácido láctico y por lo tanto, tiene un papel central en la prevención de la acumulación de ácido láctico ruminal e animales adaptados a los granos [17]. Endotoxinas bacterianas Las endotoxinas o lipopolisacáridos son un componente de la pared celular de todas las bacterias Gram negativas, sin importar si son patógenas o no. Debido a que las bacterias ruminales son predominantemente Gram negativas y que la muerte y desintegración de cierto número de bacterias en una población son procesos bacterianos normales, comúnmente se encuentran presente endotoxinas en el fluido ruminal. La concentración de endotoxina es más alta en animales alimentados con granos en comparación con los que se alimentan con forraje [20,21]. Se ha sospechado durante mucho tiempo que las endotoxinas ruminales contribuyen a la patogénesis de la acidosis ruminal [22,23]. Los cambios clínicos y en la bioquímica sanguínea asociados con la acidosis ruminal son de alguna manera similares a los observados después de la administración de endotoxinas [24–26]. En el rumen acidótico, debido a la caída precipitada (como en la acidosis aguda) o a las fluctuaciones en el pH ruminal (como en la acidosis subaguda), las bacterias Gram negativas pueden sufrir lisis, liberando así concentraciones significativas de endotoxinas libres en el rumen [24,27–30]. Para que la endotoxina bacteriana participe en la patogénesis de la acidosis, debe absorberse dentro de la sangre desde el tracto gastro intestinal. Sin embargo el hecho de que la endotoxina pueda absorberse o traspasar del rumen o de cualquier otra parte del intestino hacia la sangre aun permanece sin resolver. Debido a la gran combinación de endotoxina y a la disponibilidad de una gran superficie de absorción, el rumen parece ser el sitio lógico para este consumo de endotoxinas. También, la endotoxina que pasó dentro del abomaso o del intestino delgado puede inactivarse por medio de por medio de ácidos o enzimas [26]. Sin embargo, el epitelio ruminal parece ser impermeable a las endotoxinas [1]. Almidón y azúcares solubles Streptococcus bovis Lactobacillus sp Bacterias amlolíticas Piruvato Resistentes al ácido (pH < 5.5) Sensibles al ácido (pH < 5.0) Sensibles al ácido (pH < 5.5) Lactato AGVs Bacterias fermentadoras de lactato Fig. 2. Producción de lactato y de AGVs de la fermentación del almidón y de los azúcares solubles y como se involucran los grupos bacterianos ruminales sensibles y resistentes al ácido. Cambios por protozoarios ciliados Se cree que los protozoarios ciliados so mucho más sensibles que las bacterias a las fluctuaciones y reducciones en el pH ruminal, de ahí que el pH es un factor crítico en el mantenimiento de protozoarios ciliados en el rumen. Por lo tanto, un cambio microbiano consistente asociado con la acidosis ruminal es una marcada reducción en el número de protozoarios ciliados [13,31,32]. La reducción significativa en el número de protozoarios, y en algunos casos su completa eliminación, es una característica común de la acidosis aguda y subaguda. El género Entodinium es el protozoario ruminal más resistente a un pH bajo. Lo cual explica porque este género es el más dominante, llegando al 90% al 99% de la población total en el ganado bovino con dietas altas en granos [33–35]. Los protozoarios ciliados tienen un papel significativo en el metabolismo del almidón ruminal y del ácido láctico [32]. En términos de producción de ácido láctico, los protozoarios Holotriquia, Isotricha y Dasytricha, producen isómeros de ácido láctico como un producto importante de la fermentación de almidón y azúcar, mientras que los entodinioformes producen solamente cantidades traza [36]. Por otro lado, la fermentación del ácido láctico solamente se asocia con los protozoarios entodinioformes y no con los protozoarios holotriquias [37]. Aunque no se conoce la contribución relativa de los protozoarios ciliados al tamaño y la conversión combinados de lactato ruminal, los protozoarios ciliados y la concentración de ácido láctico generalmente tiene una relación inversa en el rumen [38,39], probablemente causada por el consumo de azúcares y almidones por los protozoarios ciliados, lo cual secuestra estos substratos de la fermentación bacteriana, también, la eliminación de lactato se aumenta en presencia de protozoarios entodinioformes [37,39]. Incluso, los protozoarios ciliados pueden tener una influencia indirecta sobre la producción de ácido láctico o en su acumulación por su interacción con las bacterias. Principalmente debido a su actividad predadora, la presencia de protozoarios ciliados se asocia con una densidad bacteriana reducida en el rumen [36]. Por lo tanto, los protozoarios ciliados son capaces de reducir la tasa y extensión de la fermentación de almidón en el rumen [40]. La reducción en la velocidad de la fermentación del almidón debería llevar a una producción más estable de AGV y a un pH posprandial más alto en el rumen. La reducción en la actividad bacteriana da cuenta de un efecto moderador sobre la fermentación ruminal que los protozoarios ciliados ejercen en los animales alimentados con dietas altas en granos. Este hallazgo se apoya en los valores más altos de pH y en las concentraciones más bajas de AGVs en el rumen del ganado que tienen concentraciones normales de protozoarios, en comparación con los animales a los que se les quitó la flora ruminal [41,42]. Por lo tanto, los protozoarios ciliados tienen un papel beneficioso, al que Hungate llamó el “efecto amortiguador o buffering” [43], en el rumen del ganado alimentado con grano. Esta conclusión es contraria a la percepción de que la contribución de los protozoarios ciliados al metabolismo ruminal de animales con dietas altas en grano no es significativa debido a que las dietas con base en almidón reducen, o incluso elimina, la población de protozoarios [43]. Fermentación ruminal sobre los productos y la acidosis La acidosis ruminal representa varios grados de acidez en el rumen, por lo tanto, la acumulación total de ácido orgánico (AGV y ácido láctico) dicta si el rumen es acídico o no [4,44]. El pH ruminal de 5.6 o más bajo se considera generalmente lo típico en la acidosis ruminal, un rango de pH de 5.0 a 5.5 se considera como acidosis aguda o subaguda, y un pH por debajo del 5.0, acercándose al 4.5 o por debajo, es considerado acidosis aguda (Fig. 3A, B) [4,44,45]. En la acidosis aguda, la razón por la que el pH alcanza 4.5 o menos es la acumulación de ácido láctico, la que es el resultado de una producción en aumento de y una fermentación de ácido láctico disminuida (ver Fig. 3A,). La concentración total de AGV generalmente aumenta al inicio de la acidosis, pero con la progresión de la acidosis, las concentraciones de AGV declinan de forma dramática debido a la destrucción de la flora bacteriana normal y a la dilución ruminal, como resultado de una afluencia de fluidos para compensar el aumento de osmolaridad [23]. El aumento e la producción es esencialmente el resultado del establecimiento de una población de Lactobacilli tolerante al ácido y la disminución en la fermentación tiene ocurrencia debido a que el pH se encuentra por debajo del rango necesario para que se encuentren activas las bacterias fermentadoras de lactato [46]. En la acidosis subaguda, la razón por la que el pH cae por debajo de 5.6 es la acumulación de AGV, resultado de una combinación de la sobreproducción (mayor cantidad de sustrato) y posiblemente una absorción disminuida (ver Fig. 3B). Guía de términos Ruminal pH Concentration, mM Molar percent pH ruminal Concentración en mM Porcentaje molar VFA AGV Total organic acid Ácido orgánico total Lactic acid Ácido láctico Acute acidosis Acidosis aguda Subacuteacidosis Acidosis subaguda Fig. 3. Concentración total de ácido orgánico (C) y proporciones molares de AGV totales (‐) y ácido láctico (:) en acidosis aguda (A) y en acidosis subaguda (B). (de Nagaraja TG, Titgemeyer EC. Acidosis in beef cattle. J Dairy Sci 2007;90(ESuppl. 0):E17–38; con permiso). Guía de términos Amylolytic bacteria L(+) Lactate Pyruvate D(-) Lactate Valerate Propionate Acetate D-LDH L-LDH Racemase Acrylate Succinate Starch and soluble sugars Butyrate PFL POR Bacterias amilolíticas Lactato L(+) Piruvato Lactato D(-) Valerato Propionato Acetato Deshidrogenasa láctica D Deshidrogenasa láctica L Racemasa Acrilato Succinato Almidón y azúcares solubles Butirato piruvato formato-liasa piruvato óxidoreductasa Fig. 4. Principales intermediarios metabólicos y grupos de bacterias ruminal involucrados en la fermentación del almidón y de los azúcares solubles a ácido láctico y AGVs (acetato, propionato, butirato y valerato). D‐LDH, deshidrogenasa láctica D; L‐LDH, deshidrogenasa láctica L; PFL, piruvato formato‐liasa; POR, piruvato óxidoreductasa. Aunque el ácido láctico se produce durante la acidosis subaguda, no se acumula porque las bacterias que fermentan acetato permanecen activas [13] y rápidamente lo metabolizan a AGVs. Conforme el pH se acerca a 5.0 o por debajo de esto por un periodo sostenido, el crecimiento de bacterias que fermentan lactato es inhibido y por lo tanto, el lactato se comienza a acumular. Por lo tanto, la acidosis subaguda tiene el potencial de transición a una acidosis láctica si el pH de 5.0 se mantiene por un periodo de tiempo. Sin embargo, la duración de tiempo necesaria para que esto suceda no se ha determinado aun. En el rumen, el lactato es metabolizado a principalmente acetato, propionato y a butirato, así como en alguna extensión, caproato y a valerato (Fig. 4). Las proporciones molares de los productos de fermentación provenientes del lactato se encuentran influenciadas por las especies bacterianas, por el pH ruminal e incluso por la presencia de glucosa. El S. ruminantium subespecie lactilyca metaboliza el lactato a succinato y a propionato, principalmente. El M. elsdenii, un organismos ruminal predominante que utiliza lactato, produce butirato, caproato, and valerato en presencia de glucosa, con una concurrente reducción de propionato [47]. Posiblemente, los productos como el butirato y el valerato permiten a los electrones de la oxidación del lactato que se utilicen. En animales con acidosis experimentalmente inducida con un desafío intraruminal de almidón, se ha observado que cuando se previene la acumulación de ácido láctico con el uso de antibióticos como la monensina, aumentan grandemente las concentraciones de butirato y de valerato, indicativo de que hay actividad de M. elsdenii [48,49]. Aunque se considera que los ácidos ruminales son los principales contribuyentes a la patofisiología de la acidosis, se ha implicado que otros productos de la fermentación microbiana, como el etanol y las aminas, tienen un papel en ella [44,50]. La concentración ruminal de etanol, principalmente un producto de Lactobacilli heterofermentadores, aumenta bajo condiciones de acidosis [51], pero no es suficiente mente alto como para que sea significativo. Las aminas farmacológicamente activas, como la histamina, la tiamina y la triptamina son producidas en el rumen por descarboxilación de la histidina, de la tirosina y del triptófano. Respectivamente. La histamina ha recibido atención considerable debido al papel que se le ha atribuido en la laminitis. La destrucción del proceso hemodinámico normal es un importante factor en el desarrollo de la laminitis [52]. La histamina es un potente vasodilatador y aumenta la permeabilidad capilar [53], y la asociación de histamina se ajusta bien con la teoría en nutrición del desarrollo de laminitis [52]. La producción y la acumulación ruminal de la histamina se asocian generalmente con un pH bajo [54]. Debido a que la histamina es un potente efector hemodinámico y la alteración del proceso hemodinámico normal es un importante factor causante de la laminitis, se ha sospechado por mucho tiempo que la histamina ruminal está relacionada con el inicio de la laminitis [52]. La concentración de histamina es muy variable [55], y se han observado altas concentraciones aun bajo condiciones no acídicas del rumen [56]. Sin embargo, que se absorba o no la histamina ha sido objeto de controversia [31,53]. Consumo de alimento y acidosis El tiempo crítico de ocurrencia de la acidosis es durante el periodo de la dieta escalonada o step‐up para que el animal cambie a una dieta alta en granos al entrar al corral de engorda. Cuando el ganado bovino está adaptado al grano, cualquier interrupción en los patrones de consumo de alimento, como una tormenta que lo impida, puede precipitar la acidosis. Algunos otros factores de la dieta pueden tener impacto significativo sobre los patrones de consumo y, por lo tanto, sobre la incidencia de la acidosis. El tipo (maíz con mucha humedad más que maíz rolado o sorgo) y la cantidad del grano, el procesamiento del grano (particularmente en hojuelas al vapor), el tipo y la cantidad de rastrojo y agregar aditivos al alimento (como ionóforos) influencian los patrones de consumo y la acidosis subaguda [57,58]. Los granos como el centeno, el trigo y el maíz con una alta humedad que tienen tasas rápidas de digestión ruminal de almidón, generalmente causan la mayoría de los problemas. Un estudio que ilustró la diferencia en los patrones de consumo entre los granos de maíz y de trigo se publicó por Flulton y colegas [59]. En ese estudio, se alimentó al ganado aumentado los niveles de concentrado de 35% a 55%, 75% y 90% en la dieta de maíz o trigo. Cada nivel de concentrado se proporcionó por 5 días y se monitoreó el consumo diario. El promedio del patrón de consumo a lo largo de los 5 días dentro de cada nivel para la dieta con maíz aumentó suavemente. Sin embargo, en la dieta con trigo, el consumo alcanzó cierto nivel y no aumentó más. Esta diferencia refleja la tasa más alta de digestión para el trigo en comparación con el maíz. Los datos de consumo tomados diariamente revelaron mucha variación entre cada nivel de concentrado y las fluctuaciones fueron mayores en la dieta con trigo, en comparación con la dieta con maíz. Los datos ilustran como al expresar el consumo en forma de promedio de periodo de días, por corral y demás, puede enmascarar las variaciones entre días y entre animales. El momento crítico para que tenga ocurrencia la acidosis también se encuentra durante la fase tardía de finalización, cuando los consumos son los más grandes y la pared del rumen se encuentra comprometida al máximo por tantos meses de ambientes altamente ácidos. Los animales gordos se encuentran afectados por diferentes factores relacionados a las visitas al comedero y por factores fisiológicos. Algunos factores a considerarse son: Acumulación de lodo y nieve en los corrales. Prevalencia de laminitis en el hato. Clima muy frío que haga que los animales duden en visitar el comedero de forma frecuente. Enfermedad o cojera que no estén asociadas con la laminitis. Clima extremadamente caliente o húmedo que inhiba el apetito hasta que el animal esté muy hambriento. Fluctuaciones en el contenido de materia seca de la ración, dando oportunidad a una sobrealimentación de la ración más seca Fluctuaciones en la palatabilidad del grano como cuando se encuentra disponible grano de maíz recién cosechado. Signos clínicos Los signos de acidosis son más evidentes con la acidosis aguda. El inicio de los signos clínicos es muy variable, pero normalmente se tornan aparentes 12 a 36 horas después de comer grano de forma compulsiva. En casos per agudos, el ganado puede morir dentro de las siguientes 8 a 16 horas. En la forma aguda, la acidosis es suficientemente grave como para inducir un daño significativo de las funciones fisiológicas. Los signos que se observan primero es la incoordinación, lo que es seguido por letargia. La anorexia es un hallazgo consistente. Se presenta estasis ruminal, debido al cese de la motilidad ruminal, que también es común. El completo cese de la motilidad ruminal es indicativo de un rumen altamente acídico ya que la motilidad es inhibida por altas concentraciones de ácido láctico y de AGVs, particularmente de butirato [60]. Las heces serán inicialmente pastosas y después se tornarán acuosas y frecuentemente espumosas, con un olor fétido. Se desarrollará una deshidratación significativa dentro de las siguientes 24 a 48 horas. En casos graves, los animales están recumbentes, con la cabeza metida en el flanco, como durante la paresis del parto [61]. Los animales que se recuperan después de un episodio de acidosis ruminal sostenida pueden desarrollar rumenitis, laminitis o abscesos en hígado; estos problemas se reflejarán en un desempeño reducido (consumo de alimento y ganancia de peso). Los animales que experimentan una acidosis subaguda raramente muestran signos clínicos. De forma individual los animales dentro de un corral que muestran letargia, tienen diarrea o muestran una tasa respiratoria en aumento o signos de incomodidad pueden indicar un problema potencial que requerirá mayor investigación. Un consumo de alimento reducido puede ser el signo más importante de una acidosis subaguda, lo que es difícil de discernir a nivel de animal en individual. Los patrones de consumo que sugieren fluctuaciones diarias en el consumo a nivel de corral, pueden ser importantes indicadores de acidosis subaguda. Diagnóstico de acidosis El diagnóstico de la acidosis aguda no representa mayor problema en los corrales de engorda, sin embargo, la naturaleza insidiosa de la acidosis subaguda hace que sea difícil reconocerla. Una disminución en el consumo de alimento puede ser el único signo de que existe un problema. Por lo tanto, se vuelve una necesidad el monitorear el consumo y el comportamiento de alimentación para detectar irregularidades en los patrones de consumo. Aunque los corrales de engorda pongan alimento a un corral con ganado, en realidad están alimentando a animales individuales dentro de un corral. De manera que hacer promedios del consumo de alimento basándose en corral a lo largo de un periodo de tiempo puede enmascarar las variaciones individuales y las que se dan día a día en el consumo [58], esto es especialmente cierto conforme va aumentando la cantidad de animales por corral. Grandes cantidades de ganado bovino por corral no solamente crea problemas de sociabilización, sino que también hace que sea más fácil que los animales se alejen del comedero y por lo tanto, desarrollen patrones inconsistentes de consumo. Algunos de los signos que pueden ser indicativos de acidosis en un corral de engorda incluyen: La calificación de consistencia fecal con más de 20% de deposiciones sueltas o más de 5% de acuosidad (el piso del corral parece un parche de orina con granos) indican una ácidos aguda en algunos animales. Más del 10% del ganado parecen sensibles (doloridos) en la parte frontal de las patas, con sensibilidad bilateral, causando que los animales parezcan estar caminando en vidrios rotos. Aparece un raspado (húmedo) de las áreas laterales del ano, donde el animal roza su cola excesivamente, presumiblemente debido al efecto irritante de las heces acídicas tambien conocido como “trasero de limpiador de parabrisas”]. Puede observarse un aumento en la tasa respiratoria en algunos animales en un intento de eliminar dióxido de carbono para compensar la acidosis metabólica. El pH ruminal puede ser un buen indicador de la acidosis subaguda; sin embargo, un pH ruminal dentro de un rango de acidosis subaguda (5.0 ‐ 5.5) puede no reflejar un estado acídico a menos que se sostenga por un tiempo. Por lo tanto, el muestreo del pH del contenido ruminal, además de no ser muy práctico en una situación de corral de engorda, puede tener un valor limitado. En vacas lecheras, se ha evaluado la aspiración percutánea con aguja, llamada rumenocentesis, como una herramienta de diagnóstico para la acidosis subaguda. Nordlund [62] recomendó que un pH por abajo del 5.5 en más del 30% de las vacas en un subgrupo (mínimo de 10 vacas), seleccionadas de un grupo de alto riesgo durante los primeros 60 días posparto, deberá considerarse como indicativo de acidosis subaguda. No se han conducido estudios similares en ganado bovino en corral de engorda. Prevención de la acidosis El control de la acidosis claramente depende de un manejo de la nutrición con sentido común [57]. Debido a que los problemas de la acidosis subaguda no pueden reconocerse fácilmente por el personal del corral de engorda, es difícil instituir las intervenciones que ayuden a adelantarse al inicio de la acidosis subaguda, sin embargo, es importante estar conscientes de los factores nutricionales y de manejo que influencian la acidosis subaguda. La evaluación de la dieta sería el primer paso para un manejo efectivo de la acidosis. El tiempo crítico para que se de la acidosis es durante el periodo de dieta escalonada o step‐up para que el animal cambie a dietas altas en grano, cuando el ganado entra a los corrales de engorda. De forma tradicional, se proporcionan dietas que tienen más concentrado con cantidades de grano cada vez más grandes a lo largo de un periodo de 3 a 4 semanas para minimizar el riesgo de acidosis [63]. Sin embargo, puede haber acidosis aun cuando se está ayudando a los animales a adaptarse gradualmente a la dieta con granos [64], lo que indica que la habilidad de los bovinos a soportar los desafíos con granos puede ser muy variable [63,65]. El tipo y cantidad de grano, el tipo de procesamiento del grano, el tipo y nivel de fibra, los aditivos alimenticios y un manejo prudente del comedero son factores importantes que influencian la acidosis subaguda. Los granos y los granos procesados difieren en la tasa de fermentación de almidones y aquellos que tienen tasas más altas de fermentación son más propensos a inducir acidosis. Una estrategia para minimizar el riesgo asociado con la alimentación con granos que tienen altas tasas de fermentación (trigo, centeno, maíz alto en humedad y demás) es mezclar esos granos con los que tienen una tasa baja de fermentación de almidones [66,67]. Stock y colegas [66] han demostrado que la inclusión del 25% de sorgo rolado en una dieta de maíz con alta humedad molido mejora el desempeño del animal en los primeros 28 días del periodo de alimentación, lo que sugiere la reducción de los efectos negativos de la acidosis. La mejora en la ganancia o en la eficiencia alimenticia resultado de estas combinaciones de granos que se dan en el alimento, en comparación con el uso de un solo grano en el alimento, es lo que los nutriólogos llaman un efecto asociativo. El grado de procesamiento del grano es también un factor que influencía la prevalencia de la acidosis. Cuando el grano ha sido vuelto hojuela por vapor de forma extensiva, el almidón se vuelve más fermentable en el rumen, dando como resultado una tasa más rápida de producción de ácido. Por lo tanto, la densidad óptima para hacer hojuelas puede reducir la ocurrencia de acidosis y mejorar la ganancia y la eficiencia alimenticia [68]. Generalmente, se agrega fibra a las dietas de finalización para controlar la acidosis y para una transición más suave durante la adaptación a dietas altas en granos. El dar fibra en la dieta implica problemas de manejo y de mezclado en los corrales de engorda, de manera que la tendencia ha sido intentar dar dietas con menos fibra, o incluso sin fibra. Los niveles de fibra en los corrales de engorda son ahora más bajos (0% a 8% de materia seca) en comparación con hace 15 o 20 años (10 a 15% de materia seca) [70]. El costo por unidad de energía digerible es mucho mayor con fibra que con grano. Agregar fibra a una dieta que solo es concentrado generalmente aumenta el consumo de alimento, la ganancia y la eficiencia alimenticia si el corral de engorda tiene un problema de acidosis. Sin embargo, si la acidosis no es un problema, entonces el agregar la fibra aumentará el consumo pero no la ganancia y por lo tanto, reduce la eficiencia alimenticia [70]. El verdadero impacto de la fibra puede ser el efecto del factor de raspado para mantener la salud y la integridad de las papilas ruminales [71]. Las papillas ruminales saludables y morfológicamente normales tienen una superficie de absorción mayor y tasas más altas de absorción de nutrientes, en comparación con papilas deformes y anormales. Se han utilizado ionóforos, particularmente la monensina, como una herramienta de manejo para modular el consumo de alimento y para controlar la acidosis [58]. La monensina se utiliza ampliamente como un aditivo del alimento en ganado bovino en corral de engorda para mejorar la eficiencia alimenticia. Los efectos positivos de la monensina incluyen la modulación del consumo de alimento y los cambios beneficiosos en los patrones de fermentación ruminal [72]. Se ha observado una reducción o modulación del consumo de alimento de forma más consistente con la monensina tanto en ganado alimentado con granos como en ganado alimentado con forraje [64,73]. Otros ionóforos (lasalocida, propionato de laidlomicina y salinomicina) generalmente no afectan o algunas veces aumentan el consumo de alimento [72]. El mecanismo de la modulación del consumo de alimento con monensina aun no se comprende en su totalidad. Posiblemente, incluye una combinación de efectos antimicrobianos sobre la actividad fermentadora ruminal y la aversión al alimento atribuible al sabor de la monensina. Los estudios en corrales de engorda con ganado que abruptamente cambió a dietas altas en concentrados que contenían 10 a 30 g/ton de monensina mostraron que la monensina a 30 g/ton disminuía la varianza promedio en el consumo diario [74]. La disminución en la fluctuación del consumo diario lleva a una fermentación ruminal más estable, y por lo tanto, a una menor oportunidad para que se de la acidosis. Ciertos antibióticos no ionóforos como la tilosina y la virginiamicina, que son inhibitorias de bacterias Gram positivas productoras de ácido láctico [72], pueden proporcionar estabilidad a la fermentación ruminal y proveer de protección contra la acidosis [48,72]. También se han utilizado amortiguadores o buffers (bentonita, bicarbonatos) para controlar la acidosis en ganado bovino en corral de engorda [75]. Se ha sugerido que las grasas disminuyen la incidencia de acidosis al disminuir la tasa de fermentación ruminal de almidones, probablemente al recubrir los gránulos de almidón y limitando la adhesión microbiana, así como debido a los efectos antimicrobianos sobre loa ácidos grasos [76]. Sin embargo, en un reporte reciente que evalúa los efectos del nivel y tipo de grasa sobre la acidosis subaguda, Krehbiel y colegas [77] concluyeron que agregar grasas a las dietas de finalización con base de maíz rolado no aumenta la incidencia de acidosis subaguda. La influencia de la grasa suplementada sobre la acidosis puede depender de la cantidad y tipo de grano. Los subproductos de grano, como harinillas provenientes del trigo, alimentos con gluten, granos de destilería [distiller’s grains o DDG´s, por su nombre y siglas en inglés] y otros que se utilizan comúnmente en las dietas de finalización de ganado bovino en engorda. Normalmente, estos productos son el resultado de la remoción del almidón durante el proceso de molido. Generalmente, estos productos tienden a aliviar la ocurrencia de acidosis en el corral de engorda debido a que su inclusión reemplaza una porción del grano del cereal en la dieta. Los DDG´s, un subproducto derivado de la producción del etanol por fermentación de levaduras, particularmente del maíz, son ampliamente utilizados como alimento para rumiantes [69]. La mayoría de los almidones del grano se fermentan a etanol, concentrando de forma efectiva en tres veces los componentes restantes del grano, incluyendo su cascarilla, proteína y fracciones germinativas [78]. En ganado bovino, los DDG´s se utilizan a 6% ‐ 15% de la materia seca de la dieta, principalmente como una fuente de proteína a suplementar o a 25% ‐ 40% de la materia seca de al dieta, principalmente como una fuente de energía para reemplazar a los granos de cereales [79]. Los estudios han demostrado que proporcionar en el alimento de gluten de maíz húmedo o DDG´s lleva a un desempeño similar, o incluso mejor, que de las dietas con granos que sirven de control o testigo [80,81]. La mejora en el desempeño de ganado bovino en corral de engorda con subproductos que reemplazan a los granos sugiere que el posible alivio de los efectos negativos de la acidosis. El manejo de la carga ácida en el corral de engorda se ha vuelto más fácil con el cambio de raciones de finalización altas en granos procesados a aquellas que contienen grandes cantidades de subproductos de la fermentación, como los DDG´s. En la opinión del autor, este cambio representa un único cambio significativo en la alimentación desde la introducción de monensina en la engorda. Esencialmente, los nutriólogos tienen muchas estrategias de intervención en la dieta para minimizar y manejar la acidosis en ganado bovino en corral de engorda. Sin embargo, a pesar de la estrategia utilizada, el manejo efectivo de la acidosis depende del manejo diario del comedero. Una meta de los nutriólogos y de los que alimentan al ganado en lo que se refiere al manejo de comedero, es el de proporcionar la cantidad correcta de alimento en el momento deseado [82]. En muchos corrales de engorda, el manejo tradicional del comedero es la disponibilidad continua de alimento en el comedero para asegurar un consumo ad libitum del ganado. Otra estrategia, llamada manejo de comedero limpio, es poner todo el alimento de un corral para que se consuma antes de la próxima entrega, y los comederos permanecen limpios por un periodo de tiempo [82]. Esta estrategia tiene un gran potencial de disminuir el consumo en comparación con el programa de alimentación ad libitum y por lo tanto reducir la ganancia diaria [83]. Algunos riesgos que se presente la acidosis y otros desórdenes digestivos se encuentran asociados con el manejo de un comedero limpio debido a que un animal en el corral puede consumir grandes cantidades del alimento en forma individual a una tasa muy rápida [70,83]. Para minimizar la variación en el consumo, la estrategia de manejo debe tomar en cuenta la composición de la dieta, el nivel de monensina y las respuestas de comportamiento del ganado en su medio ambiente [82]. Se requiere más investigación para desarrollar estrategias de manejo de comedero que se adapten a las diferentes dietas, a los aditivos de alimento, al ganado, al clima y al resto de factores a considerar para así minimizar el riesgo de tener acidosis en un corral de engorda. Secuelas de la acidosis La acidosis ruminal está asociada con muchos otros padecimientos en la engorda que pueden impactar de forma significativa el desempeño del animal. Brent [53] discutió la rumenitis, los abscesos hepáticos, la laminitis y la polioencefalomalacia como problemas relacionados a la acidosis [84]. Britton y Stock [4] agregaron el síndrome de muerte súbita, el timpanismo, las infecciones por clostridios y la malabsorción a la lista de problemas asociados con un episodio de acidosis. Resumen La mortalidad por enfermedades digestivas en ganado bovino en corral de engorda tienen el segundo lugar, en importancia, solamente superadas por las enfermedades respiratorias. La acidosis es un importante desorden digestivo y es probable que continúe siéndolo debido a los intentos continuos para mejorar la eficiencia en la producción de carne de res agregando al alimento más grano y menos fibra. La acidosis subaguda es la forma más prevalente de acidosis en corrales de engorda pero es difícil de diagnosticar debido a la ausencia de signos clínicos observables. Los cambios ruminales en la acidosis subaguda no son tan dramáticos como los de la acidosis aguda y no son suficientemente graves como para inducir una acidosis sistémica. La acidosis ruminal es también un factor predisponente para muchos padecimientos en ganado bovino en corral de engorda, como la rumenitis, la laminitis, la polioencefalomalacia, el síndrome de muerte súbita y los abscesos hepáticos. El control de la acidosis se alcanza grandemente por medio de un manejo con sentido común de la nutrición. Sin embargo, no existe una única estrategia o solución para controlar la acidosis en ganado bovino en corral de engorda. La monensina se ha vuelto una herramienta de manejo para dar estabildad a la fermentación ruminal, modulando el consumo de alimento y controlando la acidosis. Una efectiva estrategia de manejo debe tomar en cuenta los factores en la formulación de la dieta, un programa de alimentación consistente, un manejo prudente de comedero, el uso de subproductos sin almidón y los aditivos que se agregan al alimento con el objetivo de minimizar la variación en el consumo de alimento entre corrales y entre animales en individual. Referencias [1] Nagaraja TG, Titgemeyer EC. Acidosis in beef cattle. J Dairy Sci 2007;90(ESuppl. 0): E17–38. [2] Cooper RJ, Klopfenstein TJ, Stock RA, et al. Observations on acidosis through continual feed intake and ruminalpHmonitoring. In: Nebraska Beef Report. Lincoln (NE): University of Nebraska; 1998. p. 75–6. [3] Carter RR, Grovum WL.Areview of the physiological significance of hypertonic body fluids on feed intake and ruminal function: salivation, motility and microbes. J Anim Sci 1990;68: 2811. [4] Britton RA, Stock R. Acidosis: a continual problem in cattle fed high grain diets. In: Proceedings of Cornell Nutrition Conference for Feed Manufactures. Ithaca (NY): Cornell University; 1989. p. 8. [5] Leedle JAZ, Hespell RB. Diurnal variations in bacterial numbers and fluid parameters in ruminal contents of animals fed low‐ or high‐forage diets. Appl Environ Microbiol 1980; 44:402–12. [6] Ricke SC, Martin SA, Nisbet DJ. Ecology, metabolism, and genetics of ruminal selenomonads. Crit Rev Microbiol 1996;22:27–65. [7] McAllister TA, Cheng K‐J, Rode LM, et al. Digestion of barley, maize, and wheat by selected species of ruminal bacteria. Appl Environ Microbiol 1990;56:3146–53. [8] Wells JE, Krause DO, Callaway TR, et al. Bacteriocin‐mediated antagonism by ruminal lactobacilli against Streptococcus bovis. Federation of European Microbiological Societies 1997;22:237. [9] Russell JB. IntracellularpHof acid‐tolerant ruminal bacteria. Appl Environ Microbiol 1991; 57:3383–4. [10] Finlayson HJ. The effect of pH on the growth and metabolism of Streptococcus bovis in continuous culture. J Appl Bacteriol 1986;61:201–8. [11] Gill H, Shu SQ, Leng RA. Immunization with Streptococcus bovis protects against lactic acidosis in sheep. Vaccine 2000;18:2541–8. [12] Nagaraja TG, Miller GW. Rumen microbial changes in ionophore antibiotic‐treated steers with experimentally induced acidosis. Australian Journal of Animal Science 1989;2:465–8. [13] Goad DW, Goad CL, Nagaraja TG. Ruminal microbial and fermentative changes associated with experimentally induced subacute acidosis in steers. J Anim Sci 1998;76:234–41. [14] Slyter LL. Influence of acidosis on rumen function. J Anim Sci 1976;43:910–29. [15] Al Jassim RAM, Rowe JB. Better understanding of acidosis and its control. Recent Advances in Animal Nutrition in Australia 1999;12:91–7. [16] Sharpe ME, Latham MJ, Garvie EI, et al. Two new species of Lactobacillus isolated from the rumen, Lactobacillus ruminis sp nov and Lactobacillus vitulinus sp nov. J Gen Microbiol 1973;77:37–49. [17] Counotte GHM, Prins RA, Janssen RHA, et al. Role of Megasphaera elsdenii in the fermentation of DL‐[2‐13C] lactate in the rumen of dairy cattle. Appl Environ Microbiol 1981;42: 649–55. [18] Huber TL, Cooley JH, Goetsch DD, et al. Lactic acid‐utilizing bacteria in ruminal fluid of a steer adapted from hay feeding to a high‐grain ration. Am J Vet Res 1976;37:611–3. [19] Mackie RI, Gilchrist FMC, Roberts AM, et al. Microbiological and chemical changes in the rumen during the stepwise adaptation of sheep to high concentrate diets. J Agric Sci 1978;90: 241–54. [20] Andersen PH, Bergelin B, Christensen KA. Effect of feeding regimen on concentration of free endotoxin in ruminal fluid of cattle. J Anim Sci 1994;72:481–7. [21] Nagaraja TG, Fina LR, Bartley EE, et al. Endotoxin activity of cell‐free rumen fluid from cattle fed hay or grain. Can J Microbiol 1978;24:1253–61. [22] Dougherty RW. Physiological changes in ruminants being fed high energy feeds. In: Weinberg MS, Sheffner AL, editors. Buffers in ruminant physiology and metabolism. New York: Church and Dwight Co.; 1976. p. 49–60. [23] Huber TL. Physiological effects of acidosis on feedlot cattle. J Anim Sci 1976;43:902–9. [24] Aiumlamai S, Kindahl H, Fredriksson G, et al. The role of endotoxins in induced ruminal acidosis in calves. Acta Vet Scand 1992;33:117–27. [25] Jacobsen S, Toelboell T, Andersen PH. Dose dependency and individual variability in selected clinical, haematological and blood biochemical responses after systemic lipopolysaccharide challenge in cattle. Vet Res 2005;36:167–78. [26] Nagaraja TG, Bartley EE, Anthony HD, et al. Endotoxin shock in calves from intravenous injection of rumen bacterial endotoxin. J Anim Sci 1979;49:567. [27] Andersen PH, Hesselholt M, Jaløv N. Endotoxin and arachidonic acid metabolites in portal, hepatic and arterial blood of cattle with acute ruminal acidosis. Acta Vet Scand 1994;35:223–43. [28] Andersen PH, Jarløv N. Investigation of the possible role of endotoxin, TXA2, PGI2 and PGE2 in experimentally induced rumen acidosis in cattle. Acta Vet Scand 1990;31:27–38. [29] Gozho GN, Plaizier JC, Krause DO, et al. Subacute ruminal acidosis induces ruminal lipopolysaccharide endotoxin release and triggers an inflammatory response. J Dairy Sci 2005;88:1399–403. [30] Nagaraja TG, Bartley EE, Fina LR, et al. Relationship of rumen gram negative bacteria and free endotoxin to lactic acidosis in cattle. J Anim Sci 1978;47:1329–36. [31] Braun U, Rihs T, Schefer U. Ruminal lactic acidosis in sheep and goats. Vet Rec 1992;130: 343–9. [32] Nagaraja TG, Towne G, et al. Ciliated protozoa in relation to ruminal acidosis and lactic acid metabolism. In: Hoshino S, Onodera R, Minato H, editors. The rumen ecosystem: the microbial metabolism and its regulation. New York: Springer‐Verlag; 1990. p. 187–94. [33] Franzolin R, Dehority BA. Effect of prolonged high‐concentrate feeding on ruminal protozoa concentrations. J Anim Sci 1996;74:2803–9. [34] Hristov AN, Ivan M, Rode LM, et al. Fermentation characteristics and ruminal ciliate protozoal populations in cattle fed medium‐ or high‐concentrate barley‐based diets. J Anim Sci 2001;79:515–24. [35] Towne G, Nagaraja TG, BrandtR Jr, et al. Dynamics of ruminal ciliated protozoa in feedlot cattle. Appl Environ Microbiol 1990;56:3174–8. [36] Bonhomme A. Rumen ciliates: their metabolism and relationships with bacteria and their hosts. Anim Feed Sci Technol 1990;30:203–6. [37] Newbold CJ, Williams AG, Chamberlain DG. The in‐vitro metabolism of D, L‐lactic acid by rumen microorganisms. J Sci Food Agric 1987;38:9–18. [38] Nagaraja TG, Dennis SM, Galitzer SJ, et al. Effect of lasalocid, monensin and thiopeptin on lactate production from in vitro rumen fermentation of starch. Can J Anim Sci 1986;66: 129–39. [39] Newbold CJ, Chamberlain DG, Williams AG. The effects of defaunation on the metabolism of lactic acid in the rumen. J Sci Food Agric 1986;27:1083–90. [40] Mendoza G, Britton R, Stock R. Influence of ruminal protozoa on site and extent of starch digestion and ruminal fermentation. J Anim Sci 1993;71:1572–8. [41] Nagaraja TG, Towne G, Beharka AA. Moderation of ruminal fermentation by ciliated protozoa in cattle fed a high‐grain diet. Appl Environ Microbiol 1992;58:2410–4. [42] Veira DM. The role of ciliate protozoa in nutrition of the ruminant. J Anim Sci 1986;63: 1547–60. [43] Hungate RE. The rumen protozoa. In: Kreir JP, editor. Parasitic Protozoa. vol. 2. New York: Academic Press Inc.; 1978. p. 655–95. [44] Owens FN, Secrist DS, Hill WJ, et al. Acidosis in cattle: a review. J Anim Sci 1998;76:275–86. [45] Krause KM, Oetzel GR. Understanding and preventing subacute ruminal acidosis in dairy herds: a review. Anim Feed Sci Technol 2006;126:215–36. [46] Therion JT, Kistner A, Kornelius JH. Effect of pH on growth rates of rumen amylolytic and lactilytic bacteria. Appl Environ Microbiol 1982;44:428. [47] Marounek M, Fliegrova K, Bartos S. Metabolism and some characteristics of ruminal strains of Megasphaera elsdenii. Appl Environ Microbiol 1989;55:1570–3. [48] Coe ML, Nagaraja TG, Sun YD, et al. Effect of virginiamycin on ruminal fermentation in cattle during adaptation to a high concentrate diet and during an induced acidosis. J Anim Sci 1999;77:2259–68. [49] Nagaraja TG, Avery TB, Galitzer SJ, et al. Effect of ionophore antibiotics on experimentally induced lactic acidosis in cattle. Am J Vet Res 1985;46:2444–52. [50] Dunlop RH. Pathogenesis of ruminant lactic acidosis. Adv Vet Sci Comp Med 1972;16: 259–302. [51] Allison MJ, Dougherty RW, Bucklin JA, et al. Ethanol accumulation in the rumen after overfeeding with readily fermentable carbohydrate. Science 1964;144:54–5. [52] Nocek JE. Bovine acidosis. Implications on laminitis. J Dairy Sci 1997;80:1005–28. [53] Brent BE. Relationship of acidosis to other feedlot ailments. J Anim Sci 1976;43:930–5. [54] Irwin LN, Mitchell GE Jr, Tucker RE, et al. Histamine, tyramine, tryptamine and electrolytes during glucose induced lactic acidosis. J Anim Sci 1979;48:367–74. [55] Koers WC, Britton R, Klopfenstein TJ, et al. Ruminal histamine, lactate and animal performance. J Anim Sci 1976;43:684–91. [56] Sjaastad OV. Determination of and occurrence of histamine in rumen liquor of sheep. Acta Vet Scand 1967;8:176–83. [57] Elam CJ. Acidosis in feedlot cattle: practical observations. J Anim Sci 1976;43:898–901. [58] Stock RA, Britton RA. Acidosis in feedlot cattle. In: Scientific update on Rumensin/Tylan for the professional feedlot consultant. Indianapolis (IN): Elanco Animal Health; 1994. p. A1–16. [59] Fulton WR, Klopfenstein TJ, Britton RA. Adaptation to high concentrate diets by beef cattle. I. Adaptation to corn and wheat diets. J Anim Sci 1979;49:775–85. [60] Crichlow EC, Chaplin RK. Ruminal lactic acidosis: relationship of forestomach motility to nondissociated volatile fatty acids level. Am J Vet Res 1985;46:1908–11. [61] Howard JL. Ruminant metabolic acidosis. Bovine Practitioner 1981;16:44–53. [62] Nordlund KV, Garrett EF, Oetzel GR. Herd‐based rumenocentesis: a clinical approach to the diagnosis of subacute rumen acidosis. Compendium of Continuing Education for the Practicing Veterinarian 1995;17:S48–56. [63] Bevans DW, Beauchemin KA, Schwartzkopf‐Genswein KA, et al. Effect of rapid or gradual grain adaptation on subacute acidosis and feed intake by feedlot cattle. J Anim Sci 2005;83: 1116–32. [64] Burrin DG, Britton RA. Response to monensin in cattle during subacute acidosis. J Anim Sci 1988;63:888. [65] Brown MS, Krehbiel CR, Galyean ML, et al. Evaluation of models of acute and subacute acidosis on dry matter intake, ruminal fermentation, blood chemistry and endocrine profiles of beef steers. J Anim Sci 2000;78:3155–68. [66] Stock RA, Brink DR, Brandt RT, et al. Feeding combinations of high moisture corn and dry corn to finishing cattle. J Anim Sci 1987;65:282–9. [67] Stock RA, Brink DR, Britton RA, et al. Feeding combinations of high moisture corn and dry‐rolled grain sorghum to finishing steers. J Anim Sci 1987;65:290–302. [68] Reinhardt CD, Brandt RT, Behnke KC, et al. Effect of steam‐flaked sorghum grain density on performance, mill production rate, and subacute acidosis in feedlot steers. J Anim Sci 1997;75:2852. [69] Tjardes K, Wright C. 2002. Feeding corn distiller’s co‐products to beef cattle. Available at: http://www.distillersgrains.com/pdf/Schingoethe‐ExEx2036DDGforBeefCattle.pdf. Accessed March 8, 2007. [70] Stock RA. Acidosis in cattle: an overview. Proceedings of the American Association for the Bovine Practitioner 2000;33:30–7. [71] Bartley EE, Meyer RM, Call EP. Rumen metabolism and absorption of a 14C‐labelled elastomeric copolymer and its value as a roughage substitute for cattle. J Anim Sci 1981; 52:1150–7. [72] Nagaraja TG, Newbold CJ, Van Nevel CJ, et al. Manipulation of ruminal fermentation. In: Hobson PN, Stewart CS, editors. The rumen microbial ecosystem. 2nd edition. New York: Blackie Academic; 1997. p. 523–632. [73] Stock RA, Laudert SB, Stroup WW, et al. Effect of monensin and tylosin combination on feed intake variation of feedlot steers. J Anim Sci 1995;73:39–44. [74] Burrin DG, Stock RA, Britton RA. Monensin level during grain adaptation and finishing performance in cattle. J Anim Sci 1988;66:513–8. [75] Horn GW, Gordon JL, Prigge EC, et al. Dietary buffers and ruminal and blood parameters of subclinical lactic acidosis in steers. J Anim Sci 1979;48:683–91. [76] Huffman RP, Stock RA, Sindt MH, et al. Effect of fat type and forage level on performance of finishing cattle. J Anim Sci 1992;70:3889–98. [77] Krehbiel CR, Stock RA, Shain DH, et al. Effect of level and type of fat on subacute acidosis in cattle fed dry‐rolled corn finishing diets. J Anim Sci 1995;73:2438–46. [78] Spiehs MJ, Whitney MH, Shurson GC. Nutrient database for distiller’s dried grains with solubles produced from new ethanol plants in Minnesota and South Dakota. J Anim Sci 2002;80:2639–45. [79] Klopfenstein T. Distiller’s grains for beef cattle. Available at: http://www.distillersgrains. com/pdf/Klopfenstein‐DG for Beef%Cattle‐11–01.pdf 2001. Accessed March 8, 2007. [80] Ham GA, Stock RA, Klopfenstein TJ, et al. Wet corn distiller’s byproducts compared with dried corn distiller’s grains with solubles as a source of protein and energy for ruminants. J Anim Sci 1994;72:3246–57. [81] Larson EM, Stock RA, Klopfenstein TJ, et al. Feeding value of wet distillers byproducts for finishing ruminants. J Anim Sci 1993;71:2228–36. [82] Pritchard RH, Bruns KW. Controlling variation in feed intake through bunk management. J Anim Sci 2003;81(E Suppl 2):E133. Available at: http://www.asas org/symposia/03esupp2/ jas2395pdf. Accessed March 8, 2007. [83] Erickson GE, Milton CT, Fanning KC, et al. Interaction between bunk management and monensin concentration on finishing performance, feeding behavior, and ruminal metabolism during an acidosis challenge with feedlot cattle. J Anim Sci 2003;81:2869–79. [84] Nagaraja TG, Laudert SB, Parrott JC. Liver abscesses in feedlot cattle Part 1 causes, pathogenesis, pathology, and diagnosis. Compendium on Continuing Education for Practicing Veterinarian 1996;18:S230–41.