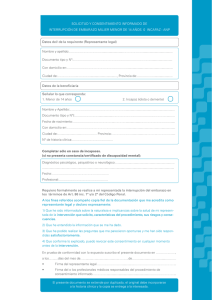
Formato - Facultad de Odontologia UC
Anuncio

CONSENTIMIENTO INFORMADO Todo consentimiento informado conlleva cada uno de estos ítems , si aplican. 1. Titulo de la Investigación _________________________________________________________ 2. Introducción. ___________________________________________________________________ 3. Propósito del Estudio ____________________________________________________________ 4. Procedimiento a seguir. __________________________________________________________ 5. Experiencia anterior con el medicamento (si procede) __________________________________ 6. Molestias y Riesgos. _____________________________________________________________ 7. Alternativas Terapéuticas _________________________________________________________ 8. Criterios de Exclusión. ____________________________________________________________ 9. Beneficios. _____________________________________________________________________ 10. Remuneraciones. _______________________________________________________________ 11. Compensación por Lesiones. _____________________________________________________ 12. Gastos _______________________________________________________________________ 13. Confidencialidad. _______________________________________________________________ 14. Notificación de nuevos hallazgos __________________________________________________ 15. Nº de teléfonos para contactar al investigador principal ________________________________ 16. Participación voluntaria. _________________________________________________________ 17. Terminación del estudio. _________________________________________________________ 18. Nombre y firma del paciente. _____________________________________________________ 19. Nombre y firma de dos testigos. ___________________________________________________ 20. Fuentes adicionales de información. _______________________________________________ 21. Leyes, Códigos y normas que lo amparan ___________________________________________ 22. Recursos Técnicos ______________________________________________________________ 23. Destino de la investigación (Publicación u otra) _______________________________________ 24. Uso del lenguaje adecuado. ______________________________________________________ 25. Notificación de suspensión de la investigación (si procede). _____________________________________________________________________ 26. Observaciones finales: __________________________________________________________ ________________________________________________________________________________