1 Expansión isoterma 2 Expansión adiabática
Anuncio

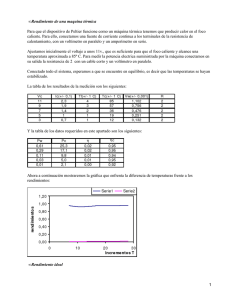
Un gas ideal monoatómico ocupa un volumen de a la presión de y a la temperatura de . El gas se expande hasta la presión final de mediante un proceso cuasiestático. Calcule el trabajo realizado, el calor absorbido y la variación de energía interna en los siguientes casos: 1. Expansión isoterma. 2. Expansión adiabática. 1 Expansión isoterma La energía interna de un gas ideal sólo depende de su temperatura. Al ser un proceso isotermo, ésta no cambia. Por tanto ΔU = 0 Para calcular el trabajo realizado utilizamos la ecuación de estado para expresar la presión en función del volumen Hemos usado la ley de Boyle para expresar el resultado en función del cociente de presiones, y la ecuación del gas ideal para sustituir nRT por P1V1. El trabajo es negativo, pues al expandirse el gas realiza trabajo sobre el recipiente que le contiene. Como la variación de energía interna es nula, el calor absorbido por el gas es 2 Expansión adiabática En este caso el calor absorbido por el gas es cero: Q=0 Podemos expresar la variación de energía interna en función de la diferencia de temperaturas entre los estados inicial y final ΔU = ncv(T2 − T1) Aqui, cv es el calor específico molar a volumen constante. Para un gas ideal monoatómico tenemos cv = 3R / 2. Nos falta encontrar la temperatura en el estado final. Para ello usamos la ecuación: Por tanto, la variación de energía interna es Hemos usado que en un gas monoatómico γ = 5 / 3. El trabajo que realiza el gas es Comparación gráfica de los dos procesos Podemos observar que el trabajo realizado por el gas en el proceso adiabático es menor que el que realiza en el proceso isotermo. Esto puede comprobarse también en el diagrama PV de la figura. En un punto del diagrama, la pendiente de la adiabática es siempre mayor que la de la isoterma. Entonces, al hacer la expansión, la adiabática se queda a la derecha de la isoterma, y por tanto, el área debajo de la adiabática es menor que debajo de la isoterma. Termodinámica Teoría (1212) Enunciado Kelvin-Planck: No es posible ninguna transformación cíclica que transforme íntegramente el calor absorbido en trabajo. Una máquina térmica es un dispositivo cuyo objetivo es convertir calor en trabajo. Para ello utiliza un material de trabajo (vapor de agua, aire, gasolina) que realiza una serie de transformaciones termodinámicas de forma cíclica, para que la máquina pueda funcionar de forma continua. A través de dichas transformaciones la sustancia absorbe calor (normalmente, de un foco térmico) que transforma en trabajo. Enunciado de Clausius: No es posible el paso de calor de un cuerpo frío a uno caliente sin el consumo de trabajo. Un refrigerador es un dispositivo cuyo objetivo es extraer calor de un cuerpo a una cierta temperatura y cederlo a otro que se encuentra a una temperatura superior. Para ello utiliza un material de trabajo (vapor de agua, aire u otras sustancias) que realiza una serie de transformaciones termodinámicas de forma cíclica, para que pueda funcionar de forma continua, como sucede con las máquinas térmicas. El paso de calor de un cuerpo frio a otro caliente no se produce de forma espontánea. Ciclo de Carnot (máquina de Carnot) Ciclo de Carnot inverso (refrigerador) Un ciclo de Carnot se recorre en sentido horario para que el gas produzca trabajo. Las transformaciones que constituyen el ciclo de Carnot son: Expansión isoterma (1-2): al gas absorbe una cantidad de calor Q1 manteniéndose a la temperatura del foco caliente T1. Expansión adiabática (2-3): el gas se enfría sin pérdida de calor hasta la temperatura del foco frío T2. Compresión isoterma (3-4): el gas cede el calor Q2 al foco frío, sin variar de temperatura. Compresión adiabática (4-1): el gas se calienta hasta la temperatura del foco caliente T1, cerrando el ciclo. En un refrigerador de Carnot, el ciclo se recorre en sentido antihorario, ya que el trabajo es negativo (trabajo consumido por el gas): Expansión adiabática (1-2): el gas se enfría sin pérdida de calor hasta la temperatura del foco frío T2. Expansión isoterma (2-3): el gas se mantiene a la temperatura del foco frío (T2) y durante la expansión, absorbe el calor Q2 de dicho foco. Compresión adiabática (3-4): el gas se calienta hasta la temperatura del foco caliente T 1, sin intercambio de calor. Compresión isoterma (4-1): al gas cede el calor Q1 al foco caliente, manteniéndose a la temperatura de dicho foco T1 y cerrando el ciclo. Documento informativo editado por <[email protected]>, de: http://acer.forestales.upm.es/basicas/udfisica/asignaturas/fisica/termo2p/termo2p_portada.html