Bioquímica-07
Tema 45.- Traducción del RNA.- Biosíntesis de proteínas. Código genético. Etapas de la traducción.
Modificaciones post-traduccionales.
Mathews & van Holde.- cap. 27, págs. 1160 y siguientes. Lehninger.- 27, pags. 1034 y siguientes.
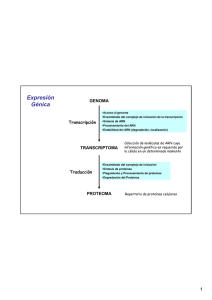
La biosíntesis de proteínas consiste en la traducción de la información codificada en el RNA
mensajero a una secuencia de aminoácidos para sintetizar
proteínas y la operación se realiza en un complejo formado por
RNA-proteína denominado ribosoma.
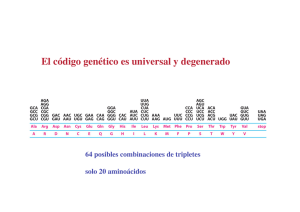
El alfabeto de cuatro letras de las secuencias nucleotídicas de los
Ac. nucleicos se traduce a otro lenguaje distinto, el de los 20
AA en las proteínas. Cada aminoácido viene especificado por
unidades de información de tras bases en el mRNA, llamadas
codones.
La traducción requiere de moléculas adaptadoras,
tRNA, que tienen tripletes anticodones, que reconocen los
codones complementarios e insertan el AA específico en la
posición adecuada en la secuencia polipeptídica.
Lectura codón-anticodón
Codón: triplete de nucleotidos cuya secuencia es específica
para cada AA.
Las relaciones de correspondencia entre cada triplete “codón” en el mRNA y cada AA - que se une a
su tRNA con el “anticodón” complementario- , constituyen el código genético.
Código genético.- Formado por tripletes de nucleotidos (codones) que se relacionan con los AA protéicos.
El primer codón que se traduce (codón de
inicio, AUG) establece un marco o pauta
de lectura, que va a condicionar la
secuencia de AA en la proteína.
Hay tres codones de terminación o
codones sin sentido (UAA, UAG, UGA).
El código genético es degenerado, porque
un AA puede ser codificado por más de un
codón. Cada AA puede tener uno o varios
tripletes que lo codifiquen.
El balanceo, de la 3ª base, permite que
algunos tRNA (anticodón) reconozcan
más de un triplete (codón) en el mRNA.
Más de 100 macromoléculas intervienen
en la traducción, destacan: ribosomas
(rRNA y proteínas), t-RNAs, m-RNA,
enzimas y factores proteicos.
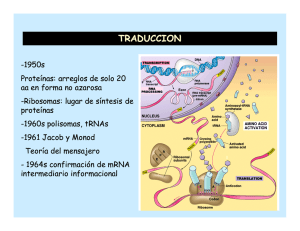
Lugar de la síntesis de proteínas.Hay que estudiar el lugar donde se produce la síntesis de
proteínas: los ribosomas. En procariotas los ribosomas
tienen un tamaño de 70S y sus dos subunidades son de 30S
y 50S. El mRNA se asocia, para ser leido, con la
subunidad 30S y después se asocia la subunidad 50S. Cada
cadena de mRNA está siendo leída simultáneamente por
muchos ribosomas, cada uno sintetizando una copia de la
proteina.
1
Bioquímica-07
Etapas de la traducción.
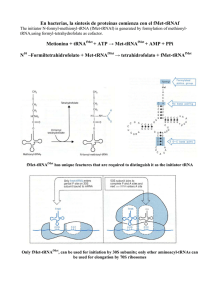
0.- Activación de AA. Consiste en la preparación de los AAs para
entrar en la síntesis de proteínas. Se consume 1 ATP por AA.
Las aminoacil-tRNA sintetasas catalizan la unión del AA correcto a
su tRNA y son específicas para cada AA. Algunos AAs tienen más
de un tRNA, pero cada tRNA solo reconoce a un AA. Esta
interacción específica entre la aminoacil-tRNa sintetasa y el tRNA
constituye un "segundo código genético".
Algunas aminoacil-tRNA sintetasas pueden realizar incluso
corrección de pruebas.
Esquema de un t-RNA + AA____>
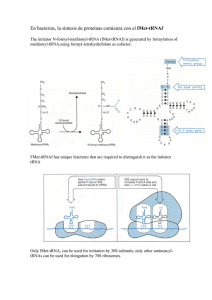
1.- Iniciación.- La síntesis de polipéptidos empieza en el extremo
amino-terminal y con un AA específico
(MET).
Complejo de iniciación
Este complejo está formado por el mRNA unido a la subunidad ribosómica 30S y
al tRNA cargado con dicho MET y asociado por su triplete anticodón con el su
triplete de iniciación en el mRNA (AUG). A continuación se une la subunidad
50S que coloca el complejo mRNA(codón)-tRNA(anticodón) cargado en el lugar
P del ribosoma.
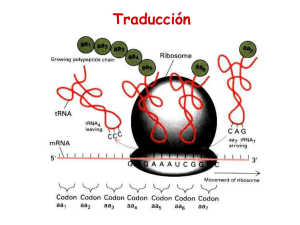
2.- Elongación.- En el lugar A del ribosoma entra el siguiente tRNA cargado con
el AA relativo al triplete siguiente del mRNA; y así
situados
los
dos
aminoácidos, en los
lugares P y A, se
forma
el
enlace
peptídico con la
catálisis de la peptidil
transferasa.
A continuación se
produce
la
translocación, que consiste en el
desplazamiento del ribosoma a lo
largo del mRNA en sentido 5’ a 3’, de
forma que el tRNA 1º quede en el
lugar de salida (E), el tRNA 2º quede
en el lugar P y el lugar A queda vacio
para la entrada de un nuevo tRNA
cargado con AA.
En el proceso intervienen
varias proteínas o factores
de elongación (EF-Tu,
EF-Ts, EF-G) y también
es necesaria la energía en
forma de GTP, en varios
puntos del proceso (1GTP
en iniciación y 2 GTP en
elongación).
2
Bioquímica-07
3.- Terminación.- El final de la síntesis de la cadena polipeptídica requiere de una señal especial en los
tripletes del mRNA (tripletes sin sentido) y de factores de terminación o liberación (RF).
Los tripletes de terminación son: UAA, UAG y UGA
Modificaciones post-traducción: plegamiento y maduración
de proteínas.
Las cadenas polipeptídicas liberadas de los ribosomas se pliegan y
sufren modificaciones químicas.
Tipos de modificación:
- Pérdida de secuencias señal.
- Modificaciones amino-terminales y carboxilo-terminales.
- Modificaciones en AA concretos.
- Unión de cadenas glucídicas.
- Modificaciones proteolíticas.
- Formación de puentes disulfuro.
La fidelidad en la síntesis proteica es energéticamente cara:
- Formación de aminoacil-tRNA, 2 ATP
- Primer paso de elongación, 1 GTP
- Traslocación, 1 GTP
La formación de cada enlace peptídico requiere, al menos, 4 ATP
.
Los polisomas
(asociaciones
de ribosomas)
permiten
la
traducción
múltiple
y
rápida
del
mensaje
contenido en
el m-RNA.
puromicina
La síntesis de proteinas es inhibida por muchos antibioticos y
toxinas.
La puromicina es un antibiótico con estructura similar al aminoacil
-adenosina del aminoacil-tRNA. Por ello, se acopla en el lugar A
de los ribosomas y puede unirse con el grupo carboxilo del péptido
en formación, pero la síntesis de la cadena peptídica no puede
progresar puesto que la estructura de la puromicina no cuenta con
grupo amino terminal para que continúe la síntesis y por tanto la
síntesis de la cadena proteica queda interrumpida.
3