LABORATORIO QUIMICA ORGANICA : ALDEHIDOS Y CETONAS
Anuncio

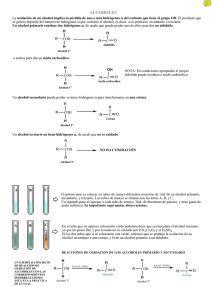
LABORATORIO QUIMICA ORGANICA : ALDEHIDOS Y CETONAS Objetivos 1.- Sintetizar un aldehído y/o cetona mediante la oxidación de alcoholes primarios o secundarios. 2.- Plantear las ecuaciones involucradas en la obtención del aldehído o la cetona 3.- Caracterizar el comportamiento de aldehídos y cetonas frente a reactivos específicos 4.- Deducir la identidad de una muestra problema Introducción Cualquier persona familiarizada con los laboratorios de biología, recose el olor característico del formaldehído HCHO, el mas sencillo de los aldehídos. El formaldehído, se caracteriza por su olor irritante y por reaccionar con las proteínas volviéndolas insolubles; por esta razón, unida a su acción antimicrobiana, hace que se emplee como medio de conservación de cadáveres. La disolución en agua que se conoce como formol o formalina contiene 40% de formaldehído. El formaldehído es eficaz contra bacterias, hongos y virus, pero su acción es lenta. Como germicida, se usa para desinfectar objetos como material quirúrgico y guantes, en concentraciones mas altas se usa para el tratamiento del mal olor de pies (hiperhidrolisis). Sin embargo, su mayor uso es en la síntesis de plásticos. Una de las propiedades mas características de aldehídos y cetonas es el olor. Es así, como ellos se emplean en la fabricación de perfumes. Los perfumes están formados por compuestos orgánicos tales como, alcoholes (caproico y bencilico), fenoles (timol y eugenol), benzandehido, pineno y cetonas. Los aldehídos y las cetonas son compuestos polares, debido a esto, tienen puntos de ebullición mas elevados que los no polares de peso molecular comparable. El metanal es gaseoso hasta C12 son líquidos y del C13 en adelante son sólidos. Las cetonas son liquidas hasta C10 desde allí son sólidas. Además, hasta C4 son solubles en agua, pero esto disminuye a medida que aumenta el peso molecular. OBTENCIÓN DE ALDEHÍDOS POR OXIDACIÓN DE ALCOHOLES La oxidación de un alcohol primario produce un aldehído, se usa como catalizador K2Cr2O7, KMnO4/OH H R-C-OH → R-CHO H La oxidación de un alcohol secundario produce una cetona, se usa como catalizador K2Cr2O7 acuoso, CrO3 en ácido acético glacial o piridina R R-C-OH O → R-C-R H Las características químicas de estos compuestos son similares, debido a la presencia del grupo carbonilo (C=O). Sin embargo, los aldehídos son mas reactivos que las cetonas, esto se debe a que los grupos R (alquilos o arilos), obstaculizan el ataque de otras partículas y por consiguiente la reacción se hace mas lenta. OXIDACIÓN Esta reacción permite diferenciar aldehídos de cetonas. Los aldehídos se oxidan fácilmente con agentes oxidantes fuertes como K2Cr2O7, (dicromato de potasio) o KMnO4 (permanganato de potasio) o también con un oxidante suave como el nitrato de plata (AgNO3), esta oxidación se lleva a cabo en medio alcalino y en presencia de amoniaco para evitar la precipitación del oxido de plata. Este reactivo llamado reactivo de Tollens, sirve para identificar los aldehídos y diferenciarlos de las cetonas. REACTIVO DE TOLLENS El reactivo de tollens es un agente oxidante formado por una solución de nitrato de plata en solución de hidróxido de amonio, transforma los aldehídos en ácidos y reduce el ion plata (Ag+) a plata metalica que se deposita en la superficie interna del recipiente usado, formando un espejo, comúnmente llamado espejo de plata R-CHO + 2 Ag (NH3)2 + + OH - → R-COO - + Ag + 4 NH3 + 2 H2 O REACTIVO DE BENEDICT Esta formado por una solución de sulfato cúprico en ácido cítrico y en medio básico, al oxidarse el aldehído hasta ácido, se produce la reducción del ion cúprico de color azul a oxido cuproso de color rojo. Las cetonas no dan esta reacción REACCION DEL HALOFORMO Las cetonas se oxidan difícilmente, pero las cetonas que tiene CO-CH3 (metilcetona) se oxidan suavemente a acido carboxilico y un haloformo (cloroformo, Bromoformo y yodoformo)- CHX3- en presencia de un hipohalito (hipoclorito, hipobromito o hipoyodito). Si se usa e hipoyodito se forma el yodoformo, fácil de identificar por ser un sólido amarillo y de olor característico. X R-CO-CH3 + 3 XO - + 5 OH - → H-C-X + R COO- + OHX cetona hipohalito haloformo PROCEDIMENTO EXPERIMENTAL 1.- OXIDACIÓN DE ALCOHOLES vierte 2 ml de alcohol etílico en un tubo de ensayo y registra tus observaciones antes de la reacción luego, añade unas gotas de KMnO4 y observa. Realiza lo anterior con otros alcoholes que te indicara tu profesora. Completa la tabla SUSTANCIA OBSERVACION 2.- REACTIVO DE TOLLENS vierte 2 ml del aldehído en un tubo de ensayo. registra tus observaciones antes de la reacción luego, añade unas gotas del reactivo de tollens, agita y observa anota tus observaciones. Realiza lo anterior con acetona y la muestra problema. Completa la tabla SUSTANCIA OBSERVACION 3.- REACTIVO DE BENEDICT vierte 2 ml del aldehído en un tubo de ensayo. luego, añade unas gotas del reactivo de BENEDICT, agita y observa registra tus observaciones. Realiza lo mismo con la acetona y la muestra problema. Completa la tabla SUSTANCIA OBSERVACION 4.- REACCION DEL HALOFORMO vierte 2 ml de la acetona. en un tubo de ensayo. luego, añade hipoyodito de sodio, agita y observa. Anota tus observaciones Realiza lo mismo con el aldehído y la muestra problema. Completa la tabla SUSTANCIA OBSERVACION Según los ensayos realizados la muestra problema seria un (A)........................................................... Porque ......................................................................................................................................................................................... .........................................................................................................................................................................................